Method Article
在成像微孔板中使用预制聚乙二醇(PEG)水凝胶简单建立血管化成骨骨髓壁龛
摘要
通过将间充质细胞和内皮细胞接种到预制的3D PEG水凝胶上,建立了骨髓血管壁龛的 体外 模型。壁龛的内皮网络、ECM 成分和 ALP 活性因所使用的生长因子而异。该平台可用于高级癌症模型。
摘要
骨和骨髓是高度血管化和结构复杂的器官,是癌症和转移形成的部位。非常需要与药物筛选兼容的概述骨和骨髓特异性功能(包括血管形成)的 体外 模型。这样的模型可以弥合简单,结构无关的二维(2D)体 外 模型与更昂贵,道德上具有挑战性的 体内 模型之间的差距。本文介绍了一种基于工程聚乙二醇 (PEG) 基质的可控三维 (3D) 共培养测定,用于生成血管化、成骨骨髓壁龛。PEG基质设计允许通过简单的细胞接种步骤开发3D细胞培养物,无需封装,从而能够开发复杂的共培养系统。此外,基质是透明的,并预制在玻璃底96孔成像板上,使该系统适用于显微镜。对于此处描述的测定,首先培养人骨髓来源的间充质基质细胞(hBM-MSC),直到形成充分发育的3D细胞网络。随后,加入表达GFP的人脐静脉内皮细胞(HUVECs)。培养物开发之后是明场和荧光显微镜。hBM-MSC网络的存在支持血管样结构的形成, 否则这些结构不会形成并保持稳定至少7天。血管样网络形成的程度可以很容易地量化。该模型可以通过在培养基中补充骨形态发生蛋白 2 (BMP-2) 来调整成骨骨髓生态位,该蛋白可促进 hBM-MSC 的成骨分化,如在共培养的第 4 天和第 7 天增加碱性磷酸酶 (ALP) 活性来评估。该细胞模型可用作培养各种癌细胞并研究它们如何与骨和骨髓特异性血管壁龛相互作用的平台。此外,它适用于自动化和高内涵分析,这意味着它可以在高度可重复的培养条件下进行癌症药物筛查。
引言
骨骼和骨髓是结构和功能复杂的器官,对人类健康至关重要。这反映在调节造血和骨骼维护的不同壁龛的存在上1。现在人们普遍认为,在健康的骨髓中,造血和骨骼干细胞及其后代的维持和扩增由不同的生态位控制。这些生态位包括各种细胞类型,包括骨系细胞、间充质干细胞、内皮和血管周围细胞、神经元和神经胶质细胞、脂肪细胞、破骨细胞、巨噬细胞和中性粒细胞2。毫不奇怪,这些主要与脉管系统相关的生态位也参与各种类型的白血病的发展3,并且是不同癌症的转移部位4。由于其在骨形成、重塑和骨(骨髓)维护方面的特定作用,骨相关脉管系统具有与身体其他部位发现的脉管系统不同的独特特殊结构 5,6,7。因此,全身施用的抗血管生成或脉管系统调节药物在这些特殊环境中可能具有不同的效果8。因此,研究维持骨和骨髓生理特性、骨和骨髓再生以及对治疗反应的分子机制的模型是非常可取的。
经典的二维(2D)组织培养和使用动物模型的体内研究为参与骨和骨髓发育的不同细胞和分子参与者的作用提供了宝贵的见解9,10。允许对相关人类细胞进行高通量实验的模型可以提高我们对如何在这些高度复杂的系统中调节选定参数的理解。
在过去的十年中,源自组织工程的原理已被用于生成3D组织模型11,12。这些主要依赖于将组织相关细胞封装到生物材料中以建立3D单培养或共培养13。最常用的生物材料是纤维蛋白14,胶原蛋白15和基质胶16,17,所有这些都具有高度的生物相容性,并为许多细胞类型的生长提供了适当的条件。这些生物材料能够生成体外模型,概括体内18中发现的不同血管壁龛的关键方面。此外,使用微流体装置生成灌注的血管骨和骨髓模型有助于生成更复杂的体外模型19,20,21,22。
控制天然生物材料的成分和工程特性的困难激发了合成类似物的开发,这些类似物可以合理设计,具有可预测的物理,化学和生物学特性23,24。我们开发了完全合成的XIII因子(FXIII)交联聚乙二醇(PEG)基水凝胶,其与RGD肽和基质金属蛋白酶(MMP)切割位点功能化,以促进细胞附着和重塑25,26。这些生物材料的模块化设计已成功用于优化3D血管化骨和骨髓模型形成的条件27,28。
为了测试大量不同的培养条件和新疗法,需要具有更高通量能力的模型。我们最近表明,我们的PEG水凝胶的FXIII交联可以通过电化学过程进行控制,从而形成深度水凝胶刚度梯度29。当细胞被添加到这种水凝胶上时,它们向内部迁移并逐渐发展成高度互连的3D细胞网络30。无需将细胞封装到水凝胶中(通常与其他3D支架一起存在),不仅简化了实验设计,而且还允许在不同时间点顺序添加不同的细胞类型以生成复杂的共培养系统。这些水凝胶可预制到玻璃底96孔成像板上,因此可以通过手动和自动细胞接种方案建立3D培养物。PEG水凝胶的光学透明度使该平台与显微镜兼容。
在这里,我们提出了一种简单的方法,用于在这个即用型合成即插即用平台中生成和表征血管化成骨壁龛。我们表明,血管网络的发育可以用通常用于诱导体外成骨的生长因子骨形态发生蛋白-2(BMP-2)刺激,而成骨分化可以通过补充成纤维细胞生长因子2(FGF-2)来预防27,31。与FGF-2刺激的网络相比,形成的网络在整体外观以及细胞和ECM分布方面是不同的。此外,我们使用碱性磷酸酶作为标志物监测了成骨诱导。我们证明了该标志物的表达随着时间的推移而增加,并使用定性和定量方法将该表达与FGF-2刺激网络中的表达进行比较。最后,我们证明了该模型生成的生态位对两种潜在应用的适用性。首先,我们通过将贝伐珠单抗添加到预先形成的壁龛中并监测其存在下血管网络的降解来进行概念验证药物敏感性测定。其次,我们将MDA-MB-231乳腺癌和U2OS骨肉瘤细胞添加到预先形成的成骨生态位中,表明这些生态位可用于研究癌细胞与其环境之间的相互作用。
研究方案
图 1 总结了以下协议部分。
1. 建立3D基质单一栽培
- 准备hBM-MSC细胞悬液。
- 在补充有 10% FBS、1% 青霉素-链霉素和 5 ng/mL FGF-2 的培养箱中,在 37 °C 和 5% CO2 的培养箱中将 hBM-MSC 生长至 70%-90% 的汇合水平。细胞可以使用至第6代。
- 用PBS洗涤细胞,并在37°C下用0.05%胰蛋白酶-EDTA分离3-5分钟。 通过用基础培养基冲洗(补充有10%FBS和1%青霉素链霉素的MEMα)停止分离过程。将悬浮细胞收集在 50 mL 锥形离心管中。
- 使用血细胞计数器或自动细胞计数器对细胞进行计数,并确定悬浮液中的细胞总数。
- 通过以200× g 离心5分钟来沉淀细胞。小心地除去上清液。
- 将细胞重悬于适当体积的基础培养基中,以达到 1 x 107 个细胞/mL 储备溶液的浓度。
- 制备 50 mL 锥形离心管,其中包含所需体积的基础培养基,并补充有相应的生长因子(定义浓度的 FGF-2 和 BMP-2,例如 0 ng/mL、25 ng/mL、50 ng/mL、100 ng/mL 或 200 ng/mL)。每孔需要 200 μL。如果要使用自动液体处理器进行细胞接种,还要考虑仪器的死体积。对于手动细胞接种,体积超过10%就足够了。
- 从储备溶液中加入 hBM-MSC,稀释度为 1:66.67,以达到 1.5 x 105 个细胞/mL 的浓度。
- 准备用于播种的板。
- 去除覆盖在96孔水凝胶板上的聚丙烯粘合剂膜。
- 小心地吸出覆盖水凝胶的储存缓冲液。对于此任务,请使用微孔板清洗机;但是,可以手动处理。
- 使用手动吸气器或多通道移液器时,将吸头靠在孔壁上,并在吸出缓冲液的同时缓慢向下向内孔边缘移动。这将避免损坏水凝胶表面。
- 使用自动洗板机时,将吸液喷嘴设置在距离板载体至少3.8 mm(这相当于距离水凝胶板内环0.8 mm)和孔边缘的位置。有关更详细的说明,请参阅制造商手册,并获得96孔水凝胶板的板图。
- 充分混合后,加入步骤1.1.7中制备的细胞悬液的200μL/孔,以确保细胞均匀分布。在接种过程中,为避免细胞在底物的一个区域中不均匀沉降,请勿倾斜板。对于手动接种,定期混合细胞悬液(接种三个孔后)以保持混合物均匀。对于自动接种,在分液前立即与血清移液管混合,以便分液含有相同数量细胞的体积。
- 在潮湿气氛中将培养物保持在37°C和5%CO2 。
- 根据需要使用5倍物镜的明场显微镜监测培养物的发展。接种后约30分钟获取参考图像以评估添加的细胞数量。
2. 建立3D基质-内皮细胞共培养
- 准备GFP-HUVEC细胞悬液。
- 通过在37°C下涂上由150μg/ mL大鼠尾胶原蛋白I在0.02M乙酸中包被30分钟的溶液来制备用于HUVEC培养的烧瓶。 使用前用PBS冲洗一次。
- 在补充有10%FBS的EGM-2中将GFP-HUVECs生长至80%-100%的汇合水平,在37°C的培养箱中,在加湿气氛中补充5%CO2 。细胞可以使用至第7代。
- 用PBS洗涤细胞,并在37°C下用0.05%胰蛋白酶-EDTA分离2-3分钟。 通过用基础培养基冲洗(补充有10%FBS和1%青霉素链霉素的MEMα)停止分离过程。将悬浮细胞收集在 50 mL 锥形离心管中。
- 使用血细胞计数器或自动细胞计数器对细胞进行计数,并确定悬浮液中存在的细胞总数。
- 通过以200× g 离心5分钟来沉淀细胞。小心地除去上清液。
- 将细胞重悬于适当体积的基础培养基中,以达到 1 x 107 个细胞/mL 储备溶液的浓度。
- 制备 50 mL 锥形离心管,其中包含所需体积的基础培养基,并补充有相应生长因子(定义浓度的 FGF-2 和 BMP-2,例如 0 ng/mL、25 ng/mL、50 ng/mL、100 ng/mL 或 200 ng/mL),如步骤 1.1.6 中对 hBM-MSC 中所述。
- 从储备溶液中加入 GFP-HUVEC 以 1:66.67 的稀释度达到 1.5 x 105 个细胞/mL 的浓度,如步骤 1.1.7 中对 hBM-MSC 所述。
- 从含有基质单一培养物的平板中吸出培养基,如步骤1.2.2中所述的缓冲液去除。
- 加入步骤2.1.8中制备的GFP-HUVEC细胞悬液的200μL /孔,如步骤1.3中hBM-MSC添加中所述。
- 在37°C和5%CO2 在潮湿气氛中孵育。每3-4天更换一次培养基。
- 根据需要使用5倍物镜通过明场和荧光显微镜监测培养物的发展。将培养物维持到共培养的第 4 天或第 7 天,分别进行早期或中期表征,或根据需要进行。
3. 表征程序 1:定量内皮细胞网络的形成
- 在所需的时间点,使用适合定量的设置(即,最佳聚焦、高对比度和低放大倍率 [例如,5x] 用于更大视场)使用荧光显微镜从 GFP-HUVEC 获取 GFP 信号。
- 对同一天获得的所有图像进行均匀的预处理(例如,使用斐济32)以进一步增强对比度。请注意,GFP信号可能会随着培养时间而变暗;因此,在不同日期采集的图像可能需要不同的处理。
- 如果使用 Fiji 或 ImageJ,请打开同一时间点的所有 GFP 通道图像,然后打开 "亮度和对比度 "菜单。选择代表中间条件(不是最暗的信号,也不是最亮的信号)的图像,然后通过选择"自动"自动来 自动调整对比度。选择" 设置",然后选中 "传播到所有其他打开的映像"。
- 直观地评估自动选择的范围是否适合当前时间点的所有图像,并根据需要手动重新调整并重新传播到所有图像。
- 将调整后的图像另存为TIF文件,并对获取的其他时间点重复步骤3.2.1和步骤3.2.2。
- 对所有图像应用中值模糊滤镜(例如,半径 3 表示 2048x2048 图像),以避免下游伪影识别,从而促进准确的网络识别。通过合并 (2x2) 减小大小,并将所有预处理的图像保存为文件夹中的灰度 RGB 颜色 TIF 文件以进行量化。这些步骤可以手动完成,也可以使用作者将根据请求共享的宏以批处理模式完成。
- 使用 ImageJ33 血管生成分析仪中的批处理模式分析在步骤 3.1-3.3 中创建的文件夹中的所有图像。请注意,根据图像的大小和可用的工作内存,每个图像可能需要几分钟的时间。
- 通过检查识别结构和原始图像的叠加来验证量化结果。如果算法识别出人工结构,在原始图像中只能看到很少或没有细胞,则调整预处理参数,并重新分析原始图像,或从分析中排除此类问题区域和/或复制图像。
- 通过将每个样品的值乘以分析面积与 1 mm 2 的比率,将获得的值归一化为 1 mm2 的面积。如果使用不同大小的图像,此步骤尤其重要。
- 从分析中提取各种网络参数,例如总网络长度、交汇点数、段数、隔离段数、分支间隔和平均网格大小,并使用它们来表征不同时间点和不同培养条件下的内皮网络。
4. 表征程序 2:评估 ECM 沉积
- 在所需的终点时间点,使用免疫荧光评估ECM沉积。在培养的最后6小时或固定后,在100μL培养基中添加针对各种ECM分子的一抗,如下所述。
- 在室温下用200μL /孔的PBS洗涤培养物5分钟,并在室温下用100μL /孔的4%多聚甲醛在化学通风橱下固定30分钟。 请注意,建议同时固定板的所有孔,因为在此过程中可能会损坏周围的培养物。用200μL/孔的PBS在室温下洗涤固定培养物三次,每次5分钟,并在4°C下储存在200μL/孔的PBS中,或立即进行下一步。
- 在固定后与针对ECM分子的一抗孵育之前,将固定培养物与PBS中的200μL /孔的1%BSA作为封闭溶液在室温下孵育30分钟。
- 吸出封闭溶液,并在 4 °C 下与 100 μL/孔的一抗溶液在 PBS 中的 1% BSA 中孵育过夜。 在室温下分别用 200 μL /孔的 PBS 洗涤 3 次 5 分钟、至少 3 小时和 5 分钟。
注意:未结合的抗体从水凝胶中完全扩散出来需要很长的洗涤步骤。
- 吸出封闭溶液,并在 4 °C 下与 100 μL/孔的一抗溶液在 PBS 中的 1% BSA 中孵育过夜。 在室温下分别用 200 μL /孔的 PBS 洗涤 3 次 5 分钟、至少 3 小时和 5 分钟。
- 为了促进二次染色溶液(包括细胞内复染剂)的渗透,根据培养物的细胞密度,在PBS中使用0.3%Triton X-100和1%BSA在室温下透化培养物30-90分钟。
注意:对于细胞内分子的基于抗体的染色,此步骤应在与步骤4.1.2中所述的一抗孵育之前进行。 - 根据需要制备含有相应二抗和复染剂的二级染色溶液(例如,核染色剂,例如DAPI和细胞骨架染色剂,例如鬼笔环肽-罗丹明)。
- 制备由 0.1% Triton X-100、1% PBS 中的 BSA 和复染剂(例如 1 μg/mL DAPI 和 1:4,000 鬼笔环肽-罗丹明)组成的染色缓冲液,并以推荐的稀释度添加相应的二抗。
- 加入 100 μL/孔的二次染色溶液,并在 4 °C 下孵育过夜。 与一抗孵育后的程序类似,在室温下分别用200μL/孔的PBS洗涤3次5分钟,至少3小时和5分钟。
- 对于结构的3D分辨率,从玻璃底部开始采集共聚焦堆栈,z步长为2.5μm,最终高度为500μm,使用10倍物镜和0.75倍数码变焦。要在斐济生成GFP和F-肌动蛋白信号的3D重建,请在创建复合并使用斐济3D查看器生成重建之前分别对每个通道进行阈值。
- 为了可视化免疫染色沉积的ECM,使用5μm的z步长,10倍物镜和1.5倍数字变焦获取高度为100μm的共聚焦堆栈。在创建合成之前,生成最大强度投影,并分别调整斐济每个通道的亮度和对比度。
- 对细胞外环境进行直接颜色染色。
- 向多聚甲醛固定孔中加入200μL /孔的Picrosirius Red染色溶液,并在室温下孵育1小时。
- 接下来,用蒸馏水洗涤染色孔五次,然后每天或每隔一天洗涤两次,持续3-4天,同时监测样品颜色清除。在漫长的洗涤步骤中将板保持在4°C(即超过6小时的任何内容)。
- 使用配备彩色相机的明场显微镜采集染色样品的图像,并在各种条件下保持相等的白平衡。要获得样品的概览,请使用低放大倍率(例如,2.5倍)扫描整个孔。如果显微镜没有附带支持自动拼接的软件,请手动进行(例如,在斐济34中使用成对拼接)。
注意:以前用于免疫荧光的孔可用于此目的,前提是完成荧光图像采集。 - 按照步骤4.2.1-4.2.3中描述的Picrosirius Red染色的相同步骤进行茜素红染色,洗涤和成像。
5. 表征程序 3:通过监测 ALP 活性评估成骨分化
- 在不同的培养结束时间点(例如,共培养的第4天和第7天),使用5-溴-4-氯-3-吲哚基磷酸酯(BCIP)/硝基蓝四唑(NBT)染色定量评估ALP活性。
- 在与 BCIP/NBT 底物溶液孵育之前,用 200 μL/孔的 PBS 洗涤培养物一次,应按照制造商的说明制备。在37°C孵育,同时定期监测颜色发展。一旦颜色开始在非成骨条件下发展,立即用200μL/孔的PBS洗涤一次,然后用4%多聚甲醛固定,如步骤4.1.1中所述。
- 获取染色样品的彩色图像,如步骤4.2.3中所述的Picrosirius Red染色。
- 在不同的培养结束时间点(例如,共培养的第4天和第7天),量化细胞裂解物中的ALP活性。
- 用200μL/孔的PBS洗涤培养物三次,然后在37°C下与200μL/孔的0.25%胰蛋白酶-EDTA孵育。 每10分钟,通过剧烈上下移液搅动培养物以促进消化,并用标准细胞培养显微镜监测培养物形态。
- 一旦获得孔中没有细长细胞结构的液体单细胞悬液(通常在20-30分钟后),将样品转移到2mL管中,加入200μLMSC基础培养基以抑制胰蛋白酶,并以500× g 离心5分钟以沉淀回收的细胞。倒出上清液,并将沉淀在-80°C冷冻,或直接进行步骤5.2.3。
- 解冻在步骤5.2.2中获得的细胞沉淀,并与500μL由0.56M 2-氨基-2-甲基-1-丙醇,0.2%Triton X-100,pH 10组成的裂解缓冲液在冰上孵育30分钟。接下来,在4°C下以16,100× g 离心10分钟,并将样品保持在冰上。在步骤5.2.7中描述的测量之后,将样品冷冻在-20°C或-80°C,或直接继续DNA定量,如步骤5.2.8中所述。
注意:裂解缓冲液可以提前制备,无菌过滤,并储存在4°C。 - 在裂解缓冲液中制备由 20 mM 4-硝基苯基磷酸二钠盐六水合物和 4 mM MgCl2 组成的 ALP 试剂。
注意:最好在定量当天新鲜制备此溶液。 - 在不干扰任何沉淀碎片的情况下,将步骤5.2.3中制备的50μL细胞裂解物上清液一式两份分配到标准透明组织培养96孔板的孔中。将裂解缓冲液作为空白对照添加到两个孔中。
- 使用多通道移液器,向步骤5.2.5中填充的孔中加入50μL/孔的ALP试剂。短暂摇动板,并在37°C下避光孵育10分钟。具有较高ALP活性的孔将显示为黄色。使用多通道移液器加入 100 μL/孔的 1 M NaOH 停止反应。
- 使用酶标仪读取410nm处的光密度。平均技术重复项,并减去空白控件的平均值。
- 执行DNA定量以根据总细胞数对先前步骤中确定的ALP活性进行标准化。这里描述了一种基于荧光测量的方法,但细胞裂解物中DNA定量的任何其他方法都与测定兼容。根据制造商的说明,使用市售试剂盒制备DNA定量所需的试剂和DNA标准品。
注意:建议使用裂解缓冲液制备DNA标准品。 - 如果将步骤5.2.3中描述的用于ALP定量的样品冷冻,则解冻它们,在4°C下以16,100× g 离心2分钟,然后将它们放在冰上。在不干扰任何沉淀碎片的情况下,将 50 μL 细胞裂解物上清液一式两份分配到黑色 96 孔板的孔中。将样品冷冻在-20°C或-80°C,必要时重复ALP和DNA定量。添加一式两份的DNA标准品。
- 使用多通道移液器,加入 50 μL DNA 染色剂,孵育,并按照制造商的说明读取荧光强度。使用标准曲线值,确定并应用测量强度值到DNA浓度的转换。
- 通过将步骤5.2.7中获得的ALP值除以每个样品的相应DNA浓度来归一化。
6. 应用1:进行药敏试验
- 当内皮网络完全发育时(通常在基质-内皮细胞共培养的第4天),在新鲜培养基中的培养物中加入抗血管生成化合物,例如贝伐珠单抗,并测试其随时间和不同条件下的活性(例如,不同浓度的FGF-2或BMP-2)。
- 制备含有与相应培养物相同的生长因子的新鲜培养基,直到这一点。
- 制备由目标化合物的稀释剂组成的对照溶液(例如,贝伐珠单抗:60 mg/mL α-海藻糖二水合物、0.4 mg/mL吐温20、5.8 mg/mL磷酸钠(一水合物和一水合物)和1.2 mg/mL磷酸二水钠),并无菌过滤。
- 将所需浓度(例如,10μg/mL贝伐珠单抗)的目标化合物和等体积的对照溶液分别添加到指定用于测试条件和对照条件的培养基中。
- 制备含有与相应培养物相同的生长因子的新鲜培养基,直到这一点。
- 从培养物中吸出培养基,并加入步骤6.1.1中新鲜制备的培养基的200μL/孔。孵育适合待测化合物的时间(例如,贝伐珠单抗:2 天)。监测培养发育,并表征内皮网络,如第3节所述。使用GFP图像和从步骤3.7中描述的分析中提取的定量网络参数评估化合物在抑制血管生成或烧蚀预成型结构方面的有效性。
7. 应用2:建立与各种癌细胞类型的先进共培养系统
- 在共培养的第4天,当内皮网络基本建立时,将其他细胞类型(例如MDA-MB-231或U2OS癌细胞)添加到新鲜培养基中的培养物中。
- 按照制造商的说明使用细胞相容的活染料标记癌细胞,以便能够将它们与共培养物中的GFP标记的HUVEC和非标记的hBM-MSC区分开来。
- 在含有与相应培养物相同的生长因子的新鲜培养基中制备浓度为1.5 x 104 个细胞/ mL的癌细胞悬浮液,直到该点。
- 根据需要监测培养发育和癌细胞定位。
注意:根据癌症类型,活动和环境,它们可能需要几天时间才能到达基质 - 内皮细胞共培养物中的血管结构(例如,MDA-BM-231和U2OS为2天)。因此,应相应地计时以可视化癌细胞相互作用的延时成像。
结果
通过将hBM-MSC和GFP-HUVECs依次接种到96孔成像板内具有刚度梯度的预制PEG水凝胶上来建立血管生态位培养物(图1)。通过实时落射荧光显微镜纵向监测培养物,并在选定的时间点进一步表征。通过直接颜色染色和基于抗体的染色评估细胞外隔室。从生成的生态位中取出和裂解细胞后,对ALP活性进行定量。此外,我们证明了该平台适用于抗血管生成药物敏感性测定,并作为癌症共培养模型的基础。
如协议中所述,通过在无生长因子或存在 FGF-2 或 BMP-2 的情况下以 50 ng/mL 接种 3 x 104 个细胞/孔来建立 hBM-MSC 和表达 GFP 的 HUVEC 的共培养物。从早期时间点开始,可以从仅显示GFP-HUVEC的明场和荧光图像中观察到培养物之间的差异(图2A)。通过纵向观察相同的区域,可以注意到培养物发育的差异,例如在FGF-2存在下发育更快。一般来说,在没有任何生长因子的情况下,培养物似乎不太发达,两种类型的细胞扩散较少,并且存在无细胞区域。相比之下,明场图像显示BMP-2存在下最密集的培养物。然而,在两种含有生长因子的条件下形成的血管样网络,以及最广泛和相互关联的网络是由FGF-2形成的。这些观察到的差异也可以使用血管 生成分析仪 进行量化。事实上,在存在FGF-2的情况下,网络总长度最高,在没有增长因子的情况下最低(图2B)。指示网络中分支点的交汇点数量遵循与总长度相同的趋势(图2C)。相反,与没有任何生长因子的条件相比,两种含有生长因子的条件都具有显着更少的孤立片段,表明更高的互连性(图2D)。此外,3D共聚焦成像显示,在FGF-2刺激条件下,内皮细胞穿透深度更强(图2E)。
hBM-MSC/GFP-HUVEC共培养物在FGF-2或BMP-2存在下维持7天,然后固定并染色ECM组分。免疫细胞化学染色后进行共聚焦激光扫描显微镜检查,根据生长因子补充剂的类型,培养物形态存在显着差异(图3A)。使用FGF-2,培养物被组织成浓缩的微血管样结构,这些结构在内皮细胞和间充质细胞中都很密集,而在BMP-2存在的情况下,hBM-MSC跨越了更大的区域,从更广泛的F-肌动蛋白阳性和GFP阴性区域可以看出。ECM蛋白纤连蛋白和胶原蛋白I以类似的方式定位,而层粘连蛋白和胶原蛋白IV更集中在内皮结构周围。然而,在FGF-2存在的情况下,内皮结构周围的浓度增加比在BMP-2存在下更明显。除了基于抗体的染色外,还进行了直接颜色染色以评估ECM的整体纤维化状态(Picrosirius Red染色; 图3B),以及Ca在ECM上的沉积(茜素红染色; 图3C)形成的壁龛。Picrosirius Red染色在用BMP-2培养的生态位中更强,更广泛,而茜素红染色遵循相同的趋势。
接下来,通过评估ALP活性作为早期成骨标志物,根据其成骨潜力来表征培养物。在共培养的第4天和第7天,通过用胰蛋白酶消化水凝胶从壁龛中取出细胞。为了量化ALP活性,裂解回收的细胞,并进行pNPP测定。根据每个样品的总DNA对获得的值进行归一化,以解释不同条件下细胞数量的潜在差异。事实上,可以观察到条件的DNA含量之间的微小差异,并且从没有任何生长因子的条件下检索到最少的细胞(未显示)。然而,标准化的ALP活性在不同条件下差异很大,随着BMP-2浓度的升高和100ng/mL的平台,活性呈增加趋势(图4A,B)。含有50 ng/mL FGF-2的病症的活性水平最低。虽然在评估的两个时间点都可以观察到类似的趋势,但从第4天到第7天,培养中所有值都随着时间的推移而显着增加。除了定量测定外,还可以使用基于BCIP / NBT底物转换的直接颜色染色来定性可视化ALP活性。与FGF-2相比,在BMP-2存在下观察到更广泛和更强烈的紫色染色(图4C)。
为了证明特征化的成骨生态位的两个潜在应用,进行了概念验证药物敏感性研究和癌症共培养。对于药物敏感性测定,将贝伐珠单抗或由贝伐珠单抗制剂的稀释剂组成的对照溶液加入到含有新鲜BMP-2的培养基中。在第4天,当在50ng / mL BMP-2存在下形成已建立的网络时,在常规培养基更换期间加入对照溶液或含贝伐珠单抗的培养基,并使用荧光成像监测培养物。加入 10 μg/mL 贝伐珠单抗导致先前形成的网络缩回或消融,而对照条件在更换培养基 2 天后仍具有广泛的网络(图 5A,B)。这些变化也可以通过使用血管生成分析仪对每天采集的荧光图像进行ImageJ跟踪网络的总长度来量化(图5C)。或者,贝伐珠单抗或任何其他化合物也可以从共培养开始添加,以评估它们对网络形成的影响。在贝伐珠单抗的情况下,这完全抑制了内皮网络的形成(未显示)。
对于第二次应用,将MDA-MB-231乳腺癌或U2OS骨肉瘤细胞以1.5 x 103个细胞 /孔的密度添加到含有50 ng / mL BMP-2的新鲜培养基中的第4天共培养物中。为了将它们与GFP标记的HUVECs和未标记的hBM-MSC区分开来,癌细胞在接种到成骨生态位之前与CellTrace FarRed一起孵育。通过荧光显微镜监测培养物;开始时,大多数癌细胞位于底物表面附近,但2天后,可以发现它们更接近包含血管共培养物的层。因此,选择第2天作为延时显微镜的起点,以显示癌细胞与血管壁龛内细胞之间相互作用的动力学。有趣的是,可以看到MDA-MB-231细胞接近和远离内皮结构,因此可能正在探测或重塑其环境(图5D)。使用CellTrace FarRed作为癌细胞的标记,GFP作为HUVEC的标记,以及F-肌动蛋白的额外染色,可以使用共聚焦激光扫描显微镜区分所有细胞类型(图5E)。
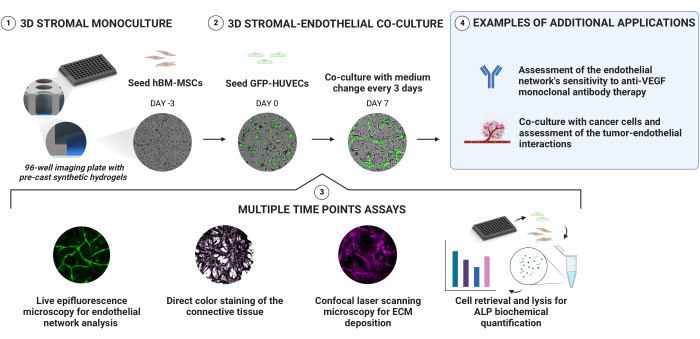
图 1:一种可靠生成血管化成骨壁龛的简单方法。 具有深度刚度梯度的预制合成水凝胶允许通过顺序细胞接种生成3D培养物,而无需直接封装。在加入表达GFP的HUVEC之前,将hBM-MSC预先培养3天。通过纵向采集明场和GFP信号来监测培养物。在选定的时间点,进一步评估壁龛的ECM沉积和成骨状态。通过直接颜色染色和从壁龛中取出细胞并对细胞裂解物进行pNPP测定来评估碱性磷酸酶活性。 请点击此处查看此图的大图。
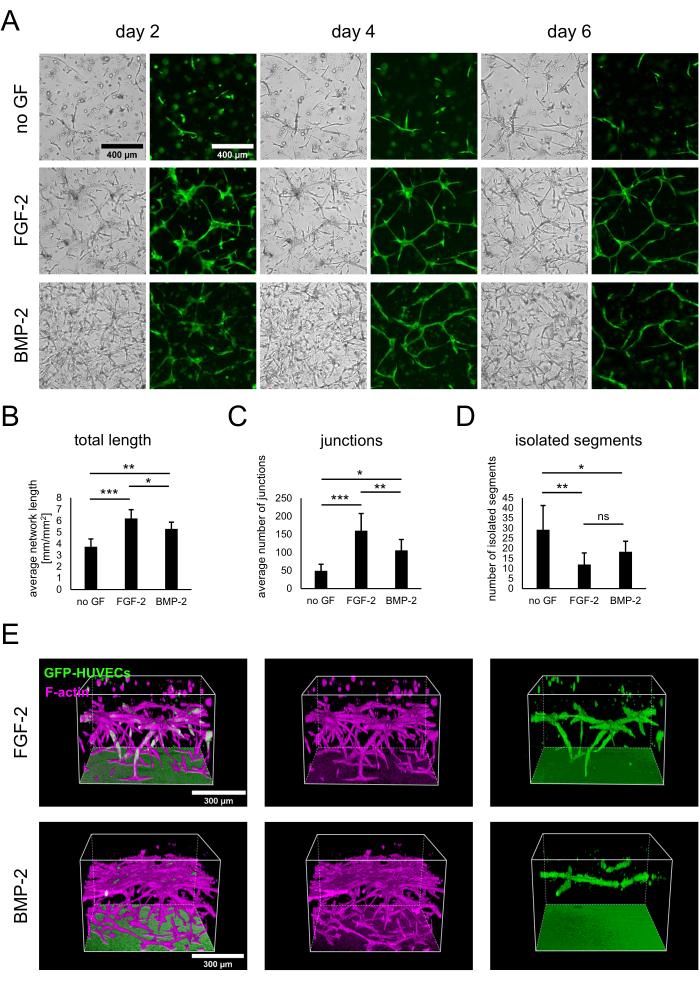
图 2:用 FGF-2 或 BMP-2 刺激血管样网络。 (A) 在没有生长因子或存在 FGF-2 或 BMP-2 的情况下生长的细胞共培养的第 2 天、第 4 天和第 6 天获得明场和荧光 (GFP) 图像,均为 50 ng/mL。比例尺:400 μm。 (B-D) 在共培养的第 4 天成像的 GFP-HUVEC 网络的量化参数,使用 ImageJ 的血管生成分析仪进行分析。数据表示为平均值±标准差。统计分析使用GraphPad Prism 9.5.1进行。使用n≥4进行了具有Dunnett多重比较检验的普通单因素方差分析;* P < 0.05;** P < 0.01;P < 0.001。(E)从FGF-2-(顶行)和BMP-2-(底行)刺激条件下的GFP和F-肌动蛋白信号的共聚焦堆栈(总高度:547.5μm;z步长:2.5μm)生成的三维重建。比例尺:300 μm。 请点击此处查看此图的大图。
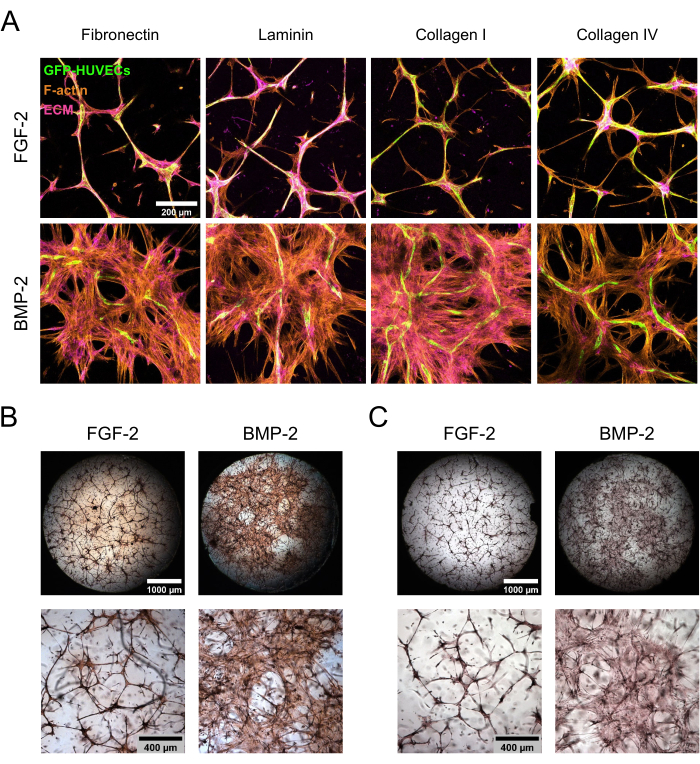
图3:BMP-2诱导离域hBM-MSC扩散和ECM沉积。 (A-C)在FGF-2或BMP-2存在下生长的7天共培养物经受(A)免疫荧光或(B,C)直接颜色染色。(A)对培养物进行F-肌动蛋白和ECM蛋白纤连蛋白,层粘连蛋白,胶原I和胶原蛋白IV染色。图像描绘了共聚焦堆栈的最大强度投影(总高度:100μm;z步长:5μm)。比例尺:200 μm。 (B,C)使用(B)Picrosirius Red和(C)茜素红对培养物进行染色。顶行描绘了在 2.5 倍放大倍率(比例尺:1,000 μm)下采集的图像的拼接、全井概览,而底行描绘了在 5 倍放大倍率(比例尺:400 μm)下采集的一个视野。请点击此处查看此图的大图。
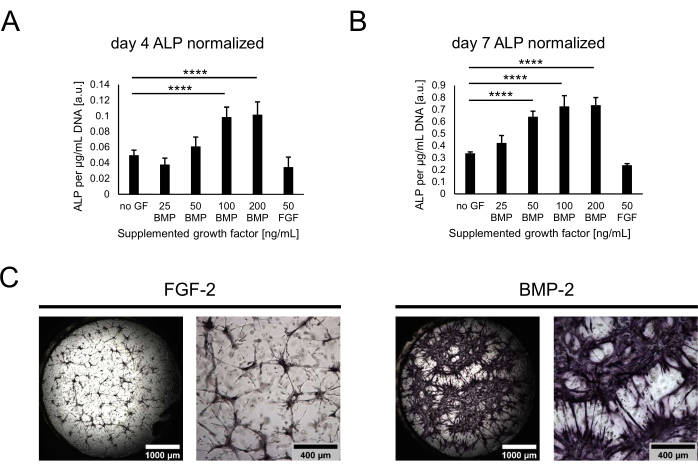
图 4:通过直接颜色染色对 BMP-2 诱导的 ALP 活性进行生化评估。 (A,B)ALP活性是在没有生长因子或存在不同浓度的BMP-2或50ng / mL的FGF-2的情况下生长的培养物的细胞裂解物中测定的(A)4天或(B) 7天的共同文化。ALP活性被归一化为每个裂解物样品的DNA含量。数据表示为平均值±标准差。统计分析使用GraphPad Prism 9.5.1进行。使用邓内特多重比较检验进行普通单因素方差分析,n = 5;P < 0.0001。(C) 在 50 ng/mL FGF-2 或 BMP-2 存在下生长的生态位中对 ALP 活性进行直接颜色染色,共培养 7 天。左侧的图像描绘了在 2.5 倍放大倍率(比例尺:1,000 μm)下采集的图像的拼接全孔概览,而右侧的图像描绘了在 5 倍放大倍率(比例尺:400 μm)下采集的一个视野。请点击此处查看此图的大图。
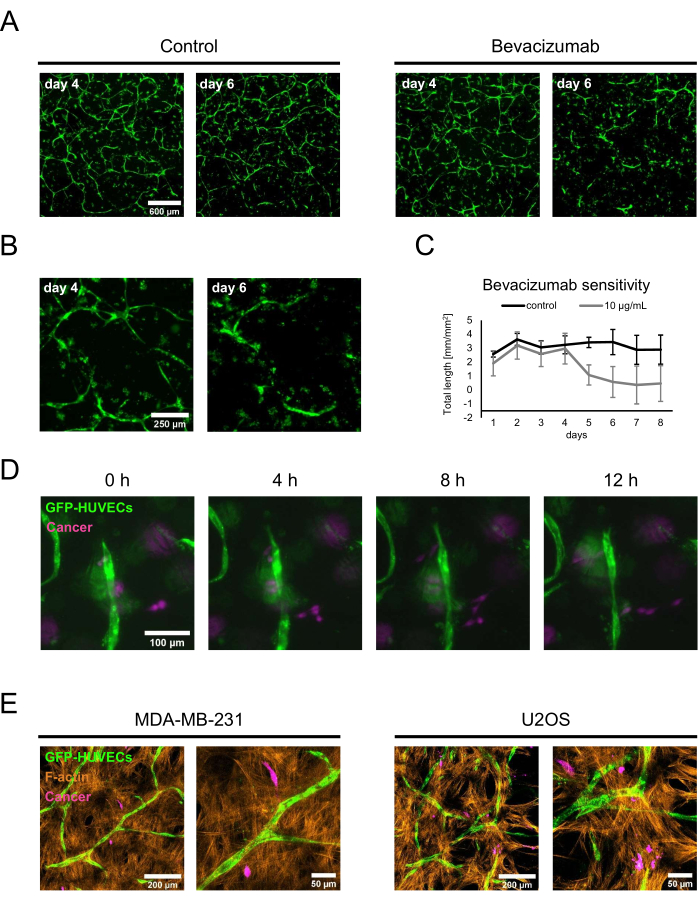
图5:在晚期癌症模型中采用成骨血管化壁龛。 (A)在共培养的第4天对在BMP-2存在下生长的培养物的GFP信号进行成像,然后加入对照溶液(左)或10μg/ mL的贝伐珠单抗(右)2天,然后再次对培养物进行成像(共培养的第6天)。比例尺:600 μm。 (B)贝伐珠单抗处理的培养物的高倍率图像如A所示。比例尺:250 μm。 (C)使用ImageJ的血管生成分析仪从每天采集的图像中量化A所示的内皮网络的总长度;n ≥ 3.(D)将CellTrace FarRed标记的MDA-MB-231乳腺癌细胞添加到在BMP-2存在下生长的4天共培养物中,并在癌细胞添加后2天开始获取延时图像。比例尺:100 μm。 (E)如D中所述产生的三重共培养物的共聚焦堆栈(总高度:70μm;z步长:2.4μm)的最大强度投影,并固定并染色F-肌动蛋白。左:以MDA-MB-231乳腺癌细胞为特征的壁龛;右:以U2OS骨肉瘤细胞为特征的壁龛。左侧图像的比例尺:200 μm;右侧图像的比例尺:50 μm。 请点击此处查看此图的大图。
讨论
在这里,我们描述了一种在完全合成和可控的基于3D PEG的基质中建立高度血管化骨和骨髓壁龛体体 外模型的 协议,该模型在骨和骨髓生物学研究,组织工程和癌症研究中具有多种应用。该模型建立在基于PEG的合成水凝胶上,该水凝胶用RGD肽和MMP切割位点功能化,并在玻璃底96孔成像板上以深度密度梯度铸造30。这种即插即用的平台被证明可以建立高度互连的3D蜂窝网络,而无需将细胞封装到水凝胶中。与前面描述的细胞封装协议类似,在这项工作中,我们展示了通过细胞固有的ECM28 重塑底物以创建细胞类型特定的微环境。因此,使用这种方法,可以在高度可重复的器官型3D培养条件下轻松进行药物筛选分析和高内涵分析。玻璃底 96 孔板和光学透明水凝胶使该平台与液体处理自动化和高通量显微镜兼容。
生成成骨血管骨髓生态位的第一步是在PEG水凝胶上预培养hBM-MSCs至少3天。在此期间,它们附着在水凝胶上,穿透它,并开始建立细胞-细胞接触和ECM沉积。在接种hBM-MSC之前,必须去除储存缓冲液。由于水凝胶位于96孔成像板标准孔内的内孔内,因此可以安全地沿孔的侧面插入吸液尖端,直到它接触内孔环。如果真空泵设置为尽可能低的吸力,则可以使用真空泵进行抽吸。或者,可以使用喷嘴高度调整到内孔环上方至少0.8 mm的自动洗板机从水凝胶板中吸出缓冲液。使用自动化进行液体处理可以最大限度地减少对水凝胶表面的损坏,并提高所得培养物的重现性。一旦细胞沉淀在水凝胶上,水凝胶表面上的小缺陷就会变得可见,并出现在缺陷水凝胶区域的较低焦点平面上。因此,在第0天获取参考图像可作为细胞接种均匀性和水凝胶表面完整性的良好质量控制。虽然小的水凝胶表面缺陷并不排除孔的进一步使用,但细胞倾向于聚集在缺陷区域,并可能生长成非代表性图案或更快地到达底部玻璃,在那里它们生长成单层。使用/评估这些孔时必须注意这些伪影。类似的考虑适用于在整个测定期间进行的任何培养基变化。
该协议的第二步涉及将GFP-HUVEC添加到预先形成的hBM-MSC单一培养物中(共培养的第0天)。hBM-MSC沉积的ECM为内皮细胞的生长提供了很好的支架,在这项工作中,即使在hBM-MSC条件培养基的存在下,也只能在水凝胶上形成圆形细胞簇(未显示)。在接种在hBM-MSC培养物上后,HUVEC整合并形成微血管样结构,与在细胞封装产生的共培养物中观察到的结构相当27,28。通常,发育良好的3D微血管样网络在共培养后4天内形成,这可以通过使用GFP标记的HUVEC进行纵向监测。这些结构可以在培养中维持至少7天,这意味着有足够的时间跟踪血管网络组织的变化以响应治疗,例如用于筛选抗血管生成药物。通过使用成熟的工具(例如 ImageJ33 的血管生成分析仪插件)分割 GFP 图像,可以批量模式量化内皮网络的形态学元素,其参数可用于评估例如药物疗效和药效学。
对于许多潜在应用,所描述的细胞模型的一个显着优点是其可塑性。简单地用不同的生长因子补充培养基可以改变共培养的外观。例如,BMP-2在整个单培养和共培养期间的存在会产生成骨血管生态位,显示ALP活性增加,细胞外钙沉积以及ECM组装和沉积。相反,在FGF-2存在的情况下,成骨标志物不存在,共培养形成较少的侧向细胞关联,但显示出更显着的3D细胞生长。与无生长因子治疗相比,FGF-2抑制ALP活性,而BMP-2引起更强的ALP活性,这一事实与先前的观察结果一致27。然而,尽管hBM-MSC基质成分存在这些巨大差异,但在这项工作中,两种生长因子处理条件的微血管网络的范围非常相似。在对照培养物中,仅形成一些短的血管网络,可能代表血管化不良的骨髓生态位。这表明,通过简单地改变添加到培养基中的生长因子的类型、浓度和时间,可以产生一系列明确的血管化骨髓生态位,这是比较研究所需要的。然而,为了确保可重复的结果,重要的是要注意培养过程和形态可能因所用细胞的历史(例如,常规培养维持期间使用的传代次数和分离方法)而异,建议在测定设计期间控制这些因素。
在这里,作为该模型的首次应用,我们证明了工程微血管网络对用10μg/ mL贝伐珠单抗治疗的敏感性。值得注意的是,重要的是要确认所使用的算法可以准确识别内皮网络,因为伪影通常是在网络不发达的图像中产生的。如果是这种情况,则需要对用于图像处理的参数(分割之前和期间)进行微调,通常是在试错的基础上。
作为第二个应用,我们提出了一种由间充质、内皮和癌细胞的顺序接种形成的先进共培养模型。该模型允许研究癌细胞,基质和骨髓脉管系统之间的相互作用,这可能是转移过程中的重要因素。此外,该模型可用于药物筛选应用和测试靶标超出血管生成的化合物。
在2D培养中,细胞不接收生理微环境信号,不获得天然存在的细胞形态,因此与天然3D环境中的细胞相比,分化方式不同35。当在工程3D水凝胶中生长时,细胞在早期沉积固有的ECM,该ECM提供粘附位点并且可以主动重塑28,36。在这里,为了建立用于筛选应用的简化3D模型,将血管形成细胞接种到工程水凝胶的表面上,并在没有灌注的情况下建立血管网络。基于成像的评估是在有助于血管结构的内皮细胞的 2D 投影上进行的。然而,与FGF-2刺激的样品相比,只有共聚焦图像显示BMP-2刺激样品中3D血管网络的向内生长不太明显。这表明形成的血管结构的长度被低估了,而它们的连通性被高估了。此外,血管周围和内皮细胞之间的相互作用以及血管腔的形成尚未得到研究。这些方面,特别是在药物治疗反应方面,将需要进一步关注。最后,需要改进的方案,首先建立广泛的3D血管网络,然后诱导其成骨分化,以生成更多的生理骨和骨髓模型。
总体而言,此处介绍的模型用途广泛,可以轻松针对特定应用进行定制。例如,可以使用来自不同来源的间充质细胞和内皮细胞。已知脂肪组织MSCs和脐带MSCs与BM-MSCs相比表达不同的血管生成因子,并且它们可以很容易地被取代为替代基质成分37。也可以使用从已经确定的骨髓壁龛中分离的内皮细胞代替HUVEC。人们还可以与患者来源的、匹配的骨髓间充质细胞和内皮细胞建立共培养,用于个性化医学应用,正如最近建议用于血管化肌肉共培养的那样38。此外,水凝胶板的设计允许使用明场和荧光显微镜对培养物进行纵向监测,从而为用户提供根据应用缩短或延长培养时间的可能性。或者,如果需要比本协议中更短或更长的观察时间,则可以相应地调整用于接种的细胞密度以加速或延迟细胞网络的形成。在任何情况下,都需要小心避免细胞过度生长成片状结构,这可能导致水凝胶收缩并最终导致细胞脱离。
最后,可以使用该模型进行广泛的测定。除了在活培养物或固定培养物中进行免疫荧光和显微镜检查外,还可以对3D培养物进行酶消化,并且可以检索细胞并进行任何类型的生化测定。在这里,我们演示了使用比色/荧光测定法测定细胞裂解物中的ALP活性和DNA含量定量,但该系统与许多其他技术兼容,包括PCR,RNAseq和蛋白质组学。如果所需测定的灵敏度不是很高,则可以汇集来自多个孔的样品,以增加可用于测定的样品量。如果所需的应用需要更快的凝胶溶解,则可以将板的轨道振荡与较小体积的消化溶液结合使用,以确保孔中形成涡流,假设板上的所有孔都将以这种方式使用(活培养物对这种苛刻的处理很敏感)。总之,我们在这里提出了一个协议,如果按描述使用,可以保证生成体 外 模型,该模型概括了成骨血管壁龛的关键方面,但也足够通用,可以针对量身定制的应用进行修改。
披露声明
Ectica Technologies AG是3DProSeed水凝胶孔板的制造商,并拥有商业利益。Benjamin R. Simona和Martin Ehrbar是Ectica Technologies AG的股东。
致谢
作者要感谢Riccardo Urbanet在液体处理设备方面的技术援助,并感谢Rodi Odabasi在落射荧光显微镜方面的支持。这项工作由瑞士国家科学基金会(资助号310030E_202429和205321_204318)和Ectica Technologies AG资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
参考文献
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。