Method Article
تصوير mtHyPer7 ، وهو مستشعر حيوي نسبي لبيروكسيد الميتوكوندريا ، في خلايا الخميرة الحية
In This Article
Summary
بيروكسيد الهيدروجين (H 2 O2) هو مصدر للضرر التأكسدي وجزيء إشارة. يصف هذا البروتوكول كيفية قياس الميتوكوندريا H 2 O2باستخدام HyPer7 (mtHyPer7) الذي يستهدف الميتوكوندريا ، وهو مستشعر حيوي نسبي مشفر وراثيا ، في الخميرة الحية. يوضح بالتفصيل كيفية تحسين ظروف التصوير وإجراء التحليل الخلوي ودون الخلوي الكمي باستخدام البرامج المتاحة مجانا.
Abstract
تم العثور على ضعف الميتوكوندريا ، أو التغيير الوظيفي ، في العديد من الأمراض والظروف ، بما في ذلك الاضطرابات التنكسية العصبية والعضلية الهيكلية والسرطان والشيخوخة الطبيعية. هنا ، يتم وصف نهج لتقييم وظيفة الميتوكوندريا في خلايا الخميرة الحية بدقة خلوية ودون خلوية باستخدام مستشعر حيوي مشفر وراثيا ، طفيف التوغل ، نسبي. يكتشف المستشعر الحيوي ، HyPer7 (mtHyPer7) الذي يستهدف الميتوكوندريا ، بيروكسيد الهيدروجين (H 2O2) في الميتوكوندريا. وهو يتألف من تسلسل إشارة الميتوكوندريا المنصهر مع بروتين فلوري دائري ومجال H2O2 المستجيب لبروتين OxyR البكتيري. يتم إنشاء المستشعر الحيوي ودمجه في جينوم الخميرة باستخدام نظام CRISPR-Cas9 الخالي من العلامات ، للحصول على تعبير أكثر اتساقا مقارنة بالتركيبات المحمولة بالبلازميد.
يستهدف mtHyPer7 كميا الميتوكوندريا ، وليس له أي تأثير يمكن اكتشافه على معدل نمو الخميرة أو مورفولوجيا الميتوكوندريا ، ويوفر قراءة كمية للميتوكوندريا H 2 O2في ظل ظروف النمو الطبيعية وعند التعرض للإجهاد التأكسدي. يشرح هذا البروتوكول كيفية تحسين ظروف التصوير باستخدام نظام مجهر متحد البؤر للقرص الدوار وإجراء تحليل كمي باستخدام البرامج المتاحة مجانا. تتيح هذه الأدوات جمع معلومات زمانية مكانية غنية عن الميتوكوندريا داخل الخلايا وبين الخلايا في السكان. علاوة على ذلك ، يمكن استخدام سير العمل الموضح هنا للتحقق من صحة أجهزة الاستشعار الحيوية الأخرى.
Introduction
الميتوكوندريا هي عضيات خلوية حقيقية النواة أساسية معروفة جيدا بوظيفتها في إنتاج ATP من خلال الفسفرة التأكسدية ونقل الإلكترون1. بالإضافة إلى ذلك ، الميتوكوندريا هي مواقع لتخزين الكالسيوم ، وتوليف الدهون ، والأحماض الأمينية ، ومجموعات الأحماض الدهنية والحديد والكبريت ، ونقل الإشارة 2,3. داخل الخلايا ، تشكل الميتوكوندريا شبكة ديناميكية ذات مورفولوجيا وتوزيع مميزين ، والتي تختلف وفقا لنوع الخلية وحالة التمثيل الغذائي. علاوة على ذلك ، على الرغم من أن الميتوكوندريا يمكن أن تندمج وتنقسم ، فليست كل الميتوكوندريا في الخلية متكافئة. وثقت العديد من الدراسات عدم التجانس الوظيفي للميتوكوندريا داخل الخلايا الفردية في سمات مثل إمكانات الغشاء والحالة المؤكسدة4،5،6. يرجع هذا الاختلاف في وظيفة الميتوكوندريا جزئيا إلى تلف العضية من طفرات mtDNA (التي تحدث بمعدل أعلى من الحمض النووي النووي) وإلى الضرر التأكسدي بواسطة أنواع الأكسجين التفاعلية (ROS) المتولدة داخل وخارج العضية7،8،9. يتم تخفيف الأضرار التي لحقت العضية من خلال آليات مراقبة جودة الميتوكوندريا التي تعمل على إصلاح الضرر أو القضاء على الميتوكوندريا التي تضررت بشكل لا يمكن إصلاحه10.
بيروكسيد الهيدروجين (H 2 O2) هو نوع من الأكسجين التفاعلي الذي يعد مصدرا للضرر التأكسدي للبروتينات الخلوية والأحماض النووية والدهون. ومع ذلك ، يعملH 2 O2 أيضا كجزيء إشارة ينظم الأنشطة الخلوية من خلال الأكسدة العكسية للثيول في البروتينات المستهدفة11,12. يتم إنتاج H 2 O2 من الإلكترونات التي تتسرب من سلسلة نقل إلكترون الميتوكوندريا وبواسطة إنزيمات محددة ، مثل NADPH oxidase و monoamineoxidases 13،14،15،16،17،18،19،20. كما أنه معطل بواسطة أنظمة مضادات الأكسدة ، بما في ذلك تلك التي تعتمد على ثيوريدوكسين والجلوتاثيون21،22،23. وبالتالي ، فإن تحليل مستويات الميتوكوندريا H2 O2 أمر بالغ الأهمية لفهم دور هذا المستقلب في وظيفة الميتوكوندريا والخلوية الطبيعية وفي ظل ظروف الإجهاد التأكسدي.
الهدف العام من هذا البروتوكول هو الكشف عن الميتوكوندريا H 2 O 2 باستخدام مستشعر حيوي H 2 O2مشفر وراثيا ، HyPer7 ، يستهدف العضية (mtHyPer7). mtHyPer7 هو وهم يتكون من تسلسل إشارة الميتوكوندريا من ATP9 (التسلسل المسبق Su9) ، وهو شكل دائري من بروتين الفلورسنت الأخضر (GFP) ، ومجال ربط H 2 O2 لبروتين OxyR من النيسرية السحائية24 (الشكل 1). في GFP الدائري ، يتم دمج N- و C-termini من GFP الأصلي ويتم تشكيل تيرميني جديد بالقرب من chromophore ، مما يضفي حركة أكبر على البروتين وقابلية أكبر لخصائصه الطيفية مقارنة ب GFP25 الأصلي. تفاعل مجال OxyR الخاص ب mtHyPer7 مع H 2 O 2 هو تقارب عالي ، H 2 O2انتقائي ، ويؤدي إلى أكسدة عكسية لبقايا السيستين المحفوظة وتشكيل جسر ثاني كبريتيد. يتم نقل التغيرات التوافقية المرتبطة بأكسدة OxyR إلى GFP الدائري في mtHyPer7 ، مما يؤدي إلى تحول طيفي في الحد الأقصى للإثارة لكروموفور mtHyPer7 من 405 نانومتر في الحالة المختزلة إلى 488 نانومتر في الحالة المؤكسدة H2O2 26. وبالتالي ، فإن نسبة التألق من mtHyPer7 استجابة للإثارة عند 488 نانومتر مقابل 405 نانومتر تعكس أكسدة المسبار بواسطة H 2 O2.
من الناحية المثالية ، يجب أن يوفر المستشعر الحيوي قراءة كمية مطلقة في الوقت الفعلي للجزيء المستهدف. لسوء الحظ ، هذا ليس ممكنا دائما في قياسات العالم الحقيقي. في حالة مستشعرات الأكسدة ، مثل mtHyPer7 ، تتأثر القراءة في الوقت الفعلي بمعدل تقليل جسر ثاني كبريتيد. تختلف أنظمة الاختزال التي تستخدمها المستشعرات الحيوية ROS ، ويمكن أن تغير بشكل كبير ديناميكيات استجابة المسبار - كما هو موضح في مقارنة HyPer7 ، التي تم تقليلها بواسطة نظام thioredoxin ، و roGFP2-Tsa2ΔCR ، التي تم تقليلها بواسطة الجلوتاثيون في خميرة السيتوسول27. وبالتالي ، لاستخلاص استنتاج حول تركيز H2O2 النسبي من نسب mtHyPer7 ، يجب على المرء أن يفترض أن نظام الاختزال يحافظ على قدرة ثابتة أثناء التجربة. على الرغم من هذه الاعتبارات ، تم استخدام HyPer7 والتحقيقات ذات الصلة في سياقات مختلفة للحصول على معلومات حول H 2 O2في الخلايا الحية 25،28،29.
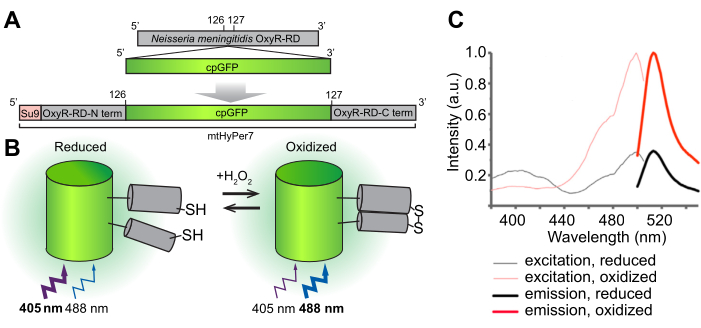
الشكل 1: التصميم والآلية الجزيئية وأطياف الإثارة / الانبعاث للمستشعر الحيوي H2O2 mtHyPer7. (أ) يتم اشتقاق مسبار mtHyPer7 عن طريق إدخال GFP متغير دائريا في مجال OxyR-RD من النيسرية السحائية. يحتوي على تسلسل استهداف الميتوكوندريا من الوحدة الفرعية 9 من ATP synthase من Neurospora crassa (Su9). (B) رسم توضيحي لآلية استشعار H 2 O2ل mtHyPer7. تزيد أكسدة السيستين في مجال RD من انبعاث التألق عند الإثارة عند 488 نانومتر وتقلل من الانبعاثات الناتجة عن الإثارة عند 405 نانومتر. (ج) أطياف الإثارة والانبعاث ل HyPer7 في أشكال مؤكسدة ومختزلة. أعيد طبع هذا الرقم بإذن من باك وآخرين 24. الاختصارات: GFP = بروتين الفلورسنت الأخضر. cpGFP = GFP متغير بشكل دائري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يوفر هذا التصوير النسبي ل mtHyPer7 فوائد مهمة للميتوكوندريا H 2 O2الكمي 24,27 ؛ يوفر التحكم الداخلي لتركيز المسبار. بالإضافة إلى ذلك ، فإن التحول في ذروة الإثارة الناتجة عن التعرض H2 O 2 لم يكتمل ، حتى في تركيزات تشبع H 2 O 2. وبالتالي ، يمكن أن يزيد التصوير النسبي من الحساسية من خلال دمج نقطتين طيفيتين في التحليل.
يتميز مسبار mtHyPer7 المستخدم هنا بتقارب عال جدا مع H 2 O2 وحساسيةمنخفضة نسبيا لدرجة الحموضة24 ، وقد تم استهدافه بنجاح ل Caenorhabditis elegans mitochondria30. كما تم استخدام هذا البروتين في الخميرة 27,31. ومع ذلك ، اعتمدت الدراسات السابقة على التعبير المحمول بالبلازميد ل mtHyPer7 ، مما يؤدي إلى تباين من خلية إلى خلية في تعبير المسبار27. بالإضافة إلى ذلك ، تم دمج البنية الموصوفة في هذا البروتوكول في منطقة محفوظة وخالية من الجينات على الكروموسوم X32 باستخدام نهج قائم على كريسبر للتكامل الخالي من العلامات. يتم التحكم أيضا في التعبير عن جين المستشعر الحيوي المتكامل بواسطة محفز TEF1 التأسيسي القوي (الشكل 2). نتيجة لذلك ، هناك تعبير أكثر استقرارا واتساقا للمستشعر الحيوي في مجموعات خلايا الخميرة مقارنة بالتعبير الملاحظ باستخدام تعبير المستشعر الحيوي المحمول بالبلازميد ، ويمكن نشر الخلايا التي تحمل المستشعر الحيوي دون الحاجة إلى وسائط انتقائية.
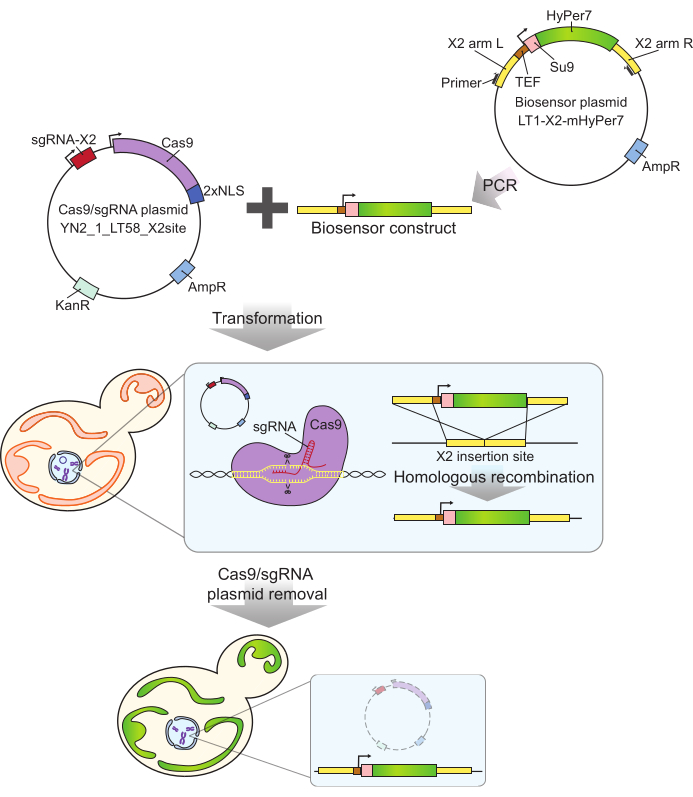
الشكل 2: توليد الخلايا المعبرة عن mtHyPer7 بواسطة كريسبر. يتم إدخال بنية البلازميد المحتوية على Cas9 و sgRNA (YN2_1_LT58_X2site) و mtHyPer7 المضخم ل PCR في خلايا الخميرة الناشئة عن طريق تحويل أسيتات الليثيوم. يتم التعرف على موقع الإدخال الخالي من الجينات على الكروموسوم X (X2) وقطعه بواسطة بروتين Cas9 مع sgRNA ، ويتم دمج المستشعر الحيوي في الجينوم عن طريق إعادة التركيب المتماثل. بعد تحديد المحولات الناجحة عن طريق الفحص المجهري ، ومستعمرة PCR ، والتسلسل ، تتم إزالة بلازميد Cas9 (معالجته) عن طريق النمو في الوسائط غير الانتقائية. الاختصارات: sgRNA = دليل واحد RNA. TEF = عامل محسن النسخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أخيرا ، يوفر mtHyPer7 مزايا على أجهزة الاستشعار الحيوية الأخرى ROS. على سبيل المثال ، يمكن أن تنتج الأصباغ العضوية المستخدمة للكشف عن أنواع الأكسجين التفاعلية (على سبيل المثال ، ثنائي هيدرويثيديوم [DHE] 2 و MitoSOX3) تلطيخا غير متساو أو غير محدد وغالبا ما يتم تسليمها في مذيبات مثل الإيثانول أو ثنائي ميثيل سلفوكسيد ، والتي تتطلب ضوابط إضافية لتأثيرات المذيبات. فئة أخرى من أجهزة الاستشعار الحيوية ROS هي المستشعرات الحيوية القائمة على نقل طاقة الرنين الفلوري (FRET) (على سبيل المثال ، Redoxfluor لحالة الأكسدة والاختزالالخلوية 4 ، وأجهزة استشعار البيروكسيد HSP-FRET5 و OxyFRET 6 و PerFRET6). هذه المجسات مشفرة وراثيا وحساسة للغاية من حيث المبدأ ويمكن استهدافها كميا للميتوكوندريا باستخدام تسلسلات إشارات الميتوكوندريا المميزة جيدا. ومع ذلك ، هناك تحديات في استخدام المجسات القائمة على FRET ، بما في ذلك الخلفية بسبب الإثارة المتقاطعة والنزيف ، والمتطلبات الصارمة لقرب وتوجيه الفلوروفورات لحدوثFRET 33,34. بالإضافة إلى ذلك ، تتكون مجسات FRET من بروتينين فلوريين يتطلبان تركيبات أكبر للتعبير في الخلايا ذات الأهمية مقارنة بمجسات إزاحة الأطياف. تم تطوير البروتوكول الموصوف هنا للاستفادة من نقاط القوة في المستشعر الحيوي المستند إلى HyPer7 ، ولاستخدام هذا المسبار المضغوط ، المتري النسبي ، عالي التقارب ، المشفر وراثيا للتصوير الكمي للبيروكسيد في الميتوكوندريا في الخميرة الحية.
Protocol
1. توليد بلازميد المستشعر الحيوي ، والاندماج في جينوم الخميرة ، وتقييم استهداف mtHyPer7 للميتوكوندريا والتأثيرات على مورفولوجيا الميتوكوندريا ، ومعدلات النمو الخلوي ، أو حساسية الإجهاد التأكسدي
ملاحظة: راجع الملف التكميلي 1 والجدول التكميلي S1 والجدول التكميلي S2 والجدول التكميلي S3 لبناء بلازميد المستشعر الحيوي والسلالات والبلازميدات والبادئات ، على التوالي ، المستخدمة في بناء أجهزة الاستشعار الحيوية وتوصيفها. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والأدوات المستخدمة في هذا البروتوكول.
- تضخيم بنية المستشعر الحيوي من بلازميد المستشعر الحيوي باستخدام البادئات Y290 و Y291 (الشكل 2) عبر تفاعل البلمرة المتسلسل (PCR).
- امزج 500 نانوغرام من بلازميد Cas9 / توجيه الحمض النووي الريبي (YN2_1_LT58_X2site32) مع 50 ميكرولتر من منتج تفاعل البوليميراز المتسلسل من الخطوة 1.1 (بنية المستشعر الحيوي). حول الخليط إلى خميرة ناشئة باستخدام طريقة أسيتات الليثيوم35 وحدد المحولات على ألواح YPD التي تحتوي على 200 مجم / مل G418.
- فحص المحولات المرشحة عن طريق تضخيم تفاعل البوليميراز المتسلسل للحمض النووي الجينومي باستخدام البادئات Y292 و Y293. بالنسبة للمحولات التي تحمل إدخالا بالحجم المتوقع (موجب: 3.5 كيلو بايت ؛ سلبي: 0.3 كيلو بايت) ، قم بتسلسل المنطقة المدرجة لمزيد من التحقق من الصحة.
- تقييم تأثير المستشعر الحيوي على النمو ووظيفة الميتوكوندريا (الشكل 3). إذا بدا أن المستشعر الحيوي يؤثر على وظيفة الخلايا أو الميتوكوندريا ، فحاول تقليل التأثير عن طريق تغيير المروج أو موقع التكامل أو سلالة الوالدين.
- تحديد تأثير بناء المستشعر الحيوي على معدل النمو في وجود وغياب الإجهاد التأكسدي (على سبيل المثال ، الباراكوات) ، كما هو موضح سابقا36.
- تمييع خلايا الطور متوسط اللوغاريتم إلى كثافة بصرية 600 نانومتر (OD 600) تبلغ 0.0035 في200 ميكرولتر من الوسائط المقابلة مع وبدون معالجة في كل بئر من صفيحة مسطحة القاع ذات 96 بئرا. قم بقياس الكثافة البصرية للثقافة كل 20 دقيقة لمدة 72 ساعة باستخدام قارئ اللوحة. احسب الحد الأقصى لمعدل النمو (المنحدر) باعتباره الحد الأقصى للتغيير في OD خلال فترة 240 دقيقة خلال دورة 72 ساعة.
- تصور الخلايا عن طريق المجهر الفلوري وتقييم السطوع ومورفولوجيا الميتوكوندريا كما هو موضح سابقا37.
- قم بتنمية الخلايا إلى مرحلة منتصف السجل ، وقم بتلطيخ الميتوكوندريا ب 250 نانومتر MitoTracker Red لمدة 30 دقيقة ، واغسلها مرتين قبل التصوير. التقط مداخن Z بعمق 6 ميكرومتر على فترات 0.3 ميكرومتر على مجهر مضان واسع المجال أو متحد البؤر وافحصه بصريا. ابحث عن الميتوكوندريا التي تشكل هياكل أنبوبية ممدودة.
- تحديد تأثير بناء المستشعر الحيوي على معدل النمو في وجود وغياب الإجهاد التأكسدي (على سبيل المثال ، الباراكوات) ، كما هو موضح سابقا36.
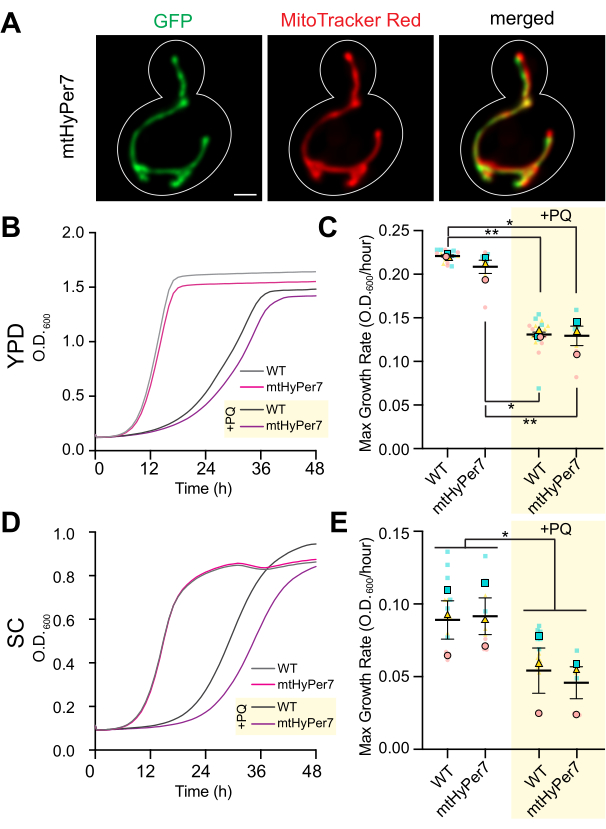
الشكل 3: يستهدف mtHyPer7 الميتوكوندريا ولا يؤثر على مورفولوجيا الميتوكوندريا أو نمو الخلايا أو الحساسية للإجهاد التأكسدي. أ: مورفولوجيا الميتوكوندريا في خلايا فطر الخميرة الحية التي تعبر عن mtHyPer7 . اللوحة اليسرى: mtHyPer7 مرئي بإثارة 488 نانومتر. اللوحة الوسطى: الميتوكوندريا المسمى ب 250 نانومتر ميتو تراكر أحمر. اللوحة اليمنى: الصور المدمجة. يتم عرض الإسقاطات القصوى للكثافة. يظهر مخطط الخلية باللون الأبيض. شريط المقياس = 1 ميكرومتر. (B، C) منحنيات النمو ومعدل النمو الأقصى للخلايا من النوع البري والخلايا التي تعبر عن mtHyPer7 نمت في وجود (+ PQ) أو عدم وجود 2.5 مللي متر باراكوات في وسائط YPD. (د، ه) منحنيات النمو ومعدل النمو الأقصى للخلايا من النوع البري والخلايا المعبرة عن mtHyPer7 التي نمت في وجود (+ PQ) أو عدم وجود 2.5 مللي متر باراكوات في وسائط SC. جميع منحنيات النمو هي وسيلة لثلاثة تكرارات مستقلة. يتم تمثيل معدلات النمو القصوى كمتوسط ± الخطأ المعياري للمتوسط (SEM). تم إجراء تحليل منحنى النمو عن طريق تخفيف خلايا الطور اللوغاريتمي المتوسط إلى OD 600 من 0.0035 في200 ميكرولتر من الوسائط المقابلة في كل بئر من صفيحة مسطحة القاع ذات 96 بئرا. تم قياس OD للثقافة كل 20 دقيقة لمدة 72 ساعة باستخدام قارئ اللوحة. تم طلاء كل سلالة / حالة في ثلاث نسخ وتم رسم متوسط معدل النمو. تم حساب معدل النمو الأقصى (المنحدر) باستخدام التغييرات في OD على مدى فترة 240 دقيقة على مدار 72 ساعة. الاختصارات: WT = النوع البري ؛ PQ = باراكوات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. زراعة الخلايا والتحضير للتصوير (الشكل 4)
- نشر الخلايا في وسط اصطناعي إلى مرحلة منتصف السجل للتصوير. توفر ثقافة طور اللوغاريتم المتوسط سعة 5 مل خلايا كافية لأربع أو خمس شرائح وما مجموعه >100 خلية ناشئة للتحليل.
- في الصباح في اليوم السابق للتجربة ، قم بإعداد الزراعات السائلة عن طريق تلقيح 5 مل من الوسط الاصطناعي الكامل (SC) في أنبوب مخروطي القاع سعة 50 مل مع مستعمرة واحدة من خلايا الخميرة.
- احتضان الاستزراع المسبق في شاكر مداري عند 200 دورة في الدقيقة و 30 درجة مئوية لمدة 6-8 ساعات. قم بقياس OD 600 للاستزراع المسبق ، والذي يجب أن يكون في مرحلة منتصف السجل: ~ 0.5-1 × 107 خلايا / مل ، OD600 ~ 0.1-0.3.
- قم بإعداد ثقافة مرحلة منتصف السجل باستخدام ما قبل الثقافة للتصوير في اليوم التالي. احسب كمية الاستزراع المسبق اللازمة لاستزراع مرحلة منتصف السجل بعد النمو بين عشية وضحاها (8-16 ساعة). عندما تزرع الخلايا في وسط SC ، يكون وقت المضاعفة ~ 2 ساعة. لذلك ، يتم حساب حجم (V) من الزراعة المسبقة لتلقيح مزرعة بين عشية وضحاها 5 مل باستخدام المعادلة (1):
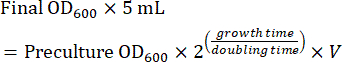 (1)
(1) - قم بتلقيح 5 مل من وسط SC في أنبوب مخروطي القاع سعة 50 مل بكمية الزراعة الأولية المحسوبة في الخطوة 2.1.3. تنمو في شاكر مداري عند 200 دورة في الدقيقة و 30 درجة مئوية لمدة 8-16 ساعة.
- في يوم التصوير ، تأكد من أن الثقافة التي تم إنشاؤها في الخطوة 2.1.4 في مرحلة منتصف السجل (OD600 ~ 0.1-0.3). تركيز الخلايا من 1 مل من ثقافة مرحلة منتصف السجل عن طريق الطرد المركزي عند 6000 × جم لمدة 30 ثانية. قم بإزالة المادة الطافية ، وترك 10-20 ميكرولتر من المادة الطافية في الأنبوب. أعد تعليق حبيبات الخلية عن طريق الخلط برفق مع الوسائط المتبقية باستخدام ماصة دقيقة.
- استخدم منفاخ هواء أو منديلا خاليا من النسالة لإزالة الغبار من شريحة مجهر زجاجي وإضافة 1.8 ميكرولتر من تعليق الخلية إلى الشريحة. قم بتغطية الخلايا بغطاء زجاجي # 1.5 (بسمك 170 ميكرومتر) ، مع خفض انزلاق الغطاء ببطء بزاوية لتجنب إدخال الفقاعات.
- قم بالصورة على الفور وتجاهل الشريحة بعد 10 دقائق من التصوير.
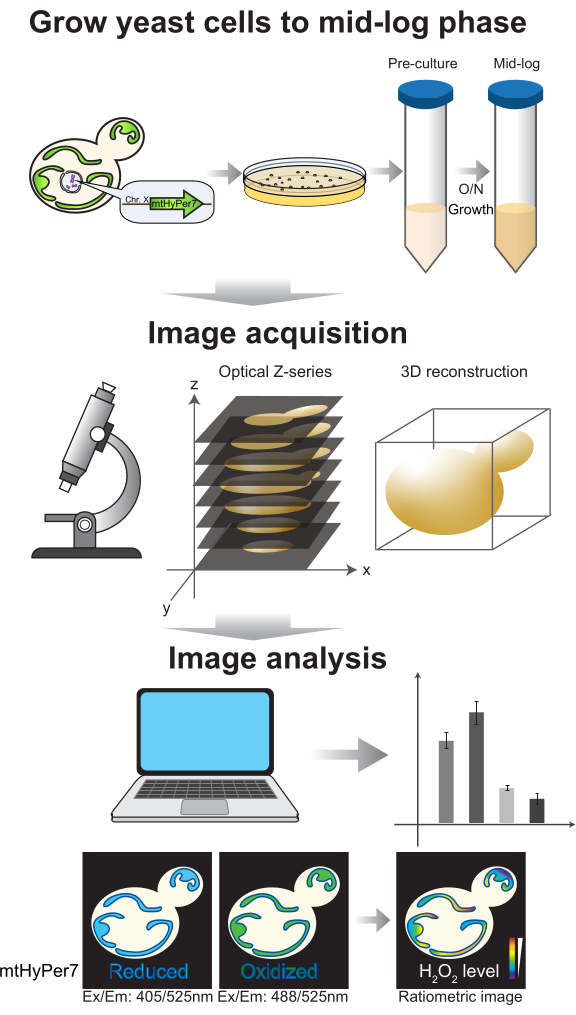
الشكل 4: نمو الخلايا وتصويرها. تزرع خلايا الخميرة الناشئة التي تعبر عن mtHyPer7 إلى مرحلة منتصف السجل. يتم جمع صور سلسلة Z بواسطة المجهر متحد البؤر القرص الدوار ثم تخضع لإعادة بناء وتحليل 3D. انظر أقسام البروتوكول 2-3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تحسين ظروف التصوير وجمع الصور (الشكل 5)
- حدد وضع التصوير. بالنسبة للتقسيم البصري بدون معالجة لاحقة ، يفضل استخدام أداة متحدة البؤر للقرص الدوار. ومع ذلك ، إذا كانت الإشارة منخفضة ، أو كانت هذه الأداة غير متوفرة ، فاستخدم التصوير واسع المجال ، مع التأكد من فك الصور واسعة المجال لإزالة الضبابية خارج التركيز البؤري ، كما هو موضح سابقا38.
- حدد البصريات. استخدم عدسة غمر بالزيت ذات فتحة رقمية عالية ، مثل 100x / 1.45 Plan-Apochromat.
- حدد الأطوال الموجية للإثارة والانبعاث. للتصوير البؤري للقرص الدوار ، استخدم إثارة الليزر عند 405 نانومتر و 488 نانومتر ومرشح انبعاث GFP قياسي. للتصوير واسع المجال ، استخدم الصمام الثنائي الباعث للضوء (LED) أو إثارة المصباح ، ولكن تأكد من أن إعداد المرشح يسمح باختلاف الإثارة أثناء تمرير الانبعاثات عبر مرشح GFP القياسي.
ملاحظة: يمكن تحقيق ذلك ، على سبيل المثال ، عن طريق إزالة مرشح الإثارة من مكعب GFP واستخدام LED أو عجلة المرشح لتحديد الإثارة. - حدد وقت التعرض وشدة الإضاءة.
- إنشاء شروط اكتساب تعطي إشارة يمكن اكتشافها بسهولة ودقة مقبولة في كل قناة مضان. على سبيل المثال ، على مجهر متحد البؤر للقرص الدوار مزود بكاميرا sCMOS ، استخدم 2 × 2 binning ، وطاقة ليزر 20-40٪ ، وتعرض 200-600 مللي ثانية.
- افحص الرسم البياني للصورة. في صورة 12 بت (4096 مستوى رمادي ممكن) ، تأكد من أن النطاق الديناميكي الإجمالي لقيم البكسل لا يقل عن عدة مئات من المستويات الرمادية ، دون تشبع (الشكل 5 أ). بالإضافة إلى ذلك ، تأكد من أن النطاق أعلى بترتيب واحد من مستوى الضوضاء. احسب مستوى التشويش باعتباره الانحراف المعياري لقيم البكسل في منطقة خالية من الخلايا في الصورة، مقاسا كما هو موضح في الخطوة 4.1.3.1.
- اختبار التبييض الضوئي أو إجهاد الميتوكوندريا الناجم عن التصوير في ظل ظروف التصوير المحددة. إذا لوحظ التبييض الضوئي المفرط أو زيادة في الميتوكوندريا H 2 O2، قلل من طاقة الليزر وقم بزيادة التعرض أو التجميع.
- اجمع سلسلة من الصور ذات الفاصل الزمني ، دون تأخير بين عمليات الاستحواذ ، لتقييم آثار ظروف التصوير على استقرار الإشارة والإجهاد التأكسدي في الميتوكوندريا. باستخدام برنامج الحصول على المجهر أو ImageJ ، قم بقياس متوسط قيمة البكسل في كل قناة مضان لتأكيد استقرار الإشارة (<5٪ تغيير ؛ الشكل 5 ب). إذا كانت التجربة لا تتضمن تصويرا بفاصل زمني ، فتأكد من أن التألق مستقر على مكدسين أو ثلاثة مكدسات Z متكررة (25-35 تعرضا).
ملاحظة: قد يشير انخفاض مضان كلتا القناتين إلى التبييض الضوئي. ومع ذلك ، فإن الانخفاض في التألق المتحمس 405 نانومتر مصحوبا بزيادة في القناة المثارة 488 نانومتر قد يشير إلى زيادة الميتوكوندريا H 2O2 والإجهاد التأكسدي الناجم عن التصوير في العضية.
- اجمع سلسلة من الصور ذات الفاصل الزمني ، دون تأخير بين عمليات الاستحواذ ، لتقييم آثار ظروف التصوير على استقرار الإشارة والإجهاد التأكسدي في الميتوكوندريا. باستخدام برنامج الحصول على المجهر أو ImageJ ، قم بقياس متوسط قيمة البكسل في كل قناة مضان لتأكيد استقرار الإشارة (<5٪ تغيير ؛ الشكل 5 ب). إذا كانت التجربة لا تتضمن تصويرا بفاصل زمني ، فتأكد من أن التألق مستقر على مكدسين أو ثلاثة مكدسات Z متكررة (25-35 تعرضا).
- الحصول على الصور. في حالة تجميع مكدسات Z، تأكد من أن الفاصل الزمني Z هو نفسه لكل الصور في مجموعة البيانات، وقم بتضمين الخلية بأكملها. بالنسبة للخميرة الناشئة ، صورة بفاصل Z يبلغ 0.5 ميكرومتر وعمق مكدس إجمالي يبلغ 6 ميكرومتر. الحصول على صور الضوء المرسل لتوثيق حدود الخلايا.
- تحليل الصور يدويا أو شبه آلي عبر البرامج النصية المتوفرة في الملف التكميلي 2 وفي https://github.com/theresaswayne/biosensor ، باستخدام توزيع فيجي ل ImageJ39 والبرنامج الإحصائي R (الشكل 6). في تعليمات البرنامج ، تظهر أوامر القائمة الهرمية بخط عريض مع "|" ، مما يشير إلى سلسلة من تحديدات القائمة. يتم عرض الخيارات والأزرار بالخط العريض.
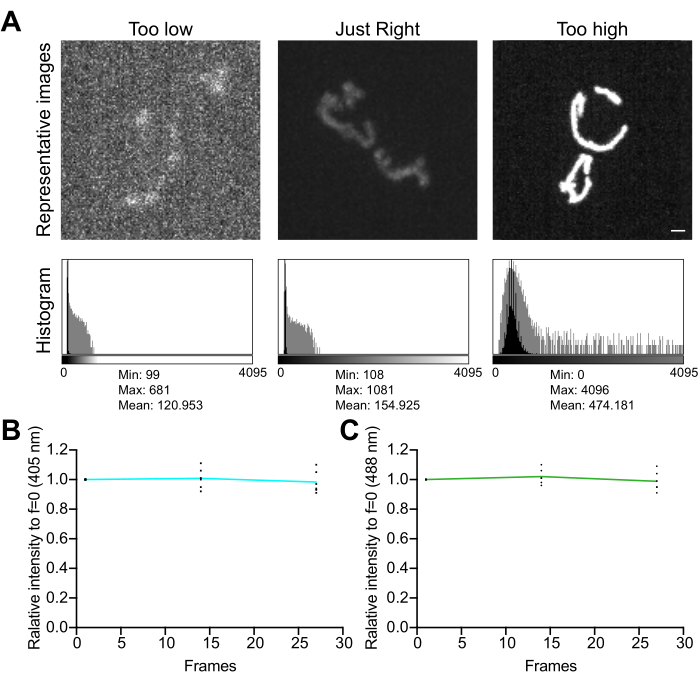
الشكل 5: تحسين التصوير. أ: تقييم الصور والرسوم البيانية لنطاق الشدة الصحيح. يتم عرض الإسقاطات القصوى الكثافة للصور متحدة البؤر للقرص الدوار. يتم عرض الرسوم البيانية مع كل من المحور Y الخطي (أسود) ومحور Y بمقياس لوغاريتم (رمادي) لتوضيح النطاق الديناميكي للصورة. اللوحات اليسرى: صورة صاخبة ذات كثافة منخفضة ونطاق ديناميكي. اللوحات المركزية: صورة ذات نطاق ديناميكي مقبول (~ 1000 مستوى رمادي) وكثافة. اللوحات اليمنى: صورة محسنة التباين بشكل غير صحيح لإنتاج تشبع مفرط. شريط المقياس = 1 ميكرومتر. (B ، C) تحليل التبييض الضوئي ل mtHyPer7. تم جمع مداخن Z المتتالية دون تأخير ، وتم جمع مداخن Z ، وتم قياس متوسط كثافة الميتوكوندريا وتطبيعها إلى النقطة الزمنية الأولى. يتم عرض النتائج من النقاط الزمنية الثلاث الأولى (27 تعرضا). ب: الطول الموجي للإثارة: 405 نانومتر. ج: الطول الموجي للإثارة: 488 نانومتر. القيم الموضحة هي متوسطات ثلاث خلايا من كل تجربة من ثلاث تجارب مستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التحليل شبه الآلي مع البرامج النصية
- قم بإنشاء وقياس صور النسبة باستخدام برنامج نصي لتحليل المستشعر الحيوي (على سبيل المثال ، biosensor.ijm أو biosensor-image-subtraction.ijm).
- حدد البرنامج النصي المراد استخدامه. بروتوكول استخدام كل برنامج نصي مشابه. سيتم تحديد أي اختلافات في النص.
- biosensor.ijm: في هذا البرنامج النصي ، يتم تصحيح الخلفية والضوضاء باستخدام مناطق الصورة المحددة من قبل المستخدم أو القيم الثابتة أو عدم الطرح. حدد طرقا لتصحيح الخلفية والضوضاء بشكل مستقل.
- biosensor-image-subtraction.ijm: في هذا البرنامج النصي ، يتم التعامل مع كل من الخلفية والضوضاء بنفس الطريقة التي يختارها المستخدم ، والتي قد تكون واحدة مما يلي: صورة فارغة أو منطقة محددة من قبل المستخدم داخل الصورة أو قيمة ثابتة أو بدون تصحيح.
- في فيجي، افتح صورة مكدس Z متعددة القنوات تم الحصول عليها في الخطوة 3.5. افتح ملف البرنامج النصي لتحليل المستشعر الحيوي المطلوب. قم بتشغيل البرنامج النصي بالنقر فوق تشغيل في نافذة محرر البرامج النصية . في نافذة الحوار التي تظهر ، أدخل المعلومات المطلوبة.
- حدد أرقام قنوات البسط والمقام لحساب النسبة. بالنسبة إلى mtHyPer7 ، البسط هو القناة المثارة عند 488 نانومتر ، والمقام هو القناة المثارة عند 405 نانومتر. حدد رقم القناة لصورة الضوء المرسل ، إذا كان موجودا ، أو 0 إذا لم يكن هناك شيء.
- حدد طريقة طرح الخلفية المطلوبة من الخيارات الأربعة التالية. إذا كانت الخلفية موحدة نسبيا، فاختر تحديد منطقة صورة، والتي تقيس مستوى الخلفية في الصورة مباشرة. إذا كانت الخلفية تختلف اختلافا كبيرا عبر الحقل، فاستخدم البرنامج النصي biosensor-image-subtraction.ijm وحدد صورة فارغة (لتجميع صورة فارغة للتصحيح، التقط مكدس Z متعدد القنوات بشروط اكتساب متطابقة في مجال رؤية خال من الخلايا، أو من شريحة مصنوعة من وسيط نمو خال من الخلايا). تسمح القيمة الثابتة بإدخال قيمة خلفية تم قياسها مسبقا. لا شيء يترك الخلفية دون تصحيح ، ولكنه قد يقلل من دقة القياس.
- حدد طريقة طرح الضوضاء المطلوبة. يتم استخدام قيمة التشويش كعتبة أقل على صور القناة المقنعة المطروحة في الخلفية لتقليل تأثير الاختلاف العشوائي في قراءات الكاشف. اختر تحديد منطقة صورة أو قيمة ثابتة للسماح بإدخال مستوى ضوضاء تم قياسه مسبقا ، والذي يعمل عادة بشكل جيد حيث تكون مستويات الضوضاء ثابتة إذا ظلت ظروف التصوير ثابتة. بدلا من ذلك، اختر لا شيء واستخدم قيمة 1 كحد أدنى، مما قد يزيد من تباين القياسات.
- حدد خوارزمية عتبة للكشف عن الميتوكوندريا بدقة واتساق ؛ يوصى باستخدام Otsu أو MaxEntropy . من الناحية المثالية ، استخدم نفس الخوارزمية لجميع الصور في التجربة ، ولكن تأكد من التعرف الدقيق على الميتوكوندريا. استخدم طريقة عتبة مختلفة إذا كانت هناك تغييرات في التشكل أثناء التجربة.
- حدد عدد مناطق الاهتمام (ROIs) لكل خلية. على سبيل المثال، في حالة قياس الاختلافات بين الأم والبرعم، حدد 2.
- حدد مجلد الإخراج حيث سيتم حفظ القياسات وصور النسبة.
- اتبع المطالبات لتصحيح الخلفية والضوضاء.
- تحديد المنطقة (إن أمكن): إذا تم اختيار تحديد منطقة صورة لقياس الخلفية أو التشويش، فاتبع المطالبات لرسم منطقة خلفية (خارج أي خلايا أو عناصر فلورية) باستخدام أداة عائد استثمار المستطيل. بعد رسم المنطقة ، انقر فوق موافق.
- إدخال القيمة الثابتة (إن أمكن): إذا تم اختيار قيمة ثابتة لقياس الخلفية أو الضوضاء ، فاتبع المطالبات لإدخال قيم الخلفية و / أو الضوضاء لكل قناة مضان.
- صورة مرجعية فارغة (إن وجدت): في البرنامج النصي biosensor-image-subtraction.ijm ، إذا تم اختيار صورة فارغة لتصحيح الخلفية أو الضوضاء ، فاتبع المطالبات لتحديد ملف صورة فارغ.
- ضع علامة على عائد الاستثمار للقياس. في مزارع مرحلة منتصف اللوغاريتم، اقصر التحليل على الخلايا الناشئة.
- ارسم عائد الاستثمار المقابل للخلايا الفردية أو المناطق دون الخلوية بناء على صورة المجال الساطع. لا يجب أن يتطابق عائد الاستثمار تماما مع مخطط الخلية ، حيث سيتم قياس الميتوكوندريا العتبة فقط ضمن عائد الاستثمار. بدلا من ذلك، افتح مجموعة عائد استثمار محفوظة مسبقا: في مدير عائد الاستثمار، انقر على المزيد، ثم حدد ملف عائد الاستثمار.
- اضغط على T بعد إنشاء كل عائد استثمار لإضافة عائد الاستثمار المحدد إلى مدير عائد الاستثمار. في مدير عائد الاستثمار، حدد إظهار الكل لتوثيق الخلايا التي تم وضع علامة عليها. ستظهر كل منطقة مضافة كعنصر مرقم في قائمة مدير عائد الاستثمار. في حالة تحليل أكثر من عائد استثمار واحد لكل خلية (على سبيل المثال ، الأم والبراعم) ، ضع علامة على عائد الاستثمار بنفس الترتيب لكل خلية تم تحليلها.
- بعد إضافة جميع عائد الاستثمار المطلوب إلى مدير عائد الاستثمار، انقر فوق موافق في نافذة الحوار وضع علامة على الخلايا .
- اختر تنسيق جدول القياس. في نافذة الحوار MultiMeasure التي تظهر، حدد قياس كل الشرائح. تحقق من صف واحد لكل شريحة الخيار لإنتاج جدول بالتنسيق المطلوب. استخدم process_multiROI_tables. R البرنامج النصي لمعالجة الجداول التي تم إنشاؤها باستخدام خيار صف واحد لكل شريحة ؛ لا تتحقق من إلحاق النتائج. كرر هذه الخطوة 3x (لقياس صور البسط [488] والمقام [405] والنسبة [488/405]).
- سيحفظ البرنامج النصي ملفات الإخراج في المجلد المحدد في الخطوة 4.1.2.6.
- حدد البرنامج النصي المراد استخدامه. بروتوكول استخدام كل برنامج نصي مشابه. سيتم تحديد أي اختلافات في النص.
- حساب النسب المتوسطة المرجحة لكل منطقة أو خلية
- باستخدام النتائج التي تم الحصول عليها في الخطوة السابقة ، احسب نسب المتوسط المرجح لكل منطقة أو خلية باستخدام المعادلة (2). احسب إما نسب "البكسل" أو "حسب المنطقة" (انظر المناقشة للحصول على التفاصيل).
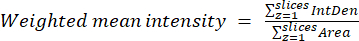 (2)
(2)
ملاحظة: تتضمن قيم المساحة والكثافة المتكاملة (IntDen) وحدات البكسل داخل الميتوكوندريا العتبة فقط. يمكن أتمتة هذا الحساب باستخدام process_multiROI_tables. برنامج R النصي و R الإحصائي.
- باستخدام النتائج التي تم الحصول عليها في الخطوة السابقة ، احسب نسب المتوسط المرجح لكل منطقة أو خلية باستخدام المعادلة (2). احسب إما نسب "البكسل" أو "حسب المنطقة" (انظر المناقشة للحصول على التفاصيل).
- إنشاء صورة نسبة ملونة. نظرا لأن التغييرات في تدرج اللون (اللون) تكون أكثر وضوحا للعين البشرية من التغيرات في الشدة ، قم بتحويل قيمة النسبة إلى مقياس ألوان لتسهيل التفسير البصري. سيقوم البرنامج النصي colorize_ratio_image.ijm بتلوين صورة نسبة مقنعة.
- في فيجي ، افتح صورة مكدس نسبة Z التي تم إنشاؤها في الخطوة 4.1.6. افتح ملف البرنامج النصي colorize_ratio_image.ijm. قم بتشغيل البرنامج النصي بالنقر فوق تشغيل في نافذة محرر البرامج النصية . في نافذة الحوار التي تظهر ، أدخل المعلومات المطلوبة.
- طريقة التلوين: في الخيار غير المعدل، تظهر كل وحدات بكسل الميتوكوندريا بنفس السطوع. ومع ذلك ، قد تظهر بعض الصور صاخبة حيث تساهم كل من وحدات البكسل الخافتة والساطعة في نسبة الصورة. لتقليل هذا التأثير ، استخدم خيار معدل الكثافة .
- الحد الأدنى والحد الأقصى للقيمة المعروضة: تتحكم هذه القيم في نطاق قيم النسبة التي سيتم تلوينها. اختر قيما بالقرب من متوسط القيم الدنيا والقصوى التي تمت ملاحظتها في التجربة (استنادا إلى متوسط النسب المرجحة المحسوبة في الخطوة 4.2.1). ضمن التجربة ، تأكد من الحصول على جميع الصور ذات ظروف التصوير المتطابقة وعرض جميع الصور ذات القيم الدنيا والقصوى المتطابقة.
- وضع الإسقاط: يتم عرض مكدسات Z كإسقاطات لإظهار مجموعة الميتوكوندريا بأكملها. يتم إنشاء الإسقاط قبل التلوين. حدد الحد الأقصى لإسقاط الكثافة القصوى (مع الحفاظ على قيم النسبة والكثافة القصوى) أو المتوسط لإسقاط متوسط الكثافة.
- مجلد الإخراج: حدد المجلد الذي تريد حفظ الصور الملونة فيه.
- إذا تم تحديد الخيار غير المعدل، فحدد نظام ألوان (جدول البحث; LUT) في نافذة الحوار التي تظهر. استخدم جداول البحث Fire أو Rainbow RGB المضمنة في فيجي ، أو أي جدول بحث مرغوب فيه بتنسيق .lut الخاص ب ImageJ (استيراد من ملف LUT). يوصى باستخدام Rainbow Smooth40 LUT (مضمن في الملف التكميلي 2 وعلى GitHub).
- يحفظ البرنامج النصي ملفات الإخراج إلى المجلد المحدد في الخطوة 4.3.1.4. يتضمن ذلك صورة النسبة الملونة (Color_RGB.tif) وصورة النسبة الملونة مع شريط معايرة يوضح التطابق بين قيم النسبة ولون الصورة (Color_with_bar.tif).
- في فيجي ، افتح صورة مكدس نسبة Z التي تم إنشاؤها في الخطوة 4.1.6. افتح ملف البرنامج النصي colorize_ratio_image.ijm. قم بتشغيل البرنامج النصي بالنقر فوق تشغيل في نافذة محرر البرامج النصية . في نافذة الحوار التي تظهر ، أدخل المعلومات المطلوبة.
5. التحليل اليدوي
ملاحظة: يستغرق هذا النهج وقتا أطول ولكنه يسمح بالمرونة في المعالجة المسبقة وتحديد العتبة.
- صحيح للخلفية.
- تعيين الخيارات في فيجي.
- انقر فوق تحليل | تعيين القياسات. في نافذة الحوار التي تظهر، حدد مربعات المنطقة والمتوسط وStdDev وIntden وتسمية العرض. اضبط المنازل العشرية على 3.
- انقر فوق تحرير | خيارات | الإدخال / الإخراج. في نافذة الحوار التي تظهر، حدد مربعي حفظ أرقام الصفوف وحفظ رؤوس الأعمدة.
- لزيادة حساسية حساب النسبة ، اطرح الخلفية من كل قناة مضان. إذا كانت الخلفية موحدة نسبيا، فقم بقياس متوسط كثافة منطقة خالية من الخلايا في صورة ما، واطرح هذه القيمة من الصورة بأكملها (الخطوة 5.1.2.1). بدلا من ذلك ، إذا كانت الخلفية تختلف اختلافا كبيرا عبر الحقل ، فاستخدم صورة فارغة للتصحيح (الخطوة 5.1.2.2.).
- لطرح منطقة يختارها المستخدم ، انقر فوق صورة | اللون | قم بتقسيم القنوات ، واحتفظ بجميع صور القناة مفتوحة ، حيث ستكون هناك حاجة إليها لاحقا. لكل قناة مضان ، ارسم عائد استثمار في الخلفية (خارج أي خلايا) وانقر فوق تحليل | قياس، أو بالنسبة إلى الحزم المكدسة، انقر على صورة | مداخن | قياس المكدس. لاحظ القيمة المتوسطة لعائد الاستثمار الذي يظهر في جدول النتائج . انقر فوق تحرير | حدد بلا، ثم معالجة | الرياضيات | طرح. في نافذة الحوار التي تظهر، أدخل متوسط قيمة الخلفية المقاسة، مقربا إلى أقرب عدد صحيح.
ملاحظة: يمنع التقريب الأخطاء في العمليات الثنائية لاحقا. - لطرح صورة فارغة من ملف بيانات، اجمع صورة فارغة من حقل رؤية خال تماما من الخلايا أو من شريحة معدة باستخدام وسيط نمو خال من الخلايا. انقر فوق عملية | حاسبة الصور. في نافذة الحوار التي تظهر ، اضبط العملية على طرح ، واضبط Image1 و Image2 على صورة الخلية والصورة الفارغة ، على التوالي. تحقق إنشاء نافذة جديدة ونتيجة 32 بت.
- لطرح منطقة يختارها المستخدم ، انقر فوق صورة | اللون | قم بتقسيم القنوات ، واحتفظ بجميع صور القناة مفتوحة ، حيث ستكون هناك حاجة إليها لاحقا. لكل قناة مضان ، ارسم عائد استثمار في الخلفية (خارج أي خلايا) وانقر فوق تحليل | قياس، أو بالنسبة إلى الحزم المكدسة، انقر على صورة | مداخن | قياس المكدس. لاحظ القيمة المتوسطة لعائد الاستثمار الذي يظهر في جدول النتائج . انقر فوق تحرير | حدد بلا، ثم معالجة | الرياضيات | طرح. في نافذة الحوار التي تظهر، أدخل متوسط قيمة الخلفية المقاسة، مقربا إلى أقرب عدد صحيح.
- تعيين الخيارات في فيجي.
- لقصر التحليل على الميتوكوندريا ، قم بإجراء التجزئة. نظرا لأن كل قناة قد تتغير شدتها اعتمادا على حالة المستشعر الحيوي ، استخدم مجموع القناتين لتحديد مساحة الميتوكوندريا باستمرار.
- لإنشاء صورة مجموع ، انقر فوق عملية | حاسبة الصور. في نافذة الحوار التي تظهر ، اضبط العملية على إضافة ، واضبط Image1 و Image2 على قناتي الفلورسنت المطروحتين في الخلفية بأي ترتيب. حدد إنشاء نافذة جديدة ونتيجة 32 بت وانتظر ظهور صورة مجموع.
- اضبط العتبة لتعريف الميتوكوندريا على صورة المجموع.
- انقر على الصورة | ضبط | العتبة. في نافذة العتبة التي تظهر ، تحقق من الخلفية الداكنة والرسم البياني للمكدس. اضبط الطريقة على الخوارزمية المطلوبة (على سبيل المثال ، Otsu أو MaxEntropy). استخدم عتبة تلقائية للاستنساخ ، ولكن إذا لم تكن هناك طريقة تلقائية مناسبة ، فقم بضبط العتبة يدويا.
ملاحظة: من الناحية المثالية ، يجب استخدام نفس الخوارزمية لجميع الصور في التجربة ، ولكن التغييرات في التشكل أثناء التجربة قد تتطلب طريقة عتبة مختلفة في بعض الحالات. - عندما يكون الحد مرضيا، انقر على تطبيق. في نافذة الحوار التي تظهر، اختر تحويل إلى قناع. في نافذة الحوار التي تظهر ، حدد خلفية سوداء واترك المربعات الأخرى بدون تحديد. احفظ صورة القناع الناتجة لتقييم دقة التجزئة.
- انقر على الصورة | ضبط | العتبة. في نافذة العتبة التي تظهر ، تحقق من الخلفية الداكنة والرسم البياني للمكدس. اضبط الطريقة على الخوارزمية المطلوبة (على سبيل المثال ، Otsu أو MaxEntropy). استخدم عتبة تلقائية للاستنساخ ، ولكن إذا لم تكن هناك طريقة تلقائية مناسبة ، فقم بضبط العتبة يدويا.
- قم بتحويل قيم القناع من 0 و 255 إلى 0 و 1 ، على التوالي ، بالنقر فوق عملية | الرياضيات | تقسيم. اضبط القيمة على 255 ، وعند المطالبة ، حدد الخيار لمعالجة جميع الصور.
- ضع القناع على قنوات التألق المطروحة في الخلفية بالنقر فوق عملية | حاسبة الصور. في نافذة الحوار التي تظهر ، اضبط العملية على ضرب. اضبط Image1 وImage2 على قناة البسط والقناع، على التوالي. تحقق إنشاء نافذة جديدة ونتيجة 32 بت ؛ كرر ضرب القناع مع قناة المقام.
- قم بإعداد كل قناة مقنعة لحساب النسبة عن طريق تعيين وحدات بكسل الخلفية إلى NaN ("ليس رقما").
- حدد قناة البسط المقنع وانقر على صورة | ضبط | العتبة. في نافذة العتبة ، انقر فوق تعيين، وفي نافذة الحوار التي تظهر، اضبط الحد الأدنى على مستوى الضوضاء المحسوب أو على 1، واترك الحد الأقصى كما هو.
- في نافذة العتبة ، انقر فوق تطبيق. في مربع الحوار التالي، اختر تعيين إلى NaN. كرر لقناة المقام المقنع.
- قم بإنشاء صورة النسبة.
- انقر فوق عملية | حاسبة الصور. في نافذة الحوار التي تظهر ، اضبط العملية على تقسيم. اضبط Image1 وImage2 على قناتي البسط والمقام المقنعين المطروحين في الخلفية، على التوالي. بالنسبة إلى mtHyPer7 ، البسط هو الشكل المؤكسد المثار عند 488 نانومتر ، والمقام هو الشكل المختزل المثار عند 405 نانومتر. لذلك ، تشير النسب الأعلى إلى ارتفاع H2 O2.
- تحقق إنشاء نافذة جديدة ونتيجة 32 بت. احفظ صورة النسبة للتحليل.
- ضع علامة على مجالات الاهتمام وحددها. يتم تحديد كل خلية أو منطقة دون خلوية وتخزينها كعائد استثمار في مدير عائد الاستثمار. لا يجب أن تتطابق عائد الاستثمار تماما مع مخططات الخلية ، حيث سيتم قياس مناطق الميتوكوندريا المقنعة فقط.
- باستخدام صورة الضوء المرسل لمنع التحيز ، قم بإنشاء عائد استثمار يتوافق مع الخلايا الفردية (أو المناطق دون الخلوية). في ثقافات مرحلة منتصف السجل ، قصر التحليل على خلايا الخميرة التي تحمل البراعم ، والتي تشارك بنشاط في انقسام الخلايا. اضغط على T بعد إنشاء كل عائد استثمار لإضافته إلى مدير عائد الاستثمار. حدد إظهار الكل لتوثيق الخلايا التي تم وضع علامة عليها.
- انقر فوق صورة النسبة التي تم إنشاؤها أعلاه ، وفي مدير عائد الاستثمار ، انقر فوق المزيد ... | متعدد القياسات. في نافذة الحوار التي تظهر، حدد قياس كل الشرائح. لا تحدد إلحاق النتائج. تحقق من صف واحد لكل شريحة الخيار لإنتاج جدول بالتنسيق المطلوب. process_multiROI_tables. سيقوم البرنامج النصي R بمعالجة الجداول التي تم إنشاؤها باستخدام خيار صف واحد لكل شريحة في برنامج R الإحصائي.
- احفظ النتائج. انقر فوق نافذة النتائج ، ثم ملف | احفظ جدول النتائج واحفظه بتنسيق .csv أو .xls. قم بتعيين اسم الملف ليطابق اسم الصورة.
- احفظ عائد الاستثمار. في مدير عائد الاستثمار، تأكد أولا من عدم تحديد أي عائد استثمار: انقر على إلغاء التحديد، ثم المزيد | حفظ. افتح عائد الاستثمار المحفوظ مع الصورة الأصلية في فيجي للإسناد الترافقي للقياسات مع الصورة.
- احسب متوسط النسب المرجحة لكل خلية أو منطقة باستخدام النتائج التي تم الحصول عليها في الخطوة السابقة والمعادلة (3). احسب إما نسب "البكسل" أو "حسب المنطقة" (انظر المناقشة للحصول على التفاصيل).
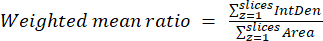 (3)
(3)
ملاحظة: تتضمن قيم المساحة والكثافة المتكاملة وحدات البكسل داخل الميتوكوندريا العتبة فقط. يمكن أتمتة هذا الحساب باستخدام process_multiROI_tables. البرنامج النصي R في البرنامج الإحصائي R. - إنشاء صورة نسبة ملونة.
ملاحظة: يمكن أن تكون الصور الملونة غير معدلة، حيث تظهر جميع وحدات بكسل الميتوكوندريا بنفس السطوع، أو معدلة الكثافة، حيث يتم استخدام كثافة البكسل في الصورة الأصلية لتعيين الشدة في الصورة الملونة.- لإنتاج صورة ملونة غير معدلة:
- افتح صورة النسبة التي تم إنشاؤها أعلاه. انقر على الصورة | تكرار لإنشاء نسخة من الصورة، ثم إغلاق الصورة الأصلية.
- إذا كانت الصورة عبارة عن مكدس Z ، فإما أن تحدد شريحة واحدة ، أو قم بإنشاء إسقاط Z لعرض كل الميتوكوندريا. استخدم إما الحد الأقصى للكثافة (مع الاحتفاظ بالحد الأقصى لقيم النسبة والكثافة عند كل إحداثي XY pixel) أو إسقاط متوسط الكثافة.
- انقر على الصورة | ابحث عن الجداول واضبط جدول البحث على نظام الألوان المطلوب (على سبيل المثال، Rainbow RGB أو Fire [متوفر افتراضيا في ImageJ]). بدلا من ذلك ، انقر فوق ملف | قم باستيراد LUT وحدد أي جدول بحث مرغوب فيه بتنسيق .lut الخاص ب ImageJ ، مثل Rainbow Smooth40 (مضمن في الملف التكميلي 2 وعلى GitHub). تأكد من أن جدول البحث له لون غامق معين للقيمة 0.
- اضبط تباين الشاشة بالنقر فوق صورة | ضبط | السطوع / التباين. في نافذة السطوع/التباين، انقر فوق تعيين، وفي نافذة الحوار التي تظهر، أدخل القيم المطلوبة للقيم المعروضة الدنيا والقصوى. لتعظيم اختلافات الألوان التي لوحظت ، اضبطها على الحد الأدنى والحد الأقصى الذي تم الحصول عليه تقريبا عبر جميع الصور. اضبط جميع الصور في التجربة على نفس مستويات التباين.
ملاحظة: لا تنقر فوق تطبيق، لأن هذا سيغير قيم البكسل ويمنع إنشاء شريط معايرة دقيق في الخطوة التالية. - أضف شريط معايرة الألوان بالنقر فوق تحليل | أدوات | شريط المعايرة. في نافذة الحوار التي تظهر ، حدد خيار تراكب لإزالة الشريط ، إذا رغبت في ذلك ، بالنقر فوق صورة | تراكب | إزالة التراكب.
- إذا رغبت في ذلك ، أضف شريط مقياس بالنقر فوق تحليل | أدوات | شريط المقياس. في نافذة الحوار التي تظهر، قم بتعيين الحجم والموقع واللون المطلوب للشريط. حدد خيار التراكب للحفاظ على لون الشريط بغض النظر عن جدول البحث المستخدم.
- قم بإنشاء صورة RGB للنشر بالنقر فوق صورة | تراكب | تسطيح. احفظ الصورة الناتجة.
ملاحظة: هذه الصورة للعرض أو النشر فقط. يتم تغيير قيم الشدة ، لذلك لا يمكن قياسها. يتم أيضا حرق الأشرطة بشكل دائم على الصورة.
- لإنشاء صورة معدلة الكثافة:
- انقر على الصورة | تكرار لإنشاء نسخة من الصورة، ثم إغلاق الصورة الأصلية.
- إذا كانت الصورة عبارة عن مكدس Z، فإما أن تحدد شريحة واحدة أو قم بإنشاء إسقاط Z لعرض كل الميتوكوندريا.
- اضبط تباين عرض صورة النسبة بالنقر فوق صورة | ضبط | السطوع/التباين، وفي نافذة السطوع/التباين، انقر فوق تعيين. في نافذة الحوار التي تظهر ، أدخل القيم المطلوبة للقيم المعروضة الحد الأدنى والحد الأقصى . لتعظيم اختلافات الألوان التي تمت ملاحظتها، اضبطها على الحد الأدنى والحد الأقصى تقريبا الذي تم الحصول عليه عبر كل الصور، واضبط كل الصور في التجربة على نفس مستويات التباين. انقر فوق تطبيق لإعادة قياس قيم البيكسل.
- لإنشاء شريط معايرة ، قم بتكرار هذه الصورة المحسنة ، وقم بإنشاء شريط بالانتقال إلى تحليل | أدوات | شريط المعايرة. قم بتحويل الصورة والتراكب إلى تنسيق RGB بالنقر فوق صورة | تراكب | تسطيح. إذا رغبت في ذلك ، الصق هذا الشريط على صورة RGB المعدلة الكثافة التي تم الحصول عليها في الخطوة 5.6.2.12 للعرض أو النشر.
- قم بإنشاء صورة جديدة بنفس عرض وارتفاع الصورة بالنقر فوق ملف | جديد | صورة.... في نافذة الحوار التي تفتح ، قم بتعيين المعلمات كما يلي: النوع: RGB ؛ املأ ب: أسود; العرض والارتفاع: 9عرض وارتفاع الصورة) ؛ شرائح: 1.
- قم بتحويل المكدس الجديد إلى مكدس صور HSB (تدرج اللون ، التشبع ، السطوع) بالنقر فوق صورة | النوع | HSB المكدس.
- انقر على صورة النسبة المعدلة بالتباين بالانتقال إلى تحرير | حدد الكل، ثم تحرير | نسخ. ثم ، انقر فوق مكدس HSB ، وحدد الشريحة الأولى (Hue) ، وانقر فوق تحرير | لصق لنقل قيم النسبة.
- حدد الشريحة 2 (التشبع) من مكدس HSB. اضبط لون المقدمة على اللون الأبيض بالانتقال إلى تحرير | خيارات | الألوان. انقر فوق تحرير | حدد الكل، ثم تحرير | تعبئة، وفي نافذة الحوار التي تفتح، حدد لا لتعبئة الشريحة الحالية باللون الأبيض فقط.
- افتح صورة البيانات الأولية وقم بتقسيم القنوات بالنقر فوق صورة | اللون | تقسيم القنوات.
- قم بإنشاء متوسط قناتي النسبة باستخدام حاسبة الصور والنقر فوق العملية | حاسبة الصور. في نافذة الحوار التي تظهر، اضبط العملية على متوسط، واضبط Image1 وImage2 على صورتي البسط والمقام، على التوالي. تحقق من إنشاء نافذة جديدة.
- انقر فوق متوسط الصورة التي تم إنشاؤها أعلاه بالانتقال إلى تحرير | حدد الكل، ثم تحرير | نسخ. ثم ، انقر فوق مكدس HSB ، وحدد الشريحة الثالثة (القيمة) ، وانقر فوق تحرير | لصق لنقل قيم الكثافة.
- قم بتحويل مكدس HSB إلى مساحة ألوان RGB بالنقر فوق صورة | النوع | لون RGB. احفظ الصورة الناتجة.
- لإنتاج صورة ملونة غير معدلة:
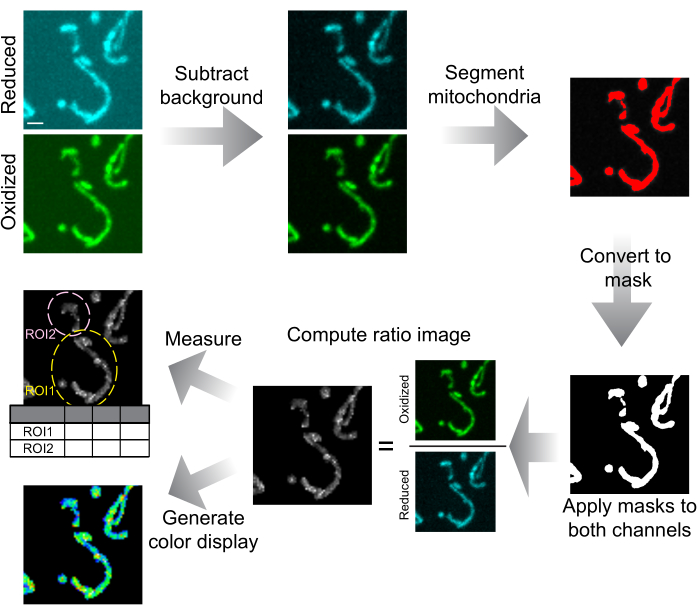
الشكل 6: رسم تخطيطي لتحليل الصور وعرضها. يتم طرح الصور متحدة البؤر للقرص الدوار أولا في الخلفية. يتم تقسيم الميتوكوندريا حسب العتبة وتحويلها إلى أقنعة لكل شريحة. يتم تطبيق هذه الأقنعة على كلتا القناتين ويتم استخدام الصور المقنعة لحساب صورة النسبة. يتم رسم عائد الاستثمار لقياس نسبة mtHyPer7 في الخلايا أو المناطق تحت الخلوية. يمكن أيضا إنشاء صور ذات نسبة ملونة لعرض البيانات. شريط المقياس = 1 ميكرومتر. الاختصار: ROI = منطقة الاهتمام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
للتأكد من أن mtHyPer7 هو مسبار مناسب لتقييم الميتوكوندريا H 2 O2 ،تم تقييم توطين mtHyPer7 وتأثيره على ميتوكوندريا الخميرة وصحة الخلية. لتقييم استهداف mtHyPer7 ، تم تلطيخ الميتوكوندريا بالصبغة الحيوية الخاصة بالميتوكوندريا MitoTracker Red في التحكم في خلايا الخميرة والخميرة التي تعبر عن mtHyPer7. باستخدام تلطيخ MitoTracker Red ، تم حل الميتوكوندريا كهياكل أنبوبية طويلة تتماشى على طول محور البرعم الأم وتتراكم في طرف البرعم وطرف الخلية الأم البعيدة إلى البرعم41. كان مورفولوجيا الميتوكوندريا مشابها في الخلايا الضابطة وخلايا التعبير عن mtHyPer7. بالإضافة إلى ذلك ، شارك mtHyPer7 في المترجمة مع الميتوكوندريا ذات اللون الأحمر MitoTracker (الشكل 3 أ). وهكذا ، تم استهداف mtHyPer7 بكفاءة وكمية للميتوكوندريا دون التأثير على مورفولوجيا الميتوكوندريا الطبيعية أو توزيعها.
بعد ذلك ، تم إجراء تجارب تحقق إضافية لتقييم تأثير mtHyPer7 على اللياقة الخلوية والحساسية للإجهاد التأكسدي في الميتوكوندريا. تتشابه معدلات نمو الخلايا المعبرة عن mtHyPer7 في الوسائط الغنية أو الاصطناعية القائمة على الجلوكوز (YPD أو SC ، على التوالي) مع تلك الموجودة في الخلايا البرية غير المحولة (الشكل 3B ، D). لتقييم الآثار المحتملة على الإجهاد التأكسدي في الميتوكوندريا ، تمت معالجة الخميرة الضابطة و mtHyPer7 بمستويات منخفضة من الباراكوات ، وهو جزيء صغير نشط للأكسدة والاختزال يتراكم في الميتوكوندريا وينتج عنه مستويات مرتفعة من الأكسيد الفائق في العضية24,27. إذا كان تعبير mtHyPer7 إما يحفز الإجهاد التأكسدي في الميتوكوندريا أو يحمي الميتوكوندريا من الإجهاد التأكسدي ، فيجب أن تظهر الخلايا المعبرة عن mtHyPer7 حساسية متزايدة أو منخفضة للعلاج بالباراكوات ، على التوالي. أدى العلاج بمستويات منخفضة من الباراكوات إلى انخفاض معدلات نمو الخميرة. علاوة على ذلك ، كانت معدلات نمو الخلايا من النوع البري والخلايا المعبرة عن mtHyPer7 في وجود الباراكوات متشابهة (الشكل 3C ، E). لذلك ، لم يخلق التعبير عن المستشعر الحيوي ضغوطا خلوية كبيرة في خلايا الخميرة الناشئة أو يغير حساسية الخميرة للإجهاد التأكسدي للميتوكوندريا.
بالنظر إلى الأدلة على أن mtHyPer7 مناسب لدراسة الميتوكوندريا H 2 O 2 في الخميرة الناشئة ، فقد تم اختبار ما إذا كان mtHyPer7 يمكنه اكتشاف الميتوكوندريا H 2 O 2 في مرحلة منتصف السجل الخميرة من النوع البري والتغيرات في الميتوكوندريا H 2 O 2 الناتجة عن H2O 2المضافة خارجيا. تم إجراء تجربةمعايرة H 2 O2 وتم قياس متوسط نسبة الأكسدة المخفضة (O / R) mtHyPer7 في الميتوكوندريا.
أنتجت البرامج النصية للتحليل الآلي العديد من ملفات الإخراج.
صورة النسبة (النسبة.tif): مكدس Z يتكون من نسبة مكدسات 488 نانومتر و 405 نانومتر مصححة في الخلفية. يمكن مشاهدة هذا المكدس في فيجي دون معالجة إضافية ؛ ومع ذلك ، يوصى بتحسين التباين و / أو تلوين الصورة كما هو موضح في البروتوكول الخطوة 4.3 أو 5.6 قبل المشاهدة.
صورة القناع (قناع.tif): مكدس Z يتكون من مناطق الميتوكوندريا العتبة المستخدمة للتحليل. يجب استخدام هذه الصورة لتقييم دقة العتبة.
عائد الاستثمار المستخدم للتحليل (ROIs.zip): عند فتح هذا الملف في فيجي ، جنبا إلى جنب مع الصورة المصدر ، يتم تثبيت عائد الاستثمار على الصورة للإسناد الترافقي لجدول النتائج والصورة المصدر. تتم إعادة تسمية كل عائد استثمار برقم خلية ورقم عائد استثمار.
جداول القياس (NumResults.csv ، DenomResults.csv ، Results.csv) التي تحتوي على المساحة والمتوسط والكثافة المتكاملة للميتوكوندريا العتبة لكل شريحة في صور البسط والمقام والنسبة ، على التوالي. في الشرائح التي كانت فيها الميتوكوندريا غائبة أو خارج نطاق التركيز ، يتم تسجيل NaN.
ملف سجل (Log.txt) يوثق الخيارات المستخدمة لتصحيح الخلفية والضوضاء ، والحد الأدنى ، وحساب النسبة.
أظهرت نسبة O / R ل mtHyPer7 استجابة تعتمد على الجرعة لتركيز H 2 O 2 ، والتي وصلت إلى هضبة عند 1-2 mM مضافة خارجيا H 2 O 2(الشكل 7). والمثير للدهشة أن نسبة HyPer7 كانت أقل في الخلايا المعرضة ل 0.1 mMH2 O2 مقارنة بالخلايا الضابطة ، على الرغم من أن هذا الاختلاف لم يكن ذا دلالة إحصائية. قد يكون أحد التفسيرات لهذه الظاهرة هو استجابة الهرمون ، حيث قد يؤدي التعرض لمستوى منخفض من الإجهاد إلى استجابات الإجهاد ، مثل آليات مضادات الأكسدة ، والتي بدورها تقلل من كمية أنواع الأكسجين التفاعلية التي يمكن اكتشافها بواسطة المسبار. في المقابل ، قد تطغى المستويات الأعلى من الضغوطات على استجابات الإجهاد الداخلية وتؤدي إلى قراءة أعلى من HyPer7.
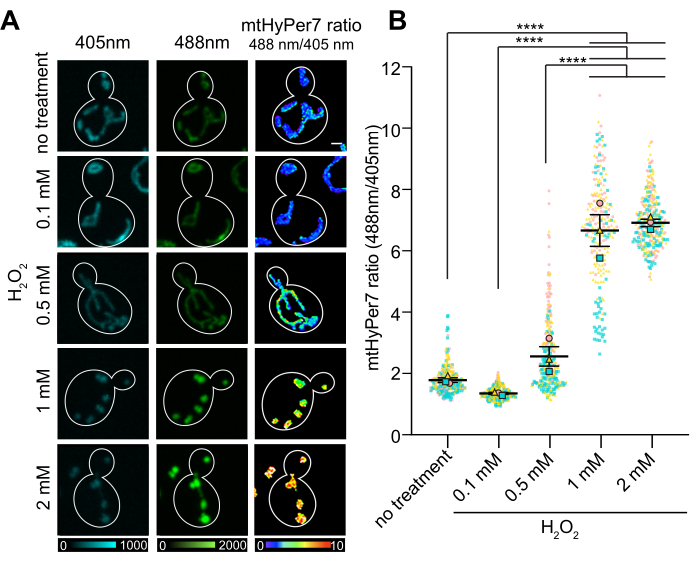
الشكل 7: استجابة mtHyPer7 ل H 2 O 2 المضافة خارجيا. (أ) أقصى إسقاط للصور المثارة 405 نانومتر و 488 نانومتر وإسقاط متوسط الكثافة للصور التناسبية ل mtHyPer7 في خلايا الطور متوسط اللوغاريتم المعرضة لتركيزات مختلفة من H 2 O2. يشير اللون الكاذب إلى نسبة mtHyPer7 المؤكسدة: المخفضة (مقياس في الأسفل). شريط المقياس = 1 ميكرومتر. يظهر مخطط الخلية باللون الأبيض ؛ ن > 100 خلية لكل حالة. (ب) القياس الكمي ل mtHyPer7 المؤكسد: نسبة مخفضة في خلايا الخميرة الناشئة المعالجة بتركيزات مختلفة من H 2 O2. يتم عرض وسائل خمس محاكمات مستقلة ، مع رموز مختلفة الشكل والألوان لكل محاكمة. متوسط ± SEM لنسبة المؤكسد: انخفاض mtHyPer7: 1.794 ± 0.07627 (بدون علاج) ، 1.357 ± 0.03295 (0.1 مللي مول) ، 2.571 ± 0.3186 (0.5 مللي مول) ، 6.693 ± 0.5194 (1 مللي مول) ، 7.017 ± 0.1197 (2 مللي مول). p < 0.0001 (ANOVA أحادي الاتجاه مع اختبار مقارنات Tukey المتعددة). يشار إلى قيم p على النحو التالي: ****p < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أخيرا ، كشفت الدراسات السابقة أن الميتوكوندريا الأكثر لياقة ، والتي يتم اختزالها بشكل أكبر وتحتوي على كمية أقل من الأكسيد الفائق ، يتم توريثها بشكل تفضيلي بواسطة خلايا ابنة الخميرة4 ، وأن المحفزات الخلوية يتم نقلها وتنشيطها في خلايا ابنة الخميرة42،43،44،45. توثق هذه الدراسات الوراثة غير المتماثلة للميتوكوندريا أثناء انقسام خلايا الخميرة ودور هذه العملية في لياقة الخلايا الابنة وعمرها ، وكذلك عدم تناسق عمر الأم وابنتها. لاختبار ما إذا كانت هناك اختلافات فيH 2 O2 بين الأمهات والبراعم ، تم قياس mtHyPer7 في البراعم والخلايا الأم. لوحظت اختلافات في الميتوكوندريا H 2 O 2 داخل خلايا الخميرة ، وتم اكتشاف انخفاض طفيف ولكن ذو دلالة إحصائية في قراءات المستشعر الحيوي H 2 O 2في الميتوكوندريا في مهدها مقارنة بتلك الموجودة في الخلية الأم (الشكل 8). تتوافق هذه النتائج مع النتائج السابقة التي تفيد بأن الميتوكوندريا في مهدها محمية بشكل أفضل من الإجهاد التأكسدي. كما أنها توفر وثائق تفيد بأن mtHyPer7 يمكن أن يوفر قراءة كمية للميتوكوندريا H 2 O2مع دقة خلوية ودون خلوية في الخميرة الناشئة.
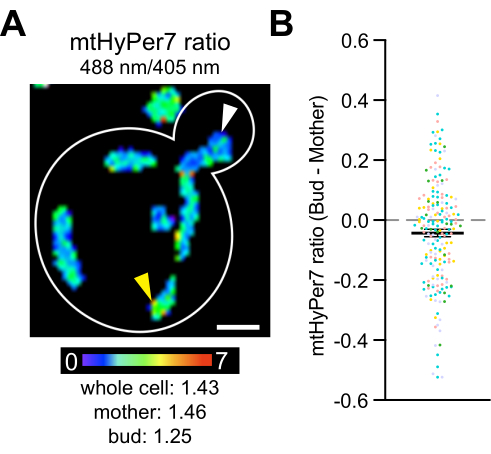
الشكل 8: مستوى الميتوكوندريا H 2 O2أقل في الخلية البنوية. (A) الحد الأقصى لإسقاط صورة قياس النسبة ل mtHyPer7 في خلية تمثيلية. يشير اللون الكاذب إلى نسبة mtHyPer7 المؤكسدة: المخفضة (مقياس في الأسفل). الاختلافات تحت الخلوية في النسبة واضحة (رؤوس الأسهم). شريط المقياس = 1 ميكرومتر. مخطط الخلية: أبيض. ب: الفرق بين نسبة mtHyPer7 في البرعم والخلية الأم. لكل خلية على حدة ، تم طرح قيمة نسبة الأم من قيمة نسبة البراعم ورسمها كنقطة. n = 193 خلية مجمعة من خمس تجارب مستقلة ، معروضة برموز ملونة مختلفة لكل تجربة. متوسط ± SEM للفرق بين نسبة mtHyPer7 في البراعم والخلايا الأم: -0.04297 ± 0.01266. p = 0.0008 (اختبار t المقترن) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي S1: السلالات المستخدمة في هذه الدراسة. قائمة سلالات الخميرة المستخدمة. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي S2: البلازميدات المستخدمة في هذه الدراسة. قائمة البلازميدات المستخدمة. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي S3: الاشعال المستخدمة في هذه الدراسة. قائمة الاشعال المستخدمة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: بروتوكول لبناء البلازميد المستشعر الحيوي. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: البرامج النصية للتحليل الآلي. لكل برنامج نصي، يتم توفير ملفات إدخال نموذجية وملفات إخراج. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
في هذا البروتوكول ، يتم وصف طريقة لاستخدام mtHyPer7 كمستشعر حيوي لتقييم الميتوكوندريا H 2 O2في خلايا الخميرة الناشئة الحية. يتم إنشاء المستشعر الحيوي باستخدام طريقة قائمة على كريسبر ويتم إدخاله في منطقة خالية من الجينات المحفوظة في جينوم الخميرة دون استخدام علامات قابلة للاختيار. بالمقارنة مع أجهزة الاستشعار الحيوية المحمولة بالبلازميد ، يتم التعبير عن المستشعرات المتكاملة في جميع الخلايا وبمستويات متسقة ، مما يوفر نتائج تقدير كمي أكثر موثوقية. لا يتم استخدام علامات قابلة للاختيار لتوليد خلايا تعبر عن mtHyPer7 ، مما يسمح باستخدام مجموعة واسعة من خلفيات الإجهاد ويسهل التعديل الجيني للخلايا المعبرة عن أجهزة الاستشعار الحيوية. يستهدف بروتين mtHyPer7 بشكل صحيح الميتوكوندريا دون تأثيرات ملحوظة على مورفولوجيا الميتوكوندريا أو وظيفتها أو توزيعها أو معدلات نموها الخلوي. يظهر mtHyPer7 استجابة تعتمد على الجرعة ل H2O2 المضافة خارجيا. علاوة على ذلك ، فإن mtHyPer7 قادر على الإبلاغ عن عدم تجانس جودة الميتوكوندريا بدقة تحت الخلية. أخيرا ، يؤدي استخدام مجهر متحد البؤر للقرص الدوار بدلا من الفحص المجهري واسع المجال لتصوير المستشعرات الحيوية المستهدفة للميتوكوندريا إلى تقليل التبييض الضوئي للفلوروفورات ويولد صورا عالية الدقة لتحليل الاختلافات تحت الخلوية.
القيود والنهج البديلة
هذه الطريقة غير مناسبة لتصوير الخلايا لأكثر من 10 دقائق ، حيث ستجف الخلايا تحت غطاء الغطاء. للتصوير على المدى الطويل ، من الأفضل استخدام طريقة وسادة أجار46 أو لشل حركة الخلايا في طبق ثقافة ذو قاع زجاجي مملوء بوسط SC.
يجب أن يسترشد اختيار المستشعر الحيوي بتركيز الهدف في ظل الظروف التجريبية. إذا كانت حساسية HyPer7 عالية جدا ، فيوصى بإصدار HyPer مختلف ، مثل HyPer3 أو HyPerRed47,48. ومع ذلك ، تجدر الإشارة إلى أن مجسات HyPer الأخرى أكثر حساسية لدرجة الحموضة. بالنسبة للحساسية العالية ، قد يكون roGFP القائم على البيروكسيريدوكسين أكثر ملاءمة (roGFP2Tsa2ΔCR)27.
ترتبط الحالة المستقرة للأكسدة لمستشعر H 2O2 بكل من معدلات الأكسدة والاختزال. يحدث معدل أكسدة المستشعرات الحيوية بشكل أساسي بسبب H 2O2 ، لكن معدل التخفيض يعتمد على أنظمة الحد من مضادات الأكسدة النشطة في الخلية والعضيات. لقد ثبت أن HyPer7 يتم تقليله في الغالب بواسطة نظام thioredoxin في سيتوسول الخميرة ، ويكون تخفيضه أسرع من roGFP2Tsa2ΔCR27. لذلك ، يجب أن تؤخذ آليات الاختزال المختلفة وديناميكيات الاستجابة للمسبار في الاعتبار عند تفسير قياسات أجهزة الاستشعارالحيوية H 2 O2. على وجه الخصوص ، لاستنتاج مستويات H2 O2 من قراءات المستشعر الحيوي ، يجب افتراض أن نظام الاختزال يحافظ على قدرة ثابتة أثناء التجربة. كبديل للنصوص الموصوفة هنا ، تم توفير مجموعة متنوعة من البرامج الأخرى مجانا لتحليل مستشعرات الأكسدةوالاختزال 49.
خطوات حاسمة
مع أي مستشعر حيوي ، من الأهمية بمكان إثبات أن المستشعر الحيوي نفسه لا يؤثر على العملية التي يتم قياسها. لذلك ، من المهم مقارنة النمو ومورفولوجيا الميتوكوندريا للسلالات تحت كل حالة تجريبية. هنا ، يتم تقييم مورفولوجيا الميتوكوندريا باستخدام MitoTracker Red ، الذي يلطخ الميتوكوندريا بطريقة تعتمد على إمكانات الغشاء. ومع ذلك ، يمكن إجراء مقارنة للميتوكوندريا في الخلايا غير المحولة والمحولة بواسطة أجهزة الاستشعار الحيوية عن طريق تلطيخ إستر ميثيل رباعي ميثيل رودامين (TMRM) ، وهو صبغة حيوية بديلة للميتوكوندريا مستشعرة للغشاء ، أو MitoTracker Green ، الذي يلطخ الميتوكوندريا بشكل مستقل عن إمكانات الغشاء. في حالة الاشتباه في وجود تأثيرات ضارة ، قد يساعد تقليل مستوى التعبير أو تغيير موقع التكامل.
يعد التحقق من صحة سلوك استجابة الجرعة للمسبار ونسبة الإشارة إلى الضوضاء لتقنية التصوير أمرا ضروريا أيضا لجمع نتائج قوية. إذا تجاوز التباين داخل المجموعة التباين بين المجموعات ، يصبح من الصعب اكتشاف الاختلافات. قد ينتج التباين داخل المجموعة عن التباين الحقيقي في السكان ، أو عن الضوضاء في عملية الكشف. الخطوات الرئيسية لزيادة نسبة الإشارة: الضوضاء هي الحصول على الصورة (نطاق قيمة البكسل والضوضاء) ، وطرح الخلفية ، والعتبة.
يمكن أيضا تقليل تأثيرات الضوضاء أثناء خطوات الحساب. الطريقة الأكثر مباشرة هي حساب متوسط الكثافة المرجح من قياسات صورة النسبة (النتائج .csv) ، حيث يمثل كل بكسل النسبة المحلية بين كفاءات الإثارة. ينتج عن هذا نسبة "بكسل". ومع ذلك ، إذا كانت نسبة إشارة الصورة: الضوضاء منخفضة ، فيمكن الحصول على نتائج أكثر قوة عن طريق حساب متوسط الكثافة المرجح لعائد الاستثمار في كل من قناتي البسط والمقام ، ثم حساب النسبة بين هذين المتوسطين المرجحين (نسبة "المنطقة").
لتحديد طريقة الحد الأدنى، الأمر فيجي صورة | ضبط | يمكن استخدام Auto Threshold لتجربة جميع طرق فيجي المضمنة تلقائيا. لتقييم التجزئة (العتبة) ، يتم تحويل القناع المحفوظ إلى تحديد بالنقر فوق تحرير | الاختيار | قم بإنشاء تحديد ، وإضافته إلى مدير عائد الاستثمار (بالضغط على T) ، ثم تنشيطه في ملف الصورة الأولية. إذا لم يتم اكتشاف الميتوكوندريا بشكل كاف ، فيجب محاولة طريقة تجزئة مختلفة.
عند مقارنة الصور ، من الضروري الحصول على جميع الصور بظروف تصوير متطابقة ، وكذلك عرض جميع الصور مع تحسين التباين المتطابق.
يجب مراعاة حركة الميتوكوندريا عند تحسين ظروف التصوير. إذا تحركت الميتوكوندريا بشكل كبير بين الإثارة عند 405 و 488 نانومتر ، فلن تكون صورة النسبة دقيقة. يوصى بالحفاظ على وقت التعرض <500 مللي ثانية وتغيير الإثارة بأسرع طريقة متاحة (مثل نبضة الزناد أو مرشح قابل للضبط الصوتي البصري). عند التقاط مكدس Z ، يجب إجراء كلا الإثارتين لكل خطوة Z قبل الانتقال إلى الخطوة Z التالية.
لعرض النتائج ، تكون التغييرات في اللون (اللون) أكثر وضوحا للعين البشرية من التغيرات في الشدة. لذلك، يتم تحويل قيمة النسبة إلى مقياس لون لتسهيل التفسير المرئي. يمكن أن تكون الصور الملونة غير معدلة ، حيث تظهر جميع وحدات بكسل الميتوكوندريا بنفس السطوع ، أو معدلة الكثافة ، حيث يتم استخدام كثافة البكسل في الصورة الأصلية لتعيين الشدة في الصورة الملونة.
التعديل واستكشاف الأخطاء وإصلاحها
كبديل لتأكيد وظيفة الميتوكوندريا عن طريق التحدي مع الباراكوات ، قد تكون الخلايا مطلية بنسخة طبق الأصل أو تلقيحها في مصادر كربون قابلة للتخمير وغير قابلة للتخمير.
لطرح الخلفية ، طرح الكرة المتداول (بالانتقال إلى العملية | طرح الخلفية...) يمكن استخدامه أيضا لإزالة عدم انتظام الإضاءة. يجب التأكد من أن وجود الخلايا لا يغير الخلفية التي يتم طرحها (عن طريق تحديد خيار إنشاء خلفية وفحص النتيجة).
باختصار ، يوفر مسبار mtHyPer7 طريقة متسقة وطفيفة التوغل لربط الحالة المورفولوجية والوظيفية لميتوكوندريا الخميرة في الخلايا الحية ، ويسمح بدراسة الإجهاد الخلوي المهم وجزيء الإشارات في نظام نموذجي قابل للتتبع وراثيا ويمكن الوصول إليه بسهولة.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
يشكر المؤلفون كاثرين فيلبو لوبيز على المساعدة التقنية المتخصصة. تم دعم هذا العمل بمنح من المعاهد الوطنية للصحة (NIH) (GM122589 و AG051047) إلى LP.
استخدمت هذه الدراسات المورد المشترك للفحص المجهري البؤري والمتخصص لمركز هربرت إيرفينغ الشامل للسرطان في جامعة كولومبيا ، والذي تم تمويله جزئيا من خلال منحة دعم مركز السرطان NIH / NCI P30CA013696.
Materials
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | A9126 | |
| Bacto Agar | BD Difco | DF0145170 | |
| Bacto Peptone | BD Difco | DF0118170 | |
| Bacto Tryptone | BD Difco | DF211705 | |
| Bacto Yeast Extract | BD Difco | DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | H5659 | |
| L-leucine | Sigma-Aldrich | L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | L8662 | |
| L-methionine | Sigma-Aldrich | M9625 | |
| L-phenylalanine | Sigma-Aldrich | P5482 | |
| L-tryptophan | Sigma-Aldrich | T8941 | |
| L-tyrosine | Sigma-Aldrich | T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. 856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
References
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved