Method Article
Bildgebung von mtHyPer7, einem ratiometrischen Biosensor für mitochondriales Peroxid, in lebenden Hefezellen
In diesem Artikel
Zusammenfassung
Wasserstoffperoxid (H2O2) ist sowohl eine Quelle oxidativer Schäden als auch ein Signalmolekül. Dieses Protokoll beschreibt, wie mitochondrialesH2O2mit Hilfe von HyPer7 (mtHyPer7), einem genetisch kodierten ratiometrischen Biosensor, in lebender Hefe gemessen werden kann. Es wird beschrieben, wie die Bildgebungsbedingungen optimiert und quantitative zelluläre und subzelluläre Analysen mit frei verfügbarer Software durchgeführt werden können.
Zusammenfassung
Mitochondriale Dysfunktion oder funktionelle Veränderung tritt bei vielen Krankheiten und Zuständen auf, darunter neurodegenerative und muskuloskelettale Erkrankungen, Krebs und normales Altern. Hier wird ein Ansatz beschrieben, um die mitochondriale Funktion in lebenden Hefezellen mit zellulärer und subzellulärer Auflösung mit Hilfe eines genetisch kodierten, minimalinvasiven, ratiometrischen Biosensors zu untersuchen. Der Biosensor, der auf Mitochondrien abzielende HyPer7 (mtHyPer7), weist Wasserstoffperoxid (H2O2) in Mitochondrien nach. Es besteht aus einer mitochondrialen Signalsequenz, die mit einem zirkulär permutierten fluoreszierenden Protein fusioniert ist, und derH2O2-responsivenDomäne eines bakteriellen OxyR-Proteins. Der Biosensor wird mit einem CRISPR-Cas9-markerfreien System generiert und in das Hefegenom integriert, um eine konsistentere Expression im Vergleich zu plasmidgetragenen Konstrukten zu erreichen.
mtHyPer7 ist quantitativ auf Mitochondrien ausgerichtet, hat keinen nachweisbaren Einfluss auf die Hefewachstumsrate oder die mitochondriale Morphologie und liefert einen quantitativen Messwert für mitochondrialesH2O2unter normalen Wachstumsbedingungen und bei Exposition gegenüber oxidativem Stress. In diesem Protokoll wird erläutert, wie die Bildgebungsbedingungen mit einem konfokalen Spinning-Disk-Mikroskopsystem optimiert und quantitative Analysen mit frei verfügbarer Software durchgeführt werden können. Diese Werkzeuge ermöglichen es, umfangreiche raumzeitliche Informationen über Mitochondrien sowohl innerhalb von Zellen als auch zwischen Zellen in einer Population zu sammeln. Darüber hinaus kann der hier beschriebene Arbeitsablauf zur Validierung anderer Biosensoren verwendet werden.
Einleitung
Mitochondrien sind essentielle eukaryotische Zellorganellen, die für ihre Funktion bei der Produktion von ATP durch oxidative Phosphorylierung und Elektronentransport bekannt sind1. Darüber hinaus sind Mitochondrien Orte für die Kalziumspeicherung, die Synthese von Lipiden, Aminosäuren, Fettsäure- und Eisen-Schwefel-Clustern sowie die Signaltransduktion 2,3. Innerhalb von Zellen bilden Mitochondrien ein dynamisches Netzwerk mit charakteristischer Morphologie und Verteilung, die je nach Zelltyp und Stoffwechselzustand variiert. Obwohl Mitochondrien fusionieren und sich teilen können, sind nicht alle Mitochondrien in einer Zelle gleichwertig. Zahlreiche Studien haben die funktionelle Heterogenität von Mitochondrien innerhalb einzelner Zellen in Attributen wie Membranpotenzial und oxidativem Zustand dokumentiert 4,5,6. Diese Variation der mitochondrialen Funktion ist zum Teil auf eine Schädigung der Organelle durch mtDNA-Mutationen (die mit einer höheren Rate als in der Kern-DNA auftreten) und auf oxidative Schäden durch reaktive Sauerstoffspezies (ROS) zurückzuführen, die sowohl innerhalb als auch außerhalb der Organelle erzeugt werden 7,8,9. Die Schädigung der Organelle wird durch mitochondriale Qualitätskontrollmechanismen gemildert, die den Schaden reparieren oder unreparabel geschädigte Mitochondrien eliminieren10.
Wasserstoffperoxid (H2O2) ist eine reaktive Sauerstoffspezies, die eine Quelle oxidativer Schäden an zellulären Proteinen, Nukleinsäuren und Lipiden ist. H2O2dient jedoch auch als Signalmolekül, das zelluläre Aktivitäten durch die reversible Oxidation von Thiolen in Zielproteinenreguliert 11,12. H2O2 wird aus Elektronen hergestellt, die aus der mitochondrialen Elektronentransportkette austreten, und von spezifischen Enzymen wie der NADPH-Oxidase und den Monoaminoxidasen 13,14,15,16,17,18,19,20. Es wird auch durch antioxidative Systeme inaktiviert, einschließlich solcher, die auf Thioredoxin und Glutathion basieren21,22,23. Daher ist die Analyse der mitochondrialenH2O2-Spiegelvon entscheidender Bedeutung, um die Rolle dieses Metaboliten bei der normalen mitochondrialen und zellulären Funktion und unter Bedingungen von oxidativem Stress zu verstehen.
Das übergeordnete Ziel dieses Protokolls ist der Nachweis von mitochondrialemH2O2 mit einem genetisch kodierten ratiometrischenH2O2-Biosensor, HyPer7, der auf die Organelle (mtHyPer7) ausgerichtet ist. mtHyPer7 ist eine Chimäre, die aus der mitochondrialen Signalsequenz von ATP9 (der Su9-Vorsequenz), einer zirkulär permutierten Form des grün fluoreszierenden Proteins (GFP) und der H2O2-Bindungsdomäne des OxyR-Proteins aus Neisseria meningitidis24 besteht (Abbildung 1). In zirkulär permutiertem GFP werden die N- und C-Termini von nativem GFP fusioniert und neue Termini in der Nähe des Chromophors gebildet, die dem Protein eine größere Mobilität und eine größere Labilität seiner spektralen Eigenschaften im Vergleich zu nativem GFP25 verleihen. Die Wechselwirkung der OxyR-Domäne von mtHyPer7 mit H2O2 ist hochaffin, H2O2-selektivund führt zu einer reversiblen Oxidation der konservierten Cysteinreste und zur Bildung von Disulfidbrücken. Konformationsänderungen, die mit der Oxidation von OxyR assoziiert sind, werden auf das zirkulär permutierte GFP in mtHyPer7 übertragen, was zu einer spektralen Verschiebung des Anregungsmaximums des mtHyPer7-Chromophors von 405 nm im reduzierten Zustand auf 488 nm im H2O2-oxidierten Zustandführt 26. Somit spiegelt das Verhältnis der Fluoreszenz von mtHyPer7 als Reaktion auf die Anregung bei 488 nm gegenüber 405 nm die Oxidation der Sonde durchH2O2wider.
Im Idealfall sollte ein Biosensor eine absolute, quantitative Echtzeit-Ablesung seines Zielmoleküls liefern. Leider ist dies bei realen Messungen jedoch nicht immer möglich. Bei Oxidationssensoren, wie z. B. mtHyPer7, wird die Echtzeitanzeige durch die Reduktionsrate der Disulfidbrücke beeinflusst. Die von ROS-Biosensoren verwendeten Reduktionssysteme unterscheiden sich, und diese können die Dynamik der Sondenantwort dramatisch verändern - wie der Vergleich von HyPer7, das durch das Thioredoxin-System reduziert wurde, und roGFP2-Tsa2ΔCR, reduziert durch Glutathion in Hefezytosol27, zeigte. Um also aus den mtHyPer7-Verhältnisseneinen Rückschluss auf die relative H2O2-Konzentration zu ziehen, muss man davon ausgehen, dass das Reduktionssystem während des Experiments eine konstante Kapazität beibehält. Ungeachtet dieser Überlegungen wurden HyPer7 und verwandte Sonden in verschiedenen Zusammenhängen verwendet, um Informationen überH2O2in lebenden Zellen zu erhalten 25,28,29.
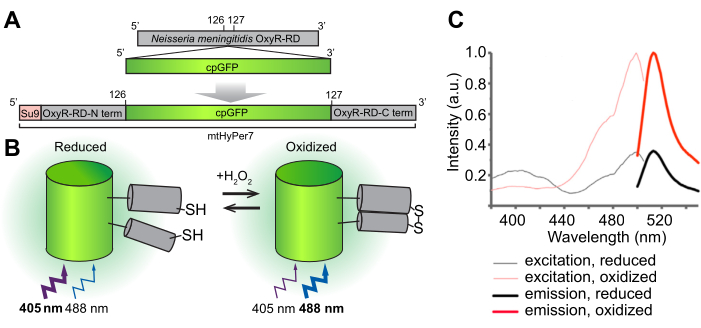
Abbildung 1: Design, molekularer Mechanismus und Anregungs-/Emissionsspektren des H2O2-Biosensors mtHyPer7. (A) Die mtHyPer7-Sonde wird durch Insertion von zirkulär permutiertem GFP in die OxyR-RD-Domäne von Neisseria meningitidis abgeleitet. Es enthält die mitochondriale Targeting-Sequenz aus der Untereinheit 9 der ATP-Synthase aus Neurospora crassa (Su9). (B) Illustration des H2O2-Sensormechanismus von mtHyPer7. Die Oxidation von Cysteinen in der RD-Domäne erhöht die Fluoreszenzemission bei Anregung bei 488 nm und verringert die durch Anregung bei 405 nm erzeugte Emission. (C) Anregungs- und Emissionsspektren von HyPer7 in oxidierter und reduzierter Form. Diese Abbildung wurde mit freundlicher Genehmigung von Pak et al.24 abgedruckt. Abkürzungen: GFP = grün fluoreszierendes Protein; cpGFP = zirkulär permutiertes GFP. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diese ratiometrische Bildgebung von mtHyPer7 bietet wichtige Vorteile für die mitochondriale H2O2-Quantifizierung24,27; Es bietet eine interne Kontrolle für die Sondenkonzentration. Darüber hinaus ist die Verschiebung des Anregungspeaks, die durch dieH2O2-Expositionhervorgerufen wird, nicht vollständig, selbst bei Sättigungskonzentrationen vonH2O2. So kann das Ratio-Imaging die Empfindlichkeit erhöhen, indem zwei Spektralpunkte in die Analyse einbezogen werden.
Die hier verwendete mtHyPer7-Sonde hat eine sehr hohe Affinität zuH2O2und eine relativ geringe Empfindlichkeit gegenüber pH24 und wurde erfolgreich auf Caenorhabditis elegans-Mitochondrien 30 ausgerichtet. Dieses Protein wurde auch in Hefeverwendet 27,31. Frühere Studien stützten sich jedoch auf die plasmidgetragene Expression von mtHyPer7, was zu einer Variabilität der Sondenexpression von Zelle zu Zelle führt27. Darüber hinaus wurde das in diesem Protokoll beschriebene Konstrukt mit Hilfe eines CRISPR-basierten Ansatzes zur markerfreien Integration in eine konservierte, genfreie Region auf Chromosom X32 integriert. Die Expression des integrierten Biosensor-Gens wird ebenfalls durch den starken konstitutiven TEF1-Promotor gesteuert (Abbildung 2). Infolgedessen gibt es eine stabilere, konsistentere Expression des Biosensors in Hefezellpopulationen als bei der Plasmid-basierten Biosensorexpression, und Zellen, die den Biosensor tragen, können ohne die Notwendigkeit selektiver Medien vermehrt werden.
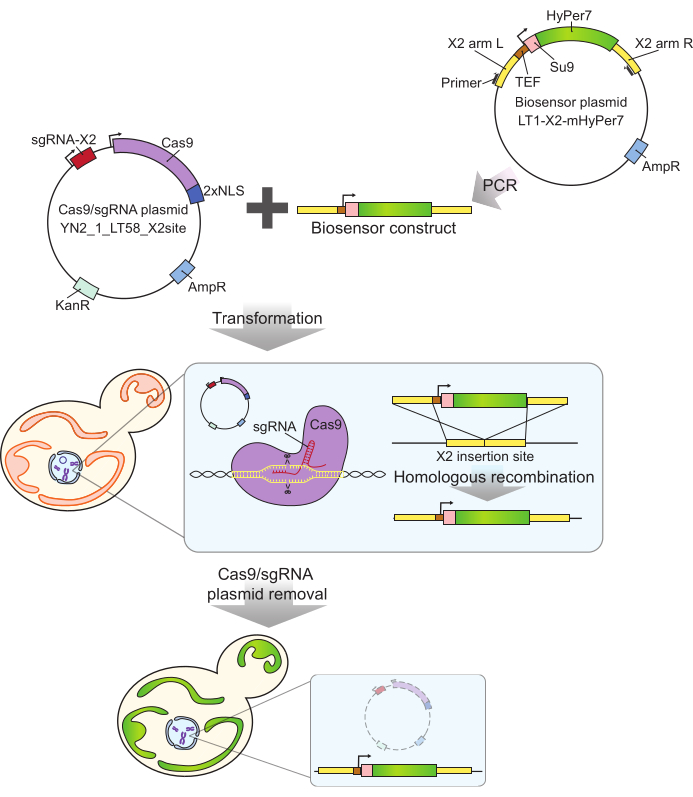
Abbildung 2: Generierung von mtHyPer7-exprimierenden Zellen mittels CRISPR. Das Cas9- und sgRNA-haltige Plasmid (YN2_1_LT58_X2site) und PCR-amplifizierte mtHyPer7-haltige Biosensorkonstrukt wird durch Lithiumacetat-Transformation in knospende Hefezellen eingebracht. Die genfreie Insertionsstelle auf Chromosom X (X2) wird vom Cas9-Protein mit der sgRNA erkannt und geschnitten, und der Biosensor wird durch homologe Rekombination in das Genom integriert. Nach der Identifizierung der erfolgreichen Transformanten durch mikroskopisches Screening, Kolonie-PCR und Sequenzierung wird das Cas9-Plasmid durch Wachstum in nicht-selektiven Medien entfernt (ausgehärtet). Abkürzungen: sgRNA = Single guide RNA; TEF = Transkriptionsverstärker-Faktor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Schließlich bietet mtHyPer7 Vorteile gegenüber anderen ROS-Biosensoren. Beispielsweise können organische Farbstoffe, die zum Nachweis von ROS verwendet werden (z. B. Dihydroethidium [DHE]2 und MitoSOX3), eine ungleichmäßige oder unspezifische Färbung verursachen und werden häufig in Lösungsmitteln wie Ethanol oder Dimethylsulfoxid geliefert, die zusätzliche Kontrollen für Lösungsmitteleffekte erfordern. Eine weitere Klasse von ROS-Biosensoren sind Biosensoren auf Basis von Fluoreszenz-Resonanz-Energietransfer (FRET) (z. B. Redoxfluor für den zellulären Redoxzustand4 und die Peroxidsensoren HSP-FRET5, OxyFRET 6 und PerFRET6). Diese Sonden sind genetisch kodiert und prinzipiell hochempfindlich und können mit Hilfe gut charakterisierter mitochondrialer Signalsequenzen quantitativ auf Mitochondrien ausgerichtet werden. Es gibt jedoch Herausforderungen bei der Verwendung von FRET-basierten Sonden, einschließlich des Hintergrunds aufgrund von Kreuzanregung und Durchblutung sowie strenger Anforderungen an die Nähe und Ausrichtung der Fluorophore, damit FRET auftretenkann 33,34. Darüber hinaus bestehen FRET-Sonden aus zwei fluoreszierenden Proteinen, die im Vergleich zu spektrenverschiebenden Sonden größere Konstrukte für die Expression in den interessierenden Zellen benötigen. Das hier beschriebene Protokoll wurde entwickelt, um die Stärken des HyPer7-basierten Biosensors zu nutzen und diese kompakte, ratiometrische, hochaffine, genetisch kodierte Sonde für die quantitative Bildgebung von Peroxid in Mitochondrien in lebender Hefe zu verwenden.
Protokoll
1. Generierung des Biosensor-Plasmids, Integration in das Hefegenom und Bewertung des Targetings von mtHyPer7 auf Mitochondrien und Auswirkungen auf die mitochondriale Morphologie, die zellulären Wachstumsraten oder die Empfindlichkeit gegenüber oxidativem Stress
HINWEIS: Siehe Ergänzungsdatei 1, Ergänzungstabelle S1, Ergänzungstabelle S2 und Ergänzungstabelle S3 für die Konstruktion von Biosensor-Plasmiden, Stämmen, Plasmiden bzw. Primern, die für die Konstruktion und Charakterisierung von Biosensoren verwendet werden. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien, Reagenzien und Instrumenten, die in diesem Protokoll verwendet werden.
- Amplifikation des Biosensor-Konstrukts aus dem Biosensor-Plasmid mit den Primern Y290 und Y291 (Abbildung 2) mittels Polymerase-Kettenreaktion (PCR).
- Mischen Sie 500 ng des Cas9/guide-RNA-Plasmids (YN2_1_LT58_X2site32) mit 50 μl des PCR-Produkts aus Schritt 1.1 (Biosensor-Konstrukt). Wandeln Sie das Gemisch mit der Lithiumacetatmethode35 in knospende Hefe um und wählen Sie Transformanten auf YPD-Platten mit 200 mg/ml G418 aus.
- Screening von Kandidatentransformanten durch PCR-Amplifikation genomischer DNA unter Verwendung der Primer Y292 und Y293. Bei Transformanten mit einem Insert der erwarteten Größe (positiv: 3,5 kb; negativ: 0,3 kb) ist der eingefügte Bereich zur weiteren Validierung zu sequenzieren.
- Bewerten Sie die Wirkung des Biosensors auf das Wachstum und die mitochondriale Funktion (Abbildung 3). Wenn der Biosensor die Funktion von Zellen oder Mitochondrien zu beeinträchtigen scheint, versuchen Sie, den Effekt zu minimieren, indem Sie den Promotor, die Integrationsstelle oder den Elternstamm ändern.
- Bestimmen Sie die Wirkung des Biosensorkonstrukts auf die Wachstumsrate in Gegenwart und Abwesenheit eines oxidativen Stressors (z. B. Paraquat), wie zuvorbeschrieben 36.
- Verdünnen Sie Zellen der mittleren logarithmischen Phase auf eine optische Dichte von 600 nm (OD 600) von 0,0035 in200 μl entsprechender Medien mit und ohne Behandlung in jede Vertiefung einer 96-Well-Platte mit flachem Boden. Messen Sie die optische Dichte der Kultur alle 20 Minuten für 72 Stunden mit einem Plattenleser. Berechnen Sie die maximale Wachstumsrate (Steigung) als maximale Änderung der OD über ein Intervall von 240 Minuten während des 72-Stunden-Kurses.
- Visualisieren Sie die Zellen durch Fluoreszenzmikroskopie und bewerten Sie die Helligkeit und die mitochondriale Morphologie, wie zuvor beschrieben37.
- Lassen Sie die Zellen bis zur mittleren logarithmischen Phase wachsen, färben Sie die Mitochondrien 30 Minuten lang mit 250 nM MitoTracker Red und waschen Sie sie vor der Bildgebung zweimal. Erfassen Sie Z-Stapel mit einer Tiefe von 6 μm in Intervallen von 0,3 μm auf einem Weitfeld- oder konfokalen Fluoreszenzmikroskop und prüfen Sie sie visuell. Achten Sie auf Mitochondrien, die längliche röhrenförmige Strukturen bilden.
- Bestimmen Sie die Wirkung des Biosensorkonstrukts auf die Wachstumsrate in Gegenwart und Abwesenheit eines oxidativen Stressors (z. B. Paraquat), wie zuvorbeschrieben 36.
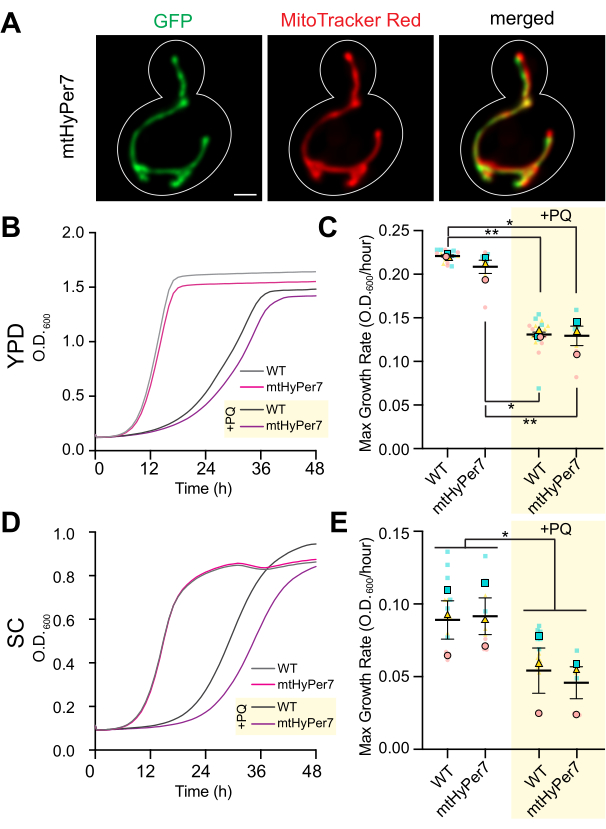
Abbildung 3: mtHyPer7 ist auf Mitochondrien ausgerichtet und hat keinen Einfluss auf die mitochondriale Morphologie, das Zellwachstum oder die Empfindlichkeit gegenüber oxidativem Stress. (A) Mitochondriale Morphologie in lebenden Hefezellen, die mtHyPer7 exprimieren. Linkes Bild: mtHyPer7 visualisiert mit 488 nm Anregung. Mittleres Bild: Mitochondrien, markiert mit 250 nM MitoTracker Red. Rechtes Feld: zusammengeführte Bilder. Es werden Projektionen mit maximaler Intensität gezeigt. Der Zellenumriss wird weiß dargestellt. Maßstabsbalken = 1 μm. (B,C) Wachstumskurven und maximale Wachstumsrate von Wildtyp-Zellen und Zellen, die mtHyPer7 exprimieren, die in Gegenwart (+PQ) oder Abwesenheit von 2,5 mM Paraquat in YPD-Medien gezüchtet wurden. (D,E) Wachstumskurven und maximale Wachstumsrate von Wildtyp- und mtHyPer7-exprimierenden Zellen, die in Gegenwart (+PQ) oder Abwesenheit von 2,5 mM Paraquat in SC-Medien gezüchtet wurden. Alle Wachstumskurven sind die Mittelwerte von drei unabhängigen Replikationen. Die maximalen Wachstumsraten werden als Mittelwert ± Standardfehler des Mittelwerts (SEM) dargestellt. Die Analyse der Wachstumskurve erfolgte durch Verdünnung von Zellen in der mittleren logarithmischen Phase auf einen OD 600 von 0,0035 in200 μl entsprechendem Medium in jeder Vertiefung einer 96-Well-Platte mit flachem Boden. Der OD der Kultur wurde alle 20 min für 72 h mit einem Plattenleser gemessen. Jeder Stamm/Zustand wurde dreifach plattiert und die durchschnittliche Wachstumsrate wurde aufgetragen. Die maximale Wachstumsrate (Steigung) wurde anhand der OD-Änderungen über ein 240-min-Intervall über einen Zeitraum von 72 h berechnet. Abkürzungen: WT = Wildtyp; PQ = paraquat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Zellkultur und Vorbereitung für die Bildgebung (Abbildung 4)
- Vermehren Sie die Zellen in synthetischem Medium zur Bildgebung in die mittlere logarithmische Phase. Eine 5-ml-Kultur in der mittleren logarithmischen Phase liefert genügend Zellen für vier oder fünf Objektträger und insgesamt >100 knospenförmige Zellen für die Analyse.
- Am Morgen des Tages vor dem Experiment werden flüssige Vorkulturen vorbereitet, indem 5 ml synthetisches vollständiges (SC) Medium in ein 50-ml-Röhrchen mit konischem Boden mit einer einzigen Kolonie von Hefezellen inokuliert werden.
- Die Vorkultur wird in einem Orbitalschüttler bei 200 U/min und 30 °C für 6-8 h inkubiert. Messen Sie den OD 600 der Vorkultur, der sich in der mittleren logarithmischen Phase befinden sollte: ~0,5-1 × 107 Zellen/ml, OD600 ~0,1-0,3.
- Bereiten Sie eine Kultur in der Mitte der logarithmischen Phase vor, indem Sie die Vorkultur für die Bildgebung am nächsten Tag verwenden. Berechnen Sie die Menge an Vorkultur, die für eine Kultur in der mittleren logarithmischen Phase nach dem Wachstum über Nacht (8-16 h) benötigt wird. Wenn die Zellen in SC-Medium gezüchtet werden, beträgt die Verdopplungszeit ~2 h. Daher wird das Volumen (V) der Vorkultur für die Inokulation einer 5-ml-Übernachtkultur mit Gleichung (1) berechnet:
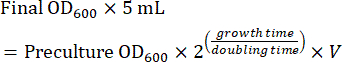 (1)
(1) - Es werden 5 ml SC-Medium in ein 50-ml-Röhrchen mit konischem Boden mit der in Schritt 2.1.3 berechneten Menge an Vorkultur beimpft. In einem Orbitalschüttler bei 200 U/min und 30 °C für 8-16 h wachsen lassen.
- Vergewissern Sie sich am Tag der Bildgebung, dass sich die in Schritt 2.1.4 erzeugte Kultur in der mittleren logarithmischen Phase befindet (OD600 ~0,1-0,3). Konzentrieren Sie die Zellen aus 1 ml der mittellogarithmischen Phasenkultur durch Zentrifugation bei 6.000 × g für 30 s. Entfernen Sie den Überstand und lassen Sie 10-20 μl des Überstandes im Röhrchen. Resuspendieren Sie das Zellpellet durch vorsichtiges Mischen mit Restmedien mit einer Mikropipette.
- Verwenden Sie ein Luftgebläse oder ein fusselfreies Tuch, um Staub von einem Objektträger zu entfernen, und geben Sie 1,8 μl der Zellsuspension auf den Objektträger. Decken Sie die Zellen mit einem Deckglas #1.5 (170 μm dick) ab und senken Sie das Deckglas langsam schräg ab, um das Eindringen von Blasen zu vermeiden.
- Sofort abbilden und das Objektträger nach 10 Minuten Bildgebung verwerfen.
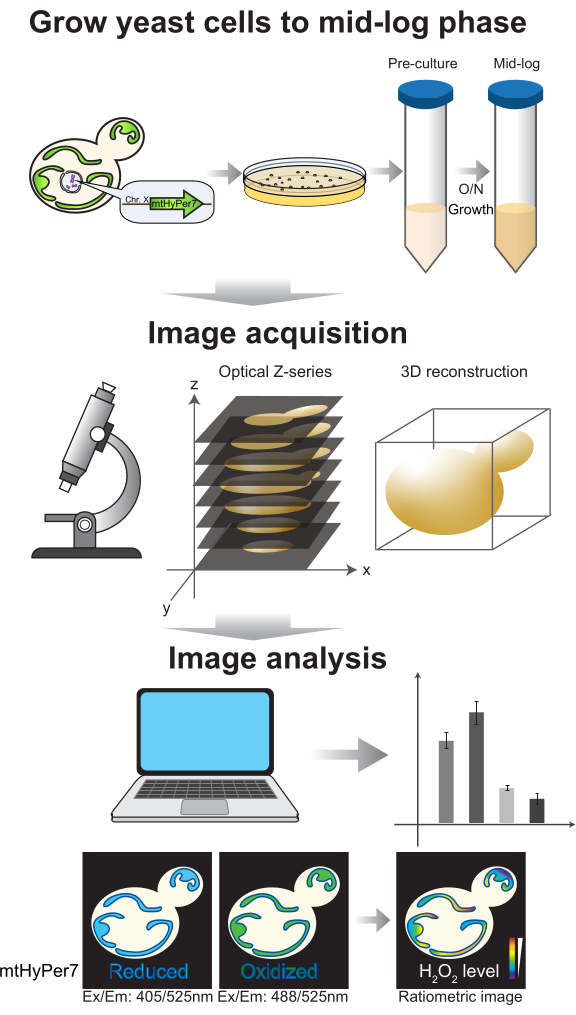
Abbildung 4: Zellwachstum und Bildgebung. Knospende Hefezellen, die mtHyPer7 exprimieren, werden bis zur mittleren logarithmischen Phase herangezüchtet. Die Bilder der Z-Serie werden mittels konfokaler Spinning-Disk-Mikroskopie aufgenommen und dann einer 3D-Rekonstruktion und -Analyse unterzogen. Siehe Protokollabschnitte 2-3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Optimierung der Bildgebungsbedingungen und der Bilderfassung (Abbildung 5)
- Wählen Sie einen Imaging-Modus aus. Für optische Schnitte ohne Nachbearbeitung wird ein konfokales Spinning-Disk-Instrument bevorzugt. Wenn das Signal jedoch schwach ist oder dieses Instrument nicht verfügbar ist, verwenden Sie eine Weitfeld-Bildgebung, um sicherzustellen, dass die Weitfeldbilder entfaltet werden, um unscharfe Unschärfe zu entfernen, wie zuvor beschrieben38.
- Wählen Sie die Optik aus. Verwenden Sie ein Ölimmersionsobjektiv mit hoher numerischer Apertur, z. B. 100x/1,45 Plan-Apochromat.
- Wählen Sie die Anregungs- und Emissionswellenlängen aus. Verwenden Sie für die konfokale Bildgebung mit Spinning-Disk eine Laseranregung bei 405 nm und 488 nm und einen Standard-GFP-Emissionsfilter. Verwenden Sie für die Weitfeld-Bildgebung eine Leuchtdiode (LED) oder eine Lampenanregung, stellen Sie jedoch sicher, dass der Filteraufbau eine Variation der Anregung zulässt, während die Emission durch den Standard-GFP-Filter geleitet wird.
HINWEIS: Dies kann z. B. erreicht werden, indem der Anregungsfilter von einem GFP-Würfel entfernt und eine LED oder ein Filterrad verwendet wird, um die Anregung auszuwählen. - Wählen Sie Belichtungszeit und Beleuchtungsstärke.
- Etablieren Sie Aufnahmebedingungen, die ein leicht detektierbares Signal und eine akzeptable Auflösung in jedem Fluoreszenzkanal liefern. Verwenden Sie beispielsweise bei einem konfokalen Spinning-Disk-Mikroskop mit einer sCMOS-Kamera 2 x 2 Binning, 20-40 % Laserleistung und 200-600 ms Belichtung.
- Untersuchen Sie das Bildhistogramm. Stellen Sie bei einem 12-Bit-Bild (4.096 mögliche Graustufen) sicher, dass der gesamte Dynamikumfang der Pixelwerte mindestens mehrere hundert Graustufen ohne Sättigung beträgt (Abbildung 5A). Stellen Sie außerdem sicher, dass die Reichweite um eine Größenordnung höher ist als der Geräuschpegel. Berechnen Sie den Rauschpegel als Standardabweichung der Pixelwerte in einem zellenfreien Bereich eines Bildes, gemessen wie in Schritt 4.1.3.1 beschrieben.
- Test auf Photobleaching oder bildgebenden induzierten mitochondrialen Stress unter den ausgewählten Bildgebungsbedingungen. Wenn eine übermäßige Photobleichung oder eine Zunahme der mitochondrialenH2O2beobachtet wird, reduzieren Sie die Laserleistung und erhöhen Sie die Belichtung oder das Binning.
- Sammeln Sie eine Zeitrafferserie von Bildern, ohne Verzögerung zwischen den Aufnahmen, um die Auswirkungen der Bildgebungsbedingungen auf die Signalstabilität und den oxidativen Stress in den Mitochondrien zu beurteilen. Messen Sie mit der Mikroskop-Erfassungssoftware oder ImageJ den durchschnittlichen Pixelwert in jedem Fluoreszenzkanal, um die Signalstabilität zu bestätigen (<5 % Änderung; Abbildung 5B). Wenn das Experiment keine Zeitrafferaufnahmen beinhaltet, stellen Sie sicher, dass die Fluoreszenz über zwei oder drei wiederholte Z-Stapel (25-35 Aufnahmen) stabil ist.
HINWEIS: Eine Abnahme der Fluoreszenz beider Kanäle kann auf ein Photobleichen hinweisen. Eine Abnahme der 405 nm-angeregten Fluoreszenz, begleitet von einer Zunahme des 488 nm-angeregten Kanals, kann jedoch auf einen erhöhten mitochondrialenH2O2- und bildgebenden oxidativen Stress in der Organelle hinweisen.
- Sammeln Sie eine Zeitrafferserie von Bildern, ohne Verzögerung zwischen den Aufnahmen, um die Auswirkungen der Bildgebungsbedingungen auf die Signalstabilität und den oxidativen Stress in den Mitochondrien zu beurteilen. Messen Sie mit der Mikroskop-Erfassungssoftware oder ImageJ den durchschnittlichen Pixelwert in jedem Fluoreszenzkanal, um die Signalstabilität zu bestätigen (<5 % Änderung; Abbildung 5B). Wenn das Experiment keine Zeitrafferaufnahmen beinhaltet, stellen Sie sicher, dass die Fluoreszenz über zwei oder drei wiederholte Z-Stapel (25-35 Aufnahmen) stabil ist.
- Erfassen von Bildern. Wenn Sie Z-Stapel erfassen, stellen Sie sicher, dass das Z-Intervall für alle Bilder im Datensatz gleich ist, und schließen Sie die gesamte Zelle ein. Für knospende Hefe Bild mit einem Z-Intervall von 0,5 μm und einer Gesamtstapeltiefe von 6 μm. Erfassen Sie Durchlichtbilder, um Zellgrenzen zu dokumentieren.
- Analysieren Sie Bilder manuell oder halbautomatisch über die Skripte, die in Supplemental File 2 und bei https://github.com/theresaswayne/biosensor verfügbar sind, unter Verwendung der Fidschi-Distribution von ImageJ39 und der Statistiksoftware R (Abbildung 6). In den Softwareanweisungen werden hierarchische Menübefehle fett mit "|" dargestellt, was eine Reihenfolge der Menüauswahl angibt. Optionen und Schaltflächen werden fett dargestellt.
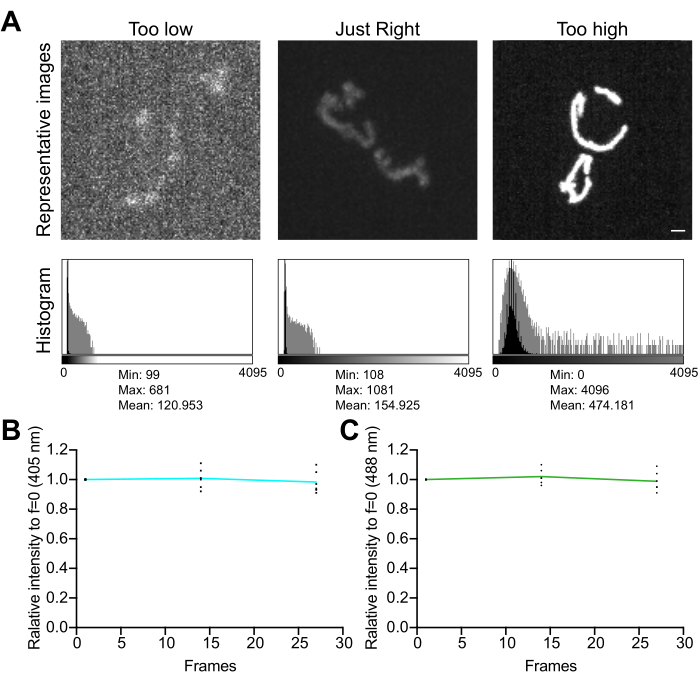
Abbildung 5: Optimierung der Bildgebung . (A) Auswertung von Bildern und Histogrammen für den richtigen Intensitätsbereich. Es werden Projektionen mit maximaler Intensität von konfokalen Spinning-Disk-Bildern gezeigt. Die Histogramme werden sowohl mit einer linearen Y-Achse (schwarz) als auch mit einer logarithmischen Y-Achse (grau) dargestellt, um den Bilddynamikbereich zu veranschaulichen. Linke Felder: ein verrauschtes Bild mit geringer Intensität und geringem Dynamikumfang. Mittlere Panels: ein Bild mit einem akzeptablen Dynamikumfang (~1.000 Graustufen) und einer akzeptablen Intensität. Rechte Felder: Ein Bild, das nicht richtig kontrastverstärkt wurde, um eine übermäßige Sättigung zu erzeugen. Maßstabsbalken = 1 μm. (B,C) Analyse der Photobleichung von mtHyPer7. Aufeinanderfolgende Z-Stapel wurden ohne Verzögerung gesammelt, Z-Stapel wurden summiert und die mittlere Intensität der Mitochondrien wurde gemessen und auf den ersten Zeitpunkt normalisiert. Die Ergebnisse der ersten drei Zeitpunkte (27 Aufnahmen) werden angezeigt. (B) Anregungswellenlänge: 405 nm. (C) Anregungswellenlänge: 488 nm. Bei den gezeigten Werten handelt es sich um die Mittelwerte von jeweils drei Zellen aus drei unabhängigen Studien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Halbautomatische Analyse mit Skripten
- Generieren und messen Sie Verhältnisbilder mit einem Biosensor-Analyseskript (z. B. biosensor.ijm oder biosensor-image-subtraction.ijm).
- Wählen Sie das zu verwendende Skript aus. Das Protokoll für die Verwendung der einzelnen Skripte ist ähnlich. Eventuelle Unterschiede werden im Text angegeben.
- biosensor.ijm: In diesem Skript werden Hintergrund und Rauschen mit benutzerdefinierten Bildbereichen, festen Werten oder ohne Subtraktion korrigiert. Wählen Sie die Methoden für die Hintergrund- und Rauschkorrektur unabhängig voneinander aus.
- biosensor-image-subtraction.ijm: In diesem Skript werden sowohl Hintergrund als auch Rauschen mit der gleichen vom Benutzer ausgewählten Methode behandelt, die eine der folgenden sein kann: leeres Bild, vom Benutzer ausgewählter Bereich innerhalb des Bildes, fester Wert oder keine Korrektur.
- Öffnen Sie in Fidschi ein Mehrkanal-Z-Stapelbild, das Sie in Schritt 3.5 aufgenommen haben. Öffnen Sie die gewünschte Skriptdatei für die Biosensoranalyse. Führen Sie das Skript aus, indem Sie im Skript-Editor-Fenster auf Ausführen klicken. Geben Sie im angezeigten Dialogfenster die angeforderten Informationen ein.
- Wählen Sie die Kanalnummern des Zählers und Nenners für die Verhältnisberechnung aus. Für mtHyPer7 ist der Zähler der Kanal, der bei 488 nm angeregt wird, und der Nenner ist der Kanal, der bei 405 nm angeregt wird. Wählen Sie die Kanalnummer des Durchlichtbildes aus, falls vorhanden, oder 0 , wenn keines vorhanden ist.
- Wählen Sie die gewünschte Methode zur Hintergrundsubtraktion aus den folgenden vier Optionen aus. Wenn der Hintergrund relativ gleichmäßig ist, wählen Sie Bildbereich auswählen, um die Hintergrundebene im Bild direkt zu messen. Wenn der Hintergrund im Feld erheblich variiert, verwenden Sie das Skript biosensor-image-subtraction.ijm und wählen Sie Leeres Bild (um ein leeres Bild zur Korrektur zu erfassen, erfassen Sie einen Mehrkanal-Z-Stapel mit identischen Aufnahmebedingungen in einem zellfreien Sichtfeld oder von einem Objektträger, der mit zellfreiem Wachstumsmedium erstellt wurde). Fester Wert ermöglicht die Eingabe eines zuvor gemessenen Hintergrundwerts. Keine lässt den Hintergrund unkorrigiert, kann aber die Genauigkeit der Messung verringern.
- Wählen Sie die gewünschte Methode zur Rauschsubtraktion aus. Der Rauschwert wird als unterer Schwellenwert für die vom Hintergrund subtrahierten, maskierten Kanalbilder verwendet, um den Effekt zufälliger Variationen in der Detektoranzeige zu reduzieren. Entscheiden Sie sich für Bildbereich auswählen oder Fester Wert , um die Eingabe eines zuvor gemessenen Rauschpegels zu ermöglichen, was in der Regel gut funktioniert, da die Rauschpegel konstant sind, wenn die Bildbedingungen konstant gehalten werden. Alternativ können Sie auch Keine auswählen und einen Wert von 1 als unteren Schwellenwert verwenden, wodurch die Variabilität der Messungen erhöht werden kann.
- Wählen Sie einen Schwellalgorithmus, um Mitochondrien genau und konsistent zu erkennen. Otsu oder MaxEntropy werden empfohlen. Verwenden Sie im Idealfall den gleichen Algorithmus für alle Bilder in einem Experiment, stellen Sie jedoch die genaue Erkennung der Mitochondrien sicher. Verwenden Sie eine andere Schwellenwertmethode, wenn sich die Morphologie während eines Experiments ändert.
- Wählen Sie die Anzahl der Regions of Interest (ROIs) pro Zelle aus. Wenn Sie z. B. den Unterschied zwischen Mutter und Knospe messen möchten, wählen Sie 2 aus.
- Wählen Sie den Ausgabeordner aus, in dem Maße und Verhältnisbilder gespeichert werden sollen.
- Befolgen Sie die Anweisungen zur Hintergrund- und Geräuschkorrektur.
- Bereichsauswahl (falls zutreffend): Wenn Bildbereich auswählen für die Hintergrund- oder Rauschmessung ausgewählt wurde, befolgen Sie die Anweisungen zum Zeichnen eines Hintergrundbereichs (außerhalb von Zellen oder fluoreszierenden Artefakten) mit dem Rechteck-ROI-Werkzeug. Nachdem Sie den Bereich gezeichnet haben, klicken Sie auf OK.
- Eingabe eines festen Wertes (falls zutreffend): Wenn Fester Wert für die Hintergrund- oder Rauschmessung ausgewählt wurde, befolgen Sie die Anweisungen zur Eingabe von Hintergrund - und/oder Rauschwerten für jeden Fluoreszenzkanal.
- Leeres Referenzbild (falls zutreffend): Wenn im Skript biosensor-image-subtraction.ijm die Option Leeres Bild für die Hintergrund- oder Rauschkorrektur ausgewählt wurde, folgen Sie den Anweisungen, um eine leere Bilddatei auszuwählen.
- Markieren Sie ROIs für die Messung. Beschränken Sie die Analyse bei Kulturen in der mittleren logarithmischen Phase auf knospierte Zellen.
- Zeichnen Sie ROIs, die einzelnen Zellen oder subzellulären Regionen auf der Grundlage des Hellfeldbildes entsprechen. Der ROI muss nicht genau mit dem Zellumriss übereinstimmen, da nur Mitochondrien innerhalb des ROI gemessen werden. Alternativ können Sie ein zuvor gespeichertes ROI-Set öffnen: Klicken Sie im ROI-Manager auf "Mehr" und wählen Sie dann die ROI-Datei aus.
- Drücken Sie T, nachdem Sie jede ROI erstellt haben, um die ausgewählte ROI zum ROI-Manager hinzuzufügen. Aktivieren Sie im ROI-Manager die Option Alle anzeigen, um die markierten Zellen zu dokumentieren. Jede hinzugefügte Region wird als nummeriertes Element in der ROI-Manager-Liste angezeigt. Wenn Sie mehr als einen ROI pro Zelle analysieren (z. B. Mutter und Knospe), markieren Sie die ROIs für jede analysierte Zelle in der gleichen Reihenfolge.
- Nachdem alle gewünschten ROIs zum ROI-Manager hinzugefügt wurden, klicken Sie im Dialogfenster Zellen markieren auf OK.
- Wählen Sie das Format der Maßtabelle. Aktivieren Sie im angezeigten Dialogfenster MultiMeasure die Option Alle Slices messen. Aktivieren Sie die Option Eine Zeile pro Slice, um eine Tabelle mit dem gewünschten Format zu erstellen. Verwenden Sie die process_multiROI_tables. R-Skript zum Verarbeiten von Tabellen, die mit der Option Eine Zeile pro Slice erstellt wurden; Aktivieren Sie nicht die Option Ergebnisse anhängen. Wiederholen Sie diesen Schritt 3x (für die Messung des Zählers [488], des Nenners [405] und des Verhältnisses [488/405]).
- Das Skript speichert die Ausgabedateien in dem Ordner, der in Schritt 4.1.2.6 ausgewählt wurde.
- Wählen Sie das zu verwendende Skript aus. Das Protokoll für die Verwendung der einzelnen Skripte ist ähnlich. Eventuelle Unterschiede werden im Text angegeben.
- Berechnung der gewichteten Mittelwerte für jede Region oder Zelle
- Berechnen Sie anhand der im vorherigen Schritt erhaltenen Ergebnisse die gewichteten Mittelwerte für jede Region oder Zelle mithilfe von Gleichung (2). Berechnen Sie entweder "pixelweise" oder "regionsweise" Verhältnisse (siehe die Diskussion für Details).
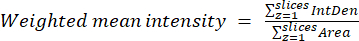 (2)
(2)
HINWEIS: Die Werte für die Fläche und die integrierte Dichte (IntDen) umfassen nur die Pixel innerhalb der Mitochondrien mit Schwellenwert. Diese Berechnung kann mit dem process_multiROI_tables automatisiert werden. R-Skript und R-Statistiksoftware.
- Berechnen Sie anhand der im vorherigen Schritt erhaltenen Ergebnisse die gewichteten Mittelwerte für jede Region oder Zelle mithilfe von Gleichung (2). Berechnen Sie entweder "pixelweise" oder "regionsweise" Verhältnisse (siehe die Diskussion für Details).
- Generieren Sie ein Bild mit farbigem Verhältnis. Da Änderungen des Farbtons (der Farbe) für das menschliche Auge offensichtlicher sind als Änderungen der Intensität, konvertieren Sie den Verhältniswert in eine Farbskala, um die visuelle Interpretation zu erleichtern. Das colorize_ratio_image.ijm-Skript färbt ein Bild mit maskiertem Verhältnis ein.
- Öffnen Sie in Fidschi ein Z-Stapelbild, das in Schritt 4.1.6 generiert wurde. Öffnen Sie die Skriptdatei colorize_ratio_image.ijm. Führen Sie das Skript aus, indem Sie im Skript-Editor-Fenster auf Ausführen klicken. Geben Sie im angezeigten Dialogfenster die angeforderten Informationen ein.
- Färbemethode: Bei der Option Unmoduliert erscheinen alle mitochondrialen Pixel mit der gleichen Helligkeit. Einige Bilder können jedoch verrauscht erscheinen, da sowohl dunkle als auch helle Pixel zum Verhältnisbild beitragen. Um diesen Effekt zu reduzieren, verwenden Sie die Option " Intensität moduliert" .
- Minimaler und maximal angezeigter Wert: Diese Werte steuern den Bereich der Verhältniswerte, die eingefärbt werden. Wählen Sie Werte aus, die nahe an den durchschnittlichen Minimal- und Maximalwerten liegen, die in einem Experiment beobachtet wurden (basierend auf den in Schritt 4.2.1 berechneten gewichteten Mittelwertverhältnissen). Stellen Sie sicher, dass Sie innerhalb eines Experiments alle Bilder mit identischen Bildgebungsbedingungen erfassen und alle Bilder mit identischen Minimal- und Maximalwerten anzeigen.
- Projektionsmodus: Z-Stapel werden als Projektionen angezeigt, um die gesamte mitochondriale Population darzustellen. Die Projektion wird vor der Kolorierung erstellt. Wählen Sie " Max " für eine Projektion mit maximaler Intensität (unter Beibehaltung des maximalen Verhältnisses und der Intensitätswerte) oder " Durchschnitt" für eine Projektion mit durchschnittlicher Intensität.
- Ausgabeordner: Wählen Sie den Ordner aus, in dem die kolorierten Bilder gespeichert werden sollen.
- Wenn die Option Unmoduliert ausgewählt wurde, wählen Sie ein Farbschema (Nachschlagetabelle; LUT) im angezeigten Dialogfenster. Verwenden Sie die in Fiji integrierten Fire - oder Rainbow-RGB-LUTs oder eine beliebige LUT im .lut-Format von ImageJ (Aus LUT-Datei importieren). Die Rainbow Smooth40 LUT wird empfohlen (in Supplemental File 2 und auf GitHub enthalten).
- Das Skript speichert die Ausgabedateien in dem Ordner, der in Schritt 4.3.1.4 ausgewählt wurde. Dazu gehören das kolorierte Verhältnisbild (Color_RGB.tif) und das kolorierte Verhältnisbild mit einem Kalibrierungsbalken, der die Übereinstimmung zwischen Verhältniswerten und Bildfarbe (Color_with_bar.tif) anzeigt.
- Öffnen Sie in Fidschi ein Z-Stapelbild, das in Schritt 4.1.6 generiert wurde. Öffnen Sie die Skriptdatei colorize_ratio_image.ijm. Führen Sie das Skript aus, indem Sie im Skript-Editor-Fenster auf Ausführen klicken. Geben Sie im angezeigten Dialogfenster die angeforderten Informationen ein.
5. Manuelle Analyse
HINWEIS: Dieser Ansatz nimmt mehr Zeit in Anspruch, ermöglicht jedoch Flexibilität bei der Vorverarbeitung und dem Festlegen des Schwellenwerts.
- Korrigieren Sie den Hintergrund.
- Legen Sie Optionen in Fidschi fest.
- Klicken Sie auf Analysieren | Legen Sie die Maße fest. Aktivieren Sie im angezeigten Dialogfenster die Kontrollkästchen für Fläche, Mittelwert, StdDev, IntDen und Beschriftung anzeigen. Legen Sie die Dezimalstellen auf 3 fest.
- Klicken Sie auf Bearbeiten | Optionen | Eingang/Ausgang. Aktivieren Sie im angezeigten Dialogfenster die Kontrollkästchen Zeilennummern speichern und Spaltenüberschriften speichern.
- Um die Empfindlichkeit der Verhältnisberechnung zu erhöhen, subtrahieren Sie den Hintergrund von jedem Fluoreszenzkanal. Wenn der Hintergrund relativ gleichmäßig ist, messen Sie die mittlere Intensität eines zellfreien Bereichs in einem Bild und subtrahieren Sie diesen Wert vom gesamten Bild (Schritt 5.1.2.1). Wenn der Hintergrund im Feld stark variiert, verwenden Sie alternativ ein leeres Bild zur Korrektur (Schritt 5.1.2.2.).
- Um einen vom Benutzer ausgewählten Bereich zu subtrahieren, klicken Sie auf Bild | Farbe | Teilen Sie die Kanäle auf und lassen Sie alle Kanalbilder geöffnet, da sie später benötigt werden. Zeichnen Sie für jeden Fluoreszenzkanal eine ROI auf den Hintergrund (außerhalb aller Zellen) und klicken Sie auf Analysieren | Messen, oder klicken Sie für Stapel auf Bild | Stapel | Stapel messen. Beobachten Sie den Mittelwert des ROI, der in der Ergebnistabelle angezeigt wird. Klicken Sie auf Bearbeiten | Wählen Sie "Keine" und dann "Verarbeiten" | Mathematik | Subtrahieren. Geben Sie im angezeigten Dialogfenster den gemessenen mittleren Hintergrundwert, auf die nächste ganze Zahl gerundet, ein.
Hinweis: Durch das Runden werden spätere Fehler bei binären Operationen vermieden. - Um ein leeres Bild aus einer Datendatei zu subtrahieren, erfassen Sie ein leeres Bild aus einem vollständig zellfreien Sichtfeld oder von einem Objektträger, der mit zellfreiem Wachstumsmedium präpariert wurde. Klicken Sie auf Prozess | Bild-Rechner. Legen Sie im angezeigten Dialogfenster den Vorgang auf Subtrahieren fest, und legen Sie Bild1 und Bild2 auf das Zellenbild bzw. das leere Bild fest. Aktivieren Sie Neues Fenster und 32-Bit-Ergebnis erstellen.
- Um einen vom Benutzer ausgewählten Bereich zu subtrahieren, klicken Sie auf Bild | Farbe | Teilen Sie die Kanäle auf und lassen Sie alle Kanalbilder geöffnet, da sie später benötigt werden. Zeichnen Sie für jeden Fluoreszenzkanal eine ROI auf den Hintergrund (außerhalb aller Zellen) und klicken Sie auf Analysieren | Messen, oder klicken Sie für Stapel auf Bild | Stapel | Stapel messen. Beobachten Sie den Mittelwert des ROI, der in der Ergebnistabelle angezeigt wird. Klicken Sie auf Bearbeiten | Wählen Sie "Keine" und dann "Verarbeiten" | Mathematik | Subtrahieren. Geben Sie im angezeigten Dialogfenster den gemessenen mittleren Hintergrundwert, auf die nächste ganze Zahl gerundet, ein.
- Legen Sie Optionen in Fidschi fest.
- Um die Analyse auf Mitochondrien zu beschränken, führen Sie eine Segmentierung durch. Da jeder Kanal je nach Zustand des Biosensors seine Intensität ändern kann, verwenden Sie die Summe der beiden Kanäle, um den Bereich der Mitochondrien konsistent zu definieren.
- Um ein Summenbild zu erstellen, klicken Sie auf Prozess | Bild-Rechner. Legen Sie im angezeigten Dialogfenster den Vorgang auf Hinzufügen fest, und legen Sie Bild1 und Bild2 in beliebiger Reihenfolge auf die beiden vom Hintergrund subtrahierten Fluoreszenzkanäle fest. Aktivieren Sie Neues Fenster und 32-Bit-Ergebnis erstellen und warten Sie, bis ein Summenbild angezeigt wird.
- Legen Sie den Schwellenwert fest, um Mitochondrien auf dem Summenbild zu definieren.
- Klicken Sie auf Bild | Anpassen | Schwellenwert. Aktivieren Sie im angezeigten Fenster "Schwellenwert" die Optionen "Dunkler Hintergrund" und "Histogramm stapeln". Legen Sie Methode auf den gewünschten Algorithmus fest (z. B. Otsu oder MaxEntropy). Verwenden Sie automatisierte Schwellenwerte für die Reproduzierbarkeit, aber wenn keine automatische Methode geeignet ist, passen Sie den Schwellenwert manuell an.
HINWEIS: Im Idealfall sollte derselbe Algorithmus für alle Bilder in einem Experiment verwendet werden, aber Änderungen der Morphologie während eines Experiments können unter bestimmten Bedingungen eine andere Schwellenwertmethode erfordern. - Wenn der Schwellenwert zufriedenstellend ist, klicken Sie auf Übernehmen. Wählen Sie im angezeigten Dialogfenster die Option In Maske konvertieren. Aktivieren Sie im angezeigten Dialogfenster die Option Schwarzer Hintergrund und lassen Sie die anderen Kontrollkästchen deaktiviert. Speichern Sie das resultierende Maskenbild, um die Segmentierungsgenauigkeit zu bewerten.
- Klicken Sie auf Bild | Anpassen | Schwellenwert. Aktivieren Sie im angezeigten Fenster "Schwellenwert" die Optionen "Dunkler Hintergrund" und "Histogramm stapeln". Legen Sie Methode auf den gewünschten Algorithmus fest (z. B. Otsu oder MaxEntropy). Verwenden Sie automatisierte Schwellenwerte für die Reproduzierbarkeit, aber wenn keine automatische Methode geeignet ist, passen Sie den Schwellenwert manuell an.
- Konvertieren Sie die Maskenwerte von 0 und 255 in 0 bzw. 1, indem Sie auf Prozess | Mathematik | Teilen. Legen Sie den Wert auf 255 fest, und wählen Sie bei Aufforderung die Option zum Verarbeiten aller Bilder aus.
- Wenden Sie die Maske auf die vom Hintergrund subtrahierten Fluoreszenzkanäle an, indem Sie auf Prozess | Bild-Rechner. Legen Sie im angezeigten Dialogfenster den Vorgang auf Multiplizieren fest. Legen Sie Image1 und Image2 auf den Zählerkanal bzw. die Maske fest. Aktivieren Sie Neues Fenster und 32-Bit-Ergebnis erstellen. Wiederholen Sie die Maskenmultiplikation mit dem Nennerkanal.
- Bereiten Sie jeden maskierten Kanal für die Verhältnisberechnung vor, indem Sie die Hintergrundpixel auf NaN ("keine Zahl") setzen.
- Wählen Sie den maskierten Zählerkanal aus und klicken Sie auf Bild | Anpassen | Schwellenwert. Klicken Sie im Fenster Schwellenwert auf Festlegen, und legen Sie im angezeigten Dialogfenster das Minimum auf den berechneten Geräuschpegel oder auf 1 fest, und lassen Sie das Maximum unverändert.
- Klicken Sie im Fenster Schwellenwert auf Übernehmen. Wählen Sie im nächsten Dialogfenster Set to NaN (Auf NaN setzen) aus. Wiederholen Sie den Vorgang für den Kanal des maskierten Nenners.
- Generieren Sie das Verhältnisbild.
- Klicken Sie auf Prozess | Bild-Rechner. Legen Sie im angezeigten Dialogfenster den Vorgang auf Teilen fest. Legen Sie Image1 und Image2 auf die vom Hintergrund subtrahierten maskierten Zähler- bzw. Nennerkanäle fest. Für mtHyPer7 ist der Zähler die oxidierte Form, die bei 488 nm angeregt wird, und der Nenner ist die reduzierte Form, die bei 405 nm angeregt wird. Daher deuten höhere Verhältnisse auf einen höheren H2O2-Wert hin.
- Aktivieren Sie Neues Fenster und 32-Bit-Ergebnis erstellen. Speichern Sie das Verhältnisbild zur Analyse.
- Markieren und quantifizieren Sie Interessenbereiche. Jede Zelle oder subzelluläre Region wird ausgewählt und als ROI im ROI-Manager gespeichert. Die ROIs müssen nicht perfekt mit den Zellumrissen übereinstimmen, da nur die maskierten Mitochondrienregionen gemessen werden.
- Verwenden Sie das Durchlichtbild, um Verzerrungen zu vermeiden, und erstellen Sie ROIs, die einzelnen Zellen (oder subzellulären Regionen) entsprechen. In Kulturen in der mittleren logarithmischen Phase ist die Analyse auf Hefezellen mit Knospen zu beschränken, die aktiv an der Zellteilung beteiligt sind. Drücken Sie T , nachdem Sie jede ROI erstellt haben, um sie dem ROI-Manager hinzuzufügen. Aktivieren Sie Alle anzeigen , um die markierten Zellen zu dokumentieren.
- Klicken Sie auf das oben erstellte Verhältnisbild und klicken Sie im ROI-Manager auf Mehr ... | MultiMeasure. Aktivieren Sie im angezeigten Dialogfenster die Option Alle Slices messen. Aktivieren Sie nicht die Option Ergebnisse anhängen. Aktivieren Sie die Option Eine Zeile pro Slice, um eine Tabelle mit dem gewünschten Format zu erstellen. Die process_multiROI_tables. Das R-Skript verarbeitet Tabellen, die mit der Option Eine Zeile pro Slice in der R-Statistiksoftware erstellt wurden.
- Speichern Sie die Ergebnisse. Klicken Sie auf das Fenster Ergebnisse und dann auf Datei | Speichern Sie die Ergebnistabelle im .csv- oder .xls-Format. Legen Sie den Dateinamen so fest, dass er mit dem Bildnamen übereinstimmt.
- Sparen Sie die ROIs. Vergewissern Sie sich zunächst, dass im ROI-Manager keine ROIs ausgewählt sind: Klicken Sie auf Auswahl aufheben, dann auf Mehr | Speichern. Öffnen Sie die gespeicherten ROIs zusammen mit dem Originalbild in Fidschi, um die Messungen mit dem Bild zu vergleichen.
- Berechnen Sie die gewichteten Mittelwerte pro Zelle oder Region, indem Sie die Ergebnisse aus dem vorherigen Schritt und der Gleichung (3) verwenden. Berechnen Sie entweder "pixelweise" oder "regionsweise" Verhältnisse (siehe die Diskussion für Details).
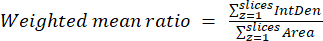 (3)
(3)
HINWEIS: Die Werte für die Fläche und die integrierte Dichte umfassen nur die Pixel innerhalb der Mitochondrien mit Schwellenwert. Diese Berechnung kann mit dem process_multiROI_tables automatisiert werden. R-Skript in der R-Statistiksoftware. - Generieren Sie ein Bild mit farbigem Verhältnis.
HINWEIS: Kolorierte Bilder können unmoduliert sein, bei denen alle mitochondrialen Pixel mit der gleichen Helligkeit erscheinen, oder intensitätsmoduliert, bei denen die Pixelintensität im Originalbild verwendet wird, um die Intensitäten im kolorierten Bild festzulegen.- So erzeugen Sie ein unmoduliertes koloriertes Bild:
- Öffnen Sie das oben generierte Verhältnisbild. Klicken Sie auf Bild | Duplizieren , um eine Kopie des Bildes zu erstellen, und schließen Sie dann das Originalbild.
- Wenn es sich bei dem Bild um einen Z-Stapel handelt, wählen Sie entweder eine einzelne Schicht aus oder generieren Sie eine Z-Projektion, um alle Mitochondrien anzuzeigen. Verwenden Sie entweder eine maximale Intensitätsprojektion (wobei das maximale Verhältnis und die Intensitätswerte an jeder XY-Pixelkoordinate beibehalten werden) oder eine Projektion mit durchschnittlicher Intensität.
- Klicken Sie auf Bild | Lookup-Tabellen und stellen Sie die LUT auf das gewünschte Farbschema ein (z. B. Rainbow RGB oder Fire [standardmäßig in ImageJ verfügbar]). Alternativ klicken Sie auf Datei | Importieren Sie die LUT und wählen Sie eine beliebige LUT im .lut-Format von ImageJ aus, z. B. Rainbow Smooth40 (in Supplemental File 2 und auf GitHub enthalten). Stellen Sie sicher, dass der LUT eine dunkle Farbe zugewiesen ist, die dem Wert 0 zugewiesen ist.
- Stellen Sie den Displaykontrast ein, indem Sie auf Bild | Anpassen | Helligkeit/Kontrast. Klicken Sie im Fenster Helligkeit/Kontrast auf Festlegen, und geben Sie im angezeigten Dialogfenster die gewünschten Werte für die angezeigten Minimal- und Maximalwerte ein . Um die beobachteten Farbunterschiede zu maximieren, stellen Sie diese ungefähr auf das Minimum und Maximum ein, das für alle Bilder erhalten wird. Stellen Sie für alle Bilder in einem Experiment die gleichen Kontraststufen ein.
HINWEIS: Klicken Sie nicht auf Übernehmen, da dadurch die Pixelwerte geändert werden und die Generierung eines genauen Kalibrierungsbalkens im nächsten Schritt verhindert wird. - Fügen Sie einen Farbkalibrierungsbalken hinzu, indem Sie auf Analysieren | Werkzeuge | Kalibrierungsbalken. Aktivieren Sie im angezeigten Dialogfenster die Option Überlagerung, um den Balken bei Bedarf zu entfernen, indem Sie auf Bild | Überlagerung | Overlay entfernen.
- Falls gewünscht, fügen Sie eine Maßstabsleiste hinzu, indem Sie auf Analysieren | Werkzeuge | Maßstabsleiste. Legen Sie im angezeigten Dialogfenster die gewünschte Größe, Position und Farbe für den Balken fest. Aktivieren Sie die Option Überlagern , um die Farbe des Balkens unabhängig von der verwendeten LUT beizubehalten.
- Generieren Sie ein RGB-Bild für die Veröffentlichung, indem Sie auf Bild | Überlagerung | Flach drücken. Speichern Sie das resultierende Bild.
HINWEIS: Dieses Bild dient nur zur Präsentation oder Veröffentlichung. Die Intensitätswerte sind verändert, so dass es nicht gemessen werden kann. Die Balken werden auch dauerhaft auf dem Bild eingebrannt.
- So erstellen Sie ein intensitätsmoduliertes Bild:
- Klicken Sie auf Bild | Duplizieren , um eine Kopie des Bildes zu erstellen, und schließen Sie dann das Original.
- Wenn es sich bei dem Bild um einen Z-Stapel handelt, wählen Sie entweder eine einzelne Schicht aus oder generieren Sie eine Z-Projektion, um alle Mitochondrien anzuzeigen.
- Stellen Sie den Darstellungskontrast des Bildverhältnisses ein, indem Sie auf Bild | Anpassen | Helligkeit/Kontrast, und klicken Sie im Fenster Helligkeit/Kontrast auf Festlegen. Geben Sie im angezeigten Dialogfenster die gewünschten Werte für die angezeigten Minimal - und Maximalwerte ein. Um die beobachteten Farbunterschiede zu maximieren, legen Sie diese ungefähr auf das Minimum und Maximum fest, das für alle Bilder erhalten wird, und stellen Sie alle Bilder in einem Experiment auf die gleichen Kontraststufen ein. Klicken Sie auf "Anwenden ", um die Pixelwerte neu zu skalieren.
- Um einen Kalibrierungsbalken zu erstellen, duplizieren Sie dieses verbesserte Bild und generieren Sie einen Balken, indem Sie zu Analysieren | Werkzeuge | Kalibrierungsbalken. Konvertieren Sie das Bild und das Overlay in das RGB-Format, indem Sie auf Bild | Überlagerung | Flach drücken. Falls gewünscht, fügen Sie diesen Balken auf das intensitätsmodulierte RGB-Bild ein, das Sie in Schritt 5.6.2.12 erhalten haben, um es zu präsentieren oder zu veröffentlichen.
- Erstellen Sie ein neues Bild mit der gleichen Breite und Höhe wie das Bild, indem Sie auf Datei | Neu | Bild.... Stellen Sie im sich öffnenden Dialogfenster die Parameter wie folgt ein: Typ: RGB; Füllung mit: Schwarz; Breite und Höhe: 9Breite und Höhe des Bildes); Scheiben: 1.
- Konvertieren Sie den neuen Stapel in einen HSB-Bildstapel (Farbton, Sättigung, Helligkeit), indem Sie auf Bild | Typ | HSB-Stapel.
- Klicken Sie auf das Bild mit dem kontrastangepassten Verhältnis, indem Sie zu Bearbeiten | Wählen Sie "Alle" und dann " Bearbeiten" | Kopieren. Klicken Sie dann auf den HSB-Stapel, wählen Sie das erste Segment (Farbton) aus und klicken Sie auf Bearbeiten | Einfügen , um die Verhältniswerte zu übertragen.
- Wählen Sie Schicht 2 (Sättigung) des HSB-Stacks aus. Legen Sie die Vordergrundfarbe auf Weiß fest, indem Sie zu Bearbeiten | Optionen | Farben. Klicken Sie auf Bearbeiten | Wählen Sie "Alle" und dann " Bearbeiten" | Füllen, und wählen Sie im sich öffnenden Dialogfenster Nein aus, um nur das aktuelle Segment mit Weiß zu füllen.
- Öffnen Sie das Rohdatenbild und teilen Sie die Kanäle auf, indem Sie auf Bild | Farbe | Split-Kanäle.
- Generieren Sie den Mittelwert der beiden Verhältniskanäle mit dem Bildrechner und klicken Sie auf Prozess | Bild-Rechner. Legen Sie im angezeigten Dialogfenster den Vorgang auf Mittelwert fest, und legen Sie Image1 und Image2 auf die Zähler - bzw. Nennerbilder fest. Aktivieren Sie das Kontrollkästchen Neues Fenster erstellen.
- Klicken Sie auf das oben erstellte Durchschnittsbild, indem Sie zu Bearbeiten | Wählen Sie "Alle" und dann " Bearbeiten" | Kopieren. Klicken Sie dann auf den HSB-Stack, wählen Sie das dritte Segment (Wert) aus und klicken Sie auf Bearbeiten | Einfügen , um die Intensitätswerte zu übertragen.
- Konvertieren Sie den HSB-Stack in den RGB-Farbraum, indem Sie auf Bild | Typ | RGB-Farbe. Speichern Sie das resultierende Bild.
- So erzeugen Sie ein unmoduliertes koloriertes Bild:
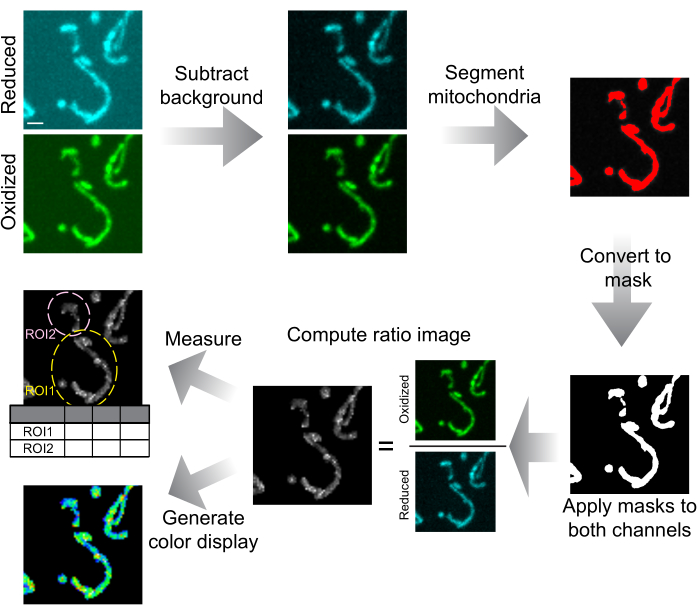
Abbildung 6: Schematische Darstellung der Bildanalyse und -präsentation. Konfokale Spinning-Disk-Bilder werden zunächst vom Hintergrund subtrahiert. Mitochondrien werden nach Schwellenwerten segmentiert und für jede Schicht in Masken umgewandelt. Diese Masken werden auf beide Kanäle angewendet, und die maskierten Bilder werden verwendet, um das Verhältnisbild zu berechnen. ROIs werden gezogen, um das mtHyPer7-Verhältnis in Zellen oder subzellulären Regionen zu messen. Für die Datenpräsentation können auch farbige Verhältnisbilder generiert werden. Maßstabsleiste = 1 μm. Abkürzung: ROI = Region of Interest. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Um zu bestätigen, dass mtHyPer7 eine geeignete Sonde zur Beurteilung des mitochondrialenH2O2ist, wurde die Lokalisation von mtHyPer7 und seine Wirkung auf die Hefemitochondrien und die Zellgesundheit untersucht. Um das Targeting von mtHyPer7 zu untersuchen, wurden Mitochondrien mit dem lebenswichtigen Mitochondrien-spezifischen Farbstoff MitoTracker Red in Kontrollhefezellen und Hefen, die mtHyPer7 exprimieren, gefärbt. Mit Hilfe der MitoTracker Red-Färbung wurden Mitochondrien als lange röhrenförmige Strukturen aufgelöst, die entlang der Mutter-Knospen-Achse ausgerichtet waren und sich in der Spitze der Knospe und der Spitze der Mutterzelle distal der Knospe ansammelten41. Die mitochondriale Morphologie war in den Kontroll- und mtHyPer7-exprimierenden Zellen ähnlich. Darüber hinaus kolokalisierte mtHyPer7 mit MitoTracker Rot-gefärbten Mitochondrien (Abbildung 3A). Auf diese Weise wurde mtHyPer7 effizient und quantitativ auf Mitochondrien ausgerichtet, ohne die normale Morphologie oder Verteilung der Mitochondrien zu beeinträchtigen.
Als nächstes wurden zusätzliche Validierungsexperimente durchgeführt, um die Wirkung von mtHyPer7 auf die zelluläre Fitness und die Empfindlichkeit gegenüber oxidativem Stress in den Mitochondrien zu bewerten. Die Wachstumsraten von mtHyPer7-exprimierenden Zellen in reichhaltigen oder synthetischen glukosebasierten Medien (YPD bzw. SC) ähneln denen von untransformierten Wildtyp-Zellen (Abbildung 3B,D). Um die möglichen Auswirkungen auf oxidativen Stress in den Mitochondrien zu untersuchen, wurden Kontroll- und mtHyPer7-exprimierende Hefe mit niedrigen Konzentrationen von Paraquat behandelt, einem redoxaktiven kleinen Molekül, das sich in den Mitochondrien anreichert und zu erhöhten Superoxidspiegeln in der Organelle führt24,27. Wenn die mtHyPer7-Expression entweder oxidativen Stress in den Mitochondrien induziert oder die Mitochondrien vor oxidativem Stress schützt, dann sollten mtHyPer7-exprimierende Zellen eine erhöhte bzw. verminderte Empfindlichkeit gegenüber der Behandlung mit Paraquat aufweisen. Die Behandlung mit niedrigen Paraquat-Konzentrationen führte zu einer Abnahme der Hefewachstumsraten. Darüber hinaus waren die Wachstumsraten von Wildtyp- und mtHyPer7-exprimierenden Zellen in Gegenwart von Paraquat ähnlich (Abbildung 3C,E). Daher erzeugte die Expression des Biosensors keinen signifikanten zellulären Stress in knospenden Hefezellen oder veränderte die Empfindlichkeit der Hefe gegenüber mitochondrialem oxidativem Stress.
Angesichts der Evidenz, dass mtHyPer7 für die Untersuchung von mitochondrialem H2O2 in knospender Hefe geeignet ist, wurde getestet, ob mtHyPer7 mitochondriales H2O2 in Wildtyp-Hefen in der mittleren logarithmischen Phase und Veränderungen des mitochondrialen H2O2 nachweisen kann, die durch extern zugesetztesH2O2 induziert werden. Es wurde einH2O2-Titrationsexperiment durchgeführt und das mittlere Verhältnis von oxidiertem zu reduziertem (O/R) mtHyPer7 in Mitochondrien gemessen.
Die automatisierten Analyseskripte erzeugten mehrere Ausgabedateien.
Das Verhältnisbild (ratio.tif): Ein Z-Stapel, der aus dem Verhältnis der hintergrundkorrigierten, schwelligen 488-nm- und 405-nm-Stapel besteht. Dieser Stapel kann in Fidschi ohne zusätzliche Verarbeitung angezeigt werden. Es wird jedoch empfohlen, den Kontrast zu verstärken und/oder das Bild vor dem Betrachten zu kolorieren, wie in Protokollschritt 4.3 oder 5.6 beschrieben.
Das Maskenbild (mask.tif): Ein Z-Stapel, der aus den für die Analyse verwendeten mitochondrialen Bereichen mit Schwellenwerten besteht. Dieses Bild muss verwendet werden, um die Genauigkeit des Schwellenwerts zu bewerten.
Die für die Analyse verwendeten ROIs (ROIs.zip): Wenn diese Datei zusammen mit dem Quellbild in Fidschi geöffnet wird, werden die ROIs dem Bild überlagert, um Querverweise auf die Ergebnistabelle und das Quellbild zu erstellen. Jeder ROI wird mit einer Zellennummer und einer ROI-Nummer umbenannt.
Messtabellen (NumResults.csv, DenomResults.csv, Results.csv), die die Fläche, den Mittelwert und die integrierte Dichte der Mitochondrien mit Schwellenwert für jede Schicht in den Zähler-, Nenner- bzw. Verhältnisbildern enthalten. In Schichten, in denen Mitochondrien fehlten oder unscharf waren, wird NaN aufgezeichnet.
Eine Protokolldatei (Log.txt), in der die Optionen für die Hintergrund- und Rauschkorrektur, die Schwellenwerte und die Verhältnisberechnung dokumentiert sind.
Das O/R-Verhältnis von mtHyPer7 zeigte eine dosisabhängige Reaktion auf dieH2O2-Konzentration, die bei 1-2 mM extern zugegebenem H2O2 ein Plateau erreichte (Abbildung 7). Überraschenderweise war das HyPer7-Verhältnis in den Zellen, die bei 0,1 mMH2O2exponiert wurden, niedriger als in den Kontrollzellen, obwohl dieser Unterschied statistisch nicht signifikant war. Eine Erklärung für dieses Phänomen könnte eine Hormesis-Reaktion sein, bei der die Exposition gegenüber einem niedrigen Stressorniveau Stressreaktionen hervorrufen kann, wie z. B. antioxidative Mechanismen, die wiederum die Menge an ROS senken, die von der Sonde nachgewiesen werden kann. Im Gegensatz dazu können höhere Stressoren die internen Stressreaktionen überwältigen und zu einem höheren Messwert von HyPer7 führen.
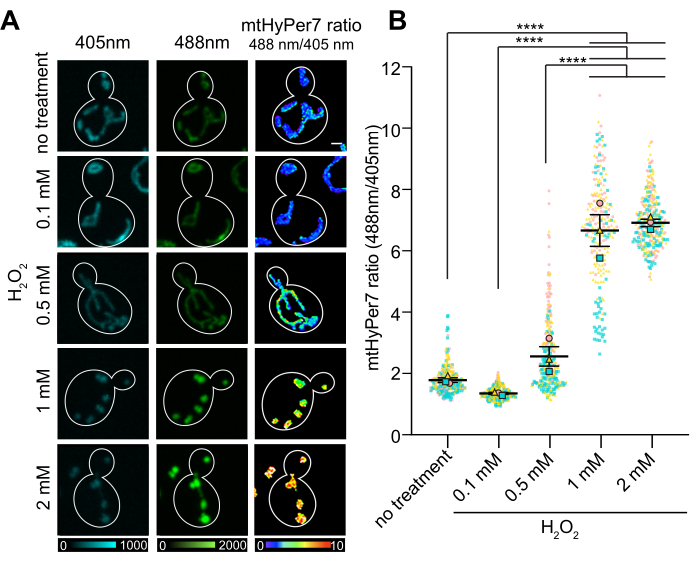
Abbildung 7: Reaktion von mtHyPer7 auf extern zugesetztesH2O2. (A) Maximale Projektion von 405 nm und 488 nm angeregten Bildern und durchschnittliche Intensitätsprojektion von ratiometrischen Bildern von mtHyPer7 in Zellen der mittleren logarithmischen Phase, die bei unterschiedlichen Konzentrationen von H2O2 exponiert wurden. Die Pseudofarbe zeigt das Verhältnis von oxidiertem zu reduziertem mtHyPer7 an (Skala unten). Maßstabsleiste = 1 μm. Der Zellenumriss wird in Weiß dargestellt. n > 100 Zellen pro Bedingung. (B) Quantifizierung des Verhältnisses von mtHyPer7 oxidiert zu reduziert in knospenden Hefezellen, die mit unterschiedlichen Konzentrationen vonH2O2 behandelt wurden. Die Mittelwerte von fünf unabhängigen Versuchen werden gezeigt, mit unterschiedlich geformten und farbigen Symbolen für jeden Versuch. Mittlerer ± SEM des Verhältnisses von oxidiertem:reduziertem mtHyPer7: 1,794 ± 0,07627 (keine Behandlung), 1,357 ± 0,03295 (0,1 mM), 2,571 ± 0,3186 (0,5 mM), 6,693 ± 0,5194 (1 mM), 7,017 ± 0,1197 (2 mM). p < 0,0001 (unidirektionale ANOVA mit dem Tukey-Mehrfachvergleichstest). p-Werte werden wie folgt bezeichnet: ****p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Schließlich zeigten frühere Studien, dass fittere Mitochondrien, die reduzierter sind und weniger Superoxid enthalten, bevorzugt von Hefe-Tochterzellen vererbt werden4 und dass zytosolische Katalasen zu Hefe-Tochterzellen transportiert und dort aktiviert werden42,43,44,45. Diese Studien dokumentieren die asymmetrische Vererbung von Mitochondrien während der Hefezellteilung und eine Rolle dieses Prozesses bei der Fitness und Lebensdauer von Tochterzellen sowie bei der Altersasymmetrie zwischen Mutter und Tochter. Um zu testen, ob Unterschiede inH2O2zwischen Müttern und Knospen bestehen, wurde mtHyPer7 in Knospen und Mutterzellen gemessen. Innerhalb der Hefezellenwurden Unterschiede in der mitochondrialen H2O2-Ablesung beobachtet, und eine subtile, aber statistisch signifikante Abnahme derH2O2-Biosensor-Ablesungwurde in den Mitochondrien in der Knospe im Vergleich zu denen in der Mutterzelle festgestellt (Abbildung 8). Diese Ergebnisse stimmen mit früheren Erkenntnissen überein, dass Mitochondrien in der Knospe besser vor oxidativem Stress geschützt sind. Sie dokumentieren auch, dass mtHyPer7 eine quantitative Ablesung für mitochondriales H2O2 mit zellulärer und subzellulärer Auflösung in knospenden Hefen liefern kann.
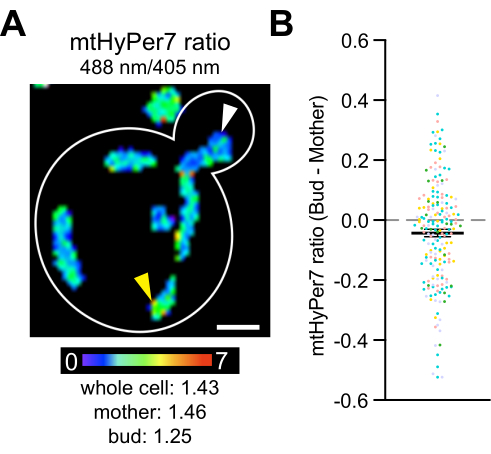
Abbildung 8: Der mitochondrialeH2O2-Spiegelist in der Tochterzelle niedriger. (A) Maximale Projektion eines ratiometrischen Bildes von mtHyPer7 in einer repräsentativen Zelle. Die Pseudofarbe zeigt das Verhältnis von oxidiertem zu reduziertem mtHyPer7 an (Skala unten). Subzelluläre Unterschiede im Verhältnis sind erkennbar (Pfeilspitzen). Maßstabsleiste = 1 μm. Zellenumriss: weiß. (B) Differenz zwischen dem mtHyPer7-Verhältnis in der Knospe und der Mutterzelle. Für jede einzelne Zelle wurde der Wert des Mutterverhältnisses vom Wert des Knospenverhältnisses subtrahiert und als Punkt aufgetragen. n = 193 Zellen, die aus fünf unabhängigen Experimenten gepoolt wurden, dargestellt mit unterschiedlich farbigen Symbolen für jedes Experiment. Mittelwert ± SEM der Differenz zwischen dem mtHyPer7-Verhältnis in der Knospen- und Mutterzelle: -0,04297 ± 0,01266. p = 0,0008 (gepaarter t-Test) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle S1: In dieser Studie verwendete Stämme. Liste der verwendeten Hefestämme. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle S2: In dieser Studie verwendete Plasmide. Liste der verwendeten Plasmide. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle S3: In dieser Studie verwendete Primer. Liste der verwendeten Primer. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: Protokoll für die Konstruktion von Biosensor-Plasmiden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Skripte für die automatisierte Analyse. Für jedes Skript werden Beispieleingabedateien und Ausgabedateien bereitgestellt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Protokoll wird eine Methode zur Verwendung von mtHyPer7 als Biosensor zur Bestimmung von mitochondrialemH2O2in lebenden knospenden Hefezellen beschrieben. Der Biosensor wird mit einer CRISPR-basierten Methode konstruiert und ohne den Einsatz von selektierbaren Markern in eine konservierte genfreie Region im Hefegenom eingebracht. Im Vergleich zu plasmidgetragenen Biosensoren werden integrierte Biosensoren in allen Zellen und in konsistenten Konzentrationen exprimiert, was zuverlässigere Quantifizierungsergebnisse liefert. Es werden keine selektierbaren Marker verwendet, um mtHyPer7-exprimierende Zellen zu erzeugen, was die Verwendung eines breiteren Spektrums von Stammhintergründen ermöglicht und die genetische Modifikation von Biosensor-exprimierenden Zellen erleichtert. Das mtHyPer7-Protein ist korrekt auf die Mitochondrien ausgerichtet, ohne dass dies spürbare Auswirkungen auf die Morphologie, Funktion, Verteilung oder zelluläre Wachstumsraten der Mitochondrien hat. mtHyPer7 zeigt eine dosisabhängige Reaktion auf extern zugeführtesH2O2. Darüber hinaus ist mtHyPer7 in der Lage, über die Heterogenität der mitochondrialen Qualität mit subzellulärer Auflösung zu berichten. Schließlich führt die Verwendung eines konfokalen Spinning-Disk-Mikroskops im Gegensatz zur Weitfeldmikroskopie zur Abbildung von Biosensoren, die auf die Mitochondrien abzielen, zu einer geringeren Photobleichung der Fluorophore und erzeugt hochauflösende Bilder für die Analyse subzellulärer Unterschiede.
Grenzen und alternative Ansätze
Diese Methode eignet sich nicht für die Bildgebung von Zellen für mehr als 10 Minuten, da die Zellen unter dem Deckglas austrocknen. Für eine längerfristige Bildgebung ist es besser, die Agar-Pad-Methode46 zu verwenden oder Zellen in einer mit SC-Medium gefüllten Kulturschale mit Glasboden zu immobilisieren.
Die Wahl des Biosensors sollte sich an der Konzentration des Ziels unter experimentellen Bedingungen orientieren. Wenn die Empfindlichkeit von HyPer7 zu hoch ist, würde eine andere HyPer-Version empfohlen werden, wie z.B. HyPer3 oder HyPerRed47,48. Es ist jedoch zu beachten, dass andere HyPer-Sonden pH-empfindlicher sind. Für eine höhere Sensitivität könnte das auf Peroxiredoxin basierende roGFP besser geeignet sein (roGFP2Tsa2ΔCR)27.
Der stationäre Oxidationszustand desH2O2-Sensorsist sowohl an die Oxidations- als auch an die Reduktionsrate gebunden. Die Oxidationsrate von Biosensoren wird hauptsächlich durchH2O2verursacht, aber die Reduktionsrate hängt von den antioxidativen Reduktionssystemen ab, die in der Zelle und im Organell aktiv sind. Es wurde gezeigt, dass HyPer7 überwiegend durch das Thioredoxin-System im Hefezytosol reduziert wird, und seine Reduktion ist schneller als die von roGFP2Tsa2ΔCR27. Daher sollten die unterschiedlichen Reduktionsmechanismen und Antwortdynamiken der Sonde bei der Interpretation von Messungen von H2O2-Biosensoren berücksichtigt werden. Insbesondere muss für die Ableitung vonH2O2-Wertenaus der Biosensorauslesung davon ausgegangen werden, dass das Reduktionssystem während des Versuchs eine konstante Kapazität aufrechterhält. Als Alternative zu den hier beschriebenen Skripten wurde eine Vielzahl anderer Software für die Analyse von Redoxsensoren49 frei zur Verfügung gestellt.
Kritische Schritte
Bei jedem Biosensor ist es wichtig nachzuweisen, dass der Biosensor selbst den zu messenden Prozess nicht beeinflusst. Daher ist es wichtig, das Wachstum und die mitochondriale Morphologie von Stämmen unter jeder experimentellen Bedingung zu vergleichen. Hier wird die Morphologie der Mitochondrien mit dem MitoTracker Red beurteilt, der die Mitochondrien membranpotentialabhängig färbt. Der Vergleich der Mitochondrien in untransformierten und biosensortransformierten Zellen kann jedoch durch Färbung mit Tetramethylrhodaminmethylester (TMRM), einem alternativen mitochondrialen Vitalfarbstoff zur Messung des Membranpotenzials, oder MitoTracker Green, der Mitochondrien unabhängig vom Membranpotenzial färbt, durchgeführt werden. Wenn schädliche Auswirkungen vermutet werden, kann es hilfreich sein, das Expressionsniveau zu verringern oder die Integrationsstelle zu ändern.
Die Validierung des Dosis-Wirkungs-Verhaltens der Sonde und des Signal-Rausch-Verhältnisses der Bildgebungstechnik ist ebenfalls unerlässlich, um robuste Ergebnisse zu erhalten. Wenn die Variabilität innerhalb einer Gruppe die Variabilität zwischen den Gruppen übersteigt, werden Unterschiede schwer zu erkennen. Die Variabilität innerhalb der Gruppe kann sich aus tatsächlichen Populationsschwankungen oder aus Rauschen im Erkennungsprozess ergeben. Die wichtigsten Schritte zur Erhöhung des Signal-Rausch-Verhältnisses sind die Bilderfassung (Pixelwertbereich und Rauschen), die Hintergrundsubtraktion und die Schwellenwerte.
Auch Rauscheffekte können während der Berechnungsschritte reduziert werden. Der einfachste Ansatz besteht darin, die gewichtete mittlere Intensität aus den Verhältnisbildmessungen (Results.csv) zu berechnen, wobei jedes Pixel das lokale Verhältnis zwischen den Anregungseffizienzen darstellt. Dadurch entsteht ein "pixelweises" Verhältnis. Wenn das Bildsignal-Rausch-Verhältnis jedoch niedrig ist, können robustere Ergebnisse erzielt werden, indem die gewichtete mittlere Intensität für einen ROI sowohl im Zähler- als auch im Nennerkanal berechnet und dann das Verhältnis zwischen diesen beiden gewichteten Mittelwerten berechnet wird ("regionsweises" Verhältnis).
Um eine Schwellenwertmethode auszuwählen, müssen Sie mit dem Befehl Fiji Image | Anpassen | Auto Threshold kann verwendet werden, um alle integrierten Fiji-Methoden automatisch auszuprobieren. Um die Segmentierung (Thresholding) auszuwerten, wird eine gespeicherte Maske mit einem Klick auf Bearbeiten | Auswahl | Auswahl erstellen, dem ROI-Manager hinzufügen (durch Drücken von T) und dann für die RAW-Bilddatei aktiviert. Wenn Mitochondrien nicht ausreichend detektiert werden, sollte eine andere Segmentierungsmethode versucht werden.
Beim Vergleich von Bildern ist es wichtig, alle Bilder mit identischen Abbildungsbedingungen aufzunehmen und alle Bilder mit identischer Kontrastverstärkung anzuzeigen.
Die Bewegung der Mitochondrien muss bei der Optimierung der Bildgebungsbedingungen berücksichtigt werden. Wenn sich die Mitochondrien signifikant zwischen der Anregung bei 405 und 488 nm bewegen, ist das Verhältnisbild nicht genau. Es wird empfohlen, die Belichtungszeit <500 ms zu halten und die Anregung mit der schnellsten verfügbaren Methode (z. B. einem Triggerimpuls oder einem akusto-optischen abstimmbaren Filter) zu ändern. Beim Erfassen eines Z-Stapels sollten beide Anregungen für jeden Z-Schritt durchgeführt werden, bevor zum nächsten Z-Schritt übergegangen wird.
Für die Darstellung der Ergebnisse sind Änderungen des Farbtons (Farbe) für das menschliche Auge offensichtlicher als Änderungen der Intensität. Daher wird der Verhältniswert in eine Farbskala umgewandelt, um die visuelle Interpretation zu erleichtern. Kolorierte Bilder können unmoduliert sein, bei denen alle mitochondrialen Pixel mit der gleichen Helligkeit erscheinen, oder intensitätsmoduliert, bei denen die Pixelintensität im Originalbild verwendet wird, um die Intensitäten im kolorierten Bild festzulegen.
Modifikation und Fehlerbehebung
Als Alternative zur Bestätigung der mitochondrialen Funktion durch Provokation mit Paraquat können Zellen repliziert oder in fermentierbare und nicht fermentierbare Kohlenstoffquellen inokuliert werden.
Für die Hintergrundsubtraktion ist die Rollballsubtraktion (durch Navigieren zu Verarbeiten | Hintergrund subtrahieren...) kann auch verwendet werden, um Ungleichmäßigkeit der Beleuchtung zu beseitigen. Es sollte sichergestellt werden, dass das Vorhandensein von Zellen den Hintergrund, der subtrahiert wird, nicht verändert (indem Sie die Option Hintergrund erstellen aktivieren und das Ergebnis untersuchen).
Zusammenfassend lässt sich sagen, dass die mtHyPer7-Sonde eine konsistente, minimal-invasive Methode zur Beziehung des morphologischen und funktionellen Status von Hefemitochondrien in lebenden Zellen darstellt und die Untersuchung eines wichtigen zellulären Stressor- und Signalmoleküls in einem genetisch behandelbaren, leicht zugänglichen Modellsystem ermöglicht.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Die Autoren danken Katherine Filpo Lopez für die fachkundige technische Unterstützung. Diese Arbeit wurde durch Zuschüsse der National Institutes of Health (NIH) (GM122589 und AG051047) an LP unterstützt.
Für diese Studien wurde die gemeinsame Ressource für konfokale und spezialisierte Mikroskopie des Herbert Irving Comprehensive Cancer Center an der Columbia University verwendet, die zum Teil durch den NIH/NCI Cancer Center Support Grant P30CA013696 finanziert wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | A9126 | |
| Bacto Agar | BD Difco | DF0145170 | |
| Bacto Peptone | BD Difco | DF0118170 | |
| Bacto Tryptone | BD Difco | DF211705 | |
| Bacto Yeast Extract | BD Difco | DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | H5659 | |
| L-leucine | Sigma-Aldrich | L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | L8662 | |
| L-methionine | Sigma-Aldrich | M9625 | |
| L-phenylalanine | Sigma-Aldrich | P5482 | |
| L-tryptophan | Sigma-Aldrich | T8941 | |
| L-tyrosine | Sigma-Aldrich | T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. 856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
Referenzen
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten