Method Article
Визуализация mtHyPer7, ратиометрического биосенсора для митохондриальной перекиси, в живых клетках дрожжей
В этой статье
Резюме
Перекись водорода (H2O2) является одновременно источником окислительного повреждения и сигнальной молекулой. Этот протокол описывает, как измерить митохондриальныйH2O2 с помощью митохондриального HyPer7 (mtHyPer7), генетически кодируемого ратиометрического биосенсора, у живых дрожжей. В нем подробно описывается, как оптимизировать условия визуализации и выполнять количественный клеточный и субклеточный анализ с помощью бесплатного программного обеспечения.
Аннотация
Митохондриальная дисфункция, или функциональные изменения, обнаруживается при многих заболеваниях и состояниях, включая нейродегенеративные и опорно-двигательные расстройства, рак и нормальное старение. В данной работе описан подход к оценке митохондриальной функции в живых клетках дрожжей при клеточном и субклеточном разрешении с использованием генетически кодируемого, минимально инвазивного, ратиометрического биосенсора. Биосенсор, нацеленный на митохондрии HyPer7 (mtHyPer7), обнаруживает перекись водорода (H2O2) в митохондриях. Он состоит из митохондриальной сигнальной последовательности, соединенной с циркулярно перестановленным флуоресцентным белком, и H 2 O2чувствительным доменом бактериального белка OxyR. Биосенсор генерируется и интегрируется в геном дрожжей с помощью системы без маркеров CRISPR-Cas9 для более стабильной экспрессии по сравнению с плазмидными конструкциями.
mtHyPer7 количественно нацелен на митохондрии, не оказывает заметного влияния на скорость роста дрожжей или морфологию митохондрий и обеспечивает количественное измерение митохондриальногоH2O2 в нормальных условиях роста и при воздействии окислительного стресса. В этом протоколе объясняется, как оптимизировать условия визуализации с помощью системы конфокального микроскопа с вращающимся диском и выполнять количественный анализ с помощью свободно доступного программного обеспечения. Эти инструменты позволяют собирать богатую пространственно-временную информацию о митохондриях как внутри клеток, так и между клетками в популяции. Кроме того, описанный здесь рабочий процесс может быть использован для проверки других биосенсоров.
Введение
Митохондрии являются важными эукариотическими клеточными органеллами, которые хорошо известны своей функцией в производстве АТФ путем окислительного фосфорилирования и транспорта электронов1. Кроме того, митохондрии являются местами накопления кальция, синтеза липидов, аминокислот, жирнокислотных и железо-серных кластеров, а также передачи сигнала 2,3. Внутри клеток митохондрии образуют динамическую сеть с характерной морфологией и распределением, которая варьируется в зависимости от типа клетки и метаболического состояния. Кроме того, хотя митохондрии могут сливаться и делиться, не все митохондрии в клетке эквивалентны. Многочисленные исследования документально подтвердили функциональную гетерогенность митохондрий в пределах отдельных клеток по таким характеристикам, как мембранный потенциал и окислительное состояние 4,5,6. Эти изменения в митохондриальной функции частично обусловлены повреждением органеллы мутациями мтДНК (которые происходят с большей частотой, чем в ядерной ДНК) и окислительным повреждением активными формами кислорода (АФК), генерируемыми как внутри, так и вне органелл 7,8,9. Повреждение органелл смягчается митохондриальными механизмами контроля качества, которые восстанавливают повреждение или устраняют митохондрии, поврежденные безвозможности восстановления.
Перекись водорода (H2O2) представляет собой активную форму кислорода, которая является источником окислительного повреждения клеточных белков, нуклеиновых кислот и липидов. Однако Н2О2 также служит сигнальной молекулой, регулирующей клеточную активность посредством обратимого окисления тиолов в белках-мишенях11,12. Н2О2 производится из электронов, которые просачиваются из митохондриальной цепи переноса электронов, и специфическими ферментами, такими как НАДФН-оксидаза и моноаминоксидазы 13,14,15,16,17,18,19,20. Он также инактивируется антиоксидантными системами, в том числе на основе тиоредоксина и глутатиона21,22,23. Таким образом, анализ митохондриальных уровнейH2O2имеет решающее значение для понимания роли этого метаболита в нормальном функционировании митохондрий и клеток, а также в условиях окислительного стресса.
Общей целью этого протокола является обнаружение митохондриальногоH2O 2 с помощью генетически кодируемого ратиометрического биосенсора H 2 O 2HyPer7, который нацелен на органеллу (mtHyPer7). mtHyPer7 представляет собой химеру, состоящую из митохондриальной сигнальной последовательности АТФ9 (пресеквенция Su9), циркулярно перестановочной формы зеленого флуоресцентного белка (GFP) и H2O 2-связывающего домена белка OxyR из Neisseria meningitidis24 (рис. 1). В циркулярно перестановленном GFP N- и C-концы нативного GFP сливаются, а вблизи хромофора образуются новые концы, которые придают белку большую подвижность и большую лабильность его спектральных характеристик по сравнению с нативным GFP25. Взаимодействие домена OxyR mtHyPer7 с H 2 O 2 является высокоаффинным, H 2 O2 селективным и приводит к обратимому окислению консервативных остатков цистеина и образованию дисульфидных мостиков. Конформационные изменения, связанные с окислением OxyR, переносятся на циркулярно перестановленный GFP в mtHyPer7, что приводит к спектральному сдвигу максимума возбуждения хромофора mtHyPer7 с 405 нм в восстановленном состоянии до 488 нм в H2O2-окисленном состоянии26. Таким образом, отношение флуоресценции от mtHyPer7 в ответ на возбуждение при 488 нм против 405 нм отражает окисление зондаH2O2.
В идеале биосенсор должен обеспечивать абсолютное количественное считывание целевой молекулы в режиме реального времени. Однако, к сожалению, это не всегда возможно в реальных измерениях. В случае датчиков окисления, таких как mtHyPer7, на показания в режиме реального времени влияет скорость восстановления дисульфидного мостика. Восстановительные системы, используемые биосенсорами АФК, различаются, и они могут существенно изменить динамику ответа зонда, как показано при сравнении HyPer7, восстановленного системой тиоредоксина, и roGFP2-Tsa2ΔCR, восстановленного глутатионом, в дрожжевых цитозоле27. Таким образом, чтобы сделать вывод об относительной концентрацииH2O2по соотношениям mtHyPer7, необходимо предположить, что восстановительная система сохраняет постоянную емкость в течение всего эксперимента. Несмотря на эти соображения, HyPer7 и связанные с ним зонды использовались в различных контекстах для получения информации оH2O2в живых клетках25,28,29.
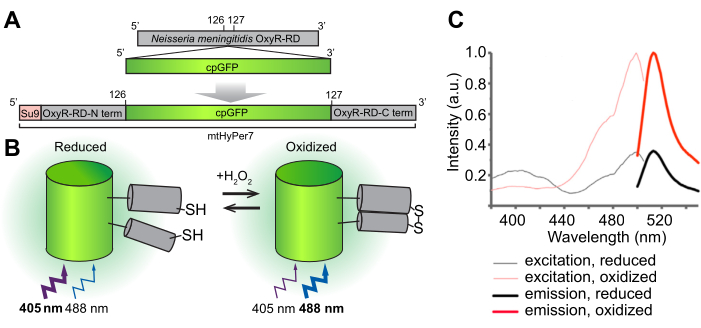
Рисунок 1: Конструкция, молекулярный механизм и спектры возбуждения/излучения биосенсора H 2 O2 mtHyPer7. (A) Зонд mtHyPer7 получен путем вставки циркулярно перестановленного GFP в домен OxyR-RD из Neisseria meningitidis. Он содержит митохондриальную целевую последовательность субъединицы 9 АТФ-синтазы Neurospora crassa (Su9). (B) Иллюстрация механизма чувствительности H 2 O2mtHyPer7. Окисление цистеинов в домене RD увеличивает флуоресцентное излучение при возбуждении на длине волны 488 нм и уменьшает излучение, производимое возбуждением на длине волны 405 нм. (C) Спектры возбуждения и испускания HyPer7 в окисленной и восстановленной формах. Этот рисунок перепечатан с разрешения Pak et al.24. Сокращения: GFP = зеленый флуоресцентный белок; cpGFP = GFP с круговой перестановкой. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Эта ратиометрическая визуализация mtHyPer7 предлагает важные преимущества для количественного определения митохондриальногоH2O2 24,27; Он обеспечивает внутренний контроль концентрации зонда. Кроме того, сдвиг пика возбуждения, вызванный экспозицией Н2О2, не является полным, даже при насыщающих концентрациях Н2О2. Таким образом, визуализация коэффициентов может повысить чувствительность за счет включения в анализ двух спектральных точек.
Используемый здесь зонд mtHyPer7 имеет очень высокое сродство к H 2 O2 и относительнонизкую чувствительность к pH24 и был успешно нацелен на митохондрии Caenorhabditis elegans 30. Этот белок также используется в дрожжах27,31. Тем не менее, предыдущие исследования основывались на плазмидной экспрессии mtHyPer7, что приводит к межклеточной вариабельности экспрессии зонда27. Кроме того, конструкция, описанная в этом протоколе, была интегрирована в консервативную, свободную от генов область на хромосоме X32 с использованием подхода на основе CRISPR для интеграции без маркеров. Экспрессия интегрированного биосенсорного гена также контролируется сильным конститутивным промотором TEF1 (рис. 2). В результате наблюдается более стабильная, последовательная экспрессия биосенсора в популяциях дрожжевых клеток по сравнению с экспрессией биосенсоров, переносимых плазмидами, и клетки, несущие биосенсор, могут размножаться без необходимости использования селективных сред.
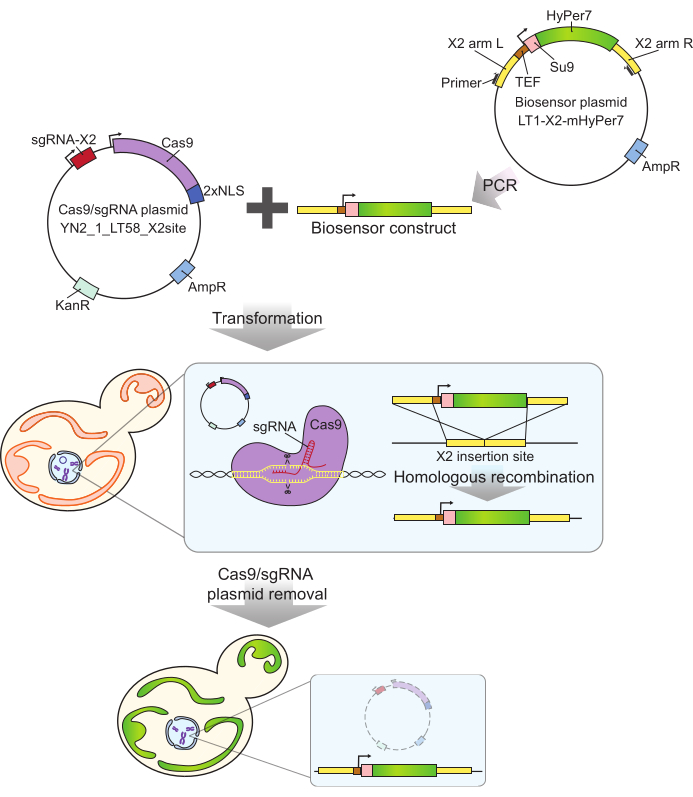
Рисунок 2: Генерация клеток, экспрессирующих mtHyPer7, методом CRISPR. Плазмида (YN2_1_LT58_X2site), содержащая Cas9 и sgRNA, а также ПЦР-амплифицированная мтHyPer7-содержащая биосенсорная конструкция вводятся в почковающиеся дрожжевые клетки путем трансформации ацетата лития. Безгенный сайт вставки на хромосоме X (X2) распознается и разрезается белком Cas9 с sgRNA, а биосенсор интегрируется в геном путем гомологичной рекомбинации. После идентификации успешных трансформантов с помощью микроскопического скрининга, колонной ПЦР и секвенирования плазмида Cas9 удаляется (отверждается) путем выращивания в неселективных средах. Сокращения: sgRNA = однонаправляющая РНК; TEF = фактор усиления транскрипции. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Наконец, mtHyPer7 имеет преимущества по сравнению с другими биосенсорами АФК. Например, органические красители, используемые для обнаружения АФК (например, дигидроэтидий [DHE]2 и MitoSOX3), могут вызывать неравномерное или неспецифическое окрашивание и часто поставляются в виде растворителей, таких как этанол или диметилсульфоксид, которые требуют дополнительного контроля воздействия растворителей. Другим классом биосенсоров АФК являются биосенсоры на основе флуоресцентного резонансного переноса энергии (FRET) (например, редокфтор для окислительно-восстановительного состоянияклеток 4 и перекисные сенсоры HSP-FRET5, OxyFRET 6 и PerFRET6). Эти зонды генетически закодированы и в принципе очень чувствительны и могут быть количественно нацелены на митохондрии с использованием хорошо охарактеризованных митохондриальных сигнальных последовательностей. Тем не менее, существуют проблемы в использовании зондов на основе FRET, в том числе фон из-за перекрестного возбуждения и просвечивания, а также строгие требования к близости и ориентации флуорофоров для возникновения FRET33,34. Кроме того, зонды FRET состоят из двух флуоресцентных белков, которые требуют более крупных конструкций для экспрессии в интересующих клетках по сравнению со зондами, меняющими спектры. Протокол, описанный здесь, был разработан для того, чтобы воспользоваться преимуществами биосенсора на основе HyPer7 и использовать этот компактный, ратиометрический, высокоаффинный, генетически кодируемый зонд для количественной визуализации перекиси в митохондриях у живых дрожжей.
протокол
1. Генерация биосенсорной плазмиды, интеграция в геном дрожжей и оценка нацеливания mtHyPer7 на митохондрии и влияния на морфологию митохондрий, скорость клеточного роста или чувствительность к окислительному стрессу
ПРИМЕЧАНИЕ: См. Дополнительный файл 1, Дополнительную таблицу S1, Дополнительную таблицу S2 и Дополнительную таблицу S3 для конструирования биосенсорных плазмид, штаммов, плазмид и праймеров, соответственно, используемых для конструирования и характеризации биосенсоров. См. Таблицу материалов для получения подробной информации, связанной со всеми материалами, реагентами и инструментами, используемыми в этом протоколе.
- Амплифицируют конструкцию биосенсора из плазмиды биосенсора с помощью праймеров Y290 и Y291 (рис. 2) методом полимеразной цепной реакции (ПЦР).
- Смешайте 500 нг плазмиды Cas9/направляющей РНК (YN2_1_LT58_X2site32) с 50 мкл продукта ПЦР из стадии 1.1 (конструкция биосенсора). Превратите смесь в почковающиеся дрожжи с помощью метода ацетата лития35 и выберите трансформанты на планшетах YPD, содержащие 200 мг/мл G418.
- Скрининг трансформантов-кандидатов методом ПЦР-амплификации геномной ДНК с использованием праймеров Y292 и Y293. Для трансформаторов, несущих вставку ожидаемого размера (положительная: 3,5 kb; отрицательная: 0,3 kb), последовательность вставленной области для дальнейшей проверки.
- Оцените влияние биосенсора на рост и функцию митохондрий (рис. 3). Если биосенсор влияет на функцию клеток или митохондрий, попытайтесь свести к минимуму этот эффект, изменив промотор, сайт интеграции или родительский штамм.
- Определите влияние биосенсорной конструкции на скорость роста в присутствии и отсутствии окислительного стрессора (например, параквата), как описано ранее36.
- Разбавляйте ячейки средней логарифмической фазы до оптической плотности 600 нм (OD 600) 0,0035 в200 мкл соответствующей среды с обработкой и без нее в каждой лунке 96-луночной пластины с плоским дном. Измеряйте оптическую плотность культуры каждые 20 мин в течение 72 ч с помощью планшетного ридера. Рассчитайте максимальную скорость роста (наклон) как максимальное изменение наружного диаметра за 240-минутный интервал в течение 72-часового курса.
- Визуализируйте клетки с помощью флуоресцентной микроскопии и оцените яркость и морфологию митохондрий, как описано ранее37.
- Вырастите клетки до средней логарифмической фазы, окрасьте митохондрии 250 нМ MitoTracker Red в течение 30 минут и дважды промойте перед визуализацией. Захват Z-стопок глубиной 6 мкм с интервалом 0,3 мкм на широкопольном или конфокальном флуоресцентном микроскопе и визуальный осмотр. Ищите митохондрии, образующие удлиненные трубчатые структуры.
- Определите влияние биосенсорной конструкции на скорость роста в присутствии и отсутствии окислительного стрессора (например, параквата), как описано ранее36.
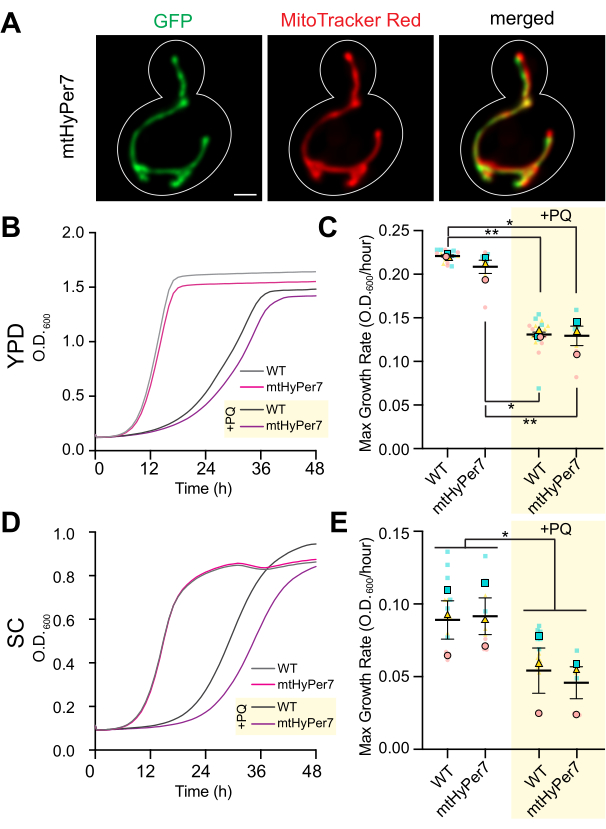
Рисунок 3: mtHyPer7 нацелен на митохондрии и не влияет на морфологию митохондрий, рост клеток или чувствительность к окислительному стрессу. (A) Морфология митохондрий в живых дрожжевых клетках, экспрессирующих mtHyPer7. Левая панель: mtHyPer7, визуализированный с возбуждением 488 нм. Средняя панель: митохондрии, помеченные 250 нМ MitoTracker Red. Правая панель: объединенные изображения. Показаны проекции максимальной интенсивности. Контур ячейки показан белым цветом. Масштабная линейка = 1 мкм. (B,C) Кривые роста и максимальная скорость роста клеток дикого типа и клеток, экспрессирующих mtHyPer7, выращенных в присутствии (+PQ) или отсутствии 2,5 мМ параквата в средах YPD. (Д,Э) Кривые роста и максимальная скорость роста клеток дикого типа и mtHyPer7, экспрессирующих мтHyPer7, выращенных в присутствии (+PQ) или отсутствии 2,5 мМ параквата в средах SC. Все кривые роста являются средними значениями трех независимых репликаций. Максимальные темпы роста представлены в виде среднего значения ± стандартной ошибки среднего значения (SEM). Анализ кривой роста проводили путем разбавления ячеек средней логарифмической фазы до наружного диаметра600 0,0035 в 200 мкл соответствующей среды в каждую лунку 96-луночной пластины с плоским дном. Наружный диаметр культуры измеряли каждые 20 мин в течение 72 ч с помощью планшетного ридера. Каждый штамм/состояние был нанесен на три экземпляра и построен график усредненной скорости роста. Максимальная скорость роста (наклон) рассчитывалась с использованием изменения наружного диаметра в течение 240 мин интервала в течение 72 ч. Аббревиатуры: WT = дикий тип; PQ = паракват. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Культивирование клеток и подготовка к визуализации (рис. 4)
- Размножают клетки в синтетической среде до средней логарифмической фазы для визуализации. Культура средней фазы объемом 5 мл обеспечивает достаточное количество клеток для четырех или пяти предметных стекол и в общей сложности >100 почковавшихся клеток для анализа.
- Утром, за день до эксперимента, готовят жидкие прекультуры, засеивая 5 мл синтетической полной среды (СК) в пробирку с коническим дном объемом 50 мл с одной колонией дрожжевых клеток.
- Инкубируют прекультуру в орбитальном шейкере при 200 об/мин и 30 °C в течение 6-8 ч. Измеряют OD 600 прекультуры, которая должна быть в средней логарифмической фазе: ~0,5-1 × 107 клеток/мл, OD600 ~0,1-0,3.
- Подготовьте культуру в середине логарифмической фазы, используя прекультуру для визуализации на следующий день. Рассчитайте количество прекультуры, необходимое для культивирования в середине логарифмической фазы после ночного роста (8-16 ч). При выращивании клеток в среде SC время удвоения составляет ~2 ч. Таким образом, объем (V) прекультуры для посева 5 мл ночной культуры рассчитывают по уравнению (1):
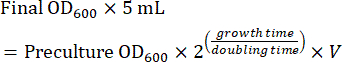 (1)
(1) - Посев 5 мл среды SC в пробирку с коническим дном объемом 50 мл с количеством прекультуры, рассчитанным на этапе 2.1.3. Выращивать в орбитальном шейкере при 200 об/мин и 30 °C в течение 8-16 ч.
- В день визуализации убедитесь, что культура, полученная на шаге 2.1.4, находится в средней фазе логарифма (OD600 ~0,1-0,3). Концентрируют клетки из 1 мл культуры средней логарифмической фазы центрифугированием при 6 000 × г в течение 30 с. Удалите надосадочную жидкость, оставив в пробирке 10-20 мкл надосадочной жидкости. Ресуспендируйте гранулы клеток, осторожно смешивая их с остаточной средой с помощью микропипетки.
- Используйте воздуходувку или безворсовую салфетку, чтобы удалить пыль со предметного стекла микроскопа и добавить 1,8 мкл клеточной суспензии к предметному стеклу. Накройте ячейки стеклянным покровным стеклом #1,5 (толщина 170 мкм), медленно опуская его под углом, чтобы избежать образования пузырьков.
- Изображение сразу же и выбросьте слайд через 10 минут визуализации.
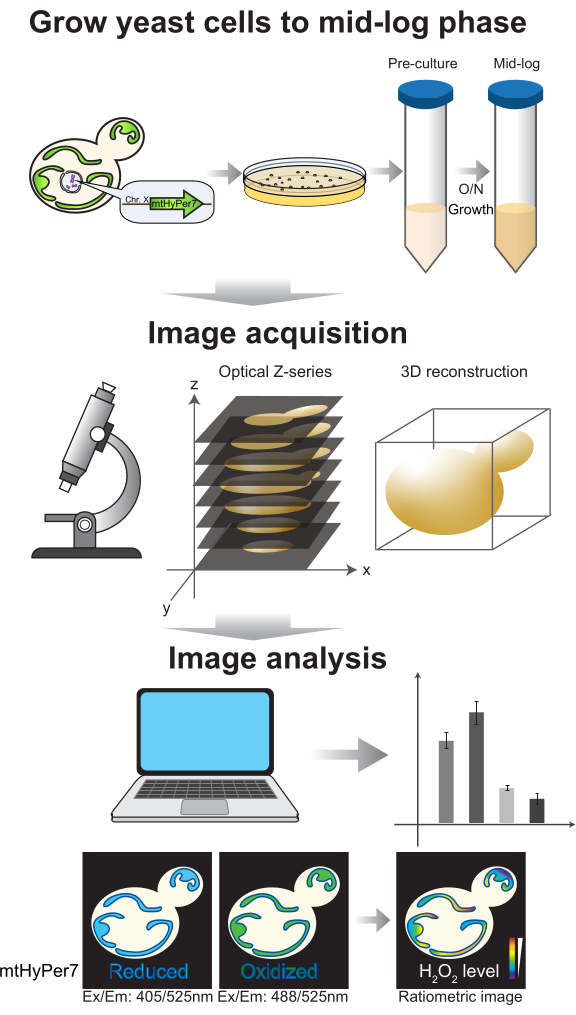
Рисунок 4: Рост клеток и визуализация. Почковающиеся дрожжевые клетки, экспрессирующие mtHyPer7, выращивают до середины логарифмической фазы. Изображения серии Z собираются с помощью конфокальной микроскопии с вращающимся диском, а затем подвергаются 3D-реконструкции и анализу. Смотрите разделы протокола 2-3. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Оптимизация условий визуализации и сбора изображений (рис. 5)
- Выберите режим визуализации. Для оптического секционирования без постобработки предпочтительнее конфокальный прибор с вращающимся диском. Однако, если сигнал слабый или этот прибор недоступен, используйте широкоугольную визуализацию, гарантируя, что широкоугольные изображения деконволютированы для устранения размытия вне фокуса, как описано ранее38.
- Выберите оптику. Используйте масляный иммерсионный объектив с высокой числовой апертурой, например 100x/1.45 Plan-Apochromat.
- Выберите длины волн возбуждения и излучения. Для конфокальной визуализации вращающегося диска используют лазерное возбуждение на длинах волн 405 нм и 488 нм и стандартный эмиссионный фильтр GFP. Для широкоугольной визуализации используйте светодиод (LED) или возбуждение лампы, но убедитесь, что настройка фильтра позволяет изменять возбуждение при прохождении излучения через стандартный фильтр GFP.
ПРИМЕЧАНИЕ: Это можно сделать, например, удалив фильтр возбуждения из куба GFP и используя светодиод или колесо фильтров для выбора возбуждения. - Выберите время экспозиции и интенсивность освещения.
- Установите условия захвата, которые дают легко обнаруживаемый сигнал и приемлемое разрешение в каждом канале флуоресценции. Например, на конфокальном микроскопе с вращающимся диском и камерой sCMOS используйте биннинг 2 x 2, мощность лазера 20-40% и экспозицию 200-600 мс.
- Изучите гистограмму изображения. В 12-битном изображении (4 096 возможных уровней серого) убедитесь, что общий динамический диапазон значений пикселей составляет не менее нескольких сотен уровней серого без насыщенности (рис. 5A). Кроме того, убедитесь, что диапазон на порядок выше уровня шума. Вычислите уровень шума как стандартное отклонение значений пикселей в свободной от ячеек области изображения, измеренное, как описано в шаге 4.1.3.1.
- Тест на фотообесцвечивание или митохондриальный стресс, индуцированный визуализацией, в выбранных условиях визуализации. Если наблюдается чрезмерное фотообесцвечивание или повышение митохондриальногоH2O2, уменьшите мощность лазера и увеличьте экспозицию или биннинг.
- Соберите серию покадровых изображений без задержки между съемками, чтобы оценить влияние условий визуализации на стабильность сигнала и окислительный стресс в митохондриях. Используя программное обеспечение для сбора данных микроскопом или ImageJ, измерьте среднее значение пикселя в каждом канале флуоресценции, чтобы убедиться в стабильности сигнала (изменение <5%; Рисунок 5Б). Если эксперимент не включает в себя покадровую визуализацию, убедитесь, что флуоресценция стабильна в течение двух-трех повторяющихся Z-стеков (25-35 экспозиций).
ПРИМЕЧАНИЕ: Снижение флуоресценции обоих каналов может указывать на фотообесцвечивание; однако снижение флуоресценции, возбужденной с длиной волны 405 нм, сопровождающееся увеличением возбужденного канала с длиной волны 488 нм, может указывать на повышение митохондриального уровняH2O2 и индуцированный визуализацией окислительный стресс в органелле.
- Соберите серию покадровых изображений без задержки между съемками, чтобы оценить влияние условий визуализации на стабильность сигнала и окислительный стресс в митохондриях. Используя программное обеспечение для сбора данных микроскопом или ImageJ, измерьте среднее значение пикселя в каждом канале флуоресценции, чтобы убедиться в стабильности сигнала (изменение <5%; Рисунок 5Б). Если эксперимент не включает в себя покадровую визуализацию, убедитесь, что флуоресценция стабильна в течение двух-трех повторяющихся Z-стеков (25-35 экспозиций).
- Получение изображений. При сборе стеков Z убедитесь, что интервал Z одинаков для всех изображений в наборе данных, и включите всю ячейку. Для почковавшихся дрожжей изображение с Z-интервалом 0,5 мкм и общей глубиной штабеля 6 мкм. Получение изображений в проходящем свете для документирования границ ячеек.
- Анализ изображений вручную или в полуавтоматическом режиме с помощью сценариев, доступных в дополнительном файле 2 и в https://github.com/theresaswayne/biosensor, с использованием фиджийского распределения ImageJ39 и статистического программного обеспечения R (рисунок 6). В инструкциях к программному обеспечению иерархические команды меню выделены жирным шрифтом с символом «|», что указывает на последовательность выбора меню. Параметры и кнопки выделены полужирным шрифтом.
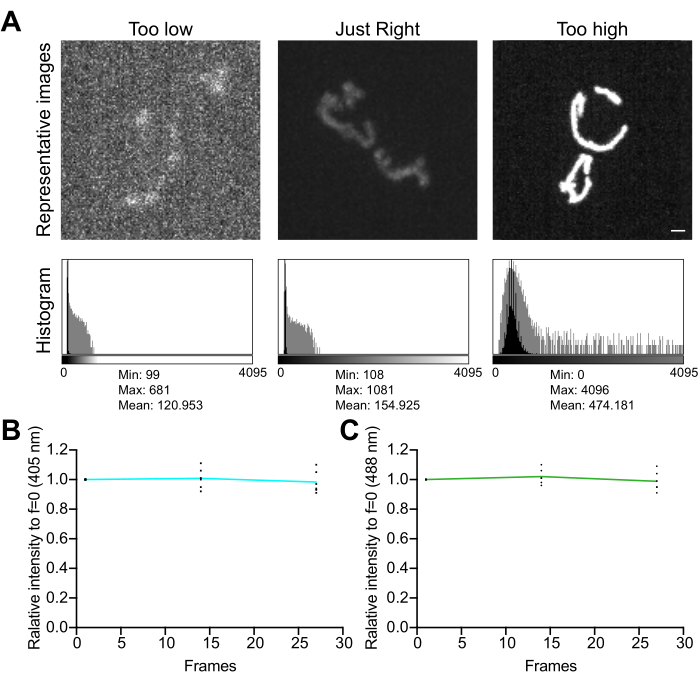
Рисунок 5: Оптимизация визуализации . (A) Оценка изображений и гистограмм для правильного диапазона интенсивности. Показаны проекции максимальной интенсивности конфокальных изображений вращающегося диска. Гистограммы показаны как с линейной осью Y (черная), так и с осью Y логарифмической шкалы (серая), чтобы проиллюстрировать динамический диапазон изображения. Левые панели: зашумленное изображение с низкой интенсивностью и динамическим диапазоном. Центральные панели: изображение с приемлемым динамическим диапазоном (~1 000 уровней серого) и интенсивностью. Правые панели: изображение с неправильной контрастностью для получения чрезмерной насыщенности. Масштабная линейка = 1 мкм. (B,C) Анализ фотообесцвечивания mtHyPer7. Последовательные Z-стеки собирались без задержки, Z-стеки суммировались, а средняя интенсивность митохондрий измерялась и нормализовалась до первой временной точки. Показаны результаты из первых трех временных точек (27 экспозиций). (B) Длина волны возбуждения: 405 нм. (C) Длина волны возбуждения: 488 нм. Показанные значения представляют собой средние значения по трем ячейкам из каждого из трех независимых испытаний. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Полуавтоматический анализ со скриптами
- Создавайте и измеряйте изображения соотношений с помощью сценария анализа биосенсоров (например, biosensor.ijm или biosensor-image-subtraction.ijm).
- Выберите сценарий для использования. Протокол для использования каждого скрипта аналогичен; Любые отличия будут указаны в тексте.
- biosensor.ijm: В этом сценарии фон и шум корректируются с помощью выбранных пользователем областей изображения, фиксированных значений или без вычитания. Выберите методы коррекции фона и шума самостоятельно.
- biosensor-image-subtraction.ijm: В этом сценарии фон и шум обрабатываются одним и тем же выбранным пользователем методом, который может быть одним из следующих: пустое изображение, выбранная пользователем область в изображении, фиксированное значение или отсутствие коррекции.
- На Фиджи откройте многоканальное изображение стека Z, полученное на шаге 3.5. Откройте нужный файл скрипта анализа биосенсоров. Запустите сценарий, нажав кнопку «Выполнить » в окне «Редактор сценариев ». В появившемся диалоговом окне введите запрашиваемую информацию.
- Выберите номера каналов числителя и знаменателя для вычисления коэффициента. Для mtHyPer7 числителем является канал, возбуждаемый на длине волны 488 нм, а знаменателем — канал, возбуждаемый на длине волны 405 нм. Выберите номер канала изображения в проходящем свете, если он присутствует, или 0, если его нет.
- Выберите желаемый метод вычитания фона из следующих четырех вариантов. Если фон относительно однородный, выберите « Выбрать область изображения», которая непосредственно измеряет уровень фона на изображении. Если фон существенно различается по полю, используйте сценарий biosensor-image-subtraction.ijm и выберите Пустое изображение (чтобы собрать пустое изображение для коррекции, захватите многоканальный стек Z с идентичными условиями захвата в бесклеточном поле зрения или со слайда, сделанного с помощью бесклеточной питательной среды). Фиксированное значение позволяет ввести ранее измеренное фоновое значение. Ни один из них не оставляет фон без коррекции, но может снизить точность измерения.
- Выберите нужный метод вычитания шума. Значение шума используется в качестве нижнего порога на изображениях маскированных каналов с вычитанием фона, чтобы уменьшить эффект случайного изменения показаний детектора. Выберите « Выбрать область изображения» или «Фиксированное значение », чтобы разрешить ввод ранее измеренного уровня шума, что обычно хорошо работает, поскольку уровни шума постоянны, если условия изображения остаются постоянными. Кроме того, можно выбрать «Нет » и использовать значение 1 в качестве нижнего порога, что может увеличить вариативность измерений.
- Выберите пороговый алгоритм для точного и последовательного обнаружения митохондрий; Рекомендуется использовать Otsu или MaxEntropy . В идеале использовать один и тот же алгоритм для всех изображений в эксперименте, но обеспечить точное распознавание митохондрий. Используйте другой метод определения пороговых значений, если во время эксперимента происходят изменения в морфологии.
- Выберите количество областей интереса (ROI) в ячейке. Например, при измерении различий между матерью и бутоном выберите 2.
- Выберите выходную папку, в которой будут сохранены изображения измерений и соотношений.
- Следуйте инструкциям по коррекции фона и шума.
- Выбор области (если применимо): Если для измерения фона или шума был выбран параметр Выбрать область изображения, следуйте инструкциям, чтобы нарисовать фоновую область (за пределами любых ячеек или флуоресцентных артефактов) с помощью инструмента ROI прямоугольника. Нарисовав область, нажмите кнопку ОК.
- Ввод фиксированного значения (если применимо): Если для измерения фона или шума было выбрано Фиксированное значение , следуйте инструкциям, чтобы ввести значения фона и/или шума для каждого канала флуоресценции.
- Пустое эталонное изображение (если применимо): в сценарии biosensor-image-subtraction.ijm, если для коррекции фона или шума было выбрано пустое изображение , следуйте инструкциям, чтобы выбрать пустой файл изображения.
- Отметьте ROI для измерения. В культурах средней логарифмической фазы ограничьте анализ почковавшимися клетками.
- Нарисуйте ROI, соответствующие отдельным клеткам или субклеточным областям, на основе изображения в светлом поле. ROI не обязательно должен точно совпадать с контуром клетки, так как будут измеряться только пороговые митохондрии в пределах ROI. Кроме того, можно открыть ранее сохраненный набор ROI: в Диспетчере ROI нажмите Дополнительно, затем выберите файл ROI.
- Нажимайте клавишу T после создания каждого ROI, чтобы добавить выбранный ROI в ROI Manager. В диспетчере рентабельности инвестиций установите флажок Показать все, чтобы задокументировать помеченные ячейки. Каждый добавленный регион будет отображаться в виде пронумерованного элемента в списке ROI Manager. Если вы анализируете более одного ROI на клетку (например, материнскую и почку), отметьте ROI в одинаковом порядке для каждой анализируемой клетки.
- После того, как все требуемые значения рентабельности инвестиций будут добавлены в Диспетчер рентабельности инвестиций, нажмите кнопку ОК в диалоговом окне Пометить ячейки .
- Выберите формат таблицы измерений. В появившемся диалоговом окне «Мультиизмерение » установите флажок «Измерить все срезы». Установите флажок Одна строка на срез, чтобы создать таблицу нужного формата. Используйте process_multiROI_tables. Скрипт R для обработки таблиц, созданных с параметром Одна строка на срез ; не устанавливайте флажок Добавить результаты. Повторите этот шаг 3 раза (для измерения числителя [488], знаменателя [405] и соотношения [488/405] изображений).
- Скрипт сохранит выходные файлы в папку, выбранную на шаге 4.1.2.6.
- Выберите сценарий для использования. Протокол для использования каждого скрипта аналогичен; Любые отличия будут указаны в тексте.
- Расчет средневзвешенных коэффициентов для каждого региона или ячейки
- Используя результаты, полученные на предыдущем шаге, рассчитайте средневзвешенные коэффициенты для каждой области или ячейки, используя уравнение (2). Вычислите соотношение «по пикселям» или «по регионам» (подробнее см. в обсуждении).
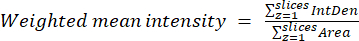 (2) См.
(2) См.
ПРИМЕЧАНИЕ: Значения площади и интегрированной плотности (IntDen) включают только пиксели в пределах пороговых митохондрий. Этот расчет можно автоматизировать с помощью process_multiROI_tables. Скрипт R и статистическое программное обеспечение R.
- Используя результаты, полученные на предыдущем шаге, рассчитайте средневзвешенные коэффициенты для каждой области или ячейки, используя уравнение (2). Вычислите соотношение «по пикселям» или «по регионам» (подробнее см. в обсуждении).
- Сгенерируйте цветное изображение с пропорциями. Поскольку изменения оттенка (цвета) более очевидны для человеческого глаза, чем изменения интенсивности, преобразуйте значение соотношения в цветовую шкалу для более легкой визуальной интерпретации. Скрипт colorize_ratio_image.ijm раскрашивает изображение маскированного соотношения.
- На Фиджи откройте изображение стека коэффициента Z, созданное на шаге 4.1.6. Откройте файл скрипта colorize_ratio_image.ijm. Запустите сценарий, нажав кнопку «Выполнить » в окне «Редактор сценариев ». В появившемся диалоговом окне введите запрашиваемую информацию.
- Метод раскрашивания: В параметре «Без модуляции » все митохондриальные пиксели отображаются с одинаковой яркостью. Тем не менее, некоторые изображения могут выглядеть зашумленными, так как как как тусклые и яркие пиксели вносят свой вклад в изображение пропорций. Чтобы уменьшить этот эффект, используйте параметр «Интенсивность с модуляцией ».
- Минимальное и максимальное отображаемое значение: эти значения управляют диапазоном значений соотношений, которые будут раскрашены. Выбирайте значения, близкие к средним минимальным и максимальным значениям, наблюдаемым в эксперименте (на основе средневзвешенных коэффициентов, рассчитанных на шаге 4.2.1). В ходе эксперимента обязательно получите все изображения с одинаковыми условиями визуализации и отобразите все изображения с одинаковыми минимальными и максимальными значениями.
- Режим проекции: Z-стеки отображаются в виде проекций, чтобы показать всю митохондриальную популяцию. Проекция создается перед раскрашиванием. Выберите «Максимум» для проекции максимальной интенсивности (с сохранением максимального коэффициента и значений интенсивности) или «Среднее» для проекции средней интенсивности.
- Папка вывода: выберите папку, в которой будут сохранены раскрашенные изображения.
- Если была выбрана опция Без модуляции , выберите цветовую схему (таблица подстановки; LUT) в появившемся диалоговом окне. Используйте таблицы LUT Fire или Rainbow RGB , встроенные в Fiji, или любые другие таблицы LUT в формате .lut ImageJ (импорт из файла LUT). Рекомендуется использовать Rainbow Smooth40 LUT (включен в Supplemental File 2 и на GitHub).
- Скрипт сохраняет выходные файлы в папку, выбранную на шаге 4.3.1.4. К ним относятся цветное изображение пропорций (Color_RGB.tif) и цветное изображение пропорций с калибровочной полосой, показывающей соответствие между значениями соотношения и цветом изображения (Color_with_bar.tif).
- На Фиджи откройте изображение стека коэффициента Z, созданное на шаге 4.1.6. Откройте файл скрипта colorize_ratio_image.ijm. Запустите сценарий, нажав кнопку «Выполнить » в окне «Редактор сценариев ». В появившемся диалоговом окне введите запрашиваемую информацию.
5. Ручной анализ
ПРИМЕЧАНИЕ: Этот подход занимает больше времени, но обеспечивает гибкость в предварительной обработке и установке порогового значения.
- Поправьте на фон.
- Установить параметры на Фиджи.
- Нажмите « Анализировать» | Установите измерения. В появившемся диалоговом окне установите флажки Area, Mean, StdDev, IntDen и Display Label. Установите десятичные знаки равным 3.
- Нажмите « Редактировать» | Опции | Ввод/вывод. В появившемся диалоговом окне установите флажки Сохранить номера строк и Сохранить заголовки столбцов.
- Чтобы повысить чувствительность вычисления соотношения, вычтите фон из каждого канала флуоресценции. Если фон относительно однородный, измерьте среднюю интенсивность свободной от ячеек области на изображении и вычтите это значение из всего изображения (шаг 5.1.2.1). В качестве альтернативы, если фон существенно различается по полю, используйте пустое изображение для коррекции (шаг 5.1.2.2.).
- Чтобы вычесть выбранный пользователем регион, нажмите на Изображение | Цвет | Разделите каналы и оставьте все изображения каналов открытыми, так как они понадобятся позже. Для каждого флуоресцентного канала нарисуйте ROI на фоне (за пределами любых ячеек) и нажмите Analyze | Измерить или для стеков щелкните Изображение | Стеки | Стек мер. Обратите внимание на среднее значение ROI, которое отображается в таблице Результаты . Нажмите « Редактировать» | Выберите «Нет», затем «Обработать | Математика | Вычитание. В появившемся диалоговом окне введите среднее измеренное значение фона, округленное до ближайшего целого числа.
ПРИМЕЧАНИЕ: Округление предотвращает ошибки с бинарными операциями в дальнейшем. - Чтобы вычесть пустое изображение из файла данных, возьмите пустое изображение из полностью свободного от клеток поля зрения или из слайда, подготовленного с использованием бесклеточной питательной среды. Нажмите « Процесс» | Калькулятор изображений. В появившемся диалоговом окне задайте для операции значение Вычитание, а для параметров Image1 и Image2 — изображение ячейки и пустое изображение соответственно. Отметьте Создать новое окно и 32-битный результат.
- Чтобы вычесть выбранный пользователем регион, нажмите на Изображение | Цвет | Разделите каналы и оставьте все изображения каналов открытыми, так как они понадобятся позже. Для каждого флуоресцентного канала нарисуйте ROI на фоне (за пределами любых ячеек) и нажмите Analyze | Измерить или для стеков щелкните Изображение | Стеки | Стек мер. Обратите внимание на среднее значение ROI, которое отображается в таблице Результаты . Нажмите « Редактировать» | Выберите «Нет», затем «Обработать | Математика | Вычитание. В появившемся диалоговом окне введите среднее измеренное значение фона, округленное до ближайшего целого числа.
- Установить параметры на Фиджи.
- Чтобы ограничить анализ митохондриями, выполните сегментацию. Поскольку интенсивность каждого канала может меняться в зависимости от состояния биосенсора, используйте сумму двух каналов для последовательного определения площади митохондрий.
- Чтобы создать итоговое изображение, нажмите на Process | Калькулятор изображений. В появившемся диалоговом окне задайте для операции значение Добавить, а для параметров Image1 и Image2 — два флуоресцентных канала с вычитанием фона в любом порядке. Отметьте Create New Window и 32-bit Result и дождитесь появления итогового изображения.
- Установите пороговое значение для определения митохондрий на суммарном изображении.
- Нажмите на изображение | Регулировка | Порог. В появившемся окне « Порог » отметьте « Темный фон » и «Гистограмма стека». Задайте для параметра Method нужный алгоритм (например, Otsu или MaxEntropy). Используйте автоматическое пороговое значение для воспроизводимости, но если автоматический метод не подходит, отрегулируйте порог вручную.
ПРИМЕЧАНИЕ: В идеале один и тот же алгоритм должен использоваться для всех изображений в эксперименте, но изменения морфологии во время эксперимента могут потребовать другого метода порогового значения в некоторых условиях. - Когда пороговое значение станет удовлетворительным, нажмите кнопку Применить. В появившемся диалоговом окне выберите «Преобразовать в маску». В появившемся диалоговом окне поставьте галочку напротив пункта Черный фон и не устанавливайте галочки. Сохраните полученное изображение маски для оценки точности сегментации.
- Нажмите на изображение | Регулировка | Порог. В появившемся окне « Порог » отметьте « Темный фон » и «Гистограмма стека». Задайте для параметра Method нужный алгоритм (например, Otsu или MaxEntropy). Используйте автоматическое пороговое значение для воспроизводимости, но если автоматический метод не подходит, отрегулируйте порог вручную.
- Преобразуйте значения маски из 0 и 255 в 0 и 1 соответственно, нажав на Process | Математика | Делить. Установите значение 255 и при появлении запроса выберите параметр обработки всех изображений.
- Примените маску к флуоресцентным каналам с вычитанием фона, щелкнув Process | Калькулятор изображений. В появившемся диалоговом окне задайте для операции значение Умножение. Задайте для параметров Image1 и Image2 канал числителя и маску соответственно. Поставьте галочку напротив пункта Создать новое окно и 32-битного результата; Повторите умножение маски с каналом знаменателя.
- Подготовьте каждый маскируемый канал к расчету соотношения, установив для фоновых пикселей значение NaN («не число»).
- Выберите канал замаскированного числителя и нажмите на Изображение | Регулировка | Порог. В окне « Порог » нажмите кнопку «Установить» и в появившемся диалоговом окне установите минимум на расчетный уровень шума или на 1, а максимальное оставьте как есть.
- В окне Пороговое значение нажмите кнопку Применить. В следующем диалоговом окне выберите «Задать значение NaN». Повторите то же самое для канала замаскированного знаменателя.
- Сгенерируйте изображение соотношения.
- Нажмите «Процесс» | Калькулятор изображений. В появившемся диалоговом окне задайте для параметра operation значение Divide. Задайте для параметров Image1 и Image2 каналы маскированного числителя и знаменателя с вычитанием фона соответственно. Для mtHyPer7 числителем является окисленная форма, возбуждаемая при длине волны 488 нм, а знаменателем — восстановленная форма, возбуждаемая при длине волны 405 нм. Следовательно, более высокие коэффициенты указывают на более высокийH2O2.
- Отметьте Создать новое окно и 32-битный результат. Сохраните изображение пропорций для анализа.
- Отметьте и количественно определите области, представляющие интерес. Каждая клетка или субклеточная область выбирается и сохраняется в качестве ROI в ROI Manager. ROI не обязательно должны идеально совпадать с контурами клеток, так как будут измеряться только замаскированные участки митохондрий.
- Используя изображение в проходящем свете для предотвращения смещения, создайте ROI, соответствующие отдельным клеткам (или субклеточным областям). В культурах средней логарифмической фазы ограничьте анализ дрожжевыми клетками, несущими почки, которые активно участвуют в клеточном делении. Нажимайте клавишу T после создания каждого ROI, чтобы добавить его в ROI Manager. Установите флажок Показать все , чтобы задокументировать ячейки, которые были помечены.
- Нажмите на изображение коэффициента, созданное выше, и в Менеджере ROI нажмите Еще ... | МультиМера. В появившемся диалоговом окне установите флажок Измерить все срезы. Не устанавливайте флажок Добавить результаты. Установите флажок Одна строка на срез, чтобы создать таблицу нужного формата. В process_multiROI_tables. Скрипт R будет обрабатывать таблицы, созданные с параметром Одна строка на срез в статистическом программном обеспечении R.
- Сохраните результаты. Нажмите на окно « Результаты », затем «Файл | Сохраните таблицу результатов в формате .csv или .xls. Задайте имя файла так, чтобы оно совпадало с именем изображения.
- Сохраняйте рентабельность инвестиций. В Диспетчере ROI сначала убедитесь, что ROI не выбраны: нажмите Отменить выбор, затем Еще | Сохраните. Откройте сохраненные ROI вместе с исходным изображением на Фиджи, чтобы сопоставить измерения с изображением.
- Вычислите средневзвешенные отношения для каждой ячейки или области, используя результаты, полученные на предыдущем шаге, и уравнение (3). Вычислите соотношение «по пикселям» или «по регионам» (подробнее см. в обсуждении).
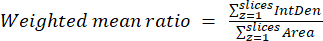 (3) См.
(3) См.
ПРИМЕЧАНИЕ: Значения площади и интегрированной плотности включают только пиксели в пределах пороговых митохондрий. Этот расчет можно автоматизировать с помощью process_multiROI_tables. R в статистическом программном обеспечении R. - Сгенерируйте цветное изображение с пропорциями.
ПРИМЕЧАНИЕ: Раскрашенные изображения могут быть немодулированными, когда все митохондриальные пиксели отображаются с одинаковой яркостью, или с модуляцией интенсивности, когда интенсивность пикселей в исходном изображении используется для установки интенсивности в раскрашенном изображении.- Чтобы получить немодулированное цветное изображение, выполните следующие действия.
- Откройте сгенерированное выше изображение пропорций. Нажмите на изображение | Дублировать , чтобы создать копию изображения, а затем закрыть исходное изображение.
- Если изображение представляет собой стек Z, выберите один срез или создайте проекцию Z, чтобы просмотреть все митохондрии. Используйте либо проекцию максимальной интенсивности (с сохранением максимального коэффициента и значений интенсивности в каждой координате пикселя XY), либо проекцию средней интенсивности.
- Нажмите на изображение | Lookup Tables и установите LUT на желаемую цветовую схему (например, Rainbow RGB или Fire [доступно по умолчанию в ImageJ]). Кроме того, нажмите « Файл | Импортируйте LUT и выберите любой нужный LUT в формате .lut ImageJ, например Rainbow Smooth40 (включен в дополнительный файл 2 и на GitHub). Убедитесь, что LUT имеет темный цвет , присвоенный значению 0.
- Установите контрастность дисплея, нажав на Изображение | Регулировка | Яркость/Контрастность. В окне « Яркость/контрастность» нажмите кнопку «Установить» и в появившемся диалоговом окне введите требуемые значения отображаемых значений « Минимум » и «Максимум ». Чтобы максимизировать наблюдаемые различия в цвете, установите их примерно на минимум и максимум, получаемый на всех изображениях. Установите для всех изображений в эксперименте одинаковые уровни контрастности.
ПРИМЕЧАНИЕ: Не нажимайте кнопку Применить, так как это изменит значения пикселей и предотвратит создание точной калибровочной полосы на следующем шаге. - Добавьте полосу калибровки цвета, щелкнув Analyze | Инструменты | Калибровочная планка. В появившемся диалоговом окне отметьте опцию Overlay , чтобы удалить панель, при желании нажав на Image | Наложение | Удалить наложение.
- При необходимости добавьте масштабную линейку, щелкнув Analyze | Инструменты | Масштабная линейка. В появившемся диалоговом окне задайте нужный размер, расположение и цвет полосы. Отметьте опцию Overlay , чтобы сохранить цвет полосы независимо от используемой таблицы LUT.
- Сгенерируйте RGB-изображение для публикации, нажав на Изображение | Наложение | Расплющить. Сохраните получившееся изображение.
ПРИМЕЧАНИЕ: Это изображение предназначено только для презентации или публикации. Значения интенсивности изменяются, поэтому ее невозможно измерить. Полосы также постоянно выжигаются на изображении.
- Чтобы создать изображение с модуляцией интенсивности, выполните следующие действия.
- Нажмите на изображение | Дублировать , чтобы создать копию изображения, а затем закрыть оригинал.
- Если изображение представляет собой Z-стек, выберите один срез или создайте Z-проекцию для просмотра всех митохондрий.
- Установите контрастность дисплея изображения с пропорциями, нажав на Изображение | Регулировка | Яркость/Контрастность, а затем в окне Яркость/Контрастность нажмите кнопку Установить. В появившемся диалоговом окне введите требуемые значения для отображаемых значений Минимум и Максимум . Чтобы максимизировать наблюдаемые различия в цвете, установите их приблизительно к минимуму и максимуму, полученному на всех изображениях, и установите для всех изображений в эксперименте одинаковые уровни контрастности. Нажмите кнопку Применить , чтобы изменить масштаб значений пикселов.
- Чтобы создать калибровочную полосу, продублируйте это улучшенное изображение и создайте полосу, перейдя в раздел Анализ | Инструменты | Калибровочная планка. Преобразуйте изображение и наложение в формат RGB, нажав на Изображение | Наложение | Расплющить. При необходимости вставьте эту полосу на RGB-изображение с модуляцией интенсивности, полученное на шаге 5.6.2.12, для презентации или публикации.
- Создайте новое изображение с той же шириной и высотой, что и изображение, нажав на Файл | Новинка | Изображение.... В открывшемся диалоговом окне задайте параметры следующим образом: Тип: RGB; Заливка: Черный; Ширина и высота: 9ширина и высота изображения); Кусочки: 1.
- Преобразуйте новый стек в стек изображений HSB (оттенок, насыщенность, яркость), щелкнув Изображение | Тип | Стек HSB.
- Нажмите на изображение с поправкой на контрастность, перейдя в раздел Редактировать | Выберите «Все», затем «Редактировать |» Копировать. Затем щёлкните по стеку HSB, выберите первый срез (Hue) и нажмите Edit | Вставьте для переноса значений соотношений.
- Выберите срез 2 (Saturation) стека HSB. Установите цвет переднего плана на белый , перейдя в меню Правка | Опции | Цвета. Нажмите « Редактировать» | Выберите «Все», затем «Редактировать |» Заливка, а в открывшемся диалоговом окне выберите Нет , чтобы залить белым цветом только текущий срез.
- Откройте изображение необработанных данных и разделите каналы, нажав на Изображение | Цвет | Разделение каналов.
- Сгенерируйте среднее значение двух каналов соотношения с помощью Калькулятора изображений и щелчка Процесс | Калькулятор изображений. В появившемся диалоговом окне задайте для операции значение «Среднее», а для параметров «Изображение1» и «Изображение2» — числитель и знаменатель соответственно. Установите флажок Создать новое окно.
- Нажмите на среднее изображение, созданное выше, перейдя в раздел Редактировать | Выберите «Все», затем «Редактировать |» Копировать. Затем щёлкните по стеку HSB, выберите третий срез (Value) и нажмите Edit | Вставьте для переноса значений интенсивности.
- Преобразуйте стек HSB в цветовое пространство RGB, щелкнув Image | Тип | Цвет RGB. Сохраните получившееся изображение.
- Чтобы получить немодулированное цветное изображение, выполните следующие действия.
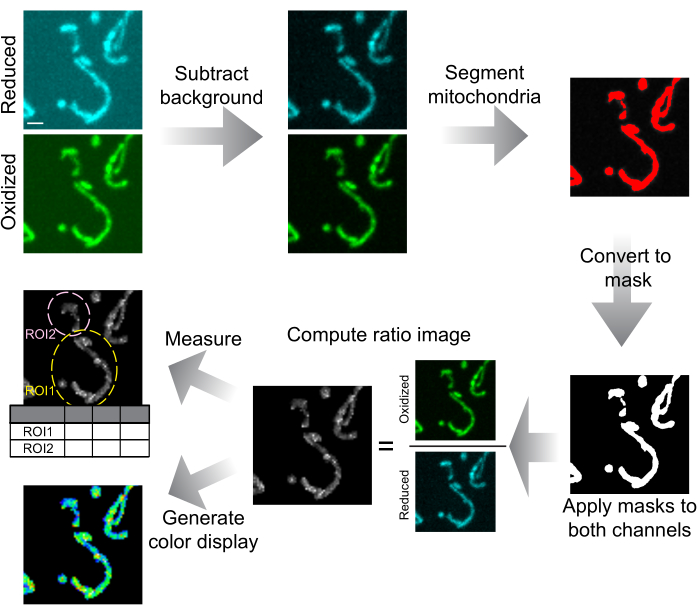
Рисунок 6: Схема анализа и представления изображений. Конфокальные изображения вращающегося диска сначала вычитаются из фона. Митохондрии сегментируются по пороговым значениям и преобразуются в маски для каждого среза. Эти маски применяются к обоим каналам, а замаскированные изображения используются для вычисления соотношения. ROI рассчитывается для измерения соотношения mtHyPer7 в клетках или субклеточных областях. Для представления данных также могут быть сгенерированы цветные изображения с пропорциями. Масштабная линейка = 1 мкм. Аббревиатура: ROI = регион интереса. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Чтобы подтвердить, что mtHyPer7 является подходящим зондом для оценки митохондриальногоH2O2, была оценена локализация mtHyPer7 и его влияние на митохондрии дрожжей и здоровье клеток. Для оценки таргетирования mtHyPer7 митохондрии окрашивали жизненно важным митохондриально-специфическим красителем MitoTracker Red в контрольных дрожжевых клетках и дрожжах, экспрессирующих mtHyPer7. При использовании окрашивания MitoTracker Red митохондрии были решены в виде длинных трубчатых структур, которые выровнялись вдоль оси мать-почка и накапливались на кончике почки и кончике материнской клетки дистальнее зачатка41. Морфология митохондрий была сходной в контрольных клетках и клетках, экспрессирующих mtHyPer7. Кроме того, mtHyPer7 локализовался с митохондриями, окрашенными в красный цвет MitoTracker (рис. 3A). Таким образом, mtHyPer7 был эффективно и количественно нацелен на митохондрии, не влияя на нормальную морфологию или распределение митохондрий.
Затем были проведены дополнительные валидационные эксперименты для оценки влияния mtHyPer7 на клеточную приспособленность и чувствительность к окислительному стрессу в митохондриях. Скорость роста клеток, экспрессирующих mtHyPer7, в богатых или синтетических средах на основе глюкозы (YPD или SC, соответственно) аналогична таковой у нетрансформированных клеток дикого типа (рис. 3B, D). Для оценки возможного влияния на окислительный стресс в митохондриях контрольные и мтHyPer7-экспрессирующие дрожжи обрабатывали низкими уровнями параквата, редокс-активной малой молекулы, которая накапливается в митохондриях и приводит к повышению уровня супероксида в органелле24,27. Если экспрессия mtHyPer7 либо индуцирует окислительный стресс в митохондриях, либо защищает митохондрии от окислительного стресса, то клетки, экспрессирующие mtHyPer7, должны демонстрировать повышенную или пониженную чувствительность к лечению паракватом соответственно. Лечение низкими уровнями параквата приводило к снижению темпов роста дрожжей. Более того, скорость роста клеток дикого типа и клеток, экспрессирующих mtHyPer7, в присутствии параквата была сходной (рис. 3C,E). Таким образом, экспрессия биосенсора не создавала значительных клеточных стрессов в почковавшихся дрожжевых клетках и не изменяла чувствительность дрожжей к митохондриальному окислительному стрессу.
Учитывая доказательства того, что mtHyPer7 подходит для изучения митохондриального H2O2 у почковавшихся дрожжей, было проверено, может ли mtHyPer7 обнаруживать митохондриальный H2O2 у дрожжей дикого типа в середине логарифмической фазы и изменения в митохондриальномH2O2, индуцированные внешним добавлениемH2O2. Был проведен эксперимент по титрованиюH2O2 и измерено среднее отношение окисленный:восстановленный (O/R) mtHyPer7 в митохондриях.
Сценарии автоматизированного анализа выдали несколько выходных файлов.
Изображение соотношения (ratio.tif): Z-стек, состоящий из стеков с коррекцией фона и пороговых значений 488 нм и 405 нм. Этот стек можно посмотреть на Фиджи без дополнительной обработки; Тем не менее, перед просмотром рекомендуется повысить контрастность и/или раскрасить изображение, как описано в шагах протокола 4.3 или 5.6.
Изображение маски (mask.tif): стек Z, состоящий из пороговых митохондриальных областей, используемых для анализа. Это изображение необходимо использовать для оценки точности порогового значения.
Рентабельность инвестиций, используемая для анализа (ROIs.zip): когда этот файл открывается на Фиджи вместе с исходным изображением, ROI накладывается на изображение для перекрестных ссылок на таблицу результатов и исходное изображение. Каждый ROI переименовывается с номером ячейки и номером ROI.
Таблицы измерений (NumResults.csv, DenomResults.csv, Results.csv), содержащие площадь, среднюю и интегрированную плотность пороговых митохондрий для каждого среза на изображениях числителя, знаменателя и соотношения соответственно. В срезах, где митохондрии отсутствовали или были не в фокусе, регистрируется NaN.
Файл журнала (Log.txt), документирующий параметры, используемые для коррекции фона и шума, порогового значения и вычисления соотношения.
Отношение O/R mtHyPer7 показало дозозависимый ответ на концентрацию H2O2, который достигал плато при 1-2 мМ при внешнем добавленииH2O2(рис. 7). Удивительно, но соотношение HyPer7 было ниже в клетках, подвергшихся воздействию 0,1 мМH2O2, чем в контрольных клетках, хотя эта разница не была статистически значимой. Одним из объяснений этого явления может быть реакция гормезиса, при которой воздействие низкого уровня стрессора может вызывать стрессовые реакции, такие как антиоксидантные механизмы, которые, в свою очередь, снижают количество АФК, обнаруживаемое зондом. Более высокие уровни стрессоров, напротив, могут подавлять внутренние стрессовые реакции и приводить к более высокому считыванию от HyPer7.
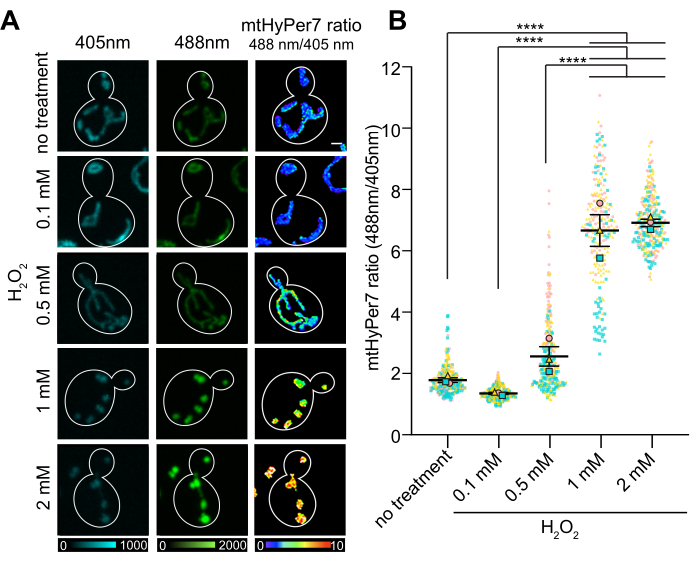
Рисунок 7: Реакция mtHyPer7 на добавленный извне H2 O 2. (A) Максимальная проекция возбужденных изображений 405 нм и 488 нм и проекция средней интенсивности ратиометрических изображений mtHyPer7 в клетках средней логарифмической фазы, подвергшихся воздействию различных концентраций H2O2. Псевдоцвет указывает на соотношение окисленный:восстановленный mtHyPer7 (шкала внизу). Масштабная линейка = 1 мкм. Контур ячейки показан белым цветом; n > 100 ячеек на условие. (B) Количественное определение соотношения mtHyPer7 окисленный:восстановленный в почковавшихся дрожжевых клетках, обработанных различными концентрациями H2O2. Показаны средства пяти независимых испытаний с символами различной формы и цвета для каждого испытания. Среднее ± СЭМ соотношения окисленный:восстановленный mtHyPer7: 1,794 ± 0,07627 (без обработки), 1,357 ± 0,03295 (0,1 мМ), 2,571 ± 0,3186 (0,5 мМ), 6,693 ± 0,5194 (1 мМ), 7,017 ± 0,1197 (2 мМ). p < 0,0001 (односторонний ANOVA с тестом множественных сравнений Тьюки). Значения p обозначаются как: ****p < 0,0001. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Наконец, предыдущие исследования показали, что более здоровые митохондрии, которые более редуцированы и содержат меньше супероксида, преимущественно наследуются дочерними клетками дрожжей4, и что цитозольные каталазы транспортируются и активируются в дочерних клетках дрожжей42,43,44,45. Эти исследования документируют асимметричное наследование митохондрий во время деления дрожжевых клеток и роль этого процесса в приспособленности и продолжительности жизни дочерних клеток, а также возрастную асимметрию между матерью и дочерью. Чтобы проверить, существуют ли различия вH2O2 между матерями и почками, mtHyPer7 был измерен в почках и материнских клетках. Различия в митохондриях H2O2 наблюдались внутри дрожжевых клеток, а в митохондриях в зародыше было обнаружено незначительное, но статистически значимое снижение показаний биосенсораH2O2по сравнению с таковыми в материнской клетке (рис. 8). Эти результаты согласуются с предыдущими выводами о том, что митохондрии в зародыше лучше защищены от окислительного стресса. Они также предоставляют документацию о том, что mtHyPer7 может обеспечить количественное считывание митохондриальногоH2O2 с клеточным и субклеточным разрешением у почковавшихся дрожжей.
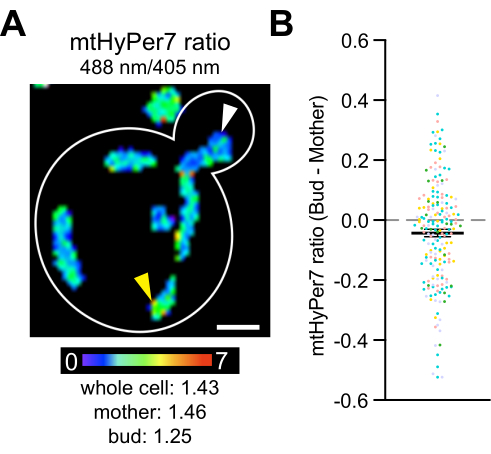
Рисунок 8: Уровень митохондриальныхH2O2ниже в дочерней клетке. (A) Максимальная проекция ратиометрического изображения mtHyPer7 в репрезентативной ячейке. Псевдоцвет указывает на соотношение окисленный:восстановленный mtHyPer7 (шкала внизу). Субклеточные различия в соотношении очевидны (наконечники стрел). Масштабная линейка = 1 мкм. Контур ячейки: белый. (B) Разница между соотношением mtHyPer7 в зародыше и материнской клетке. Для каждой отдельной ячейки значение материнского коэффициента вычиталось из значения соотношения почек и отображалось в виде точки. n = 193 ячейки, объединенные из пяти независимых экспериментов, показанных разными цветными символами для каждого эксперимента. Среднее ± SEM разницы между соотношением mtHyPer7 в зародышевой и материнской клетках: -0,04297 ± 0,01266. p = 0,0008 (парный t-критерий) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная таблица S1: Штаммы, использованные в данном исследовании. Список используемых штаммов дрожжей. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица S2: Плазмиды, использованные в этом исследовании. Список используемых плазмид. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица S3: Праймеры, использованные в данном исследовании. Список используемых грунтовок. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 1: Протокол построения плазмиды биосенсора. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: Скрипты для автоматизированного анализа. Для каждого скрипта предоставляются образцы входных и выходных файлов. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В этом протоколе описан метод использования mtHyPer7 в качестве биосенсора для оценки митохондриальногоH2O2в живых почковающихся дрожжевых клетках. Биосенсор конструируется методом на основе CRISPR и вводится в консервативную бесгенную область генома дрожжей без использования селективных маркеров. По сравнению с биосенсорами, содержащимися в плазмиде, интегрированные биосенсоры экспрессируются во всех клетках и на одинаковых уровнях, что обеспечивает более надежные количественные результаты. Для генерации клеток, экспрессирующих mtHyPer7, не используются селективные маркеры, что позволяет использовать более широкий спектр штаммовых фонов и облегчает генетическую модификацию клеток, экспрессирующих биосенсоры. Белок mtHyPer7 правильно нацелен на митохондрии без заметного влияния на морфологию, функцию, распределение или скорость клеточного роста митохондрий. mtHyPer7 демонстрирует дозозависимую реакцию на внешне добавленныйH2O2. Более того, mtHyPer7 способен сообщать о гетерогенности качества митохондрий с субклеточным разрешением. Наконец, использование конфокального микроскопа с вращающимся диском в отличие от широкопольной микроскопии для визуализации митохондриальных биосенсоров приводит к меньшему фотообесцвечиванию флуорофоров и получению изображений с высоким разрешением для анализа субклеточных различий.
Ограничения и альтернативные подходы
Этот метод не подходит для визуализации клеток более 10 минут, так как клетки высохнут под покровным стеклом. Для более длительной визуализации лучше использовать метод агаровой подушечки46 или иммобилизовать клетки в культуральной чашке со стеклянным дном, заполненной средой SC.
При выборе биосенсора следует руководствоваться концентрацией мишени в экспериментальных условиях. Если чувствительность HyPer7 слишком высока, рекомендуется другая версия HyPer, например HyPer3 или HyPerRed47,48. Однако следует отметить, что другие зонды HyPer более чувствительны к pH. Для более высокой чувствительности более подходящим может быть roGFP на основе пероксиредоксина (roGFP2Tsa2ΔCR)27.
Устойчивое состояние окисления датчикаH2O2 связано как со скоростью окисления, так и со скоростью восстановления. Скорость окисления биосенсоров в основном обусловленаH2O2, но скорость восстановления зависит от антиоксидантных восстановительных систем, активных в клетке и органеллах. Показано, что HyPer7 преимущественно восстанавливается системой тиоредоксина в цитозоле дрожжей, и его восстановление происходит быстрее, чем у roGFP2Tsa2ΔCR27. Поэтому при интерпретации измерений биосенсоровH2O2следует учитывать различные механизмы редукции и динамику отклика зонда. В частности, для определения уровняН2О2по показаниям биосенсора необходимо предположить, что система восстановления поддерживает постоянную емкость во время эксперимента. В качестве альтернативы описанным здесь сценариям в свободном доступе имеется множество других программ для анализа окислительно-восстановительных датчиков49.
Критические шаги
В случае с любым биосенсором очень важно продемонстрировать, что сам биосенсор не влияет на измеряемый процесс. Поэтому важно сравнивать рост и митохондриальную морфологию штаммов в каждом экспериментальном состоянии. Здесь морфология митохондрий оценивается с помощью MitoTracker Red, который окрашивает митохондрии в зависимости от мембранного потенциала. Тем не менее, сравнение митохондрий в нетрансформированных и трансформированных биосенсорами клетках может быть выполнено путем окрашивания тетраметилродаминовым метиловым эфиром (TMRM), альтернативным митохондриальным красителем, чувствительным к мембранному потенциалу, или MitoTracker Green, который окрашивает митохондрии независимо от мембранного потенциала. При подозрении на вредные последствия может помочь снижение уровня экспрессии или изменение сайта интеграции.
Валидация характеристик зонда «доза-реакция» и отношения сигнал/шум метода визуализации также важны для получения надежных результатов. Если изменчивость внутри группы превышает изменчивость между группами, различия становится трудно обнаружить. Внутригрупповая изменчивость может быть результатом истинной популяционной изменчивости или шума в процессе обнаружения. Ключевыми шагами для увеличения соотношения сигнал/шум являются получение изображения (диапазон значений пикселей и шум), вычитание фона и пороговое значение.
Шумовые эффекты также могут быть уменьшены на этапах расчета. Самый простой подход заключается в вычислении взвешенной средней интенсивности на основе измерений изображения соотношения (Results.csv), где каждый пиксель представляет локальное соотношение между эффективностью возбуждения. В результате получается «пиксельное» соотношение. Однако, если отношение сигнал/шум изображения низкое, более надежные результаты можно получить, вычислив средневзвешенную интенсивность для ROI как в каналах числителя, так и в канале знаменателя, а затем вычислив отношение между этими двумя средневзвешенными значениями (соотношение «по регионам»).
Чтобы выбрать метод порогового значения, используйте команду Fiji Image | Регулировка | Auto Threshold можно использовать для автоматической опробования всех встроенных методов Fiji. Для оценки сегментации (порогового значения) сохраненная маска преобразуется в выделение нажатием кнопки Редактировать | Выбор | Create Selection, добавляется в ROI Manager (нажатием клавиши T), а затем активируется на файле необработанного изображения. Если митохондрии не обнаруживаются должным образом, следует попробовать другой метод сегментации.
При сравнении изображений важно получить все изображения с одинаковыми условиями изображения, а также отобразить все изображения с одинаковым повышением контрастности.
Движение митохондрий необходимо учитывать при оптимизации условий визуализации. Если митохондрии значительно перемещаются между возбуждением на длине волны 405 и 488 нм, изображение соотношения будет неточным. Рекомендуется поддерживать время экспозиции <500 мс и изменять возбуждение самым быстрым доступным методом (например, триггерным импульсом или акустооптическим перестраиваемым фильтром). При захвате стека Z оба возбуждения должны быть выполнены для каждого шага Z, прежде чем переходить к следующему шагу Z.
Для отображения результатов изменения оттенка (цвета) более очевидны для человеческого глаза, чем изменения интенсивности. Поэтому значение коэффициента преобразуется в цветовую шкалу для облегчения визуальной интерпретации. Цветные изображения могут быть немодулированными, когда все митохондриальные пиксели отображаются с одинаковой яркостью, или с модуляцией интенсивности, когда интенсивность пикселей в исходном изображении используется для установки интенсивности в раскрашенном изображении.
Модификация и устранение неполадок
В качестве альтернативы подтверждению митохондриальной функции с помощью параквата, клетки могут быть реплицированы или инокулированы в ферментируемые и неферментируемые источники углерода.
Для вычитания фона вычитание катящегося шара (перейдя в Process | Вычитание фона...) Также может использоваться для устранения неравномерности освещения. Необходимо убедиться, что наличие ячеек не изменяет вычитаемый фон (установив флажок Создать фон и проверив результат).
Таким образом, зонд mtHyPer7 представляет собой последовательный, минимально инвазивный метод определения морфологического и функционального состояния митохондрий дрожжей в живых клетках и позволяет изучать важный клеточный стрессор и сигнальную молекулу в генетически управляемой, легкодоступной модельной системе.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Авторы благодарят Кэтрин Филпо Лопес (Katherine Filpo Lopez) за экспертную техническую помощь. Эта работа была поддержана грантами Национальных институтов здравоохранения (NIH) (GM122589 и AG051047) LP.
В этих исследованиях использовался общий ресурс по конфокальной и специализированной микроскопии Комплексного онкологического центра Герберта Ирвинга при Колумбийском университете, частично финансируемый за счет гранта NIH/NCI Cancer Center Support Grant P30CA013696.
Материалы
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | A9126 | |
| Bacto Agar | BD Difco | DF0145170 | |
| Bacto Peptone | BD Difco | DF0118170 | |
| Bacto Tryptone | BD Difco | DF211705 | |
| Bacto Yeast Extract | BD Difco | DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | H5659 | |
| L-leucine | Sigma-Aldrich | L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | L8662 | |
| L-methionine | Sigma-Aldrich | M9625 | |
| L-phenylalanine | Sigma-Aldrich | P5482 | |
| L-tryptophan | Sigma-Aldrich | T8941 | |
| L-tyrosine | Sigma-Aldrich | T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. 856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
Ссылки
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены