A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التلاعب Tuina للحد من الالتهاب وفقدان الغضروف في الفئران هشاشة العظام في الركبة
In This Article
Summary
نقدم بروتوكولا لمعالجة Tuina التي يتم إجراؤها على فئران هشاشة العظام في الركبة التي يسببها الجص. بناء على النتائج الأولية ، اقترح أن فعالية الطريقة تعتمد على الحد من الالتهاب وفقدان الغضروف.
Abstract
تشير التجارب السريرية إلى أن معالجة Tuina فعالة في علاج هشاشة العظام في الركبة (KOA) ، في حين أن هناك حاجة إلى مزيد من الدراسات لاكتشاف آليتها. لذلك ، فإن التلاعب بالنماذج الحيوانية لالتهاب المفاصل في الركبة أمر بالغ الأهمية. يوفر هذا البروتوكول عملية قياسية لمعالجة Tuina على فئران KOA واستكشاف أولي لآلية Tuina ل KOA. يتم تطبيق طريقة التلاعب بالضغط والعجن (نوع من التلاعب Tuina الذي يشير إلى الضغط والعجن على منطقة معينة من سطح الجسم) على 5 نقاط وخز حول مفصل الركبة للفئران. تم توحيد قوة وتواتر التلاعب عن طريق تسجيلات ضغط الإصبع ، ويتم وصف موضع الفئران أثناء التلاعب بالتفصيل في البروتوكول. يمكن قياس تأثير التلاعب عن طريق اختبارات سلوك الألم والنتائج المجهرية في الزليلي والغضاريف. أظهرت فئران KOA تحسنا كبيرا في سلوك الألم. تم تقليل تسلل الأنسجة الزليلية الالتهابية في مجموعة Tuina ، وكان التعبير عن عامل نخر الورم (TNF) - α أقل بكثير. بالمقارنة مع المجموعة الضابطة ، كان موت الخلايا الغضروفية المبرمج أقل في مجموعة Tuina. توفر هذه الدراسة بروتوكولا موحدا لمعالجة Tuina على فئران KOA ودليلا أوليا على أن الآثار العلاجية ل Tuina قد تكون مرتبطة بالحد من الالتهاب الزليلي وموت الخلايا الغضروفية المبرمج المتأخر.
Introduction
هشاشة العظام في الركبة (KOA) هو مرض تنكسي يتجلى بشكل رئيسي في آلام المفاصل. التليف ، تكسير ، تقرح ، وفقدان الغضروف المفصلي هي الأسباب الرئيسية لهذا المرض1. KOA له معدل انتشار مرتفع وقد يؤدي إلى تأثير عميق على الحياة اليومية للمرضى ، مما يسبب الإعاقة في الحالات الشديدة. بين الأشخاص الذين تتراوح أعمارهم بين 45-84 سنة ، يزداد انتشار KOA مع تقدم العمر ، ويبلغ معدل الانتشار بين الأشخاص الذين تبلغ أعمارهم 85 عاما فما فوق 15٪ ، مع غلبة النساء 2,3. وبالإضافة إلى ذلك، قد تفرض اتفاقية الكويت عبئا اقتصاديا خطيرا على الفرد والمجتمع على حد سواء. أظهر مسح أن تكاليف الرعاية الصحية المباشرة على نصيب الفرد من KOA وصلت إلى 8,858 دولارا ± 5,120 دولارا سنويا4. مع شيخوخة المجتمع ، أصبحت KOA مشكلة صحية عالمية وقضية اجتماعية رئيسية ، فضلا عن قضية موضوعية للبحث العلمي.
أظهرت الدراسات القائمة على الأدلة فعالية التلاعب ب Tuina في علاج KOA5. يمكن أن يؤدي التلاعب ب Tuina إلى تخفيف الألم وتحسين الخلل الوظيفي لدى مرضى KOA ، والتي ترتبط آليتها بالتأثيرات المضادة للالتهابات 6,7. وجد العلماء أن التلاعب Tuina يثبط بشكل فعال التعبير عن العوامل الالتهابية interleukin (IL) -β و 5-hydroxytryptamine ويبطئ تنكس الغضروف المفصلي في نموذج KOA الأرنب8. واقترح أن Tuina يمكن أن يعزز الدورة الدموية والتمثيل الغذائي في موقع الآفة ، مما ساعد على إزالة العوامل الالتهابية مثل IL-1 و IL-6 وعامل نخر الورم (TNF) -α ، وبالتالي تخفيف الأعراض السريرية ل KOA9. بالإضافة إلى ذلك ، يمكن للحركة السلبية للمفصل من خلال التلاعب Tuina تعزيز تغلغل ونشر السائل الزليلي في الغضروف المفصلي ويحسن استقلاب المغذيات الأنسجة10. اقترحت دراسات أخرى أن التلاعب Tuina يمكن أن يحسن بشكل فعال المؤشرات الميكانيكية الحيوية في مرضى KOA11. يمكن أن تؤدي التلاعب المطبقة على الأنسجة الرخوة إلى تحسين توزيع الإجهاد على الأطراف وتعزيز وظيفة التوازن12,13. في الوقت نفسه ، مع بعض التلاعب بتعديل المفاصل ، يمكن أيضا تعديل محاذاة الأطراف السفلية لتصحيح المشية غير الطبيعية14,15.
لا يزال يتعين استكشاف آلية عمل التلاعب Tuina في علاج KOA ، وبالتالي ، من الضروري إجراء دراسة تجريبية. مفتاح تطبيق Tuina في التجارب هو توحيد النمذجة وتثبيت الحيوانات وطرق التدخل16. تحدد طريقة النمذجة ما إذا كان التجارب يمكنه إظهار خصائص المرض. وفي الوقت نفسه ، يمكن لطرق التثبيت المناسبة أن تسهل تدخل التلاعب Tuina وتعكس بشكل أفضل تأثير Tuina. توحيد أساليب التدخل هو أصعب جزء من التلاعب Tuina. في عام 2010 ، ذكر النظام الأساسي لمعايير الوخز بالإبر الصينية معايير نقطة الوخز بالإبر لحيوانات التجارب ، مما يوفر إمكانية الوخز بالإبر وعمليات Tuina في التجارب على الحيوانات17. ومع ذلك ، لا تزال هناك صعوبات في توحيد التلاعب Tuina. هناك أنواع متعددة من التلاعب Tuina18. يعتمد اختيار التلاعب المحدد بشكل أساسي على المرض المراد علاجه والنظريات العلاجية التي يفضلها المؤدي. في دراسة Tuina ل KOA، تم إيلاء المزيد من الاهتمام لمعالجة الضغط على النقاط (الضغط على نقاط الوخز المحددة بالإبهام أو الكوع)، والتلاعب بدفع Yizhichan (التلاعب بالدفع عن طريق هز الإبهام)، والتلاعب بالضغط والعجن (الذي يشير إلى الضغط والعجن على منطقة معينة من سطح الجسم بالإصبع أو راحة اليد)19. يعد التلاعب بالضغط والعجن أحد أكثر معالجات Tuina استخداما ، والذي يجمع بين الضغط والعجن لتحريك الأنسجة تحت الجلد20. يمكن أن يؤدي التلاعب بالضغط والعجن المطبق على نقاط الوخز إلى تعزيز الدورة الدموية وتخفيف الألم ويمثل التأثير العلاجي ل Tuina على KOA19.
في هذا البروتوكول ، سيتم وصف عملية التلاعب بالضغط والعجن على فئران KOA بالتفصيل ، بما في ذلك نقاط الوخز المختارة ، وشدة وتواتر التلاعب وموضع جسم الفئران ، وذلك لتوفير مرجع للبحوث المستقبلية.
Protocol
اجتازت هذه الدراسة مراجعة أخلاقيات الحيوان التي أجرتها لجنة أخلاقيات الحيوان التجريبية في مستشفى Yueyang للطب الصيني التقليدي والغربي المتكامل التابع لجامعة شنغهاي للطب الصيني التقليدي (YYLAC-2022-166).
1. إعداد وتجميع التجارب
- إعداد الحيوان
- قم بتربية ما مجموعه 10 إناث فئران صحية SPF SD من 200-220 جم في درجة حرارة الغرفة (18-21 درجة مئوية) ، والرطوبة 40٪ -50٪ ، 12 ساعة: 12 ساعة تناوب إيقاع الساعة البيولوجية. إجراء تجارب على الحيوانات المتعلقة بالألم مع الامتثال الصارم للأحكام ذات الصلة من المبادئ التوجيهية والمبادئ التوجيهية الأخلاقية للحيوان.
- تجميع الحيوانات
- تقسيم الفئران عشوائيا إلى مجموعة Tuina ومجموعة التحكم. علاج الفئران من مجموعة Tuina مع التلاعب الصحافة والعجن لمدة 21 يوما بعد النمذجة. ضع الفئران من المجموعة الضابطة في نفس غرفة Tuina وضعها في كيس من القماش الأسود في وقت واحد أثناء خضوع مجموعة Tuina للعلاج.
2. نمذجة الحيوانات
- تخدير الحيوان
- استخدام إيزوفلوران لتخدير الغاز. ضع الجرذ في صندوق الحث بتركيز تحريض 3٪. تمايل الصندوق بعد وضع الجرذ لأسفل وتأكيد التخدير عند انقلاب الفئران دون محاولة العودة إلى وضعية الانبطاح.
- أخرج الجرذ من صندوق الحث وأصلح أنفه في قناع التخدير. اضبط تركيز الأيزوفلوران على 2٪ للحفاظ على التخدير. تأكد من التخدير عندما لا يستجيب الجرذ عند قرص الكفوف. ضع مرهم العين على الفئران لمنع الجفاف عند تخدير الفئران ، حيث لا يمكن إغلاق الجفون.
- طريقة النمذجة21
- استخدم آلة الحلاقة لإزالة شعر الطرف الخلفي الأيمن. ضع وسادة قطنية طبية بين الكاحل الأيمن ومفصل الورك للفئران. ثبت مفصل الركبة الأيمن عند تمديد 180 درجة مع 5-6 طبقات من ضمادة الجص الرطبة بالتساوي. لف ضمادة الجص الحلزونية بدءا من الكاحل وتغطي 1/3 من سابقتها. استخدم مجفف شعر لتجفيف الجص وتصلبه.
- لف الجص الخارجي بمادة قاعدة طقم الأسنان بعد أن تجف ضمادة الجص وتتصلب لإصلاح الجص ومنعه من القضم.
- امزج مواد قاعدة طقم الأسنان لجعلها لزجة وتلتصق الخليط بالجزء الخارجي من الجص (يجب ألا يتجاوز الخليط حافة الضمادة ، الشكل 1). بعد أن يصبح الخليط صلبا ، قم بإيقاف تشغيل آلة التخدير وانتظر حتى يستيقظ الحيوان بشكل طبيعي. الإشراف على الفئران لمنع حوادث التخدير قبل استيقاظ الفئران.
- ثبت الجص بشكل مناسب على الطرف الخلفي الأيمن للفأر ، حيث أن التثبيت المحكم يقيد الدورة الدموية ، بينما يميل التثبيت الفضفاض إلى السقوط. مراقبة الدورة الدموية في الطرف الطرفي. إذا تم الكشف عن تورم في الطرف الطرفي أو بشرة أرجوانية ، فقم بقطع جزء من الجص على الفور للمساعدة في استعادة الدورة الدموية. أعد صنع الجص إذا كان مكسورا وفشل في الحفاظ على امتداد الطرف السفلي.
- قم بإزالة الجص بعد 3 أسابيع من الشلل المستمر. استخدم المقص الجراحي لقطع مادة قاعدة طقم الأسنان بالخارج وضمادة الجص. شطف الطرف السفلي من الفئران بالمحلول الملحي وتجفيفه بالشاش. إذا كانت هناك آفات جلدية محلية ، فقم بتعقيمها باستخدام اليودوفور.
- التحقق من النموذج22
- التحقق القائم على الأشعة السينية
- إجراء فحص بالأشعة السينية للركبة اليمنى بعد 1 يوم من نهاية النمذجة. خذ الصور الشعاعية الأمامية الخلفية في وضع الاستلقاء مع ثني الورك عند 30 درجة ، وتمديد الركبة عند 0 درجة ، واختطاف الورك عند 15 درجة. حافظ على الرضفة مباشرة أمام الركبة وضع أنبوب المبرد 110 مم من مفصل الركبة.
- خذ الصور الشعاعية الجانبية في وضع الاستلقاء الجانبي الأيمن مع ثني الورك الأيمن عند 30 درجة وتمديد الركبة اليمنى عند 0 درجة. اجعل ثني الورك للطرف الأيسر عند 70 درجة ، وانثناء الركبة عند 45 درجة ، وضع أنبوب المبرد على بعد 110 مم من مفصل الركبة. اضبط معلمات الكشف على أنها جهد التعرض 50 كيلو فولت ، التيار 250 مللي أمبير ، جرعة التعرض 32 مللي أمبير ، ووقت التعرض 128 مللي ثانية.
- قارن مع الأشعة السينية للفئران العادية ، تأكد من أن الأشعة السينية للركبة النموذجية تظهر مساحة أضيق للمفصل مع تضخم العظم عند الحافة.
- الجمعية الدولية لأبحاث هشاشة العظام (OARSI) تسجل23
- ضع الجرذ في صندوق القتل الرحيم و perfuse CO2 بمعدل 30 ٪ -70 ٪ حجم القفص في الدقيقة. توقف عن تعطير CO2 بعد اكتشاف أن الجرذ غير متحرك ، ولا يتنفس ، وأن التلميذ متوسع. مراقبة لمدة 2 دقيقة أخرى لتأكيد الوفاة.
ملاحظة: يمكن إجراء خلع عنق الرحم بعد القتل الرحيم القائم على CO2 كشكل ثانوي لتأكيد الوفاة. إصلاح الفئران على الطاولة وفهم ذيله بيد واحدة. اضغط لأسفل على رأس الجرذ بالإبهام والسبابة من ناحية أخرى. تأكد من الموت عند سماع صوت صدع ، ويفقد الجرذ الحركة ونبض القلب في نفس الوقت. - ثبت الفئران في وضع ضعيف بإبرة حقنة على لوح رغوي مع ثني الطرف الخلفي الأيمن في الاختطاف والدوران الخارجي. قرصة الجلد حول مفصل الركبة بمقص جراحي. كشف العضلات حول مفصل الركبة عن طريق قطع الجلد ثم قطع اللفافة تحت الجلد.
- قطع عظم الفخذ والساق الحجاب مع مقص العظام وإزالة مفصل الركبة الأيمن. قم بإزالة الأنسجة الرخوة الزائدة برفق، مثل العضلات والأربطة، خارج المفصل.
- ثبت المفصل في 4٪ بارافورمالدهيد لمدة 24-48 ساعة عند 4 درجات مئوية. قم بإزالة المفصل في محلول حمض الفورميك بنسبة 10٪ لمدة 3 أيام حتى يمكن وخز الأنسجة العظمية بسهولة بإبرة.
- ضع وتقليم الأنسجة منزوعة الكلس في غطاء الدخان وانقلها إلى صندوق التجفيف في آلة التجفيف. أضف 75٪ إيثانول لمدة 4 ساعات ، ثم 90٪ إيثانول لمدة 2 ساعة ، متبوعا ب 95٪ إيثانول لمدة 1 ساعة ، إيثانول مطلق لمدة 30 دقيقة ، جولة أخرى من الإيثانول المطلق الطازج لمدة 30 دقيقة ، بنزين كحول لمدة 5-10 دقائق ، زيلين لمدة 5-10 دقائق ، جولة أخرى من الزيلين الطازج لمدة 5-10 دقائق ، شمع لمدة 1 ساعة ، جولة أخرى من الشمع الطازج لمدة 1 ساعة ، والجولة الأخيرة من الشمع الطازج لمدة 1 ساعة للجفاف والغمر بالشمع الشفاف.
- ثم ضع المنديل في الجهاز لتضمينه. قطع كتلة الشمع إلى شرائح الشمع من 4 ميكرومتر بعد تثبيت البارافين وتسطيح شريحة في الماء الدافئ. ضع الشريحة على شريحة زجاجية وجففها. قم بتخزينه في درجة حرارة الغرفة.
- راقب عينة الغضروف وسجلها وفقا لتقييم درجة التشريح المرضي للغضروف OA (الجدول 1) 23. إذا كانت درجة الفئران بعد النمذجة أعلى بكثير من درجة الفئران العادية ، فإن النمذجة كانت ناجحة.
- ضع الجرذ في صندوق القتل الرحيم و perfuse CO2 بمعدل 30 ٪ -70 ٪ حجم القفص في الدقيقة. توقف عن تعطير CO2 بعد اكتشاف أن الجرذ غير متحرك ، ولا يتنفس ، وأن التلميذ متوسع. مراقبة لمدة 2 دقيقة أخرى لتأكيد الوفاة.
- التحقق القائم على الأشعة السينية
الجدول 1. تقييم درجة التشريح المرضي للغضروف OA. الصف هو تقدم العمق في الغضروف. مجموع النقاط = الدرجة × التدريج. 0 للمفاصل الطبيعية ، 24 لالتهاب المفاصل الحاد. الرجاء الضغط هنا لتنزيل هذا الجدول.

الشكل 1. الفئران يجمد في الجص. بعد تخدير الفئران ، تم لف أطرافها السفلية اليمنى بضمادات من الجبس ، مثبتة في وضع التمدد المفرط ، ومغطاة بطبقة من مواد قاعدة طقم الأسنان في الخارج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التلاعب توينا
- مجال التطبيق
- حدد ما مجموعه 5 نقاط وخز على الطرف الخلفي الأيمن للفئران ، بما في ذلك ST34 و ST35 و SP10 و EX-LE4 و BL40 (الشكل 2). حدد موقع نقاط الوخز وفقا لمبادئ تحديد المواقع بالوخز بالإبر في 24.
- موقف للتطبيق
- قطع قطعة قماش سوداء في كيس 9 سم × 15 سم مع فتح جانب واحد وشد الفتحة بحبل. قبل التلاعب Tuina ، اسحب ذيل الجرذ برفق لجعله يحفر في الكيس وكشف أطرافه الخلفية خارج الحقيبة.
- استخدم إحدى يديك لإبقاء الجرذ في وضعية الانبطاح ، ممسكا بذيله وساقه الخلفية بينما تطبق اليد الأخرى التلاعب بالضغط والعجن على نقطة وخز معينة (الشكل 3).
- التلاعب توينا
- تشغيل الضغط والتلاعب العجن على 5 نقاط الوخز على الطرف الخلفي الأيمن لمدة 2 دقيقة لكل منهما. ضع إبهام المؤدين على نقطة الوخز بالإبر المحددة لأداء الضغط الإيقاعي والعجن ، ودفع الجلد والأنسجة تحت الجلد معا في حركة دائرية.
- استخدم تسجيلات ضغط الإصبع (وحدات نيوتن) لضمان شدة وتكرار التلاعب بشكل متسق. حافظ على الشدة بين 3-5 نيوتن والتردد عند 2 هرتز (الشكل 4). تطبيق التلاعب مرة واحدة في اليوم لمدة 21 يوما.

الشكل 2. موقف نقاط الإبر. يقع SP10 على ارتفاع 5 مم فوق مفصل الركبة الداخلي في الفئران. يقع ST34 على ارتفاع 5 مم فوق مفصل الركبة الخارجي في الفئران. يقع EX-LE4 في الجانب الإنسي من رباط الركبة في الفئران. يقع ST35 في الجانب الجانبي من رباط الركبة في الفئران. يقع BL40 في منتصف الشريط المأبضي المستعرض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
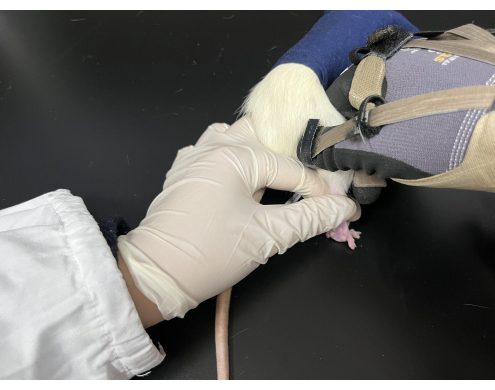
الشكل 3. التلاعب Tuina تطبيقها على الفئران. تم الاحتفاظ بالفئران في كيس أسود مع كشف أطرافها الخلفية. أمسك المؤدي ذيل الجرذ باليد اليسرى بينما قامت اليد اليمنى بالتلاعب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. تسجيلات ضغط الإصبع. يتم استخدام جهاز يسجل قوة وتواتر ضغط الإصبع للحصول على ردود فعل في الوقت الفعلي على شدة وتردد في عملية التلاعب Tuina. (أ) جهاز استشعار الضغط ومعدات النقل. ب: تسجيلات ضغط الإصبع. (ج) القوة المسجلة أثناء التلاعب بتوينا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. اختبارات سلوك الألم
- اختبر سلوك الألم قبل وبعد النمذجة ، وفي يوم واحد بعد (D1) ، وبعد 7 أيام من (D7) ، وبعد 14 يوما من (D14) و 21 يوما بعد (D21) من معالجة Tuina ، بما في ذلك عتبة الانسحاب الميكانيكية واختبارات كمون سحب المخلب.
- عتبة السحب الميكانيكية (MWT)
- ضع الفئران في حجرة زجاجية شفافة مقاس 20 سم × 10 سم × 20 سم تقع على مرحلة عالية 40 سم تتكون من شبكة سلكية بفتحة 10 مم × 10 مم. الحفاظ على درجة حرارة الغرفة عند 23 درجة مئوية ± 2 درجة مئوية.
- توطين الفئران في المختبر السلوكي لمدة 2 ساعة على الأقل يوميا خلال مرحلة الاختبار السلوكي لتجنب التدخل في نتائج الاختبار بسبب عدم تكيف الحيوانات مع البيئة في بداية الاختبار الرسمي. ضع الفئران في المختبر السلوكي لمدة 30 دقيقة قبل بدء الاختبار الرسمي لتسهيل تكيفها مع البيئة وتقليل عوامل تشتيت الانتباه.
- استخدم ألياف Von Frey الإلكترونية لقياس MWT. تحفيز الجرذ مع الألياف في وسط قدمه وسحب الألياف عندما يظهر الجرذ حركات واضحة مثل رفع الساق وتجنبها. يمكن للآلة تسجيل قيمة الضغط القصوى (N) تلقائيا في هذه اللحظة.
- ابدأ التحفيز التالي في نفس الجرذ بعد 15 ثانية على الأقل من التحفيز الحالي. لا تتجاوز 5 ثوان خلال كل تحفيز لمنع التحسس للمنبهات اللمسية في مخالب الفئران. كرر الاختبار 5x حتى يصبح الفرق بين القياسات الثلاثة المتتالية ضئيلا (في حدود 10 N).
- احذف القيم ذات الاختلافات الكبيرة (القيم القصوى والدنيا) وخذ متوسط القيم الثلاث المتبقية كعتبة سحب ميكانيكية.
- زمن انتقال سحب Paw (PWL)
- ضع الفئران في حجرة صغيرة من الزجاج المقسى الشفاف بحجم 20 سم × 10 سم × 20 سم. قم بتغطية الجزء العلوي من المقصورة بغطاء زجاجي شفاف مع فتحات تهوية. حافظ على درجة حرارة الصفيحة الزجاجية الشفافة عند 28-30 درجة مئوية ، حيث يتم وضع المقصورة.
- استقر الفئران في هذه البيئة لمدة 30 دقيقة على الأقل للتأقلم قبل بدء كل اختبار رسمي. إذا كانت الفئران تتبول أو تتغوط في المقصورة ، فقم بتنظيفه بورق ماص في الوقت المناسب لتجنب التأثير على نقل حرارة الإشعاع الضوئي اللاحق.
- ركز الضوء على مركز قدم الجرذ واضغط على زر ابدأ . اضغط على الزر إيقاف عندما يظهر الجرذ سلوكيات واضحة مثل تراجع القدم أو لعق المخلب وسجل الوقت في هذه المرحلة. يجب ألا يتجاوز وقت تشعيع الأضواء 20 ثانية لتجنب تلف جلد الفئران.
- قم بإجراء التشعيع التالي على نفس الجرذ بعد 10 دقائق على الأقل لمنع التحسس. قياس 5x على كل فأر.
- قم بإزالة القيم ذات الاختلافات الكبيرة (الحد الأقصى والحد الأدنى للقيمة). خذ متوسط القيم المتبقية ك PWL.
5. إعداد عينة
- إجراء القتل الرحيم على الماوس كما هو موضح في 2.3.2.1.
- إعداد الغشاء الزليلي
- إصلاح الفئران في موقف ضعيف مع إبرة حقنة على لوح رغوة مع الطرف الخلفي الأيمن ثني في الاختطاف والدوران الخارجي. قرصة الجلد حول مفصل الركبة بمقص جراحي وكشف العضلات حول مفصل الركبة للفئران عن طريق قطع الجلد ثم قطع اللفافة تحت الجلد.
- خذ الرباط الرضفي كمعلم لتجريد مجموعات العضلات فوق الرباط الرضفي. شق نهاية الرباط الرضفي (عند حدبة الظنبوب) بعناية وابحث عن الغشاء الزليلي عندما يقرص الرباط لأعلى من الأسفل.
- قطع بعناية الأنسجة الزليلية مع مقص العيون وغسل الدم والسائل الزليلي مع المياه المالحة المبردة مسبقا. ثبت الغشاء الزليلي في 4٪ بارافورمالدهيد لمدة 48 ساعة على الأقل بعد امتصاص الماء من سطح الأنسجة بشاش نظيف.
- قم بإعداد العينة كما في الخطوات 2.3.2.5 - 2.3.2.6. قم بإجراء التسجيل كما في الخطوة 2.3.2.7.
- أداء تلطيخ الهيماتوكسيلين ويوزين
- قم بإزالة الشمع من الماء باستخدام الزيلين لمدة 20 دقيقة ، واستبدله بجولة أخرى من الزيلين الطازج لمدة 20 دقيقة ، تليها المعالجة بالإيثانول اللامائي لمدة 5 دقائق ، واستبدلها بجولة أخرى من الإيثانول اللامائي الطازج لمدة 5 دقائق ، ثم أضف 90٪ إيثانول من حيث الحجم لمدة 5 دقائق ، و 80٪ إيثانول من حيث الحجم لمدة 5 دقائق ، و 70٪ إيثانول من حيث الحجم لمدة 5 دقائق ، وأخيرا الماء المقطر لمدة 5 دقائق.
- اغمر الشريحة في محلول تلطيخ الهيماتوكسيلين لمدة 3-8 دقائق. إزالة الشريحة وشطف وصمة عار بالماء المقطر. انقله إلى سائل التمايز (1٪ كحول حمض الهيدروكلوريك) لمدة 30 ثانية تقريبا ، بحيث تتلاشى الشريحة إلى اللون الأزرق الباهت. شطفه بالماء المقطر ، ووضعه في محلول تلطيخ يوزين لمدة 1-3 دقائق.
- قم بتجفيف الشريحة بجزء حجم الإيثانول بنسبة 95٪ لمدة 5 دقائق ، واستبدلها بجولة أخرى من الإيثانول الطازج بنسبة 95٪ لمدة 5 دقائق ، متبوعا بالإيثانول اللامائي لمدة 5 دقائق ، واستبدلها بجولة أخرى من الإيثانول اللامائي الطازج لمدة 5 دقائق.
- اجعل الشريحة شفافة عن طريق إضافة الزيلين لمدة 5 دقائق ، واستبدلها بجولة أخرى من الزيلين الطازج لمدة 5 دقائق ، ثم أغلقها براتنج محايد.
- وضع العلامات الطرفية بوساطة نوكسي نيوكليوتيديل ترانسفيراز (TUNEL) على الغضروف
- قم بتجفيف عينة الغضروف في الإيثانول اللامائي والإيثانول 90٪ والإيثانول 85٪ والإيثانول 75٪ حتى يكتمل ترطيب إزالة الشمع. نقع في برنامج تلفزيوني لمدة 5 دقائق. أضف 3٪ H 2O2 بالتنقيط لمدة 10 دقائق.
- يضاف محلول عمل البروتيناز K بالتنقيط ويهضم على حرارة 37 درجة مئوية لمدة 10 دقائق. أضف 20 ميكرولتر من المخزن المؤقت لوضع العلامات لكل شريحة للحفاظ على رطوبتها والتخلص من السائل الزائد بعد تحضير محلول العمل. أضف 20 ميكرولتر من محلول العمل إلى كل شريحة واحتضانها لمدة ساعتين عند 37 درجة مئوية في صندوق مبلل.
- أضف 50 ميكرولتر من محلول الإغلاق قطرة قطرة وأغلق لمدة 30 دقيقة. ثم أضف 50 ميكرولتر من الأجسام المضادة المضادة للديجوكسين المخفف (1: 100 تخفيف) بالتنقيط واحتضانها عند 37 درجة مئوية لمدة 2 ساعة في صندوق مبلل. أضف 10 ميكرولتر من مخفف الأجسام المضادة SABC (تخفيف 1: 100) بالتنقيط واحتضان عند 37 درجة مئوية لمدة 2 ساعة في صندوق مبلل.
- أضف محلول تطوير اللون DAB (50 ميكرولتر لكل من الكواشف A و B و C في 1000 ميكرولتر من الماء المقطر) بالتنقيط لمدة 10-15 دقيقة. يكتمل تطور اللون عندما يكون حبيبيا أصفر بني.
- إعادة وصمة عار مع الهيماتوكسيلين لمدة 3 ثوان. بعد الجفاف المتدرج والعلاج الشفاف ، جفف في درجة حرارة الغرفة وأغلق الشريحة بعناية باستخدام اللثة المحايدة. انتبه لتجنب ترك الفقاعات والغراء الفائض.
- التحليل الكيميائي المناعي ل IL-1β و TNF-α
- قم بإزالة الشمع من الشرائح بشكل روتيني في الزيلين وقم بترطيبها في كحول متدرج. قم بتعطيل البيروكسيديز الداخلي في الأقسام بنسبة 3٪ H 2 O2. ضع حامل الشريحة في محلول سترات 95 درجة مئوية (درجة الحموضة 6.0) واحتضانها في حمام مائي فوق 95 درجة مئوية لأكثر من 20 دقيقة. أخرج صندوق الحضانة واتركه في درجة حرارة الغرفة لمدة 20 دقيقة على الأقل.
- احتضن 5٪ مصل الماعز العادي مع برنامج تلفزيوني لمدة 10 دقائق عند 37 درجة مئوية وتخلص من السائل الزائد. أضف 150 ميكرولتر من الأجسام المضادة التي أسقطها قطرة واتركها عند 37 درجة مئوية لمدة 1 ساعة ، ثم احفظها طوال الليل عند 4 درجات مئوية. في اليوم التالي ، أعد تسخينه عند 37 درجة مئوية لمدة 45 دقيقة.
- اغسل 3 مرات مع برنامج تلفزيوني لمدة 5 دقائق لكل منهما. قم بتغطية المنديل الموجود على الشريحة ب 3٪ BSA وأغلقه عند 37 درجة مئوية لمدة 30 دقيقة. أضف 150 ميكرولتر من الجسم المضاد II قطرة قطرة واتركه في درجة حرارة الغرفة لمدة 1 ساعة. اغسل 3x باستخدام PBS لمدة 5 دقائق لكل منهما وأضف 150 pL من سائل تطوير اللون DAB بالتنقيط. راقب درجة تلطيخ تحت المجهر حتى تصبح العينة صفراء بنية حتى بالعين المجردة.
- على الفور ، شطف مع برنامج تلفزيوني لمدة 10 دقائق. وصمة عار مرة أخرى مع الهيماتوكسيلين ، وتجفيف في الكحول المتدرج ، وجعل الشرائح شفافة في الزيلين ، وختم مع اللثة محايدة.
- التحليل الإحصائي
- المقاطع الملطخة بالأنسجة المناعية مع التعبير الإيجابي للبروتين المرتبط بها صفراء أو صفراء بنية. سجل شدة التعبير الإيجابي بواسطة برنامج Image J لكل مجموعة من الأقسام الكيميائية المناعية واستخدم معايير التقييم لمتوسط الكثافة البصرية (AOD) ، محسوبة بواسطة IOD مقسومة على المنطقة.
- استخدم برنامج التحليل للتحليل الإحصائي. استخدم اختبار t إذا كانت البيانات مطابقة للتوزيع الطبيعي ومربع كاي واستخدم الاختبار غير المعلمي إذا لم تتوافق مع التوزيع الطبيعي. تحليل بيانات القياس المتكررة عن طريق معادلات التقدير المعممة.
النتائج
اختبارات سلوك الألم
أظهرت نتائج MWT أن MWT للطرف الخلفي الأيمن بعد النمذجة كان أقل بكثير من ذي قبل (p<0.05). بالمقارنة مع المجموعة الضابطة ، كان MWT للفئران مرتفعا بشكل ملحوظ بعد Tuina (p<0.05; الشكل 5 والجدول 2).
Discussion
توفر هذه الدراسة بروتوكولا للتلاعب Tuina على فئران KOA. من خلال اختبارات سلوك الألم والنتائج النسيجية ، اقترح أن مثل هذه السلسلة من التلاعب Tuina المطبقة على فئران KOA يمكن أن تقلل من الالتهاب الزليلي وموت الخلايا المبرمج للغضروف ، والذي يمكن أن يكون مرجعا للتلاعب Tuina على النماذج الحيوانية ل KOA.
...Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل مشروع بناء التخصصات السريرية الحرجة في شنغهاي (رقم المنحة: Shslczdzk04001) ؛ برنامج الإبحار التابع للجنة شنغهاي للعلوم والتكنولوجيا (رقم المنحة: 22YF1444300) ؛ مشاريع ضمن ميزانية جامعة شنغهاي للطب الصيني التقليدي (رقم المنحة: 2021LK091).
Materials
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
References
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24 (2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734 (2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4 (2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l., Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131 (2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224 (2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved