Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Diz Osteoartritli Sıçanlarda Enflamasyonu ve Kıkırdak Kaybını Azaltmak için Tuina Manipülasyonu
Bu Makalede
Özet
Alçı ile immobilize edilmiş diz osteoartriti olan sıçanlarda yapılan Tuina manipülasyonu için bir protokol sunuyoruz. Ön sonuçlara dayanarak, yöntemin etkinliğinin iltihaplanma ve kıkırdak kaybının azaltılmasına dayandığını öne sürdü.
Özet
Klinik çalışmalar, Tuina manipülasyonunun diz osteoartritinin (KOA) tedavisinde etkili olduğunu gösterirken, mekanizmasını keşfetmek için daha fazla çalışmaya ihtiyaç vardır. Bu nedenle, diz osteoartritinin hayvan modellerinin manipülasyonu kritiktir. Bu protokol, KOA sıçanlarında Tuina manipülasyonu için standart bir süreç ve KOA için Tuina mekanizmasının ön araştırmasını sağlar. Pres ve yoğurma manipülasyon yöntemi (vücut yüzeyinin belirli bir bölgesinin preslenmesi ve yoğrulması anlamına gelen bir tür Tuina manipülasyonu), sıçanların diz eklemi etrafındaki 5 akupunktur noktasına uygulanır. Manipülasyonun kuvveti ve sıklığı parmak basıncı kayıtları ile standardize edildi ve manipülasyon sırasında sıçanın konumu protokolde ayrıntılı olarak açıklandı. Manipülasyonun etkisi ağrı davranış testleri ve sinovyal ve kıkırdaktaki mikroskobik bulgularla ölçülebilir. KOA sıçanları ağrı davranışında önemli bir iyileşme gösterdi. Tuina grubunda sinovyal doku inflamatuar infiltrasyonu azaldı ve tümör nekroz faktörü (TNF)-α ekspresyonu anlamlı olarak daha düşüktü. Kontrol grubu ile karşılaştırıldığında, kondrosit apoptozu Tuina grubunda daha azdı. Bu çalışma, KOA sıçanlarında Tuina manipülasyonu için standart bir protokol ve Tuina'nın terapötik etkilerinin sinovyal inflamasyonu ve gecikmiş kondrosit apoptozunu azaltmakla ilişkili olabileceğine dair ön kanıt sunmaktadır.
Giriş
Diz osteoartriti (KOA), esas olarak eklem ağrısı ile kendini gösteren dejeneratif bir hastalıktır. Fibrozis, çatlama, ülserasyon ve eklem kıkırdağı kaybı bu hastalığın başlıca nedenleridir1. KOA'nın prevalansı yüksektir ve hastaların günlük yaşamları üzerinde derin bir etkiye neden olarak ciddi vakalarda sakatlığa neden olabilir. 45-84 yaş arası kişilerde KOA prevalansı yaşla birlikte artar ve 85 yaş ve üzeri kişilerde görülme sıklığı %15 olup, kadınlarda baskındır 2,3. Buna ek olarak, KOA hem bireye hem de topluma ciddi bir ekonomik yük getirebilir. Bir anket, kişi başına KOA'daki doğrudan sağlık bakım maliyetlerinin yılda 8.858 $ ± 5.120 $'a ulaştığını gösterdi4. Toplumun yaşlanmasıyla birlikte KOA, dünya çapında bir sağlık sorunu ve önemli bir sosyal sorun haline geldiği gibi, bilimsel araştırmalar için güncel bir konu haline gelmiştir.
Kanıta dayalı çalışmalar, Tuina manipülasyonunun KOA5 tedavisinde etkinliğini göstermiştir. Tuina manipülasyonu, mekanizması anti-enflamatuar etkilerle ilişkili olan KOA hastalarında ağrıyı hafifletebilir ve işlev bozukluğunu iyileştirebilir 6,7. Bilim adamları, Tuina manipülasyonunun inflamatuar faktörler interlökin (IL)-β ve 5-hidroksitriptamin ekspresyonunu etkili bir şekilde inhibe ettiğini ve bir tavşan KOA model8'de eklem kıkırdağının dejenerasyonunu yavaşlattığını buldular. Tuina'nın lezyon bölgesinde kan dolaşımını ve metabolizmasını destekleyebileceğini, bunun da IL-1, IL-6 ve tümör nekroz faktörü (TNF)-α gibi enflamatuar faktörlerin temizlenmesine yardımcı olduğunu ve böylece KOA9'un klinik semptomlarını hafiflettiğini öne sürdü. Ek olarak, eklemin Tuina manipülasyonu yoluyla pasif hareketi, sinovyal sıvının eklem kıkırdağına nüfuz etmesini ve difüzyonunu teşvik edebilir ve doku besin metabolizmasınıiyileştirir 10. Diğer çalışmalar, Tuina manipülasyonunun KOA hastalarında biyomekanik indeksleri etkili bir şekilde iyileştirebileceğini göstermiştir11. Yumuşak dokulara uygulanan manipülasyonlar, uzuvlar üzerindeki stres dağılımını iyileştirebilir ve denge fonksiyonunu geliştirebilir12,13. Aynı zamanda, bazı eklem ayarlama manipülasyonları ile, anormal yürüyüşleri düzeltmek için alt ekstremitelerin hizalanması daayarlanabilir 14,15.
Tuina manipülasyonunun KOA tedavisinde etki mekanizması araştırılmaya devam etmektedir ve bu nedenle deneysel bir çalışma gereklidir. Tuina'nın deney hayvanlarında uygulanmasının anahtarı, modelleme, hayvan fiksasyonu ve müdahale yöntemlerinin standardizasyonudur16. Modelleme yöntemi, deney hayvanının hastalığın özelliklerini sergileyip sergileyemeyeceğini belirler. Bu arada, uygun fiksasyon yöntemleri Tuina manipülasyonunun müdahalesini kolaylaştırabilir ve Tuina'nın etkisini daha iyi yansıtabilir. Müdahale yöntemlerinin standardizasyonu Tuina manipülasyonunun en zor kısmıdır. 2010 yılında, Çin akupunktur standartlarının temel sistemi, deney hayvanları için akupunktur noktası standartlarından bahsederek, hayvan deneylerinde akupunktur ve Tuina operasyonlarına olanak sağlamıştır17. Bununla birlikte, Tuina manipülasyonunu standartlaştırmada hala zorluklar var. Tuina manipülasyonunun birden fazla türü vardır18. Spesifik manipülasyonun seçimi esas olarak tedavi edilecek hastalığa ve sanatçının tercih ettiği terapötik teorilere bağlıdır. Tuina'nın KOA için yaptığı çalışmada, nokta basma manipülasyonuna (başparmak veya dirsek ile belirli akupunktur noktalarına basma), Yizhichan itme manipülasyonuna (başparmağı kıpırdatarak itme manipülasyonu) ve pres ve yoğurma manipülasyonuna (vücut yüzeyinin belirli bölgesinin parmak veya avuç içi ile bastırılması ve yoğrulması anlamına gelir) daha fazla dikkat edilmiştir.19. Pres ve yoğurma manipülasyonu, deri altı dokusunu hareket ettirmek için presleme ve yoğurmayı birleştiren en yaygın kullanılan Tuina manipülasyonlarından biridir20. Akupunktur noktalarına uygulanan pres ve yoğurma manipülasyonu kan dolaşımını hızlandırabilir ve ağrıyı hafifletebilir ve Tuina'nın KOA19 üzerindeki terapötik etkisini temsil eder.
Bu protokolde, KOA sıçanları üzerinde pres ve yoğurma manipülasyonunun çalışması, gelecekteki araştırmalar için bir referans sağlamak amacıyla, seçilen akupunktur noktaları, manipülasyonun yoğunluğu ve sıklığı ve sıçanın vücut pozisyonu dahil olmak üzere ayrıntılı olarak açıklanacaktır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu çalışma, Şanghay Geleneksel Çin Tıbbı Üniversitesi'ne bağlı entegre geleneksel Çin ve batı tıbbı Yueyang Hastanesi deneysel hayvan etik komitesi tarafından yürütülen hayvan etiği incelemesini geçmiştir (YYLAC-2022-166).
1. Deney hayvanı hazırlama ve gruplandırma
- Hayvan Hazırlama
- Oda sıcaklığında (18-21 °C), nem% 40 -% 50, 12 saat: 12 saat sirkadiyen ritim değişimlerinde 200-220 g'lık toplam 10 sağlıklı SPF SD dişi sıçan yetiştirin. Ağrı ile ilgili hayvan deneylerini, hayvan etik yönergelerinin ve yönergelerinin ilgili hükümlerine sıkı sıkıya bağlı kalarak yürütün.
- Hayvanların gruplandırılması
- Sıçanları rastgele Tuina grubuna ve kontrol grubuna bölün. Tuina grubunun sıçanlarını, modellemeden sonra 21 gün boyunca pres ve yoğurma manipülasyonu ile tedavi edin. Kontrol grubunun farelerini aynı Tuina odasına koyun ve Tuina grubu tedavi görürken aynı anda siyah bir bez torbaya koyun.
2. Hayvanların modellenmesi
- Hayvanın uyuşturulması
- Gaz anestezisi için izofluran kullanın. Sıçanı% 3'lük bir indüksiyon konsantrasyonu ile indüksiyon kutusuna yerleştirin. Sıçanı yatırdıktan sonra kutuyu sallayın ve sıçan yüzüstü pozisyona dönme girişiminde bulunmadan yuvarlandığında anesteziyi onaylayın.
- Fareyi indüksiyon kutusundan çıkarın ve burnunu anestezik maskeye sabitleyin. Anesteziyi korumak için izofluran konsantrasyonunu% 2'ye ayarlayın. Sıçan pençelerini sıkıştırırken yanıt vermediğinde anesteziyi onaylayın. Göz kapakları kapatılamadığı için sıçanlar uyuşturulduğunda kuruluğu önlemek için sıçanlara göz merhemi sürün.
- Modelleme yöntemi21
- Sağ arka bacaktaki tüyleri almak için tıraş makinesini kullanın. Sıçanın sağ ayak bileği ile kalça eklemi arasına tıbbi bir pamuklu ped yerleştirin. Sağ diz eklemini 5-6 kat ıslak alçı bandajla 180° uzatmada eşit şekilde sabitleyin. Alçı bandajı ayak bileğinden başlayarak bir öncekinin 1 / 3'ünü kaplayacak şekilde spiral sarın. Alçıyı kurutmak ve sertleştirmek için bir saç kurutma makinesi kullanın.
- Alçıyı sabitlemek ve kemirmesini önlemek için alçı bandaj kuruduktan ve sertleştikten sonra alçıyı protez taban malzemesi ile dış cephe sarın.
- Yapışkan hale getirmek için protez taban malzemelerini karıştırın ve karışımı alçının dışına yapıştırın (karışım bandajın kenarını geçmemelidir, Şekil 1). Karışım sertleştikten sonra anestezi makinesini kapatın ve hayvanın doğal olarak uyanmasını bekleyin. Sıçanlar uyanmadan önce anestezi kazalarını önlemek için sıçanları denetleyin.
- Alçıyı farenin sağ arka ayağına uygun şekilde sabitleyin, çünkü sıkı bir sabitleme kan dolaşımını kısıtlarken, gevşek bir sabitleme düşme eğilimindedir. Terminal uzuvdaki kan dolaşımını gözlemleyin. Terminal ekstremitenin şişmesi veya mor bir cilt tespit edilirse, dolaşımın geri kazanılmasına yardımcı olmak için alçının bir kısmını derhal kesin. Alçı kırılırsa ve alt ekstremite uzantısını koruyamazsa yeniden yapın.
- 3 haftalık sürekli immobilizasyondan sonra alçıyı çıkarın. Protez taban malzemesini dışarıya ve alçı bandajı kesmek için cerrahi makas kullanın. Sıçanın alt ekstremitesini tuzlu su ile durulayın ve gazlı bezle kurulayın. Lokal cilt lezyonları varsa, iyodofor ile sterilize edin.
- Model doğrulama22
- X-ışını tabanlı doğrulama
- Modellemenin bitiminden 1 gün sonra sağ diz röntgen muayenesi yapın. 30°'de kalça fleksiyonu, 0°'de diz ekstansiyonu ve 15°'de kalça abdüksiyonu ile sırtüstü pozisyonda anteroposterior radyografiler çekin. Patellayı doğrudan dizin önünde tutun ve radyatör borusunu diz ekleminden 110 mm uzağa yerleştirin.
- Sağ kalça fleksiyonu 30° ve sağ diz ekstansiyonu 0° olacak şekilde sağ lateral dekübit pozisyonunda lateral radyografiler çekin. Sol ekstremite kalça fleksiyonunu 70°'de ve diz fleksiyonunu 45°'de yapın ve radyatör borusunu diz ekleminden 110 mm uzağa yerleştirin. Algılama parametrelerini pozlama voltajı 50 kV, akım 250 mA, maruz kalma dozu 32 mAs ve maruz kalma süresi 128 ms olarak ayarlayın.
- Normal sıçanların röntgeni ile karşılaştırın, modellenen diz röntgeninin kenarda osteofit hiperplazisi ile daha dar eklem alanı gösterdiğini kontrol edin.
- Uluslararası Osteoartrit Araştırma Derneği (OARSI) puanlaması23
- Sıçanı ötenazi kutusuna yerleştirin ve CO2'yi dakikada% 30 -% 70 kafes hacmi oranında perfüze edin. Sıçanın hareketsiz olduğunu, nefes almadığını ve göz bebeğinin genişlediğini tespit ettikten sonra CO2 perfüzasyonunu durdurun. Ölümü doğrulamak için 2 dakika daha gözlemleyin.
NOT: Servikal çıkık, ölümü doğrulamak için ikincil bir form olarak CO2 bazlı ötenaziden sonra yapılabilir. Fareyi masanın üzerine sabitleyin ve kuyruğunu bir elinizle kavrayın. Diğer elin başparmağı ve işaret parmağı ile farenin kafasına bastırın. Bir çatlak sesi duyduğunuzda ölümü onaylayın ve sıçan aynı anda hareket ve kalp atışını kaybeder. - Sıçanı, bir köpük levha üzerinde bir şırınga iğnesi ile sırtüstü pozisyonda sabitleyin, sağ arka bacak abdüksiyon ve dış rotasyonda bükülür. Diz ekleminin etrafındaki cildi cerrahi makasla sıkıştırın. Diz eklemi çevresindeki kasları, cildi keserek ve ardından deri altı fasyayı keserek ortaya çıkarın.
- Femur ve tibia diyafizini kemik makasla kesin ve sağ diz eklemini çıkarın. Eklemin dışındaki kaslar ve bağlar gibi ekstra yumuşak dokuları nazikçe çıkarın.
- Eklemi 4 ° C'de 24-48 saat boyunca% 4 paraformaldehit içinde sabitleyin. Eklemi% 10 formik asit çözeltisinde, kemik dokusu bir iğne ile kolayca deklare edilene kadar 3 gün boyunca dekalsifiye edin.
- Kireçten arındırılmış dokuyu çeker ocak içine yerleştirin ve düzeltin ve dehidrasyon makinesindeki bir dehidrasyon kutusuna aktarın. 4 saat boyunca% 75 etanol, daha sonra 2 saat% 90 etanol, ardından 1 saat% 95 etanol, 30 dakika boyunca mutlak etanol, 30 dakika boyunca başka bir tur taze mutlak etanol, 5-10 dakika boyunca alkol benzen, 5-10 dakika boyunca ksilen, 5-10 dakika boyunca başka bir tur taze ksilen, 1 saat boyunca balmumu, 1 saat boyunca başka bir tur taze balmumu, ve dehidrasyon ve şeffaf balmumu daldırma için 1 saat boyunca son taze balmumu turu.
- Ardından, gömmek için mendili makineye yerleştirin. Parafin sertleştikten sonra balmumu bloğunu 4 μm'lik balmumu dilimleri halinde kesin ve dilimi ılık suda düzleştirin. Dilimi bir cam slayt üzerine yerleştirin ve kurutun. Oda sıcaklığında saklayın.
- Kıkırdak örneğini gözlemleyin ve OA kıkırdak histopatoloji derecesi değerlendirmesine göre puanlayın (Tablo 1)23. Modelleme sonrası sıçanların skoru normal sıçanlarınkinden anlamlı olarak yüksekse, modelleme başarılı olmuştur.
- Sıçanı ötenazi kutusuna yerleştirin ve CO2'yi dakikada% 30 -% 70 kafes hacmi oranında perfüze edin. Sıçanın hareketsiz olduğunu, nefes almadığını ve göz bebeğinin genişlediğini tespit ettikten sonra CO2 perfüzasyonunu durdurun. Ölümü doğrulamak için 2 dakika daha gözlemleyin.
- X-ışını tabanlı doğrulama
Tablo 1. OA kıkırdak histopatoloji derecesi değerlendirmesi. Derece, kıkırdak içine derinlik ilerlemesidir. Toplam puan = Sınıf x Evreleme. Normal eklemler için 0, şiddetli artrit için 24. Bu Tabloyu indirmek için lütfen buraya tıklayın.

Şekil 1. Sıçanlar alçıda hareketsiz hale getirildi. Sıçanlar uyuşturulduktan sonra, sağ alt ekstremiteleri alçı bandajlarla sarıldı, hiperekstansiyon pozisyonunda sabitlendi ve dışarıda bir protez taban malzemesi tabakası ile kaplandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Tuina manipülasyonu
- Uygulama alanı
- Sıçanların sağ arka ekstremitesinde ST34, ST35, SP10, EX-LE4 ve BL40 dahil olmak üzere toplam 5 akupunktur noktası seçin (Şekil 2). Akupunktur noktalarını 24'teki akupunktur noktası konumlandırma ilkelerine göre bulun.
- Başvuru pozisyonu
- Bir tarafı açık 9 cm x 15 cm'lik bir torbaya siyah bir bez kesin ve açıklığı bir iple sıkın. Tuina manipülasyonundan önce, farenin kuyruğunu yavaşça çekerek torbaya girmesini sağlayın ve arka bacaklarını torbanın dışına çıkarın.
- Sıçanı yüzüstü pozisyonda tutmak için bir elinizi kullanın, kuyruğunu ve arka bacağını tutarken, diğer elinizle belirli bir akupunktur noktasına baskı ve yoğurma manipülasyonu uygulayın (Şekil 3).
- Tuina manipülasyonu
- Sağ arka bacaktaki 5 akupunktur noktasına her biri 2 dakika boyunca pres ve yoğurma manipülasyonu uygulayın. Ritmik pres ve yoğurma yapmak için sanatçının başparmağını seçilen akupunktur noktasına yerleştirin, cildi ve deri altı dokusunu dairesel bir hareketle birlikte hareket ettirin.
- Manipülasyonun tutarlı yoğunluğunu ve sıklığını sağlamak için parmak basıncı kayıtlarını (Newton cinsinden birimler) kullanın. Yoğunluğu 3-5 N arasında ve frekansı 2 Hz'de tutun (Şekil 4). Manipülasyonu 21 gün boyunca günde bir kez uygulayın.

Şekil 2. Akupunktur noktaları pozisyonu. SP10, sıçanlarda iç diz ekleminin 5 mm yukarısında bulunur. ST34, sıçanlarda dış diz ekleminin 5 mm yukarısında bulunur. EX-LE4, sıçanlarda diz bağının medial tarafında bulunur. ST35, sıçanlarda diz bağının lateral tarafında bulunur. BL40, enine popliteal şeridin orta noktasında bulunur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
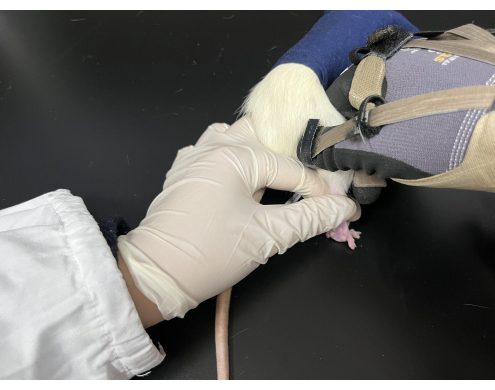
Şekil 3. Sıçanlara uygulanan Tuina manipülasyonu. Sıçanlar, arka bacakları açıkta kalacak şekilde siyah bir torbada tutuldu. Oyuncu, farenin kuyruğunu sol eliyle tutarken, sağ el manipülasyonu gerçekleştirdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. Parmak basıncı kayıtları. Tuina manipülasyonu sürecindeki yoğunluk ve frekans hakkında gerçek zamanlı geri bildirim için parmak basıncının kuvvetini ve sıklığını kaydeden bir cihaz kullanılır. (A) Basınç sensörü ve iletim ekipmanı. (B) Parmak basıncı kayıtları. (C) Tuina manipülasyonu sırasında kaydedilen kuvvet. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Ağrı Davranış Testleri
- Modellemeden önce ve sonra ve (D1) 1 gün sonra, 7 gün sonra (D7), 14 gün sonra (D14) ve 21 gün sonra (D21) Tuina manipülasyonu, mekanik geri çekilme eşiği ve pençe geri çekilme gecikme testleri dahil olmak üzere ağrı davranışını test edin.
- Mekanik geri çekilme eşiği (MWT)
- Sıçanları, 10 mm x 10 mm açıklıkta bir tel kafesten oluşan 40 cm yüksekliğinde bir sahneye yerleştirilmiş 20 cm x 10 cm x 20 cm şeffaf temperli cam kabine yerleştirin. Oda sıcaklığını 23 °C ± 2 °C arasında tutun.
- Resmi testin başlangıcında hayvanların çevreye uyum sağlayamaması nedeniyle test sonuçlarına müdahale etmemek için davranışsal test aşamasında fareleri günde en az 2 saat davranış laboratuvarında bekletin. Çevreye adaptasyonlarını kolaylaştırmak ve dikkat dağıtıcı faktörleri azaltmak için fareleri resmi testin başlamasından 30 dakika önce davranış laboratuvarına yerleştirin.
- MWT'yi ölçmek için elektronik Von Frey lifleri kullanın. Sıçanı ayağının ortasındaki lifle uyarın ve sıçan bacağını kaldırma ve kaçınma gibi belirgin hareketler gösterdiğinde lifi geri çekin. Makine bu anda maksimum basınç değerini (N) otomatik olarak kaydedebilir.
- Mevcut stimülasyondan en az 15 saniye sonra aynı sıçanda bir sonraki stimülasyonu başlatın. Sıçanların pençelerinde dokunsal uyaranlara karşı duyarlılığı önlemek için her stimülasyon sırasında 5 saniyeyi geçmeyin. Ardışık üç ölçüm arasındaki fark önemsiz olana kadar (5 N içinde) testi 10x tekrarlayın.
- Büyük farkları olan değerleri (maksimum ve minimum değerler) silin ve kalan üç değerin ortalamasını mekanik para çekme eşiği olarak alın.
- Pençe çekme gecikmesi (PWL)
- Fareleri 20 cm x 10 cm x 20 cm boyutlarında küçük bir şeffaf temperli cam bölmeye yerleştirin. Bölmenin üstünü havalandırma delikleri olan şeffaf bir cam kapakla örtün. Bölmenin yerleştirildiği şeffaf cam plakanın sıcaklığını 28-30 °C'de tutun.
- Her resmi testin başlamasından önce iklimlendirmek için fareleri en az 30 dakika bu ortama yerleştirin. Sıçanlar bölmede idrar yapar veya dışkılarsa, sonraki ışık radyasyonu ısı transferini etkilememek için zamanında emici kağıtla temizleyin.
- Spot ışığını farenin ayağının ortasına odaklayın ve Başlat düğmesine basın. Sıçan ayak geri çekilmesi veya pençe yalama gibi bariz davranışlar gösterdiğinde Durdur düğmesine basın ve bu noktada zamanı kaydedin. Sıçanın cildine zarar vermemek için spot ışığı ışınlama süresi 20 saniyeyi geçmemelidir.
- Hassaslaşmayı önlemek için bir sonraki ışınlamayı en az 10 dakika sonra aynı sıçan üzerinde gerçekleştirin. Her sıçan üzerinde 5x ölçün.
- Büyük farkları olan değerleri kaldırın (maksimum ve minimum değer). Kalan değerlerin ortalamasını PWL olarak alın.
5. Numune hazırlama
- 2.3.2.1'de açıklandığı gibi fare üzerinde ötenazi gerçekleştirin.
- Sinovyal membran hazırlığı
- Sıçanı, bir köpük levha üzerinde bir şırınga iğnesi ile sırtüstü pozisyonda sabitleyin, sağ arka bacak abdüksiyon ve dış rotasyonda bükülür. Diz ekleminin etrafındaki cildi cerrahi makasla sıkıştırın ve cildi keserek ve ardından deri altı fasyayı keserek sıçanların diz eklemi etrafındaki kasları ortaya çıkarın.
- Patella ligamentinin üzerindeki kas gruplarını soymak için patella ligamentini bir dönüm noktası olarak alın. Patellar ligamanın ucunu (tibial tüberozitede) dikkatlice kesin ve ligament aşağıdan yukarı doğru sıkıştığında sinovyal membranı bulun.
- Sinovyal dokuyu oftalmik makasla dikkatlice kesin ve kanı ve sinovyal sıvıyı önceden soğutulmuş salinle yıkayın. Temiz gazlı bezle doku yüzeyinden su emdikten sonra sinovyal membranı en az 48 saat boyunca% 4 paraformaldehit içinde sabitleyin.
- Numuneyi 2.3.2.5- 2.3.2.6 adımlarındaki gibi hazırlayın. Puanlamayı 2.3.2.7 adımındaki gibi gerçekleştirin.
- Hematoksilen ve eozin boyamanın yapılması
- 20 dakika boyunca ksilen ile suya dewax yapın, 20 dakika boyunca başka bir tur taze ksilen ile değiştirin, ardından 5 dakika boyunca susuz etanol ile muamele edin, 5 dakika boyunca başka bir tur taze susuz etanol ile değiştirin, daha sonra 5 dakika boyunca hacimce %90 etanol, 5 dakika boyunca hacimce %80 etanol, 5 dakika boyunca hacimce %70 etanol ekleyin, ve son olarak 5 dakika damıtılmış su.
- Slaytı 3-8 dakika hematoksilen boyama çözeltisine daldırın. Slaytı çıkarın ve lekeyi damıtılmış suyla durulayın. Neredeyse 30 saniye boyunca farklılaşma sıvısına (% 1 hidroklorik asit alkol) taşıyın, böylece slayt soluk maviye döner. Damıtılmış suyla durulayın ve 1-3 dakika eozin boyama solüsyonuna koyun.
- Slaytı 5 dakika boyunca %95 etanol hacim fraksiyonu ile kurutun, 5 dakika boyunca başka bir tur taze %95 etanol ile değiştirin, ardından 5 dakika boyunca susuz etanol ile değiştirin, 5 dakika boyunca başka bir tur taze susuz etanol ile değiştirin.
- 5 dakika ksilen ekleyerek slaydı şeffaf hale getirin, 5 dakika boyunca başka bir tur taze ksilen ile değiştirin ve ardından nötr reçine ile kapatın.
- Kıkırdak üzerinde terminal-deoksinükleotidil transferaz aracılı çentik ucu etiketleme (TUNEL)
- Mum alma hidrasyonu tamamlanana kadar kıkırdak örneğini susuz etanol, %90 etanol, %85 etanol ve %75 etanol içinde kurutun. PBS'de 5 dakika bekletin. 10 dakika boyunca damla damla %3H2O2ekleyin.
- Proteinaz K çalışma solüsyonunu damla damla ekleyin ve 37 °C'de 10 dakika sindirin. Nemli tutmak için dilim başına 20 μL etiketleme tamponu ekleyin ve çalışma solüsyonunu hazırladıktan sonra fazla sıvıyı silkeleyin. Her slayta 20 μL çalışma solüsyonu ekleyin ve ıslak bir kutuda 37 °C'de 2 saat inkübe edin.
- 50 μL kapatma solüsyonunu damla damla ekleyin ve 30 dakika kapatın. Daha sonra damla damla 50 μL seyreltilmiş biyotinile anti-digoksin antikoru (1:100 seyreltme) ekleyin ve ıslak bir kutuda 37 °C'de 2 saat inkübe edin. Damla damla 10 μL SABC antikor seyreltici (1:100 seyreltme) ekleyin ve ıslak bir kutuda 37 °C'de 2 saat inkübe edin.
- DAB renk geliştirme solüsyonunu (1000 μL damıtılmış su içinde A, B ve C reaktiflerinin her biri 50 μL) damla damla 10-15 dakika ekleyin. Renk gelişimi kahverengimsi sarı tanecikli olduğunda tamamlanır.
- 3 saniye boyunca hematoksilen ile tekrar boyayın. Gradyan dehidrasyon ve şeffaf işlemden sonra, oda sıcaklığında kurutun ve slaytı nötr sakızla dikkatlice kapatın. Kabarcık ve taşan tutkal bırakmamaya dikkat edin.
- IL-1β ve TNF-α'nin immünohistokimyasal analizi
- Slaytları rutin olarak ksilen içinde mumdan arındırın ve gradyan alkolle nemlendirin. Endojen peroksidazı% 3H2O2ile bölümlerde inaktive edin. Sürgü tutucuyu 95 °C sitrat tamponuna (pH 6.0) yerleştirin ve 95 °C'nin üzerindeki bir su banyosunda 20 dakikadan fazla inkübe edin. Kuluçka kutusunu çıkarın ve en az 20 dakika oda sıcaklığında bırakın.
- %5 normal keçi serumunu PBS ile 37 °C'de 10 dakika inkübe edin ve fazla sıvıyı silkeleyin. 150 μL antikor I damla damla ekleyin ve 37 °C'de 1 saat bekletin, ardından gece boyunca 4 °C'de saklayın. Ertesi gün 37 °C'de 45 dakika tekrar ısıtın.
- Her biri 5 dakika boyunca PBS ile 3x yıkayın. Slayt üzerindeki dokuyu %3 BSA ile örtün ve 37 °C'de 30 dakika kapatın. Damla damla 150 μL antikor II ekleyin ve oda sıcaklığında 1 saat bekletin. Her biri 5 dakika boyunca PBS ile 3x yıkayın ve damla damla 150 pL DAB renk geliştirme sıvısı ekleyin. Numune çıplak gözle bile kahverengimsi sarı olana kadar mikroskop altında boyama derecesini gözlemleyin.
- Hemen, PBS ile 10 dakika durulayın. Hematoksilen ile tekrar boyayın, gradyan alkolde dehidre edin, slaytları ksilen içinde şeffaf hale getirin ve nötr sakızla kapatın.
- İstatistiksel analiz
- İlişkili proteinin pozitif ekspresyonu ile immünohistokimyasal olarak boyanmış bölümler sarı veya kahverengimsi sarıdır. Her bir immünohistokimyasal kesit grubu için Image J yazılımı ile pozitif ekspresyon yoğunluğunu puanlayın ve alana bölünen IOD ile hesaplanan ortalama optik yoğunluğun (AOD) değerlendirme kriterlerini kullanın.
- İstatistiksel analiz için analiz yazılımı kullanın. Veriler normal dağılıma uyuyorsa t-testi, normal dağılıma uymuyorsa parametrik olmayan testi kullanın. Genelleştirilmiş tahmin denklemleri ile tekrarlanan ölçüm verilerini analiz edin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Ağrı davranış testleri
DYT sonuçları, modelleme sonrası sağ arka ekstremitenin DYT'sinin öncekine göre anlamlı olarak daha düşük olduğunu gösterdi (p<0.05). Kontrol grubu ile karşılaştırıldığında, sıçanların DYT'si Tuina'dan sonra anlamlı olarak yükseldi (p<0.05; Şekil 5 ve Tablo 2).
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışma, KOA sıçanlarında Tuina manipülasyonu için bir protokol sağlar. Ağrı davranış testleri ve histomorfolojik bulgular sayesinde, KOA sıçanlarına uygulanan böyle bir dizi Tuina manipülasyonunun, KOA'nın hayvan modellerinde Tuina manipülasyonunun bir referansı olabilecek sinovyal inflamasyonu ve kıkırdak apoptozunu azaltabileceğini öne sürdü.
Protokol sırasında birkaç kritik prosedür vardır. İlk olarak, KOA modelini indüklemek için uygun bir yöntem se?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Şanghay Kritik Klinik Uzmanlıklar İnşaat Projesi (Hibe Numarası: Shslczdzk04001) tarafından desteklenmiştir; Şanghay Bilim ve Teknoloji Komisyonu'nun Yelken programı (Hibe Numarası: 22YF1444300); Şanghay Geleneksel Çin Tıbbı Üniversitesi bütçesi dahilindeki projeler (Hibe Numarası: 2021LK091).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
Referanslar
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24(2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734(2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4(2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l, Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131(2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224(2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır