Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Manipulación de Tuina para reducir la inflamación y la pérdida de cartílago en ratas con artrosis de rodilla
En este artículo
Resumen
Presentamos un protocolo para la manipulación de Tuina realizada en ratas con artrosis de rodilla inmovilizada por yeso. Sobre la base de los resultados preliminares, sugirió que la eficacia del método se basaba en la reducción de la inflamación y la pérdida de cartílago.
Resumen
Los ensayos clínicos sugieren que la manipulación de Tuina es eficaz en el tratamiento de la osteoartritis de rodilla (KOA), mientras que se requieren más estudios para descubrir su mecanismo. Por lo tanto, la manipulación de modelos animales de artrosis de rodilla es fundamental. Este protocolo proporciona un proceso estándar para la manipulación de Tuina en ratas KOA y una exploración preliminar del mecanismo de Tuina para KOA. El método de manipulación de presión y amasamiento (un tipo de manipulación Tuina que se refiere a presionar y amasar el área específica de la superficie del cuerpo) se aplica en 5 puntos de acupuntura alrededor de la articulación de la rodilla de ratas. La fuerza y la frecuencia de la manipulación se estandarizaron mediante registros de presión de los dedos, y la posición de la rata durante la manipulación se describe en detalle en el protocolo. El efecto de la manipulación se puede medir mediante pruebas de comportamiento del dolor y hallazgos microscópicos en el sinovial y el cartílago. Las ratas KOA mostraron una mejora significativa en el comportamiento del dolor. La infiltración inflamatoria del tejido sinovial se redujo en el grupo de Tuina y la expresión del factor de necrosis tumoral (TNF)-α fue significativamente menor. En comparación con el grupo control, la apoptosis de condrocitos fue menor en el grupo Tuina. Este estudio proporciona un protocolo estandarizado para la manipulación de Tuina en ratas KOA y pruebas preliminares de que los efectos terapéuticos de Tuina pueden estar relacionados con la reducción de la inflamación sinovial y el retraso de la apoptosis de los condrocitos.
Introducción
La artrosis de rodilla (KOA) es una enfermedad degenerativa que se manifiesta principalmente en dolores articulares. La fibrosis, el agrietamiento, la ulceración y la pérdida de cartílago articular son las principales causas de esta enfermedad1. El KOA tiene una alta prevalencia y puede tener un profundo impacto en la vida diaria de los pacientes, causando discapacidad en casos graves. Entre las personas de 45 a 84 años, la prevalencia de KOA aumenta con la edad, y la prevalencia entre las personas de 85 años y más es del 15%, con predominio en mujeres 2,3. Además, el KOA puede suponer una grave carga económica tanto para el individuo como para la sociedad. Una encuesta mostró que los costos directos de atención médica en KOA per cápita alcanzaron hasta $8,858 ± $5,120 por año4. Con el envejecimiento de la sociedad, el KOA se ha convertido en un problema de salud mundial y en un importante problema social, así como en un tema de actualidad para la investigación científica.
Los estudios basados en la evidencia han demostrado la eficacia de la manipulación de Tuina en el tratamiento de la KOA5. La manipulación de Tuina podría aliviar el dolor y mejorar la disfunción en pacientes con KOA, cuyo mecanismo está relacionado con efectos antiinflamatorios 6,7. Los investigadores encontraron que la manipulación de Tuina inhibió eficazmente la expresión de los factores inflamatorios interleucina (IL)-β y 5-hidroxitriptamina y ralentizó la degeneración del cartílago articular en un modelo KOA de conejo8. Sugirió que Tuina podría promover la circulación sanguínea y el metabolismo en el sitio de la lesión, lo que ayudó a eliminar factores inflamatorios como IL-1, IL-6 y factor de necrosis tumoral (TNF)-α, aliviando así los síntomas clínicos de KOA9. Además, el movimiento pasivo de la articulación a través de la manipulación de Tuina puede promover la penetración y difusión del líquido sinovial en el cartílago articular y mejorar el metabolismo de los nutrientes tisulares10. Otros estudios sugirieron que la manipulación de Tuina puede mejorar efectivamente los índices biomecánicos en pacientes con KOA11. Las manipulaciones aplicadas sobre los tejidos blandos pueden mejorar la distribución del estrés sobre las extremidades y mejorar la función del equilibrio12,13. Al mismo tiempo, con algunas manipulaciones de ajuste articular, también se puede ajustar la alineación de las extremidades inferiores para corregir marchas anormales14,15.
El mecanismo de acción de la manipulación de Tuina en el tratamiento de la KOA aún no se ha explorado, por lo que es necesario un estudio experimental. La clave para la aplicación de Tuina en animales de experimentación es la estandarización de los métodos de modelado, fijación animal e intervención16. El método de modelización determina si el animal de experimentación puede exhibir las características de la enfermedad. Mientras tanto, los métodos de fijación apropiados pueden facilitar la intervención de la manipulación de Tuina y reflejar mejor el efecto de Tuina. La estandarización de los métodos de intervención es la parte más difícil de la manipulación de Tuina. En 2010, el sistema básico de estándares chinos de acupuntura mencionó los estándares de puntos de acupuntura para animales de experimentación, proporcionando la posibilidad de operaciones de acupuntura y Tuina en experimentos con animales17. Sin embargo, todavía hay dificultades para estandarizar la manipulación de Tuina. Existen múltiples tipos de manipulación de Tuina18. La elección de la manipulación específica depende principalmente de la enfermedad a tratar y de las teorías terapéuticas que prefiera el intérprete. En el estudio de Tuina para KOA, se ha prestado más atención a la manipulación de presión de puntos (presionar los puntos de acupuntura específicos con el pulgar o el codo), la manipulación de empuje de Yizhichan (una manipulación de empuje moviendo el pulgar) y la manipulación de presión y amasamiento (que se refiere a presionar y amasar el área específica de la superficie del cuerpo con el dedo o la palma de la mano)19. La manipulación de prensa y amasamiento es una de las manipulaciones de Tuina más utilizadas, que combina el prensado y el amasamiento para mover el tejido subcutáneo20. La manipulación de la presión y el amasamiento aplicados en los puntos de acupuntura puede promover la circulación sanguínea y aliviar el dolor y representa el efecto terapéutico de Tuina en KOA19.
En este protocolo, se describirá en detalle la operación de manipulación de prensa y amasado en ratas KOA, incluyendo los puntos de acupuntura seleccionados, la intensidad y frecuencia de la manipulación y la posición corporal de la rata, con el fin de proporcionar una referencia para futuras investigaciones.
Protocolo
Este estudio ha superado la revisión de ética animal realizada por el comité de ética animal experimental del Hospital Yueyang de medicina tradicional china y occidental integrada afiliado a la Universidad de Medicina Tradicional China de Shanghái (YYLAC-2022-166).
1. Preparación y agrupación de animales de experimentación
- Preparación Animal
- Cría un total de 10 ratas hembras SPF SD sanas de 200-220 g a temperatura ambiente (18-21 °C), humedad 40%-50%, alternancias del ritmo circadiano de 12 h: 12 h. Llevar a cabo experimentos con animales relacionados con el dolor en estricto cumplimiento de las disposiciones pertinentes de las directrices y directrices éticas de los animales.
- Agrupación de animales
- Divida aleatoriamente las ratas en el grupo Tuina y el grupo de control. Tratar a las ratas del grupo Tuina con manipulación de prensa y amasado durante 21 días después del modelado. Coloque las ratas del grupo de control en la misma habitación de Tuina y colóquelas en una bolsa de tela negra simultáneamente mientras el grupo de Tuina se somete al tratamiento.
2. Modelado de animales
- Anestesiar al animal
- Use isoflurano para la anestesia con gases. Coloque la rata en la caja de inducción con una concentración de inducción del 3%. Agite la caja después de acostar a la rata y confirme la anestesia cuando la rata se dé la vuelta sin intentar volver a la posición prona.
- Saca a la rata de la caja de inducción y fija su nariz en la máscara anestésica. Ajuste la concentración de isoflurano al 2% para mantener la anestesia. Confirme la anestesia cuando la rata no responda al pellizcarse las patas. Aplique ungüento para los ojos a las ratas para evitar la sequedad cuando las ratas están anestesiadas, ya que los párpados no se pueden cerrar.
- Método de modelado21
- Use una máquina de afeitar para eliminar el vello de la extremidad trasera derecha. Coloque una almohadilla de algodón médico entre el tobillo derecho y la articulación de la cadera de la rata. Fije la articulación de la rodilla derecha en una extensión de 180° con 5-6 capas de vendaje de yeso húmedo de manera uniforme. Envuelve en espiral el vendaje de yeso empezando por el tobillo y cubriendo 1/3 del anterior. Usa un secador de pelo para secar y endurecer el yeso.
- Envuelva externamente el yeso con material base para dentaduras postizas después de que el vendaje de yeso se seque y se endurezca para fijar el yeso y evitar que roa.
- Mezcle los materiales de la base de la dentadura postiza para que quede pegajosa y adhiera la mezcla al exterior del yeso (la mezcla no debe sobrepasar el borde del vendaje, Figura 1). Después de que la mezcla se endurezca, apague la máquina de anestesia y espere a que el animal se despierte de forma natural. Supervise a las ratas para evitar accidentes con la anestesia antes de que se despierten.
- Fije el yeso adecuadamente en la extremidad trasera derecha de la rata, ya que una fijación apretada restringe la circulación sanguínea, mientras que una fijación suelta tiende a caerse. Observar la circulación sanguínea en la extremidad terminal. Si se detecta hinchazón de la extremidad terminal o una tez morada, corte rápidamente parte del yeso para ayudar a restaurar la circulación. Vuelva a hacer el yeso si está roto y no logra mantener la extensión de la extremidad inferior.
- Retire el yeso después de 3 semanas de inmovilización continua. Use tijeras quirúrgicas para cortar el material de la base de la dentadura postiza por fuera y el vendaje de yeso. Enjuaga la extremidad inferior de la rata con solución salina y sécala con una gasa. Si hay lesiones cutáneas locales, esterilizar con yodóforo.
- Verificación del modelo22
- Verificación basada en rayos X
- Realice un examen de rayos X de la rodilla derecha 1 día después del final del modelado. Realizar radiografías anteroposteriores en decúbito supino con flexión de cadera a 30°, extensión de rodilla a 0° y abducción de cadera a 15°. Mantenga la rótula directamente delante de la rodilla y coloque el tubo del radiador a 110 mm de la articulación de la rodilla.
- Realizar radiografías laterales en decúbito lateral derecho con flexión de cadera derecha a 30° y extensión de rodilla derecha a 0°. Realice la flexión de la cadera de la extremidad izquierda a 70° y la flexión de la rodilla a 45°, y coloque el tubo del radiador a 110 mm de distancia de la articulación de la rodilla. Establezca los parámetros de detección como tensión de exposición de 50 kV, corriente de 250 mA, dosis de exposición de 32 mAs y tiempo de exposición de 128 ms.
- Compare con la radiografía de ratas normales, verifique que la radiografía de rodilla modelada muestre un espacio articular más estrecho con hiperplasia de osteofitos en el borde.
- La Sociedad Internacional de Investigación de la Osteoartritis (OARSI) obtuvo una puntuaciónde 23
- Coloque la rata en la caja de eutanasia y perfunda CO2 a razón de 30%-70% de volumen de jaula por minuto. Deje de perfundir CO2 después de detectar que la rata está inmóvil, no respira y que la pupila está dilatada. Observe durante otros 2 minutos para confirmar la muerte.
NOTA: La luxación cervical se puede realizar después de la eutanasia basada en CO2 como una forma secundaria para confirmar la muerte. Fija la rata en la mesa y agarra su cola con una mano. Presiona la cabeza de la rata con el pulgar y el índice de la otra mano. Confirme la muerte al escuchar el sonido de un crujido, y la rata pierde el movimiento y los latidos del corazón al mismo tiempo. - Fije a la rata en posición supina con una aguja de jeringa sobre una tabla de espuma con la extremidad trasera derecha flexionada en abducción y rotación externa. Pellizque la piel alrededor de la articulación de la rodilla con unas tijeras quirúrgicas. Exponga los músculos alrededor de la articulación de la rodilla cortando la piel y luego cortando la fascia subcutánea.
- Cortar la diáfisis del fémur y la tibia con unas tijeras de hueso y extirpar la articulación de la rodilla derecha. Retire suavemente los tejidos blandos adicionales, como los músculos y los ligamentos, fuera de la articulación.
- Fijar la junta en paraformaldehído al 4% durante 24-48 h a 4 °C. Descalcifique la articulación en una solución de ácido fórmico al 10% durante 3 días hasta que el tejido óseo se pueda pinchar fácilmente con una aguja.
- Coloque y recorte el tejido descalcificado en la campana extractora y transfiéralo a una caja de deshidratación en la máquina de deshidratación. Agregue etanol al 75% durante 4 h, luego etanol al 90% durante 2 h, seguido de etanol al 95% durante 1 h, etanol absoluto durante 30 min, otra ronda de etanol absoluto fresco durante 30 min, alcohol benceno durante 5-10 min, xileno durante 5-10 min, otra ronda de xileno fresco durante 5-10 min, cera durante 1 h, otra ronda de cera fresca durante 1 h, y ronda final de cera fresca durante 1 h para la deshidratación y la inmersión en cera transparente.
- Luego, coloque el tejido en la máquina para incrustarlo. Cortar el bloque de cera en rodajas de cera de 4 μm después de que la parafina se haya endurecido y aplanar la rodaja en agua tibia. Coloque la rebanada en un portaobjetos de vidrio y séquela. Guárdalo a temperatura ambiente.
- Observar la muestra de cartílago y puntuarla de acuerdo con la evaluación del grado histopatológico del cartílago OA (Tabla 1)23. Si la puntuación de las ratas después del modelado es significativamente más alta que la de las ratas normales, el modelado fue exitoso.
- Coloque la rata en la caja de eutanasia y perfunda CO2 a razón de 30%-70% de volumen de jaula por minuto. Deje de perfundir CO2 después de detectar que la rata está inmóvil, no respira y que la pupila está dilatada. Observe durante otros 2 minutos para confirmar la muerte.
- Verificación basada en rayos X
Tabla 1. Evaluación del grado histopatológico del cartílago OA. El grado es la progresión de la profundidad en el cartílago. Puntuación total = Calificación x Estadificación. 0 para articulaciones normales, 24 para artritis grave. Haga clic aquí para descargar esta tabla.

Figura 1. Ratas inmovilizadas en yeso. Después de que las ratas fueron anestesiadas, sus extremidades inferiores derechas fueron envueltas con vendajes de yeso, fijadas en la posición hiperextendida y cubiertas con una capa de materiales de base de dentaduras postizas en el exterior. Haga clic aquí para ver una versión más grande de esta figura.
3. Manipulación de Tuina
- Ámbito de aplicación
- Seleccione un total de 5 puntos de acupuntura en la extremidad trasera derecha de las ratas, incluidos ST34, ST35, SP10, EX-LE4 y BL40 (Figura 2). Localice los puntos de acupuntura de acuerdo con los principios del posicionamiento del punto de acupuntura en 24.
- Posición para la aplicación
- Corta un paño negro en una bolsa de 9 cm x 15 cm con una abertura lateral y aprieta la abertura con una cuerda. Antes de la manipulación de Tuina, tira suavemente de la cola de la rata para que se entierre en la bolsa y exponga sus extremidades traseras fuera de la bolsa.
- Use una mano para mantener a la rata en posición prona, sosteniendo su cola y pata trasera mientras la otra mano aplica la manipulación de presión y amasamiento en un punto de acupuntura específico (Figura 3).
- Manipulación de Tuina
- Opere la manipulación de prensa y amasamiento en los 5 puntos de acupuntura de la extremidad posterior derecha durante 2 minutos cada uno. Coloque el pulgar del ejecutante en el punto de acupuntura seleccionado para realizar una presión rítmica y un amasamiento, uniendo la piel y el tejido subcutáneo con un movimiento circular.
- Utilice registros de presión de los dedos (unidades en Newton) para garantizar una intensidad y frecuencia constantes de la manipulación. Mantenga la intensidad entre 3-5 N y la frecuencia en 2 Hz (Figura 4). Aplique la manipulación una vez al día durante 21 días.

Figura 2. Posición de los puntos de acupuntura. SP10 se encuentra 5 mm por encima de la articulación interna de la rodilla en ratas. ST34 se encuentra 5 mm por encima de la articulación externa de la rodilla en ratas. EX-LE4 se localiza en el lado medial del ligamento de la rodilla en ratas. ST35 se localiza en la cara lateral del ligamento de la rodilla en ratas. BL40 se encuentra en el punto medio de la franja poplítea transversal. Haga clic aquí para ver una versión más grande de esta figura.
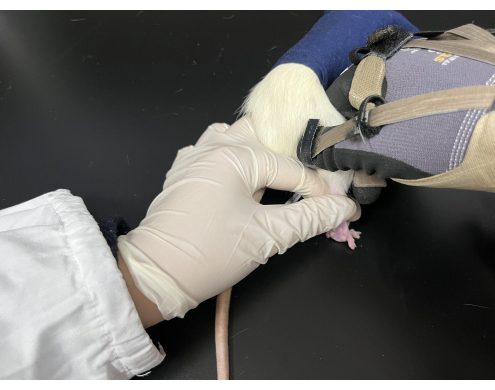
Figura 3. Manipulación de Tuina aplicada en ratas. Las ratas fueron mantenidas en una bolsa negra con sus extremidades traseras expuestas. El intérprete sostenía la cola de la rata con la mano izquierda mientras la mano derecha realizaba la manipulación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Registros de la presión de los dedos. Un dispositivo que registra la fuerza y la frecuencia de la presión de los dedos se utiliza para obtener información en tiempo real sobre la intensidad y la frecuencia en el proceso de manipulación de Tuina. (A) Sensor de presión y equipo de transmisión. (B) Registros de la presión de los dedos. (C) La fuerza registrada durante la manipulación de Tuina. Haga clic aquí para ver una versión más grande de esta figura.
4. Pruebas de comportamiento del dolor
- Probar el comportamiento del dolor antes y después del modelado, y a 1 día después (D1), 7 días después (D7), 14 días después (D14) y 21 días después (D21) de la manipulación de Tuina, incluyendo pruebas de umbral de retirada mecánica y latencia de retirada de patas.
- Umbral de retirada mecánica (MWT)
- Coloque a las ratas en un cubículo de vidrio templado transparente de 20 cm x 10 cm x 20 cm ubicado en un escenario de 40 cm de altura que está compuesto por una celosía de alambre con un tamaño de apertura de 10 mm x 10 mm. Mantenga la temperatura ambiente entre 23 °C ± 2 °C.
- Coloque a las ratas en el laboratorio de comportamiento durante al menos 2 h al día durante la fase de prueba de comportamiento para evitar interferencias con los resultados de la prueba debido a la falta de adaptación de los animales al entorno al comienzo de la prueba formal. Coloque a las ratas en el laboratorio de comportamiento durante 30 minutos antes del inicio de la prueba formal para facilitar su adaptación al entorno y reducir los factores de distracción.
- Utilice fibras electrónicas de Von Frey para medir el MWT. Estimule a la rata con la fibra en el centro de su pie y retire la fibra cuando la rata muestre movimientos obvios como levantar la pata y evitar. La máquina puede registrar automáticamente el valor máximo de presión (N) en este momento.
- Inicie la siguiente estimulación en la misma rata al menos 15 s después de la estimulación actual. No exceda los 5 s durante cada estimulación para evitar la sensibilización a los estímulos táctiles en las patas de las ratas. Repita la prueba 5 veces hasta que la diferencia entre las tres mediciones consecutivas sea insignificante (dentro de 10 N).
- Elimine los valores con grandes diferencias (los valores máximo y mínimo) y tome el promedio de los tres valores restantes como umbral de extracción mecánica.
- Latencia de retirada de la pata (PWL)
- Coloque las ratas en un pequeño compartimento de vidrio templado transparente con un tamaño de 20 cm x 10 cm x 20 cm. Cubra la parte superior del compartimento con una cubierta de vidrio transparente con orificios de ventilación. Mantenga la temperatura de la placa de vidrio transparente a 28-30 °C, sobre la que se coloca el compartimento.
- Coloque a las ratas en este entorno durante al menos 30 minutos para que se aclimaten antes del inicio de cada prueba formal. Si las ratas orinan o defecan en el compartimento, límpielo con papel absorbente a tiempo para evitar afectar la posterior transferencia de calor por radiación de luz.
- Enfoca el foco en el centro de la pata de la rata y presiona el botón Inicio . Presione el botón Detener cuando la rata muestre comportamientos obvios, como la retracción de los pies o el lamido de las patas, y registre el tiempo en este punto. El tiempo de irradiación del foco no debe exceder los 20 s para evitar daños en la piel de la rata.
- Realice la siguiente irradiación en la misma rata después de al menos 10 minutos para evitar la sensibilización. Mide 5x en cada rata.
- Elimine los valores con grandes diferencias (el valor máximo y el valor mínimo). Tome el promedio de los valores restantes como PWL.
5. Preparación de la muestra
- Realizar la eutanasia en el ratón como se describe en 2.3.2.1.
- Preparación de la membrana sinovial
- Fije a la rata en posición supina con una aguja de jeringa sobre una tabla de espuma con la extremidad trasera derecha flexionada en la abducción y rotación externa. Pellizque la piel alrededor de la articulación de la rodilla con unas tijeras quirúrgicas y exponga los músculos alrededor de la articulación de la rodilla de las ratas cortando la piel y luego cortando la fascia subcutánea.
- Tome el ligamento rotuliano como punto de referencia para despojar a los grupos musculares por encima del ligamento rotuliano. Haga una incisión en el extremo del ligamento rotuliano (en la tuberosidad tibial) con cuidado y encuentre la membrana sinovial cuando el ligamento se pellizque hacia arriba desde abajo.
- Cortar cuidadosamente el tejido sinovial con unas tijeras oftálmicas y lavar la sangre y el líquido sinovial con solución salina previamente enfriada. Fijar la membrana sinovial en paraformaldehído al 4% durante al menos 48 h después de absorber el agua de la superficie del tejido con una gasa limpia.
- Prepare la muestra como en los pasos 2.3.2.5 a 2.3.2.6. Realice la puntuación como en el paso 2.3.2.7.
- Realización de tinción con hematoxilina y eosina
- Desparafinar a agua con xileno durante 20 minutos, reemplazar con otra ronda de xileno fresco durante 20 minutos, seguido de tratar con etanol anhidro durante 5 minutos, reemplazar con otra ronda de etanol anhidro fresco durante 5 minutos, luego agregar etanol al 90% por volumen durante 5 minutos, 80% de etanol por volumen durante 5 minutos, 70% de etanol por volumen durante 5 minutos, y finalmente agua destilada durante 5 min.
- Sumerja el portaobjetos en una solución de tinción de hematoxilina durante 3-8 min. Retire el portaobjetos y enjuague la mancha con agua destilada. Muévalo al líquido de diferenciación (alcohol de ácido clorhídrico al 1%) durante casi 30 s, de modo que el portaobjetos se desvanezca a azul pálido. Enjuáguelo con agua destilada y colóquelo en una solución de tinción de eosina durante 1-3 minutos.
- Deshidrate el portaobjetos con una fracción de volumen de etanol al 95% durante 5 minutos, reemplácelo con otra ronda de etanol fresco al 95% durante 5 minutos, seguido de etanol anhidro durante 5 minutos, reemplácelo con otra ronda de etanol anhidro fresco durante 5 minutos.
- Haga que el portaobjetos sea transparente agregando xileno durante 5 minutos, reemplácelo con otra ronda de xileno fresco durante 5 minutos y luego séllelo con resina neutra.
- Etiquetado de extremos de muesca mediado por desoxinucleotidil transferasa terminal (TUNEL) en cartílago
- Deshidratar la muestra de cartílago en etanol anhidro, etanol al 90%, etanol al 85% y etanol al 75% hasta completar la hidratación desparafinadora. Remojar en PBS durante 5 min. Añadir 3% H 2O2 gota a gota durante 10 min.
- Añadir la solución de trabajo de proteinasa K gota a gota y digerir a 37 °C durante 10 min. Agregue 20 μL de tampón de etiquetado por rebanada para mantenerlo húmedo y sacuda el exceso de líquido después de preparar la solución de trabajo. Añadir 20 μL de solución de trabajo a cada portaobjetos e incubar durante 2 h a 37 °C en una caja húmeda.
- Añadir 50 μL de la solución de cierre gota a gota y cerrar durante 30 min. A continuación, añadir 50 μL de anticuerpo anti-digoxina biotinilado diluido (dilución 1:100) gota a gota e incubar a 37 °C durante 2 h en una caja húmeda. Añadir 10 μL de diluyente de anticuerpos SABC (dilución 1:100) gota a gota e incubar a 37 °C durante 2 h en una caja húmeda.
- Añadir solución de revelado de color DAB (50 μL de cada uno de los reactivos A, B y C en 1000 μL de agua destilada) gota a gota durante 10-15 min. El desarrollo del color se completa cuando es granular de color amarillo parduzco.
- Vuelva a teñir con hematoxilina durante 3 s. Después de la deshidratación en gradiente y el tratamiento transparente, seque a temperatura ambiente y selle el portaobjetos cuidadosamente con goma neutra. Preste atención para evitar dejar burbujas y pegamento desbordado.
- Análisis inmunohistoquímico de IL-1β y TNF-α
- Desparafinar los portaobjetos rutinariamente en xileno e hidratarlos en alcohol de gradiente. Inactivar la peroxidasa endógena en las secciones con 3%H2O2. Coloque el portaobjetos en tampón de citrato a 95 °C (pH 6,0) e incube en un baño de agua a más de 95 °C durante más de 20 min. Saque la caja de incubación y déjela a temperatura ambiente durante al menos 20 minutos.
- Incubar suero de cabra normal al 5% con PBS durante 10 min a 37 °C y sacudir el exceso de líquido. Añadir 150 μL de anticuerpo I gota a gota y dejar reposar a 37 °C durante 1 h, luego almacenar durante la noche a 4 °C. Al día siguiente, vuelva a calentar a 37 °C durante 45 min.
- Lavar 3 veces con PBS durante 5 minutos cada una. Cubra el tejido en el portaobjetos con BSA al 3% y séllelo a 37 °C durante 30 min. Añadir 150 μL de anticuerpo II gota a gota y dejar reposar a temperatura ambiente durante 1 h. Lavar 3 veces con PBS durante 5 minutos cada una y añadir 150 pL de líquido de desarrollo de color DAB gota a gota. Observe el grado de tinción bajo el microscopio hasta que la muestra se vuelva de color amarillo parduzco incluso a simple vista.
- Inmediatamente, enjuague con PBS durante 10 min. Vuelva a teñir con hematoxilina, deshidratar en alcohol de gradiente, hacer que los portaobjetos sean transparentes en xileno y sellar con goma neutra.
- Análisis estadístico
- Las secciones teñidas inmunohistoquímicamente con expresión positiva de la proteína asociada son amarillas o de color amarillo parduzco. Puntúe la intensidad de la expresión positiva mediante el software Image J para cada grupo de secciones inmunohistoquímicas y utilice los criterios de evaluación de la densidad óptica media (AOD), calculada por IOD dividida por área.
- Utilice software de análisis para el análisis estadístico. Utilice la prueba t si los datos se ajustan a la distribución normal y chi-cuadrado y utilice la prueba no paramétrica si no se ajustan a la distribución normal. Analice datos de medición repetidos mediante ecuaciones de estimación generalizadas.
Resultados
Pruebas de comportamiento del dolor
Los resultados del TMM mostraron que el TMM de la extremidad posterior derecha después del modelado fue significativamente menor que antes (p<0.05). En comparación con el grupo control, el TMM de las ratas se elevó significativamente después de Tuina (p<0.05; Figura 5 y Tabla 2).
Discusión
Este estudio proporciona un protocolo para la manipulación de Tuina en ratas KOA. A través de pruebas de comportamiento al dolor y hallazgos histomorfológicos, sugirió que tal serie de manipulación de Tuina aplicada a ratas KOA podría reducir la inflamación sinovial y la apoptosis del cartílago, lo que podría ser una referencia de la manipulación de Tuina en modelos animales de KOA.
Hay varios procedimientos críticos durante el protocolo. En primer lugar, es importante elegir un mé...
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Este trabajo fue apoyado por el Proyecto de Construcción de Especialidades Clínicas Críticas de Shanghái (Número de subvención: Shslczdzk04001); el programa de vela de la Comisión de Ciencia y Tecnología de Shanghái (número de subvención: 22YF1444300); Proyectos dentro del presupuesto de la Universidad de Medicina Tradicional China de Shanghái (Número de subvención: 2021LK091).
Materiales
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
Referencias
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24 (2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734 (2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4 (2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l., Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131 (2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224 (2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados