É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Manipulação de Tuina para Reduzir a Inflamação e Perda de Cartilagem em Ratos com Osteoartrite de Joelho
Neste Artigo
Resumo
Apresentamos um protocolo para manipulação de Tuina realizada em ratos com osteoartrite de joelho induzida por gesso imobilizado. Com base nos resultados preliminares, sugeriu-se que a eficácia do método dependia da redução da inflamação e da perda de cartilagem.
Resumo
Ensaios clínicos sugerem que a manipulação de Tuina é eficaz no tratamento da osteoartrite do joelho (OA), enquanto mais estudos são necessários para descobrir seu mecanismo. Portanto, a manipulação de modelos animais de osteoartrite de joelho é fundamental. Este protocolo fornece um processo padrão para a manipulação de Tuina em ratos KOA e uma exploração preliminar do mecanismo de Tuina para KOA. O método de manipulação de prensagem e amassamento (um tipo de manipulação de Tuina que se refere a pressionar e amassar a área específica da superfície corporal) é aplicado em 5 acupontos ao redor da articulação do joelho de ratos. A força e a frequência de manipulação foram padronizadas por meio de registros de pressão dos dedos, e a posição do rato durante a manipulação é descrita em detalhes no protocolo. O efeito da manipulação pode ser medido por testes de comportamento da dor e achados microscópicos na sinovial e cartilagem. Ratos KOA apresentaram melhora significativa no comportamento da dor. O infiltrado inflamatório do tecido sinovial foi reduzido no grupo Tuina e a expressão do fator de necrose tumoral (TNF)-α foi significativamente menor. Em comparação com o grupo controle, a apoptose de condrócitos foi menor no grupo Tuina. Este estudo fornece um protocolo padronizado para manipulação de Tuina em ratos KOA e prova preliminar de que os efeitos terapêuticos de Tuina podem estar relacionados à redução da inflamação sinovial e retardo da apoptose de condrócitos.
Introdução
A osteoartrite do joelho (OA) é uma doença degenerativa que se manifesta principalmente por dores articulares. Fibrose, fissuras, ulceração e perda de cartilagem articular são as principais causas dessa doença1. A OA tem alta prevalência e pode resultar em profundo impacto no cotidiano dos pacientes, causando incapacidade em casos graves. Entre pessoas de 45 a 84 anos, a prevalência de OAB aumenta com a idade, e a prevalência entre pessoas com 85 anos ou mais é de 15%, com predomínio em mulheres 2,3. Além disso, a KOA pode trazer um sério fardo econômico tanto para o indivíduo quanto para a sociedade. Uma pesquisa mostrou que os custos diretos de saúde com KOA per capita atingiram até US$ 8.858 ± US$ 5.120 por ano4. Com o envelhecimento da sociedade, o OAB tornou-se um problema de saúde mundial e uma importante questão social, bem como um tema atual para a pesquisa científica.
Estudos baseados em evidências demonstraram a eficácia da manipulação de Tuina no tratamento de OA5. A manipulação da Tuina poderia aliviar a dor e melhorar a disfunção em pacientes com OA, cujo mecanismo está relacionado a efeitos anti-inflamatórios 6,7. Estudiosos descobriram que a manipulação de Tuina efetivamente inibiu a expressão dos fatores inflamatórios interleucina (IL)-β e 5-hidroxitriptamina e retardou a degeneração da cartilagem articular em um modelo de KOA de coelho8. Sugeriu que Tuina poderia promover circulação sanguínea e metabolismo no local da lesão, o que ajudou a eliminar fatores inflamatórios como IL-1, IL-6 e fator de necrose tumoral (TNF)-α, aliviando assim os sintomas clínicos da OA9. Além disso, o movimento passivo da articulação através da manipulação de Tuina pode promover a penetração e difusão do líquido sinovial na cartilagem articular e melhorar o metabolismo tecidual de nutrientes10. Outros estudos sugeriram que a manipulação de Tuina pode efetivamente melhorar os índices biomecânicos em pacientes com OA11. Manipulações aplicadas sobre tecidos moles podem melhorar a distribuição do estresse sobre os membros e melhorar a função de equilíbrio12,13. Ao mesmo tempo, com algumas manipulações de ajuste articular, o alinhamento dos membros inferiores também pode ser ajustado para corrigir marchas anormais14,15.
O mecanismo de ação da manipulação de Tuina no tratamento de OA ainda precisa ser explorado e, portanto, um estudo experimental é necessário. A chave para a aplicação de Tuina em animais de experimentação é a padronização dos métodos de modelagem, fixação animal eintervenção16. O método de modelagem determina se o animal de experimentação pode apresentar as características da doença. Enquanto isso, métodos de fixação apropriados podem facilitar a intervenção da manipulação de Tuina e refletir melhor o efeito de Tuina. A padronização dos métodos de intervenção é a parte mais difícil da manipulação de Tuina. Em 2010, o sistema básico de normas chinesas de acupuntura mencionou os padrões de ponto de acupuntura para animais de experimentação, proporcionando a possibilidade de operações de acupuntura e Tuina em experimentos com animais17. No entanto, ainda existem dificuldades na padronização da manipulação de Tuina. Existem vários tipos de manipulação de Tuina18. A escolha da manipulação específica depende principalmente da doença a ser tratada e das teorias terapêuticas preferidas pelo executor. No estudo de Tuina para OA, mais atenção foi dada à manipulação de pressão pontual (pressionar os acupontos específicos com o polegar ou cotovelo), manipulação de empurrar Yizhichan (uma manipulação de empurrar mexendo o polegar) e manipulação de pressão e amassamento (que se refere a pressionar e amassar a área específica da superfície corporal pelo dedo ou palma da mão)19. A manipulação da prensagem e do amassamento é uma das manipulações de Tuina mais utilizadas, que combina pressão e amassamento para movimentar o tecido subcutâneo20. A manipulação da prensagem e do amassamento aplicada em acupontos pode promover a circulação sanguínea e aliviar a dor e representa o efeito terapêutico do Tuina nacovid-19.
Neste protocolo, a operação de manipulação da prensagem e amassamento em ratos KOA será descrita em detalhes, incluindo acupontos selecionados, intensidade e frequência da manipulação e a posição corporal do rato, de modo a fornecer uma referência para pesquisas futuras.
Protocolo
Este estudo passou pela revisão ética animal conduzida pelo comitê de ética animal experimental do Hospital Yueyang de medicina tradicional chinesa e ocidental integrada afiliada à Universidade de Medicina Tradicional Chinesa de Xangai (YYLAC-2022-166).
1. Preparação e agrupamento de animais experimentais
- Preparo Animal
- Criar um total de 10 ratas saudáveis SPF SD de 200-220 g à temperatura ambiente (18-21 °C), umidade 40%-50%, 12 h: 12 h alternâncias do ritmo circadiano. Conduzir experimentos com animais relacionados à dor em estrita conformidade com as disposições relevantes das diretrizes e diretrizes éticas em animais.
- Agrupamento de animais
- Divida aleatoriamente os ratos em grupo Tuina e grupo controle. Tratar ratos do grupo Tuina com manipulação de prensagem e amassamento por 21 dias após a modelagem. Coloque os ratos do grupo controle na mesma sala de Tuina e coloque-os em um saco de pano preto simultaneamente enquanto o grupo Tuina estiver em tratamento.
2. Modelagem de animais
- Anestesiar o animal
- Use isoflurano para anestesia gasosa. Colocar o rato na caixa de indução com uma concentração de indução de 3%. Agite a caixa depois de deitar o rato para baixo e confirme a anestesia quando o rato capotar sem tentar retornar à posição prona.
- Retire o rato da caixa de indução e fixe o nariz na máscara anestésica. Ajustar a concentração de isoflurano para 2% para manter a anestesia. Confirme a anestesia quando o rato não responder ao beliscar as patas. Aplique pomada ocular nos ratos para evitar o ressecamento quando os ratos estão anestesiados, pois as pálpebras não podem ser fechadas.
- Método de modelagem21
- Use máquina de barbear para remover os pelos do membro posterior direito. Coloque um algodão médico entre o tornozelo direito e a articulação do quadril do rato. Fixe a articulação do joelho direito em extensão de 180° com 5-6 camadas de bandagem de gesso molhado uniformemente. Enrole em espiral a bandagem de gesso começando pelo tornozelo e cobrindo 1/3 da anterior. Use um secador de cabelo para secar e endurecer o gesso.
- Envolva externamente o gesso com material de base de prótese após a bandagem de gesso secar e endurecer para fixar o gesso e evitar que ele roa.
- Misture os materiais de base da prótese para torná-la pegajosa e adera a mistura à parte externa do gesso (a mistura não deve exceder a borda do curativo, Figura 1). Depois que a mistura ficar dura, desligue o aparelho de anestesia e espere o animal acordar naturalmente. Supervisionar os ratos para evitar acidentes anestésicos antes que os ratos acordem.
- Fixe o gesso adequadamente no membro posterior direito do rato, pois uma fixação apertada restringe a circulação sanguínea, enquanto uma fixação solta tende a cair. Observe a circulação sanguínea no membro terminal. Se for detectado inchaço da extremidade terminal ou tez roxa, corte imediatamente parte do gesso para ajudar a restaurar a circulação. Refaça o gesso se ele estiver quebrado e não conseguir manter a extensão do membro inferior.
- Retirar o gesso após 3 semanas de imobilização contínua. Use tesoura cirúrgica para cortar o material de base da prótese externa e bandagem de gesso. Enxaguar o membro inferior do rato com soro fisiológico e secar com gaze. Se houver lesões cutâneas locais, esterilizar com iodóforo.
- Verificação do modelo22
- Verificação baseada em raios-X
- Realizar um exame radiográfico do joelho direito 1 dia após o término da modelagem. Realizar radiografias anteroposteriores em decúbito dorsal horizontal, com flexão de quadril a 30°, extensão de joelho a 0° e abdução de quadril a 15°. Mantenha a patela diretamente na frente do joelho e coloque o tubo do radiador a 110 mm da articulação do joelho.
- Realizar radiografias em perfil em decúbito lateral direito, com flexão do quadril direito a 30° e extensão do joelho direito a 0°. Fazer a flexão de quadril do membro esquerdo a 70° e flexão do joelho a 45° e colocar o tubo do radiador a 110 mm de distância da articulação do joelho. Defina os parâmetros de detecção como tensão de exposição 50 kV, corrente 250 mA, dose de exposição 32 mAs e tempo de exposição 128 ms.
- Comparando com a radiografia de ratos normais, verifique se a radiografia modelada do joelho mostra espaço articular mais estreito com hiperplasia de osteófitos na borda.
- Pontuação23 na Osteoarthritis Research Society International (OARSI)
- Coloque o rato na caixa de eutanásia e perfunda CO2 à taxa de 30%-70% do volume da gaiola por minuto. Pare de perfundir CO2 depois de detectar que o rato está imóvel, não respirando e que a pupila está dilatada. Observe por mais 2 min para confirmar a morte.
NOTA: A luxação cervical pode ser realizada após a eutanásia baseada em CO2 como uma forma secundária para confirmar o óbito. Fixe o rato na mesa e segure sua cauda com uma mão. Pressione a cabeça do rato com o polegar e o indicador da outra mão. Confirme a morte ao ouvir o som de um estalo, e o rato perde o movimento e os batimentos cardíacos ao mesmo tempo. - Fixar o rato em decúbito dorsal com uma agulha de seringa sobre uma placa de espuma com o membro posterior direito flexionado em abdução e rotação externa. Aperte a pele ao redor da articulação do joelho com uma tesoura cirúrgica. Expor os músculos ao redor da articulação do joelho cortando a pele e, em seguida, cortando a fáscia subcutânea.
- Cortar a diáfise do fêmur e tíbia com tesoura óssea e remover a articulação do joelho direito. Remova suavemente os tecidos moles extras, como músculos e ligamentos, fora da articulação.
- Fixar a articulação em paraformaldeído a 4% durante 24-48 h a 4 °C. Descalcifique a articulação em solução de ácido fórmico a 10% por 3 dias até que o tecido ósseo possa ser facilmente cutucado com uma agulha.
- Coloque e corte o tecido descalcificado no exaustor e transfira-o para uma caixa de desidratação na máquina de desidratação. Adicionar etanol 75% por 4 h, depois etanol 90% por 2 h, seguido por etanol 95% por 1 h, etanol absoluto por 30 min, outra rodada de etanol absoluto fresco por 30 min, álcool benzeno por 5-10 min, xileno por 5-10 min, outra rodada de xileno fresco por 5-10 min, cera por 1 h, outra rodada de cera fresca por 1 h, e rodada final de cera fresca por 1 h para desidratação e imersão em cera transparente.
- Em seguida, coloque o tecido na máquina para incorporação. Corte o bloco de cera em fatias de cera de 4 μm após a fixação da parafina e achate a fatia em água morna. Coloque a fatia em uma lâmina de vidro e seque. Conservar à temperatura ambiente.
- Observar a amostra de cartilagem e pontuar de acordo com a avaliação do grau histopatológico da cartilagem da OA (Tabela 1)23. Se o escore dos ratos após a modelagem for significativamente maior do que o dos ratos normais, a modelagem foi bem-sucedida.
- Coloque o rato na caixa de eutanásia e perfunda CO2 à taxa de 30%-70% do volume da gaiola por minuto. Pare de perfundir CO2 depois de detectar que o rato está imóvel, não respirando e que a pupila está dilatada. Observe por mais 2 min para confirmar a morte.
- Verificação baseada em raios-X
Tabela 1. Avaliação do grau histopatológico da cartilagem da OA. Grau é a progressão de profundidade para cartilagem. Escore total = Grau x Estadiamento. 0 para articulações normais, 24 para artrite grave. Clique aqui para baixar esta tabela.

Gráfico 1. Ratos imobilizados em gesso. Após a anestesia dos ratos, os membros inferiores direitos foram envolvidos com bandagens gessadas, fixados na posição hiperestendida e cobertos com uma camada de materiais de base de prótese externamente. Clique aqui para ver uma versão maior desta figura.
3. Manipulação de Tuina
- Área de aplicação
- Selecionar um total de 5 acupontos no membro posterior direito de ratos, incluindo ST34, ST35, SP10, EX-LE4 e BL40 (Figura 2). Localizar os acupontos de acordo com os princípios de posicionamento do acuponto em 24.
- Posição para aplicação
- Corte um pano preto em um saco de 9 cm x 15 cm com uma abertura lateral e aperte a abertura com uma corda. Antes da manipulação de Tuina, puxe suavemente a cauda do rato para fazê-lo penetrar no saco e expor seus membros posteriores fora do saco.
- Utilizar uma das mãos para manter o rato em decúbito ventral, segurando a cauda e a pata traseira, enquanto a outra mão aplica a manipulação da pressão e do amassamento em um acuponto específico (Figura 3).
- Manipulação de Tuina
- Operar a prensa e a manipulação do amassamento nos 5 acupontos do membro posterior direito por 2 min cada. Coloque o polegar do executante no ponto de acupuntura selecionado para realizar pressão rítmica e amassamento, unindo a pele e o tecido subcutâneo em um movimento circular.
- Use registros de pressão dos dedos (unidades em Newton) para garantir intensidade e frequência consistentes da manipulação. Manter a intensidade entre 3-5 N e a frequência em 2 Hz (Figura 4). Aplicar a manipulação uma vez ao dia durante 21 dias.

Gráfico 2. Posição de acupontos. O SP10 está localizado 5 mm acima da articulação interna do joelho em ratos. ST34 está localizado 5 mm acima da articulação externa do joelho em ratos. EX-LE4 está localizado na face medial do ligamento do joelho em ratos. ST35 está localizado na face lateral do ligamento do joelho em ratos. O BL40 está localizado no ponto médio da faixa poplítea transversal. Clique aqui para ver uma versão maior desta figura.
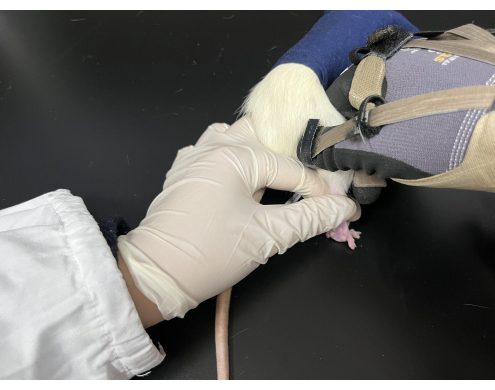
Gráfico 3. Manipulação de Tuina aplicada em ratos. Os ratos foram mantidos em um saco preto com os membros posteriores expostos. O executante segurava a cauda do rato com a mão esquerda, enquanto a mão direita realizava a manipulação. Clique aqui para ver uma versão maior desta figura.

Gráfico 4. Registros da pressão dos dedos. Um dispositivo que registra a força e a frequência da pressão dos dedos é usado para feedback em tempo real sobre a intensidade e frequência no processo de manipulação de Tuina. (A) Sensor de pressão e equipamento de transmissão. (B) Registros da pressão dos dedos. (C) A força registrada durante a manipulação de Tuina. Clique aqui para ver uma versão maior desta figura.
4. Testes de Comportamento Álgico
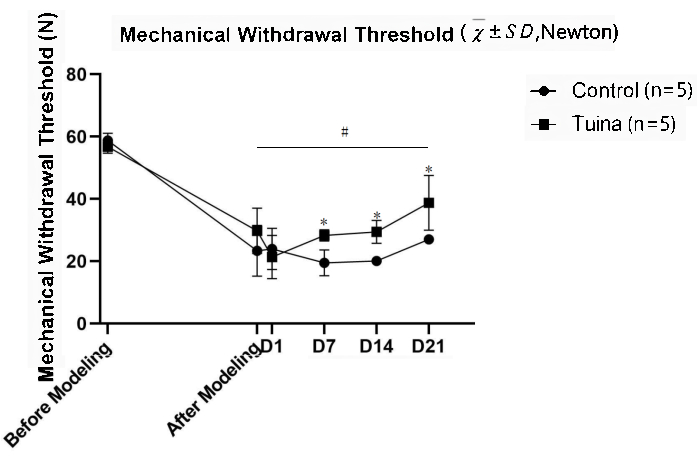
- Testar o comportamento da dor antes e após a modelagem, e 1 dia após (D1), 7 dias após (D7), 14 dias após (D14) e 21 dias após (D21) a manipulação de Tuina, incluindo os testes de limiar de retirada mecânica e latência de retirada da pata.
- Limiar de retirada mecânica (TMP)
- Coloque os ratos em um cubículo de vidro temperado transparente de 20 cm x 10 cm x 20 cm, localizado em um estágio de 40 cm de altura, que é composto por uma rede de arame com abertura de 10 mm x 10 mm. Manter a temperatura ambiente entre 23 °C ± 2 °C.
- Colocar os ratos no laboratório comportamental por pelo menos 2 h por dia durante a fase de teste comportamental para evitar interferência nos resultados do teste devido à falta de adaptação dos animais ao ambiente no início do teste formal. Colocar os ratos no laboratório comportamental por 30 min antes do início do teste formal para facilitar sua adaptação ao ambiente e reduzir os fatores de distração.
- Use fibras eletrônicas de Von Frey para medir o TCM. Estimule o rato com a fibra no centro do pé e retire a fibra quando o rato apresentar movimentos óbvios, como levantar a perna e evitar. A máquina pode registrar automaticamente o valor de pressão máxima (N) neste momento.
- Iniciar a próxima estimulação no mesmo rato pelo menos 15 s após a estimulação atual. Não exceder 5 s durante cada estimulação para evitar a sensibilização a estímulos táteis nas patas de ratos. Repetir o teste 5x até que a diferença entre as três medidas consecutivas seja insignificante (dentro de 10 N).
- Exclua os valores com grandes diferenças (os valores máximo e mínimo) e tome a média dos três valores restantes como o limite de retirada mecânica.
- Latência de retirada da pata (PWL)
- Coloque os ratos em um pequeno compartimento de vidro temperado transparente com tamanho de 20 cm x 10 cm x 20 cm. Cubra a parte superior do compartimento com uma tampa de vidro transparente com orifícios de ventilação. Manter a temperatura da placa de vidro transparente a 28-30 °C, na qual o compartimento é colocado.
- Assentar os ratos neste ambiente por pelo menos 30 min para aclimatar antes do início de cada teste formal. Se os ratos urinarem ou defecarem no compartimento, limpe-o com papel absorvente a tempo de evitar afetar a subsequente transferência de calor da radiação luminosa.
- Concentre o holofote no centro do pé do rato e pressione o botão Iniciar . Pressione o botão Parar quando o rato mostrar comportamentos óbvios, como retração do pé ou lamber a pata, e registre o tempo neste ponto. O tempo de irradiação do holofote não deve exceder 20 s para evitar danos à pele do rato.
- Realizar a próxima irradiação no mesmo rato após pelo menos 10 min para evitar a sensibilização. Meça 5x em cada rato.
- Remova os valores com grandes diferenças (o valor máximo e o valor mínimo). Tome a média dos valores restantes como o PWL.
5. Preparo da amostra
- Realizar a eutanásia no rato, conforme descrito no ponto 2.3.2.1.
- Preparação da membrana sinovial
- Fixar o rato na posição supina com uma agulha de seringa sobre uma placa de espuma com o membro posterior direito flexionado na abdução e rotação externa. Aperte a pele ao redor da articulação do joelho com tesoura cirúrgica e exponha os músculos ao redor da articulação do joelho de ratos, cortando a pele e, em seguida, cortando a fáscia subcutânea.
- Tome o ligamento patelar como um marco para despir os grupos musculares acima do ligamento patelar. Incise cuidadosamente a terminação do ligamento patelar (na tuberosidade tibial) e encontre a membrana sinovial quando o ligamento for pinçado para cima por baixo.
- Cortar cuidadosamente o tecido sinovial com tesoura oftálmica e lavar o sangue e o líquido sinovial com soro fisiológico pré-resfriado. Fixar a membrana sinovial em paraformaldeído a 4% por pelo menos 48 h após a absorção de água da superfície do tecido com gaze limpa.
- Preparar a amostra como nos passos 2.3.2.5- 2.3.2.6. Execute a pontuação como na etapa 2.3.2.7.
- Realização de coloração de hematoxilina e eosina
- Definar para água com xileno por 20 min, substituir por outra rodada de xileno fresco por 20 min, seguido de tratamento com etanol anidro por 5 min, substituir por outra rodada de etanol anidro fresco por 5 min, em seguida, adicionar 90% de etanol em volume por 5 min, 80% de etanol em volume por 5 min, 70% de etanol em volume por 5 min, e, finalmente, água destilada por 5 min.
- Imergir a lâmina em solução corante de hematoxilina por 3-8 min. Retire a lâmina e enxágue a mancha com água destilada. Mova-o para o fluido de diferenciação (álcool de ácido clorídrico a 1%) por quase 30 s, de modo que a lâmina desbote para azul pálido. Enxágue com água destilada e coloque em solução corante de eosina por 1-3 min.
- Desidratar a lâmina com fração volumétrica de etanol 95% por 5 min, substituir por outra rodada de etanol fresco a 95% por 5 min, seguida de etanol anidro por 5 min, substituir por outra rodada de etanol anidro fresco por 5 min.
- Torne a lâmina transparente adicionando xileno por 5 min, substitua-a por outra rodada de xileno fresco por 5 min e, em seguida, sela-a com resina neutra.
- Marcação nick end mediada por desoxinucleotidiltransferase terminal (TUNEL) na cartilagem
- Desidratar a amostra de cartilagem em etanol anidro, etanol 90%, etanol 85% e etanol 75% até que a hidratação desparafinadora esteja completa. Mergulhe em PBS por 5 min. Adicione 3% H 2O2 gota a gota por 10 min.
- Adicionar a solução de trabalho de proteinase K gota a gota e digerir a 37 °C durante 10 minutos. Adicionar 20 μL de tampão de marcação por fatia para mantê-lo úmido e sacudir o excesso de líquido após preparar a solução de trabalho. Adicionar 20 μL de solução de trabalho a cada lâmina e incubar durante 2 h a 37 °C numa caixa húmida.
- Adicionar 50 μL da solução de fecho gota a gota e fechar durante 30 minutos. Em seguida, adicione 50 μL de anticorpo antidigoxina biotinilado diluído (diluição 1:100) gota a gota e incube a 37 °C por 2 h em uma caixa úmida. Adicionar 10 μL de diluente de anticorpos SABC (diluição 1:100) gota a gota e incubar a 37 °C durante 2 h numa caixa húmida.
- Adicionar a solução de revelação de cor DAB (50 μL cada um dos reagentes A, B e C em 1000 μL de água destilada) gota a gota por 10-15 min. O desenvolvimento da cor se completa quando é granular amarelo-acastanhado.
- Recoloração com hematoxilina por 3 s. Após desidratação do gradiente e tratamento transparente, seque à temperatura ambiente e sele cuidadosamente a lâmina com goma neutra. Preste atenção para evitar deixar bolhas e cola transbordante.
- Análise imunoistoquímica de IL-1β e TNF-α
- Desencenar as lâminas rotineiramente em xileno e hidratá-las em álcool gradiente. Inativar a peroxidase endógena nos cortes com 3% H 2O2. Colocar o suporte de corrediça em tampão citrato a 95 °C (pH 6,0) e incubar num banho-maria acima de 95 °C durante mais de 20 minutos. Retire a caixa de incubação e deixe-a em temperatura ambiente por pelo menos 20 min.
- Incubar 5% de soro normal de cabra com PBS durante 10 minutos a 37 °C e sacudir o excesso de líquido. Adicionar 150 μL de anticorpo I gota a gota e deixar repousar a 37 °C por 1 h, depois armazenar durante a noite a 4 °C. No dia seguinte, volte a aquecer a 37 °C por 45 min.
- Lave 3x com PBS por 5 min cada. Cobrir o tecido na lâmina com BSA a 3% e selá-lo a 37 °C por 30 min. Adicionar 150 μL de anticorpo II gota a gota e deixar repousar à temperatura ambiente durante 1 h. Lave 3x com PBS por 5 min cada e adicione 150 pL de líquido de revelação de cor DAB gota a gota. Observe o grau de coloração ao microscópio até que a amostra se torne amarelo-acastanhada mesmo a olho nu.
- Imediatamente, enxágue com PBS por 10 min. Manchar novamente com hematoxilina, desidratar em álcool gradiente, tornar as lâminas transparentes em xileno e selar com goma neutra.
- Análise estatística
- Os cortes imunohistoquimicamente corados com expressão positiva da proteína associada são amarelos ou amarelo-acastanhados. Pontuar a intensidade de expressão positiva pelo software Image J para cada grupo de cortes imunoistoquímicos e utilizar os critérios de avaliação da densidade óptica média (DAO), calculada pelo IOD dividido por área.
- Utilizar software de análise para análise estatística. Utilizar o teste t se os dados estiverem em conformidade com a distribuição normal e o qui-quadrado e utilizar o teste não paramétrico se não estiverem em conformidade com a distribuição normal. Analise dados de medições repetidas por meio de equações de estimação generalizadas.
Resultados
Testes de comportamento da dor
Os resultados do TCM mostraram que o TCM do membro posterior direito após a modelagem foi significativamente menor do que antes (p<0,05). Em comparação com o grupo controle, o TCM dos ratos foi significativamente elevado após Tuina (p<0,05; Figura 5 e Tabela 2).
Discussão
Este estudo fornece um protocolo para manipulação de Tuina em ratos KOA. Através de testes de comportamento da dor e achados histomorfológicos, sugeriu-se que tal série de manipulação de Tuina aplicada em ratos KOA poderia reduzir a inflamação sinovial e a apoptose da cartilagem, o que poderia ser uma referência da manipulação de Tuina em modelos animais de KOA.
Existem vários procedimentos críticos durante o protocolo. Primeiro, é importante escolher um método apropriado para ...
Divulgações
Os autores declaram não ter interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Shanghai Critical Clinical Specialties Construction Project (Grant Number: Shslczdzk04001); o programa de Vela da Comissão de Ciência e Tecnologia de Xangai (Grant Number: 22YF1444300); Projetos dentro do orçamento da Universidade de Medicina Tradicional Chinesa de Xangai (Número da Bolsa: 2021LK091).
Materiais
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
Referências
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24 (2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734 (2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4 (2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l., Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131 (2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224 (2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados