Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Tuina-Manipulation zur Verringerung von Entzündung und Knorpelverlust bei Ratten mit Kniearthrose
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll zur Tuina-Manipulation vor, das an Gips-immobilisiert-induzierten Kniearthrose-Ratten durchgeführt wird. Basierend auf den vorläufigen Ergebnissen deutete dies darauf hin, dass die Wirksamkeit der Methode auf der Verringerung von Entzündungen und Knorpelverlust beruhte.
Zusammenfassung
Klinische Studien deuten darauf hin, dass die Tuina-Manipulation bei der Behandlung von Kniearthrose (KOA) wirksam ist, während weitere Studien erforderlich sind, um ihren Mechanismus zu entdecken. Daher ist die Manipulation von Tiermodellen der Kniearthrose von entscheidender Bedeutung. Dieses Protokoll bietet einen Standardprozess für die Tuina-Manipulation an KOA-Ratten und eine vorläufige Untersuchung des Tuina-Mechanismus für KOA. Die Press- und Knetmethode (eine Art Tuina-Manipulation, die sich auf das Drücken und Kneten des spezifischen Bereichs der Körperoberfläche bezieht) wird auf 5 Akupunkturpunkte um das Kniegelenk von Ratten angewendet. Die Kraft und Frequenz der Manipulation wurden durch Fingerdruckaufzeichnungen standardisiert, und die Position der Ratte während der Manipulation ist im Protokoll detailliert beschrieben. Die Wirkung der Manipulation kann durch Schmerzverhaltenstests und mikroskopische Befunde in Synovial- und Knorpel gemessen werden. KOA-Ratten zeigten eine signifikante Verbesserung des Schmerzverhaltens. Die infilzierende Infiltration des Synovialgewebes war in der Tuina-Gruppe reduziert und die Expression des Tumornekrosefaktors (TNF)-α war signifikant geringer. Im Vergleich zur Kontrollgruppe war die Apoptose der Chondrozyten in der Tuina-Gruppe geringer. Diese Studie liefert ein standardisiertes Protokoll für die Tuina-Manipulation an KOA-Ratten und einen vorläufigen Beweis dafür, dass die therapeutischen Wirkungen von Tuina mit der Verringerung der Synovialentzündung und der verzögerten Chondrozyten-Apoptose zusammenhängen könnten.
Einleitung
Kniearthrose (KOA) ist eine degenerative Erkrankung, die sich hauptsächlich in Gelenkschmerzen äußert. Fibrose, Rissbildung, Ulzeration und Verlust des Gelenkknorpels sind die Hauptursachen für diese Erkrankung1. KOA hat eine hohe Prävalenz und kann tiefgreifende Auswirkungen auf das tägliche Leben der Patienten haben und in schweren Fällen zu Behinderungen führen. Bei Menschen im Alter von 45-84 Jahren nimmt die Prävalenz von KOA mit dem Alter zu, und die Prävalenz bei Menschen ab 85 Jahren beträgt 15%, mit einer Dominanz bei Frauen 2,3. Darüber hinaus kann KOA eine ernsthafte wirtschaftliche Belastung sowohl für den Einzelnen als auch für die Gesellschaft darstellen. Eine Umfrage ergab, dass die direkten Gesundheitskosten für KOA pro Kopf bis zu 8.858 US-Dollar ± 5.120 US-Dollar pro Jahrerreichten 4. Mit der Alterung der Gesellschaft ist KOA zu einem weltweiten Gesundheitsproblem und einem großen sozialen Problem sowie zu einem aktuellen Thema für die wissenschaftliche Forschung geworden.
Evidenzbasierte Studien haben die Wirksamkeit der Tuina-Manipulation bei der Behandlung von KOA5 gezeigt. Die Tuina-Manipulation könnte Schmerzen lindern und Funktionsstörungen bei KOA-Patienten verbessern, deren Mechanismus mit entzündungshemmenden Wirkungen zusammenhängt 6,7. Die Wissenschaftler fanden heraus, dass die Tuina-Manipulation die Expression der Entzündungsfaktoren Interleukin (IL)-β und 5-Hydroxytryptamin wirksam hemmte und die Degeneration des Gelenkknorpels in einem KOA-Modell eines Kaninchens verlangsamte8. Es deutete darauf hin, dass Tuina die Durchblutung und den Stoffwechsel an der Läsionsstelle fördern konnte, was dazu beitrug, Entzündungsfaktoren wie IL-1, IL-6 und Tumornekrosefaktor (TNF)-α zu beseitigen und dadurch die klinischen Symptome von KOA9 zu lindern. Darüber hinaus kann die passive Bewegung des Gelenks durch Tuina-Manipulation das Eindringen und die Diffusion von Synovialflüssigkeit in den Gelenkknorpel fördern und den Nährstoffstoffwechsel des Gewebes verbessern10. Andere Studien deuteten darauf hin, dass die Tuina-Manipulation die biomechanischen Indizes bei KOA-Patienten effektiv verbessern kann11. Manipulationen, die auf Weichgewebe angewendet werden, können die Stressverteilung über die Gliedmaßen verbessern und die Gleichgewichtsfunktion verbessern12,13. Gleichzeitig kann mit einigen Manipulationen der Gelenkanpassung auch die Ausrichtung der unteren Gliedmaßen angepasst werden, um abnorme Gangarten zu korrigieren14,15.
Der Wirkmechanismus der Tuina-Manipulation bei der Behandlung von KOA muss noch erforscht werden, daher ist eine experimentelle Studie erforderlich. Der Schlüssel zur Anwendung von Tuina bei Versuchstieren ist die Standardisierung von Modellierungs-, Tierfixierungs- und Interventionsmethoden16. Die Modellierungsmethode bestimmt, ob das Versuchstier die Merkmale der Krankheit aufweisen kann. In der Zwischenzeit können geeignete Fixationsmethoden das Eingreifen der Tuina-Manipulation erleichtern und die Wirkung von Tuina besser widerspiegeln. Die Standardisierung der Interventionsmethoden ist der schwierigste Teil der Tuina-Manipulation. Im Jahr 2010 wurden im Grundsystem der chinesischen Akupunkturstandards die Akupunkturpunktstandards für Versuchstiere erwähnt, die die Möglichkeit für Akupunktur- und Tuina-Operationen im Tierversuch bieten17. Allerdings gibt es immer noch Schwierigkeiten bei der Standardisierung der Tuina-Manipulation. Es gibt mehrere Arten der Tuina-Manipulation18. Die Wahl der spezifischen Manipulation hängt hauptsächlich von der zu behandelnden Krankheit und den therapeutischen Theorien ab, die der Darsteller bevorzugt. In der Studie von Tuina für KOA wurde mehr Aufmerksamkeit auf die Point-Pressing-Manipulation (Drücken der spezifischen Akupunkturpunkte mit dem Daumen oder Ellbogen), die Yizhichan-Push-Manipulation (eine Push-Manipulation durch Wackeln des Daumens) und die Press- und Knetmanipulation (die sich auf das Drücken und Kneten des spezifischen Bereichs der Körperoberfläche mit dem Finger oder der Handfläche bezieht) gewidmet19. Die Press- und Knetmanipulation ist eine der am weitesten verbreiteten Tuina-Manipulationen, bei der Pressen und Kneten kombiniert werden, um das Unterhautgewebe zu bewegen20. Die Press- und Knetmanipulation von Akupunkturpunkten kann die Durchblutung fördern und Schmerzen lindern und stellt die therapeutische Wirkung von Tuina auf KOA19 dar.
In diesem Protokoll wird die Funktionsweise der Press- und Knetmanipulation an KOA-Ratten detailliert beschrieben, einschließlich ausgewählter Akupunkturpunkte, Intensität und Häufigkeit der Manipulation und der Körperposition der Ratte, um eine Referenz für zukünftige Forschungen zu bieten.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Diese Studie hat die Tierethikprüfung bestanden, die von der Ethikkommission für Versuchstiere des Yueyang-Krankenhauses für integrierte traditionelle chinesische und westliche Medizin durchgeführt wurde, die mit der Shanghai University of Traditional Chinese Medicine verbunden ist (YYLAC-2022-166).
1. Versuchstierzubereitung und -gruppierung
- Zubereitung von Tieren
- Aufzucht von insgesamt 10 gesunden weiblichen Ratten mit LSF SD von 200-220 g bei Raumtemperatur (18-21 °C), Luftfeuchtigkeit 40%-50%, 12 h: 12 h zirkadiane Rhythmuswechsel. Führen Sie schmerzbedingte Tierversuche unter strikter Einhaltung der einschlägigen Bestimmungen tierethischer Richtlinien und Richtlinien durch.
- Gruppierung von Tieren
- Teilen Sie die Ratten nach dem Zufallsprinzip in die Tuina-Gruppe und die Kontrollgruppe ein. Behandeln Sie Ratten der Tuina-Gruppe 21 Tage lang nach der Modellierung mit Press- und Knetmanipulation. Setzen Sie Ratten der Kontrollgruppe in denselben Tuina-Raum und legen Sie sie gleichzeitig in einen schwarzen Stoffbeutel, während die Tuina-Gruppe behandelt wird.
2. Modellierung von Tieren
- Betäubung des Tieres
- Verwenden Sie Isofluran für die Gasanästhesie. Setzen Sie die Ratte in die Induktionsbox mit einer Induktionskonzentration von 3%. Wackeln Sie mit der Box, nachdem Sie die Ratte abgelegt haben, und bestätigen Sie die Betäubung, wenn sich die Ratte umdreht, ohne zu versuchen, in die Bauchlage zurückzukehren.
- Nehmen Sie die Ratte aus der Induktionsbox und fixieren Sie ihre Nase in der Anästhesiemaske. Stellen Sie die Isoflurankonzentration auf 2 % ein, um die Anästhesie aufrechtzuerhalten. Bestätigen Sie die Betäubung, wenn die Ratte nicht reagiert, wenn sie ihre Pfoten kneift. Tragen Sie Augensalbe auf die Ratten auf, um Trockenheit zu verhindern, wenn Ratten betäubt werden, da die Augenlider nicht geschlossen werden können.
- Modellierungsmethode21
- Verwenden Sie eine Rasiermaschine, um die Haare der rechten Hintergliedmaße zu entfernen. Lege ein medizinisches Wattepad zwischen den rechten Knöchel und das Hüftgelenk der Ratte. Fixieren Sie das rechte Kniegelenk in 180° Streckung mit 5-6 Lagen nassem Gipsverband gleichmäßig. Wickeln Sie den Gipsverband spiralförmig vom Knöchel aus und bedecken Sie 1/3 des vorherigen. Verwenden Sie einen Föhn, um den Putz zu trocknen und auszuhärten.
- Umwickeln Sie das Pflaster nach dem Trocknen und Aushärten des Gipsverbandes von außen mit Prothesenbasismaterial, um das Pflaster zu fixieren und ein Nagen zu verhindern.
- Mischen Sie die Prothesenbasismaterialien, um sie klebrig zu machen, und kleben Sie die Mischung auf die Außenseite des Gipses (die Mischung sollte den Rand des Verbandes nicht überschreiten, Abbildung 1). Nachdem die Mischung hart geworden ist, schalten Sie das Anästhesiegerät aus und warten Sie, bis das Tier auf natürliche Weise aufwacht. Beaufsichtigen Sie die Ratten, um Narkoseunfälle zu vermeiden, bevor die Ratten aufwachen.
- Befestigen Sie das Pflaster entsprechend an der rechten Hintergliedmaße der Ratte, da eine feste Fixierung die Durchblutung einschränkt, während eine lockere Fixierung dazu neigt, abzufallen. Beobachten Sie die Durchblutung der terminalen Gliedmaße. Wenn eine Schwellung der terminalen Extremität oder ein violetter Teint festgestellt wird, schneiden Sie sofort einen Teil des Pflasters ab, um die Durchblutung wiederherzustellen. Machen Sie das Pflaster neu, wenn es gebrochen ist und die Streckung der unteren Gliedmaßen nicht aufrechterhält.
- Entfernen Sie das Pflaster nach 3 Wochen kontinuierlicher Ruhigstellung. Schneiden Sie mit einer chirurgischen Schere das Prothesenbasismaterial außen ab und geben Sie den Gipsverband an. Spülen Sie die untere Extremität der Ratte mit Kochsalzlösung ab und trocknen Sie sie mit Gaze ab. Wenn lokale Hautläsionen vorhanden sind, sterilisieren Sie mit Jodophor.
- Modell-Verifizierung22
- Röntgenbasierte Verifikation
- Führen Sie 1 Tag nach Beendigung der Modellierung eine Röntgenuntersuchung des rechten Knies durch. Nehmen Sie anteroposteriore Röntgenaufnahmen in Rückenlage mit Hüftbeugung bei 30°, Kniestreckung bei 0° und Hüftabduktion bei 15° an. Halten Sie die Kniescheibe direkt vor dem Knie und setzen Sie das Heizkörperrohr 110 mm vom Kniegelenk entfernt auf.
- Laterale Röntgenaufnahmen in rechter lateraler Dekubitusposition mit rechter Hüftbeugung bei 30° und rechter Kniestreckung bei 0°. Machen Sie die Hüftbeugung der linken Gliedmaße bei 70° und die Kniebeugung bei 45° und legen Sie das Heizkörperrohr 110 mm vom Kniegelenk entfernt. Stellen Sie die Detektionsparameter als Expositionsspannung 50 kV, Strom 250 mA, Expositionsdosis 32 mAs und Expositionszeit 128 ms ein.
- Vergleichen Sie mit dem Röntgenbild normaler Ratten, überprüfen Sie, ob das modellierte Knieröntgenbild einen engeren Gelenkspalt mit Osteophytenhyperplasie am Rand zeigt.
- Osteoarthritis Research Society International (OARSI) mit23 Punkten
- Setzen Sie die Ratte in die Euthanasiebox und perfundiertieren Sie CO2 mit einer Rate von 30%-70% Käfigvolumen pro Minute. Beenden Sie die Durchblutung von CO2 , nachdem Sie festgestellt haben, dass die Ratte unbeweglich ist, nicht atmet und dass die Pupille erweitert ist. Beobachten Sie weitere 2 Minuten, um den Tod zu bestätigen.
HINWEIS: Die Gebärmutterhalsluxation kann nach einer CO2 -basierten Euthanasie als sekundäre Form zur Bestätigung des Todes durchgeführt werden. Fixieren Sie die Ratte auf dem Tisch und fassen Sie ihren Schwanz mit einer Hand. Drücken Sie mit Daumen und Zeigefinger der anderen Hand auf den Kopf der Ratte. Bestätigen Sie den Tod, wenn Sie das Geräusch eines Knackens hören, und die Ratte verliert gleichzeitig Bewegung und Herzschlag. - Fixieren Sie die Ratte in Rückenlage mit einer Spritzennadel auf einer Schaumstoffplatte, wobei die rechte Hintergliedmaße in Abduktion und Außenrotation gebeugt ist. Kneifen Sie die Haut um das Kniegelenk herum mit einer chirurgischen Schere zusammen. Legen Sie die Muskeln um das Kniegelenk frei, indem Sie die Haut und dann die subkutane Faszie durchtrennen.
- Oberschenkel- und Schienbeindiaphyse mit einer Knochenschere abtrennen und das rechte Kniegelenk entfernen. Entfernen Sie vorsichtig die überschüssigen Weichteile, wie Muskeln und Bänder, außerhalb des Gelenks.
- Fixieren Sie die Fuge in 4%igem Paraformaldehyd für 24-48 h bei 4 °C. Entkalken Sie das Gelenk 3 Tage lang in 10%iger Ameisensäurelösung, bis das Knochengewebe leicht mit einer Nadel gestochen werden kann.
- Legen Sie das entkalkte Gewebe in den Abzug, schneiden Sie es ab und geben Sie es in eine Dörrbox in der Dörrmaschine. 75% Ethanol für 4 h, dann 90% Ethanol für 2 h, gefolgt von 95% Ethanol für 1 h, absolutes Ethanol für 30 min, eine weitere Runde frisches absolutes Ethanol für 30 min, Alkoholbenzol für 5-10 min, Xylol für 5-10 min, eine weitere Runde frisches Xylol für 5-10 min, Wachs für 1 h, eine weitere Runde frisches Wachs für 1 h, und abschließende Runde frisches Wachs für 1 Stunde zum Austrocknen und Eintauchen in transparentes Wachs.
- Legen Sie dann das Gewebe zum Einbetten in die Maschine. Schneiden Sie den Wachsblock nach dem Aushärten des Paraffins in 4 μm dicke Wachsscheiben und drücken Sie die Scheibe in warmem Wasser flach. Die Scheibe auf einen Objektträger legen und trocknen. Bei Raumtemperatur lagern.
- Beobachten Sie die Knorpelprobe und bewerten Sie sie gemäß der histopathologischen Bewertung des OA-Knorpelschopathologiegrades (Tabelle 1)23. Wenn der Score der Ratten nach der Modellierung signifikant höher ist als der der normalen Ratten, war die Modellierung erfolgreich.
- Setzen Sie die Ratte in die Euthanasiebox und perfundiertieren Sie CO2 mit einer Rate von 30%-70% Käfigvolumen pro Minute. Beenden Sie die Durchblutung von CO2 , nachdem Sie festgestellt haben, dass die Ratte unbeweglich ist, nicht atmet und dass die Pupille erweitert ist. Beobachten Sie weitere 2 Minuten, um den Tod zu bestätigen.
- Röntgenbasierte Verifikation
Tabelle 1. Bewertung des Histopathologiegrades von OA-Knorpeln. Der Grad ist die Tiefenprogression in den Knorpel. Gesamtpunktzahl = Note x Inszenierung. 0 für normale Gelenke, 24 für schwere Arthritis. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.

Abbildung 1. Ratten, die in Gips immobilisiert wurden. Nachdem die Ratten betäubt worden waren, wurden ihre rechten unteren Gliedmaßen mit Gipsverbänden umwickelt, in der überstreckten Position fixiert und außen mit einer Schicht Prothesenbasismaterialien bedeckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Tuina-Manipulation
- Anwendungsbereich
- Wählen Sie insgesamt 5 Akupunkturpunkte an der rechten Hintergliedmaße von Ratten aus, darunter ST34, ST35, SP10, EX-LE4 und BL40 (Abbildung 2). Lokalisieren Sie die Akupunkturpunkte nach den Prinzipien der Akupunkturpositionierung in 24.
- Position für die Bewerbung
- Schneiden Sie ein schwarzes Tuch in einen 9 cm x 15 cm großen Beutel mit einer seitlichen Öffnung und ziehen Sie die Öffnung mit einem Seil fest. Ziehen Sie vor der Tuina-Manipulation vorsichtig am Schwanz der Ratte, damit sie sich in den Beutel eingräbt und ihre Hintergliedmaßen außerhalb des Beutels freilegt.
- Verwenden Sie eine Hand, um die Ratte in Bauchlage zu halten, und halten Sie ihren Schwanz und ihr Hinterbein, während Sie mit der anderen Hand Druck ausüben und einen bestimmten Akupunkturpunkt kneten (Abbildung 3).
- Tuina-Manipulation
- Führen Sie die Press- und Knetmanipulation an den 5 Akupunkturpunkten an der rechten Hintergliedmaße für jeweils 2 Minuten durch. Legen Sie den Daumen des Darstellers auf den ausgewählten Akupunkturpunkt, um rhythmisch zu drücken und zu kneten, wobei Haut und Unterhautgewebe in einer kreisenden Bewegung zusammengeführt werden.
- Verwenden Sie Fingerdruckaufzeichnungen (Einheiten in Newton), um eine gleichbleibende Intensität und Häufigkeit der Manipulation zu gewährleisten. Halten Sie die Intensität zwischen 3-5 N und die Frequenz bei 2 Hz (Abbildung 4). Wenden Sie die Manipulation 21 Tage lang einmal täglich an.

Abbildung 2. Position der Akupunkturpunkte. SP10 befindet sich bei Ratten 5 mm oberhalb des inneren Kniegelenks. ST34 befindet sich bei Ratten 5 mm oberhalb des äußeren Kniegelenks. EX-LE4 befindet sich bei Ratten auf der medialen Seite des Kniebandes. ST35 befindet sich bei Ratten auf der lateralen Seite des Kniebandes. BL40 befindet sich in der Mitte des quer verlaufenden Kniekehlstreifens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
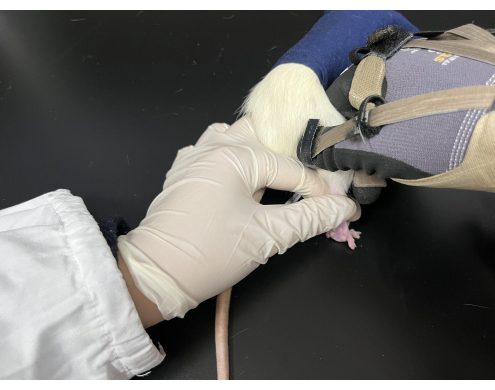
Abbildung 3. Tuina-Manipulation bei Ratten. Die Ratten wurden in einem schwarzen Sack gehalten, wobei ihre Hintergliedmaßen freigelegt waren. Der Darsteller hielt den Schwanz der Ratte mit der linken Hand, während die rechte Hand die Manipulation durchführte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Aufzeichnungen des Fingerdrucks. Ein Gerät, das die Kraft und Frequenz des Fingerdrucks aufzeichnet, wird für die Echtzeit-Rückmeldung über die Intensität und Frequenz während des Prozesses der Tuina-Manipulation verwendet. (A) Drucksensoren und Übertragungsgeräte. (B) Aufzeichnungen des Fingerdrucks. (C) Die Kraft, die während der Tuina-Manipulation aufgezeichnet wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Tests zum Schmerzverhalten
- Testen Sie das Schmerzverhalten vor und nach der Modellierung sowie 1 Tag nach (D1), 7 Tagen nach (D7), 14 Tagen nach (D14) und 21 Tagen nach (D21) der Tuina-Manipulation, einschließlich mechanischer Rückzugsschwelle und Pfotenrückzugslatenztests.
- Mechanische Entnahmeschwelle (MWT)
- Setzen Sie die Ratten in eine 20 cm x 10 cm x 20 cm große Kabine aus transparentem gehärtetem Glas, die sich auf einer 40 cm hohen Bühne befindet, die aus einem Drahtgitter mit einer Öffnung von 10 mm x 10 mm besteht. Halten Sie die Raumtemperatur bei 23 °C ± 2 °C.
- Setzen Sie die Ratten während der Verhaltenstestphase für mindestens 2 Stunden pro Tag in das Verhaltenslabor, um Interferenzen mit den Testergebnissen aufgrund der mangelnden Anpassung der Tiere an die Umgebung zu Beginn des formalen Tests zu vermeiden. Setzen Sie die Ratten vor Beginn des formalen Tests für 30 Minuten in das Verhaltenslabor, um ihre Anpassung an die Umgebung zu erleichtern und störende Faktoren zu reduzieren.
- Verwenden Sie elektronische Von-Frey-Fasern, um die MWT zu messen. Stimulieren Sie die Ratte mit der Faser in der Mitte ihres Fußes und ziehen Sie die Faser zurück, wenn die Ratte offensichtliche Bewegungen zeigt, wie z. B. das Anheben des Beins und das Ausweichen. Die Maschine kann in diesem Moment automatisch den maximalen Druckwert (N) erfassen.
- Beginnen Sie die nächste Stimulation in derselben Ratte mindestens 15 s nach der aktuellen Stimulation. Überschreiten Sie nicht 5 s bei jeder Stimulation, um eine Sensibilisierung für taktile Reize in den Pfoten von Ratten zu verhindern. Wiederholen Sie den Test 5x, bis die Differenz zwischen den drei aufeinanderfolgenden Messungen unbedeutend ist (innerhalb von 10 N).
- Löschen Sie die Werte mit großen Unterschieden (den Maximal- und den Minimalwert) und nehmen Sie den Durchschnitt der verbleibenden drei Werte als mechanische Entnahmeschwelle.
- Latenz beim Pfotenrückzug (PWL)
- Legen Sie die Ratten in ein kleines Fach aus transparentem gehärtetem Glas mit einer Größe von 20 cm x 10 cm x 20 cm. Decken Sie die Oberseite des Fachs mit einer transparenten Glasabdeckung mit Belüftungslöchern ab. Halten Sie die Temperatur der transparenten Glasplatte, auf der das Fach steht, bei 28-30 °C.
- Bringen Sie die Ratten mindestens 30 Minuten lang in diese Umgebung, um sich vor Beginn jedes formalen Tests zu akklimatisieren. Wenn Ratten in das Fach urinieren oder koten, reinigen Sie es rechtzeitig mit saugfähigem Papier, um die spätere Wärmeübertragung der Lichtstrahlung nicht zu beeinträchtigen.
- Fokussieren Sie den Scheinwerfer auf die Mitte des Rattenfußes und drücken Sie die Start-Taste . Drücken Sie die Stopp-Taste , wenn die Ratte offensichtliche Verhaltensweisen wie Fußeinziehen oder Pfotenlecken zeigt, und notieren Sie die Zeit an dieser Stelle. Die Einstrahlungszeit des Scheinwerfers sollte 20 s nicht überschreiten, um eine Beschädigung der Haut der Ratte zu vermeiden.
- Führen Sie die nächste Bestrahlung an derselben Ratte nach mindestens 10 Minuten durch, um eine Sensibilisierung zu vermeiden. Messen Sie 5x an jeder Ratte.
- Entfernen Sie die Werte mit großen Unterschieden (den Maximal- und den Minimalwert). Nehmen Sie den Durchschnitt der verbleibenden Werte als PWL.
5. Probenvorbereitung
- Euthanasie an der Maus wie in 2.3.2.1 beschrieben durchführen.
- Vorbereitung der Synovialmembran
- Fixieren Sie die Ratte in Rückenlage mit einer Spritzennadel auf einer Schaumstoffplatte, wobei die rechte Hintergliedmaße in der Abduktion und Außenrotation gebeugt ist. Kneifen Sie die Haut um das Kniegelenk mit einer chirurgischen Schere zusammen und legen Sie die Muskeln um das Kniegelenk von Ratten frei, indem Sie die Haut und dann die subkutane Faszie durchtrennen.
- Nehmen Sie das Patellaband als Anhaltspunkt, um die Muskelgruppen oberhalb des Patellabandes abzustreifen. Schneiden Sie das Ende des Patellabandes (an der Tuberositas tibiaalis) vorsichtig ein und finden Sie die Synovialmembran, wenn das Band von unten nach oben eingeklemmt ist.
- Schneiden Sie das Synovialgewebe vorsichtig mit einer Augenschere ab und waschen Sie das Blut und die Gelenkflüssigkeit mit vorgekühlter Kochsalzlösung ab. Befestigen Sie die Synovialmembran mindestens 48 Stunden lang in 4% Paraformaldehyd, nachdem Sie Wasser von der Gewebeoberfläche mit sauberer Gaze aufgenommen haben.
- Die Probe ist wie in den Schritten 2.3.2.5 bis 2.3.2.6 vorzusehen. Führen Sie die Bewertung wie in Schritt 2.3.2.7 beschrieben durch.
- Durchführung von Hämatoxylin- und Eosin-Färbungen
- 20 Minuten lang zu Wasser mit Xylol entwachsen, 20 Minuten lang durch eine weitere Runde frisches Xylol ersetzen, gefolgt von einer Behandlung mit wasserfreiem Ethanol für 5 Minuten, 5 Minuten lang durch eine weitere Runde frisches wasserfreies Ethanol ersetzen, dann 90 Volumenprozent Ethanol für 5 Minuten, 80 Volumenprozent Ethanol für 5 Minuten, 70 Volumenprozent Ethanol für 5 Minuten hinzufügen, und zum Schluss destilliertes Wasser für 5 min.
- Tauchen Sie den Objektträger 3-8 Minuten lang in Hämatoxylin-Färbelösung. Entfernen Sie den Objektträger und spülen Sie den Fleck mit destilliertem Wasser ab. Bewegen Sie es für fast 30 s in die Differenzierungsflüssigkeit (1%iger Salzsäurealkohol), so dass der Objektträger blassblau verblasst. Spülen Sie es mit destilliertem Wasser ab und legen Sie es für 1-3 Minuten in eine Eosin-Färbelösung.
- Den Objektträger 5 Minuten lang mit 95 % Ethanol-Volumenanteil dehydrieren, 5 Minuten lang durch frisches 95 % Ethanol ersetzen, anschließend 5 Minuten lang wasserfreies Ethanol und 5 Minuten lang durch eine weitere Runde frisches wasserfreies Ethanol ersetzen.
- Machen Sie den Objektträger transparent, indem Sie 5 Minuten lang Xylol hinzufügen, ersetzen Sie ihn 5 Minuten lang durch eine weitere Runde frisches Xylol und versiegeln Sie ihn dann mit neutralem Harz.
- Terminale Desoxynukleotidyltransferase-vermittelte Nick-End-Markierung (TUNEL) auf Knorpel
- Dehydrieren Sie die Knorpelprobe in wasserfreiem Ethanol, 90 % Ethanol, 85 % Ethanol und 75 % Ethanol, bis die Entwachsungshydratation abgeschlossen ist. 5 Minuten in PBS einweichen. 3%H2O2tropfenweise für 10 Min. zugeben.
- Proteinase K-Arbeitslösung tropfenweise zugeben und bei 37 °C 10 min verdauen. Fügen Sie 20 μl Etikettierpuffer pro Scheibe hinzu, um sie feucht zu halten, und schütteln Sie überschüssige Flüssigkeit ab, nachdem Sie die Arbeitslösung zubereitet haben. Auf jeden Objektträger werden 20 μl Arbeitslösung gegeben und 2 h bei 37 °C in einer Nassbox inkubiert.
- 50 μl der Verschlusslösung tropfenweise zugeben und 30 min lang verschließen. Dann 50 μl verdünnter biotinylierter Anti-Digoxin-Antikörper (1:100 Verdünnung) tropfenweise zugeben und bei 37 °C für 2 h in einer Nassbox inkubieren. 10 μl SABC-Antikörperverdünnungsmittel (1:100 Verdünnung) tropfenweise zugeben und bei 37 °C 2 h in einer Nassbox inkubieren.
- DAB-Farbentwicklungslösung (je 50 μl Reagenzien A, B und C in 1000 μl destilliertem Wasser) 10-15 min lang tropfenweise zugeben. Die Farbentwicklung ist abgeschlossen, wenn sie bräunlich-gelb körnig ist.
- 3 s lang mit Hämatoxylin nachfärben. Nach der Gradiententrocknung und der transparenten Behandlung bei Raumtemperatur trocknen und den Objektträger vorsichtig mit neutralem Gummi versiegeln. Achten Sie darauf, dass keine Blasen und überlaufender Kleber entstehen.
- Immunhistochemische Analyse von IL-1β und TNF-α
- Entwachse die Objektträger routinemäßig in Xylol und hydratisiere sie in Gradientenalkohol. Inaktivierung der endogenen Peroxidase in den Abschnitten mit 3%H2O2. Den Objektträgerhalter in 95 °C Citratpuffer (pH 6,0) legen und in einem Wasserbad über 95 °C über 20 min inkubieren. Nehmen Sie die Inkubationsbox heraus und lassen Sie sie mindestens 20 Minuten bei Raumtemperatur stehen.
- 5% normales Ziegenserum mit PBS 10 min bei 37 °C inkubieren und überschüssige Flüssigkeit abschütteln. 150 μl Antikörper I tropfenweise zugeben und 1 h bei 37 °C stehen lassen, dann über Nacht bei 4 °C lagern. Am nächsten Tag bei 37 °C für 45 Minuten wieder erwärmen.
- 3x mit PBS für jeweils 5 min waschen. Das Gewebe auf dem Objektträger mit 3% BSA bedecken und bei 37 °C für 30 min versiegeln. 150 μl Antikörper II tropfenweise zugeben und 1 h bei Raumtemperatur stehen lassen. 3x mit PBS für jeweils 5 min waschen und 150 pL DAB-Farbentwicklungsflüssigkeit tropfenweise hinzufügen. Beobachten Sie den Grad der Färbung unter dem Mikroskop, bis die Probe auch mit bloßem Auge bräunlich-gelb wird.
- Sofort 10 Minuten lang mit PBS abspülen. Erneut mit Hämatoxylin färben, in Gradientenalkohol dehydrieren, Objektträger in Xylol transparent machen und mit neutralem Gummi versiegeln.
- Statistische Analyse
- Immunhistochemisch gefärbte Schnitte mit positiver Expression des assoziierten Proteins sind gelb oder bräunlich-gelb. Bewerten Sie die Intensität der positiven Expression mit der Software Image J für jede Gruppe immunhistochemischer Schnitte und verwenden Sie die Bewertungskriterien der durchschnittlichen optischen Dichte (AOD), berechnet durch IOD geteilt durch Fläche.
- Verwenden Sie eine Analysesoftware für statistische Analysen. Verwenden Sie den t-Test, wenn die Daten der Normalverteilung und dem Chi-Quadrat entsprechen, und verwenden Sie den nichtparametrischen Test, wenn sie nicht der Normalverteilung entsprechen. Analysieren Sie wiederholte Messdaten durch verallgemeinerte Schätzgleichungen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Tests zum Schmerzverhalten
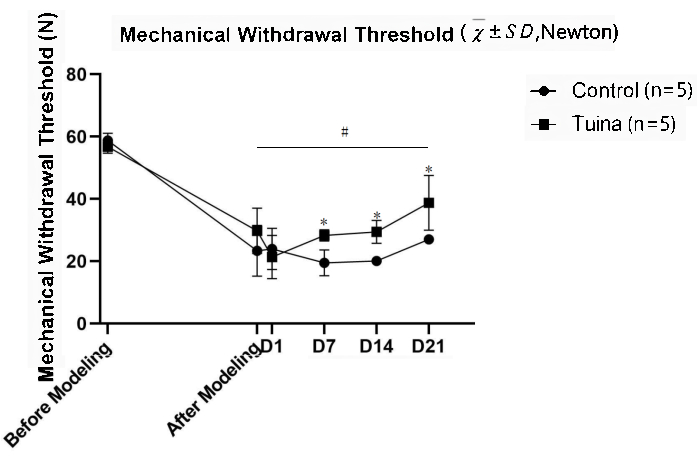
Die MWT-Ergebnisse zeigten, dass die MWT der rechten Hintergliedmaße nach der Modellierung signifikant niedriger war als zuvor (p<0,05). Im Vergleich zur Kontrollgruppe war die MWT der Ratten nach Tuina signifikant erhöht (p<0,05; Abbildung 5 und Tabelle 2).
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Studie liefert ein Protokoll für die Tuina-Manipulation an KOA-Ratten. Durch Schmerzverhaltenstests und histomorphologische Befunde deutete es darauf hin, dass eine solche Serie von Tuina-Manipulationen, die an KOA-Ratten angewendet wurden, die Synovialentzündung und die Knorpelapoptose reduzieren könnte, was eine Referenz für die Tuina-Manipulation in Tiermodellen von KOA sein könnte.
Während des Protokolls gibt es mehrere kritische Verfahren. Zunächst ist es wichtig, eine geeign...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Diese Arbeit wurde unterstützt durch das Shanghai Critical Clinical Specialties Construction Project (Fördernummer: Shslczdzk04001); das Segelprogramm der Shanghai Science and Technology Commission (Fördernummer: 22YF1444300); Projekte im Rahmen des Budgets der Shanghai University of Traditional Chinese Medicine (Fördernummer: 2021LK091).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
Referenzen
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24(2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734(2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4(2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l, Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131(2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224(2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten