Method Article
مقايسة صفيحة مجهرية معدلة قائمة على الكثافة البصرية لتوصيف عدوى الشعيات
In This Article
Summary
يتم وصف طريقة الصفائح الدقيقة القائمة على الكثافة الضوئية لتحديد النمو البكتيري على المدى الطويل في وجود البكتيريا ، وهي مناسبة للأكتينوميسيتات وغيرها من البكتيريا بطيئة النمو. تتضمن هذه الطريقة تعديلات لتقليل التبخر وتكثيف الغطاء ورمز R لحساب مقاييس الإصابة بالفيروس ، بما في ذلك المنطقة الواقعة أسفل المنحنى ، والحد الأقصى للنمو ، والفوعة النسبية.
Abstract
تعد البكتيريا جزءا أساسيا من البيئات الطبيعية ، ولديها قدرة قوية على تشكيل مجموعات البكتيريا. لفهم كيفية تفاعل العاثيات الفردية مع المضيفات البكتيرية بطيئة النمو مثل الفطريات الشعاعية ، هناك حاجة إلى طريقة سهلة وموثوقة لقياس النمو البكتيري على المدى الطويل في وجود العاثيات. تسمح قارئات الصفائح الدقيقة الطيفية بإجراء قياسات متكررة عالية الإنتاجية ، ولكن احتضان حجم صغير لفترة طويلة يمكن أن يمثل تحديات فنية. يتكيف هذا الإجراء مع صفيحة دقيقة قياسية ذات 96 بئرا للسماح بالزراعة المشتركة للعاثيات والبكتيريا دون أخذ عينات فرعية لمدة 96 ساعة ، مع تسجيل نمو البكتيريا كل 8 ساعات باستخدام قيم الامتصاص الطيفي. يتم تحليل قيم الكثافة الضوئية هذه باستخدام R للحصول على مقاييس العدوى ، بما في ذلك تثبيط النسبة المئوية للنمو ، والفوعة النسبية ، ومؤشر Stacy-Ceballos. توفر الطرق الموضحة هنا طريقة فعالة لإجراء وتحليل تجارب منحنى نمو الصفائح الدقيقة طويلة المدة وتتضمن تعديلات لتقليل التبخر وتكثيف الغطاء. تسهل هذه البروتوكولات المقايسات القائمة على الصفائح الدقيقة للتفاعلات بين المضيفات البكتيرية بطيئة النمو والبكتيريا الخاصة بهم.
Introduction
البكتيريا أو العاثيات هي فيروسات تصيب البكتيريا. إنها أكثر الكيانات البيولوجية عددا على هذا الكوكب1 ، ومن المقبول عموما أن البكتيريا تؤثر على التطور البكتيري وعمليات النظام البيئي2،3،4. توجد عدة طرق لوصف وقياس وتحليل نطاق مضيف البكتيريا 8 وديناميكيات العدوى 5,6 ، بما في ذلك الطرق القائمة على الأجار مثل طريقة أجار مزدوجة الطبقة7 وطرق الصفائح الدقيقة القائمة على الكثافة الضوئية 8،9،10،11،12. كل طريقة لها مزاياها وعيوبها. نظرا لكفاءتها ، فإن اختبارات الطلاء باستخدام طريقة أجار الطبقة المزدوجة هي "المعيار الذهبي" لمقايسات نطاق المضيف ، ولكن هذه الطريقة كثيفة الوقتوالعمالة 9. تعطي طرق الصفائح الدقيقة السريعة ، التي تعود بنتائج في غضون 24 ساعة أو أقل ، نتائج ممتازة للمضيفات البكتيرية سريعة النمو مثل الإشريكية القولونية9،10،11،12 ولكنها قصيرة جدا لإظهار تطور عدوى البكتيريا في المضيفات البكتيرية البطيئة النمو مثل الفطريات الشعاعية7،13،14،15.
لا يمكن تشغيل اختبار الصفائح الدقيقة القائم على الكثافة الضوئية المصمم للبكتيريا سريعة النمو لعدة أيام مطلوبة لتوصيف ديناميكيات العدوى في بكتيريا مضيفة بطيئة النمو دون حدوث تبخر وإعطاء كثافات بكتيرية عالية بشكل مصطنع. وبالتالي ، فإن الحصول على بيانات عالية الإنتاجية قابلة للمقارنة حول ديناميكيات عدوى البكتيريا للأنواع البكتيرية بطيئة النمو يتطلب تقنيات متخصصة تتكيف مع هذه البكتيريا.
تقلل طريقة الصفيحة الدقيقة المعروضة هنا من التبخر ، مما يسمح بزراعة البكتيريا بطيئة النمو مع العاثية لفترة ممتدة تبلغ 96 ساعة وتمكين التحقيقات في ديناميكيات عدوى العاثيات ونطاق المضيف. تعرض هذه الطريقة أيضا مؤشر Stacy-Ceballos16 ، وهو مقياس قائم على الكثافة الضوئية يسمح بإجراء مقارنات ضراوة بين أنظمة الفيروسات المضيفة المتباينة.
Protocol
في حين أن هذا البروتوكول مكتوب ل Gordonia terrae ، فقد تم استخدامه أيضا بنجاح لثغرات Gordonia و Gordonia rubripertincta و Gordonia westfalica.
1. إعداد البكتيريا
- في خزانة السلامة الأحيائية ، استخدم الممارسة الميكروبيولوجية الجيدة17 لتلقيح مستعمرة واحدة من Gordonia terrae CAG3 في دورق محير معقم سعة 1 لتر مع 200 مل من مرق الكالسيوم خميرة الببتون18 (PYCa) تحتوي على 0.01 مجم / مل سيكلوهيكسيميد (انظر جدول المواد).
- احتضان القارورة عند 30 درجة مئوية مع الرج عند 250 دورة في الدقيقة حتى يتم تشبع المزرعة أو لمدة 3 أيام7.
- قم بتخفيف ثقافة G. terrae المشبعة في مرق PYCa بشكل متسلسل ، ولوحة الانتشار 100 ميكرولتر لكل من التخفيفات 10−4 و 10−5 و 10−6 على ألواح PYCa19,20. برد المستزرع المشبع غير المخفف على حرارة 4 درجات مئوية.
- احتضان لوحات انتشار مقلوبة لمدة 3 أيام عند 30 درجة مئوية.
- بعد الحضانة ، حدد "لوحة قابلة للعد" ، لوحة بها 20-200 مستعمرة. احسب عدد المستعمرات على تلك اللوحة ، واحسب وحدات تكوين المستعمرة لكل مليلتر (cfu / mL) 19,20.
- تمييع الثقافة المشبعة مع مرق PYCa إلى 4.0 × 106 cfu / mL البكتيريا.
2. إعداد العاثية
ملاحظة: تم الحصول على النتائج التمثيلية المبلغ عنها باستخدام Gordonia phage DelRio21 ، وهي بكتيريا معتدلة معزولة على G. terrae. كما تم استخدام هذه الطرق بنجاح مع عاثيات جوردونيا الأخرى.
- بدءا من البكتيريا المعزولة ، قم بتخفيف عينة العاثية بشكل متسلسل في المخزن المؤقت للعاثية7 إلى تخفيف 1 × 10−8 . قم بإجراء مقايسة عيار العاثية الآجار مزدوجة الطبقة7 عن طريق إصابة 0.3 مل من ثقافة G. terrae المشبعة ب 10 ميكرولتر من كل تخفيف للعاثيات. بعد حضانة درجة حرارة الغرفة لمدة 5-10 دقائق ، امزج خليط البكتيريا والعاثية مع 3 مل من أجار PYCa العلوي ، واسكبه على ألواح أجار PYCa.
- احتضان الألواح المقلوبة عند 30 درجة مئوية لمدة 3 أيام أو حتى تتشكلاللويحات 7.
- بعد الحضانة ، حدد "لوحة قابلة للعد" ، لوحة بها 20-200 لوحة. احسب عدد اللويحات على تلك اللوحة ، واحسب وحدات تكوين البلاك لكل ملليلتر (pfu / mL) 7.
3. إعداد الصفيحة الدقيقة
ملاحظة: يجب استخدام الألواح الدقيقة ذات القاع المسطح ذات 96 بئرا (انظر جدول المواد) لهذه الطريقة. يجب إكمال جميع عمليات تحضير اللوحة وتحميلها في خزانة السلامة البيولوجية ، ويجب استخدام الممارسة الميكروبيولوجية الجيدة17.
- قم بإعداد محلول طلاء الغطاء المضاد للضباب من خلال الجمع بين 100 ميكرولتر من Triton-X 100 و 40 مل من الأيزوبروبانول بنسبة 100٪ و 160 مل من الماء منزوع الأيونات22. يقلب للخلط ويخزن في درجة حرارة الغرفة.
- في خزانة السلامة الحيوية ، أضف 6 مل من محلول طلاء الغطاء إلى السطح الداخلي لغطاء معقم مكون من 96 بئرا ، مع إمساك الغطاء من الحواف وتدويره لضمان تغطيته بالمحلول. اترك المحلول على الغطاء لمدة 20 ثانية ، ثم اسكب المحلول ، واقلب الغطاء على منشفة ورقية معقمة بزاوية حتى يجف الغطاء تماما ، والذي يستغرق عادة 35-45 دقيقة. احرص على تثبيت الغطاء من الحواف.
- تحضير 20 مل من الأغاروز 0.1٪ في الماء لكل صفيحة ميكروية 96 بئر ، في الميكروويف لإذابة الأغاروز.
- بمجرد أن يبرد الأغاروز إلى 50-60 درجة مئوية ، ماصة 100 ميكرولتر من الأغاروز 0.1٪ في جميع الفراغات بين آبار الصفيحة و 200 ميكرولتر من الأغاروز في الآبار في الصف A والصف H والعمود 1 والعمود 2 والعمود 11 والعمود 1223 (الشكل 1).
4. تحميل اللوحة بالبكتيريا والعاثيات
ملاحظة: يجب إكمال جميع عمليات تحضير اللوحة وتحميلها في خزانة السلامة البيولوجية ، ويجب استخدام الممارسة الميكروبيولوجية الجيدة17 .
- ستحتوي اللوحة المكونة من 96 بئرا على 75 ميكرولتر من البكتيريا 2.0 × 106 cfu / mL في كل بئر9. تمييع 4.0 × 10 6 cfu / mL الثقافة البكتيرية 1: 1 مع مرق 2x PYCa إلى 2.0 × 106 cfu / mL. تحضير 5 مل لكل لوحة 96 بئر.
- خفف محللات العاثية باستخدام المخزن المؤقتللعاثية 7 لجعل 1 مل لكل من 2.0 × 106 pfu / mL ، 2.0 × 105 pfu / mL ، و 2.0 × 104 pfu / mL تركيزات. سيسمح ذلك بتعدد العدوى (MOI) من 1 و 0.1 و 0.01 داخل الصفيحة الدقيقة9.
- لتحميل الصفيحة الدقيقة ، خذ صفيحة تم تحضيرها بمحلول مضاد للضباب والأغاروز ، وسحب 75 ميكرولتر من البكتيريا 2.0 × 106 cfu / mL في الأعمدة 3-10 ، بعد الشكل 1.
- إلى العمود 3 والعمود 4 ، أضف 75 ميكرولتر من مخزن العاثيات المعقم إلى كل بئر ليكون بمثابة تحكم إيجابي خال من العاثيات ، باتباع الشكل 1 ، والماصة لأعلى ولأسفل للخلط بعد كل إضافة. أضف 75 ميكرولتر من العاثية 2.0 × 10 6 pfu / mL إلى العمود 5 والعمود6 ، و 75 ميكرولتر من العاثية 2.0 × 105 pfu / mL إلى العمود 7 والعمود 8 ، و 75 ميكرولتر من 2.0 × 104 pfu / mL phage إلى العمود 9 والعمود 10 ، مع السحب لأعلى ولأسفل للخلط بعد كل إضافة.
- قم بلصق كلا الجانبين القصيرين من اللوحة بشريط لاصق 0.5 بوصة لإغلاق اللوحة جزئيا مع السماح بتبادل الغازات.
5. قياس الحضانة والامتصاص
- بمجرد تحميل الألواح بالبكتيريا والعاثيات ، ضعها على شاكر الصفائح الدقيقة عند 250 دورة في الدقيقة ، واحتضانها عند 30 درجة مئوية.
- احتضان الألواح لمدة 96 ساعة ، مع أخذ قياس الكثافة البصرية عند 600 نانومتر على قارئ الصفائح الدقيقة كل 8 ساعات بدءا من الساعة 16. أعد الألواح إلى شاكر بين القياسات.
ملاحظة: تم تقييم فترات القياس من 4 و h 6 h و 8 h و 12 h ، بدءا من الساعة 0 ، وتم تحديد أن فترة أخذ العينات لمدة 8 ساعات تبدأ في 16 ساعة بعد الإصابة قد التقطت بشكل أفضل تفاعلات Gordonia-phage. - راقب الغطاء بحثا عن التكثيف طوال التجربة. إذا لوحظ تكاثف ، فاستبدل الغطاء بغطاء آخر مطلي وفقا للخطوة 3.2.
- توليد منحنيات السيطرة والنمو المصابة باتباع قسم البروتوكول 6.
6. تحليل البيانات
- استخدم برنامج جدول بيانات لحساب متوسط الانحراف المعياري لكل تخفيف للعاثيات ، باتباع تخطيط جدول البيانات في مستودع Stacy-Ceballos-Index GitHub (https://github.com/eichristenson/Stacy-Ceballos-Index).
- قم بإنشاء منحنيات التحكم والنمو المصاب ، واحسب مقاييس العدوى باستخدام R (انظر جدول المواد) باستخدام حزم DescTools 24 و dplyr 25 و ggplot226 و readxl 27 واتباع البرنامج النصي R في مستودع Stacy-Ceballos-Index GitHub (https://github.com/eichristenson/Stacy-Ceballos-Index).
- AUCcon هي المنطقة الواقعة تحت منحنى التحكم غير المصاب ، بينما AUCinf هي المنطقة الواقعة تحت منحنى المصاب16. احسب AUC ، ثم احسب تثبيط النمو بالنسبة المئوية بناء على المساحة الموجودة أسفل قيم المنحنى ، PIAUC16 ، باستخدام المعادلة التالية:
(1 - [AUCinf/AUC con]) × 100 - تظهر الخطوط الأفقية المتقطعة على كل منحنى ذروة النمو ، حيث تسمى قمة النمو غير المصابة N مقارب (con) وذروة النمو المصابة تسمى Nمقارب (inf). حدد قيمخط التقارب N ، ثم احسب تثبيط النمو المئوي بناء على قيم نمو الذروة هذه ، PImax16 ، باستخدام المعادلة التالية:
(1 - [N مقارب (inf) / Nمقارب (يخدع)]) × 100 - احسب مؤشر ستايسي سيبالوس ، ISC16 ، من قيم PIAUC و PI max ، على النحو التالي:
(PIAUC ×PI كحد أقصى) 0.5
احسب الفوعة النسبية عن طريق دمج مؤشر ستايسي سيبالوس بمرور الوقت16.
- AUCcon هي المنطقة الواقعة تحت منحنى التحكم غير المصاب ، بينما AUCinf هي المنطقة الواقعة تحت منحنى المصاب16. احسب AUC ، ثم احسب تثبيط النمو بالنسبة المئوية بناء على المساحة الموجودة أسفل قيم المنحنى ، PIAUC16 ، باستخدام المعادلة التالية:
النتائج
تكون التجربة ناجحة إذا أظهر منحنى النمو الناتج زيادة في عدد البكتيريا الضابطة الإيجابية بمرور الوقت دون أي تذبذب مفاجئ في الامتصاص. يتم عرض أمثلة على تجربة ناجحة في MOI من 1 مع وبدون عدوى عاثية منتجة في الشكل 2 والشكل 3 ، على التوالي. يتم تمثيل العدوى المنتجة عند MOI من 0.01 في الشكل 4. يشير نمط نمو التحكم الإيجابي (المنحنى الأخضر) الذي شوهد في الأشكال الثلاثة إلى أن البكتيريا تنمو ، ولا تتكتل أثناء النمو ، ولا توجد ملوثات. يشار إلى التكتل والتلوث من خلال امتصاص عالي بشكل غير عادي في نقطة زمنية واحدة. عادة ما تزداد الانحرافات المعيارية على مدار الوقت للتجربة. ومع ذلك ، فإن الزيادة الحادة أو الانحرافات المعيارية المتداخلة بين المنحنيات الضابطة والمصابة قد تشير إلى تلوث أو تكتل في بئر واحد أو أكثر.
يوضح منحنى النمو الذي يصور عدوى العاثية المنتجة، الذي يمثله الشكل 2، انخفاض امتصاص البكتيريا بمرور الوقت في الآبار مع إضافة العاثيات. لن يلاحظ هذا الانخفاض في الكثافة البكتيرية إذا كانت البكتيريا خارج النطاق المضيف للعاثيات، كما هو موضح في الشكل 3.
يتم عرض مقاييس العدوى لجميع التجارب التمثيلية ، مع I SC كبير نسبيا للعدوى المنتجة في الشكل 2 والشكل 4 و I SC صغير جدا في الشكل 3 للعاثية التي لم تصيب البكتيريا المضيفة بكفاءة.
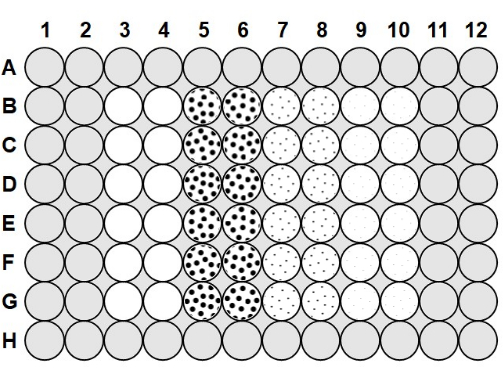
الشكل 1: تخطيط الصفيحة الدقيقة. تمتلئ المناطق الرمادية بنسبة 0.1٪ من الأغاروز. الآبار الفارغة في العمود 3 والعمود 4 هي آبار تحكم إيجابية خالية من العاثيات تحتوي فقط على مخزن عاثي وبكتيريا 2.0 × 106 cfu / mL. تحتوي الآبار المنقطة على عاثيات وبكتيريا 2.0 × 106 cfu / mL. تشير النقاط الكبيرة في العمود 5 والعمود 6 إلى MOI من 1 مع 2.0 x 106 pfu / mL phage ؛ تشير النقاط المتوسطة في العمود 7 والعمود 8 إلى MOI 0.1 مع 2.0 × 105 pfu / mL phage ؛ وتشير النقاط الصغيرة في العمود 9 والعمود 10 إلى MOI 0.01 مع 2.0 × 104 pfu / mL phage. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
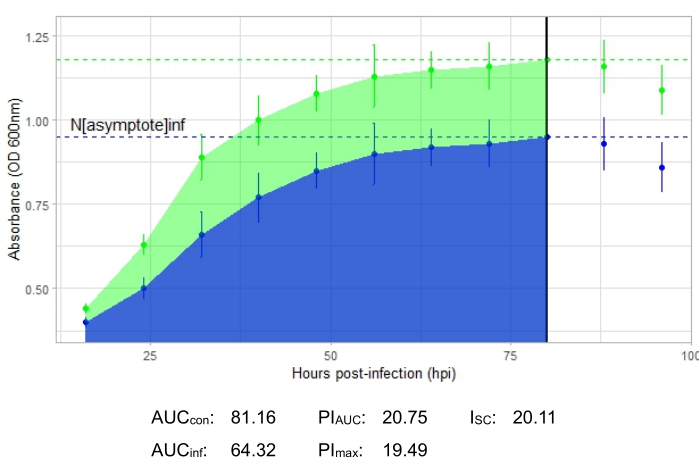
الشكل 2: تجربة منحنى نمو ناجحة مع عاثية في MOI من 1 تصيب البكتيريا المضيفة بشكل منتج. يتم عرض متوسط قيم الامتصاص (± الانحراف المعياري) للبكتيريا غير المصابة (الخضراء) والبكتيريا مع إضافة العاثية (الأزرق). الاختصارات: AUC = المنطقة تحت المنحنى. PIAUC = تثبيط النمو في المئة محسوبة من المنطقة تحت المنحنى ؛ Nمقارب = قيمة ذروة النمو ؛ PImax = تثبيط النمو في المئة محسوبة من قيم نمو الذروة ؛ ISC = مؤشر ستايسي سيبالوس. يمثل هذا الرسم البياني عاثية Gordonia المعتدلة DelRio التي تصيب G. terrae ، وهي البكتيريا التي تم عزلها عليها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
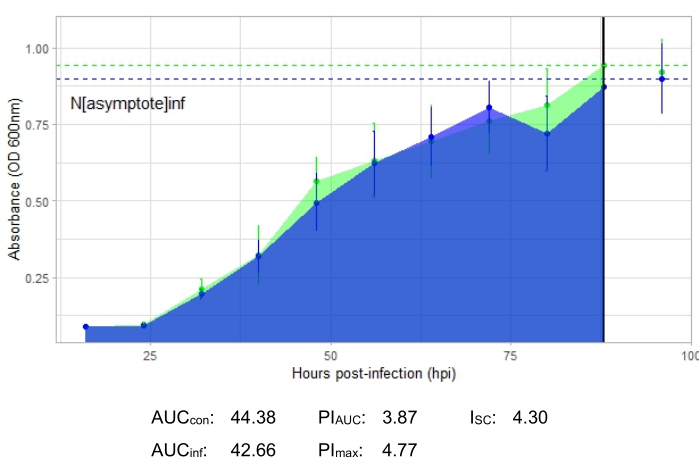
الشكل 3: تجربة منحنى نمو ناجحة مع عاثية في MOI من 1 لا تصيب البكتيريا المضيفة بكفاءة. يتم عرض متوسط قيم الامتصاص (± الانحراف المعياري) للبكتيريا غير المصابة (الخضراء) والبكتيريا مع إضافة العاثية (الأزرق). الاختصارات: AUC = المنطقة تحت المنحنى. PIAUC = تثبيط النمو في المئة محسوبة من المنطقة تحت المنحنى ؛ Nمقارب = قيمة ذروة النمو ؛ PImax = تثبيط النمو في المئة محسوبة من قيم نمو الذروة ؛ ISC = مؤشر ستايسي سيبالوس. يمثل هذا الرسم البياني عدوى G. rubripertincta بواسطة DelRio. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
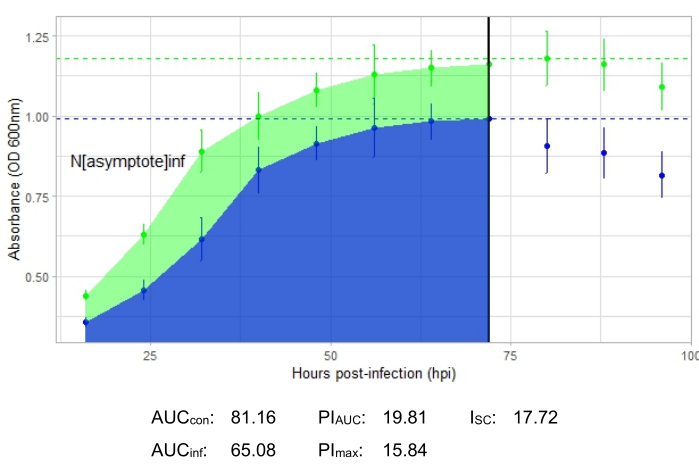
الشكل 4: تجربة منحنى نمو ناجحة مع عاثية عند MOI 0.01. يتم عرض متوسط قيم الامتصاص (± الانحراف المعياري) للبكتيريا غير المصابة (الخضراء) والبكتيريا مع إضافة العاثية (الأزرق). الاختصارات: AUC = المنطقة تحت المنحنى. PIAUC = تثبيط النمو في المئة محسوبة من المنطقة تحت المنحنى ؛ Nمقارب = قيمة ذروة النمو ؛ PImax = تثبيط النمو في المئة محسوبة من قيم نمو الذروة ؛ ISC = مؤشر ستايسي سيبالوس. يمثل هذا الرسم البياني عدوى G. terrae بواسطة DelRio. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تسمح طريقة الصفيحة الدقيقة القائمة على الكثافة الضوئية هذه بالتحقيق في نطاق مضيف البكتيريا وديناميكيات العدوى11 وتظهر فائدة مؤشر Stacy-Ceballos16 كمقياس لضراوة البكتيريا. في حين يمكن استخدام هذه الطريقة مع أي نظام مضيف للبكتيريا ، فقد تم تصميمه خصيصا لتكييف فحوصات نمو الصفائح الدقيقةالسريعة 9،10،11 للاستخدام مع البكتيريا البطيئة النمو مثل الفطريات الشعاعية. لا يمكن استخدام مقايسات الصفائح الدقيقة السريعة للبكتيريا بطيئة النمو دون تعديلات لمعالجة التبخر وتكثيف الغطاء. تصف هذه الطريقة هذه التعديلات الضرورية وتوضح ، لأول مرة ، استخدام مؤشر Stacy-Ceballos والمقاييس ذات الصلة16 لوصف عدوى البكتيريا.
يمكن أن يمثل التبخر تحديا كبيرا في مقايسات منحنى نمو الصفيحة التي تبلغ 96 بئرا لعدة أيام ؛ تحل هذه الطريقة هذه المشكلة عن طريق إضافة الأغاروز إلى الآبار الحدودية والمسافات بين الآبار. يوفر هامش الأغاروز ، جنبا إلى جنب مع معالجة الغطاء المضادللضباب 22 ، الرطوبة اللازمة داخل الصفيحة الدقيقة ويسمح بقياسات كثافة بصرية موثوقة. بدون الرطوبة المضافة ، يحدث تبخر كبير لتأثير الحافة23 خلال فترة الحضانة الطويلة المطلوبة ، مما يؤدي إلى قراءات كثافة بصرية عالية بشكل مصطنع. تعد معالجة الغطاء المضاد للضباب تعديلا ضروريا لأن تكثيف الغطاء يمكن أن يرفع أيضا قيم الكثافة الضوئية بشكل مصطنع. يعد هز الألواح خلال فترة الحضانة تعديلا موصى به ، حيث قد تتجمع بكتيريا الأكتينوميسيت أثناء النمو ، مما يعطي قيم كثافة بصرية عالية بشكل مصطنع ويقلل بشكل فعال من تعدد العدوى.
تعد نسبة البكتيريا إلى العاثية في التجارب التي تميز ديناميكيات العدوى أمرا بالغ الأهمية ، حيث يجب أن يكون هناك ما يكفي من العاثيات لإظهار تأثير العدوى ولكن ليس كثيرا لدرجة أن عدد البكتيريا المضيفة يتعطل على الفور9 أو يزداد تواتر التحلل بشكل كبير28. في هذه الطريقة ، وجد أن النسبة الأكثر فعالية للحصول على نتائج متسقة كانت MOI من 1 ، ولكن تم الحصول على نتائج قابلة للاستخدام أيضا مع MOIs من 0.1 و 0.01. عند تنفيذ هذه الطريقة ، يوصى باختيار تركيز واحد من البكتيريا واختبار تركيزات متعددة من العاثيات في نطاق MOI من 0.01-19،10،11.
تسمح هذه التقنية الموصوفة هنا بتقييم التفاعلات بين البكتيريا والمضيف بحثا عن البكتيريا بطيئة النمو في مقايسات الصفائح الدقيقة عالية الإنتاجية بدلا من أخذ العينات الفرعية من قارورة مزرعة أكبر في كل فترةقياس 29. علاوة على ذلك ، من خلال توضيح كيفية تكييف فحوصات نمو الصفائح الدقيقة9،10،11 ، تزيد هذه التقنية من فائدة فحوصات البكتيريا الأخرى القائمة على الصفائح الدقيقة للبكتيريا البطيئة النمو ، بما في ذلك توصيف العاثيات5،6،12 ودراسات التطور 30،31. أخيرا ، توضح هذه الطريقة استخدام مؤشر Stacy-Ceballos16 لوصف عدوى البكتيريا. تم تطوير هذا المقياس في البداية باستخدام بيانات من نظام نموذج فيروس قديم ويتم حسابه من قيم الكثافة الضوئية ، مما يمنحه فائدة واسعة النطاق عبر أنظمة الفيروسات المتباينة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من خلال منحة معهد تكامل الأحياء NSF DBI (BII) (الجائزة رقم 2119968; PI-Ceballos) ومن خلال برنامج Arkansas INBRE ، بمنحة من المعهد الوطني للعلوم الطبية العامة ، (NIGMS) ، P20 GM103429 من المعاهد الوطنية للصحة. يقدر المؤلفون أيضا دعم برنامج باترسون الصيفي للأبحاث الجامعية في جامعة أواتشيتا المعمدانية.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
References
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved