Method Article
Aktinobakteriyofaj enfeksiyonunu karakterize etmek için uyarlanmış optik yoğunluk tabanlı mikroplaka testi
Bu Makalede
Özet
Aktinomisetler ve diğer yavaş büyüyen bakteriler için uygun olan bakteriyofajların varlığında uzun süreli bakteri büyümesini ölçmek için optik yoğunluğa dayalı bir mikroplaka yöntemi tanımlanmıştır. Bu yöntem, buharlaşmayı ve kapak yoğuşmasını azaltmak için modifikasyonlar ve eğrinin altındaki alan, büyüme maksimumu ve göreceli virülans dahil olmak üzere virüs enfeksiyonu ölçümlerini hesaplamak için R kodunu içerir.
Özet
Bakteriyofajlar doğal ortamların önemli bir parçasıdır ve bakteri popülasyonlarını şekillendirmek için güçlü bir yeteneğe sahiptirler. Bireysel fajların aktinomisetler gibi yavaş büyüyen bakteri konakçılarıyla nasıl etkileşime girdiğini anlamak için, fajların varlığında uzun süreli bakteriyel büyümeyi ölçmek için kolay ve güvenilir bir yönteme ihtiyaç vardır. Spektrofotometrik mikroplaka okuyucular, yüksek verimli tekrarlanan ölçümlere izin verir, ancak küçük bir hacmi uzun süre inkübe etmek teknik zorluklar doğurabilir. Bu prosedür, 96 saat boyunca alt örnekleme yapmadan fajların ve bakterilerin birlikte kültürlenmesine izin vermek için standart bir 96 delikli mikroplakayı uyarlar ve bakteri büyümesi spektrofotometrik absorbans değerleri kullanılarak her 8 saatte bir kaydedilir. Bu optik yoğunluk değerleri, yüzde büyüme inhibisyonu, göreceli virülans ve Stacy-Ceballos indeksi dahil olmak üzere enfeksiyon ölçümlerini elde etmek için R kullanılarak analiz edilir. Burada özetlenen yöntemler, uzatılmış süreli mikroplaka büyüme eğrisi deneylerini yürütmek ve analiz etmek için etkili bir yol sağlar ve buharlaşmayı ve kapak yoğuşmasını azaltmak için modifikasyonlar içerir. Bu protokoller, yavaş büyüyen bakteri konakçıları ve bakteriyofajları arasındaki etkileşimlerin mikroplaka tabanlı tahlillerini kolaylaştırır.
Giriş
Bakteriyofajlar veya fajlar, bakterileri enfekte eden virüslerdir. Bunlar gezegen1'deki en çok sayıda biyolojik varlıktır ve bakteriyofajların bakteriyel evrimi ve ekosistem süreçlerini etkilediği genel olarak kabul edilir 2,3,4. Bakteriyofaj konakçı aralığı 8 ve enfeksiyon dinamiği5,6'yı tanımlamak, ölçmek ve analiz etmek için, çift katmanlı agar yöntemi7 gibi agar tabanlı yöntemler ve optik yoğunluğa dayalı mikroplaka yöntemleri8,9,10,11,12 dahil olmak üzere çeşitli yöntemler mevcuttur. Her yöntemin kendine özgü avantajları ve dezavantajları vardır. Verimlilikleri nedeniyle, çift katmanlı agar yöntemini kullanan kaplama testleri, konakçı aralığı testleri için "altın standart" tır, ancak bu yöntem zaman ve emek yoğun9'dur. Sonuçları 24 saat veya daha kısa sürede döndüren hızlı mikroplaka yöntemleri, Escherichia coli 9,10,11,12 gibi hızlı büyüyen bakteri konakçıları için mükemmel sonuçlar verir, ancak aktinomisetler7,13,14,15 gibi daha yavaş büyüyen bakteri konakçılarında bakteriyofaj enfeksiyonu ilerlemesini göstermek için çok kısadır.
Hızlı büyüyen bakteriler için tasarlanmış optik yoğunluğa dayalı bir mikroplaka testi, yavaş büyüyen bir konakçı bakterideki enfeksiyon dinamiklerini karakterize etmek için gereken birkaç gün boyunca, buharlaşma meydana gelmeden ve yapay olarak yüksek bakteri yoğunlukları vermeden çalıştırılamaz. Bu nedenle, yavaş büyüyen bakteri türleri için bakteriyofaj enfeksiyonu dinamikleri hakkında karşılaştırılabilir yüksek verimli veriler elde etmek, bu bakteriler için uyarlanmış özel teknikler gerektirir.
Burada sunulan mikroplaka yöntemi buharlaşmayı azaltır, böylece yavaş büyüyen bakterilerin 96 saatlik uzun bir süre boyunca bir fajla birlikte kültürlenmesine izin verir ve faj enfeksiyonu dinamikleri ve konakçı aralığı hakkında araştırmalar yapılmasını sağlar. Bu yöntem aynı zamanda farklı konakçı-virüs sistemleri arasında virülans karşılaştırmalarına izin veren optik yoğunluğa dayalı bir metrik olan Stacy-Ceballos indeks16'yı da göstermektedir.
Protokol
Bu protokol Gordonia terrae için yazılmış olsa da, Gordonia lacunae, Gordonia rubripertincta ve Gordonia westfalica için de başarıyla kullanılmıştır.
1. Bakteri preparatı
- Bir biyogüvenlik kabininde, Gordonia terrae CAG3'ün tek bir kolonisini, 0.01 mg / mL sikloheksimid içeren 200 mL pepton maya kalsiyum suyu 18 (PYCa) içeren 1 L steril şaşkın bir şişeye aşılamak için iyi mikrobiyolojik uygulama17'yi kullanın (Malzeme Tablosuna bakınız).
- Şişeyi 30 ° C'de, kültür doygunluğa ulaşana kadar veya 3 gün boyunca 250 rpm'de çalkalayarak inkübe edin7.
- Doymuş G. terrae kültürünü PYCa suyunda seri olarak seyreltin ve PYCa plakaları 19,20 üzerindeki 10−4, 10−5 ve 10−6 seyreltmelerin her biri100 μL yayılmış plaka 19,20. Seyreltilmemiş doymuş kültürü 4 °C'de soğutun.
- Yayılmış plakaları 30 ° C'de 3 gün boyunca ters çevrilmiş olarak inkübe edin.
- Kuluçkadan sonra, 20-200 kolonili bir plaka olan "sayılabilir bir plaka" tanımlayın. Bu plakadaki koloni sayısını sayın ve mililitre başına koloni oluşturan birimleri hesaplayın (cfu / mL)19,20.
- Doymuş kültürü PYCa suyu ile 4.0 x 106 cfu / mL bakteriye seyreltin.
2. Faj hazırlama
NOT: Bildirilen temsili sonuçlar, G. terrae üzerinde izole edilen ılıman bir bakteriyofaj olan Gordonia fajı DelRio21 ile elde edilmiştir. Bu yöntemler diğer Gordonia fajlarıyla da başarıyla kullanılmıştır.
- İzole edilmiş bir bakteriyofajla başlayarak, faj örneğini faj tamponu7'de seri olarak 1 x 10−8 seyreltmeye kadar seyreltin. Doymuş G. terrae kültürünün 0.3 mL'sini her faj seyreltmesinin 10 μL'si ileenfekte ederek çift katmanlı bir agar faj titresi testi 7 gerçekleştirin. 5-10 dakikalık oda sıcaklığında bir inkübasyonun ardından, bakteri-faj karışımını 3 mL PYCa üst agar ile birleştirin ve PYCa agar plakalarına dökün.
- 30 ° C'de ters çevrilmiş plakaları 3 gün boyunca veya plaklar7 oluşana kadar inkübe edin.
- Kuluçkadan sonra, 20-200 plakalı bir plaka olan "sayılabilir bir plaka" tanımlayın. Bu plakadaki plak sayısını sayın ve mililitre başına plak oluşturan birimleri hesaplayın (pfu/mL)7.
3. Mikroplaka hazırlama
NOT: Bu yöntem için düz tabanlı 96 kuyucuklu mikroplakalar ( Malzeme Tablosuna bakınız) kullanılmalıdır. Tüm plaka hazırlama ve yükleme bir biyogüvenlik kabininde tamamlanmalı ve iyi mikrobiyolojik uygulama17kullanılmalıdır.
- 100 μL Triton-X 100, 40 mL %100 izopropanol ve 160 mL deiyonize su22'yi birleştirerek buğu önleyici kapak kaplama çözeltisini hazırlayın. Karıştırmak için karıştırın ve oda sıcaklığında saklayın.
- Bir biyogüvenlik kabininde, steril 96 delikli bir mikroplaka kapağının iç yüzeyine 6 mL kapak kaplama çözeltisi ekleyin, kapağı kenarlarından tutun ve çözelti tarafından kaplandığından emin olmak için döndürün. Çözeltinin kapağın üzerine 20 saniye boyunca oturmasına izin verin, ardından çözeltiyi dökün ve kapağı otoklavlanmış bir kağıt havlu üzerinde, kapak tamamen kuruyana kadar bir açıyla ters çevirin, bu da tipik olarak 35-45 dakika sürer. Kapağı kenarlarından tutmaya dikkat edin.
- Her 96 delikli mikroplaka için suda 20 mL% 0.1 agaroz hazırlayın, agarozu eritmek için mikrodalga fırınlayın.
- Agaroz 50-60 ° C'ye soğuduktan sonra, plakanın kuyucukları ile 200 μL agaroz arasındaki tüm boşluklara %0,1 agarozun 100 μL'sini A sırası ve H satırı ve sütun 1, sütun 2, sütun 11 ve sütun 1223'teki kuyucuklara pipet edin (Şekil 1).
4. Plakanın bakteri ve fajla yüklenmesi
NOT: Tüm plaka hazırlama ve yükleme işlemleri bir biyogüvenlik kabininde tamamlanmalı ve iyi mikrobiyolojik uygulama17 kullanılmalıdır.
- 96 delikli plaka, her bir kuyucuk9'da 75 μL 2.0 x 106 cfu / mL bakteri içerecektir. 4.0 x 10 6 cfu/mL bakteri kültürü 1:1'i 2x PYCa suyu ile 2.0 x 106 cfu/mL'ye seyreltin. 96 delikli plaka başına 5 mL hazırlayın.
- Her biri 2.0 x 106 pfu / mL, 2.0 x 105 pfu / mL ve 2.0 x 104 pfu / mL konsantrasyonlarında 1 mL yapmak için faj tamponu7 kullanarak faj lizatını seyreltin. Bu, mikroplaka9 içinde 1, 0.1 ve 0.01'lik bir enfeksiyon çokluğuna (MOI) izin verecektir.
- Mikroplakayı yüklemek için, buğu önleyici çözelti ve agaroz ile hazırlanmış bir plaka alın ve Şekil 1'i takip eden 2.0 x 106 cfu / mL bakterilerinin 75 μL'sini 3-10 numaralı sütunlara pipetin.
- Sütun 3 ve sütun 4'e, Şekil 1'i izleyerek fajsız pozitif kontrol görevi görmesi için her bir kuyucuğa 75 μL steril faj tamponu ekleyin ve her eklemeden sonra karıştırmak için pipeti yukarı ve aşağı doğru çekin. Sütun 5 ve sütun 6'ya 2,0 x 106 pfu/mL fajın 75 μL'sini, sütun 7 ve sütun 8'e 2,0 x 105 pfu/mL fajın 75 μL'sini ve sütun 9 ve sütun 10'a 2,0 x 104 pfu /mL fajın 75 μL'sini ekleyin ve her eklemeden sonra karıştırmak için yukarı ve aşağı pipetleyin.
- Gaz değişimine izin verirken plakayı kısmen kapatmak için plakanın her iki kısa tarafını etiketleme bandında 0,5 ile bantlayın.
5. Kuluçka ve absorbans ölçümü
- Plakalar bakteri ve fajla yüklendikten sonra, bunları 250 rpm'de bir mikroplaka çalkalayıcıya yerleştirin ve 30 ° C'de inkübe edin.
- Plakaları 96 saat boyunca inkübe edin, saat 16'dan başlayarak her 8 saatte bir mikroplaka okuyucuda 600 nm'de optik yoğunluk ölçümü yapın. Plakaları ölçümler arasında çalkalayıcıya geri döndürün.
NOT: Saat 0'dan başlayarak 4, h 6 saat, 8 saat ve 12 saatlik ölçüm periyotları değerlendirilmiş ve enfeksiyon sonrası 16 saatte başlayan 8 saatlik bir örnekleme periyodunun Gordonia-faj etkileşimlerini en iyi şekilde yakaladığı belirlenmiştir. - Deney boyunca kapağı yoğuşma açısından izleyin. Yoğuşma gözlenirse, kapağı adım 3.2'ye göre kaplanmış başka bir kapakla değiştirin.
- Protokol bölüm 6'yı izleyerek kontrol ve enfekte büyüme eğrileri oluşturun.
6. Veri analizi
- Stacy-Ceballos-Index GitHub deposundaki (https://github.com/eichristenson/Stacy-Ceballos-Index) elektronik tablo düzenini izleyerek her faj seyreltmesinin ortalama ve standart sapmasını hesaplamak için bir elektronik tablo programı kullanın.
- DescTools24, dplyr 25, ggplot2 26 ve readxl27 paketleriyle ve Stacy-Ceballos-Index GitHub deposundaki (https://github.com/eichristenson/Stacy-Ceballos-Index) R betiğini izleyerek kontrol ve virüslü büyüme eğrileri oluşturun ve R kullanarak (Malzeme Tablosuna bakın) enfeksiyon ölçümlerini hesaplayın.
- AUCcon , enfekte olmamış kontrol eğrisinin altındaki alandır, AUCinf ise enfekte eğri16'nın altındaki alandır. AUC'yi hesaplayın ve ardından aşağıdaki denklemi kullanarak PIAUC16 eğri değerleri altındaki alana göre yüzde büyüme inhibisyonunu hesaplayın:
(1 - [AUCinf/AUCcon]) × 100 - Her eğrideki kesikli yatay çizgiler, enfekte olmayan büyüme zirvesi Nasimptote (con ) ve enfekte büyüme zirvesi Nasimptote (inf ) etiketli olarak tepe büyümesini gösterir. Nasimptot değerlerini tanımlayın ve ardından aşağıdaki denklemi kullanarak bu tepe büyüme değerlerine (PImax16) dayanarak yüzde büyüme inhibisyonunu hesaplayın:
(1 - [N asimptote(inf)/ Nasimptote(con)]) × 100 - PIAUC ve PImax değerlerinden Stacy-Ceballos endeksi ISC16'yı aşağıdaki gibi hesaplayın:
(PIAUC × PImaks.) 0.5
Stacy-Ceballos endeksini zaman içinde entegre ederek göreceli virülansı hesaplayın16.
- AUCcon , enfekte olmamış kontrol eğrisinin altındaki alandır, AUCinf ise enfekte eğri16'nın altındaki alandır. AUC'yi hesaplayın ve ardından aşağıdaki denklemi kullanarak PIAUC16 eğri değerleri altındaki alana göre yüzde büyüme inhibisyonunu hesaplayın:
Sonuçlar
Ortaya çıkan büyüme eğrisi, pozitif kontrol bakteri popülasyonunda zaman içinde absorbansta ani bir dalgalanma olmadan bir artış gösteriyorsa bir deney başarılıdır. Üretken bir faj enfeksiyonu olan ve olmayan 1'lik bir MOI'de başarılı bir deneyin örnekleri sırasıyla Şekil 2 ve Şekil 3'te gösterilmiştir. 0.01 MOI'de üretken bir enfeksiyon Şekil 4'te gösterilmiştir. Her üç şekilde de görülen pozitif kontrollü büyüme paterni (yeşil eğri), bakterilerin büyüdüğünü, büyüme sırasında kümelenmediklerini ve kirletici madde bulunmadığını göstermektedir. Topaklanma ve kontaminasyon, tek bir zaman noktasında alışılmadık derecede yüksek emilim ile gösterilir. Standart sapmalar tipik olarak bir deneyin zaman içinde artar; Bununla birlikte, kontrol ve enfekte eğriler arasında örtüşen ciddi bir artış veya standart sapmalar, bir veya daha fazla kuyucukta kontaminasyona veya kümelenmeye işaret edebilir.
Şekil 2 ile temsil edilen üretken bir faj enfeksiyonunu gösteren büyüme eğrisi, faj eklenmiş kuyucuklarda zamanla bakteriyel emilimin azaldığını göstermektedir. Bakteri yoğunluğundaki bu azalma, Şekil 3'te gösterildiği gibi, bakteri fajın konakçı aralığının dışındaysa görülmeyecektir.
Tüm temsili deneyler için enfeksiyon metrikleri, Şekil 2 ve Şekil 4'teki üretken enfeksiyonlar için nispeten büyük bir I SC ve konakçı bakteriyi etkili bir şekilde enfekte etmeyen faj için Şekil 3'te çok küçük bir I SC ile gösterilmiştir.
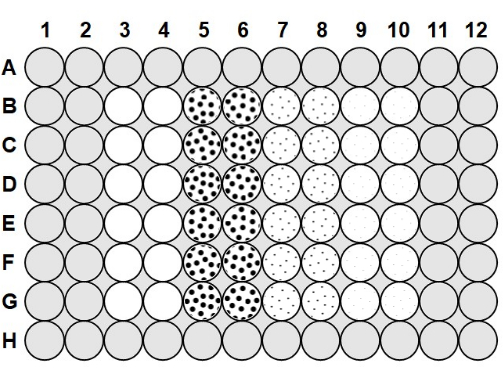
Şekil 1: Mikroplaka düzeni. Gri alanlar% 0.1 agaroz ile doldurulur. Sütun 3 ve sütun 4'teki boş kuyular, sadece faj tamponu ve 2.0 x 106 cfu/mL bakteri içeren fajsız pozitif kontrol kuyularıdır. Noktalı kuyucuklar faj ve 2.0 x 106 cfu / mL bakteri içerir; sütun 5 ve sütun 6'daki büyük noktalar, 2.0 x 106 pfu/mL faj ile 1'lik bir MOI'yi gösterir; sütun 7 ve sütun 8'deki orta noktalar, 2,0 x 105 pfu/mL faj ile 0,1'lik bir MOI'yi gösterir; ve sütun 9 ve sütun 10'daki küçük noktalar, 2.0 x 104 pfu / mL faj ile 0.01'lik bir MOI'yi gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
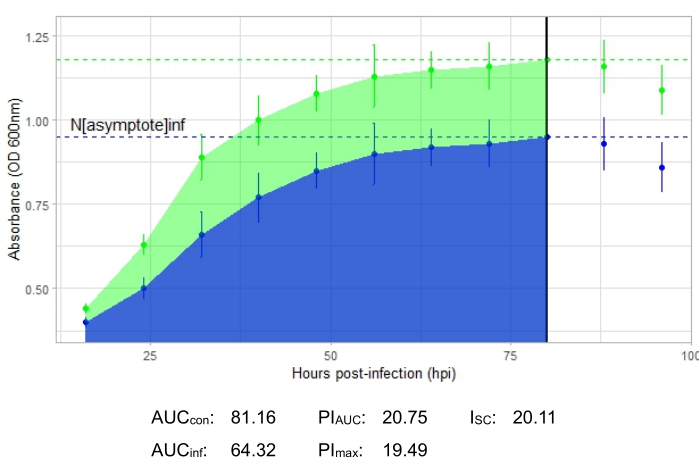
Şekil 2: Konakçı bakteriyi üretken bir şekilde enfekte eden 1 MOI'de bir faj ile başarılı bir büyüme eğrisi deneyi. Ortalama absorbans değerleri (± standart sapma), enfekte olmamış bakteriler (yeşil) ve faj eklenmiş bakteriler (mavi) için gösterilmiştir. Kısaltmalar: AUC = eğrinin altındaki alan; PIAUC = eğrinin altındaki alandan hesaplanan yüzde büyüme inhibisyonu; Nasimptot = tepe büyüme değeri; PImax = tepe büyüme değerlerinden hesaplanan yüzde büyüme inhibisyonu; ISC = Stacy-Ceballos indeksi. Bu grafik, izole edildiği bakteri olan G. terrae'yi enfekte eden ılıman Gordonia fajı DelRio'yu temsil etmektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
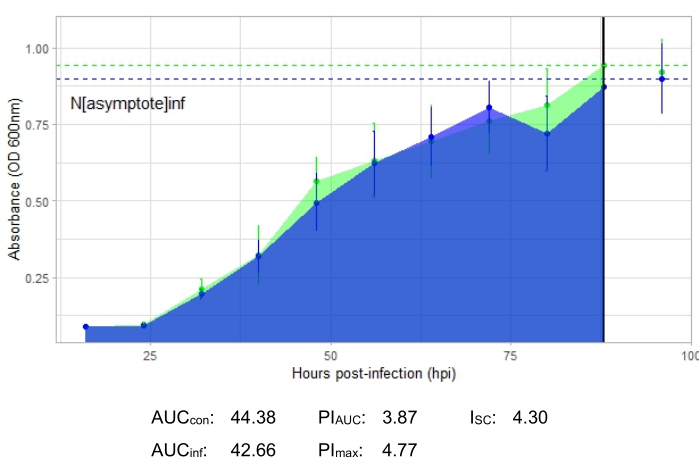
Şekil 3: Konakçı bakteriyi etkili bir şekilde enfekte etmeyen 1 MOI'de bir faj ile başarılı bir büyüme eğrisi deneyi. Ortalama absorbans değerleri (± standart sapma), enfekte olmamış bakteriler (yeşil) ve faj eklenmiş bakteriler (mavi) için gösterilmiştir. Kısaltmalar: AUC = eğrinin altındaki alan; PIAUC = eğrinin altındaki alandan hesaplanan yüzde büyüme inhibisyonu; Nasimptot = tepe büyüme değeri; PImax = tepe büyüme değerlerinden hesaplanan yüzde büyüme inhibisyonu; ISC = Stacy-Ceballos indeksi. Bu grafik, DelRio tarafından G. rubripertincta enfeksiyonunu temsil etmektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
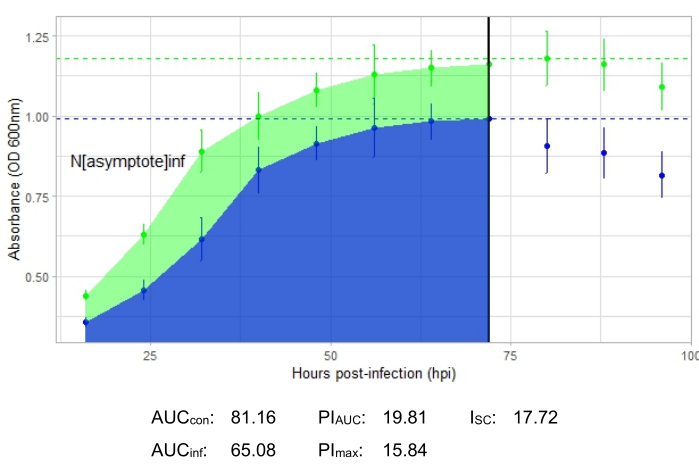
Şekil 4: 0.01 MOI'de bir faj ile başarılı bir büyüme eğrisi deneyi. Ortalama absorbans değerleri (± standart sapma), enfekte olmamış bakteriler (yeşil) ve faj eklenmiş bakteriler (mavi) için gösterilmiştir. Kısaltmalar: AUC = eğrinin altındaki alan; PIAUC = eğrinin altındaki alandan hesaplanan yüzde büyüme inhibisyonu; Nasimptot = tepe büyüme değeri; PImax = tepe büyüme değerlerinden hesaplanan yüzde büyüme inhibisyonu; ISC = Stacy-Ceballos indeksi. Bu grafik, DelRio tarafından G. terrae enfeksiyonunu temsil etmektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu optik yoğunluğa dayalı mikroplaka yöntemi, bakteriyofaj konakçı aralığı ve enfeksiyon dinamikleri11'in araştırılmasına izin verir ve Stacy-Ceballos indeksi16'nın bakteriyofaj virülansının bir ölçüsü olarak faydasını gösterir. Bu yöntem herhangi bir bakteriyofaj-konakçı sistemi ile kullanılabilirken, aktinomisetler gibi daha yavaş büyüyen bakterilerle kullanım içinhızlı mikroplaka büyüme tahlilleri 9,10,11'i uyarlamak için özel olarak tasarlanmıştır. Hızlı mikroplaka analizleri, buharlaşma ve kapak yoğuşmasını ele almak için modifikasyonlar yapılmadan yavaş büyüyen bakteriler için kullanılamaz. Bu yöntem, bu gerekli modifikasyonları açıklar ve ilk kez, bakteriyofaj enfeksiyonunu tanımlamak için Stacy-Ceballos indeksinin ve ilgili metriklerin16 kullanımını gösterir.
Evaporasyon, çok günlük 96 kuyucuklu plaka büyüme eğrisi tahlillerinde önemli bir zorluk olabilir; Bu yöntem, sınır kuyularına ve kuyular arasındaki boşluklara agaroz ekleyerek bu sorunu çözer. Agaroz marjı, buğu önleyici kapak işlemi22 ile birleştiğinde, mikroplaka içinde gerekli nemi sağlar ve güvenilir optik yoğunluk ölçümlerine izin verir. Eklenen nem olmadan, gerekli uzun inkübasyon süresi boyunca önemli kenar etkisi buharlaşması23 meydana gelir ve yapay olarak yüksek optik yoğunluklu okumalara yol açar. Buğu önleyici kapak işlemi gerekli bir modifikasyondur, çünkü kapak yoğuşması optik yoğunluk değerlerini yapay olarak da yükseltebilir. Kuluçka döneminde plakaların çalkalanması, aktinomisit bakterileri büyüme sırasında kümelenebileceğinden, yapay olarak yüksek optik yoğunluk değerleri verebileceğinden ve enfeksiyonun çokluğunu etkili bir şekilde azaltabileceğinden, önerilen bir modifikasyondur.
Enfeksiyon dinamiklerini karakterize eden deneylerde bakterilerin fajlara oranı kritiktir, çünkü bir enfeksiyon etkisi göstermek için yeterli faj olması gerekir, ancak konakçı bakteri popülasyonunun hemen9'a çarpması veya lizojen sıklığının çarpıcı bir şekilde artması28 kadar fazla değildir. Bu yöntemde, tutarlı sonuçlar elde etmek için en etkili olduğu tespit edilen oran 1'lik bir MOI idi, ancak 0.1 ve 0.01'lik MOI'lerle de kullanılabilir sonuçlar elde edildi. Bu yöntemi uygularken, bir bakteri konsantrasyonu seçmeniz ve 0.01-1 9,10,11 MOI aralığında çoklu faj konsantrasyonlarının test edilmesi önerilir.
Burada açıklanan bu teknik, bakteriyofaj-konakçı etkileşimlerinin, her ölçüm aralığında daha büyük bir kültür şişesinden alt örnekleme yerine, yüksek verimli mikroplaka tahlillerinde yavaş büyüyen bakteriler için değerlendirilmesine izin verir29. Ayrıca, mikroplaka büyüme tahlilleri 9,10,11'in nasıl uyarlanabileceğini göstererek, bu teknik, faj karakterizasyonu 5,6,12 ve evrim çalışmaları 30,31 dahil olmak üzere daha yavaş büyüyen bakteriler için diğer mikroplaka bazlı bakteriyofaj tahlillerinin faydasını arttırmaktadır. Son olarak, bu yöntem bakteriyofaj enfeksiyonunu tanımlamak için Stacy-Ceballos indeks16'nın kullanımını göstermektedir. Bu metrik başlangıçta bir arkeal virüs modeli sisteminden elde edilen verilerle geliştirilmiştir ve optik yoğunluk değerlerinden hesaplanmıştır, böylece farklı virüs sistemlerinde yaygın bir fayda sağlamıştır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma NSF DBI Biyoloji Entegrasyon Enstitüsü (BII) hibesi (ödül no. 2119968; PI-Ceballos) ve Arkansas INBRE programı tarafından, Ulusal Genel Tıp Bilimleri Enstitüsü'nden (NIGMS) bir hibe ile, Ulusal Sağlık Enstitüleri'nden P20 GM103429. Yazarlar ayrıca Ouachita Baptist Üniversitesi'ndeki Patterson Yaz Lisans Araştırma Programı'nın desteğini de takdir ediyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
Referanslar
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır