Method Article
Dosage adapté sur microplaques basé sur la densité optique pour caractériser l’infection par actinobacteriophages
Dans cet article
Résumé
Une méthode de microplaques basée sur la densité optique est décrite pour quantifier la croissance bactérienne à long terme en présence de bactériophages, adaptés aux actinomycètes et autres bactéries à croissance lente. Cette méthode comprend des modifications pour réduire l’évaporation et la condensation du couvercle et le code R pour calculer les paramètres d’infection virale, y compris la surface sous la courbe, le maximum de croissance et la virulence relative.
Résumé
Les bactériophages sont un élément clé des environnements naturels et ils ont une puissante capacité à façonner les populations bactériennes. Pour comprendre comment les phages individuels interagissent avec des hôtes bactériens à croissance lente tels que les actinomycètes, une méthode simple et fiable pour quantifier la croissance bactérienne à long terme en présence de phages est nécessaire. Les lecteurs de microplaques spectrophotométriques permettent des mesures répétées à haut débit, mais l’incubation d’un petit volume pendant une période prolongée peut présenter des défis techniques. Cette procédure adapte une microplaque standard de 96 puits pour permettre la co-culture de phages et de bactéries sans sous-échantillonnage pendant 96 h, la croissance bactérienne étant enregistrée toutes les 8 heures à l’aide de valeurs d’absorbance spectrophotométriques. Ces valeurs de densité optique sont analysées à l’aide de R pour obtenir des mesures d’infection, y compris le pourcentage d’inhibition de la croissance, la virulence relative et l’indice Stacy-Ceballos. Les méthodes décrites ici fournissent un moyen efficace de mener et d’analyser des expériences de courbe de croissance de microplaques de longue durée et comprennent des modifications pour réduire l’évaporation et la condensation du couvercle. Ces protocoles facilitent les essais sur microplaques des interactions entre les hôtes bactériens à croissance lente et leurs bactériophages.
Introduction
Les bactériophages ou phages sont des virus qui infectent les bactéries. Ce sont les entités biologiques les plus nombreuses de la planète1, et il est généralement admis que les bactériophages influencent l’évolution bactérienne et les processus écosystémiques 2,3,4. Il existe plusieurs méthodes pour décrire, mesurer et analyser la gamme d’hôtes des bactériophages 8 et la dynamique d’infection5,6, y compris des méthodes à base d’agar telles que la méthode de gélose à double couche7 et les méthodes de microplaques basées sur la densité optique 8,9,10,11,12. Chaque méthode a ses propres avantages et inconvénients. En raison de leur efficacité, les essais de placage utilisant la méthode de gélose à double couche sont la « norme d’or » pour les essais de gamme d’hôtes, mais cette méthode nécessite beaucoup de temps et de main-d’œuvre9. Les méthodes rapides sur microplaques, qui donnent des résultats en 24 heures ou moins, donnent d’excellents résultats pour les hôtes bactériens à croissance rapide tels que Escherichia coli 9,10,11,12, mais sont trop brèves pour montrer la progression de l’infection bactériophage chez les hôtes bactériens à croissance plus lente tels que les actinomycètes 7,13,14,15.
Un essai sur microplaques basé sur la densité optique conçu pour les bactéries à croissance rapide ne peut pas être exécuté pendant les plusieurs jours nécessaires pour caractériser la dynamique d’infection dans une bactérie hôte à croissance lente sans évaporation et donnant des densités bactériennes artificiellement élevées. Ainsi, l’obtention de données comparables à haut débit sur la dynamique de l’infection des bactériophages pour les espèces bactériennes à croissance lente nécessite des techniques spécialisées adaptées à ces bactéries.
La méthode sur microplaques présentée ici réduit l’évaporation, permettant ainsi aux bactéries à croissance lente d’être co-cultivées avec un phage pendant une période prolongée de 96 heures et permettant d’étudier la dynamique de l’infection par les phages et la gamme d’hôtes. Cette méthode présente également l’indice Stacy-Ceballos16, une mesure basée sur la densité optique qui permet des comparaisons de virulence entre des systèmes hôte-virus disparates.
Protocole
Bien que ce protocole soit écrit pour Gordonia terrae, il a également été utilisé avec succès pour Gordonia lacunae, Gordonia rubripertincta et Gordonia westfalica.
1. Préparation des bactéries
- Dans une enceinte de biosécurité, utiliser les bonnes pratiques microbiologiques17 pour inoculer une seule colonie de Gordonia terrae CAG3 dans une fiole défrangée stérile de 1 L contenant 200 mL de bouillon de calcium de levure peptone18(PYCa) contenant 0,01 mg/mL de cycloheximide (voir le tableau des matières).
- Incuber la fiole à 30 °C en agitant à 250 rpm jusqu’à saturation de la culture ou pendant 3 jours7.
- Diluer en série la culture saturée de G. terrae dans un bouillon de PYCa et étaler sur plaque 100 μL chacune des dilutions 10−4, 10−5 et 10−6 sur les plaques PYCa19,20. Réfrigérer la culture saturée non diluée à 4 °C.
- Incuber les plaques étalées inversées pendant 3 jours à 30 °C.
- Après l’incubation, identifier une « plaque dénombrable », une plaque avec 20 à 200 colonies. Comptez le nombre de colonies sur cette plaque et calculez les unités formant colonies par millilitre (ufc/mL)19,20.
- Diluer la culture saturée avec du bouillon PYCa à 4,0 x 106 ufc/ml de bactéries.
2. Préparation des phages
NOTE: Les résultats représentatifs rapportés ont été obtenus avec le phage Gordonia DelRio21, un bactériophage tempéré isolé sur G. terrae. Ces méthodes ont également été utilisées avec succès avec d’autres phages Gordonia .
- En commençant par un bactériophage isolé, diluer en série l’échantillon de phage dans le tampon de phage 7 jusqu’à une dilutionde 1 x 10−8 . Effectuer un essai de titre de phage sur gélose à double couche7 en infectant 0,3 mL de la culture saturée de G. terrae avec 10 μL de chaque dilution de phage. Après une incubation à température ambiante de 5 à 10 minutes, mélanger le mélange bactéries-phages avec 3 ml de gélose supérieure PYCa et verser sur des plaques de gélose PYCa.
- Incuber les plaques retournées à 30 °C pendant 3 jours ou jusqu’à ce que les plaques forment7.
- Après l’incubation, identifiez une « plaque dénombrable », une plaque avec 20 à 200 plaques. Comptez le nombre de plaques sur cette plaque et calculez les unités formant des plaques par millilitre (ufp / mL)7.
3. Préparation des microplaques
NOTA : Des microplaques à fond plat à 96 puits (voir le tableau des matériaux) devraient être utilisées pour cette méthode. Toute la préparation et le chargement de la plaque doivent être effectués dans une enceinte de biosécurité et les bonnes pratiques microbiologiques17doivent être appliquées.
- Préparer la solution de revêtement antibuée du couvercle en combinant 100 μL de Triton-X 100, 40 mL d’isopropanol à 100 % et 160 mL d’eau désionisée22. Remuer pour mélanger et conserver à température ambiante.
- Dans une enceinte de biosécurité, ajouter 6 mL de solution de revêtement de couvercle à la surface intérieure d’un couvercle de microplaques stérile à 96 puits, en tenant le couvercle par les bords et en le tournant pour s’assurer qu’il est recouvert par la solution. Laissez la solution reposer sur le couvercle pendant 20 s, puis versez la solution et inversez le couvercle sur une serviette en papier autoclavée en biais jusqu’à ce que le couvercle soit complètement sec, ce qui prend généralement 35-45 min. Veillez à tenir le couvercle par les bords.
- Préparer 20 mL d’agarose à 0,1 % dans de l’eau pour chaque microplaque de 96 puits, en cuisant au micro-ondes pour faire fondre l’agarose.
- Une fois que l’agarose a refroidi à 50-60 °C, injecter 100 μL d’agarose à 0,1 % dans tous les espaces entre les puits de la plaque et 200 μL d’agarose dans les puits de la rangée A et de la rangée H et de la colonne 1, colonne 2, colonne 11 et colonne 1223 (figure 1).
4. Chargement de la plaque avec des bactéries et des phages
NOTA: Toute la préparation et le chargement de la plaque doivent être effectués dans une enceinte de biosécurité, et les bonnes pratiques microbiologiques17 doivent être utilisées.
- La plaque de 96 puits contiendra 75 μL de bactéries 2,0 x 106 ufc/mL dans chaque puits9. Diluer la culture bactérienne 1:1 de 4,0 x 10 6 ufc/mL avec 2 bouillons PYCa à 2,0 x 106 ufc/mL. Préparer 5 mL par plaque de 96 puits.
- Diluer le lysat de phage à l’aide du tamponde phage 7 pour obtenir 1 mL de 2,0 x 106 uf/mL, 2,0 x 105 ufp/mL et 2,0 x 104 ufp/mL. Cela permettra une multiplicité d’infection (MOI) de 1, 0,1 et 0,01 dans la microplaque9.
- Pour charger la microplaque, prélever une plaque préparée avec une solution antibuée et de l’agarose, et pipeter 75 μL de bactéries 2,0 x 106 ufc/ml dans les colonnes 3 à 10, en suivant la figure 1.
- Aux colonnes 3 et 4, ajouter 75 μL de tampon de phage stérile à chaque puits pour servir de témoin positif sans phage, après la figure 1, et pipeter de haut en bas pour mélanger après chaque ajout. Ajouter 75 μL du phage 2,0 x 10 6 pfu/mL aux colonnes 5 et6 , 75 μL du phage 2,0 x 105 pfu/mL aux colonnes 7 et 8, et 75 μL du phage 2,0 x 104 ufp/mL aux colonnes 9 et 10, en pipetant de haut en bas pour mélanger après chaque ajout.
- Collez les deux côtés courts de la plaque avec du ruban d’étiquetage de 0,5 po pour sceller partiellement la plaque tout en permettant l’échange de gaz.
5. Mesure de l’incubation et de l’absorbance
- Une fois les plaques chargées de bactéries et de phages, placez-les sur un agitateur à microplaques à 250 tr/min et incuber à 30 °C.
- Incuber les plaques pendant 96 h, en prenant une mesure de densité optique à 600 nm sur un lecteur de microplaques toutes les 8 h à partir de l’heure 16. Remettez les plaques dans le vibreur entre les mesures.
REMARQUE : Des périodes de mesure de 4, h 6 h, 8 h et 12 h ont été évaluées, commençant à l’heure 0, et il a été déterminé qu’une période d’échantillonnage de 8 h commençant à 16 h après l’infection permettait de mieux saisir les interactions Gordonia-phage. - Surveillez la condensation du couvercle tout au long de l’expérience. Si de la condensation est observée, remplacer le couvercle par un autre couvercle revêtu conformément à l’étape 3.2.
- Générer des courbes de contrôle et de croissance infectées en suivant la section 6 du protocole.
6. Analyse des données
- Utilisez un tableur pour calculer la moyenne et l’écart-type pour chaque dilution de phage, en suivant la disposition de la feuille de calcul dans le référentiel GitHub Stacy-Ceballos-Index (https://github.com/eichristenson/Stacy-Ceballos-Index).
- Créez des courbes de contrôle et de croissance infectées, et calculez les métriques d’infection à l’aide de R (voir le tableau des matériaux) avec les packages DescTools 24, dplyr 25, ggplot2 26 et readxl 27 et en suivant le script R dans le référentiel GitHub Stacy-Ceballos-Index (https://github.com/eichristenson/Stacy-Ceballos-Index).
- La SSCcon est la zone sous la courbe de contrôle non infectée, tandis que l’ASCinf est la zone sous la courbe infectée16. Calculez l’ASC, puis calculez le pourcentage d’inhibition de la croissance en fonction des valeurs de l’aire sous la courbe, PIASC16, à l’aide de l’équation suivante :
(1 - [AUCinf/AUCcon]) × 100 - Les lignes horizontales pointillées sur chaque courbe montrent le pic de croissance, avec le pic de croissance non infecté étiqueté N asymptote (con) et le pic de croissance infecté étiqueté Nasymptote (inf). Identifiez les valeursd’asymptote N, puis calculez le pourcentage d’inhibition de la croissance en fonction de ces valeurs de croissance maximales, PImax16, à l’aide de l’équation suivante :
(1 - [N asymptote(inf)/ Nasymptote(con)]) × 100 - Calculez l’indice Stacy-Ceballos, ISC16, à partir des valeurs PIASC et PImax , comme suit :
(PIASC × PImax) 0,5
Calculer la virulence relative en intégrant l’indice de Stacy-Ceballos au fil du temps16.
- La SSCcon est la zone sous la courbe de contrôle non infectée, tandis que l’ASCinf est la zone sous la courbe infectée16. Calculez l’ASC, puis calculez le pourcentage d’inhibition de la croissance en fonction des valeurs de l’aire sous la courbe, PIASC16, à l’aide de l’équation suivante :
Résultats
Une expérience est réussie si la courbe de croissance résultante montre une augmentation de la population bactérienne témoin positive au fil du temps sans fluctuation soudaine de l’absorbance. Des exemples d’expérience réussie à un MOI de 1 avec et sans infection productive par phage sont présentés à la figure 2 et à la figure 3, respectivement. Une infection productive à une MOI de 0,01 est représentée à la figure 4. Le modèle de croissance du témoin positif (courbe verte) observé dans les trois figures indique que les bactéries se développent, qu’elles ne s’agglutinent pas pendant la croissance et qu’aucun contaminant n’est présent. L’agglutination et la contamination sont indiquées par une absorbance anormalement élevée à un moment donné. Les écarts-types augmentent généralement au cours d’une expérience; Cependant, une augmentation drastique ou des écarts-types chevauchant les courbes témoin et infectée peuvent indiquer une contamination ou un agglomérat dans un ou plusieurs puits.
La courbe de croissance illustrant une infection productive par phage, représentée par la figure 2, montre une absorbance bactérienne réduite au fil du temps dans les puits où le phage a été ajouté. Cette réduction de la densité bactérienne ne sera pas observée si la bactérie se trouve en dehors de la gamme d’hôtes du phage, comme le montre la figure 3.
Les paramètres d’infection sont présentés pour toutes les expériences représentatives, avec un I SC relativement important pour les infections productives dans la figure 2 et la figure 4 et un très petit ISC dans la figure 3 pour le phage qui n’a pas infecté efficacement la bactérie hôte.
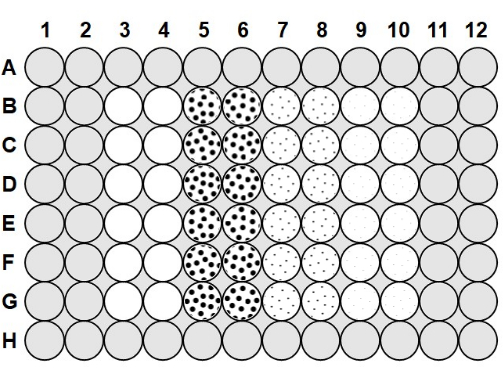
Figure 1 : Disposition des microplaques. Les zones grises sont remplies d’agarose à 0,1%. Les puits blancs des colonnes 3 et 4 sont des puits témoins sans phage positif contenant uniquement un tampon de phage et 2,0 x 106 ufc/ml de bactéries. Les puits pointillés contiennent des bactéries de phage et 2,0 x 106 ufc/mL; les gros points des colonnes 5 et 6 indiquent une MOI de 1 avec 2,0 x 106 ufp/ml de phage; les points moyens des colonnes 7 et 8 indiquent une ME de 0,1 avec 2,0 x 105 ufp/ml de phage; et les petits points dans les colonnes 9 et 10 indiquent un MOI de 0,01 avec 2,0 x 104 ufp/ml de phage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
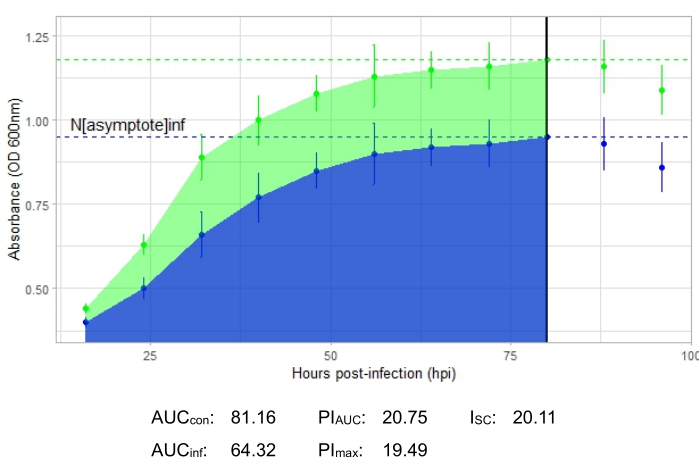
Figure 2 : Une expérience réussie de courbe de croissance avec un phage à un MOI de 1 qui infecte de manière productive la bactérie hôte. Les valeurs moyennes d’absorbance (± écart-type) sont indiquées pour les bactéries non infectées (vert) et les bactéries avec le phage ajouté (bleu). Abréviations : ASC = aire sous la courbe; ASC PI = pourcentage d’inhibition de la croissance calculée à partir de l’aire sous la courbe; Nasymptote = valeur de croissance maximale; PImax = pourcentage d’inhibition de la croissance calculé à partir des valeurs de croissance maximales; ISC = indice Stacy-Ceballos. Ce graphique représente le phage tempéré Gordonia DelRio infectant G. terrae, la bactérie sur laquelle il a été isolé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
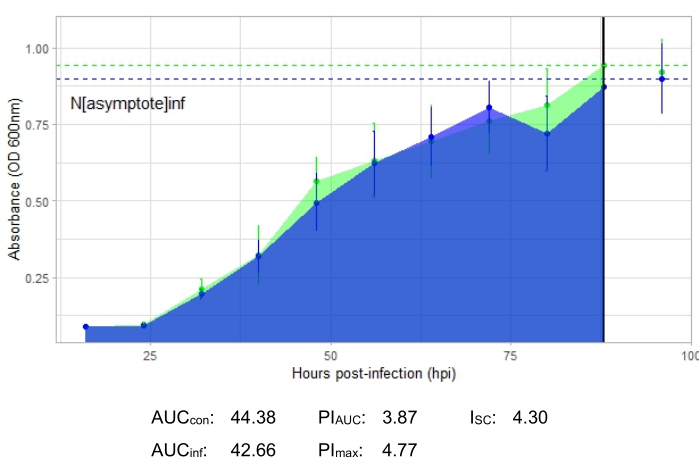
Figure 3 : Une expérience réussie de courbe de croissance avec un phage à un MOI de 1 qui n’infecte pas efficacement la bactérie hôte. Les valeurs moyennes d’absorbance (± écart-type) sont indiquées pour les bactéries non infectées (vert) et les bactéries avec le phage ajouté (bleu). Abréviations : ASC = aire sous la courbe; ASC PI = pourcentage d’inhibition de la croissance calculée à partir de l’aire sous la courbe; Nasymptote = valeur de croissance maximale; PImax = pourcentage d’inhibition de la croissance calculé à partir des valeurs de croissance maximales; ISC = indice Stacy-Ceballos. Ce graphique représente l’infection à G. rubripertincta par DelRio. Veuillez cliquer ici pour voir une version agrandie de cette figure.
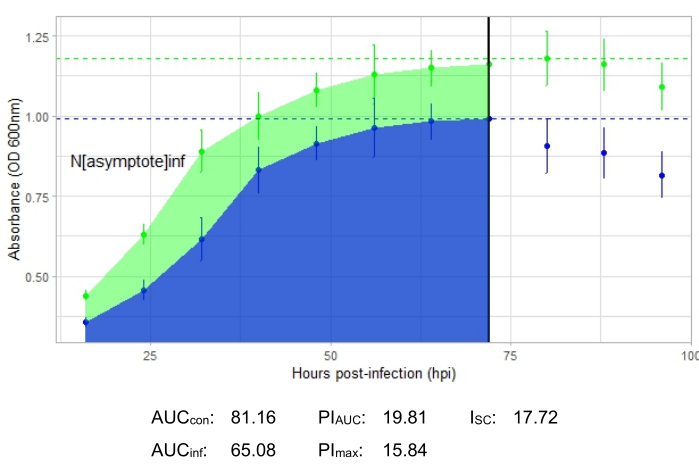
Figure 4 : Une expérience réussie de courbe de croissance avec un phage à un MOI de 0,01. Les valeurs moyennes d’absorbance (± écart-type) sont indiquées pour les bactéries non infectées (vert) et les bactéries avec le phage ajouté (bleu). Abréviations : ASC = aire sous la courbe; ASC PI = pourcentage d’inhibition de la croissance calculée à partir de l’aire sous la courbe; Nasymptote = valeur de croissance maximale; PImax = pourcentage d’inhibition de la croissance calculé à partir des valeurs de croissance maximales; ISC = indice Stacy-Ceballos. Ce graphique représente l’infection à G. terrae par DelRio. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette méthode de microplaques basée sur la densité optique permet d’étudier la gamme d’hôtes des bactériophages et la dynamique de l’infection11 et montre l’utilité de l’indice de Stacy-Ceballos16 comme mesure de la virulence des bactériophages. Bien que cette méthode puisse être utilisée avec n’importe quel système bactériophage-hôte, elle a été conçue spécifiquement pour adapter les tests de croissance rapide des microplaques 9,10,11 pour une utilisation avecdes bactéries à croissance plus lente telles que les actinomycètes. Les tests rapides sur microplaques ne peuvent pas être utilisés pour les bactéries à croissance lente sans modifications pour traiter l’évaporation et la condensation du couvercle. Cette méthode décrit ces modifications nécessaires et démontre, pour la première fois, l’utilisation de l’indice de Stacy-Ceballos et des paramètres connexes16 pour décrire l’infection bactériophagère.
L’évaporation peut être un défi de taille dans les essais de courbe de croissance sur plaque de 96 puits sur plusieurs jours; Cette méthode résout ce problème en ajoutant de l’agarose aux puits frontaliers et aux espaces entre les puits. La marge d’agarose, combinée au traitement antibuée du couvercle22, fournit l’humidité nécessaire à l’intérieur de la microplaque et permet des mesures fiables de densité optique. Sans l’humidité ajoutée, une évaporation substantielle de l’effet de bordse produit 23 pendant la longue période d’incubation requise, ce qui conduit à des lectures de densité optique artificiellement élevées. Le traitement antibuée du couvercle est une modification nécessaire car la condensation du couvercle peut également élever artificiellement les valeurs de densité optique. Secouer les plaques pendant la période d’incubation est une modification recommandée, car les bactéries actinomycètes peuvent s’agglutiner pendant la croissance, ce qui donne des valeurs de densité optique artificiellement élevées et diminue efficacement la multiplicité de l’infection.
Le rapport bactéries/phages dans les expériences caractérisant la dynamique de l’infection est critique, car il doit y avoir suffisamment de phages pour montrer un effet d’infection, mais pas au point que la population bactérienne hôte s’effondre immédiatement9 ou que la fréquence de la lysogénie soit considérablement augmentée28. Dans cette méthode, le ratio le plus efficace pour obtenir des résultats cohérents était un MMO de 1, mais des résultats utilisables ont également été obtenus avec des MOI de 0,1 et 0,01. Lors de la mise en œuvre de cette méthode, il est recommandé de choisir une concentration de bactéries et de tester plusieurs concentrations de phages dans la plage MOI de 0,01-1 9,10,11.
Cette technique décrite ici permet d’évaluer les interactions bactériophage-hôte pour les bactéries à croissance lente dans des essais sur microplaques à haut débit plutôt qu’avec un sous-échantillonnage à partir d’une fiole de culture plus grande à chaque intervalle de mesure29. De plus, en démontrant comment les essais de croissancesur microplaques 9,10,11 peuvent être adaptés, cette technique augmente l’utilité d’autres tests bactériophages à base de microplaques pour les bactéries à croissance plus lente, y compris la caractérisation des phages 5,6,12 et les études d’évolution 30,31. Enfin, cette méthode démontre l’utilisation de l’indice de Stacy-Ceballos16 pour décrire l’infection bactériophagienne. Cette métrique a été initialement développée avec les données d’un système de modèle de virus archéens et est calculée à partir des valeurs de densité optique, ce qui lui confère une utilité généralisée dans des systèmes de virus disparates.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par une subvention du NSF DBI Biology Integration Institute (BII) (prix no. 2119968; PI-Ceballos) et par le programme INBRE de l’Arkansas, avec une subvention de l’Institut national des sciences médicales générales (NIGMS), P20 GM103429 des National Institutes of Health. Les auteurs apprécient également le soutien du Patterson Summer Undergraduate Research Program de l’Université baptiste Ouachita.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
Références
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon