Method Article
التصوير المقطعي ثلاثي الأبعاد عالي الدقة للأعضاء الكاملة للعدوى الميكروبية
In This Article
Summary
هنا ، نصف الإجراء الذي يتيح الكشف على مستوى الأعضاء عن البكتيريا المسببة للأمراض أثناء العدوى والقياس الكمي لأنشطة مراسل الفلورسنت.
Abstract
تحدث معظم العدوى داخل أنسجة مضيفة ثلاثية الأبعاد مع تشريح معقد وفسيولوجيا مضيف متغيرة محليا. يؤثر وضع الخلايا الممرضة داخل هذه البيئة المتنوعة بشكل كبير على مستويات التوتر والاستجابات والمصير والمساهمة في التقدم العام للمرض وفشل العلاج. ومع ذلك ، نظرا للصعوبات التقنية في تحديد موقع الخلايا الممرضة بحجم ميكرومتر داخل الأعضاء المضيفة بحجم سم ، لم يتم استكشاف هذا المجال من البحث نسبيا. هنا ، نقدم طريقة لمواجهة هذا التحدي. نحن نستخدم التصوير المقطعي التسلسلي ثنائي الفوتون وتحليل الصور المحسن الذكاء الاصطناعي لتحديد موقع خلايا السالمونيلا الفردية في جميع أنحاء الطحال وفصوص الكبد والغدد الليمفاوية الكاملة للفئران المصابة. باستخدام مراسلي الفلورسنت وإدارة الأجسام المضادة في الجسم الحي ، يمكن تحديد معدل تكرار خلايا السالمونيلا المفردة ، وتفاعلها المحلي مع خلايا مناعية معينة ، والاستجابات البكتيرية للمضادات الحيوية. تفتح هذه المنهجيات سبلا لإجراء فحص شامل للعدوى والوقاية منها وعلاجها في سياق الأنسجة ثلاثية الأبعاد.
Introduction
تحدث العدوى في الأنسجة ذات التشريح المعقد وعلم وظائف الأعضاء المجزأة. يمكن للبيئات الدقيقة المتنوعة التي تتعايش في الأنسجة المصابة تحديد مصير المجموعات الفرعية الممرضة المحلية ومساهماتها في النتيجة الإجماليةللمرض 1،2،3. ومع ذلك ، لا يزال رسم الخرائط ثلاثية الأبعاد الشامل لمسببات الأمراض الميكروبية في الأنسجة بحجم سم يمثل تحديا4. يعد تصوير الدماغ والأعضاء الأخرى مجالا بحثيا نشطا للغاية مع تحسين الاستراتيجيات التجريبية باستمرار5 ، ولكن لا تزال العديد من الطرق تفتقر إلى الدقة دون ميكرومتر التي ستكون مطلوبة لتحديد مسببات الأمراض البكتيرية بحجم ميكرومتر بثقة. في المقابل ، يتيح التصوير المقطعي التسلسلي ثنائي الفوتون( STP) 6 التصوير الآلي متعدد الألوان والخالي من التشوه للأنسجة بأكملها بدقة دون ميكرومتر داخل المستوى ، مما ينتج عنه مجموعات بيانات حجمية كاملة. تجمع هذه الطريقة بين التقسيم المادي المتكرر للأنسجة باستخدام اهتزاز مع تصوير متقطع ثنائي الفوتون لوجوه الكتلة الناشئة مع ضوء الأشعة تحت الحمراء. تم استخدام التصوير المقطعي STP على نطاق واسع لرسم خرائط محاور رقيقة في الدماغ لإنشاء خرائط اتصال7،8،9،10.
يتيح التصوير المقطعي STP أيضا رسم خرائط ثلاثية الأبعاد للخلايا الممرضة الميكروبية الفردية (السالمونيلا ، التوكسوبلازما) في الأنسجة المصابة بأكملها11,12 باستخدام التصوير المقطعي. يكشف الجيل الثاني من التوافقي عن أغماد الكولاجين حول الشرايين وفي العصابات الليفية مثل ترابيق الطحال ، مما يوفر سياقا تشريحيا. يمكن استخدام الأجسام المضادة الفلورية المحقونة في الجسم الحي لتلطيخ الخلايا المضيفة للكشف عن التفاعلات بين الخلايا المسببة للأمراض الفردية والخلايا المناعية المتسللة مثل العدلات. هنا ، يتم وصف خط الأنابيب الذي يتضمن معالجة الأنسجة ، والتصوير ، وخياطة بلاط التصوير مع تصحيح الإضاءة ، وتكديس الصور في ثلاثة أبعاد ، والتجزئة باستخدام أدوات التعلم الآلي. ينتج خط الأنابيب هذا مواقع 3D لخلايا مسببات الأمراض الفردية والمستعمرات الدقيقة داخل سياقها المضيف. لا يزال حساب عدد الخلايا الفردية داخل المستعمرات الدقيقة أمرا صعبا بسبب حدود الدقة ، ولكن يمكن تقدير هذه الأرقام بناء على السطوع المتكامل للمستعمرة الدقيقة. يمكن تكييف خط الأنابيب بسهولة مع نماذج العدوى الأخرى إذا توفرت مسببات الأمراض المعبرة عن GFP أو YFP المؤتلفة.
Protocol
تمت الموافقة على جميع التجارب على الموصوفة هنا من قبل السلطات (الترخيص 2239 ، Kantonales Veterinäramt Basel) وتتبع الإرشادات المحلية (Tierschutz-Verordnung ، بازل) وقانون حماية السويسري (Tierschutz-Gesetz).
1. تحضير وتخزين الأنسجة المصابة
- استخدم نموذج العدوى المفضل. هنا ، تصاب الفئران البالغة من العمر 10 إلى 16 أسبوعا من كلا الجنسين ب ~ 1000 وحدة تشكيل مستعمرة (CFU) عن طريق الحقن في الوريد أو 5 × 107 CFU عن طريق الإدارة داخل المعدة بإبرة مستديرة الرأس. تشمل سلالات الماوس المناسبة BALB / c و C57BL / 6.
ملاحظة: يمكن تكييف نفس النهج بسهولة مع الأنواع المضيفة الأخرى. - تأكد من أن مسببات الأمراض تعبر عن البروتينات الفلورية لتمكين التعرف عليها في الأنسجة غير الملوثة. يمكن تصور مسببات الأمراض التي تعبر عن GFP.mut213 أو YPet14 أو TIMERbac15 أو mWasabi16 باستخدام إثارة 940 نانومتر17. يمكن تصوير السالمونيلا التي تعبر عن mCherry18 بمستويات يمكن اكتشافها بسهولة عن طريق قياس التدفق الخلوي19 باستخدام إثارة 800 نانومتر ولكن لها نسب إشارة إلى خلفية ضعيفة في الطحال والكبد المصابين والتي تظهر تألقا ذاتيا كبيرا.
- تأكد من احتفاظ جميع البروتينات الفلورية بنسبة >70٪ من شدة مضانها بعد التثبيت مع بارافورمالدهيد عند درجة حموضة محايدة بناء على القياس الكمي مع قياس التدفق الخلوي. هنا ، يتم استخدام أنسجة الفئران المصابة ، وهي الطحال والكبد والغدد الليمفاوية وبقع باير.
- قم بتلطيخ علامات سطح الخلية المضيفة في الجسم الحي عن طريق حقن الأجسام المضادة التي تحمل علامة phycoerythrin (PE) قبل 10 دقائق من التروية. لتلطيخ العدلات ، حقن الوريد 4 ميكروغرام anti-Ly-6G-PE في 100 ميكرولتر من PBS. لتلطيخ بلاعم المنطقة الهامشية في الطحال ، قم بحقن 4 ميكروغرام مضاد CD169-PE في 100 ميكرولتر من PBS (انظر جدول المواد).
- إصلاح الأنسجة المصابة من خلال التروية عبر القلبالقياسية 20 مع 15 مل من محلول الفوسفات المثلج البارد 50 مللي متر (PB ؛ 10 mM NaH2PO4 ، 40 mMNa2HPO4 ، pH 7.4) ، متبوعا ب 35 مل من 4٪ بارافورمالدهيد (PFA ؛ مثبت) في PB (الشكل 1 أ).
- باختصار ، يجب تطبيق التخدير العميق للحيوان المصاب عن طريق الحقن داخل الصفاق بمقدار 100 ملغم / كغم من الكيتامين و 16 ملغم / كغم من الزيلازين. تأكد من التخدير المناسب عن طريق تأكيد فقدان منعكس قرصة إصبع القدم.
- تطهير الفراء باستخدام الإيثانول 70 ٪ ، وتجفيفه بمنشفة ورقية معقمة ، وفتح الصدر جراحيا مع ملاقط ومقص. ضع إبرة معقمة في البطين الأيسر للقلب ، وافتح الأذين الأيمن بمقص معقم ، وقم بتشغيل المخزن المؤقت الأول ثم تثبيته من خلال الإبرة والبطين الأيسر ونظام الأوعية الدموية بأكمله باستخدام مضخة. هذا يصلح جميع الأنسجة بسرعة وبشكل موحد ويسبب القتل الرحيم.
- اجمع الأنسجة بعد التروية ، واحتضنها في حجم 20x من بارافورمالدهيد البارد 4٪ في محلول PB وضعها على شاكر عند 4 درجات مئوية طوال الليل (الشكل 1 ب). التصوير ممكن للأنسجة في نطاق الحجم من 0.05 إلى 2 سم3. للأنسجة الكبيرة ، مقطعة إلى قطع مناسبة.
- في اليوم التالي ، اغسل المنديل 3x لمدة 10 دقائق لكل منهما باستخدام مخزن PB المؤقت مع الاهتزاز عند 40 دورة في الدقيقة في درجة حرارة الغرفة لإزالة PFA.
ملاحظة: بسبب سمية PFA ، يجب تنفيذ هذه الخطوات داخل غطاء الدخان. تخلص من نفايات PFA وفقا للإرشادات المؤسسية. - قم بإزالة أي مخزن مؤقت PB زائد وأضف حجما 20x من المخزن المؤقت للتخزين الواقي من التبريد21 (876 مللي متر سكروز ، 0.25 مللي متر بولي فينيل بيروليدون ، 40٪ (v / v) جلايكول الإيثيلين ، مذاب في 50 مللي مول PB buffer) إلى العينة مع الاهتزاز عند 40 دورة في الدقيقة عند 4 درجات مئوية لمدة 6-8 ساعات أو حتى تغرق الأنسجة في القاع. احتضان العينات عند -20 درجة مئوية لمدة 3 أيام على الأقل لضمان الحد الفعال من التألق الذاتي للأنسجة11. يمكن استخدام العينات لمدة تصل إلى 5 سنوات عند تخزينها في -20 درجة مئوية.
ملاحظة: يشير غرق الأنسجة إلى الاختراق المناسب لمخزن التخزين المؤقت في الأنسجة.
2. عينة التضمين
- قم بتضمين الأنسجة في كتلة أغاروز لقطع سلس باستخدام اهتزاز. قم بتنشيط الأغاروز كيميائيا مسبقا عن طريق الأكسدة مع الدورة الشهرية ثم قم بتقليله باستخدام بوروهيدريد لتشكيل رابط متقاطع مع الأنسجة لتحسين الاستقرار أثناء عملية القطع. قم بتنفيذ الخطوات الموضحة أدناه.
- تحضير 4٪ أغاروز مؤكسد بوزن 2.25 جرام أغاروز وإضافة 0.21 جم NaIO4. أضف 100 مل من PB إلى الأغاروز و NaIO4. يقلب في درجة حرارة الغرفة في غطاء دخان لمدة 2-3 ساعات مع الحماية من الضوء.
ملاحظة: الخطوة الحرجة: لا تتجاوز التقليب لأكثر من 3 ساعات وإلا فإن الأغاروز سوف يتبلمر بشكل سيئ. - استعادة الأغاروز عن طريق الترشيح الغشائي في مرشح فراغ قياسي مع غشاء 0.2 ميكرومتر. قم بإزالة NaIO4 المتبقي عن طريق غسل 3x ب 50 مل من المخزن المؤقت PB. أعد تعليق الأغاروز المؤكسد في 50 مل من المخزن المؤقت PB.
ملاحظة: لا تذوب الأغاروز خلال هذه المرحلة. يمكن تخزين الأغاروز عند 4 درجات مئوية لمدة تصل إلى 2-3 أسابيع محمية من الضوء. - تحضير محلول بوروهيدريد بإضافة 19 غرام من البوراكس و 3 غرام من حمض البوريك إلى 1 لتر من الماء. يقلب حتى يذوب ويضبط الرقم الهيدروجيني إلى 9-9.5 مع 1 M NaOH. على طبق التحريك في غطاء الدخان ، سخني 100 مل من محلول البورات إلى 40 درجة مئوية. أضف 0.2 جم هيدروكسيهيدروكسي هيدروكسي الصوديوم 4 وحرك لمدة 15-30 دقيقة مع الحماية من الضوء.
ملاحظة: يمكن تخزين محلول بوروهيدريد لعدة أسابيع في درجة حرارة الغرفة في الظلام. الخطوة الحاسمة: عند إضافة NaBH4 إلى المخزن المؤقت للبورات ، سيتم تشكيل الغاز ، وبالتالي قم بإجراء هذه الخطوة داخل غطاء الدخان. لا تقم بهذه الخطوة في حاوية مغلقة بإحكام لأنها قد تؤدي إلى انفجار. - خذ منديلا من الفريزر بعد الحضانة الكافية لتقليل التألق الذاتي (≥ 3 أيام) ، وقم بإزالة المخزن المؤقت الزائد للتخزين الواقي من التبريد ، واغسل المنديل 3 مرات لمدة 10 دقائق لكل منهما باستخدام مخزن PB المؤقت مع الاهتزاز عند 40 دورة في الدقيقة في درجة حرارة الغرفة (RT).
- قم بإذابة ما يقرب من 20 مل من معلق الأغاروز المؤكسد (المحضر في الخطوة 1) في الميكروويف (700 واط ل ~ 30 ثانية) ، واتركه يبرد بدرجة كافية للتعامل معه (~ 45 درجة مئوية) ، واسكبه في قالب بلاستيكي.
ملاحظة: خطوة حرجة: لا تقم بإضافة الأغاروز مباشرة بعد تسخينه في الميكروويف على العينة ، فقد يؤدي ذلك إلى تدمير الأنسجة. - استخدم ملقط لالتقاط المنديل برفق وإدخاله بسرعة في الجزء السفلي من وسط الأغاروز. احتضن القالب في RT لمدة 15 دقيقة للسماح للأغاروز بالبلمرة.
- بعد بلمرة الأغاروز ، افتح القالب البلاستيكي بمشرط من أركانه الأربعة والتقط مكعب الأغاروز بعناية بأصابع قفاز.
- اغمر العينة في محلول بوروهيدريد (محضر في الخطوة 2) لمدة 2-3 ساعات عند 4 درجات مئوية لبدء الربط المتقاطع للأغاروز المؤكسد والأنسجة. هذا يمنع الأنسجة من الانفصال أثناء التقسيم.
ملاحظة: خطوة حرجة: يجب تحضين العينة المغمورة في بوروهيدريد محمية من الضوء عند 4 درجات مئوية. - اغسل مكعب الأغاروز بمحلول PB 2x لمدة 10 دقائق. اقلب مكعب الأغاروز بحيث يكون النسيج في الجانب العلوي وقم بتوصيل الكتلة بشريحة مغناطيسية (شريحة مجهرية مع مغناطيسين متصلين بالظهر) باستخدام بضع قطرات من المادة اللاصقة الفورية. يستغرق الغراء من 10 إلى 20 دقيقة حتى يتجمد ، لذا ضع منديلا ورقيا به قطرات من المخزن المؤقت PB فوق الأغاروز لضمان بقاء العينة رطبة بشكل كاف طوال الوقت (الشكل 1C).
3. إعداد microtome وتهيئة المسرح
- ضع الشريحة المغناطيسية على المعدن في وسط صندوق عينة التصوير المقطعي.
- املأ الصندوق بمخزن PB المؤقت وضعه بعناية على المسرح وشد المسمار الموجود على اليسار لتأمين صندوق العينة على مرحلة التصوير المقطعي.
ملاحظة: لا تفرط في إحكام ربط البراغي ، وإلا فسوف تتلف الصندوق البلاستيكي. - ضع الشفرة على الميكروتوم وقم بتحويل موضع العينة بعناية بالقرب من الميكروتوم وتحته. يجب أن يكون السطح العلوي للأغاروز في نفس مستوى شفرة الميكروتوم.
ملاحظة: سيؤدي وضعه منخفضا جدا إلى إضاعة وقت القطع ، بينما سيؤدي وضعه في مكان مرتفع جدا إلى إزالة جزء كبير من الكتلة عند القطع الأول. - حرك المرحلة لوضع مكعب الأغاروز في مركز الهدف وانقر مرارا وتكرارا على زر الشريحة في برنامج التصوير المقطعي حتى تحصل على شريحة سليمة من مكعب الأغاروز بأكمله.
4. تخصيص السطح والحصول على صور 2D
- توسيط العدسة الشيئية على عينة الأنسجة في الاتجاهين x و y.
- افتح برنامج الليزر وقم بتشغيل الليزر في البرنامج. عند سماع صوت موقوتة ، قم بتشغيل مفتاح الليزر ، واضبط الطول الموجي على 800 نانومتر.
ملاحظة: يجب تسخين مصدر الليزر لمدة 30 دقيقة على الأقل ، من الناحية المثالية 1 ساعة ، قبل التصوير. - أغلق أبواب خزانة المجهر ، وأطفئ جميع مصادر الإضاءة في الغرفة ، وقم بتشغيل PMTs واضبط الجهد على 750 فولت.
ملاحظة: خطوة حرجة: PMTs حساسة للغاية للضوء ، اتركها مغلقة ما لم تكن أبواب الخزانة مغلقة ويتم إيقاف تشغيل جميع مصادر الإضاءة في الغرفة. - اضبط إعدادات البروتوكول لبرنامج التصوير المقطعي كما هو موضح واضبط مصراع المجهر على تلقائي والجهد على 20 و 3 ل V1 و V2 ، على التوالي.
- انقر على زر 2D في برنامج التصوير المقطعي لالتقاط لقطة من العينة.
- بمجرد ظهور صورة ذات تألق ذاتي مرئي ، اضبط z-piezo لضبط المستوى البؤري على سطح مكعب الأغاروز. سيكون المسح الأول 20 ميكرومتر تحت السطح للحصول على صورة ثابتة للعينة.
- إذا لم تكن خلفية التألق الذاتي مرئية ، فقم بزيادة التباين حتى تظهر إشارة. يمكن أن يحدث عدم وجود إشارة مرئية (أي بسبب الأغاروز أعلى الأنسجة). في هذه الحالة ، اضبط المحور z باستخدام جهاز z-piezo حتى يصل إلى سطح الأغاروز. قد تكون هناك حاجة إلى الحركة اليدوية للعدسة إذا كان الموضع المطلوب خارج نطاق جهاز z-piezo.
- قم بقص عدة شرائح 50 ميكرومتر بعد العثور على سطح العينة واحصل على صور 2D بعد كل قطع للتأكد من ضبط المستوى البؤري بشكل صحيح على سطح وجه الكتلة.
5. العثور على حواف العينات وضبط الليزر على نقطة البداية
- استنادا إلى إحداثيات xy لمنطقة المسح بالليزر (4 إحداثيات زاوية) ، احصر منطقة التصوير في الأنسجة مع الحد الأدنى من التصوير لكتلة الأغاروز المحيطة.
- قم بإيقاف تشغيل PMTs ، واضبط الطول الموجي لليزر على 800 نانومتر ، وقم بتبديل مصراع الليزر لفتحه. يظهر موضع ضوء الليزر الذي يدخل كتلة الأغاروز كبقعة حمراء من الضوء المتناثر (الشكل 2 أ ، ب).
خطوة حاسمة: كن حذرا بشكل خاص مع ليزر الفئة 4. يمكن أن تتلف الأنسجة البشرية والعينين بسرعة. يحتاج الموظفون إلى تدريب خاص لتشغيل مثل هذه الأداة بأمان. - استخدم بقعة الليزر أثناء تحريك المرحلة للعثور على إحداثيات حواف الأنسجة باستخدام التسلسل للخلف واليمين والأمام واليسار.
- تحقق مرة أخرى من الإحداثيات وضع بقعة الليزر في الزاوية الأمامية اليمنى ، وهي نقطة البداية الافتراضية لتصوير الأنسجة.
- قم بتحويل الإحداثيات من نافذة وحدة التحكم إلى أحجام كتل يمكن التعرف عليها آليا، والتي يتم تحديدها بواسطة الخطوات xy. أدخل قياسات الخطوة هذه في بروتوكول البرنامج. أغلق أبواب الخزانة.
6. 3D المسح / التقسيم
- قم بتغيير الطول الموجي إلى 940 نانومتر لإثارة GFP أو mWasabi أو YPet و PE.
ملاحظة: الليزر غير مرئي للعين البشرية عند هذا الطول الموجي. لتحسين الإشارة إلى الخلفية ل GFP و mWasabi ومكون الانبعاث الأخضر ل TIMERbac ، ضع مرشح تمرير نطاق ضيق 510/20 نانومتر أمام PMT 2. هذا يقلل من التداخل عن طريق التألق الذاتي للأنسجة الخضراء والصفراء. - قم بتبديل مصراع المجهر إلى الوضع التلقائي ، وإعدادات جهد الغالق إلى 20 ل V1 و 1.71 ل V2.
- اضبط المعلمات الثلاثة التالية في البرنامج: سمك القسم- لمعظم الأغراض ، اضبط على 50 ميكرومتر. بالنسبة للكبد، اضبط على 30 ميكرومتر بسبب عمق التصوير المحدود. عدد الأقسام المادية - يحدد هذا إجمالي عمق الأنسجة الذي سيتم تصويره ، ويتم تعيينه وفقا لذلك. عدد الطائرات التي يجب التقاطها لكل قسم -سيحدد هذا دقة z. استخدم 5 طائرات (تنتج دقة رأسية 10 ميكرومتر) لمعظم الأغراض. للكبد استخدام 3 طائرات أو أقل.
- اضبط كسب الليزر. هذا يحتاج إلى اختبار تجريبي للأنسجة المختلفة وعمق المسح.
- حدد مسار المجلد واسمه لتخزين الصور التي تم الحصول عليها وقدم المعلومات المناسبة لملف تعريف التصوير.
- تحقق مرة أخرى من جميع القيم المدخلة.
- انقر فوق إعداد الفسيفساء 3D لبدء عملية المسح (الشكل 1D).
- بعد اكتمال التصوير ، اجمع بعناية أقسام الأنسجة من خزان المياه وقم بتخزينها في مخزن مؤقت عند -20 درجة مئوية حتى الاستخدام مرة أخرى (الشكل 1E ؛ الشكل 2 ج ، د).
7. معالجة الصور وتحليل البيانات
- قم بتنزيل البرامج النصية MATLAB على كمبيوتر Linux من https://github.com/BumannLab/Li_BumannLab_2020. انسخ البرامج النصية إلى مجلد ، على سبيل المثال ، / home / user / Program /.
ملاحظة: يجب تثبيت الوظيفة الإضافية Computer Vision Toolbox ل MATLAB وفيجي (أو ImageJ) على أجهزة كمبيوتر Linux حتى يعمل البرنامج النصي بكامل طاقته. - صور تجانب غرزة كما هو موضح أدناه.
- نقل البيانات من خادم التصوير المقطعي إلى كمبيوتر Linux.
- افتح البرنامج النصي MATLAB StepOneStitchAndArchive.m وحدد موقع المجلد المصدر الذي يحتوي على البيانات الأولية. حدد مجلدات المصدر والوجهة في البرنامج النصي.
- قم بالتبديل إلى علامة التبويب محرر وانقر فوق تشغيل. يتم عرض معلومات التقدم في نافذة الأوامر. تتضمن المعالجة قراءة المعلومات من ملف Mosaic ، وإنشاء فهرس البلاط قبل خياطة الصورة ، وتصحيح إضاءة الخلفية باستخدام Cidre22 (الشكل 3) بالإضافة إلى تصحيح الإضاءة بين الطبقات البصرية المكتسبة بعمق مختلف. ابحث عن الصور المخيطة في مجلد فرعي يسمى stitchedImages_100 في المجلد المصدر. ضغط البيانات الأولية للتخزين طويل الأجل باستخدام الأمر tar واحفظه كملف واحد بامتداد اسم الملف tar.bz2 (الشكل 1F).
- أداء تدريب النموذج والتجزئة باستخدام آلة ناقلات الدعم. لتدريب آلة ناقل الدعم وإجراء التجزئة ، اتبع الخطوات أدناه.
ملاحظة: يتم تخزين الصور المخيطة لكل قناة من قنوات التألق الثلاث في 3 مجلدات فرعية (تسمى 1 و 2 و 3 ، المقابلة للتألق الأحمر والبرتقالي والأخضر) من stitchedImages_100. يحتوي كل مجلد فرعي على جميع الصور المخيطة من نفس القناة.- معاينة الصور المخيطة. افتح صورة واحدة بنفس اسم الملف من كل مجلد فرعي باستخدام Fiji (أو ImageJ). دمج القنوات الثلاث في صورة ملونة واحدة. اضبط سطوع كل قناة حتى تظهر إشارات واضحة من البكتيريا والتألق الذاتي للأنسجة. لاحظ الحد الأقصى لمستوى الكثافة المعدل لكل قناة للخطوة التالية.
- افتح البرنامج النصي MATLAB StepTwoSegmentationAndAnalysis.m واستعرض للوصول إلى المصدر. حدد المجلد المصدر وأسماء الصور للتدريب. على سبيل المثال
المصدرD = '/' ;
red_name = [sourceD '1/section_020_01.tif']; green_name = [sourceD '2/section_020_01.tif'] ؛
blue_name = [sourceD '3/section_020_01.tif']; - انتقل إلى علامة التبويب محرر وانقر فوق تشغيل.
- سيظهر مربع حوار يطلب عتبات اللون ، املأه بناء على الفحص اليدوي السابق مع فيجي (الخطوة 7.3.1).
- حدد مناطق الخلفية ومناطق الاهتمام (أي البكتيريا) وفقا لمربعات الحوار. ستظهر الرسوم البيانية التي توضح مدى جودة تدريب النموذج وتسأل عما إذا كانت هناك حاجة إلى إضافة المزيد من المناطق. أضف المزيد من مناطق الاهتمام والخلفية حتى يمكن تقسيم البكتيريا بوضوح (الشكل 4 أ ، ب).
- قم بتسمية النموذج وحفظه. سيقوم البرنامج النصي تلقائيا بتحميل الصور وتطبيق مرشح متوسط (نصف قطر 2 بكسل).
- يتم تشغيل عملية التجزئة تلقائيا ، وتظهر معلومات التقدم في نافذة الأوامر. شاهد تقدم التجزئة. إذا كان التقسيم لا يعمل بشكل جيد مع النموذج على الصور الأخرى المخيطة، كرر تدريب النموذج لتضمين المزيد من المناطق الخلفية والبكتيرية.
- للاطلاع على نتائج التجزئة، تحقق من الملف المسمى Allpositions_filter3D.txt. يحتوي هذا الملف على إحداثيات مركز الثقل لكل بكتيريا أو مستعمرة بكتيرية دقيقة وشدة التألق المتكاملة المقابلة (الشكل 1G).
- قم بإزالة القطع الأثرية الإضافية ذات الشبكة العصبية التلافيفية كما هو موضح أدناه.
ملاحظة: بالنسبة لبعض البكتيريا، لا يزال التقسيم البسيط باستخدام جهاز Support Vector يتضمن بعض عناصر التصوير. هذا ينطبق بشكل خاص على البكتيريا المعبرة عن YPet. يمكن للتجزئة القائمة على الشبكة العصبية إزالة هذه القطع الأثرية بكفاءة (الشكل 4C). يجب تثبيت الوظيفة الإضافية Computer Vision Toolbox ل MATLAB و Fiji (أو ImageJ) على أجهزة الكمبيوتر التي تعمل بنظام Windows حتى يعمل البرنامج النصي بكامل طاقته. للحصول على معلومات حول الشبكة العصبية الأساسية ، انظر: https://ch.mathworks.com/help/deeplearning/ug/create-simple-deep-learning-network-for-classification.html- تحضير الصور. قم بتحويل ملفات tif إلى ملفات jpg بتعديلات سطوع مختلفة باستخدام Fiji. حدد مع التنظيم اليدوي ما لا يقل عن 600 بكتيريا و 600 قطعة أثرية وصور اقتصاص آمنة لهذه الكائنات في المجلدات المناسبة.
- افتح البرنامج النصي MATLAB CNNtestV4.m واستعرض للوصول إلى الملفات المصدر التي تحتوي على صور الكائنات في الخطوة 7.4.1.
- حدد مجلد الصور للتدريب. على سبيل المثال
digitDatasetPath = ملف كامل ('D:\20200602_CNN','fortrainingPixel12Folder2');
حدد عدد الصور للتدريب ، على سبيل المثال ، numTrainFiles = 600. - انتقل إلى علامة التبويب محرر وانقر فوق تشغيل. بعد التدريب ، يتم حفظ ملف نموذج CNN ك gregnet1.mat في المجلد المصدر.
- تعريف مجلد يحتوي على صور اختبار. على سبيل المثال
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
يتم حفظ النتائج في ملف YourFile.txt يحتوي على معلومات حول اسم الصورة والتصنيف على أنها بكتيريا أو قطعة أثرية. - تحديد مجلد مع صور الاختبار. على سبيل المثال
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
سيتم حفظ النتائج في ملف YourFile.txt يحتوي على معلومات حول اسم الصورة والتصنيف على أنها بكتيريا أو قطعة أثرية.
- تقدير حجم المستعمرات الدقيقة بناء على شدة مضان البكتيريا المفردة كما هو موضح أدناه.
ملاحظة: الدقة المكانية للتصوير المقطعي غير كافية لحل الخلايا البكتيرية الفردية داخل المستعمرات الدقيقة المعبأة بكثافة. ومع ذلك ، يمكن تقدير عدد البكتيريا في كل مستعمرة صغيرة بناء على التألق الكلي للمستعمرة الدقيقة فيما يتعلق بمضان البكتيريا المفردة. تعتمد دقة التقدير هذه على تجانس شدة التألق عبر مجموعة البكتيريا.- تأكيد هوية الأحداث الإيجابية ل GFP في التصوير المقطعي STP عن طريق تلطيخ المكونات البكتيرية مثل عديد السكاريد الشحمي باستخدام الكيمياء الهيستولوجية المناعية للأقسام المسترجعة من التصوير المقطعي (الشكل 1H ؛ الشكل 5).
- حدد ما لا يقل عن 30 بكتيريا مفردة واسترجع شدة مضانها من نتائج التجزئة المقابلة. استخدم قيمة الشدة المتوسطة كمرجع لبكتيريا واحدة. احسب العدد البكتيري لكل مستعمرة دقيقة بقسمة إجمالي شدة التألق للمستعمرة الدقيقة على القيمة المرجعية لبكتيريا واحدة (الشكل 1I).
- إجراء إعادة بناء 3D مع برنامج التصور كما هو موضح أدناه.
- تحضير الصورة
- التقط صور القناة الزرقاء ، والتي تحتوي على إشارات توافقية ثانية للكولاجين توفر مرجعا تشريحيا مفيدا بما في ذلك كبسولات الأنسجة والشرايين والترابيق. استخدم الصور المجزأة للبكتيرياكقناة 2 .
- قم بتجميع الصورمن القناة الأولى 10 أضعاف في كل من المحورين x و y واحفظ الصور التي تم تصغيرها في مجلد جديد. قم بعمل 3 نسخ متماثلة من الصور المصغرة داخل نفس المجلد. يجب أن يحتفظ اسم النسخ المتماثلة الجديدة بنفس التسلسل. على سبيل المثال: section_001_01.tif ، قم بنسخ 1 مع الاسم section_001_01-copy.tif ، section_001_01-copy-copy.tif. قم بتطبيق هذه الخطوات أيضا على الصورمن قناة 2 . ينتج عن تقليص الحجم أحجام ملفات أكثر قابلية للإدارة. ستعمل الصور الثلاثية على تنعيم المحور z.
- دمج الصور من كل قناة لتشكيل مكدسات الصور مع فيجي. انقر فوق > الصور مكدسات > أدوات > فارز المكدس > فرز حسب التسميات.
- أداء تصفية 3D. انقر فوق معالجة > عوامل التصفية > عامل التصفية 3D وقم بتعيين حجم مرشح Z على 6. احفظ مكدسات الصور.
- أداء التصور 3D كما هو موضح أدناه.
- افتح حزمة برامج المرئيات في طريقة عرض Arena (الإعداد الافتراضي). استخدم أيقونة مجلد المشاهدة لإضافة مجلدات إلى عرض الساحة. انقر نقرا مزدوجا لفتح الملف * .ims أو * .tif (تم إعداده في 7.6.1).
- باستخدام تحرير>خصائص الصورة، اضبط تمثيلات الألوان (LUTs) للقنوات المختلفة في نافذة ضبط العرض.
- انقر فوق خيارات متقدمة لتعيين قيم الحد الأدنى / الأقصى يدويا وقيمة لتصحيح جاما.
انقر فوق أسماء القنوات لتغيير الأسماء وجداول البحث. - بعد ضبط مظهر الصورة، قم بتصدير العرض الحالي باستخدام أداة اللقطة.
- استخدم رمز الرسوم المتحركة لتمثيل بيانات 3D كفيلم. استخدم مؤشر التنقل للعثور على منظور/عرض وتكبير/تصغير واستخدام + إضافة لإضافة إطارات مفتاحية. الانتقال إلى موضع آخر وإضافة الإطار المفتاحي التالي. اضغط على زر التسجيل الأحمر لإنشاء الفيلم. احفظه في مجلد الوجهة المطلوب ونوع الملف (الشكل 1J).
- تحضير الصورة
النتائج
يتيح الإجراء الموصوف اكتشاف خلايا السالمونيلا الفردية في أعضاء الفأر بأكملها مثل الطحال والكبد والغدد الليمفاوية المساريقية وبقع باير11 (الشكل 5 والشكل 6). كما أنه يكتشف طفيليات التوكسوبلازما جوندي في دماغ الفأر12. بعض الأنسجة المصابة بما في ذلك الكبد وبقع باير والطحال تنبعث منها تألق ذاتي كبير في النطاق الأخضر والأصفر. يتم تعزيز التألق الذاتي بشكل أكبر من خلال التثبيت مع بارافورمالدهايد ، وهو أمر ضروري للحفاظ على بنية الأنسجة. تم تحسين الكشف عن التألق الأخضر من GFP و mWasabi والمكون الأخضر ل TIMERbac مقابل خلفية التألق الذاتي هذه عن طريق وضع مرشح تمرير النطاق الضيق 510/20 نانومتر (ينقل معظم انبعاثات GFP ولكنه يحجب جزءا كبيرا من طيف التألق الذاتي) أمام المضاعف الضوئي 2 (الذي يجمع الانبعاثات الخضراء) وعن طريق تقليل التألق الذاتي للأنسجة عن طريق تخزين الأنسجة الثابتة لمدة 3 أيام أو أكثر في مادة واقية من التبريد11. ومع ذلك ، يجب أن تعبر البكتيريا عن بضعة آلاف من النسخ على الأقل لكل خلية من GFP أو بروتينات الفلورسنت الأخرى. من ناحية أخرى ، يجب تجنب مستويات البروتين الفلوري المفرطة لتقليل تكاليف اللياقة البدنية التي يمكن أن تؤدي إلى فوعة مخففة23.
يمكن تأكيد التجزئة الصحيحة للبكتيريا الفلورية في الأنسجة عن طريق الكيمياء المناعية لأقسام الأنسجة المستردة بعد التصوير. على وجه التحديد ، يمكن محاذاة الأجسام الملطخة بجسم مضاد لمكونات السطح البكتيرية مثل عديد السكاريد الدهني مع الصورة الفلورية التي تم الحصول عليها بواسطة التصوير المقطعي STP (الشكل 5). من المهم ملاحظة أن بعض خلايا السالمونيلا الملطخة تفتقر إلى البروتينات الفلورية وبالتالي يمكن اكتشافها في كل من الفحص المجهري متحد البؤر والتصوير المقطعي STP. هذه الخلايا هي السالمونيلا التي تم قتلها من قبل الجهاز المناعي المضيف كما يتضح من الفرز الخلوي للتدفق ومزارع النمو من الخلايا المصنفة المفردة بالإضافة إلى الارتباط الوثيق بين عدد وحدات تكوين المستعمرات على ألواح أجار وعدد خلايا السالمونيلا الفلورية كما هو محدد بواسطة قياس التدفقالخلوي 24. بالإضافة إلى ذلك ، يمكن أن يؤدي فقدان البلازميد إلى خلايا قابلة للحياة غير فلورية وهذا يحتاج إلى اختبار عن طريق الطلاء على الوسائط مع وبدون المضادات الحيوية المناسبة المقابلة لعلامة الاختيار على البلازميد. بالنسبة للبلازميدات المشتقة من pSC101 ، فإن فقدان البلازميد في الجسم الحي نادر19. بالنسبة لمعظم أشرطة التعبير المتكاملة كروموسوميا مثل sifB::gfp المستخدمة في11 ، لا يمكن اكتشاف فقدان التعبير في الجسم الحي. إذا كان التقسيم غير متوافق مع بيانات الكيمياء الهيستولوجية المناعية ، فيجب تعديل خط أنابيب التجزئة.
دقة التصوير المقطعي STP غير كافية لحل الخلايا البكتيرية الفردية داخل المستعمرات الدقيقة المعبأة بكثافة. ومع ذلك ، فإن شدة التألق الكلية للمستعمرة الدقيقة تمكن من تقدير عدد خلايا السالمونيلا . وهذا يتطلب سلالة فلورية ذات مستويات مضان متجانسة للغاية مثل السالمونيلا sifB::gfp11. يؤدي الجمع بين العدد التقديري لخلايا السالمونيلا لجميع المستعمرات الدقيقة والخلايا المفردة إلى إنتاج أحمال الأنسجة البكتيرية الكلية التي تتوافق مع الطرق البديلة مثل الطلاء أو قياس التدفق الخلوي لمتجانسات الأنسجة11. لا يمكن إجراء الطلاء وقياس التدفق الخلوي مباشرة من نفس الأنسجة لأنها تحتاج إلى التروية الثابتة للتصوير المقطعي STP. بدلا من ذلك ، يجب أن يتم ذلك مع إضافية غير ثابتة. إذا اختلفت الأحمال البكتيرية المتوسطة كما تحددها الأساليب المختلفة بأكثر من 3 أضعاف ، فقد تتعرض صلاحية البكتيريا الفلورية للخطر (في حالة الوحدات المكونة للمستعمرات السفلية) أو قد تفقد بعض البكتيريا بنية مراسل الفلورسنت (في حالة وحدات تشكيل مستعمرة أعلى). ستكون هناك حاجة إلى تجربة التحكم لتحديد مصدر هذه التناقضات.
يوفر التصوير المقطعي STP توطين الخلايا البكتيرية داخل بنية 3D للأنسجة المصابة. توفر الإشارات التوافقية الثانية للكولاجين معالم تشريحية مثل الشرايين والترابيق. بالإضافة إلى ذلك ، يمكن تلطيخ الخلايا المضيفة في الجسم الحي عن طريق حقن جسم مضاد لعلامات السطح قبل التروية (الشكل 5 والشكل 6). يوفر هذا التلوين معالم إضافية لحجرات الأنسجة والبيئات الدقيقة المحددة بما في ذلك بؤر الالتهاب (لا يمكن الوصول بسهولة إلى العلامات داخل الخلايا وبعض المقصورات ذات الحواجز المنتشرة مثل اللب الأبيض الطحال أو الدماغ مناسبة لهذا التلوين في الجسم الحي ). كشف هذا النهج عن اللب الأبيض الطحال كحجرة أنسجة تمكن من بقاء السالمونيلا على المدى الطويل أثناء العلاج الكيميائي المضادللميكروبات 11.
أخيرا ، يمكن تحديد تكاثر السالمونيلا بمعدلات معتدلة أو بطيئة وتوطينها داخل بنية 3D للأنسجة باستخدام السلالات التي تعبر عن مؤقتالبكالوريا ، وهو مراسل خلية واحدة لمعدل النسخ المتماثل11،15.
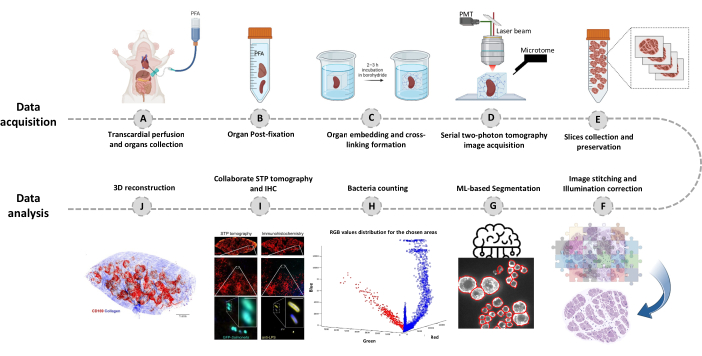
الشكل 1: إجراء تصوير الأعضاء بالكامل باستخدام التصوير المقطعي التسلسلي ثنائي الفوتون (STP). (أ-ب) يتم حصاد العضو بعد التروية عبر القلب وتخزينه طوال الليل في 4٪ بارافورمالدهيد (PFA) عند 4 درجات مئوية. (C-E) يتم تضمين العضو في الأغاروز المؤكسد وربطه ، ثم يتم مسح الأنسجة وتقطيعها باستخدام التصوير المقطعي STP. يتم جمع الشرائح للكيمياء المناعية اللاحقة. (ف-ج) خطوط أنابيب التحليل الحسابي لتحديد أعداد البكتيريا ، وتأكيد البكتيريا الفلورية ، وإعادة بناء 3D للمواقع البكتيرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إعداد التصوير المقطعي التسلسلي ثنائي الفوتون (STP). (أ) التصوير المقطعي الذي يتضمن (ب) التصوير 2 فوتون مع (ج) التقسيم الآلي للأنسجة التسلسلية. د: جمع شرائح الأنسجة لتحقيقات المتابعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
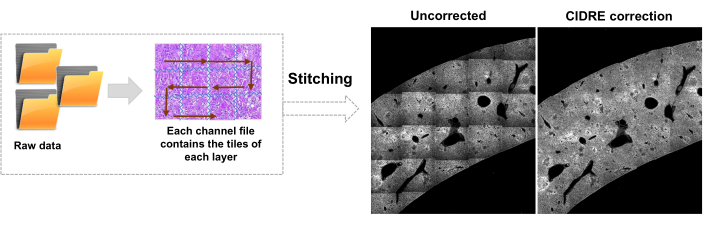
الشكل 3: خياطة البلاط وتصحيح الإضاءة. يتم خياطة البلاط وتصحيح الإضاءة غير المتساوية لاستخدام توزيعات الكثافة المصححة باستخدام تقليل الطاقة المنظم (CIDRE). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
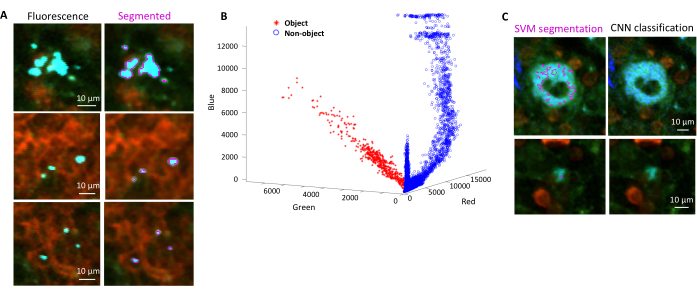
الشكل 4: تجزئة السالمونيلا التي تعبر عن البروتين الفلوري الأخضر (GFP) باستخدام آلة ناقلات الدعم (SVM) والشبكة العصبية التلافيفية (CNN). (A) صور تمثيلية لكائنات GFP مجزأة بواسطة SVM (يسار) والصور المقابلة (يمين) مع مناطق مجزأة بواسطة SVM (شريط المقياس: 10 ميكرومتر). (ب) توزيع قيم الأحمر والأخضر والأزرق (RGB) العنقودية للمناطق المجزأة. (ج) صور تمثيلية لأجسام غير تابعة لهيئة أجيال السلام تم تحديدها بشكل خاطئ بواسطة SVM على أنها بكتيريا (يسار). ترفضها CNN بشكل صحيح كخلفية (يمين ، شريط المقياس: 10 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
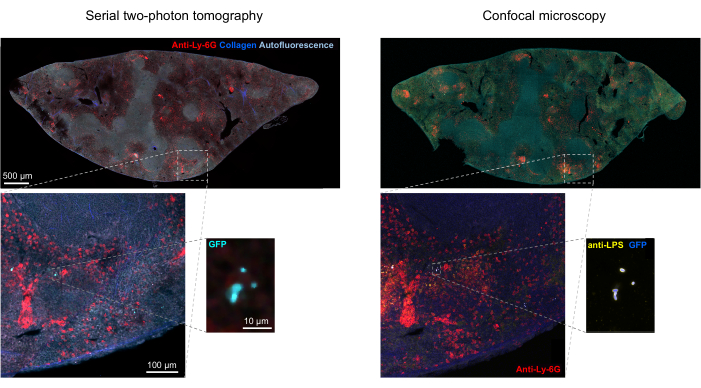
الشكل 5: الكشف عن السالمونيلا التي تعبر عن البروتين الفلوري الأخضر (GFP) عن طريق التصوير المقطعي والتأكيد بواسطة الكيمياء الهيستولوجية المناعية. صور لنفس القسم تم الحصول عليها عن طريق التصوير المقطعي (يسار) أو الفحص المجهري متحد البؤر بعد تلطيخها بجسم مضاد لعديس السكاريد الشحمي السالمونيلا (يمين). تم تلطيخ العدلات (الحمراء) عن طريق الحقن في الجسم الحي لجسم مضاد ل Ly-6G يحمل علامة PE قبل التروية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
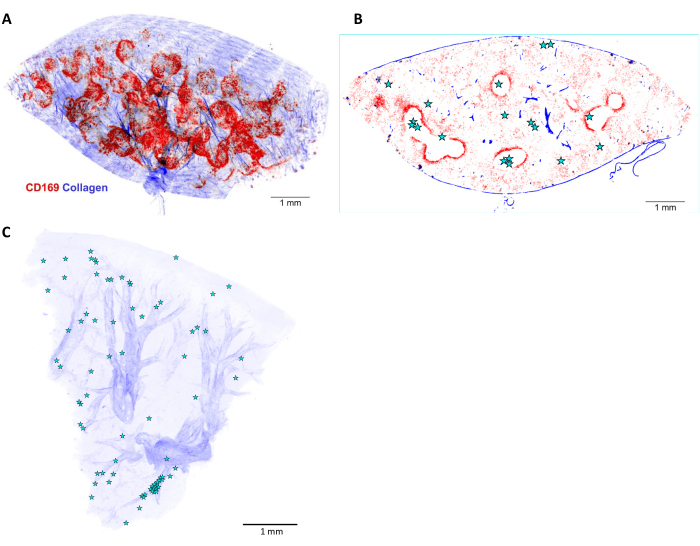
الشكل 6: إعادة بناء 3D وتوطين السالمونيلا في طحال الفأر المصاب. (أ) إعادة بناء ثلاثية الأبعاد (3D) لشريحة طحال بسمك 5 مم وملطخة في الجسم الحي قبل التروية بجسم مضاد ل CD169 (أحمر). تمثل الإشارة الزرقاء الكولاجين المكتشف بواسطة التوافقيات الثانية. (ب) مستوى بصري واحد من المكدس ثلاثي الأبعاد الموضح في (أ). يشار إلى مواقع خلايا السالمونيلا أو microcolonies بالنجوم. (ج) إعادة بناء 3D لمواقع السالمونيلا (النجوم) في الكبد المصاب. الشرايين مرئية بناء على أغلفة الكولاجين (الأزرق). شريط المقياس: 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يعد سياق الأنسجة المحلية لمسببات الأمراض البكتيرية أمرا بالغ الأهمية لتحديد هجمات المضيف المحلي ، والتكيفات البكتيرية ، والنتيجة المحلية لتفاعلات مسببات الأمراض المضيفة والعلاج الكيميائي المضاد للميكروبات ، والمساهمات الفردية في النتيجة الإجمالية للمرض. كان تصوير البكتيريا بحجم ميكرومتر في أعضاء بحجم سنتيمتر أمرا صعبا. يوفر التصوير المقطعي التسلسلي ثنائي الفوتون (STP) دقة مكانية كافية للكشف عن الخلايا البكتيرية الفردية في الأعضاء بأكملها ، والتقسيم والتصوير الآلي ، وإنتاجية كافية (~ 1 عضو في اليوم) 11. بينما يمكن تلطيخ مولدات الضد المضيفة في الجسم الحي ، يجب أن تعبر الخلايا الممرضة عن بروتينات فلورية مناسبة لضمان الكشف الشامل عن الخلايا المسببة للأمراض داخل الخلايا. تشكل مجموعات البيانات الناتجة (0.5-1.5 تيرابايت لكل عضو) تحديات كبيرة للبنى التحتية لتكنولوجيا المعلومات لتحليل البيانات وتخزينها.
هناك العديد من الخطوات الحاسمة في هذه الطريقة. أولا ، مطلوب سلالة ممرضة مع تعبير متجانس وقابل للكشف عن البروتين الفلوري GFP أو YFP. من الناحية المثالية ، يتم استخدام شريط تعبير كروموسومي25 لتقليل عدم تجانس التألق بسبب اختلاف عدد نسخ البلازميد. مطلوب كثافة مضان كافية ولكن يجب تجنب المستويات المفرطة من البروتين الفلوري لتجنب ضعف اللياقة البدنية للممرض23. يمكن الحصول على مستويات التعبير المناسبة عن طريق اختيار المروج المناسب وضبط موقع ربط الريبوسوم25 أو المنطقة غير المترجمة 5 'بأكملها (UTR)26. ثانيا ، يجب أن يتضمن تثبيت التروية غسلا أوليا بمحلول لإزالة أكبر عدد ممكن من كريات الدم الحمراء من الدورة الدموية. هذا أمر بالغ الأهمية بشكل خاص للطحال والكبد (على الرغم من صعوبة إزالة كرات الدم الحمراء الكاملة من هذه الأعضاء). تمتص كريات الدم الحمراء المتبقية الضوء في الجزء المرئي من الطيف مما يضر بجودة التصوير27. ثالثا ، يعد تخزين الأنسجة الثابتة في المادة الواقية من البرد أمرا بالغ الأهمية لتقليل التألق الذاتي للأنسجة ، والذي يكون مرتفعا بشكل خاص في الأنسجة الملتهبة ويمكن أن يلقي بظلاله على التألق الضعيف نسبيا للخلايا المسببة للأمراض11. رابعا ، يعد الربط المتقاطع الفعال للأنسجة بكتلة الأغاروز المحيطة أمرا بالغ الأهمية لقطع الاهتزاز السلس دون أن يقفز النسيج من كتلة الأغاروز. خامسا ، يجب التحقق بشكل مستقل من الإشارات الفلورية وتحديدها كخلايا ممرضة باستخدام مناهج متعامدة مثل تلطيخ الأجسام المضادة لمكونات مسببات الأمراض (مثل عديد السكاريد الدهني للبكتيريا سالبة الجرام) والفحص المجهري متحد البؤر للأقسام المستردة من التصوير المقطعي11. تحتوي بعض الأنسجة المصابة على جسيمات فلورية ذاتية ذات شكل مماثل وأطياف مضان متداخلة يمكن أن يساء تفسيرها بسهولة على أنها خلايا ممرضة. سادسا ، يجب مقارنة كمية الخلايا الممرضة داخل المستعمرات الدقيقة بالنهج المتعامدة مثل الفحص المجهري متحد البؤر لتقييم الدقة. يجب التحقق من الأحمال البكتيرية الإجمالية بناء على هذه الحسابات بالمقارنة مع الأساليب المتعامدة مثل قياس التدفق الخلوي والطلاء.
تتضمن التعديلات المهمة لبروتوكول STP المستخدم على نطاق واسع وضع مرشح تمرير النطاق الضيق 510/20 نانومتر أمام المضاعف الضوئي 211 ، لتقليل تداخل التألق الذاتي الأخضر والأصفر القوي بشكل خاص في الكبد والطحال وبقع باير المصابة والملتهبة. كما أن التألق الذاتي القوي وزيادة تشتت الضوء لهذه الأعضاء مقارنة بالدماغ (الذي يهيمن على التطبيقات الأخرى ل STP) يولد أيضا حاجة إلى تصحيح أكثر فعالية للإضاءة غير المتساوية. كتعديل آخر ، يستخدم هذا البروتوكول نهج CIDRE22 لهذا الغرض (الشكل 3) وتجزئة البكتيريا القائمة على الذكاء الاصطناعي. أخيرا ، تم تغيير المعالجة المسبقة للأنسجة من خلال تضمين خطوة حضانة في مادة واقية من التبريد عند -20 درجة مئوية مما يقلل من التألق الذاتي للأنسجة وبالتالي يسهل الكشف عن الخلايا الممرضة الصغيرة ذات التألق الضعيف نسبيا11.
قد يكون استكشاف الأخطاء وإصلاحها ضروريا إذا لم يتم اكتشاف إشارات مسببات الأمراض ، أو إذا أدى التجزئة إلى حساسية غير كافية (يتم تفويت عدد كبير جدا من الخلايا المسببة للأمراض) أو دقة غير كافية (يتم تقسيم الكثير من جزيئات الخلفية كخلايا ممرضة). إذا كان من الممكن اكتشاف التألق الذاتي للأنسجة الخلفية ولكن هناك عدد قليل جدا من إشارات مسببات الأمراض ، فقد تحتوي مسببات الأمراض على كميات غير كافية من البروتينات الفلورية. يمكن اختبار ذلك باستخدام الفحص المجهري متحد البؤر لأقسام الأنسجة من نفس الأنسجة المصابة أو قياس التدفق الخلوي لمتجانسات الأنسجة19,28. قد تكون الأسباب الكامنة وراء ذلك هي عدم كفاية مستويات التعبير أو عدم استقرار شريط التعبير. يمكن أن تشمل استراتيجيات التخفيف محفزات بديلة لدفع التعبير ، أو تكييف الكودونات للجينات التي تشفر البروتين الفلوري لأنواع مسببات الأمراض ، أو استخدام تركيبات عرضية ذات عدد نسخ أعلى ، أو تثبيت أشرطة التعبير عن طريق التكامل الكروموسومي أو التكامل القاتل المتوازن29. يعد اختيار البروتين الفلوري مهما أيضا ، ولكن الاكتشاف ممكن باستخدام GFP.mut2 و mWasabi و YPet و TIMERbac. إذا كان التقسيم غير دقيق ، فقد يكون سبب ذلك هو مضان ممرض ضعيف للغاية يمكن معالجته كما هو موضح أعلاه ، أو خلفية عالية جدا من التألق الذاتي للأنسجة. قد يؤدي التروية الواسعة لمحلول الغسيل أو الحضانة المطولة في مخزن التخزين المؤقت مباشرة قبل التضمين في كتلة الأغاروز والتصوير المقطعي إلى حل هذه المشكلات. أخيرا ، هناك حاجة إلى تدريب كاف للشبكة العصبية للتصنيف الدقيق ، ولكن التدريب المفرط يمكن أن يؤدي إلى الإفراط في التجهيز الذي يضعف أداء العينات الجديدة.
حاليا ، لا توجد طريقة أخرى يمكنها تصوير أعضاء كاملة بدقة مكانية كافية في 3D للكشف عن البكتيريا الفردية. قد تحقق التحسينات المستقبلية في إزالة الأنسجة والفحص المجهري للصفائح الضوئية دقة مماثلة. قد يتيح ذلك التصوير بسرعة أعلى ومع المزيد من قنوات الفلورسنت.
أحد القيود المهمة على STP هو دقة البكسل داخل المستوى ~ 0.5 ميكرومتر والدقة الرأسية من 5 إلى 10 ميكرومتر ، وهي غير كافية لحل البكتيريا الموجودة عن كثب ، على سبيل المثال ، داخل مستعمرة صغيرة مكتظة بكثافة. ومع ذلك ، من الممكن استرداد أقسام الأنسجة بعد التصوير المقطعي للفحص المجهري الثانوي عالي الدقة لأجزاء الأنسجة المختارة. هناك قيد آخر على STP وهو توفر ثلاث قنوات مضان فقط ، مما يحد من عدد الفلوروفورات التي يمكن تصويرها في وقت واحد. مرة أخرى ، يمكن أن يكشف التحليل الثانوي لأقسام الأنسجة المسترجعة بطرق تعدد الإرسال عن موقع وشدة العديد من العلامات لأجزاء الأنسجة المختارة. يمكن دمج هذه المعلومات في بنية 3D الشاملة للأنسجة المحيطة على النحو المحدد مع STP.
في الختام ، يتيح هذا البروتوكول إجراء تحقيقات مفصلة للتفاعلات بين المضيف والممرض على المستوى المحلي ومستوى العضو الكامل. يجب أن يكون البروتوكول قابلا للتكيف بسهولة مع مسببات الأمراض الأخرى (بشرط أن يتم الحصول عليها كسلالات فلورية) ، والأعضاء الأخرى ، والأنواع المضيفة المختلفة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم العمل من قبل مؤسسة العلوم الوطنية السويسرية 310030_156818 و 310030_182315 و NCCR_ 180541 AntiResist (إلى DB).
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose Low Melt | Roth | Art. 6351.5 25g | |
| Boric acid | Sigma-Aldrich | 6768-500G | |
| Instant adhesive Loctite 435 | Henkel | ||
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Poly(ethylene glycol) | Sigma-Aldrich | P5413-1kg | |
| Polyvinylpyrrolidone | Sigma-Aldrich | PVP-100G | |
| Sodium borohydride | Sigma-Aldrich | 71321-25g | |
| Sodium hydroxide | Merck | 106453 | |
| Sodium periodate | Sigma-Aldrich | 311448-100G | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640-250G | |
| Sodium phosphate monobasic dihydrate | Sigma-Aldrich | 71500-1KG | |
| Sodium tetraborate | Sigma-Aldrich | 221732-100g | |
| Sucrose | AppliChem | A4734,1000 | |
| Tris-buffered saline (TBS) | Merck | T5912-1L | |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Vacuum filtration 500 | TPP | TPP99250 | |
| Equipment | |||
| Blade | Campden Instruments Limited | 01-01-4692 | |
| MAITAI Laser | Spectra-Physics | ||
| Peel away plastic mold | Sigma-Aldrich | E6032-1CS | |
| TissueCyte 1000 tomograph | TissueVision | ||
| Antibody/dyes | |||
| DAPI | Merck | D9542-5MG | |
| Primary antibodies | |||
| anti-LPS Salmonella, rabbit | Sifin | REF TS 1624 | |
| anti-CD169-PE, clone 3D6.112 | Biolegend | 142403 | |
| anti-Ly-6G-PE, clone 1A8 | Biolegend | 127608 | |
| Secondary antibodies | Invitrogen | ||
| chicken anti-rabbit Alexa 647 | Invitrogen | A-21443 | |
| Software | Company | Version | |
| Fiji | Image J | 1.54g or later | |
| MATLAB | MathWorks | 2017b/2018b or later | |
| Orchestrator (tomograph) | TissueVision | ||
| Visualization software Imaris | Oxford Instruments | 9.9.0 or later |
References
- Bjarnsholt, T., et al. The importance of understanding the infectious microenvironment. Lancet Infect Dis. 22 (3), e88-e92 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Bumann, D., Cunrath, O. Heterogeneity of Salmonella-host interactions in infected host tissues. Curr Opin Microbiol. 39, 57-63 (2017).
- Hofmann, J., Keppler, S. J. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 134 (15), jcs258494 (2021).
- Blain, R., et al. A tridimensional atlas of the developing human head. Cell. 186 (26), 5910-5924.e17 (2023).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Meth. 9 (3), 255-258 (2012).
- Oh, S. W., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Kim, Y., et al. Brain-wide maps reveal stereotyped cell-type-based cortical architecture and subcortical sexual dimorphism. Cell. 171 (2), 456-469.e422 (2017).
- Matho, K. S., et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature. 598 (7879), 182-187 (2021).
- Muñoz-Castañeda, R., et al. Cellular anatomy of the mouse primary motor cortex. Nature. 598 (7879), 159-166 (2021).
- Li, J., et al. Tissue compartmentalization enables Salmonella persistence during chemotherapy. Proc Natl Acad Sci U S A. 118 (51), e2113951118 (2021).
- Dogga, S. K., et al. Importance of aspartyl protease 5 in the establishment of the intracellular niche during acute and chronic infection of Toxoplasma gondii. Mol Microbiol. 118 (6), 601-622 (2022).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec No), 33-38 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Claudi, B., et al. Phenotypic variation of Salmonella in host tissues delays eradication by antimicrobial chemotherapy. Cell. 158 (4), 722-733 (2014).
- Ai, H. W., Olenych, S. G., Wong, P., Davidson, M. W., Campbell, R. E. Hue-shifted monomeric variants of Clavularia cyan fluorescent protein: identification of the molecular determinants of color and applications in fluorescence imaging. BMC Biol. 6, 13 (2008).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nat Methods. 8 (5), 393-399 (2011).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Burton, N. A., et al. Disparate impact of oxidative host defenses determines the fate of Salmonella during systemic infection in mice. Cell Host&Microbe. 15 (1), 72-83 (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988 (2021).
- de Olmos, J., Hardy, H., Heimer, L. The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study. J Comp Neurol. 181 (2), 213-244 (1978).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nat Methods. 12 (5), 404-406 (2015).
- Wendland, M., Bumann, D. Optimization of GFP levels for analyzing Salmonella gene expression during an infection. FEBS Lett. 521 (1-3), 105-108 (2002).
- Barat, S., et al. Immunity to intracellular Salmonella depends on surface-associated antigens. PLoS Pathog. 8 (10), e1002966 (2012).
- Rollenhagen, C., Sorensen, M., Rizos, K., Hurvitz, R., Bumann, D. Antigen selection based on expression levels during infection facilitates vaccine development for an intracellular pathogen. Proc Natl Acad Sci U S A. 101 (23), 8739-8744 (2004).
- Chen, F., Cocaign-Bousquet, M., Girbal, L., Nouaille, S. 5'UTR sequences influence protein levels in Escherichia coli by regulating translation initiation and mRNA stability. Front Microbiol. 13, 1088941 (2022).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Bumann, D. Examination of Salmonella gene expression in an infected mammalian host using the green fluorescent protein and two-colour flow cytometry. Mol.Microbiol. 43 (5), 1269-1283 (2002).
- Nakayama, K., Kelly, S. M., Curtiss III, R. J. B. t. Construction of an Asd+ expression-cloning vector: stable maintenance and high level expression of cloned genes in a Salmonella. vaccine strain. 6 (6), 693-697 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved