Method Article
טומוגרפיה תלת-ממדית תלת-ממדית של איברים שלמים ברזולוציה גבוהה של זיהומים מיקרוביאליים
In This Article
Summary
במאמר זה אנו מתארים הליך המאפשר זיהוי כלל איברי של חיידקים פתוגניים במהלך ההדבקה וכימות של פעילות המדווח הפלואורסצנטי.
Abstract
רוב הזיהומים מתרחשים בתוך רקמות מארח תלת מימדיות עם אנטומיה מורכבת ופיזיולוגיה מקומית משתנה של המארח. מיקומם של תאי פתוגן בסביבה מגוונת זו משפיע באופן משמעותי על רמות הלחץ שלהם, תגובותיהם, גורלם ותרומתם להתקדמות הכוללת של המחלה ולכישלון הטיפול. עם זאת, בשל הקשיים הטכניים באיתור תאי פתוגן בגודל מיקרומטר בתוך איברים מארחים בגודל ס"מ, תחום מחקר זה כמעט ולא נחקר. כאן אנו מציגים שיטה להתמודדות עם אתגר זה. אנו משתמשים בטומוגרפיה סדרתית של שני פוטונים ובניתוח תמונה משופר באמצעות בינה מלאכותית כדי לאתר תאי סלמונלה בודדים בכל הטחול, אונות הכבד ובלוטות הלימפה השלמות של עכברים נגועים. באמצעות כתבים פלואורסצנטיים ומתן נוגדנים in vivo , ניתן לקבוע את קצב השכפול של תאי סלמונלה בודדים, את האינטראקציה המקומית שלהם עם תאי חיסון ספציפיים ואת תגובות החיידקים לאנטיביוטיקה. מתודולוגיות אלו פותחות אפיקים לבחינה מקיפה של זיהומים, מניעתם והטיפול בהם בהקשר התלת-ממדי של הרקמה.
Introduction
זיהומים מתרחשים ברקמות עם אנטומיה מורכבת ופיזיולוגיה ממודרת. המיקרו-סביבות המגוונות המתקיימות יחד ברקמה הנגועה יכולות לקבוע את גורלן של תת-קבוצות פתוגנים מקומיות ואת תרומתן לתוצאה הכוללת של המחלה 1,2,3. עם זאת, מיפוי תלת-ממדי מקיף של פתוגנים מיקרוביאליים ברקמות בגודל ס"מ נותר מאתגר4. הדמיה של המוח ואיברים אחרים היא תחום מחקר פעיל מאוד עם שיפור מתמיד של אסטרטגיות ניסוי5, אך שיטות רבות עדיין חסרות את הרזולוציה תת-מיקרומטר שתידרש כדי לזהות פתוגנים חיידקיים בגודל מיקרומטר בביטחון. לעומת זאת, טומוגרפיה טורית של שני פוטונים (STP)6 מאפשרת הדמיה אוטומטית מרובת צבעים ונטולת עיוותים של רקמות שלמות ברזולוציה תת-מיקרומטרית במישור, ומניבה מערכי נתונים נפחיים מלאים. שיטה זו משלבת חתך פיזי חוזר ונשנה של הרקמה באמצעות ויברטום, עם הדמיה לסירוגין של שני פוטונים של פני הבלוק המתהווים עם אור אינפרא אדום. טומוגרפיית STP נמצאת בשימוש נרחב למיפוי אקסונים דקים במוח כדי ליצור מפות קישוריות 7,8,9,10.
טומוגרפיית STP מאפשרת גם מיפוי תלת ממדי של תאי פתוגן מיקרוביאליים בודדים (סלמונלה, טוקסופלסמה) בכל הרקמות הנגועות11,12 באמצעות טומוגרף. הדור השני-הרמוני חושף את מעטה הקולגן סביב העורקים וברצועות סיביות כגון טרבקולה של הטחול, ובכך מספק הקשר אנטומי. ניתן להשתמש בנוגדנים פלואורסצנטיים מוזרקים In vivo כדי להכתים תאים מארחים ולחשוף אינטראקציות בין תאי פתוגן בודדים לבין תאים חיסוניים חודרים כגון נויטרופילים. כאן מתואר הצינור הכולל עיבוד הרקמה, הדמיה, תפירה של אריחי הדמיה עם תיקון תאורה, ערימה של תמונות בתלת מימד וסגמנטציה באמצעות כלי למידת מכונה. צינור זה מניב מיקומים תלת-ממדיים של פתוגנים, תאים ומיקרו-מושבות בודדים בהקשר המארח שלהם. ספירת מספר התאים הבודדים בתוך מיקרו-מושבות נותרה קשה בגלל מגבלות רזולוציה, אך ניתן להעריך מספרים כאלה בהתבסס על הבהירות המשולבת של המיקרו-מושבה. ניתן להתאים את הצינור בקלות למודלים אחרים של זיהום אם פתוגנים מבטאי GFP או YFP רקומביננטיים זמינים.
Protocol
כל הניסויים בבעלי חיים המתוארים כאן אושרו על ידי הרשויות (רישיון 2239, Kantonales Veterinäramt Basel) ופועלים בהתאם להנחיות המקומיות (Tierschutz-Verordnung, Basel) ולחוק הגנת בעלי החיים השוויצרי (Tierschutz-Gesetz).
1. הכנה ואחסון של רקמות נגועות
- השתמש במודל זיהום לפי בחירה. כאן, עכברים בני 10 עד 16 שבועות משני המינים נגועים ב~ 1,000 יחידות יוצרות מושבה (CFU) על ידי הזרקה תוך ורידית או 5 x 107 CFU על ידי מתן תוך קיבתי עם מחט עגולה. זני עכברים מתאימים כוללים BALB/c ו-C57BL/6.
הערה: ניתן להתאים בקלות את אותה גישה למינים מארחים אחרים. - ודא שפתוגנים מבטאים חלבונים פלואורסצנטיים כדי לאפשר זיהוי ברקמה לא מוכתמת. פתוגנים המבטאים GFP.mut213, YPet14, TIMERbac15 או mWasabi16 ניתנים להדמיה באמצעות עירור 940 ננומטר17. סלמונלה המבטאת mCherry18 ברמות הניתנות לזיהוי בקלות על ידי ציטומטריית זרימה19 ניתנת להדמיה באמצעות עירור של 800 ננומטר, אך יש לה יחסי אות לרקע גרועים בטחול ובכבד נגועים המראים אוטופלואורסצנטיות משמעותית.
- ודא שכל החלבונים הפלואורסצנטיים שומרים על >70% מעוצמת הפלואורסצנטיות שלהם לאחר קיבוע עם פרפורמלדהיד ב- pH ניטרלי בהתבסס על כימות עם ציטומטריית זרימה. כאן, רקמת עכבר נגוע, כלומר, טחול, כבד, בלוטות לימפה, טלאים של פייר משמשים.
- יש להכתים סמני פני השטח של התא המארח in vivo על ידי הזרקת נוגדנים המסומנים בפיקואריתרין (PE) 10 דקות לפני הזילוח. כדי להכתים נויטרופילים, יש להזריק תוך ורידי 4 מיקרוגרם אנטי-Ly-6G-PE ב-100 מיקרוליטר של PBS. כדי להכתים מקרופאגים באזור השוליים בטחול, יש להזריק 4 מיקרוגרם אנטי-CD169-PE ב-100 מיקרוליטר של PBS (ראה טבלת חומרים).
- תקן רקמות נגועות באמצעות זילוח טרנסקרדיאליסטנדרטי 20 עם 15 מ"ל של חיץ פוספט 50 mM קר כקרח (PB; 10 mM NaH2PO4, 40 mMNa2HPO4, pH 7.4), ואחריו 35 מ"ל של 4% paraformaldehyde (PFA; fixative) ב-PB (איור 1A).
- בקצרה, יש לבצע הרדמה עמוקה לבעל החיים הנגוע על ידי הזרקה תוך צפקית של 100 מ"ג/ק"ג קטמין ו-16 מ"ג/ק"ג קסילזין. ודא הרדמה נאותה על ידי אישור אובדן רפלקס צביטת הבוהן.
- מחטאים את הפרווה באמצעות אתנול 70%, מייבשים אותה במגבת נייר סטרילית ופותחים בניתוח את החזה בפינצטה ובמספריים. מניחים מחט סטרילית בחדר השמאלי של הלב, פותחים את האטריום הימני עם מספריים סטריליים, ומעבירים את החיץ הראשון ולאחר מכן מקבעים דרך המחט, החדר השמאלי וכל מערכת כלי הדם באמצעות משאבה. זה מתקן את כל הרקמות במהירות ואחידה וגורם המתת חסד.
- אספו את הרקמה לאחר הזילוח, דגרו עליה בנפח פי 20 של פרפורמלדהיד קר 4% במאגר PB והניחו אותה על שייקר בטמפרטורה של 4°C למשך הלילה (איור 1B). הדמיה אפשרית עבור רקמות בטווח גודל של 0.05 עד 2 ס"מ3. עבור רקמות גדולות יותר, לחתוך לחתיכות מתאימות.
- למחרת, שטפו את הרקמה 3x במשך 10 דקות כל אחד עם חיץ PB עם טלטול ב-40 סל"ד בטמפרטורת החדר כדי להסיר PFA.
הערה: בגלל רעילות PFA, שלבים אלה חייבים להתבצע בתוך מכסה אדים. יש להשליך את פסולת PFA בהתאם להנחיות המוסדיות. - הסר כל מאגר PB עודף והוסף נפח 20x של מאגר אחסון cryoprotectant21 (876 mM סוכרוז, 0.25 mM פוליוויניל פירולידון, 40% (v/v) אתילן גליקול, מומס במאגר PB 50 mM) לדגימה עם רעד ב 40 סל"ד ב 4 ° C במשך 6-8 שעות או עד שהרקמות שוקעות לתחתית. דגירה דגימה ב -20 ° C במשך לפחות 3 ימים כדי להבטיח הפחתה יעילה של autofluorescence רקמות11. ניתן להשתמש בדגימות עד 5 שנים כאשר הן מאוחסנות בטמפרטורה של -20°C.
הערה: שקיעת הרקמה מעידה על חדירה תקינה של חיץ האחסון לתוך הרקמה.
2. הטבעה לדוגמה
- הטמיעו את הרקמה בגוש אגרוז לחיתוך חלק עם ויברטום. הפעל מראש את האגרוז כימית על ידי חמצון עם פריודט ולאחר מכן להפחית עם בורוהידריד כדי ליצור קישור צולב עם הרקמה לשיפור היציבות במהלך תהליך החיתוך. בצע את השלבים המתוארים להלן.
- מכינים אגרוז מחומצן 4% במשקל 2.25 גרם אגרוז ומוסיפים 0.21 גרם NaIO4. הוסף 100 מ"ל של PB לאגרוז ו- NaIO4. יש לערבב בטמפרטורת החדר במכסה אדים למשך 2-3 שעות עם הגנה מפני אור.
הערה: שלב קריטי: אין לחרוג מערבוב במשך יותר מ-3 שעות, אחרת האגרוז יתפלמר בצורה גרועה. - לשחזר את agarose על ידי סינון ממברנה מסנן ואקום סטנדרטי עם קרום 0.2 מיקרומטר. הסר את שאריות NaIO4 על ידי שטיפה 3x עם 50 מ"ל של מאגר PB. להשעות מחדש את agarose מחומצן ב 50 מ"ל של חיץ PB.
הערה: אין להמיס את האגרוז בשלב זה. האגרוז יכול להיות מאוחסן ב 4 ° C עד 2-3 שבועות מוגן מפני אור. - הכינו תמיסת בורוהידריד על ידי הוספת 19 גרם בורקס ו-3 גרם חומצה בורית ל-1 ליטר מים. יש לערבב עד להמסה ולכוונן את רמת החומציות ל-9-9.5 עם 1 M NaOH. על צלחת ערבוב במכסה אדים, מחממים 100 מ"ל של חיץ בוראט ל 40 מעלות צלזיוס. מוסיפים 0.2 גרם NaBH4 ומערבבים במשך 15-30 דקות תוך הגנה מפני אור.
הערה: ניתן לאחסן את תמיסת הבורוהידריד במשך מספר שבועות בטמפרטורת החדר בחושך. שלב קריטי: בעת הוספת NaBH4 לחיץ הבוראט ייווצר גז, ולכן יש לבצע שלב זה בתוך מכסה אדים. אין לבצע שלב זה במיכל אטום היטב מכיוון שהוא עלול להוביל לפיצוץ. - קח טישו מהמקפיא לאחר דגירה מספקת להפחתת אוטופלואורסצנטיות (≥ 3 ימים), הסר את מאגר האחסון הקריופרוטקטיבי העודף, ושטוף את הרקמה 3x במשך 10 דקות כל אחד עם חיץ PB עם טלטול ב -40 סל"ד בטמפרטורת החדר (RT).
- המיסו כ-20 מ"ל של תרחיף אגרוז מחומצן (שהוכן בשלב 1) במיקרוגל (700 W למשך ~30 שניות), אפשרו לו להתקרר מספיק כדי להתמודד (~45 מעלות צלזיוס), ושפכו אותו לתבנית פלסטיק.
הערה: שלב קריטי: אין להוסיף את האגרוז מיד לאחר חימום במיקרוגל על הדגימה, זה עלול להוביל להרס הרקמה. - השתמש בפינצטה כדי להרים בעדינות את הרקמה ולהחדיר אותה במהירות למרכז התחתון של האגרוז. דוגרים על התבנית ב-RT למשך 15 דקות כדי לאפשר לאגרוז להתפלמר.
- לאחר פילמור האגרוז, פתחו את תבנית הפלסטיק עם אזמל מארבע פינותיה והרימו בזהירות את קוביית האגרוז באצבעות הכפפות.
- טבלו את הדגימה בתמיסת בורוהידריד (שהוכנה בשלב 2) למשך 2-3 שעות בטמפרטורה של 4°C כדי להתחיל קישור צולב של האגרוז המחומצן והרקמה. פעולה זו מונעת את ניתוק הרקמה במהלך החיתוך.
הערה: שלב קריטי: הדגימה השקועה בבורוהידריד צריכה להיות מודגרת מוגנת מפני אור ב -4 מעלות צלזיוס. - שטפו את קוביית האגרוז עם חיץ PB 2x למשך 10 דקות. סובבו את קוביית האגרוז כך שהרקמה תהיה בצד העליון וחברו את הבלוק למגלשה מגנטית (מגלשת מיקרוסקופ עם שני מגנטים מחוברים לגב) באמצעות כמה טיפות של דבק מיידי. לוקח 10-20 דקות עד שהדבק מתמצק, לכן הניחו טישו נייר עם טיפות של חיץ PB על גבי האגרוז כדי להבטיח שהדגימה תישאר רוויה כראוי לאורך כל הדרך (איור 1C).
3. הכנת המיקרוטום והכנת הבמה
- הניחו את השקופית המגנטית על המתכת במרכז קופסת הדגימה של הטומוגרף.
- מלא את התיבה במאגר PB ומקם אותה בזהירות על הבמה והדק את הבורג משמאל כדי לאבטח את תיבת הדגימה על במת הטומוגרף.
הערה: אין להדק את הברגים יתר על המידה, אחרת הדבר יפגע בקופסת הפלסטיק. - הניחו את הלהב על המיקרוטום והזיזו בזהירות את מיקום הדגימה ליד ומתחת למיקרוטום. פני השטח העליונים של האגרוז צריכים להיות באותה רמה כמו להב המיקרוטום.
הערה: מיקום נמוך מדי יבזבז זמן חיתוך, בעוד שמיקום גבוה מדי יסיר נתח גדול מהבלוק בחיתוך הראשון. - הזיזו את הבמה כדי למקם את קוביית האגרוז למרכז המטרה ולחצו שוב ושוב על כפתור הפרוסות בתוכנת הטומוגרף עד לקבלת פרוסה שלמה של קוביית האגרוז כולה.
4. הקצאת פני השטח ורכישת תמונות דו-ממדיות
- מרכזו את עדשת האובייקט על דגימת הרקמה בכיווני x ו-y.
- פתח את תוכנת הלייזר והפעל את הלייזר בתוכנה. לאחר שמיעת צליל מתקתק, הפעל את מתג הלייזר וכוונן את אורך הגל ל-800 ננומטר.
הערה: יש לחמם את מקור הלייזר למשך 30 דקות לפחות, רצוי שעה אחת, לפני ההדמיה. - סגור את דלתות הארונות של המיקרוסקופ, כבה את כל מקורות האור בחדר, הפעל את ה- PMT והגדר את המתח ל- 750 V.
הערה: שלב קריטי: PMT רגישים מאוד לאור, יש לכבות אותו אלא אם דלתות הארונות סגורות וכל מקורות האור בחדר כבויים. - התאם את הגדרות הפרוטוקול של תוכנת הטומוגרף כמתואר והגדר את תריס המיקרוסקופ לאוטומטי ואת המתח ל -20 ו -3 עבור V1 ו- V2, בהתאמה.
- לחץ על כפתור הדו-ממד בתוכנת טומוגרף כדי לצלם את הדגימה.
- לאחר הופעת תמונה עם אוטופלואורסצנטיות גלויה, התאימו את z-piezo כדי להגדיר את מישור המוקד על משטח קוביית האגרוז. הסריקה הראשונה תהיה 20 מיקרומטר מתחת לפני השטח כדי לקבל תמונה יציבה של הדגימה.
- אם לא נראה רקע אוטופלואורסצנטי, הגדל את הניגודיות עד להופעת אות. זה יכול להתרחש כי אין אות גלוי (כלומר, בגלל agarose על גבי הרקמה). במקרה זה, התאם את ציר z באמצעות מכשיר z-piezo עד שהוא מגיע למשטח agarose. ייתכן שיהיה צורך בתנועה ידנית של העדשה אם המיקום הרצוי נמצא מחוץ לטווח של מכשיר z-piezo.
- חתכו פרוסות מרובות של 50 מיקרומטר לאחר מציאת פני השטח של הדגימה וקבלו תמונות דו-ממדיות לאחר כל חיתוך כדי לוודא שמישור המוקד מוגדר כראוי על משטח הגוש.
5. מציאת קצוות הדגימות והגדרת הלייזר לנקודת ההתחלה
- בהתבסס על קואורדינטות xy של אזור סריקת הלייזר (4 קואורדינטות פינתיות), להגביל את אזור ההדמיה לרקמה עם הדמיה מינימלית של גוש האגרוז שמסביב.
- כבה את PMTs, הגדר את אורך גל הלייזר ל 800 ננומטר, הפעל את תריס הלייזר לפתיחה. המיקום של אור לייזר שנכנס לגוש האגרוז נראה כנקודה אדומה של אור מפוזר (איור 2A,B).
שלב קריטי: היזהר במיוחד עם לייזר דרגה 4. זה יכול לפגוע במהירות רקמות אנושיות ועיניים. הצוות זקוק להכשרה מיוחדת כדי להפעיל מכשיר כזה בבטחה. - השתמש בנקודת הלייזר בעת הזזת הבמה כדי למצוא את הקואורדינטות של קצוות הרקמה באמצעות הרצף אחורה, ימינה, מלפנים ושמאלה.
- בדוק שוב את הקואורדינטות ומקם את נקודת הלייזר בפינה הימנית-קדמית, שהיא נקודת ההתחלה המוגדרת כברירת מחדל להדמיית הרקמה.
- המר את הקואורדינטות מחלון הקונסולה לגדלי בלוקים הניתנים לזיהוי על-ידי מכונה, המוגדרים על-ידי שלבי xy. הזן מדידות שלבים אלה בפרוטוקול של התוכנה. סגרו את דלתות הארון.
סריקת 6. 3D / חתך
- שנה את אורך הגל ל- 940 ננומטר כדי לעורר GFP, mWasabi או YPet, ו- PE.
הערה: הלייזר אינו נראה לעין האנושית באורך גל זה. כדי לשפר את האות לרקע עבור GFP, mWasabi והרכיב הפולט הירוק שלTIMER bac, מקם מסנן פס צר 510/20 ננומטר לפני PMT 2. פעולה זו מפחיתה את ההפרעה על ידי אוטופלואורסצנטיות של רקמה ירוקה-צהובה. - העבר את תריס המיקרוסקופ למצב אוטומטי, ואת הגדרות מתח התריס ל- 20 עבור V1 ו- 1.71 עבור V2.
- התאם את שלושת הפרמטרים הבאים בתוכנה: עובי מקטע - לרוב המטרות, הגדר ל- 50 מיקרומטר. עבור כבד, יש להגדיר ל-30 מיקרומטר בגלל עומק הדמיה מוגבל. מספר החתכים הפיזיים - זה קובע את עומק הרקמה הכולל שיצולם, מוגדר בהתאם. מספר המטוסים שיש ללכוד עבור כל קטע -זה יקבע את רזולוציית z. השתמש ב- 5 מישורים (המניבים רזולוציה אנכית של 10 מיקרומטר) לרוב המטרות. לשימוש בכבד 3 מישורים או פחות.
- הגדר את רווח הלייזר. זה צריך להיבדק אמפירית עבור רקמות שונות ועומק סריקה.
- הגדירו את נתיב התיקייה ואת השם לאחסון התמונות שנרכשו וספקו מידע מתאים למטא-קובץ ההדמיה.
- בדוק שוב את כל הערכים שהוזנו.
- לחצו על הגדרת פסיפס תלת-ממדית כדי להתחיל בתהליך הסריקה (איור 1D).
- לאחר השלמת ההדמיה, אספו בזהירות את חלקי הרקמה ממיכל המים ואחסנו אותם במאגר אחסון בטמפרטורה של -20°C עד לשימוש נוסף (איור 1E; איור 2C,D).
7. עיבוד תמונה וניתוח נתונים
- הורידו את הסקריפטים של MATLAB למחשב לינוקס מבית https://github.com/BumannLab/Li_BumannLab_2020. העתק את קבצי ה- Script לתיקיה, לדוגמה, /home/user/Program/.
הערה: יש להתקין את התוסף Computer Vision Toolbox עבור MATLAB ופיג'י (או ImageJ) במחשבי Linux כדי שהסקריפט יפעל באופן מלא. - תפר תמונות אריחים כמתואר להלן.
- העברת נתונים משרת הטומוגרף למחשב לינוקס.
- פתח את קובץ ה- Script של MATLAB StepOneStitchingAndArchive.m ואתר את תיקיית המקור המכילה את הנתונים הגולמיים. הגדר את תיקיות המקור והיעד בסקריפט.
- עבור לכרטיסייה עורך ולחץ על הפעל. מידע התקדמות מוצג בחלון הפקודה. העיבוד כולל קריאת מידע מקובץ הפסיפס, יצירת אינדקס אריחים לפני תפירת תמונה, תיקון תאורת רקע עם Cidre22 (איור 3) וכן תיקון תאורה בין שכבות אופטיות שנרכשו בעומקים שונים. מצאו את התמונות התפורות בתיקיית משנה בשם stitchedImages_100 בתיקיית המקור. דחסו את הנתונים הגולמיים לאחסון לטווח ארוך באמצעות הפקודה tar ושמרו כקובץ יחיד עם סיומת שם הקובץ tar.bz2 (איור 1F).
- בצע אימון מודל וסגמנטציה עם מכונה וקטורית תומכת. כדי לאמן את מכונת וקטור התמיכה ולבצע את הסגמנטציה, בצע את השלבים הבאים.
הערה: התמונות התפורים עבור כל אחת משלוש התעלות הפלואורסצנטיות מאוחסנות בשלוש תיקיות משנה (הנקראות 1, 2 ו- 3, המתאימות לפלואורסצנטיות אדומה, כתומה וירוקה) של stitchedImages_100. כל תיקיית משנה מכילה את כל התמונות התפורים מאותו ערוץ.- תצוגה מקדימה של התמונות התפורות. פתח תמונה אחת עם אותו שם קובץ מכל תיקיית משנה עם פיג'י (או ImageJ). מזגו את שלושת הערוצים לתמונה צבעונית אחת. כוונן את הבהירות של כל ערוץ עד לקבלת אותות ברורים מחיידקים ורקמות אוטופלואורסצנטיות. שים לב לרמת העוצמה המרבית המותאמת של כל ערוץ לשלב הבא.
- פתח את קובץ ה- Script של MATLAB StepTwoSegmentationAndAnalysis.m ודפדף אל המקור. הגדר את תיקיית המקור ואת שמות התמונות להדרכה. לדוגמה
sourceD = '/' ;
red_name = [sourceD '1/section_020_01.tif']; green_name = [sourceD '2/section_020_01.tif'];
blue_name = [sourceD '3/section_020_01.tif']; - עבור אל הכרטיסיה עורך ולחץ על הפעל.
- תופיע תיבת דו-שיח המבקשת ספי צבע, מלא אותה על סמך בדיקה ידנית קודמת עם פיג'י (שלב 7.3.1).
- בחר אזורים עבור רקע ואזורי עניין (כלומר, חיידקים) בהתאם לתיבות הדו-שיח. יופיעו גרפים המראים עד כמה המודל אומן ושואלים אם יש צורך להוסיף אזורים נוספים. הוסיפו עוד אזורי עניין ורקע עד שניתן יהיה לפלח את החיידקים בבירור (איור 4A,B).
- תן שם למודל ושמור אותו. הסקריפט יטען אוטומטית את התמונות ויחיל מסנן חציוני (רדיוס 2 פיקסלים).
- תהליך הפילוח פועל באופן אוטומטי, ומידע התקדמות מוצג בחלון הפקודה. צפו בהתקדמות הפילוח. אם הפילוח אינו פועל היטב עם המודל בתמונות תפורות אחרות, חזור על אימון המודל כדי לכלול יותר אזורי רקע וחיידקים.
- כדי לראות את תוצאות הפילוח, בדוק את הקובץ בשם Allpositions_filter3D.txt. הקובץ הזה מכיל את הקואורדינטות של מרכז הכובד עבור כל חיידק או מיקרו-מושבת חיידקים ואת עוצמת הפלואורסצנטיות המשולבת המתאימה (איור 1G).
- הסר ממצאים נוספים עם רשת עצבית קונבולוציונית כמתואר להלן.
הערה: עבור חיידקים מסוימים, סגמנטציה פשוטה עם מכונת וקטור התמיכה עדיין כוללת כמה ממצאי הדמיה. זה נכון במיוחד עבור חיידקים המבטאים YPet. סגמנטציה מבוססת רשת עצבית יכולה להסיר ביעילות את הממצאים האלה (איור 4C). ההרחבה Computer Vision Toolbox עבור MATLAB ופיג'י (או ImageJ) חייבת להיות מותקנת במחשבי Windows כדי שקובץ ה-script יתפקד באופן מלא. למידע על הרשת העצבית הבסיסית ראו: https://ch.mathworks.com/help/deeplearning/ug/create-simple-deep-learning-network-for-classification.html- הכינו את התמונות. המרת קובצי tif לקובצי jpg עם התאמות בהירות שונות באמצעות פיג'י. זהה עם אצירה ידנית לפחות 600 חיידקים ו -600 חפצים ותמונות חתוכות בטוחות של אובייקטים אלה בתיקיות המתאימות.
- פתח את סקריפט MATLAB CNNtestV4.m ונווט אל קובצי המקור המכילים את תמונות האובייקטים של שלב 7.4.1.
- הגדירו את תיקיית התמונות להדרכה. לדוגמה
digitDatasetPath = קובץ מלא ('D:\20200602_CNN','fortrainingPixel12Folder2');
הגדר את מספר התמונות לאימון, לדוגמה, numTrainFiles = 600. - עבור אל הכרטיסיה עורך ולחץ על הפעל. לאחר אימון, קובץ המודל של CNN נשמר כ- gregnet1.mat בתיקיית המקור.
- הגדירו תיקייה עם תמונות בדיקה. לדוגמה
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
התוצאות נשמרות בקובץ YourFile.txt המכיל מידע על שם התמונה והסיווג כחיידקים או חפץ. - הגדר תיקייה עם תמונות בדיקה. לדוגמה
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp').
התוצאות יישמרו בקובץ YourFile.txt, המכיל מידע על שם התמונה והסיווג כחיידקים או חפץ.
- הערך את גודלן של מושבות מיקרו בהתבסס על עוצמת הפלואורסצנטיות של חיידקים בודדים כמתואר להלן.
הערה: הרזולוציה המרחבית של הטומוגרף אינה מספיקה כדי לפתור תאי חיידקים בודדים בתוך מיקרו-מושבות צפופות. עם זאת, ניתן להעריך את מספר החיידקים בכל מושבת מיקרו בהתבסס על הפלואורסצנטיות הכוללת של המיקרוקולוניה ביחס לפלואורסצנטיות של חיידקים בודדים. דיוק הערכה זה תלוי בהומוגניות של עוצמת הפלואורסצנטיות באוכלוסיית החיידקים.- אשרו את זהותם של אירועים חיוביים ל-GFP בטומוגרפיית STP על-ידי צביעת רכיבים חיידקיים כגון ליפופוליסכריד באמצעות אימונוהיסטוכימיה של קטעים שאוחזרו מהטומוגרף (איור 1H; איור 5).
- זהה לפחות 30 חיידקים בודדים ואחזר את עוצמת הפלואורסצנטיות שלהם מתוצאות הפילוח המתאימות. השתמש בערך העוצמה החציונית כהתייחסות לחיידק יחיד. חשבו את מספר החיידקים של כל מיקרו-מושבה על-ידי חלוקת עוצמת הפלואורסצנטיות הכוללת של המיקרו-מושבה בערך הייחוס של חיידק יחיד (איור 1I).
- בצע שחזור תלת ממדי באמצעות תוכנת הדמיה כמתואר להלן.
- הכנת תמונה
- צלם את תמונות הערוץ הכחול, המכילות אותות הרמוניים שניים של קולגן המספקים התייחסות אנטומית שימושית, כולל כמוסות רקמות, עורקים וטרבקולה. השתמש בתמונות מפולחות עבור חיידקיםכערוץ השני .
- צמצמו את התמונות מערוץרחוב 1 פי 10 הן בצירי x והן בצירי y ושמרו את התמונות שהוקטנו בתיקייה חדשה. צרו 3 עותקים משוכפלים של תמונות קטנות באותה תיקייה. השם של עותקים משוכפלים חדשים צריך לשמור על אותו רצף. לדוגמה: section_001_01.tif, שכפל 1 עם שם section_001_01-copy.tif, section_001_01-copy-copy.tif. החל שלבים אלה גם על התמונותמהערוץ השני . הצמצום מניב גדלי קבצים נוחים יותר לניהול. התמונות המשולשות יחליקו את ציר z.
- מזג את התמונות מכל ערוץ ליצירת אוספי תמונות עם פיג'י. לחץ על Image > Stacks > Tools > Stack sorter > Sort by labels.
- בצע סינון תלת-ממדי. לחץ על עבד > מסננים > מסנן תלת-ממד והגדר את גודל מסנן Z כ- 6. שמרו את אוספי התמונות.
- בצע הדמיה תלת-ממדית כמתואר להלן.
- פתח את חבילת תוכנת התצוגה החזותית בתצוגת Arena (הגדרת ברירת מחדל). השתמש בסמל התיקיה Watch כדי להוסיף תיקיות לתצוגת Arena. לחץ פעמיים כדי לפתוח את הקובץ *.ims או *.tif (שהוכן ב- 7.6.1).
- בעזרת 'עריכה>מאפייני תמונה', התאימו את ייצוגי הצבעים (LUTs) של הערוצים השונים בחלון 'התאמת תצוגה'.
- לחץ על מתקדם כדי להגדיר ידנית את ערכי המינימום/מקסימום וערך לתיקון גמא.
לחץ על שמות ערוצים כדי לשנות את השמות וה- LUTs. - לאחר התאמת מראה התמונה, יצאו את התצוגה הנוכחית בעזרת הכלי תצלום בזק.
- השתמש בסמל הנפשה כדי לייצג את הנתונים התלת-ממדיים כסרט. השתמש במצביע הניווט כדי למצוא פרספקטיבה/תצוגה ושנה גודל תצוגה והשתמש + הוסף כדי להוסיף מסגרות ראשיות. מעבר למיקום אחר והוספת המסגרת הראשית הבאה. לחץ על כפתור ההקלטה האדום כדי לבנות את הסרט. שמרו אותו בתיקיית היעד הרצויה ובסוג הקובץ הרצויים (איור 1J).
- הכנת תמונה
תוצאות
ההליך המתואר מאפשר זיהוי של תאי סלמונלה בודדים באיברי עכבר שלמים כגון טחול, כבד, בלוטות לימפה מזנטריות ומדבקות פייר11 (איור 5 ואיור 6). הוא גם מזהה טפילי Toxoplasma gondii במוח העכבר12. חלק מהרקמות הנגועות, כולל כבד, מדבקות פייר וטחול, פולטות אוטופלואורסצנטיות משמעותית בטווח הירוק-צהוב. Autofluorescence משופר עוד יותר על ידי קיבוע עם paraformaldehyde, אשר יש צורך לשמר את מבנה הרקמה. זיהוי פלואורסצנטיות ירוקה מ-GFP, mWasabi והרכיב הירוק שלTIMER bac על רקע אוטופלואורסצנטי זה משופר על ידי הצבת מסנן פס פס צר 510/20 ננומטר (המשדר את רוב פליטות ה-GFP אך חוסם חלק גדול מהספקטרום האוטופלואורסצנטי) לפני מכפיל אור 2 (האוסף פליטות ירוקות) ועל ידי הפחתת אוטופלואורסצנטיות רקמות על ידי אחסון רקמות קבועות למשך 3 ימים או יותר בהגנה קריואורסנטית11. עם זאת, חיידקים עדיין צריכים לבטא לפחות כמה אלפי עותקים לכל תא של GFP או חלבונים פלואורסצנטיים אחרים. מצד שני, יש להימנע מרמות חלבון פלואורסצנטיות מוגזמות כדי למזער את עלויות הכושר שעלולות להוביל לאלימות מוחלשת23.
פילוח נכון של חיידקים פלואורסצנטיים ברקמות יכול להיות מאושר על ידי אימונוהיסטוכימיה של קטעי רקמה שאוחזרו לאחר הדמיה. באופן ספציפי, עצמים שמוכתמים בנוגדן לרכיבי פני השטח של חיידקים כמו ליפופוליסכריד יכולים להיות מיושרים עם התמונה הפלואורסצנטית שמתקבלת בטומוגרפיית STP (איור 5). חשוב לציין כי חלק מתאי הסלמונלה המוכתמים חסרים חלבונים פלואורסצנטיים ולכן ניתן לזהות פלואורסצנטיות הן במיקרוסקופ קונפוקלי והן בטומוגרפיה STP. תאים אלה הם סלמונלה שהומתו על ידי מערכת החיסון המארחת, כפי שמודגם על ידי תרביות מיון ציטומטרי של זרימה ותרביות גדילה מתאים ממוינים בודדים, כמו גם המתאם ההדוק בין מספר היחידות יוצרות המושבה על לוחות אגר לבין מספר תאי הסלמונלה הפלואורסצנטיים כפי שנקבע על ידי ציטומטריית זרימה24. בנוסף, אובדן פלסמיד יכול לגרום לתאים קיימא שאינם פלואורסצנטיים וזה צריך להיבדק על ידי ציפוי על מדיה עם וללא אנטיביוטיקה מתאימה המתאימה סמן הבחירה על פלסמיד. עבור פלסמידים שמקורם ב-pSC101, אובדן פלסמיד in vivo הוא נדיר19. עבור רוב קלטות הביטוי המשולבות כרומוזומלית כגון sifB::gfp המשמשות ב-11, אובדן הביטוי אינו ניתן לגילוי in vivo. אם הפילוח אינו עולה בקנה אחד עם נתוני האימונוהיסטוכימיה, יש לשנות את צינור הסגמנטציה.
הרזולוציה של טומוגרפיית STP אינה מספיקה כדי לפתור תאי חיידקים בודדים בתוך מיקרו-מושבות צפופות. עם זאת, עוצמת הפלואורסצנטיות הכוללת של המיקרו-מושבה מאפשרת להעריך את מספר תאי הסלמונלה . זה דורש זן פלואורסצנטי עם רמות פלואורסצנטיות הומוגניות מאוד כגון סלמונלה sifB::gfp11. שילוב המספר המשוער של תאי סלמונלה עבור כל המיקרו-מושבות והתאים הבודדים מניב עומסי רקמה חיידקיים הכוללים עומסים התואמים שיטות חלופיות כגון ציפוי או ציטומטריית זרימה של הומוגנטים ברקמה11. ציטומטריית ציפוי וזרימה לא יכולה להיעשות ישירות מאותן רקמות מכיוון שהן צריכות להיות קבועות זילוח לטומוגרפיה STP. במקום זאת, הם צריכים להיעשות עם בעלי חיים נוספים שאינם קבועים. אם עומסי החיידקים החציוניים כפי שנקבעו על ידי הגישות השונות שונים ביותר מפי 3, הכדאיות של חיידקים פלואורסצנטיים עלולה להיפגע (במקרה של יחידות יוצרות מושבה נמוכות יותר) או שחיידקים מסוימים איבדו את מבנה המדווח הפלואורסצנטי (במקרה של יחידות יוצרות מושבה גבוהות יותר). ניסוי בקרה יידרש כדי לזהות את המקור לפערים כאלה.
טומוגרפיית STP מספקת לוקליזציה של תאי חיידקים בתוך המבנה התלת-ממדי של הרקמות הנגועות. האותות ההרמוניים השניים של קולגן מספקים ציוני דרך אנטומיים כגון עורקים וטרבקולה. נוסף על כך, תאים מארחים יכולים להיות מוכתמים in vivo על-ידי הזרקת נוגדן לסמנים לפני השטח לפני הזילוח (איור 5 ואיור 6). צביעה זו מספקת ציוני דרך נוספים לתאי רקמות ולמיקרו-סביבות ספציפיות, כולל מוקדי דלקת (סמנים תוך-תאיים ותאים מסוימים עם מחסומי דיפוזיה כגון מוך לבן טבורי או המוח אינם נגישים בקלות, מתאימים לצביעת in vivo זו). גישה זו חשפה את מוך הלבן הטבורי כתא רקמה המאפשר הישרדות ארוכת טווח של סלמונלה במהלך כימותרפיה מיקרוביאלית11.
לבסוף, סלמונלה המשוכפלת בקצב מתון או איטי ניתן לזהות ולמקם בתוך המבנה התלת-ממדי של רקמות באמצעות זנים המבטאים טיימרbac, מדווח תא בודד לקצב שכפול11,15.
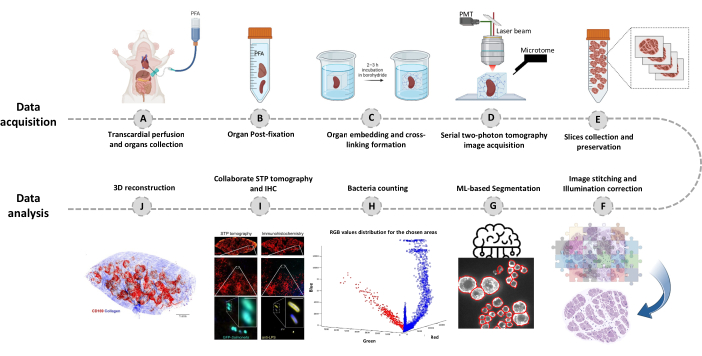
איור 1: הליך הדמיה של איברים שלמים באמצעות טומוגרפיה טורית של שני פוטונים (STP). (A-B) האיבר נקצר לאחר זילוח טרנסקרדיאלי ומאוחסן למשך הלילה ב-4% פרפורמלדהיד (PFA) ב-4°C. (C-E) האיבר מוטבע באגרוז מחומצן ומקושר צולב, ואז הרקמה נסרקת ונחתכת באמצעות טומוגרפיית STP. הפרוסות נאספות עבור אימונוהיסטוכימיה עוקבת. (פ-י) צינורות ניתוח חישוביים לכימות מספרי חיידקים, אישור חיידקים פלואורסצנטיים ושחזור תלת ממדי של מיקומי חיידקים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מערך טומוגרפיה טורי של שני פוטונים (STP). (A) טומוגרף המשלב (B) הדמיה של 2 פוטונים עם (C) חתך אוטומטי של רקמות טוריות. (D) פרוסות רקמה שנאספו לצורך חקירות מעקב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
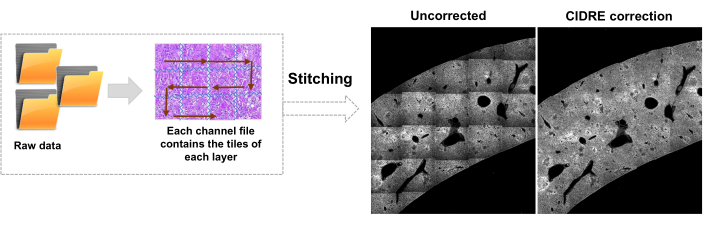
איור 3: תפירת אריחים ותיקוני תאורה. אריחים נתפרים ותאורה לא אחידה מתוקנת לשימוש בפיזור עוצמה מתוקן באמצעות מזעור אנרגיה מוסדר (CIDRE). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
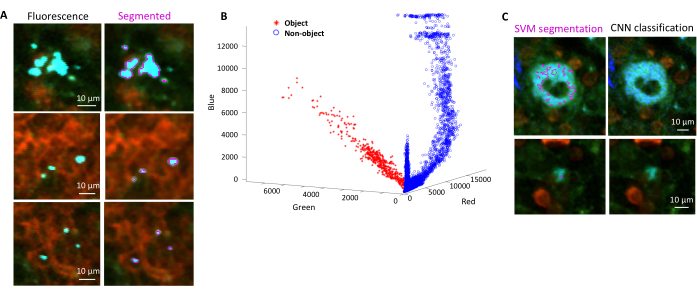
איור 4: סגמנטציה של סלמונלה המבטאת את החלבון הפלואורסצנטי הירוק (GFP) באמצעות מכונת וקטור תמיכה (SVM) ורשת עצבית קונבולוציונית (CNN). (A) תמונות מייצגות של אובייקטי GFP המפולחים לפי SVM (משמאל) ותמונות תואמות (מימין) עם אזורים המפולחים לפי SVM (סרגל קנה מידה: 10 מיקרומטר). (B) התפלגות ערכים מקובצים באשכולות אדום-ירוק-כחול (RGB) עבור האזורים המפולחים. (C) תמונות מייצגות של עצמים שאינם GFP שזוהו באופן שגוי על-ידי שרת אחסון וירטואלי כחיידקים (משמאל). CNN מבטל אותם בצדק כרקע (מימין, סרגל קנה מידה: 10 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
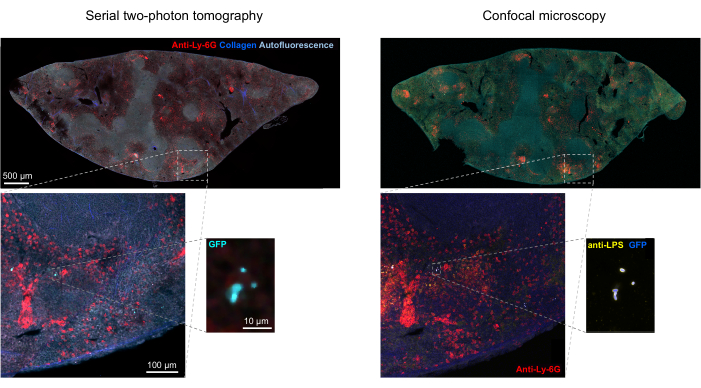
איור 5: זיהוי סלמונלה המבטאת את החלבון הפלואורסצנטי הירוק (GFP) באמצעות טומוגרפיה ואישור על-ידי אימונוהיסטוכימיה. תמונות של אותו קטע שנרכשו על ידי טומוגרפיה (משמאל) או מיקרוסקופ קונפוקלי לאחר צביעה עם נוגדן סלמונלה lipopolysaccharide (מימין). נויטרופילים (באדום) הוכתמו על ידי הזרקת in vivo של נוגדן אנטי-Ly-6G שכותרתו PE לפני הזלוף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
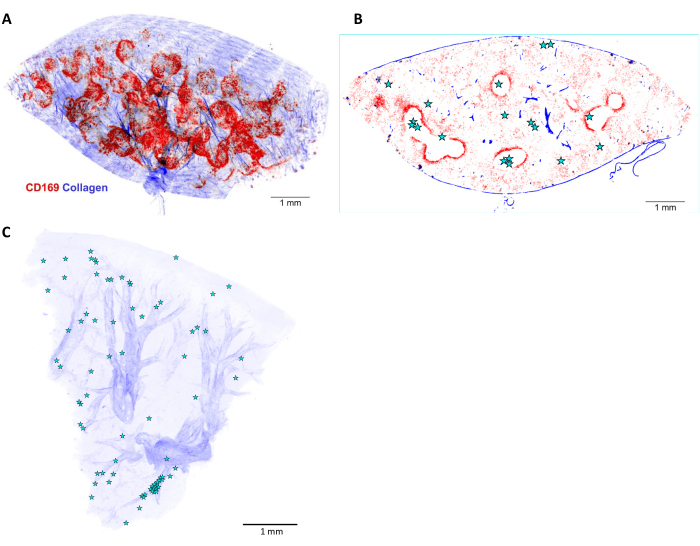
איור 6: שחזור תלת-ממדי ולוקליזציה של סלמונלה בטחול עכבר נגוע. (A) שחזור תלת ממדי (3D) של פרוסת טחול בעובי 5 מ"מ ומוכתמת in vivo לפני זילוח עם נוגדן נגד CD169 (אדום). האות הכחול מייצג קולגן שזוהה על ידי הרמוניות שניות. (B) מישור אופטי אחד של ערימת התלת-ממד המוצג ב-(A). המיקומים של תאי סלמונלה או microcolonies מסומנים על ידי כוכבים. (C) שחזור תלת-ממדי של מיקומי סלמונלה (כוכבים) בכבד נגוע. העורקים נראים על סמך מעטה הקולגן שלהם (כחול). סרגל קנה מידה: 1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
ההקשר הרקמתי המקומי של פתוגנים חיידקיים חיוני לקביעת התקפות מארח מקומיות, התאמות חיידקיות, התוצאה המקומית של אינטראקציות הפתוגן המארח וכימותרפיה מיקרוביאלית, והתרומה האישית לתוצאה הכוללת של המחלה. הדמיה של חיידקים בגודל מיקרומטר באיברים בגודל סנטימטרים הייתה מאתגרת. טומוגרפיה טורית של שני פוטונים (STP) מספקת רזולוציה מרחבית מספקת כדי לזהות תאי חיידקים בודדים באיברים שלמים, חתך והדמיה אוטומטיים, ותפוקה מספקת (~ איבר אחד ליום)11. בעוד אנטיגנים מארח יכול להיות מוכתם in vivo, תאים פתוגניים צריכים לבטא חלבונים פלואורסצנטיים מתאימים כדי להבטיח זיהוי מקיף של תאים פתוגניים תאיים. מערכי הנתונים המתקבלים (0.5-1.5 טרה-בייט לכל איבר) מציבים אתגרים משמעותיים בפני תשתיות IT לניתוח ואחסון נתונים.
ישנם מספר שלבים קריטיים בשיטה זו. ראשית, נדרש זן פתוגן עם ביטוי ניתן לזיהוי והומוגנית של חלבון פלואורסצנטי GFP או YFP. באופן אידיאלי, קלטת ביטוי כרומוזומלית25 משמשת כדי למזער הטרוגניות פלואורסצנטית עקב וריאציה של מספר העתק פלסמיד. נדרשת עוצמה פלואורסצנטית מספקת, אך יש להימנע מרמות מוגזמות של חלבון פלואורסצנטי כדי למנוע ליקויי כושר של הפתוגן23. ניתן לקבל רמות ביטוי מתאימות על ידי בחירת מקדם מתאים וכוונון עדין של אתר הקישור הריבוזומלי25 או כל האזור הלא מתורגם (UTR) 5' 26. שנית, קיבוע הזלוף צריך לכלול שטיפה ראשונית עם חיץ כדי להסיר כמה שיותר אריתרוציטים ממחזור הדם. זה קריטי במיוחד עבור הטחול והכבד (אם כי הסרה מלאה של אריתרוציטים מאיברים אלה קשה). אריתרוציטים נותרים בולעים אור בחלק הנראה של הספקטרום ופוגעים באיכות ההדמיה27. שלישית, אחסון הרקמות הקבועות בהגנה הקפויה הוא קריטי להפחתת הפלואורסצנטיות של הרקמות, שהיא גבוהה במיוחד ברקמות דלקתיות ויכולה להאפיל על הפלואורסצנטיות החלשה יחסית של תאי הפתוגן11. רביעית, הקישור הצולבות היעיל של הרקמה לגוש האגרוז שמסביב הוא קריטי לחיתוך ויברטומי חלק מבלי שהרקמה תקפוץ החוצה מגוש האגרוז. חמישית, אותות פלואורסצנטיים וזיהויים כתאי פתוגן חייבים להיות מאומתים באופן עצמאי באמצעות גישות אורתוגונליות כגון צביעה בנוגדנים לרכיבים פתוגניים (כגון ליפופוליסכריד לחיידקים גראם-שליליים) ומיקרוסקופ קונפוקלי של המקטעים שנשלפו מטומוגרף11. חלק מהרקמות הנגועות מכילות חלקיקים פלואורסצנטיים אוטומטיים בעלי צורה דומה וספקטרום פלואורסצנטי חופף שניתן לפרש בקלות בטעות כתאי פתוגן. שישית, יש להשוות את כמות התאים הפתוגניים בתוך מיקרו-מושבות לגישות אורתוגונליות כגון מיקרוסקופ קונפוקלי כדי להעריך את הדיוק. יש לאמת את העומסים החיידקיים הכוללים המבוססים על חישובים אלה בהשוואה לגישות אורתוגונליות כגון ציטומטריית זרימה וציפוי.
שינויים חשובים בפרוטוקול STP הנמצא בשימוש נרחב כוללים הצבת מסנן פס צר 510/20 ננומטר לפני מכפיל אור 211, כדי להפחית את ההפרעה של אוטופלואורסנציה ירוקה-צהובה החזקה במיוחד בכבד, בטחול ובמדבקות פייר נגועות ומודלקות. האוטופלואורסצנטיות החזקה ופיזור האור המוגבר של איברים כאלה בהשוואה למוח (השולט ביישומים אחרים של STP) יוצרים גם צורך בתיקון יעיל יותר להארה לא אחידה. כשינוי נוסף, פרוטוקול זה משתמש בגישת CIDRE22 למטרה זו (איור 3) ופילוח מבוסס בינה מלאכותית של חיידקים. לבסוף, עיבוד מקדים של רקמות השתנה על ידי הכללת שלב הדגירה בהגנה קריופרוטקטורית ב -20 °C אשר מפחית את autofluorescence רקמות ובכך מקל על זיהוי של תאים פתוגניים קטנים עם פלואורסצנטיות חלשה יחסית11.
פתרון בעיות עשוי להיות נחוץ אם לא ניתן לזהות אותות פתוגנים, או שסגמנטציה מניבה רגישות לא מספקת (יותר מדי תאי פתוגן מתפספסים) או דיוק לא מספיק (יותר מדי חלקיקי רקע מפולחים כתאי פתוגן). אם ניתן לזהות אוטופלואורסצנטיות של רקמת הרקע אך יש מעט מדי אותות פתוגנים, הפתוגנים עשויים להכיל כמויות לא מספיקות של חלבונים פלואורסצנטיים. ניתן לבדוק זאת באמצעות מיקרוסקופ קונפוקלי של חלקי רקמה מאותה רקמה נגועה או ציטומטריית זרימה של הומוגנטים ברקמה19,28. סיבות בסיסיות יכולות להיות רמות ביטוי לא מספיקות או חוסר יציבות של קלטת הביטוי. אסטרטגיות הפחתה יכולות לכלול מקדמים חלופיים להנעת ביטוי, התאמת קודון של הגנים המקודדים את החלבון הפלואורסצנטי עבור מיני הפתוגנים, שימוש במבנים אפיזומליים עם מספר העתקים גבוה יותר, או ייצוב קלטות ביטוי על ידי אינטגרציה כרומוזומלית או השלמה מאוזנת-קטלנית29. הבחירה בחלבון פלואורסצנטי חשובה גם היא, אך זיהוי אפשרי באמצעות GFP.mut2, mWasabi, YPet ו-TIMERbac. אם הסגמנטציה אינה מדויקת, הדבר עלול להיגרם על ידי פלואורסצנטיות פתוגן חלשה מדי שניתן לטפל בה כמתואר לעיל, או רקע אוטופלואורסצנטי גבוה מדי ברקמות. זילוח נרחב של תמיסת שטיפה או דגירה ממושכת במאגר האחסון מיד לפני ההטבעה בבלוק האגרוז ובטומוגרפיה עשויים לפתור בעיות אלה. לבסוף, נדרש אימון מספיק של הרשת העצבית לסיווג מדויק, אך אימון מוגזם עלול להוביל להתאמת יתר הפוגעת בביצועים של דגימות חדשות.
כיום, אין שיטה אחרת שיכולה לצלם איברים שלמים ברזולוציה מרחבית מספקת בתלת-ממד לאיתור חיידקים בודדים. שיפורים עתידיים בניקוי רקמות ומיקרוסקופ יריעות אור עשויים להשיג רזולוציה דומה. זה עשוי לאפשר הדמיה במהירות גבוהה יותר ועם יותר תעלות פלואורסצנטיות.
מגבלה חשובה של STP היא רזולוציית הפיקסלים במישור של ~0.5 מיקרומטר ורזולוציה אנכית של 5 עד 10 מיקרומטר, שאינה מספיקה לפתרון חיידקים הממוקמים קרוב, למשל, בתוך מיקרו-מושבה צפופה. עם זאת, ניתן לאחזר קטעי רקמות לאחר טומוגרפיה עבור מיקרוסקופ קונפוקלי משני ברזולוציה גבוהה של חלקי רקמה נבחרים. מגבלה נוספת של STP היא זמינותם של שלושה תעלות פלואורסצנטיות בלבד, המגבילות את מספר הפלואורופורים שניתן לצלם בו זמנית. שוב, ניתוח משני של קטעי רקמה שאוחזרו בשיטות ריבוב יכול לחשוף את המיקום והעוצמה של סמנים רבים נוספים עבור חלקי רקמה נבחרים. מידע זה יכול להיות משולב במבנה התלת-ממדי הכולל של הרקמה הסובבת כפי שנקבע באמצעות STP.
לסיכום, פרוטוקול זה מאפשר חקירות מפורטות של אינטראקציות מארח-פתוגן ברמה המקומית וברמת האיבר כולו. הפרוטוקול צריך להיות ניתן להתאמה בקלות לפתוגנים אחרים (בתנאי שניתן להשיג אותם כזנים פלואורסצנטיים), איברים אחרים ומינים מארחים שונים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
העבודה נתמכה על ידי הקרן הלאומית השוויצרית למדע 310030_156818, 310030_182315 ו-NCCR_ 180541 AntiResist (ל-DB).
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose Low Melt | Roth | Art. 6351.5 25g | |
| Boric acid | Sigma-Aldrich | 6768-500G | |
| Instant adhesive Loctite 435 | Henkel | ||
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Poly(ethylene glycol) | Sigma-Aldrich | P5413-1kg | |
| Polyvinylpyrrolidone | Sigma-Aldrich | PVP-100G | |
| Sodium borohydride | Sigma-Aldrich | 71321-25g | |
| Sodium hydroxide | Merck | 106453 | |
| Sodium periodate | Sigma-Aldrich | 311448-100G | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640-250G | |
| Sodium phosphate monobasic dihydrate | Sigma-Aldrich | 71500-1KG | |
| Sodium tetraborate | Sigma-Aldrich | 221732-100g | |
| Sucrose | AppliChem | A4734,1000 | |
| Tris-buffered saline (TBS) | Merck | T5912-1L | |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Vacuum filtration 500 | TPP | TPP99250 | |
| Equipment | |||
| Blade | Campden Instruments Limited | 01-01-4692 | |
| MAITAI Laser | Spectra-Physics | ||
| Peel away plastic mold | Sigma-Aldrich | E6032-1CS | |
| TissueCyte 1000 tomograph | TissueVision | ||
| Antibody/dyes | |||
| DAPI | Merck | D9542-5MG | |
| Primary antibodies | |||
| anti-LPS Salmonella, rabbit | Sifin | REF TS 1624 | |
| anti-CD169-PE, clone 3D6.112 | Biolegend | 142403 | |
| anti-Ly-6G-PE, clone 1A8 | Biolegend | 127608 | |
| Secondary antibodies | Invitrogen | ||
| chicken anti-rabbit Alexa 647 | Invitrogen | A-21443 | |
| Software | Company | Version | |
| Fiji | Image J | 1.54g or later | |
| MATLAB | MathWorks | 2017b/2018b or later | |
| Orchestrator (tomograph) | TissueVision | ||
| Visualization software Imaris | Oxford Instruments | 9.9.0 or later |
References
- Bjarnsholt, T., et al. The importance of understanding the infectious microenvironment. Lancet Infect Dis. 22 (3), e88-e92 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Bumann, D., Cunrath, O. Heterogeneity of Salmonella-host interactions in infected host tissues. Curr Opin Microbiol. 39, 57-63 (2017).
- Hofmann, J., Keppler, S. J. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 134 (15), jcs258494(2021).
- Blain, R., et al. A tridimensional atlas of the developing human head. Cell. 186 (26), 5910-5924.e17 (2023).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Meth. 9 (3), 255-258 (2012).
- Oh, S. W., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Kim, Y., et al. Brain-wide maps reveal stereotyped cell-type-based cortical architecture and subcortical sexual dimorphism. Cell. 171 (2), 456-469.e422 (2017).
- Matho, K. S., et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature. 598 (7879), 182-187 (2021).
- Muñoz-Castañeda, R., et al. Cellular anatomy of the mouse primary motor cortex. Nature. 598 (7879), 159-166 (2021).
- Li, J., et al. Tissue compartmentalization enables Salmonella persistence during chemotherapy. Proc Natl Acad Sci U S A. 118 (51), e2113951118(2021).
- Dogga, S. K., et al. Importance of aspartyl protease 5 in the establishment of the intracellular niche during acute and chronic infection of Toxoplasma gondii. Mol Microbiol. 118 (6), 601-622 (2022).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec No), 33-38 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Claudi, B., et al. Phenotypic variation of Salmonella in host tissues delays eradication by antimicrobial chemotherapy. Cell. 158 (4), 722-733 (2014).
- Ai, H. W., Olenych, S. G., Wong, P., Davidson, M. W., Campbell, R. E. Hue-shifted monomeric variants of Clavularia cyan fluorescent protein: identification of the molecular determinants of color and applications in fluorescence imaging. BMC Biol. 6, 13(2008).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nat Methods. 8 (5), 393-399 (2011).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Burton, N. A., et al. Disparate impact of oxidative host defenses determines the fate of Salmonella during systemic infection in mice. Cell Host&Microbe. 15 (1), 72-83 (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- de Olmos, J., Hardy, H., Heimer, L. The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study. J Comp Neurol. 181 (2), 213-244 (1978).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nat Methods. 12 (5), 404-406 (2015).
- Wendland, M., Bumann, D. Optimization of GFP levels for analyzing Salmonella gene expression during an infection. FEBS Lett. 521 (1-3), 105-108 (2002).
- Barat, S., et al. Immunity to intracellular Salmonella depends on surface-associated antigens. PLoS Pathog. 8 (10), e1002966(2012).
- Rollenhagen, C., Sorensen, M., Rizos, K., Hurvitz, R., Bumann, D. Antigen selection based on expression levels during infection facilitates vaccine development for an intracellular pathogen. Proc Natl Acad Sci U S A. 101 (23), 8739-8744 (2004).
- Chen, F., Cocaign-Bousquet, M., Girbal, L., Nouaille, S. 5'UTR sequences influence protein levels in Escherichia coli by regulating translation initiation and mRNA stability. Front Microbiol. 13, 1088941(2022).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Bumann, D. Examination of Salmonella gene expression in an infected mammalian host using the green fluorescent protein and two-colour flow cytometry. Mol.Microbiol. 43 (5), 1269-1283 (2002).
- Nakayama, K., Kelly, S. M., Curtiss III, R. J. B. t Construction of an Asd+ expression-cloning vector: stable maintenance and high level expression of cloned genes in a Salmonella. vaccine strain. 6 (6), 693-697 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved