Method Article
고분해능 3차원 전장기 단층촬영(High-resolution three-dimensional whole-organ tomography of microbial infections)
요약
여기에서는 감염 중 병원성 박테리아를 장기 전체에서 검출하고 형광 리포터 활동을 정량화할 수 있는 절차에 대해 설명합니다.
초록
대부분의 감염은 복잡한 해부학적 구조와 국소적으로 다양한 숙주 생리학을 가진 3차원 숙주 조직 내에서 발생합니다. 이러한 다양한 환경 내에서 병원체 세포의 위치는 스트레스 수준, 반응, 운명 및 질병 및 치료 실패의 전반적인 진행에 대한 기여도에 큰 영향을 미칩니다. 그러나 cm 크기의 숙주 기관 내에서 μm 크기의 병원체 세포를 찾는 기술적 어려움으로 인해 이 연구 분야는 상대적으로 탐구되지 않았습니다. 여기에서는 이 문제를 해결하는 방법을 제시합니다. 우리는 연속 이광자 단층 촬영과 AI 강화 이미지 분석을 사용하여 감염된 마우스의 전체 비장, 간엽 및 전체 림프절에서 개별 살모넬라 세포를 찾습니다. 형광 리포터와 in vivo 항체 투여를 사용하여 단일 살모넬라 세포의 복제 속도, 특정 면역 세포와의 국소 상호 작용 및 항생제에 대한 박테리아 반응을 결정할 수 있습니다. 이러한 방법론은 3차원 조직 맥락 내에서 감염, 예방 및 치료에 대한 포괄적인 검사를 위한 길을 열어줍니다.
서문
감염은 복잡한 해부학적 구조와 구획화된 생리학을 가진 조직에서 발생합니다. 감염된 조직에 공존하는 다양한 미세환경은 국소 병원체 하위 집합의 운명과 전체 질병 결과에 대한 기여도를 결정할 수 있습니다 1,2,3. 그러나 cm 크기의 조직에서 미생물 병원체에 대한 포괄적인 3D 매핑은 여전히 어려운 과제로 남아 있습니다4. 뇌 및 기타 장기의 이미징은실험 전략5을 지속적으로 개선하는 매우 활발한 연구 분야이지만, 많은 방법은 여전히 μm 크기의 박테리아 병원체를 자신 있게 식별하는 데 필요한 μm 미만의 해상도가 부족합니다. 이와 대조적으로, 연속 이광자(STP) 단층 촬영6은 μm 미만의 면내 해상도로 전체 조직의 자동화된 다중 색상, 변형 없는 이미징을 가능하게 하여 전체 체적 데이터 세트를 생성합니다. 이 방법은 진동체를 사용하여 조직의 반복적인 물리적 절편과 적외선으로 떠오르는 블록 면의 간헐적인 이광자 이미징을 결합합니다. STP 단층 촬영은 연결성 맵 7,8,9,10을 설정하기 위해 뇌의 얇은 축삭을 매핑하는 데 널리 사용되었습니다.
STP 단층 촬영은 또한 단층 촬영을 사용하여 전체 감염 조직11,12에서 개별 미생물 병원체 세포(살모넬라, 톡소플라즈마)의 3D 매핑을 가능하게 합니다. 2차 조화 생성은 동맥 주위와 비장의 섬유주와 같은 섬유질 띠에서 콜라겐 덮개를 드러내어 해부학적 맥락을 제공합니다. In vivo 주입 형광 항체는 개별 병원체 세포와 호중구와 같은 침윤 면역 세포 간의 상호 작용을 밝히기 위해 숙주 세포를 염색하는 데 사용할 수 있습니다. 여기에서는 조직 처리, 이미징, 조명 보정을 통한 이미징 타일 스티칭, 3차원 이미지 적층 및 기계 학습 도구를 사용한 분할과 관련된 파이프라인에 대해 설명합니다. 이 파이프라인은 호스트 컨텍스트 내에서 개별 병원체, 세포 및 미세 콜로니의 3D 위치를 생성합니다. 미세콜로니 내의 개별 세포의 수를 세는 것은 해상도 한계 때문에 여전히 어렵지만, 이러한 숫자는 미세콜로니의 통합 밝기를 기반으로 추정할 수 있습니다. 파이프라인은 재조합 GFP 또는 YFP 발현 병원체를 사용할 수 있는 경우 다른 감염 모델에 쉽게 적용할 수 있습니다.
프로토콜
여기에 설명된 모든 동물 실험은 당국(라이선스 2239, Kantonales Veterinäramt Basel)의 승인을 받았으며 현지 지침(Tierschutz-Verordnung, Basel) 및 스위스 동물 보호법(Tierschutz-Gesetz)을 따릅니다.
1. 감염된 조직의 준비 및 보관
- 선택한 감염 모델을 사용합니다. 여기서, 남녀 모두의 10-16 주 된 마우스는 정맥 주사에 의해 ~ 1,000 콜로니 형성 단위 (CFU)에 감염되거나 둥근 팁 바늘을 사용한 위 내 투여에 의해 5 x 107 CFU에 감염됩니다. 적합한 마우스 균주로는 BALB/c 및 C57BL/6이 있습니다.
참고: 동일한 접근 방식을 다른 숙주 종에도 쉽게 적용할 수 있습니다. - 병원체가 형광 단백질을 발현하여 염색되지 않은 조직에서 식별할 수 있도록 합니다. GFP.mut213, YPet14, TIMERbac15 또는 mWasabi16을 발현하는 병원체는 모두 940 nm excitation17을 사용하여 시각화할 수 있다. 유세포분석19로 쉽게 검출할 수 있는 수준에서 mCherry18을 발현하는 살모넬라균은 800nm excitation을 사용하여 이미징할 수 있지만 감염된 비장 및 간에서 신호 대 배경 비율이 좋지 않아 상당한 자가형광을 보입니다.
- 모든 형광 단백질이 유세포 분석을 통한 정량화를 기반으로 중성 pH에서 파라포름알데히드로 고정한 후 형광 강도의 >70%를 유지하는지 확인합니다. 여기에는 감염된 쥐 조직, 즉 비장, 간, 림프절 및 Peyer's patch가 사용됩니다.
- 관류 10분 전에 phycoerythrin(PE) 표지 항체를 주입하여 in vivo 숙주 세포 표면 마커를 염색합니다. 호중구를 염색하려면 PBS 100μL에 4μg의 항-Ly-6G-PE를 정맥 주사합니다. 비장의 변연 영역 대식세포를 염색하려면 100μL의 PBS에 4μg의 항-CD169-PE를 주입합니다( 재료 표 참조).
- 15mL의 얼음처럼 차가운 50mM 인산염 완충액(PB; 10mM NaH2PO4, 40 mMNa2HPO4, pH 7.4)과 함께 표준 심 경 관류20을 통해 감염된 조직을 고정한 다음 PB에서 4% 파라포름알데히드(PFA, 고정제) 35mL를 주입합니다(그림 1A).
- 간단히 말해서, 100mg/kg 케타민과 16mg/kg 자일라진의 복강 내 주사로 감염된 동물에게 깊은 마취를 투여합니다. 발가락 꼬집 반사의 소실을 확인하여 적절한 마취를 보장합니다.
- 70% 에탄올을 사용하여 털을 소독하고 멸균 종이 타월로 말리고 핀셋과 가위로 가슴을 외과적으로 엽니다. 멸균 바늘을 심장의 좌심실에 놓고 멸균 가위로 우심방을 열고 펌프를 사용하여 바늘, 좌심실 및 전체 혈관계를 통해 첫 번째 완충액과 고정제를 실행합니다. 이것은 모든 조직을 빠르고 균일하게 고정시키고 안락사를 유발합니다.
- 관류 후 조직을 수집하고 PB 완충액에 20x 부피의 4% 차가운 파라포름알데히드로 배양한 다음 밤새 4°C의 셰이커에 놓습니다(그림 1B). 이미징은 0.05 - 2 cm3의 크기 범위의 조직에 대해 가능합니다. 큰 티슈의 경우 적절한 조각으로 자릅니다.
- 다음날 상온에서 40rpm으로 흔드는 상태에서 PB 버퍼로 각각 10분씩 티슈를 3회 세척하여 PFA를 제거합니다.
알림: PFA 독성으로 인해 이러한 단계는 흄 후드 내부에서 수행해야 합니다. PFA 폐기물은 기관 지침에 따라 처리하십시오. - 여분의 PB 완충액을 제거하고 20배 부피의 동결 보호제 저장 완충액21 (876mM 자당, 0.25mM 폴리비닐피롤리돈, 40%(v/v) 에틸렌 글리콜, 50mM PB 완충액에 용해됨)을 4°C에서 40rpm으로 6-8시간 동안 또는 조직이 바닥으로 가라앉을 때까지 흔듭니다. -20 °C에서 최소 3일 동안 시료를 배양하여 조직 자가형광을 효과적으로 감소시킵니다11. 시료는 -20 °C에서 보관할 경우 최대 5년 동안 사용할 수 있습니다.
알림: 조직이 가라앉는 것은 저장 버퍼가 조직에 적절하게 침투했음을 나타냅니다.
2. 샘플 임베딩
- 비브라톰으로 매끄럽게 절단할 수 있도록 조직을 아가로스 블록에 삽입합니다. periodate로 산화하여 agarose를 화학적으로 사전 활성화 한 다음 붕소 수화물로 환원시켜 절단 공정 중 안정성을 향상시키기 위해 조직과 가교를 형성합니다. 아래에 설명된 단계를 수행합니다.
- 4g 아가로스 2.25g을 계량하여 4% 산화 아가로스를 제조하고 NaIO 0.21g4를 추가합니다. 아가로스와 NaIO4에 PB 100mL를 추가합니다. 빛으로부터 보호하면서 흄 후드에서 실온에서 2-3시간 동안 저어줍니다.
알림: 중요 단계: 3시간 이상 교반을 초과하지 않으면 아가로스가 제대로 중합되지 않습니다. - 0.2μm 멤브레인이 있는 표준 진공 필터에서 멤브레인 여과로 아가로스를 회수합니다. 50mL의 PB 완충액으로 3회 세척하여 남아 있는 NaIO4 를 제거합니다. 산화된 아가로스를 50mL의 PB 완충액에 재현탁시킵니다.
알림: 이 단계에서 아가로스를 녹이지 마십시오. 아가로스는 4°C에서 최대 2-3주 동안 빛으로부터 보호되며 보관할 수 있습니다. - 물 19L에 붕사 3g과 붕산 1g을 넣어 붕소 용액을 준비합니다. 용해될 때까지 저어주고 9M NaOH로 9.5-1로 pH를 조정합니다. 흄 후드의 교반 플레이트에서 붕산염 완충액 100mL를 40°C로 가열합니다. 0.2 g NaBH4 를 넣고 빛으로부터 보호하면서 15-30 분 동안 저어줍니다.
알림: 수소화붕소 용액은 어두운 곳에서 실온에서 몇 주 동안 보관할 수 있습니다. 임계 단계: 붕산염 완충액에 NaBH4 를 추가할 때 가스가 형성되므로 흄 후드 내부에서 이 단계를 수행합니다. 폭발로 이어질 수 있으므로 단단히 밀봉된 용기에서 이 단계를 수행하지 마십시오. - 자가형광 감소를 위해 충분한 배양을 한 후(≥ 3일) 냉동실에서 조직을 꺼내 과도한 동결 보호제 저장 완충액을 제거하고 실온(RT)에서 40rpm으로 진탕하면서 PB 완충액으로 각각 10분 동안 조직을 3회 세척합니다.
- 약 20mL의 산화된 아가로스 현탁액(1단계에서 준비)을 전자레인지(700W에서 ~30초 동안)에 녹이고, 처리할 수 있을 만큼 충분히 냉각(~45°C)한 다음 플라스틱 틀에 붓습니다.
참고: 중요 단계: 전자레인지에서 가열한 후 바로 아가로스를 추가하지 마십시오.ample, 조직을 파괴할 수 있습니다. - 핀셋을 사용하여 조직을 부드럽게 집어 올려 아가로스의 하단 중앙에 빠르게 삽입합니다. 아가로스가 중합될 수 있도록 상온에서 15분 동안 금형을 배양합니다.
- 아가로스 중합 후 네 모서리에서 메스로 플라스틱 몰드를 열고 장갑을 낀 손가락으로 아가로스 큐브를 조심스럽게 집어 올립니다.
- 4 ° C에서 2-3 시간 동안 샘플을 붕소 수화물 용액 (2 단계에서 준비)에 담그어 산화 된 아가로스와 조직의 가교를 시작합니다. 이렇게 하면 절편 중에 조직이 분리되는 것을 방지할 수 있습니다.
참고: 중요 단계: 수소화붕소에 담근 샘플은 4°C에서 빛으로부터 보호하여 배양해야 합니다. - 아가로스 큐브를 PB 버퍼로 2번 10분 동안 세척합니다. 조직이 위쪽에 오도록 아가로스 큐브를 돌리고 순간 접착제 몇 방울을 사용하여 블록을 자기 슬라이드(뒷면에 부착된 두 개의 자석이 있는 현미경 슬라이드)에 부착합니다. 접착제가 응고되는 데 10-20분이 걸리므로 PB 완충액 방울이 있는 종이 티슈를 아가로스 위에 올려 샘플이 전체적으로 적절하게 수분을 유지하도록 합니다(그림 1C).
3. 마이크로톰의 준비 및 무대 설정
- 단층 촬영기의 샘플 상자 중앙에 있는 금속에 자기 슬라이드를 놓습니다.
- 상자에 PB 버퍼를 채우고 s에 조심스럽게 놓습니다.tage 그리고 왼쪽의 나사를 조여 sample 상자를 s에 고정합니다.tag단층 촬영기의 e.
알림: 나사를 과도하게 조이지 마십시오. 그렇지 않으면 플라스틱 상자가 손상됩니다. - 칼날을 마이크로톰에 놓고 샘플의 위치를 마이크로톰 근처와 아래로 조심스럽게 이동합니다. 아가로스의 상부 표면은 마이크로톰의 잎과 같은 높이에 있어야 합니다.
알림: 너무 낮게 배치하면 절단 시간이 낭비되고 너무 높게 배치하면 첫 번째 절단에서 블록의 큰 덩어리가 제거됩니다. - 스테이지를 이동하여 아가로스 큐브를 대물렌즈 중앙에 배치하고 전체 아가로스 큐브의 온전한 조각을 얻을 때까지 단층 촬영 소프트웨어에서 슬라이스 버튼을 반복해서 클릭합니다.
4. 표면 할당 및 2D 이미지 획득
- 대물 렌즈를 x 및 y 방향으로 조직 샘플의 중앙에 놓습니다.
- 레이저 소프트웨어를 열고 소프트웨어에서 레이저를 켭니다. 째깍째깍 소리가 들리면 레이저 스위치를 켜고 파장을 800nm로 조정합니다.
알림: 레이저 소스는 이미징하기 전에 최소 30분, 이상적으로는 1시간 동안 예열해야 합니다. - 현미경의 캐비닛 도어를 닫고 실내의 모든 광원을 끈 다음 PMT를 켜고 전압을 750V로 설정합니다.
알림: 중요 단계: PMT는 빛에 매우 민감하므로 캐비닛 도어를 닫고 방의 모든 광원을 끄지 않는 한 꺼두십시오. - 설명된 대로 단층 촬영 소프트웨어의 프로토콜 설정을 조정하고 현미경 셔터를 자동으로 설정하고 볼륨을 설정합니다.tage는 V20 및 V3에 대해 각각 1 및 2로 설정합니다.
- 단층 촬영 소프트웨어에서 2D 버튼을 클릭하여 샘플의 스냅을 캡처합니다.
- 가시적인 자가형광이 있는 이미지가 나타나면 z-피에조를 조정하여 아가로스 큐브 표면의 초점면을 설정합니다. 첫 번째 스캔은 샘플의 안정적인 이미지를 얻기 위해 표면 아래 20μm에서 이루어집니다.
- 자가형광 배경이 보이지 않으면 신호가 나타날 때까지 대비를 높입니다. 눈에 보이는 신호가 없는 경우(즉, 조직 상단의 아가로스로 인해)가 발생할 수 있습니다. 이 경우 z-piezo 장치를 사용하여 agarose 표면에 도달할 때까지 z축을 조정합니다. 원하는 위치가 z-piezo 장치의 범위를 벗어나는 경우 렌즈의 수동 이동이 필요할 수 있습니다.
- 샘플 표면을 찾은 후 여러 개의 50μm 슬라이스를 절단하고 모든 절단 후 2D 이미지를 획득하여 초점면이 블록 면 표면에 올바르게 설정되었는지 확인합니다.
5. 샘플의 가장자리를 찾고 레이저를 시작점으로 설정
- 레이저 스캔 영역의 xy 좌표(4개의 모서리 좌표)를 기반으로 주변 아가로스 블록의 이미징을 최소화하면서 이미징 영역을 조직에 국한시킵니다.
- PMT를 끄고 레이저 파장을 800nm로 설정한 다음 레이저 셔터를 전환하여 엽니다. 아가로스 블록으로 들어오는 레이저 광의 위치는 산란광의 적색 점으로 볼 수 있습니다(그림 2A,B).
중요 단계: 클래스 4 레이저를 특히 주의하십시오. 인체 조직과 눈을 빠르게 손상시킬 수 있습니다. 직원은 이러한 기기를 안전하게 작동하기 위해 특별한 교육이 필요합니다. - 스테이지를 이동하면서 레이저 스폿을 사용하여 뒤, 오른쪽, 앞, 왼쪽 순서를 사용하여 조직 가장자리의 좌표를 찾습니다.
- 좌표를 다시 확인하고 조직 이미징의 기본 시작점인 오른쪽 전면 모서리에 레이저 스폿을 배치합니다.
- 콘솔 창의 좌표를 xy-steps로 정의되는 기계가 인식할 수 있는 블록 크기로 변환합니다. 이러한 단계 측정값을 소프트웨어 프로토콜에 입력합니다. 캐비닛 도어를 닫습니다.
6. 3D 스캐닝 / 절편
- 파장을 940nm로 바꾸어 GFP, mWasabi, YPet, PE를 자극합니다.
알림: 레이저는 이 파장에서 사람의 눈에는 보이지 않습니다. GFP, mWasabi 및 TIMERbac의 녹색 발광 구성 요소에 대한 신호-배경을 향상시키려면 PMT 510 앞에 협대역 통과 필터 20/2nm를 배치합니다. 이는 녹색-노란색 조직 자가형광에 의한 간섭을 줄입니다. - 현미경 셔터를 자동 모드로 전환하고 셔터 전압 설정을 V1의 경우 20, V2의 경우 1.71로 설정합니다.
- 소프트웨어에서 다음 세 가지 매개변수를 조정하십시오. 단면 두께 - 대부분의 경우 50μm로 설정합니다. 간의 경우 이미징 깊이가 제한되어 있으므로 30μm로 설정합니다. 물리적 단면의 수 - 이것은 이미징될 총 조직 깊이를 결정하고 그에 따라 설정됩니다. 각 섹션에 대해 캡처할 평면의 수 - 이것은 z 해상도를 결정합니다. 대부분의 경우 5개의 평면(10μm 수직 해상도 생성)을 사용합니다. 간을 위해 3개 이하의 비행기를 사용하십시오.
- 레이저 게인을 설정합니다. 이는 다양한 조직과 스캐닝 깊이에 대해 경험적으로 테스트해야 합니다.
- 획득한 이미지를 저장할 폴더 경로와 이름을 정의하고 이미징 메타파일에 대한 적절한 정보를 제공합니다.
- 입력한 모든 값을 다시 확인합니다.
- 3D 모자이크 설정을 클릭하여 스캐닝 프로세스를 시작합니다(그림 1D).
- 이미징이 완료된 후 물 탱크에서 조직 절편을 조심스럽게 수집하고 나중에 사용할 때까지 -20°C의 보관 버퍼에 보관합니다(그림 1E; 그림 2C,D).
7. 이미지 처리 및 데이터 분석
- https://github.com/BumannLab/Li_BumannLab_2020 에서 Linux 컴퓨터에 MATLAB 스크립트를 다운로드합니다. 스크립트를 폴더(예: /home/user/Program/)에 복사합니다.
참고: 스크립트가 완전히 작동하려면 MATLAB 및 Fiji(또는 ImageJ)용 Computer Vision Toolbox 애드온이 Linux 컴퓨터에 설치되어 있어야 합니다. - 아래 설명된 대로 타일 이미지를 스티치합니다.
- 단층 촬영 서버에서 Linux 컴퓨터로 데이터를 전송합니다.
- MATLAB 스크립트 StepOneStitchingAndArchive.m을 열고 원시 데이터가 포함된 소스 폴더를 찾습니다. 스크립트에서 원본 및 대상 폴더를 정의합니다.
- 편집기 탭으로 전환하고 실행을 클릭합니다. 진행률 정보가 명령 창에 표시됩니다. 이 처리에는 모자이크 파일에서 정보 읽기, 이미지 스티칭 전에 타일 인덱스 생성, Cidre22 (그림 3)를 사용한 배경 조명 보정, 서로 다른 깊이에서 획득한 광학 레이어 간의 조명 보정이 포함됩니다. 원본 폴더의 stitchedImages_100이라는 하위 폴더에서 스티칭된 이미지를 찾습니다. tar 명령을 사용하여 장기 저장을 위해 원시 데이터를 압축하고 파일 이름 확장자가 tar.bz2인 단일 파일로 저장합니다(그림 1F).
- 서포트 벡터 머신(support vector machine)을 사용하여 모델 훈련 및 분할을 수행합니다. 서포트 벡터 머신을 훈련시키고 분할을 수행하려면 아래 단계를 따르십시오.
참고: 3개의 형광 채널 각각에 대한 스티칭된 이미지는 stitchedImages_100의 3개의 하위 폴더(빨간색, 주황색 및 녹색 형광에 해당하는 1, 2 및 3)에 저장됩니다. 각 하위 폴더에는 동일한 채널의 모든 스티칭된 이미지가 포함되어 있습니다.- 스티칭된 이미지를 미리 봅니다. Fiji(또는 ImageJ)가 있는 각 하위 폴더에서 동일한 파일 이름으로 하나의 이미지를 엽니다. 세 개의 채널을 하나의 컬러 이미지로 병합합니다. 박테리아 및 조직 자가형광에서 명확한 신호가 보일 때까지 각 채널의 밝기를 조정합니다. 다음 단계에서 각 채널의 조정된 최대 강도 수준을 확인합니다.
- MATLAB 스크립트 StepTwoSegmentationAndAnalysis.m을 열고 소스로 이동합니다. 훈련을 위한 원본 폴더와 이미지 이름을 정의합니다. 예를 들어
소스 D = '/' ;
red_name = [소스 D '1/section_020_01.tif']; green_name = [소스 D '2/section_020_01.tif'];
blue_name = [소스 D '3/section_020_01.tif']; - Editor 탭으로 이동하여 Run을 클릭합니다.
- 색상 임계값을 묻는 대화 상자가 나타나면 Fiji와의 이전 수동 확인(단계 7.3.1)에 따라 채웁니다.
- 대화 상자에 따라 배경과 관심 영역(예: 박테리아)에 대한 영역을 선택합니다. 모델이 얼마나 잘 훈련되었는지 보여주고 더 많은 영역을 추가해야 하는지 묻는 그래프가 나타납니다. 박테리아가 명확하게 분할될 수 있을 때까지 더 많은 관심 영역과 배경을 추가합니다(그림 4A,B).
- 모델의 이름을 지정하고 저장합니다. 스크립트는 자동으로 이미지를 로드하고 중앙값 필터(반경 2픽셀)를 적용합니다.
- 세그멘테이션 프로세스가 자동으로 실행되고 진행률 정보가 명령 창에 표시됩니다. 세그멘테이션의 진행 상황을 확인합니다. 분할이 다른 스티칭된 이미지의 모델과 잘 작동하지 않는 경우 모델 훈련을 반복하여 더 많은 배경 및 박테리아 영역을 포함합니다.
- 세그멘테이션 결과를 보려면 Allpositions_filter3D.txt라는 파일을 확인합니다. 이 파일에는 각 박테리아 또는 박테리아 미세콜로니에 대한 무게 중심의 좌표와 해당 통합 형광 강도가 포함되어 있습니다(그림 1G).
- 아래 설명된 대로 컨볼루셔널 신경망을 사용하여 추가 아티팩트를 제거합니다.
참고: 일부 박테리아의 경우 Support Vector Machine을 사용한 간단한 분할에는 여전히 일부 이미징 아티팩트가 포함됩니다. 이것은 특히 YPet 발현 박테리아에 해당됩니다. 신경망 기반 세분화는 이러한 아티팩트를 효율적으로 제거할 수 있습니다(그림 4C). 스크립트가 완전히 작동하려면 MATLAB 및 Fiji(또는 ImageJ)용 Computer Vision Toolbox 애드온이 Windows 컴퓨터에 설치되어 있어야 합니다. 기본 신경망에 대한 자세한 내용은 https://ch.mathworks.com/help/deeplearning/ug/create-simple-deep-learning-network-for-classification.html 를 참조하십시오.- 이미지를 준비합니다. Fiji를 사용하여 밝기 조정이 다른 tif 파일을 jpg 파일로 변환합니다. 수동 큐레이션을 통해 최소 600개의 박테리아와 600개의 아티팩트를 식별하고 적절한 폴더에서 이러한 개체의 안전하게 자른 이미지를 식별합니다.
- MATLAB 스크립트 CNNtestV4.m을 열고 7.4.1단계의 객체 이미지가 포함된 소스 파일을 찾습니다.
- 학습을 위한 이미지 폴더를 정의합니다. 예를 들어
digitDatasetPath = 전체 파일 ('D:\20200602_CNN','fortrainingPixel12Folder2');
훈련시킬 영상의 개수를 정의합니다(예: numTrainFiles = 600). - Editor 탭으로 이동하여 Run을 클릭합니다. 훈련 후 CNN 모델 파일은 소스 폴더에 gregnet1.mat로 저장됩니다.
- 테스트 이미지가 있는 폴더를 정의합니다. 예를 들어
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp')입니다.
결과는 이미지 이름 및 박테리아 또는 아티팩트 분류에 대한 정보가 포함된 파일 YourFile.txt에 저장됩니다. - 테스트 이미지가 있는 폴더를 정의합니다. 예를 들어
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp')입니다.
결과는 이미지 이름과 박테리아 또는 아티팩트 분류에 대한 정보가 포함된 파일 YourFile.txt에 저장됩니다.
- 아래에 설명된 대로 단일 박테리아의 fluorescence intensity를 기반으로 micro-colonies의 크기를 추정합니다.
참고: 단층 촬영기의 공간 해상도는 조밀하게 밀집된 미세콜로니 내의 개별 박테리아 세포를 분해하기에 충분하지 않습니다. 그러나, 각 미세콜로니에서의 박테리아의 수는 단일 세균의 형광에 대한 미세콜로니의 총 형광에 기초하여 추정될 수 있다. 이 추정 정확도는 박테리아 집단 전반에 걸친 형광 강도의 균질성에 따라 달라집니다.- 단층촬영에서 채취한 절편의 면역조직화학을 사용하여 지질다당류와 같은 박테리아 성분을 염색함으로써 STP 단층촬영에서 GFP 양성 이벤트의 신원을 확인합니다(그림 1H; 그림 5).
- 최소 30개의 단일 박테리아를 식별하고 해당 세분화 결과에서 형광 강도를 검색합니다. 중간 강도 값을 단일 박테리아에 대한 참조로 활용합니다. 미세콜로니의 총 형광 강도를 단일 박테리아에 대한 참조 값으로 나누어 각 미세콜로니의 박테리아 수를 계산합니다(그림 1I).
- 아래 설명된 대로 시각화 소프트웨어를 사용하여 3D 재구성을 수행합니다.
- 이미지 준비
- 조직 캡슐, 동맥 및 섬유주를 포함한 유용한 해부학적 참조를 제공하는 콜라겐의 2차 조화 신호가 포함된 파란색 채널 이미지를 예로 들어 보겠습니다. 박테리아에 대해 분할된 이미지를 2차 채널로 사용합니다.
- 1st채널의 이미지를 x축과 y축 모두에서 10배로 비닝하고 축소된 이미지를 새 폴더에 저장합니다. 동일한 폴더 내에서 축소된 이미지를 3번 복제합니다. 새 반복실험의 이름은 동일한 시퀀스를 유지해야 합니다. 예: section_001_01.tif, 이름이 section_001_01-copy.tif, section_001_01-copy-copy.tif인 1을 복제합니다. 이 단계를 2번째 채널의 이미지에도 적용합니다. 크기를 줄이면 파일 크기를 보다 쉽게 관리할 수 있습니다. 트리플 이미지는 z축을 매끄럽게 합니다.
- 각 채널의 이미지를 병합하여 피지와 함께 이미지 스택을 형성합니다. 이미지 > 스택 > 도구 > 스택 정렬기 > 레이블 기준 정렬을 클릭합니다.
- 3D 필터링을 수행합니다. 3D 필터 > > 필터 처리를 클릭하고 Z 필터 크기를 6으로 설정합니다. 이미지 스택을 저장합니다.
- 아래 설명에 따라 3D 시각화를 수행합니다.
- Arena 보기에서 시각화 소프트웨어 패키지를 엽니다(기본 설정). 감시 폴더 아이콘을 사용하여 아레나 보기에 폴더를 추가합니다. *.ims 또는 *.tif 파일(7.6.1에서 준비됨)을 두 번 클릭하여 엽니다.
- Edit>Image Properties를 사용하여 디스플레이 조정 창에서 여러 채널의 색상 표현(LUT)을 조정합니다.
- Advanced( 고급 )를 클릭하여 최소/최대 값과 감마 보정 값을 수동으로 설정합니다.
채널 이름을 클릭하여 이름과 LUT를 변경합니다. - 이미지의 모양을 조정한 후 스냅샷 도구를 사용하여 현재 뷰를 내보냅니다.
- 애니메이션 아이콘을 사용하여 3D 데이터를 동영상으로 표현할 수 있습니다. 내비게이션 포인터를 사용하여 투시/뷰를 찾고 확대/축소하고 + 추가를 사용하여 키프레임을 추가합니다. 다른 위치로 이동하여 다음 키 프레임을 추가합니다. 빨간색 녹화 버튼을 눌러 동영상을 빌드합니다. 원하는 대상 폴더와 파일 형식에 저장합니다(그림 1J).
- 이미지 준비
결과
설명된 절차를 통해 비장, 간, 장간막 림프절 및 Peyer's patches11과 같은 전체 마우스 장기에서 개별 살모넬라 세포를 검출할 수 있습니다(그림 5 및 그림 6). 또한 쥐 뇌에서 Toxoplasma gondii 기생충을 검출합니다12. 간, Peyer's patches 및 비장을 포함한 일부 감염된 조직은 녹색-노란색 범위에서 상당한 자가형광을 방출합니다. 자가형광은 조직 구조를 보존하는 데 필요한 파라포름알데히드(paraformaldehyde)와의 고정에 의해 더욱 향상됩니다. 이 자가형광 배경에 대한 GFP, mWasabi 및 TIMERbac의 녹색 성분으로부터의 녹색 형광 검출은 광전자 증배관 2(녹색 방출을 수집함) 앞에 협대역통과 필터 510/20nm(대부분의 GFP 방출을 투과하지만 자가형광 스펙트럼의 많은 부분을 차단함)를 배치하고 고정 조직을 동결보호제11에 3일 이상 보관하여 조직 자가형광을 감소시킴으로써 개선됩니다. 그러나, 박테리아는 아직도 GFP 다른 형광 단백질의 세포 당 적어도 수천 개의 사본을 표현해야 합니다. 반면에, 독성 약화로 이어질 수 있는 피트니스 비용을 최소화하기 위해 과도한 형광 단백질 농도는 피해야 한다23.
조직 내 형광 박테리아의 정확한 분할은 이미징 후 검색된 조직 절편의 면역조직화학(immunohistochemistry)으로 확인할 수 있습니다. 특히, 지질다당류와 같은 박테리아 표면 성분에 대한 항체로 염색된 물체는 STP 단층 촬영으로 얻은 형광 이미지와 정렬할 수 있습니다(그림 5). 일부 염색된 살모넬라 세포에는 형광 단백질이 없어 컨포칼 현미경과 STP 단층 촬영 모두에서 형광을 검출할 수 있다는 점에 유의하는 것이 중요합니다. 이러한 세포는 단일 분류 세포의 유세포 분류 및 성장 배양에 의해 입증된 바와 같이 숙주 면역 체계에 의해 사멸된 살모넬라균이며, 한천 플레이트의 집락 형성 단위 수와 유세포 분석법에 의해 측정된 형광 살모넬라 세포 수 사이의 밀접한 상관 관계가 입증되었습니다24. 또한, 플라스미드 손실은 비형광 생존 세포를 초래할 수 있으며, 이는 플라스미드의 selection marker에 해당하는 적절한 항생제를 사용하거나 사용하지 않고 배지에 도금하여 테스트해야 합니다. pSC101 유래 플라스미드의 경우, in vivo 플라스미드 손실은 드뭅니다19. 11에서 사용된 sifB::gfp와 같은 대부분의 염색체 통합 발현 카세트의 경우, 생체 내에서 발현 손실을 감지할 수 없습니다. 분할이 면역조직화학 데이터와 일치하지 않는 경우 분할 파이프라인을 수정해야 합니다.
STP 단층 촬영의 해상도는 조밀하게 밀집된 미세콜로니 내의 개별 박테리아 세포를 해결하기에 충분하지 않습니다. 그러나 미세콜로니의 총 형광 강도는 살모넬라 세포의 수를 추정할 수 있습니다. 이를 위해서는 Salmonella sifB::gfp11과 같은 매우 균일한 형광 수준을 가진 형광 균주가 필요합니다. 모든 미세콜로니와 단일 세포에 대해 추정된 살모넬라 세포 수를 결합하면 조직 균질화합물의 도금 또는 유세포 분석과 같은 대체 방법과 일치하는 총 박테리아 조직 부하가 생성됩니다11. 도금과 유세포 분석은 STP 단층 촬영을 위해 관류 고정이 필요하기 때문에 동일한 조직에서 직접 수행할 수 없습니다. 대신, 고정되지 않은 추가 동물로 수행해야 합니다. 다양한 접근법에 의해 결정된 박테리아 부하의 중앙값이 3배 이상 다른 경우, 형광 박테리아의 생존력이 손상되거나(낮은 콜로니 형성 단위의 경우) 일부 박테리아가 형광 리포터 구조를 잃었을 수 있습니다(높은 콜로니 형성 단위의 경우). 이러한 불일치의 원인을 식별하기 위해 대조 실험이 필요합니다.
STP 단층 촬영은 감염된 조직의 3D 구조 내에서 박테리아 세포의 국소화를 제공합니다. 콜라겐의 두 번째 고조파 신호는 동맥 및 섬유주와 같은 해부학적 랜드마크를 제공합니다. 또한, 숙주 세포는 관류 전에 표면 마커에 항체를 주입하여 생체 내에서 염색할 수 있습니다(그림 5 및 그림 6). 이 염색은 조직 구획 및 염증 병소를 포함한 특정 미세환경에 대한 추가 랜드마크를 제공합니다(세포 내 마커 및 비장 백색 펄프 또는 뇌와 같은 확산 장벽이 있는 일부 구획은 쉽게 접근할 수 없어 생체 내 염색에 적합합니다). 이 접근법은 항균 화학요법 동안 살모넬라 균의 장기 생존을 가능하게 하는 조직 구획으로서의 비장 백색 펄프를 밝혀냈다11.
마지막으로, 중등도 또는 느린 속도로 복제되는 살모넬라균은 복제 속도11,15에 대한 단일 세포 리포터인 타이머bac를 발현하는 균주를 사용하여 조직의 3D 구조 내에서 식별하고 국소화할 수 있습니다.
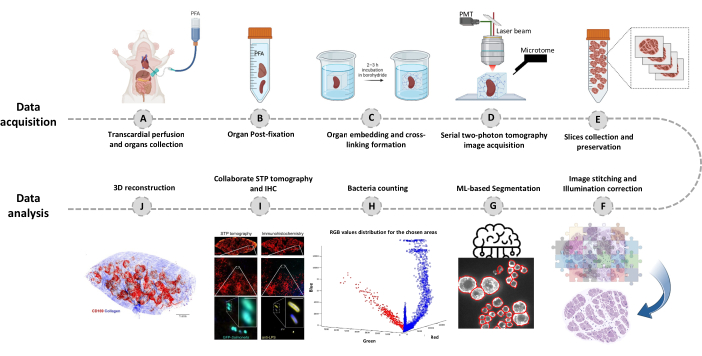
그림 1: 연속 이광자(STP) 단층 촬영을 사용한 전체 장기 이미징 절차. (A-B) 장기는 심내 관류 후 적출하고 4°C에서 4% 파라포름알데히드(PFA)에 밤새 보관합니다. (C-E) 장기를 산화된 아가로스에 매립하고 가교 결합한 다음 STP 단층 촬영을 사용하여 조직을 스캔하고 절단합니다. 절편은 후속 면역조직화학을 위해 수집됩니다. (에프제이 ) 박테리아 수를 정량화하고, 형광 박테리아를 확인하고, 박테리아 위치를 3D로 재구성하기 위한 컴퓨터 분석 파이프라인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 연속 이광자(STP) 단층 촬영 설정. (A) (B) 2광자 이미징과 (C) 자동 직렬 조직 절편을 통합한 단층계. (D) 후속 조사를 위해 수집된 조직 절편. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
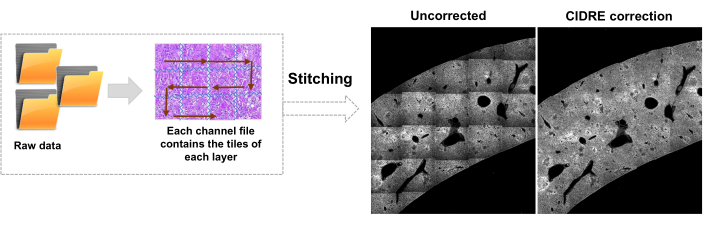
그림 3: 타일 스티칭 및 조명 보정. 타일은 스티칭되고 불균일한 조명은 CIDRE(Regularized Energy Minimization)를 사용하여 수정된 강도 분포를 사용하여 수정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
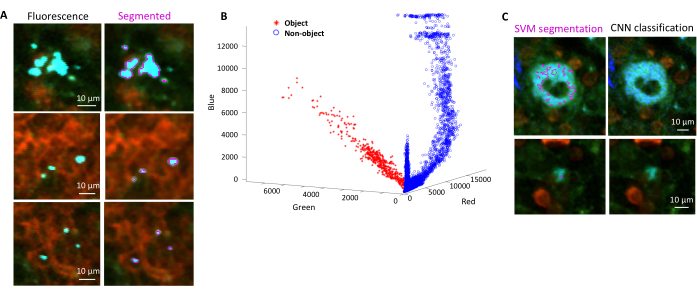
그림 4: SVM(Support Vector Machine) 및 CNN(Convolutional Neural Network)을 사용하여 녹색 형광 단백질(GFP)을 발현하는 살모넬라 균의 세분화. (A) SVM으로 분할된 GFP 물체의 대표 이미지(왼쪽)와 SVM으로 분할된 영역이 있는 해당 이미지(오른쪽)(스케일 바: 10μm). (B) 세분화된 지역에 대한 클러스터된 RGB(Red-Green-Blue) 값 분포. (C) SVM에 의해 박테리아로 잘못 식별된 비 GFP 물체의 대표 이미지(왼쪽). CNN은 이를 배경으로 정확하게 기각합니다(오른쪽, 눈금자: 10μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
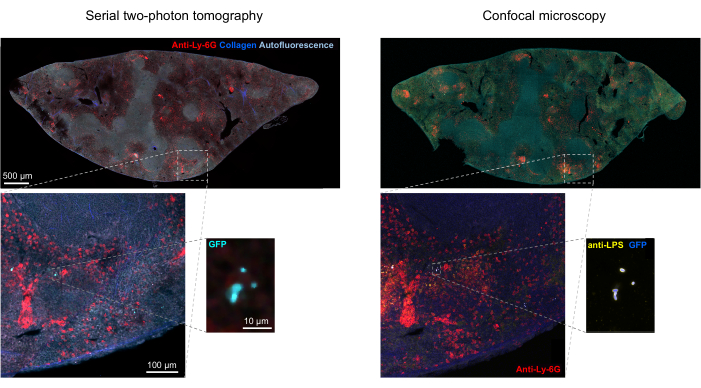
그림 5: 단층 촬영에 의한 녹색 형광 단백질(GFP)을 발현하는 살모넬라 균 검출 및 면역조직화학에 의한 확인. 살모넬라 지질다당류(Salmonella lipopolysaccharide)에 대한 항체로 염색한 후 단층 촬영(왼쪽) 또는 컨포칼 현미경으로 획득한 동일한 단면의 이미지(오른쪽). 호중구(빨간색)는 관류 전에 PE 표지된 항-Ly-6G 항체의 생체 내 주입으로 염색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
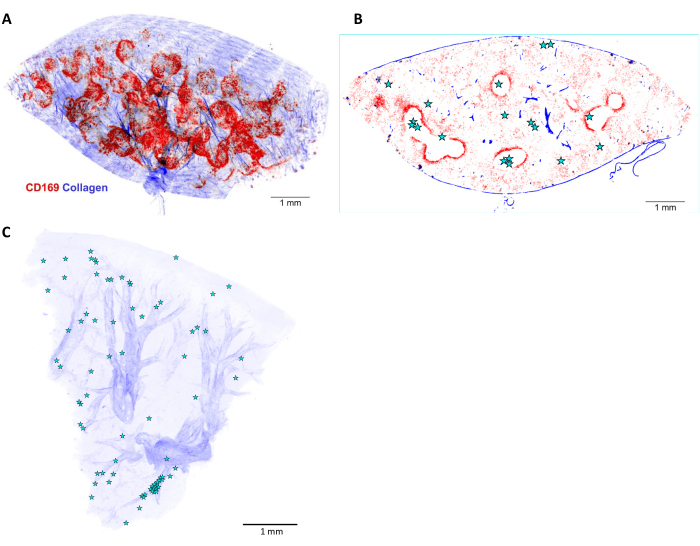
그림 6: 감염된 쥐 비장에서 살모넬라균 의 3D 재구성 및 국소화. (A) 5mm 두께의 비장 절편을 3차원(3D) 재구성하고 항-CD169 항체(빨간색)로 관류 전에 생체 내에서 염색합니다. 파란색 신호는 2차 고조파에 의해 감지된 콜라겐을 나타냅니다. (B) (A)에 표시된 3D 스택의 광학 평면 1개. 살모넬라 세포 또는 미세 식민지의 위치는 별표로 표시됩니다. (C) 감염된 간에서 살모넬라균 위치(별)의 3D 재구성. 동맥은 콜라겐 덮개(파란색)를 기준으로 볼 수 있습니다. 눈금 막대: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
세균 병원체의 국소 조직 맥락은 국소 숙주 공격, 세균 적응, 숙주 병원체 상호 작용 및 항균 화학 요법의 국소적 결과, 전체 질병 결과에 대한 개별 기여도를 결정하는 데 중요합니다. 센티미터 크기의 장기에서 마이크로미터 크기의 박테리아를 이미징하는 것은 어려운 일이었습니다. 연속 이광자(STP) 단층 촬영은 전체 장기에서 개별 박테리아 세포를 검출할 수 있는 충분한 공간 해상도, 자동화된 절편 및 이미징, 충분한 처리량(하루에 ~1개의 장기)을 제공합니다11. 숙주 항원은 in vivo에서 염색할 수 있지만, 병원체 세포는 세포 내 병원체 세포를 종합적으로 검출할 수 있도록 적절한 형광 단백질을 발현해야 합니다. 결과 데이터 세트(장기당 0.5-1.5테라바이트)는 데이터 분석 및 저장을 위한 IT 인프라에 상당한 문제를 제기합니다.
이 방법에는 몇 가지 중요한 단계가 있습니다. 첫째, 형광 단백질 GFP 또는 YFP의 검출 가능하고 균일한 발현을 가진 병원체 균주가 필요합니다. 이상적으로는, 염색체 발현 카세트(25 )를 사용하여 플라스미드 복제수 변이로 인한 형광 이질성을 최소화합니다. 충분한 형광 강도가 필요하지만 병원체(23)의 체력 장애를 피하기 위해 과도한 수준의 형광 단백질은 피해야 한다. 적절한 발현 수준은 적절한 프로모터의 선택 및 리보솜 결합 부위(25 ) 또는 전체 5' 번역되지 않은 영역(UTR)(26)의 미세 조정에 의해 얻어질 수 있다. 둘째, 관류 고정에는 혈액 순환에서 가능한 한 많은 적혈구를 제거하기 위해 완충액으로 초기 세척이 포함되어야 합니다. 이는 비장과 간에 특히 중요합니다(이러한 기관에서 적혈구를 완전히 제거하는 것은 어렵지만). 나머지 적혈구는 스펙트럼의 가시광선 부분에서 빛을 흡수하여 이미징 품질을 저하시킨다27. 셋째, 동결보호제에 고정된 조직을 보관하는 것은 염증 조직에서 특히 높고 병원체 세포의 상대적으로 약한 형광을 가려줄 수 있는 조직 자가형광을 줄이는 데 중요하다11. 넷째, 조직을 주변 아가로스 블록과 효과적으로 가교하는 것은 조직이 아가로스 블록에서 튀어나오지 않고 부드러운 비브라톰 절단에 중요합니다. 다섯째, 형광 신호와 병원체 세포로서의 식별은 병원체 성분에 대한 항체(예: 그람 음성 세균에 대한 지질다당류)로 염색하고 단층검사에서 검색한 절편의 컨포칼 현미경과 같은 직교 접근법을 사용하여 독립적으로 검증해야 합니다11. 일부 감염된 조직에는 병원체 세포로 쉽게 오인될 수 있는 유사한 모양과 겹치는 형광 스펙트럼을 가진 자가형광 입자가 포함되어 있습니다. 여섯째, 미세콜로니 내 병원체 세포의 양을 공초점 현미경과 같은 직교 접근법과 비교하여 정확도를 평가해야 합니다. 이러한 계산을 기반으로 한 전체 박테리아 부하는 유세포 분석 및 도금과 같은 직교 접근법과 비교하여 검증해야 합니다.
널리 사용되는 STP 프로토콜의 중요한 수정 사항에는 감염 및 염증이 있는 간, 비장 및 Peyer's patch에서 특히 강한 녹색-노란색 자가형광의 간섭을 줄이기 위해 광전자 증배관 211 앞에 협대역 통과 필터 510/20nm를 배치하는 것이 포함됩니다. 뇌(STP의 다른 응용 분야를 지배함)에 비해 이러한 장기의 강력한 자가형광 및 증가된 광 산란은 또한 불균일한 조명에 대한 보다 효과적인 보정이 필요합니다. 또 다른 수정 사항으로, 이 프로토콜은 이러한 목적을 위해 CIDRE 접근법22 (그림 3)와 박테리아의 AI 기반 세분화를 사용합니다. 마지막으로, -20°C에서 동결보호제에 배양 단계를 포함하여 조직 자가형광을 감소시켜 상대적으로 형광이 약한 작은 병원체 세포의 검출을 용이하게 함으로써 조직 전처리를 변경했습니다11.
병원체 신호를 감지할 수 없거나 세분화로 인해 감도가 충분하지 않거나(너무 많은 병원체 세포가 누락됨) 정밀도가 충분하지 않는(너무 많은 배경 입자가 병원체 세포로 분할됨) 문제 해결이 필요할 수 있습니다. 배경 조직 자가형광을 검출할 수 있지만 병원체 신호가 너무 적으면 병원체에 형광 단백질이 충분하지 않을 수 있습니다. 이는 동일한 감염된 조직의 조직 절편을 컨포칼 현미경으로 검사하거나 조직 균질체19,28의 유세포 분석을 사용하여 테스트할 수 있습니다. 근본적인 원인은 불충분한 발현 수준 또는 익스프레션 카세트의 불안정성일 수 있습니다. 완화 전략에는 발현을 유도하는 대체 프로모터, 병원체 종에 대한 형광 단백질을 암호화하는 유전자의 코돈 적응, 복제 수가 더 높은 에피솜 구조체의 사용, 염색체 통합 또는 균형 치사 보완에 의한 발현 카세트의 안정화가 포함될 수 있습니다29. 형광 단백질의 선택도 중요하지만 GFP.mut2, mWasabi, YPet 및 TIMERbac으로 검출이 가능합니다. 분할이 정확하지 않은 경우, 이는 위에서 설명한 대로 해결할 수 있는 너무 약한 병원체 형광 또는 너무 높은 조직 자가형광 배경이 원인일 수 있습니다. 세척 용액을 광범위하게 관류하거나 아가로스 블록 및 단층 촬영에 삽입하기 직전에 저장 완충액에서 장기간 배양하면 이러한 문제를 해결할 수 있습니다. 마지막으로, 정확한 분류를 위해서는 신경망에 대한 충분한 훈련이 필요하지만, 과도한 훈련은 새로운 샘플에 대한 성능을 저하시키는 과적합으로 이어질 수 있습니다.
현재 다른 어떤 방법도 개별 박테리아를 검출하기 위해 3D로 충분한 공간 해상도로 전체 장기를 이미지화할 수 없습니다. 조직 투명화 및 광시트 현미경 검사의 향후 개선으로 유사한 해상도를 달성할 수 있습니다. 이를 통해 더 빠른 속도와 더 많은 형광 채널로 이미징할 수 있습니다.
STP의 중요한 제한 사항은 ~0.5 μm의 평면 내 픽셀 해상도와 5 - 10 μm의 수직 해상도로, 예를 들어 조밀하게 밀집된 미세콜로니 내에 밀접하게 위치한 박테리아를 해결하기에는 충분하지 않습니다. 그러나 선택한 조직 부분의 2차 고해상도 컨포칼 현미경 검사를 위해 단층 촬영 후 조직 절편을 회수할 수 있습니다. STP의 또 다른 한계는 3개의 형광 채널만 사용할 수 있다는 것인데, 이는 동시에 이미징할 수 있는 형광단의 수를 제한합니다. 다시 말하지만, 멀티플렉싱 방법을 사용하여 검색된 조직 절편의 2차 분석은 선택한 조직 부분에 대한 더 많은 마커의 위치와 강도를 밝힐 수 있습니다. 이 정보는 STP로 결정된 대로 주변 조직의 전체 3D 구조에 통합될 수 있습니다.
결론적으로, 이 프로토콜은 국소 및 전체 장기 수준에서 숙주-병원체 상호 작용에 대한 자세한 조사를 가능하게 합니다. 프로토콜은 다른 병원체(형광 균주로 얻을 수 있는 경우), 다른 장기 및 다른 숙주 종에 쉽게 적용할 수 있어야 합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 스위스 국립과학재단(Swiss National Science Foundation) 310030_156818, 310030_182315 및 NCCR_ 180541 AntiResist(to DB)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose Low Melt | Roth | Art. 6351.5 25g | |
| Boric acid | Sigma-Aldrich | 6768-500G | |
| Instant adhesive Loctite 435 | Henkel | ||
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Poly(ethylene glycol) | Sigma-Aldrich | P5413-1kg | |
| Polyvinylpyrrolidone | Sigma-Aldrich | PVP-100G | |
| Sodium borohydride | Sigma-Aldrich | 71321-25g | |
| Sodium hydroxide | Merck | 106453 | |
| Sodium periodate | Sigma-Aldrich | 311448-100G | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640-250G | |
| Sodium phosphate monobasic dihydrate | Sigma-Aldrich | 71500-1KG | |
| Sodium tetraborate | Sigma-Aldrich | 221732-100g | |
| Sucrose | AppliChem | A4734,1000 | |
| Tris-buffered saline (TBS) | Merck | T5912-1L | |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Vacuum filtration 500 | TPP | TPP99250 | |
| Equipment | |||
| Blade | Campden Instruments Limited | 01-01-4692 | |
| MAITAI Laser | Spectra-Physics | ||
| Peel away plastic mold | Sigma-Aldrich | E6032-1CS | |
| TissueCyte 1000 tomograph | TissueVision | ||
| Antibody/dyes | |||
| DAPI | Merck | D9542-5MG | |
| Primary antibodies | |||
| anti-LPS Salmonella, rabbit | Sifin | REF TS 1624 | |
| anti-CD169-PE, clone 3D6.112 | Biolegend | 142403 | |
| anti-Ly-6G-PE, clone 1A8 | Biolegend | 127608 | |
| Secondary antibodies | Invitrogen | ||
| chicken anti-rabbit Alexa 647 | Invitrogen | A-21443 | |
| Software | Company | Version | |
| Fiji | Image J | 1.54g or later | |
| MATLAB | MathWorks | 2017b/2018b or later | |
| Orchestrator (tomograph) | TissueVision | ||
| Visualization software Imaris | Oxford Instruments | 9.9.0 or later |
참고문헌
- Bjarnsholt, T., et al. The importance of understanding the infectious microenvironment. Lancet Infect Dis. 22 (3), e88-e92 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Bumann, D., Cunrath, O. Heterogeneity of Salmonella-host interactions in infected host tissues. Curr Opin Microbiol. 39, 57-63 (2017).
- Hofmann, J., Keppler, S. J. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 134 (15), jcs258494(2021).
- Blain, R., et al. A tridimensional atlas of the developing human head. Cell. 186 (26), 5910-5924.e17 (2023).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Meth. 9 (3), 255-258 (2012).
- Oh, S. W., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Kim, Y., et al. Brain-wide maps reveal stereotyped cell-type-based cortical architecture and subcortical sexual dimorphism. Cell. 171 (2), 456-469.e422 (2017).
- Matho, K. S., et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature. 598 (7879), 182-187 (2021).
- Muñoz-Castañeda, R., et al. Cellular anatomy of the mouse primary motor cortex. Nature. 598 (7879), 159-166 (2021).
- Li, J., et al. Tissue compartmentalization enables Salmonella persistence during chemotherapy. Proc Natl Acad Sci U S A. 118 (51), e2113951118(2021).
- Dogga, S. K., et al. Importance of aspartyl protease 5 in the establishment of the intracellular niche during acute and chronic infection of Toxoplasma gondii. Mol Microbiol. 118 (6), 601-622 (2022).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec No), 33-38 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Claudi, B., et al. Phenotypic variation of Salmonella in host tissues delays eradication by antimicrobial chemotherapy. Cell. 158 (4), 722-733 (2014).
- Ai, H. W., Olenych, S. G., Wong, P., Davidson, M. W., Campbell, R. E. Hue-shifted monomeric variants of Clavularia cyan fluorescent protein: identification of the molecular determinants of color and applications in fluorescence imaging. BMC Biol. 6, 13(2008).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nat Methods. 8 (5), 393-399 (2011).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Burton, N. A., et al. Disparate impact of oxidative host defenses determines the fate of Salmonella during systemic infection in mice. Cell Host&Microbe. 15 (1), 72-83 (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- de Olmos, J., Hardy, H., Heimer, L. The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study. J Comp Neurol. 181 (2), 213-244 (1978).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nat Methods. 12 (5), 404-406 (2015).
- Wendland, M., Bumann, D. Optimization of GFP levels for analyzing Salmonella gene expression during an infection. FEBS Lett. 521 (1-3), 105-108 (2002).
- Barat, S., et al. Immunity to intracellular Salmonella depends on surface-associated antigens. PLoS Pathog. 8 (10), e1002966(2012).
- Rollenhagen, C., Sorensen, M., Rizos, K., Hurvitz, R., Bumann, D. Antigen selection based on expression levels during infection facilitates vaccine development for an intracellular pathogen. Proc Natl Acad Sci U S A. 101 (23), 8739-8744 (2004).
- Chen, F., Cocaign-Bousquet, M., Girbal, L., Nouaille, S. 5'UTR sequences influence protein levels in Escherichia coli by regulating translation initiation and mRNA stability. Front Microbiol. 13, 1088941(2022).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Bumann, D. Examination of Salmonella gene expression in an infected mammalian host using the green fluorescent protein and two-colour flow cytometry. Mol.Microbiol. 43 (5), 1269-1283 (2002).
- Nakayama, K., Kelly, S. M., Curtiss III, R. J. B. t Construction of an Asd+ expression-cloning vector: stable maintenance and high level expression of cloned genes in a Salmonella. vaccine strain. 6 (6), 693-697 (1988).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유