Method Article
微生物感染的高分辨率三维全器官断层扫描
摘要
在这里,我们描述了一种程序,该程序能够在感染期间在器官范围内检测致病菌并量化荧光报告基因活动。
摘要
大多数感染发生在三维宿主组织内,具有复杂的解剖结构和局部变化的宿主生理学。病原体细胞在这种多样化环境中的位置显着影响它们的压力水平、反应、命运以及对疾病整体进展和治疗失败的贡献。然而,由于在厘米大小的宿主器官中定位微米大小的病原体细胞的技术困难,这一研究领域一直相对未被探索。在这里,我们提出了一种应对这一挑战的方法。我们采用串行双光子断层扫描和 AI 增强图像分析来定位感染小鼠的整个脾脏、肝叶和整个淋巴结中的单个 沙门氏菌 细胞。使用荧光报告基因和 体内 抗体给药,可以确定单个 沙门氏菌 细胞的复制率、它们与特定免疫细胞的局部相互作用以及细菌对抗生素的反应。这些方法为在三维组织背景下全面检查感染、预防和治疗开辟了途径。
引言
感染发生在具有复杂解剖结构和分隔生理学的组织中。在感染组织中共存的多种微环境可以决定局部病原体亚群的命运及其对整体疾病结果的贡献1,2,3。然而,对厘米大小的组织中微生物病原体进行全面的 3D 成像仍然具有挑战性4.大脑和其他器官的成像是一个非常活跃的研究领域,实验策略不断改进5,但许多方法仍然缺乏自信地识别 μm 大小的细菌病原体所需的亚微米分辨率。相比之下,串行双光子 (STP) 断层扫描6 能够以亚微米的平面内分辨率对整个组织进行自动化多色、无变形成像,从而产生完整的体积数据集。该方法将使用振动切片机对组织进行重复物理切片与红外光对出现的块状面进行间歇性双光子成像相结合。STP断层扫描已广泛用于绘制大脑中的细轴突以建立连接图7,8,9,10。
STP 断层扫描还可以使用断层扫描仪对整个感染组织中的单个微生物病原体细胞(沙门氏菌、弓形虫)进行 3D 映射11,12。二次谐波生成揭示了动脉周围和纤维带(如脾小梁)中的胶原鞘,从而提供了解剖学背景。体内注射的荧光抗体可用于对宿主细胞进行染色,以揭示单个病原体细胞与浸润免疫细胞(如中性粒细胞)之间的相互作用。在这里,描述了涉及组织处理、成像、使用照明校正拼接成像瓦片、三维图像堆叠以及使用机器学习工具进行分割的流程。该管道可生成单个病原体、细胞和微菌落在其宿主环境中的 3D 位置。由于分辨率的限制,计算微菌落内单个细胞的数量仍然很困难,但可以根据微菌落的积分亮度来估计这些数字。如果有表达GFP或YFP的重组病原体,该管道可以很容易地适应其他感染模型。
研究方案
此处描述的所有动物实验均已获得当局的批准(许可证 2239,巴塞尔州兽医局)并遵循当地指南(巴塞尔 Tierschutz-Verordnung)和瑞士动物保护法 (Tierschutz-Gesetz)。
1.感染组织的制备和储存
- 使用所选的感染模型。在这里,10至16周龄的男女小鼠通过静脉注射感染~1,000菌落形成单位(CFU)或通过胃内给药用圆尖针头感染5 x 107 CFU。合适的小鼠品系包括 BALB/c 和 C57BL/6。
注意:相同的方法可以很容易地适用于其他宿主物种。 - 确保病原体表达荧光蛋白,以便在未染色的组织中进行鉴定。表达 GFP.mut213、YPet14、TIMERbac15 或 mWasabi16 的病原体都可以使用 940 nm 激发17 进行可视化。表达 mCherry18 的沙门氏菌水平可通过流式细胞术19 轻松检测,可以使用 800 nm 激发成像,但在感染的脾脏和肝脏中信噪比较差,表现出大量的自发荧光。
- 使用流式细胞术定量分析,确保所有荧光蛋白在中性 pH 下用多聚甲醛固定后保持其荧光强度的 >70%。在这里,使用感染的小鼠组织,即脾脏、肝脏、淋巴结和 Peyer 斑块。
- 通过在灌注前 10 分钟注射藻红蛋白 (PE) 标记的抗体 在体内 染色宿主细胞表面标志物。为了对中性粒细胞进行染色,在 100 μL PBS 中静脉注射 4 μg 抗 Ly-6G-PE。为了对脾脏中的边缘区巨噬细胞进行染色,在100μL的PBS中注射4μg抗CD169-PE(参见 材料表)。
- 通过标准经心灌注20用15mL冰冷的50mM磷酸盐缓冲液(PB;10mM NaH2PO 4,40mMNa2HPO 4,pH 7.4)固定感染组织,然后在PB中加入35mL 4%多聚甲醛(PFA;固定剂)(图1A)。
- 简而言之,通过腹膜内注射 100 mg/kg 氯胺酮和 16 mg/kg 甲苯噻嗪对感染动物进行深度麻醉。通过确认脚趾捏反射丧失来确保适当的麻醉。
- 使用 70% 乙醇对毛皮进行消毒,用无菌纸巾擦干,然后用镊子和剪刀手术打开胸部。将一根无菌针头放在心脏的左心室中,用无菌剪刀打开右心房,然后使用泵将第一个缓冲液和固定剂穿过针头、左心室和整个血管系统。这可以快速均匀地固定所有组织,并导致安乐死。
- 灌注后收集组织,将其在PB缓冲液中的20x体积的4%冷多聚甲醛中孵育,并将其置于4°C的振荡器上过夜(图1B)。成像可用于 0.05 至 2 cm3 大小范围的组织。对于较大的组织,切成合适的块。
- 第二天,用PB缓冲液洗涤组织3次,每次10分钟,在室温下以40rpm振荡以除去PFA。
注意:由于 PFA 毒性,这些步骤必须在通风橱内进行。根据机构指南处理 PFA 废物。 - 除去任何多余的PB缓冲液,并向样品中加入20x体积的冷冻保护剂储存缓冲液21 (876mM蔗糖,0.25mM聚乙烯吡咯烷酮,40%(v / v)乙二醇,溶解在50mM PB缓冲液中)在4°C下以40rpm振荡6-8小时或直到组织沉入底部。将样品在-20°C孵育至少3天,以确保有效减少组织自发荧光11。当储存在-20°C时,样品可以使用长达5年。
注意:组织的下沉表明储存缓冲液已正确渗透到组织中。
2. 样本嵌入
- 将组织嵌入琼脂糖块中,以便用振动切片机顺利切割。通过用高碘酸盐氧化预先激活琼脂糖,然后用硼氢化物还原,与组织形成交联,以提高切割过程中的稳定性。执行下面描述的步骤。
- 通过称量2.25g琼脂糖制备4%氧化琼脂糖,并加入0.21g NaIO4。向琼脂糖和 NaIO4 中加入 100 mL PB。在室温下在通风橱中搅拌2-3小时,避光保存。
注意:关键步骤:不要搅拌超过 3 小时,否则琼脂糖会严重聚合。 - 通过在具有0.2μm膜的标准真空过滤器中过滤膜回收琼脂糖。用 50 mL PB 缓冲液洗涤 3 次,去除剩余的 NaIO4 。将氧化的琼脂糖重悬于 50 mL PB 缓冲液中。
注意:在此阶段不要融化琼脂糖。琼脂糖可以在4°C下避光储存长达2-3周。 - 通过将 19 g 硼砂和 3 g 硼酸加入 1 L 水中来制备硼氢化物溶液。搅拌至溶解,并用 1 M NaOH 将 pH 调节至 9-9.5。在通风橱的搅拌板上,将 100 mL 硼酸盐缓冲液加热至 40 °C。 加入 0.2 g NaBH4 并搅拌 15-30 分钟,同时避光。
注意:硼氢化物溶液可以在室温下在黑暗中储存数周。关键步骤:当将 NaBH4 添加到硼酸盐缓冲液中时,会形成气体,因此在通风橱内进行此步骤。请勿在密封的容器中执行此步骤,因为它可能会导致爆炸。 - 充分孵育以减少自发荧光(≥ 3 天)后从冰箱中取出组织,去除多余的冷冻保护剂储存缓冲液,并用 PB 缓冲液洗涤组织 3 次,每次 10 分钟,在室温 (RT) 下以 40 rpm 振荡。
- 在微波炉(700 W,~30秒)中熔化约20mL氧化琼脂糖悬浮液(在步骤1中制备),使其冷却到足以处理(~45°C),然后将其倒入塑料模具中。
注意:关键步骤:不要在样品上微波加热琼脂糖后直接添加琼脂糖,这可能会导致破坏组织。 - 用镊子轻轻吸起组织,然后快速将其插入琼脂糖的底部中心。将模具在室温下孵育 15 分钟,让琼脂糖聚合。
- 琼脂糖聚合后,用手术刀从塑料模具的四个角打开塑料模具,然后用戴手套的手指小心地拿起琼脂糖立方体。
- 将样品浸入硼氢化物溶液(在步骤2中制备)中,在4°C下浸泡2-3小时,以启动氧化琼脂糖和组织的交联。这可以防止组织在切片过程中脱落。
注意:关键步骤:浸入硼氢化物中的样品应在4°C下避光孵育。 - 用 PB 缓冲液洗涤琼脂糖立方体 2 次 10 分钟。转动琼脂糖立方体,使组织位于上侧,然后使用几滴速溶粘合剂将块连接到磁性载玻片(显微镜载玻片,背面连接两个磁铁)。胶水凝固需要 10-20 分钟,因此将带有 PB 缓冲液滴的纸巾放在琼脂糖顶部,确保样品始终保持充分的水合(图 1C)。
3. 切片机的准备和舞台的设置
- 将磁性载玻片放在断层扫描仪样品盒中心的金属上。
- 用 PB 缓冲液填充盒子,小心地将其放置在载物台上,并拧紧左侧的螺钉,将样品盒固定在断层扫描仪的载物台上。
注意: 请勿将螺丝拧得过紧,否则会损坏塑料盒。 - 将刀片放在切片机上,小心地将样品的位置移至切片机附近和下方。琼脂糖的上表面应与切片机的刀片处于同一水平。
注意: 将其放置得太低会浪费切割时间,而将其放置得太高会在第一次切割时移除大块。 - 移动载物台,将琼脂糖立方体定位到物镜的中心,然后反复单击断层扫描软件中的 "切片 "按钮,直到获得整个琼脂糖立方体的完整切片。
4. 表面分配和获取 2D 图像
- 将物镜在 x 和 y 方向上居中在组织样品上。
- 打开激光器软件,在软件中打开激光器。听到滴答声后,打开激光开关,将波长调整为 800 nm。
注意:在成像之前,激光源需要预热至少 30 分钟,最好是 1 小时。 - 关闭显微镜的柜门,关闭房间内的所有光源,打开 PMT 并将电压设置为 750 V。
注意: 关键步骤:PMT 对光非常敏感,除非机柜门关闭并且房间中的所有光源都关闭,否则请将其关闭。 - 按照概述调整断层扫描仪软件的协议设置,并将显微镜快门设置为自动,并将 V1 和 V2 的电压分别设置为 20 和 3。
- 单击断层扫描仪软件中的 2D按钮 以捕获样品的快照。
- 一旦出现具有可见自发荧光的图像,调整z压电陶瓷以在琼脂糖立方体表面上设置焦平面。第一次扫描将在表面以下 20 μm 处进行,以获得样品的稳定图像。
- 如果看不到自发荧光背景,请增加对比度,直到出现信号。可能会出现没有可见信号的情况(即,由于组织顶部的琼脂糖)。在这种情况下,使用 z-压电器件调整 z 轴,直到它到达琼脂糖表面。如果所需位置超出 Z 压电器件的范围,则可能需要手动移动镜头。
- 找到样品表面后切割多个 50 μm 切片,并在每次切割后获取 2D 图像,以确保焦平面正确设置在块面表面上。
5. 找到样品的边缘并将激光器设置到起点
- 根据激光扫描区域的 xy 坐标(4 个角坐标),将成像区域限制在组织内,对周围琼脂糖块的成像最少。
- 关闭 PMT,将激光波长设置为 800 nm,切换激光快门打开。进入琼脂糖块的激光位置可见为散射光的红点(图2A,B)。
关键步骤:使用 4 类激光器要特别小心。它可以迅速损害人体组织和眼睛。工作人员需要经过特殊培训才能安全地操作这种仪器。 - 在移动载物台时使用激光光斑,使用后、右、前和左的序列找到组织边缘的坐标。
- 仔细检查坐标并将激光点放置在右前角,这是对组织进行成像的默认起点。
- 将控制台窗口中的坐标转换为机器可识别的块大小,这些块大小由 xy 步长定义。将这些步骤测量值输入到软件的协议中。关闭机柜门。
6. 3D扫描/切片
- 将波长更改为 940 nm 以激发 GFP、mWasabi 或 YPet 和 PE。
注意: 在此波长下,激光对人眼是不可见的。为了增强 GFP、mWasabi 和 TIMERbac 的绿色发射分量的信噪比,请在 PMT 2 前面放置一个 510/20 nm 的窄带通滤光片。这减少了黄绿色组织自发荧光的干扰。 - 将显微镜快门切换到自动模式,快门电压设置为 V1 的 20 和 V2 的 1.71。
- 在软件中调整以下三个参数: 截面厚度 - 对于大多数用途,设置为 50 μm。对于肝脏,由于成像深度有限,设置为 30 μm。物理切片的数量 - 这决定了将要成像的总组织深度,并相应地设置。每个部分要捕获的平面数量 - 这将决定 z 分辨率。大多数用途使用 5 个平面(产生 10 μm 的垂直分辨率)。对于肝脏,使用3个或更少的平面。
- 设置激光增益。这需要针对不同的组织和扫描深度进行经验测试。
- 定义用于存储采集图像的文件夹路径和名称,并为图像图元文件提供适当的信息。
- 仔细检查所有输入的值。
- 单击 3D马赛克设置 以启动扫描过程(图1D)。
- 成像完成后,小心地从水箱中收集组织切片,并将其储存在-20°C的储存缓冲液中,直至进一步使用(图1E;图2C,D)。
7. 图像处理和数据分析
- 从 https://github.com/BumannLab/Li_BumannLab_2020 的 Linux 计算机上下载 MATLAB 脚本。将脚本复制到一个文件夹,例如 /home/user/Program/。
注意:必须在 Linux 计算机上安装 MATLAB 和 Fiji(或 ImageJ)的 Computer Vision Toolbox 插件,脚本才能完全正常运行。 - 按下述方式拼接瓷砖图像。
- 将数据从断层扫描仪服务器传输到 Linux 计算机。
- 打开 MATLAB 脚本 StepOneStitchingAndArchive.m 并找到包含原始数据的源文件夹。在脚本中定义源文件夹和目标文件夹。
- 切换到 Editor 选项卡,然后单击 Run。进度信息显示在命令窗口中。处理包括从 Mosaic 文件中读取信息、在图像拼接之前生成瓦片索引、使用 Cidre22 (图 3)进行背景照明校正以及在不同深度采集的光学层之间的照明校正。在源文件夹中名为 stitchedImages_100 的子文件夹中查找拼接的图像。使用 tar 命令压缩原始数据以进行长期存储,并另存为文件扩展名为 tar.bz2 的单个文件(图 1F)。
- 使用支持向量机执行模型训练和分割。要训练支持向量机并执行分割,请按照以下步骤操作。
注:三个荧光通道中的每一个的拼接图像存储在 stitchedImages_100 的 3 个子文件夹(名为 1、2 和 3,对应于红色、橙色和绿色荧光)中。每个子文件夹都包含来自同一通道的所有拼接图像。- 预览拼接的图像。从带有 Fiji(或 ImageJ)的每个子文件夹中打开一张具有相同文件名的图像。将三个通道合并为一个彩色图像。调整每个通道的亮度,直到从细菌和组织自发荧光中看到清晰的信号。请注意调整后的每个通道的最大强度级别,以便进行下一步。
- 打开 MATLAB 脚本 StepTwoSegmentationAndAnalysis.m 并浏览到源。定义用于训练的源文件夹和图像名称。例如
sourceD = '/' ;
red_name = [来源D '1/section_020_01.tif'];green_name = [来源 D '2/section_020_01.tif'];
blue_name = [来源 D '3/section_020_01.tif']; - 转到"编辑器"选项卡,然后单击" 运行"。
- 将出现一个对话框,询问颜色阈值,根据之前与斐济的手动检查填充它(步骤 7.3.1)。
- 根据对话框选择背景区域和感兴趣区域(即细菌)。将显示图表,显示模型的训练情况,并询问是否需要添加更多区域。添加更多感兴趣区域和背景区域,直到可以清楚地分割细菌(图4A,B)。
- 命名并保存模型。该脚本将自动加载图像并应用中值滤镜(半径为 2 像素)。
- 分段过程会自动运行,并且进度信息显示在命令窗口中。观察分段的进度。如果分割在其他拼接图像上的模型效果不佳,请重复模型训练以包含更多背景和细菌区域。
- 要查看分段的结果,请检查名为 Allpositions_filter3D.txt 的文件。该文件包含每个细菌或细菌微菌落的重心坐标以及相应的积分荧光强度(图1G)。
- 使用卷积神经网络删除其他伪影,如下所述。
注意:对于某些细菌,使用支持向量机进行简单分割仍然包括一些成像伪影。对于表达YPet的细菌来说尤其如此。基于神经网络的分割可以有效地去除这些伪影(图4C)。必须在 Windows 计算机上安装适用于 MATLAB 和 Fiji(或 ImageJ)的 Computer Vision Toolbox 插件,脚本才能完全正常运行。有关底层神经网络的信息,请参阅:https://ch.mathworks.com/help/deeplearning/ug/create-simple-deep-learning-network-for-classification.html- 准备图像。使用斐济将tif文件转换为具有不同亮度调整的jpg文件。通过手动管理识别至少 600 个细菌和 600 个文物,并在适当的文件夹中安全地裁剪这些对象的图像。
- 打开 MATLAB 脚本 CNNtestV4.m 并浏览到包含步骤 7.4.1 的对象图像的源文件。
- 定义用于训练的图像文件夹。例如
digitDatasetPath = fullfile ('D:\20200602_CNN','fortrainingPixel12Folder2');
定义用于训练的图像数量,例如,numTrainFiles = 600。 - 转到"编辑器"选项卡,然后单击" 运行"。训练后,CNN 模型文件在源文件夹中保存为 gregnet1.mat。
- 定义一个包含测试图像的文件夹。例如
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp')。
结果保存在一个文件YourFile.txt其中包含有关图像名称和分类为细菌或伪影的信息。 - 定义包含测试图像的文件夹。例如
digitDatasetPathTest = fullfile('D:\20200602_CNN\fortrainingPixel12Folder2\R2500G550B450yfp')。
结果将保存在文件YourFile.txt中,其中包含有关图像名称和分类为细菌或伪影的信息。
- 根据单个细菌的荧光强度估计微菌落的大小,如下所述。
注意:断层扫描仪的空间分辨率不足以分辨密集堆积的微菌落内的单个细菌细胞。然而,每个微菌落中的细菌数量可以根据微菌落的总荧光相对于单个细菌的荧光来估计。这种估计精度取决于整个细菌群体中荧光强度的均匀性。- 通过使用从断层扫描仪中检索的切片的免疫组织化学对细菌成分(如脂多糖)进行染色,确认STP断层扫描中GFP阳性事件的身份(图1H; 图5)。
- 鉴定至少 30 种单一细菌,并从相应的分割结果中检索其荧光强度。利用中值强度值作为单个细菌的参考。通过将微菌落的总荧光强度除以单个细菌的参考值来计算每个微菌落的细菌数量(图1I)。
- 使用可视化软件执行 3D 重建,如下所述。
- 图像准备
- 以蓝色通道图像为例,其中包含胶原蛋白的二次谐波信号,包括组织包膜、动脉和小梁,提供了有用的解剖参考。使用为细菌分割的图像作为第 2 个通道。
- 将第1 个通道 的图像在 x 轴和 y 轴上缩小 10 倍,并将缩小的图像保存在新文件夹中。在同一文件夹中复制 3 次缩小的图像。新仿行的名称应保持相同的顺序。例如:section_001_01.tif,复制 1,名称为 section_001_01-copy.tif,section_001_01-copy-copy.tif。将这些步骤也应用于第 2 通道的图像。缩小大小会产生更易于管理的文件大小。三重图像将使 z 轴变得平滑。
- 合并来自每个通道的图像,以形成与斐济的图像堆栈。单击" >堆栈的图像">"工具">堆栈排序器>按标签排序。
- 执行 3D 过滤。单击 "处理 > 滤镜> 3D 滤镜 ",并将 Z 滤镜大小设置为 6。保存图像堆栈。
- 执行 3D 可视化,如下所述。
- 在 Arena 视图中打开可视化软件包(默认设置)。使用"监视文件夹"图标将文件夹添加到 Arena 视图。双击打开 *.ims 或 *.tif 文件(在 7.6.1 中准备)。
- 使用 Edit>Image Properties,在 Display Adjustment 窗口中调整不同通道的颜色表示 (LUT)。
- 单击" 高级 "以手动设置最小值/最大值和 Gamma 校正值。
单击 通道名称 以更改名称和 LUT。 - 调整图像外观后,使用快照工具导出当前视图。
- 使用"动画"图标将 3D 数据表示为影片。使用"导航指针"查找透视/视图并缩放,并使用"+ 添加"添加关键帧。移动到另一个位置并添加下一个关键帧。按 红色录制 按钮以构建影片。将其保存在所需的目标文件夹和文件类型中(图 1J)。
- 图像准备
结果
所描述的程序能够检测整个小鼠器官(如脾脏、肝脏、肠系膜淋巴结和 Peyer 斑块)中的单个沙门氏菌细胞11(图 5 和图 6)。它还可检测小鼠大脑中的刚地弓形虫寄生虫12。一些感染组织(包括肝脏、Peyer 斑块和脾脏)会发出黄绿色范围内的大量自发荧光。通过用多聚甲醛固定可进一步增强自发荧光,这对于保持组织结构是必要的。通过将 510/20 nm 窄带通滤光片(透射大部分 GFP 发射,但阻挡大部分自发荧光光谱)放在光电倍增管 2(收集绿色发射)前面,并通过将固定组织在冷冻保护剂11 中储存 3 天或更长时间来减少组织自发荧光,从而改善了在这种自发荧光背景下对 GFP、mWasabi 和 TIMERbac 绿色组分的绿色荧光的检测.然而,细菌仍应每个细胞至少表达几千个拷贝的GFP或其他荧光蛋白。另一方面,应避免过高的荧光蛋白水平,以最大限度地降低可能导致毒力减弱的健身成本23。
成像后,可以通过对检索的组织切片进行免疫组织化学来确认组织中荧光细菌的正确分割。具体来说,用抗体染成细菌表面成分(如脂多糖)的物体可以与STP断层扫描获得的荧光图像对齐(图5)。需要注意的是,一些染色的沙门氏菌细胞缺乏荧光蛋白,因此在共聚焦显微镜和STP断层扫描中都可以检测到荧光。这些细胞是已被宿主免疫系统杀死的沙门氏菌,如流式细胞术分选和单一分选细胞的生长培养所证明的那样,以及琼脂平板上集落形成单位的数量与通过流式细胞术确定的荧光沙门氏菌细胞数量之间的密切相关性24.此外,质粒丢失可导致非荧光活细胞,这需要通过在含有和不含与质粒上的选择标记相对应的适当抗生素的培养基上接种来测试。对于pSC101衍生的质粒,体内质粒丢失是罕见的19。对于大多数染色体整合的表达盒,例如11 中使用的 sifB::gfp,表达丢失在体内是无法检测到的。如果分割与免疫组化数据不一致,则需要修改分割流程。
STP断层扫描的分辨率不足以分离密集堆积的微菌落内的单个细菌细胞。然而,微菌落的总荧光强度可以估计 沙门氏菌 细胞的数量。这需要具有高度均匀荧光水平的荧光菌株,例如 沙门氏菌 sifB::gfp11。结合所有微菌落和单细胞的 沙门氏菌 细胞估计数量,产生的细菌组织总负荷与替代方法(例如组织匀浆的铺板或流式细胞术)一致11。铺板和流式细胞术不能直接从相同的组织中进行,因为它们需要灌注固定以进行 STP 断层扫描。取而代之的是,它们必须与其他未固定的动物一起完成。如果通过各种方法确定的细菌载量中位数相差超过 3 倍,则荧光细菌的活力可能会受到影响(在菌落形成单位较低的情况下),或者某些细菌可能已失去荧光报告基因构建体(在较高的菌落形成单位的情况下)。将需要进行对照实验来确定这种差异的根源。
STP 断层扫描可在感染组织的 3D 结构内定位细菌细胞。胶原蛋白的二次谐波信号提供解剖标志,如动脉和小梁。此外,可以通过在灌注前将抗体注射到表面标记物来在 体内 对宿主细胞进行染色(图 5 和 图 6)。这种染色为组织区室和特定微环境(包括炎症病灶)提供了额外的标志物(细胞内标志物和一些具有扩散屏障的区室,如脾、白髓或大脑,不容易接近,适合这种 体内 染色)。这种方法揭示了脾白髓作为组织室,使 沙门氏菌 在抗菌化疗期间能够长期存活11。
最后,可以使用表达 timerbac(复制率的单细胞报告基因)的菌株在组织的 3D 结构中识别和定位以中等或慢速复制的沙门氏菌 11,15。
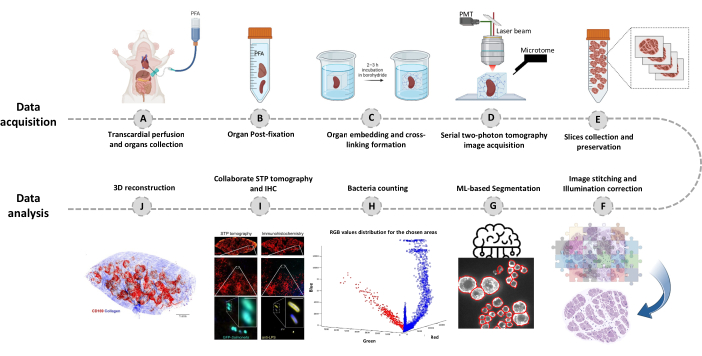
图 1:使用连续双光子 (STP) 断层扫描进行全器官成像的程序。 (A-B) 经心灌注后收获器官,并在 4 °C 的 4% 多聚甲醛 (PFA) 中储存过夜。 (CE) 将器官包埋在氧化琼脂糖中并交联,然后使用 STP 断层扫描和切片组织。收集切片用于随后的免疫组化。(F-J)用于量化细菌数量、确认荧光细菌和细菌位置 3D 重建的计算分析管道。请点击这里查看此图的较大版本.

图 2:串行双光子 (STP) 断层扫描设置。 (A) 断层扫描仪,结合 (B) 2 光子成像和 (C) 自动连续组织切片。(D) 收集组织切片进行后续调查。 请点击这里查看此图的较大版本.
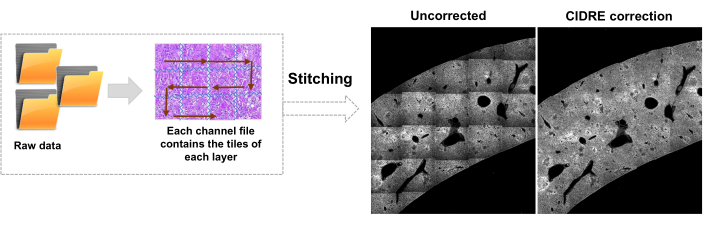
图 3:瓷砖拼接和照明校正。 拼接瓷砖,并使用正则化能量最小化 (CIDRE) 的校正强度分布来校正不均匀的照明。 请点击这里查看此图的较大版本.
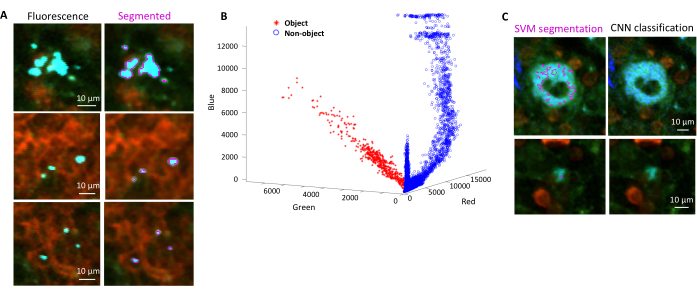
图 4:使用支持向量机 (SVM) 和卷积神经网络 (CNN) 对表达绿色荧光蛋白 (GFP) 的 沙门氏菌 进行分割。 (A) 通过SVM分割的GFP物体的代表性图像(左)和通过SVM分割的区域(右)(比例尺:10μm)。(B) 分割区域的聚簇红-绿-蓝 (RGB) 值分布。(C) 被SVM错误地识别为细菌的非GFP物体的代表性图像(左)。CNN正确地将它们视为背景(右图,比例尺:10μm)。 请点击这里查看此图的较大版本.
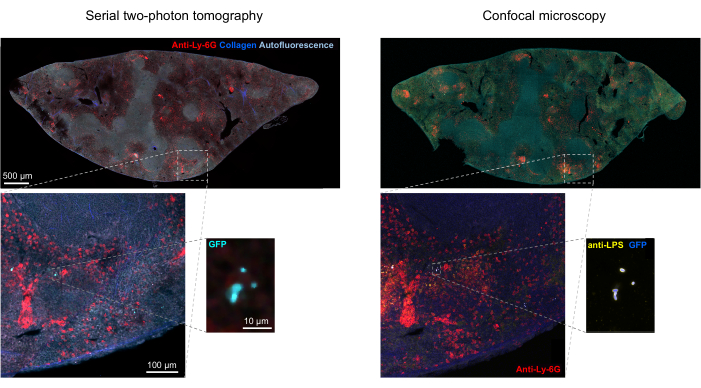
图 5:通过断层扫描检测表达绿色荧光蛋白 (GFP) 的 沙门氏菌 ,并通过免疫组织化学进行确认。 用 沙门氏菌 脂多糖抗体染色后通过断层扫描(左)或共聚焦显微镜获得的同一切片图像(右)。中性粒细胞(红色)在灌注前通过 体内 注射 PE 标记的抗 Ly-6G 抗体进行染色。 请点击这里查看此图的较大版本.
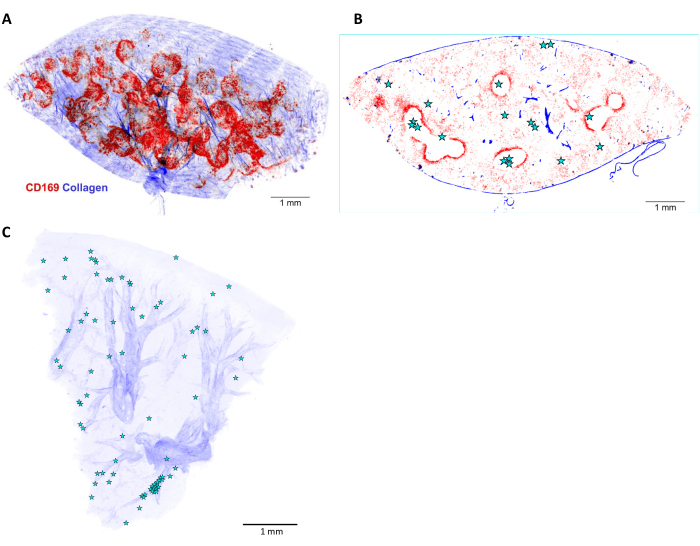
图 6:感染小鼠脾脏中 沙门氏菌 的 3D 重建和定位。 (A) 5 mm 厚的脾切片的三维 (3D) 重建,并在 体内 用抗 CD169 抗体(红色)灌注之前进行染色。蓝色信号代表二次谐波检测到的胶原蛋白。(B) (A) 所示的 3D 堆栈的一个光学平面。 沙门氏菌 细胞或微菌落的位置由星星表示。(C) 感染肝脏中 沙门氏菌 位置(星形)的 3D 重建。动脉根据其胶原蛋白鞘(蓝色)可见。比例尺: 1 mm. 请点击这里查看此图的较大版本.
讨论
细菌病原体的局部组织环境对于确定局部宿主攻击、细菌适应、宿主病原体相互作用和抗菌化疗的局部结果以及个体对整体疾病结果的贡献至关重要。在厘米大小的器官中对微米大小的细菌进行成像一直具有挑战性。串行双光子 (STP) 断层扫描提供足够的空间分辨率来检测整个器官中的单个细菌细胞、自动切片和成像,以及足够的通量(每天 ~1 个器官)11。虽然宿主抗原可以在体内染色,但病原体细胞应表达合适的荧光蛋白,以确保对细胞内病原体细胞的全面检测。由此产生的数据集(每个器官 0.5-1.5 TB)对用于数据分析和存储的 IT 基础设施构成了巨大挑战。
此方法有几个关键步骤。首先,需要具有可检测且均匀表达荧光蛋白GFP或YFP的病原体菌株。理想情况下,使用染色体表达盒25 以最小化由于质粒拷贝数变异引起的荧光异质性。需要足够的荧光强度,但应避免过量的荧光蛋白,以避免病原体的适应性损害23。通过选择适当的启动子和微调核糖体结合位点25 或整个 5' 非翻译区 (UTR)26,可以获得适当的表达水平。其次,灌注固定应包括用缓冲液进行初始洗涤,以从血液循环中去除尽可能多的红细胞。这对脾脏和肝脏尤为重要(尽管从这些器官中完全去除红细胞是困难的)。剩余的红细胞吸收光谱可见部分的光,从而影响成像质量27.第三,将固定组织储存在冷冻保护剂中对于减少组织自发荧光至关重要,自发荧光在发炎组织中尤其高,并且可以掩盖病原体细胞相对微弱的荧光11。第四,组织与周围琼脂糖块的有效交联对于顺利进行振动切片切割至关重要,而不会使组织从琼脂糖块中跳出。第五,荧光信号及其作为病原体细胞的鉴定必须使用正交方法独立验证,例如用针对病原体成分的抗体(例如革兰氏阴性菌的脂多糖)染色和从断层扫描仪11 中检索的切片的共聚焦显微镜检查。一些受感染的组织含有具有相似形状和重叠荧光光谱的自发荧光颗粒,很容易被误解为病原体细胞。第六,应将微菌落内病原体细胞的数量与正交方法(如共聚焦显微镜)进行比较,以评估准确性。基于这些计算的总细菌载量应通过与正交方法(如流式细胞术和铺板)进行比较来验证。
对广泛使用的 STP 协议的重要修改包括在光电倍增管 211 前面放置一个 510/20 nm 的窄带通滤光片,以减少在感染和发炎的肝脏、脾脏和 Peyer 斑块中特别强烈的黄绿色自发荧光的干扰。与大脑相比,这种器官具有强烈的自发荧光和增加的光散射(大脑在STP的其他应用中占主导地位),这也产生了对不均匀照明进行更有效校正的需求。作为另一项修改,该协议为此目的采用了CIDRE方法22 (图3)和基于AI的细菌分割。最后,通过在-20°C的冷冻保护剂中包括孵育步骤来改变组织预处理,这减少了组织自发荧光,从而有助于检测荧光相对较弱的小病原体细胞11。
如果无法检测到病原体信号,或者分割产生的灵敏度不足(遗漏了太多的病原体细胞)或精度不足(将太多背景颗粒分割为病原体细胞),则可能需要进行故障排除。如果背景组织自发荧光可检测到,但病原体信号太少,则病原体可能含有的荧光蛋白量不足。这可以使用来自同一感染组织的组织切片的共聚焦显微镜或组织匀浆的流式细胞术19,28 来测试。根本原因可能是表达水平不足或表达盒不稳定。缓解策略可能包括驱动表达的替代启动子、编码荧光蛋白的基因的密码子适应病原体物种、使用具有较高拷贝数的游离型构建体,或通过染色体整合或平衡致死互补稳定表达盒29。荧光蛋白的选择也很重要,但可以使用 GFP.mut2、mWasabi、YPet 和 TIMERbac 进行检测。如果分割不准确,这可能是由病原体荧光太弱引起的,可以如上所述解决,或者组织自发荧光背景太高。在嵌入琼脂糖模块和断层扫描之前,立即大量灌注洗涤液或在储存缓冲液中长时间孵育可能会解决这些问题。最后,要进行精确分类,需要对神经网络进行充分的训练,但过度训练会导致过度拟合,从而损害新样本的性能。
目前,没有其他方法可以以足够的空间分辨率对整个器官进行3D成像,以检测单个细菌。组织透明化和光片显微镜的未来改进可能会实现类似的分辨率。这可能使成像以更高的速度和更多的荧光通道实现。
STP 的一个重要限制是平面内像素分辨率为 ~0.5 μm 和垂直分辨率为 5 至 10 μm,这不足以分辨紧密定位的细菌,例如,在密集堆积的微菌落内。然而,在断层扫描后可以检索组织切片,以便对选定的组织部位进行二次高分辨率共聚焦显微镜检查。STP的另一个局限性是只有三个荧光通道,这限制了可以同时成像的荧光团的数量。同样,使用多路复用方法对检索的组织切片进行二次分析可以揭示所选组织部位的更多标记物的位置和强度。这些信息可以整合到用STP确定的周围组织的整体3D结构中。
总之,该协议可以在局部和整个器官水平上对宿主 - 病原体相互作用进行详细研究。该方案应易于适应其他病原体(前提是它们可以作为荧光菌株获得)、其他器官和不同的宿主物种。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了瑞士国家科学基金会 310030_156818、310030_182315 和 NCCR_ 180541 AntiResist(到 DB)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose Low Melt | Roth | Art. 6351.5 25g | |
| Boric acid | Sigma-Aldrich | 6768-500G | |
| Instant adhesive Loctite 435 | Henkel | ||
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Poly(ethylene glycol) | Sigma-Aldrich | P5413-1kg | |
| Polyvinylpyrrolidone | Sigma-Aldrich | PVP-100G | |
| Sodium borohydride | Sigma-Aldrich | 71321-25g | |
| Sodium hydroxide | Merck | 106453 | |
| Sodium periodate | Sigma-Aldrich | 311448-100G | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640-250G | |
| Sodium phosphate monobasic dihydrate | Sigma-Aldrich | 71500-1KG | |
| Sodium tetraborate | Sigma-Aldrich | 221732-100g | |
| Sucrose | AppliChem | A4734,1000 | |
| Tris-buffered saline (TBS) | Merck | T5912-1L | |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Vacuum filtration 500 | TPP | TPP99250 | |
| Equipment | |||
| Blade | Campden Instruments Limited | 01-01-4692 | |
| MAITAI Laser | Spectra-Physics | ||
| Peel away plastic mold | Sigma-Aldrich | E6032-1CS | |
| TissueCyte 1000 tomograph | TissueVision | ||
| Antibody/dyes | |||
| DAPI | Merck | D9542-5MG | |
| Primary antibodies | |||
| anti-LPS Salmonella, rabbit | Sifin | REF TS 1624 | |
| anti-CD169-PE, clone 3D6.112 | Biolegend | 142403 | |
| anti-Ly-6G-PE, clone 1A8 | Biolegend | 127608 | |
| Secondary antibodies | Invitrogen | ||
| chicken anti-rabbit Alexa 647 | Invitrogen | A-21443 | |
| Software | Company | Version | |
| Fiji | Image J | 1.54g or later | |
| MATLAB | MathWorks | 2017b/2018b or later | |
| Orchestrator (tomograph) | TissueVision | ||
| Visualization software Imaris | Oxford Instruments | 9.9.0 or later |
参考文献
- Bjarnsholt, T., et al. The importance of understanding the infectious microenvironment. Lancet Infect Dis. 22 (3), e88-e92 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Bumann, D., Cunrath, O. Heterogeneity of Salmonella-host interactions in infected host tissues. Curr Opin Microbiol. 39, 57-63 (2017).
- Hofmann, J., Keppler, S. J. Tissue clearing and 3D imaging - putting immune cells into context. J Cell Sci. 134 (15), jcs258494 (2021).
- Blain, R., et al. A tridimensional atlas of the developing human head. Cell. 186 (26), 5910-5924.e17 (2023).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Meth. 9 (3), 255-258 (2012).
- Oh, S. W., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Kim, Y., et al. Brain-wide maps reveal stereotyped cell-type-based cortical architecture and subcortical sexual dimorphism. Cell. 171 (2), 456-469.e422 (2017).
- Matho, K. S., et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature. 598 (7879), 182-187 (2021).
- Muñoz-Castañeda, R., et al. Cellular anatomy of the mouse primary motor cortex. Nature. 598 (7879), 159-166 (2021).
- Li, J., et al. Tissue compartmentalization enables Salmonella persistence during chemotherapy. Proc Natl Acad Sci U S A. 118 (51), e2113951118 (2021).
- Dogga, S. K., et al. Importance of aspartyl protease 5 in the establishment of the intracellular niche during acute and chronic infection of Toxoplasma gondii. Mol Microbiol. 118 (6), 601-622 (2022).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec No), 33-38 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Claudi, B., et al. Phenotypic variation of Salmonella in host tissues delays eradication by antimicrobial chemotherapy. Cell. 158 (4), 722-733 (2014).
- Ai, H. W., Olenych, S. G., Wong, P., Davidson, M. W., Campbell, R. E. Hue-shifted monomeric variants of Clavularia cyan fluorescent protein: identification of the molecular determinants of color and applications in fluorescence imaging. BMC Biol. 6, 13 (2008).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nat Methods. 8 (5), 393-399 (2011).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Burton, N. A., et al. Disparate impact of oxidative host defenses determines the fate of Salmonella during systemic infection in mice. Cell Host&Microbe. 15 (1), 72-83 (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988 (2021).
- de Olmos, J., Hardy, H., Heimer, L. The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study. J Comp Neurol. 181 (2), 213-244 (1978).
- Smith, K., et al. CIDRE: an illumination-correction method for optical microscopy. Nat Methods. 12 (5), 404-406 (2015).
- Wendland, M., Bumann, D. Optimization of GFP levels for analyzing Salmonella gene expression during an infection. FEBS Lett. 521 (1-3), 105-108 (2002).
- Barat, S., et al. Immunity to intracellular Salmonella depends on surface-associated antigens. PLoS Pathog. 8 (10), e1002966 (2012).
- Rollenhagen, C., Sorensen, M., Rizos, K., Hurvitz, R., Bumann, D. Antigen selection based on expression levels during infection facilitates vaccine development for an intracellular pathogen. Proc Natl Acad Sci U S A. 101 (23), 8739-8744 (2004).
- Chen, F., Cocaign-Bousquet, M., Girbal, L., Nouaille, S. 5'UTR sequences influence protein levels in Escherichia coli by regulating translation initiation and mRNA stability. Front Microbiol. 13, 1088941 (2022).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Bumann, D. Examination of Salmonella gene expression in an infected mammalian host using the green fluorescent protein and two-colour flow cytometry. Mol.Microbiol. 43 (5), 1269-1283 (2002).
- Nakayama, K., Kelly, S. M., Curtiss III, R. J. B. t. Construction of an Asd+ expression-cloning vector: stable maintenance and high level expression of cloned genes in a Salmonella. vaccine strain. 6 (6), 693-697 (1988).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。