Method Article
تقييم في الوقت الحقيقي لل Ca2+ المطلق ، الخلوي ، الحر والانقباض المقابل في الأوعية الليمفاوية المعزولة والمضغوطة
In This Article
Summary
يصف هذا البروتوكول طريقة لقياس الكالسيوم الخلوي والكالسيوم الحر [Ca2+] i وقطر الوعاء في الأوعية الليمفاوية المتقلصة في الوقت الفعلي ثم حساب تركيزات الكالسيوم2+ المطلقة بالإضافة إلى معلمات الانقباض / الإيقاع. يمكن استخدام هذا البروتوكول لدراسة Ca2+ وديناميكيات الانقباض عبر مجموعة متنوعة من الظروف التجريبية.
Abstract
تقع الأوعية الدموية اللمفاوية ، التي يشار إليها الآن غالبا باسم "الدورة الثالثة" ، في العديد من أجهزة الأعضاء الحيوية. تتمثل الوظيفة الميكانيكية الرئيسية للأوعية الدموية اللمفاوية في إعادة السائل من المساحات خارج الخلية إلى القنوات الوريدية المركزية. يتم التوسط في النقل الليمفاوي عن طريق تقلصات إيقاعية عفوية للأوعية الليمفاوية (LVs). يتم تنظيم تقلصات LV إلى حد كبير من خلال الارتفاع والانخفاض الدوري للكالسيوم الخلوي الحر ([Ca2+] i).
تقدم هذه الورقة طريقة لحساب التغيرات في التركيزات المطلقة ل [Ca2+] i وانقباض / إيقاع الأوعية في الوقت الفعلي في LVs المعزولة والمضغوطة. باستخدام LVs المساريقي المعزول للفئران ، درسنا التغيرات في [Ca2+] i والانقباض / الإيقاع استجابة لإضافة الدواء. تم تحميل LVs المعزولة بمؤشر استشعار Ca2+ النسبي Fura-2AM ، وتم استخدام الفحص المجهري بالفيديو إلى جانب برنامج اكتشاف الحواف لالتقاط [Ca2+] i وقياسات القطر بشكل مستمر في الوقت الفعلي.
تمت معايرة إشارة Fura-2AM من كل LV إلى الحد الأدنى والحد الأقصى للإشارة لكل سفينة واستخدمت لحساب [Ca2+] i المطلق. تم استخدام قياسات القطر لحساب المعلمات المقلصة (السعة ، القطر الانبساطي النهائي ، القطر الانقباضي النهائي ، التدفق المحسوب) والإيقاع (التردد ، وقت الانكماش ، وقت الاسترخاء) وترتبط بالقياسات المطلقة [Ca2+]i .
Introduction
تم العثور على الأوعية الدموية اللمفاوية في العديد من أجهزة الأعضاء بما في ذلك الدماغ والقلب والرئتين والكلى والمساريق1،2،3،4،5،6 ، ويعمل عن طريق دفع السائل (الليمفاوية) من المساحات الخلالية إلى القنوات الوريدية المركزية للحفاظ على توازن السوائل7،8،9،10. يبدأ بالشعيرات الدموية اللمفاوية العمياء داخل أسرة الشعيرات الدموية الوعائية التي تصب في الأوعية الليمفاوية المجمعة (LVs). يتكون جمع LVs من طبقتين من الخلايا: طبقة من الخلايا البطانية تشملها طبقة من خلايا العضلات اللمفاوية (LMCs)10,11. يتم تحقيق نقل السوائل الليمفاوية من خلال كل من القوى الخارجية (مثل تكوين الليمفاوية الجديدة ، والنبضات الشريانية ، وتقلبات الضغط الوريدي المركزي) والقوى الداخلية12.
القوة الجوهرية للنقل اللمفاوي هي الانقباض الإيقاعي التلقائي لجمع LVs ، وهو محور غالبية الدراسات التي تبحث في الوظيفة اللمفاوية. يتم تنظيم هذه المضخة اللمفاوية الجوهرية بشكل أساسي من خلال الارتفاع والسقوط الدوري ل Ca2+ ([Ca2+] i). يؤدي الاستقطاب التلقائي لغشاء البلازما في LMCs إلى تنشيط قنوات Ca2+ (Cav1.x) ذات الجهد الكهربائي "L-type" التي تؤدي إلى تدفق Ca2+ والانكماش الإيقاعي LV اللاحق8،9،10. تم توضيح هذا الدور من خلال منع Cav1.x بعوامل محددة ، مثل نيفيديبين ، الذي يثبط تقلصات LV وتسبب في تمدد الأوعية13,14. قد يؤدي الارتفاع العابر في [Ca2+] i أو "Ca2+ spike" في LMCs بوساطة قنوات Cav1.x أيضا إلى تعبئة مخازن Ca2+ داخل الخلايا عن طريق تنشيط مستقبلات الإينوزيتول ثلاثي الفوسفات (IP3) ومستقبلات الريانودين (RyRs) على الشبكة الساركوبلازمية (SR) 15،16،17،18. تشير الأدلة الحالية إلى أن مستقبلات IP3 تساهم بشكل أكبر في Ca2+ المطلوبة لتقلصات LV العادية مقارنة ب RyRs15،16،19،20،21 ؛ ومع ذلك ، قد تلعب RyRs دورا أثناء علم الأمراض أو استجابة للتدخل الصيدلاني 17,18. بالإضافة إلى ذلك ، فإن تنشيط قنوات K + المنشطة Ca2+22 وقنوات البوتاسيوم الحساسة ل ATP (KATP)23,24 يمكن أن يؤدي إلى فرط استقطاب غشاء LMC وتثبيط نشاط الانقباض التلقائي.
هناك العديد من القنوات الأيونية والبروتينات الأخرى التي قد تنظم ديناميكيات Ca2+ في جمع LVs. يعد استخدام طرق لدراسة التغيرات في Ca2+ وانقباض الأوعية استجابة للعوامل الدوائية في الوقت الفعلي أمرا مهما لفهم هذه المنظمات المحتملة. تم وصف طريقة سابقة باستخدام Fura-2 لقياس التغيرات النسبية في LV [Ca2+] i 25. نظرا لأن ثابت التفكك ل Fura-2 و Ca2+ معروف26 ، فمن الممكن حساب التركيزات الفعلية ل Ca2+ ، مما يوسع تطبيق هذه الطريقة ويوفر نظرة ثاقبة إضافية حول إشارات Ca2+ ، واستثارة الغشاء ، وآليات الانقباض27 ، بالإضافة إلى السماح بإجراء مقارنات أساسية بين المجموعات التجريبية. تم استخدام هذا النهج الأخير في خلايا عضلة القلب28 ، وبالتالي ، يمكن تكييفه مع LVs. تقدم هذه الورقة طريقة محسنة تجمع بين هذين النهجين لقياس وحساب التغيرات في [Ca2+] i المطلقة بالإضافة إلى انقباض / إيقاع الأوعية بشكل مستمر في الوقت الفعلي في LVs المعزولة والمضغوطة. كما نقدم نتائج تمثيلية ل LVs المعالجة بالنيفيديبين.
Protocol
تم شراء ذكور فئران Sprague-Dawley البالغة من العمر تسعة إلى 13 أسبوعا من بائع تجاري. بعد الوصول ، تم إيواء جميع الفئران وصيانتها في منشأة قسم طب المختبر (DLAM) بجامعة أركنساس للعلوم الطبية (UAMS) على نظام غذائي مختبري قياسي وتعريضها ل 12 ساعة من الضوء: دورة الظلام عند 25 درجةمئوية. تم تنفيذ جميع الإجراءات وفقا لبروتوكول استخدام المعتمد # 4127 من قبل اللجنة المؤسسية لرعاية واستخدام (IACUC) في UAMS.
1. تشريح وقنية LVs المساريقي
ملاحظة: من المهم إعداد غرفة التروية قبل عزل LVs المساريقي للتأكد من عدم وجود انقطاع في التدفق أو تسرب من شأنه أن يعطل التجربة.
- إعداد حمام التروية
- قم بشراء ماصات زجاجية من البورسليكات (قطر خارجي 1.2 مم ، قطر داخلي 0.68 مم ، وسحبها إلى قطر طرف خارجي 75-100 ميكرومتر) من بائع تجاري. قطع وتلميع الماصات الدقيقة (المعروفة أيضا باسم الكانيولا) إلى حوالي 1-2 سم في الطول لتركيبها في غرفة تروية الوعاء المعزول.
- قم بتوصيل كل قنية زجاجية مثبتة في غرفة نضح الوعاء بمحولات ضغط مستقلة تقع بما يتماشى مع منظمات الضغط المستقلة التي تغذيها الجاذبية باستخدام أنابيب البولي إيثيلين.
ملاحظة: يسمح هذا بمعالجة مستقلة لضغوط التدفق الداخل والخارج اعتمادا على تصميم الدراسة. يوضح الشكل 1 هذا الإعداد بالتفصيل. - ردم غرفة التروية (5 مل) ، والماصات الزجاجية الدقيقة ، ومنظم الضغط المستقل الذي يتم تغذيته بالجاذبية جنبا إلى جنب مع أنابيب البولي إيثيلين بمحلول الملح الفسيولوجي (PSS ؛ 119 mM NaCl ؛ 24 mM NaHCO3 ؛ 1.17mM NaH2PO4 ؛ 4.7 mM KCl ؛ 1.17 mM MgSO4 ؛ 5.5 mM C6H12O6 (الجلوكوز) ؛ 0.026 mM C10H16N2O8 (EDTA) ؛ و 1.6 mM CaCl2) خالية من أي فقاعات هواء. ثم ، قم بتثبيت الضغط حتى لا يتم ضغط القنية.
ملاحظة: الرقم الهيدروجيني لهذا المحلول هو ~ 7.5. يتم الحفاظ على درجة حموضة 7.4 في حمام التروية باستخدام فقاعات CO2 للعمل على نظام التخزين المؤقت للبيكربونات داخل PSS كما هو موضح في الخطوة 1.3.7. يستخدم EDTA هنا لتخليب أيونات الكالسيوم2+ الزائدة.
- إعداد عقدة
- اربط عقدة علوية مزدوجة تحت المجهر باستخدام خيط خياطة حريري مضفر (مقاس 8-0). الخطوات الرئيسية موضحة في الشكل 2.
- افصل خيوط واحدة.
- استخدم ملقطين Dumont # 5 مع أطراف دقيقة واستخدام ملقط واحد قم بعمل حلقة مزدوجة حول طرف الملقط الآخر.
- باستخدام الملقط الحلقي ، أمسك الطرف السائب من الخيط واسحبه من خلال كلتا الحلقتين مع التأكد من عدم سحب العقدة مغلقة تماما وترك فتحة صغيرة.
- استخدم مقص زنبرك فانا لقطع الخيوط الزائدة من كلا الجانبين. استخدم هذه العقد لاحقا لتثبيت LV على القنية.
ملاحظة: لا تستخدم نفس الملقط الذي ستقوم بتشريحه أو تقرنه لأن هناك خطرا أكبر من إتلاف أطراف الملقط أثناء ربط العقدة.
- اربط عقدة علوية مزدوجة تحت المجهر باستخدام خيط خياطة حريري مضفر (مقاس 8-0). الخطوات الرئيسية موضحة في الشكل 2.
- عزل وقنية LVs المساريقية
- تخدير بعمق عن طريق إعطاء إيزوفلوران 5٪ مع جرعة زائدة 1.5 لتر / دقيقة O2 والتخلص من الرأس عن طريق قطع الرأس.
- اعزل المساريق الكامل لتشريح LVs المساريقي عن طريق إجراء قطع طولي أولا على طول خط الوسط لجدار البطن ، وإضفاء الطابع الخارجي على المساريق ، ثم قص الاتصال أسفل العضلة العاصرة البوابية مباشرة و ~ 2-3 سم فوق الأعور وكذلك الاتصال بالمستقيم.
- اغسل المساريق الكامل الذي تم تشريحه في 200 مل من PSS المثلج البارد ثم انقله إلى طبق بتري مبطن بالسيليكون (8-10 مم) (100 مم) يحتوي على PSS بارد مثلج.
- تشريح LVs المساريقي من الدرجة الثانية من الدهون المحيطة والأنسجة الضامة باستخدام مجهر مجسم ، وتشريح ملقط Dumont # 5 Inox الدقيق ، ومقص زنبرك فانا. للمساعدة في تحديد نهايات LVs بمجرد إزالتها من الأنسجة ، اترك قطعة صغيرة من الدهون على الطرف القريب من LV.
- نقل LVs تشريح إلى غرفة نضح الوعاء لقنية على قنية الزجاج.
- استخدم ملقطين دقيقين من Dumont # 5 Inox ، طرف مستقيم (0.05 × 0.01 مم) لقنية LVs مع الطرف البعيد من LV على قنية P1 (التدفق) والطرف القريب من الوعاء على قنية P2 (التدفق الخارجي) لتقليد اتجاه التدفق الليمفاوي.
ملاحظة: قنيات P1 و P2 متطابقة وتختلف فقط عن الطرف الذي يتم توصيل LV به. من المهم استخدام ملقط يلتقي تماما عند الطرف وبدون ضرر لتسهيل الإمساك بجدار الوعاء الرقيق.- حرك عقدة واحدة مربوطة مسبقا على كل قنية زجاجية لتثبيت الوعاء لاحقا على القنية.
- باستخدام قطعة صغيرة من الدهون للمساعدة في توجيه اتجاه الجهد المنخفض ، قم أولا بسحب الطرف البعيد إلى P1.
- حرك العقدة لأسفل القنية وشدها لتأمين LV. تأكد من عدم الإفراط في شد وكسر طرف القنية.
- اضغط على الجهد المنخفض إلى 4-5 مم زئبق في غرفة التروية.
ملاحظة: لأغراضنا ، قمنا بتعيين ضغط P1 و P2 ليكونا متساويين ؛ ومع ذلك ، اعتمادا على الظروف التجريبية ، يمكن تعديل الضغط في كل قنية للحث على إجهاد القص أو التدفق العكسي. - كرر الخطوات 1-3-6-1-1-3-6-4 لربط الطرف القريب من الجهد المنخفض على P2.
- ضع حجر الفقاعات مع 7٪ ثاني أكسيد الكربون (CO2) / 93٪ أكسجين (O2) في غرفة الاستحمام للحفاظ على درجة الحموضة الفسيولوجية.
- قم بتوصيل الغرفة بمنظم درجة الحرارة واضبطها على 37 درجةمئوية حتى تتمكن LVs من موازنة وتطوير تقلصات مستقرة وعفوية (حوالي 30 دقيقة).
ملاحظة: يوضح الشكل 1 هذا الإعداد بالتفصيل.
2. قياس التركيزات المطلقة ل [Ca2+] i في LVs
- تلطيخ Fura-2AM للمركبات LV المقننة
- بعد تطور الانقباضات التلقائية (من الخطوة 1.3.8) ، احتضان LVs مع إستر Fura-2-acetoxymethyl (Fura-2AM ؛ 2 ميكرومتر أو 10 ميكرولتر / 5 مل) وحمض البلورونيك (PA ؛ 0.02٪ W / V أو 5 ميكرولتر / 5 مل من 20٪ PA) لمدة 30 دقيقة في الظلام.
ملاحظة: بعد إضافة Fura-2AM ، يجب تنفيذ جميع الخطوات المتبقية في الظلام. - بعد 30 دقيقة ، استبدل المحلول في غرفة التروية 3x عن طريق إفراغ حجم الحمام بالكامل بفراغ الضغط السلبي ، واستبداله ب PSS المطابق لدرجة الحرارة (37 درجةمئوية) الخالي من الكاشف.
ملاحظة: يجب أن يتم ذلك بسرعة لتقليل الوقت الذي يتم فيه تعليق الجهد المنخفض في الهواء. استخدم كلتا يديك ، على سبيل المثال ، اليد اليمنى للفراغ واليد اليسرى لاستبدال PSS الجديد الخالي من الكاشف. - بعد الغسيل ، احتضان LVs لمدة 15 دقيقة في الظلام لإزالة المؤشر الزائد والسماح بإزالة الأسترة.
- بعد تطور الانقباضات التلقائية (من الخطوة 1.3.8) ، احتضان LVs مع إستر Fura-2-acetoxymethyl (Fura-2AM ؛ 2 ميكرومتر أو 10 ميكرولتر / 5 مل) وحمض البلورونيك (PA ؛ 0.02٪ W / V أو 5 ميكرولتر / 5 مل من 20٪ PA) لمدة 30 دقيقة في الظلام.
- التقاط كاليفورنيا2+ مضان وقطر الوعاء
- انقل الغرفة إلى مرحلة المجهر الفلوري المقلوب المجهزة بمصدر ضوء LED ، وهدف 20x S Fluor ، ومحول تأطير الخلية ، ونظام كاميرا فيديو CMOS سريع ، مما يتيح التقاط مضان إطار بإطار عند 15 هرتز.
ملاحظة: يتم عرض رسم تخطيطي لإعداد سير العمل هذا في الشكل 3. يمكن التقاط إشارة Ca2+ باستخدام كاميرا CCD بمعدل 15 إطارا في الثانية على الأقل. - قم بتوصيل المجهر بالكمبيوتر المجهز ببرنامج تصوير لتسجيل التألق واكتشاف الحافة.
ملاحظة: يتيح البرنامج المشار إليه أيضا تسجيل الضغط المتزامن ؛ ومع ذلك ، لم يتم تضمين ذلك هنا. - قم بتشغيل مصدر ضوء LED وواجهة نظام الفلورسنت.
ملاحظة: تعليمات البرنامج الموضحة هنا خاصة بالبرامج المشار إليها، ولكن يمكن استخدام برامج أخرى للحصول على هذه البيانات. - افتح البرنامج (IonWizard).
- ضمن علامة التبويب ملف ، حدد جديد.
- ضمن علامة التبويب تجميع ، حدد تجربة.
- قم بتحميل القالب التجريبي المطلوب وانقر فوق موافق.
ملاحظة: ستحتاج إلى إعداد قالب تجريبي مع المعلمات المراد قياسها. يمكن العثور على تعليمات إعداد القالب في دليل البرنامج29. - اضبط التتبعات التي تظهر على الشاشة لرؤية قطر الوعاء والبسط (340 إشارة ) والمقام (380 إشارة) والنسبة بترتيب تنازلي.
- اضبط مقياس المحور ص حسب الحاجة للمساعدة في تصور الآثار.
- ضمن عمليات التتبع، حدد تحرير حدود المستخدمين. تأكد من عدم تحديد الحدود التلقائية.
- حدد المعلمة التي ترغب في ضبطها ، وأدخل القيم الدنيا والقصوى للمحور ، ثم حدد موافق.
- لبدء التجربة، انقر على START (في أسفل الشاشة).
- لقياس قطر الجهد المنخفض في وقت واحد ، استخدم برنامج اكتشاف الحافة المدمج في نظام التصوير ، والذي يولد آثارا مقلصة للمركبات منخفضة الجهد عند 3 هرتز. استخدم هذه القياسات لتحليل معلمات الانقباض والإيقاع الموضحة في القسم 3 والموضحة في الشكل 4.
- تأكد من ضبط الإضاءة بحيث يظهر جدار الجهد المنخفض كخطوط داكنة.
- حدد منطقة الاهتمام (ROI) الخالية من الدهون والحطام. بمجرد بدء التجربة ، لا تنقل عائد الاستثمار هذا.
- تأكد من ضبط العتبة بحيث يتم اكتشاف حافة جدار الوعاء طوال دورة الانكماش بأكملها.
- بالنسبة للقياسات الفلورية ، قم بتشغيل أنبوب المضاعف الضوئي (PMT).
- قم بإثارة Fura-2 ، وهو مؤشر قياس نسبي ، عن طريق تبديل الأطوال الموجية 340 و 380 نانومتر في التعرض 50 مللي ثانية باستخدام مصابيح LED ، والتقاط أطياف الانبعاثات عند 510 نانومتر عند 15 هرتز عبر مجال التصوير بأكمله.
ملاحظة: من المهم الحفاظ على جميع المعلمات البصرية (إعدادات الإثارة ، ومرشحات الانبعاثات ، والعدسة الموضوعية ، والمرايا ثنائية اللون) كما هي لسلسلة كاملة من التجارب للحصول على قياسات Ca2+ قابلة للتكرار. - قم بقياس نسبة الإشارة إلى الخلفية عن طريق الحصول أولا على مضان 340 و 380 مع وجود الجهد المنخفض في منتصف مجال الرؤية (الإشارة) ثم استخدام معالجات المرحلة لنقل مجال الرؤية إلى حافة الحمام بدون وعاء (مع الحرص على تجنب الحافة المبطنة بالسيليكون و / أو عن طريق إزالة أي حطام من الحمام) لالتقاط الخلفية.
ملاحظة: من المهم العودة إلى القسم الأصلي من السفينة في كل مرة لقياسات Ca2+ . - استبدل محلول الحمام ب PSS المطابق لدرجة الحرارة والخالي من الكاشف لإزالة المؤشر الزائد في الحمام. قد يستغرق الأمر عدة تبادلات للاستحمام لإزالة Fura-2 الزائدة ، لذا كرر هذا التبادل حتى تصل نسبة الإشارة إلى الخلفية إلى 10: 1 تقريبا.
- سجل إشارة مضان Fura-2 الأساسية والانقباضات التلقائية لمدة 30 دقيقة تقريبا متبوعة باستجابة تركيز تراكمية للنيفيديبين (NIF ؛ 0.1-100 نانومتر) ، وهو مضاد Cav1.x يعتمد على الجهد. الحصول على قياسات الخلفية لكل تركيز للدواء.
- في نهاية كل تجربة ، اغسل LVs باستخدام PSS المطابق لدرجة الحرارة Ca2+ للحصول على الحد الأدنى من إشارة مضان Fura-2 (Rmin) والحد الأقصى لقطر LVs في حالة عدم وجود Ca2+. تأكد من قياس الخلفية.
ملاحظة: يحتوي PSS الخالي من الكالسيوم2 + على نفس تركيبة PSS ولكن بدون CaCl2 ، ويتم استبدال EDTA ب 1 mM EGTA (C14H24N2O10) (درجة الحموضة ~ 7.5). - استبدل محلول الحمام ب PSS المطابق لدرجة الحرارة الذي يحتوي على 10 mM Ca2+ والأيونوميسين (10 μM IONO) ، وهو أيونوفور Ca2+ ، للحصول على أقصى إشارة مضان Fura-2 (Rmax) والحد الأدنى لقطر LVs في ظروف تشبع Ca2+. تأكد من قياس الخلفية.
- انقل الغرفة إلى مرحلة المجهر الفلوري المقلوب المجهزة بمصدر ضوء LED ، وهدف 20x S Fluor ، ومحول تأطير الخلية ، ونظام كاميرا فيديو CMOS سريع ، مما يتيح التقاط مضان إطار بإطار عند 15 هرتز.
- صيغة القياس المطلق [Ca2+]i
- استخدم Rmin و Rmax لمعايرة نسبة الأطوال الموجية 340 و 380 نانومتر وحساب تركيز Ca2+ المطلق الخالي من الخلايا الخلوية ([Ca2+] i).
- احسب تركيز Ca2+ المطلق الحر خلوي ([Ca2+]i) باستخدام المعادلة (1) 26:
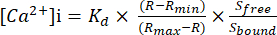 (1)
(1)
حيث Kd = 225 نانومتر (ثابت التفكك ل Fura-2) 26 ، R = نسبة 340/380 ، Rmin = نسبة 340/380 في حالة عدم وجود Ca2+ ، Rmax = نسبة 340/380 مع تشبع Ca2+ ، Sfree = إشارة 380 في حالة عدم وجود Ca2+ ،S ملزمة = إشارة 380 مع تشبع Ca2+
ملاحظة: تم تصحيح جميع إشارات الفلورسنت لمضان الخلفية. - الشكل 5 هو مثال على تتبع Ca2+ يوضح بالتفصيل المعلمات المسجلة. حدد خط الأساس Ca2+ على أنه أدنى Ca2+ قبل ارتفاع Ca2+ وذروة Ca2+ كأعلى Ca2+ تم تحقيقه خلال ارتفاع Ca2+ . السعة هي الفرق بين الذروة وخط الأساس Ca2+. قم بتصدير جميع المعلمات مباشرة من برنامج التصوير ، باستثناء تردد ارتفاع Ca2+ الذي سيتم حسابه في وضع عدم الاتصال كعدد Ca2+ spikes / s. فيما يلي الخطوات الرئيسية داخل البرنامج المشار إليه للحصول على هذه المعلمات.
ملاحظة: يمكن تصدير عمليات التتبع بالكامل إلى ملف .txt ويمكن تحليل جميع المعلمات أو حسابها في البرنامج الذي تختاره. - بالنسبة إلى Rmin، قم بتمييز قسم تتبع البسط الذي يتوافق مع الخلفية أثناء خدمة الدعم النفسي الاجتماعي الخالية من Ca2+. سيتم فتح مربع حوار وتوفير القيم لهذا الجزء من التتبع.
- ضمن العمليات، حدد الثوابت.
- حدد خلفية الكالسيوم الرقمية وأدخل أرقام الخلفية للبسط والمقام من الخطوة السابقة. انقر فوق موافق.
- قم بتمييز قسم تتبع النسبة الذي يتوافق مع أدنى نسبة أثناء خدمة الدعم النفسي الاجتماعي الخالية من Ca2+. هذا هو Rدقيقة. لاحظ أيضا قيمة المقام لهذا القسم ؛ هذا هوS مجانا.
- كرر الخطوات من 2.3.4 إلى 2.3.7 ل Rmax و Sمرتبطين بقسم التتبع الذي يتوافق مع ارتفاع نسبة الدعم النفسي والاجتماعي المجانية Ca2+ وأعلى نسبة.
- ضمن العمليات، حدد الثوابت.
- حدد معايرة الكالسيوم-الكالسيوم وأدخل القيم المدرجة في المعادلة 1. انقر فوق موافق.
- اضبط أحد التتبعات التي تظهر على الشاشة كما هو موضح في الخطوة 2.2.8 بحيث يمكنك رؤية الكالسيوم الرقمي مطروح من الكالسيوم.
- قم بإجراء تحليل عابر أحادي للحصول على المعلمات المتبقية. يمكن العثور على تعليمات لهذا في دليل البرنامج30.
- بدلا من ذلك، ضمن تصدير، حدد التتبع الحالي.
- حدد الموقع الذي ترغب في تصدير ملف .txt إليه وانقر فوق موافق.
ملاحظة: تأكد من النقر فوق التتبع الفردي الذي تريد تصديره. يمكنك تصدير التتبع بأكمله أو الأقسام المحددة من التتبع.
3. قياس انقباض الجهد المنخفض والإيقاع
- يولد برنامج الكشف عن الحواف المدمج في نظام التصوير آثارا مقلصة لقياسات قطر الجهد المنخفض كما هو موضح أعلاه. استخدم هذه القياسات لتحليل معلمات الانقباض والإيقاع. الشكل 4 هو مثال على تتبع الانقباض الذي يوضح بالتفصيل المعلمات المقلصة التي سيتم تسجيلها. قم بتصدير جميع المعلمات مباشرة من برنامج التصوير باستخدام وظيفة التحليل العابر الأحادي على تتبعالقطر 30 ، باستثناء تكرار الانقباضات والتدفق المحسوب والفاصل الزمني ، والتي سيتم حسابها في وضع عدم الاتصال.
ملاحظة: يمكن تصدير عمليات التتبع بالكامل إلى ملف .txt ويمكن تحليل جميع المعلمات أو حسابها في البرنامج الذي تختاره باستخدام المعادلات أدناه. - قياسات EDD و ESD والسعة والتردد والتدفق المحسوب
- قم بقياس الحد الأقصى والحد الأدنى للأقطار (القطر الانبساطي النهائي [EDD] والقطر الانقباضي النهائي [ESD] ، على التوالي) التي يمكن أن تحققها LVs أثناء تقلصاتها الإيقاعية والعفوية.
- احسب سعة الانقباضات (AMP) كفرق بين EDD و ESD.
- احسب التردد كعدد الانقباضات لكل فترة قياس (بالثواني).
- احسب التدفق المحسوب لكل ميكرومتر باستخدام المعادلة (2):
التدفق المحسوب = π/4 (EDD2- ESD2) F (2)
حيث EDD2 = مساحة المقطع العرضي للوعاء أثناء حالة الاسترخاء ، ESD2 = قياس مساحة المقطع العرضي للوعاء أثناء الانقباض ، F = تكرار الانقباضات / الثانية
- الإيقاع: وقت الانكماش والاسترخاء:
- المقاييس الأخرى لإيقاع الجهد المنخفض هي وقت الانكماش ووقت الاسترخاء.
- حدد وقت الانكماش على أنه الوقت الذي يستغرقه الجهد المنخفض للوصول إلى ESD مع كل انكماش.
- حدد وقت الاسترخاء على أنه الوقت الذي يستغرقه الجهد المنخفض للوصول إلى EDD لكل استرخاء ، مما سيعطي مؤشرا عاما على الإيقاع المرتبط ب [Ca2+] المطلق في إطار زمني محدد.
- احسب الفاصل الزمني (ΔT) من المعادلة (3).
Δt = t2 (ESD2) -t1 (ESD1) (3)
النتائج
تم تقييم انقباض LVs والتغيرات المقابلة في Ca2+ ([Ca2+]i) في LVs المساريقي المعزول عند التعرض لتركيزات متفاوتة من نيفيديبين (NIF ؛ 0.1-100 نانومتر) (الشكل 6). أظهرت المعلمات ، بما في ذلك سعة ارتفاع الكالسيوم2+ ، وخط الأساس Ca2+ ، وذروة Ca2+ ، انخفاضا يعتمد على التركيز مع الإضافة الإضافية ل NIF إلى غرفة التروية (الشكل 7 أ). في الوقت نفسه ، أظهرت المعلمات المقلصة مثل سعة الانكماش والتدفق المحسوب أيضا انخفاضا تدريجيا (الشكل 7 ب). كانت هناك زيادة طفيفة في قطر EDD مع NIF (الشكل 7B). يبدو أن تردد ارتفاع الكالسيوم2+ وتردد الانكماش هو استجابة الكل أو لا شيء. ومع ذلك ، حدث هذا التأثير عند 10 نانومتر لجهد منخفض واحد ، بينما توقفت جميع LVs عن الانقباضات بمقدار 100 نانومتر. وبالتالي ، فإن البيانات المجمعة تولد رسوما بيانية تشبه استجابة التركيز المتدرجة. يتوافق هذا التأثير مع المنشورات السابقة التي استخدمت NIF على LVs في مستحضرات أخرى (تصوير الأسلاك والضغط13،14). تظهر مخططات مانهاتن استجابات LV الفردية لمقاييس الإيقاع ، بما في ذلك الفاصل الزمني ووقت الانكماش ووقت الاسترخاء (الشكل 7C). يسمح هذا النوع من تمثيل البيانات للباحث باستخلاص هذه الاستجابات الكل أو لا شيء أو التباين في إيقاعات الانكماش لتوفير نظرة ثاقبة إضافية للآليات الأساسية. في النهاية ، أدى الانخفاض في سعة الانكماش وتردده إلى انخفاض في التدفق المحسوب من خلال هذه LVs المعزولة ، والتي تعمل كمؤشر بديل للوظيفة في الجسم الحي . وعموما، ارتبط الانخفاض في انقباض الجهد المنخفض بانخفاض [Ca2+]i. تقدم النتائج التي توصلنا إليها دليلا مباشرا على أنه ضمن نطاق 100 نانومتر ، أوقف NIF بشكل فعال الانقباضات وتذبذبات [Ca2+] i في LVs عن طريق استعداء قنوات Cav1.x الموجودة في خلايا العضلات الليمفاوية (LMCs).
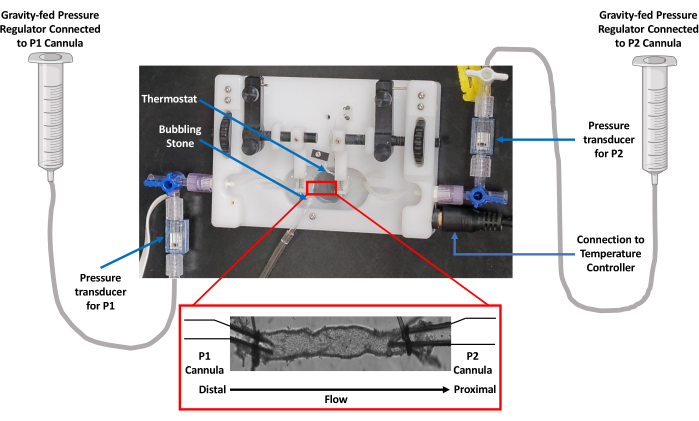
الشكل 1: صورة لإعداد غرفة الوعاء المعزول. استخدمت دراسات نضح الأوعية غرفة وعاء معزولة مجهزة بمنظم حراري. تم استخدام الجاذبية للتحكم في الضغط عبر خزان PSS. تم رصد الضغط بواسطة محولات الطاقة المتصلة بكل من قنيات التدفق (P1) والتدفق الخارجي (P2). اختصار: PSS = محلول الملح الفسيولوجي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير العقدة في لمحة. (أ) تحضير حلقة مزدوجة تحت مجهر التشريح باستخدام خيوط واحدة من خيط خياطة حريري مكون من 3 طبقات ، (ب) إمساك الطرف السائب وسحبه عبر كلتا الحلقتين ، (ج) سحب العقدة من كلا الطرفين للحفاظ على فتحة صغيرة ، و (د) قطع الفتيل الزائد من كلا الجانبين ويظهر الصندوق الأزرق عقدة علوية مزدوجة كاملة جاهزة للاستخدام. شريط المقياس = 1.5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
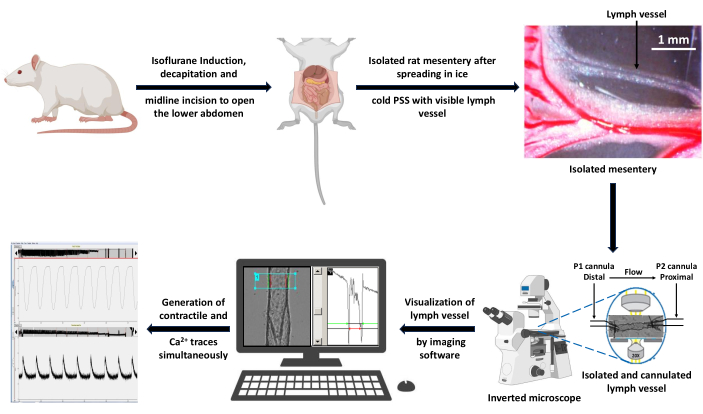
الشكل 3: رسم تخطيطي لسير العمل التجريبي للحصول على البيانات. تم تخدير فأر سليم بتحريض الأيزوفلوران بنسبة 5٪ وتم إجراء قطع الرأس لإزالة دم الجذع. تم إجراء شق في خط الوسط لكشف وعزل المساريق. تم نشر المساريق المعزول في محلول PSS بارد الجليد وتم تشريح LV خال من الدهون للقنية في غرفة تروية وعاء معزولة. تم وضع الحمام على مسرح المجهر المقلوب باستخدام عدسة موضوعية 20x. تم إثارة السفينة بدلا من ذلك بضوء الطول الموجي 340 و 380 نانومتر وتم جمع أطياف الفلورسنت المنبعثة باستخدام كاميرا CCD عند 510 نانومتر. قام الكمبيوتر المتصل بالمجهر بإنشاء آثار انقباض و Ca2+ باستخدام برنامج تصوير التقاط التألق واكتشاف الحافة. شريط المقياس = 1 مم. الاختصارات: PSS = محلول الملح الفسيولوجي ؛ LV = الأوعية الليمفاوية. CCD = جهاز مقترن بالشحن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
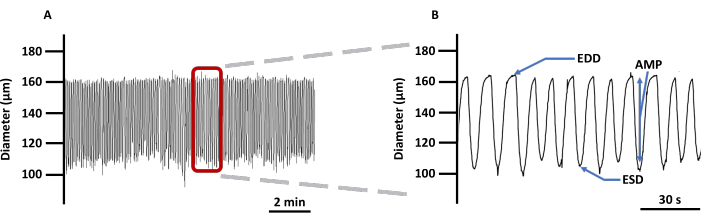
الشكل 4: تتبع انقباض LV التمثيلي. (أ) مثال على تسجيل التغيرات في قطر LVs المقننة المحملة بمؤشر التصوير Ca2+ Fura 2 AM في PSS و (B) تتبع مكبب لإظهار جميع المعلمات المتعلقة بانقباض السفينة: EDD ، ESD ، AMP ، والتردد. تم استخدام هذه القيم لحساب الإيقاع والتدفق. الاختصارات: PSS = محلول الملح الفسيولوجي ؛ LV = الأوعية الليمفاوية. EDD = قطر نهاية الانبساطي ؛ ESD = القطر الانقباضي النهائي ؛ AMP = السعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
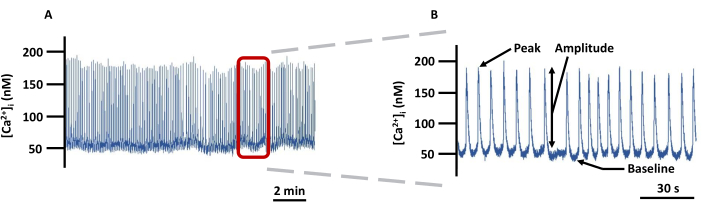
الشكل 5: تتبع تصوير LVCa 2+ التمثيلي. (أ) مثال على تسجيل التغييرات في [Ca2+] i المطلقة في LVs المقننة المحملة ب Fura-2 في PSS و (B) تتبع مكبرة لإظهار جميع المعلمات (الذروة والسعة وخط الأساس) المتعلقة ب [Ca2+] i (غير مصححة في الخلفية). اختصار: PSS = محلول الملح الفسيولوجي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
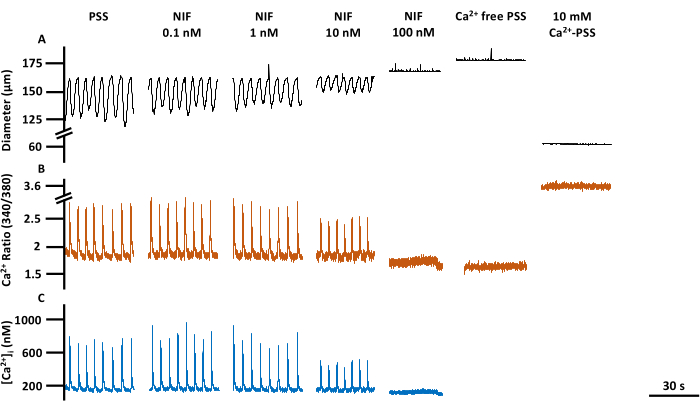
الشكل 6: انقباض الجهد المنخفض وتصوير Ca2+ في لمحة. آثار تمثيلية مقابلة لقطر (A) ، (B) نسبة 340/380 ، و (C) مطلق [Ca2+] i لخط أساس PSS ، نيفيديبين ، مضاد قناة Cav1.x (Ca2+) ، استجابة التركيز ، بما في ذلك Rmin و Rmax. الاختصارات: PSS = محلول الملح الفسيولوجي ؛ LV = الأوعية الليمفاوية. NIF = نيفيديبين. Rmin = الحد الأدنى من إشارة مضان Fura-2 ؛ Rmax = الحد الأقصى لإشارة مضان Fura-2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
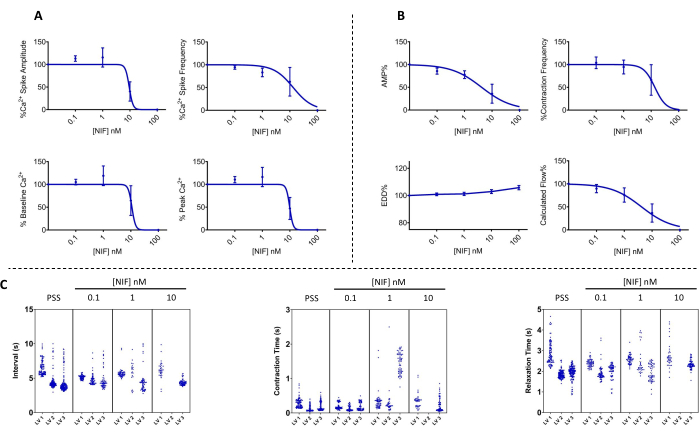
الشكل 7: تذبذب الكالسيوم2+ والانقباض المقابل المحظور بواسطة نيفيديبين في LVs. (A) Ca2+ (n = 3) و (B) تقلصات (n = 3) انخفضت المعلمات بطريقة تعتمد على التركيز مع إضافة نيفيديبين ، وهو مضاد قناة Cav1.x (Ca2+) يعتمد على الجهد. (ج) تظهر مخططات مانهاتن التمثيلية متوسط الفاصل الزمني (Δt) بين الانقباضات وأوقات الانكماش والاسترخاء. البيانات المقدمة كمتوسط ± SEM. الاختصارات: PSS = محلول الملح الفسيولوجي. LV = الأوعية الليمفاوية. NIF = نيفيديبين. EDD = قطر نهاية الانبساطي ؛ AMP = السعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نظرا للطبيعة الهشة والصغيرة للمركبات منخفضة الجهد ، من الضروري توخي أقصى درجات الحذر أثناء عمليات التشريح والقنية. حتى الأضرار الطفيفة التي لحقت بالسفينة يمكن أن تؤدي إلى تطوير LV غير قابل للحياة أو تؤدي إلى تشوهات في [Ca2+] i العابرين. يعد الاتساق في إعدادات الإثارة أمرا بالغ الأهمية بنفس القدر طوال السلسلة التجريبية بأكملها لضمان قابلية المقارنة في قياسات [Ca2+] i بين المجموعات الضابطة والمعالجة. يشكل الفشل في الحفاظ على إعدادات موحدة خطرا كبيرا يتمثل في المبالغة أو التقليل من تقدير [Ca2+] i عبر السفن داخل سلسلة تجريبية. وبالمثل ، من المهم بنفس القدر تحديد ومراقبة نفس منطقة الوعاء بدقة خلال كل تجربة.
يؤدي استخدام مؤشر القياس النسبي Fura-2AM إلى تطبيع الاختلافات الفلورية الناتجة عن سمك الأنسجة غير المتكافئ ، أو توزيع / تسرب الفلوروفور ، أو التبييض الضوئي ، وهي مشكلات شائعة مع أصباغ الطول الموجي المفرد. 31 يتيح ذلك المراقبة المستمرة الموصوفة في هذا البروتوكول. ومع ذلك ، نظرا لأن Fura-2 يعمل عن طريق مخلب Ca2+ ، فمن الممكن زيادة التحميل على LVs وتقليل [Ca2+] i المتاح للانكماش أو الاستجابة للدواء. في هذه الحالات ، لا يزال من الممكن ملاحظة طفرات Ca2+ أثناء غياب الانقباضات الإيقاعية. قد يساهم طول LV المتغير أيضا في هذه الظاهرة. في حين أن قياسات Ca2+ هذه قد لا تزال صالحة على الأرجح ، فقد يكون من الضروري تقليل تركيز Fura-2AM في الإعدادات المنسوخة لتحقيق قياسات Ca2+ والقطر بنجاح. تشمل نتائجنا فقط LVs التي كانت موجودة لكل من طفرات Ca2+ والانقباضات الإيقاعية عند خط الأساس.
يعد قياس Rmin و Rmax خطوتين حاسمتين في حساب المطلق [Ca2+] i. نظرا لأن Rmin يجب أن تكون نسبة Fura-2 في حالة عدم وجود Ca2+ ، فقد تمت إضافة تركيز عال من EGTA إلى PSS الخالي من Ca2 + لضمان استخلاب أي Ca2+ متبقية. أجريت الدراسات الأولية باستخدام EDTA في PSS الخالي من الكالسيوم2+ ، مما أدى إلى تقلصات متفرقة للأوعية مع طفرات Ca2+ المقابلة. بالنسبة ل Rmax ، تمت إضافة تركيز عال من Ca2+ إلى PSS جنبا إلى جنب مع أيونوفور ، أيونوميسين ، لتعظيم إشارة [Ca2+] i . قد يترسب محلول Ca2+ العالي ، مما قد يتطلب إزالة EDTA من PSS. الأهم من ذلك ، أن هذه القياسات الإضافية ل Rmin و Rmax توفر الفرصة لتقييم التغييرات ذات الصلة من الناحية الفسيولوجية في [Ca2+] i ، والتي يمكن أن توفر معلومات عن استثارة الغشاء وآليات الانقباض27 بالإضافة إلى السماح بإجراء مقارنات أساسية بين المجموعات التجريبية مقارنة بالبروتوكولات التي تبلغ فقط عن نسبة 340/380 ل Fura-2. الفشل في تحقيق قيم Rmin و Rmax كافية يحول دون القدرة على حساب [Ca2+] i المطلق.
نظرا للطبيعة المقلصة للمركبات منخفضة الجهد ، يمكن لهذه الطريقة أن توفر فقط مقياسا لمستويات Ca2+ العالمية بدلا من أحداث إطلاق Ca2+ المحلية التي يمكن قياسها في الأوعية المشلولة32. ومع ذلك ، فإن هذه الطريقة مفيدة لربط التغيرات في ديناميكيات [Ca2+] المطلقة مع الانقباض مقارنة بالطرق التي تستخدم الأوعية المشلولة أو الخلايا الفردية28,32. بالنسبة لهذا النهج ، من المفترض أن غالبية الكالسيوم2+ المقاسة تنشأ من خلايا العضلات الليمفاوية. ومع ذلك ، فإن الخلايا البطانية ، الموجودة أيضا في هذه LVs المعزولة ، قد تساهم في إجمالي إشارة Ca2+ التي لوحظت33. يمكن تقدير هذه المساهمة باستخدام LVs التي تم تجريدها من البطانة34. قد تؤدي تقلصات الجهد المنخفض أيضا إلى تحول جدار الوعاء الدموي قليلا داخل وخارج التركيز أثناء دورة الانكماش. لذلك ، من المهم استخدام شرائح وعاء قصيرة يمكن سحبها مشدودة ولكن دون تمديد الوعاء.
بالإضافة إلى تطبيقها في LVs ، يمكن استخدام هذه الطريقة لدراسة الأوعية المعزولة من أسرة الأوعية الدموية الأخرى ، بما في ذلك الشرايين والأوردة ، وتبشر بالاستخدام المحتمل في علم الأعصاب والفروع الأخرى لبيولوجيا الأوعية الدموية. يعد استكشاف تأثيرات مختلف المنبهات أو الخصوم التي تستهدف مسارات نقل الإشارات المختلفة وسيلة أخرى للتحقيق في ديناميكيات Ca2+ الأساسية. علاوة على ذلك ، يمكن استخدام هذه التقنية أيضا في البحث المقارن الذي يتضمن عينات مراقبة ومعالجة من المعنية. علاوة على ذلك ، فإن هذا النهج قابل للتكيف للتنفيذ على المستوى الخلوي ، كما هو الحال في خلايا العضلات اللمفاوية المعزولة ، مما يتطلب الحد الأدنى من التعديلات على أهداف غرفة التروية والمجهر. باختصار ، توفر هذه الطريقة نظرة ثاقبة ذات صلة من الناحية الفسيولوجية لديناميكيات Ca2+ العالمية لأنها ترتبط بالانقباض والإيقاع في LVs وتوفر تقييما قويا للمنظمين المحتملين لديناميكيات Ca2+ في جمع LVs.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة ، بما في ذلك المعهد الوطني للعلوم الطبية العامة ، ومراكز التميز في البحوث الطبية الحيوية (COBRE) ، ومركز دراسات استجابة المضيف لعلاج السرطان [P20-GM109005] ، والمعهد الوطني للسرطان [1R37CA282349-01] ، وزمالة ما قبل الدكتوراه لجمعية القلب الأمريكية [رقم الجائزة: 23PRE1020738 ؛ https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة أو جمعية القلب الأمريكية. تم إنشاء الشكل 1 والشكل 3 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
References
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved