Method Article
격리된 가압된 림프관에서 Absolute, Cytosolic, Free Ca2+ 및 해당 수축성의 실시간 평가
요약
이 프로토콜은 수축하는 림프관에서 세포질, 유리 칼슘[Ca2+]i 및 혈관 직경을 동시에 측정한 다음 절대 Ca2+ 농도와 수축성/리듬 매개변수를 계산하는 방법을 설명합니다. 이 프로토콜은 다양한 실험 조건에서 Ca2+ 및 수축 역학을 연구하는 데 사용할 수 있습니다.
초록
현재 종종 "제3 순환계"라고 불리는 림프 혈관은 많은 중요한 장기 시스템에 위치하고 있습니다. 림프 혈관의 주요 기계적 기능은 세포 외 공간의 액체를 중심 정맥관으로 되돌려 보내는 것입니다. 림프 수송은 림프관(LV)의 자발적인 리듬 수축에 의해 매개됩니다. LV 수축은 주로 세포질, 유리 칼슘 ([Ca2+]i)의 주기적 상승 및 하강에 의해 조절됩니다.
이 논문은 격리된 가압 LV에서 [Ca2+]i 의 절대 농도 변화와 혈관 수축성/리듬도의 변화를 실시간으로 동시에 계산하는 방법을 제시합니다. 분리된 쥐 장간막 LV를 사용하여 약물 추가에 대한 반응으로 [Ca2+]i 의 변화와 수축성/리듬도를 연구했습니다. 분리된 LV에는 비율계량 Ca2+ 감지 표시기 Fura-2AM이 로드되었으며, 에지 감지 소프트웨어와 결합된 비디오 현미경을 사용하여 [Ca2+]i 및 직경 측정값을 실시간으로 연속적으로 캡처했습니다.
각 LV의 Fura-2AM 신호는 각 용기의 최소 및 최대 신호로 보정되었으며 절대 [Ca2+]i를 계산하는 데 사용되었습니다. 직경 측정은 수축 매개변수(진폭, 이완기 말단 직경, 수축기 말단 직경, 계산된 흐름) 및 리듬(빈도, 수축 시간, 이완 시간)을 계산하는 데 사용되었으며 절대 [Ca2+]i 측정과 상관 관계가 있습니다.
서문
림프 혈관은 뇌, 심장, 폐, 신장 및 장간막을 포함한 많은 장기 시스템에서 발견되며1,2,3,4,5,6 간질 공간에서 중심 정맥관으로 유체(림프액)를 추진하여 유체 항상성을 유지하는 역할을 합니다 7,8,9,10 . 이는 혈관 모세혈관 층 내의 막힌 림프 모세혈관으로 시작하여 림프관(LV)을 모으는 것으로 배출됩니다. LV를 수집하는 것은 두 층의 세포로 구성됩니다: 림프근 세포(LMC) 층으로 둘러싸인 내피 세포 층10,11. 림프액 수송은 외인력(예: 새로운 림프 형성, 동맥 맥동, 중심 정맥압 변동)과 내재력(intrinsic forces)12을 통해 이루어진다.
림프 수송을 위한 내재적 힘은 LV를 수집하는 자발적인 리듬 수축이며, 이는 림프 기능을 조사하는 대다수 연구의 초점입니다. 이 고유 림프 펌프는 주로 세포질의 유리 Ca2+ ([Ca2+]i)의 주기적 상승 및 하강에 의해 조절됩니다. LMC에서 원형질막의 자발적인 탈분극은 전압 게이트 "L형" Ca2+(Cav1.x) 채널을 활성화하여 Ca2+ 유입 및 후속 LV 리듬 수축 8,9,10을 유발합니다. 이 역할은 니페디핀(nifedipine)과 같은 특정 물질로 Cav1.x를 차단함으로써 입증되었으며, 이는 LV 수축을 억제하고 혈관 확장을 유발했습니다13,14. Cav1.x 채널에 의해 매개되는 LMC에서 [Ca2+]i의 일시적인 상승 또는 "Ca2+ 스파이크"는 또한 근질 망상체(SR)15,16,17,18에서 이노시톨 삼인산(IP 3) 수용체 및 리아노딘 수용체(RyRs)를 활성화하여 세포 내 Ca2+ 저장을 동원할 수 있습니다. 현재 증거에 따르면 IP3 수용체는 RyRs 15,16,19,20,21에 비해 정상적인 LV 수축에 필요한 더 많은 Ca2+에 기여합니다. 그러나, RyR은 병리학 중 또는 약제학적 개입에 대한 반응으로 역할을 할 수 있다17,18. 또한, Ca2 + 활성화 K + 채널22 및 ATP 민감성 칼륨 (KATP) 채널23,24의 활성화는 LMC 막을 과분극시키고 자발적인 수축 활동을 억제 할 수 있습니다.
LV를 수집할 때 Ca2+ 역학을 조절할 수 있는 다른 많은 이온 채널과 단백질이 있습니다. 약리학적 제제에 대한 반응으로 Ca2+ 의 변화와 혈관 수축성을 실시간으로 연구하는 방법을 활용하는 것은 이러한 잠재적 조절자를 이해하는 데 중요합니다. LV[Ca2+]i 의 상대적 변화를 측정하기 위해 Fura-2를 사용하는 이전의 방법이설명되었다 25. Fura-2 및 Ca2 + 에 대한 해리 상수가 알려져 있기 때문에26 Ca2+의 실제 농도를 계산할 수 있으며, 이는 이 방법의 적용을 확대하고 Ca2+ 신호, 막 흥분성 및 수축성 메커니즘27에 대한 추가 통찰력을 제공할 뿐만 아니라 실험 그룹 간의 기준선 비교를 허용합니다. 이 후자의 접근법은 심근세포 28에서 사용되었으므로 LV에 적용될 수 있습니다. 이 논문은 이 두 가지 접근 방식을 결합하여 절대 [Ca2+]i 의 변화와 혈관 수축성/리듬도를 절연된 가압 LV에서 실시간으로 지속적으로 측정하고 계산하는 개선된 방법을 제시합니다. 또한 니페디핀으로 치료한 LV에 대한 대표적인 결과도 제공합니다.
프로토콜
9주에서 13주 된 수컷 Sprague-Dawley 쥐는 상업 판매상에서 구입했습니다. 도착 후, 모든 쥐는 표준 실험실 식단에 따라 UAMS(University of Arkansas for Medical Sciences) DLAM(Division of Lab Animal Medicine) 시설에 수용 및 관리되었으며 25 °C에서 12시간의 빛:어둠 주기에 노출되었습니다. 모든 절차는 UAMS의 IACUC(Institutional Animal Care and Use Committee)에서 승인한 동물 사용 프로토콜 #4127에 따라 수행되었습니다.
1. 장간막 LV의 절개 및 캐뉼레이션
참고: 장간막 LV를 분리하기 전에 관류 챔버를 설정하여 실험을 방해할 수 있는 흐름 중단이나 누출이 없는지 확인하는 것이 중요합니다.
- 관류 목욕 준비
- 상용 공급업체에서 붕규산 유리 마이크로피펫(외경 1.2mm, 내경 0.68mm, 외부 팁 직경 75-100μm로 당김)을 구입하십시오. 마이크로피펫(일명 캐뉼라)을 약 1-2cm 길이로 자르고 연마하여 격리된 용기 관류 챔버에 장착합니다.
- 용기 관류 챔버에 장착된 각 유리 캐뉼라를 폴리에틸렌 튜브를 사용하여 독립적인 중력 공급 압력 조절기에 따라 위치한 독립적인 압력 변환기에 연결합니다.
참고: 이를 통해 연구 설계에 따라 유입 및 유출 압력을 독립적으로 조작할 수 있습니다. 그림 1 은 이 설정을 자세히 보여줍니다. - 생리염 용액(PSS; 119 mM NaCl; 24 mM NaHCO3; 1.17 mMNaH2PO4; 4.7 mM KCl; 1.17 mM MgSO4; 5.5 mM C6H12O6 (포도당); 0.026 mM C10H16N2O8 (EDTA); 및 1.6 mM CaCl2) 기포가 없습니다. 그런 다음 캐뉼라에 압력이 가해지지 않도록 압력을 고정하십시오.
참고: 이 용액의 pH는 ~7.5입니다. 단계 1.3.7에 설명된 대로 PSS 내의 중탄산염 완충 시스템에 작용하기 위해 CO2 버블링을 사용하여 관류 수조에서 7.4의 pH를 유지합니다. EDTA는 여기에서 과도한 Ca2+ 이온을 킬레이트화하는 데 사용됩니다.
- 매듭의 준비
- 꼰 실크 봉합사(크기 8-0)를 사용하여 현미경 아래에서 이중 오버핸드 매듭을 묶습니다. 주요 단계는 그림 2에 나와 있습니다.
- 단일 필라멘트를 분리합니다.
- 끝이 미세무딘 Dumont #5 겸자 두 개를 사용하고 한 겸자를 사용하여 다른 겸자의 끝 부분을 이중 고리로 만듭니다.
- 고리가 있는 집게를 사용하여 봉합사의 느슨한 끝을 잡고 매듭을 완전히 닫히고 작은 구멍을 남기지 않도록 두 고리를 통해 당깁니다.
- Vanna 스프링 가위를 사용하여 양쪽에서 과도한 봉합사를 자릅니다. 나중에 이 매듭을 사용하여 LV를 캐뉼라에 고정합니다.
알림: 매듭을 묶는 동안 겸자 팁이 손상될 위험이 더 높기 때문에 절개하거나 캐뉼레이션할 동일한 겸자를 사용하지 마십시오.
- 꼰 실크 봉합사(크기 8-0)를 사용하여 현미경 아래에서 이중 오버핸드 매듭을 묶습니다. 주요 단계는 그림 2에 나와 있습니다.
- 장간막 LV의 분리 및 캐뉼레이션
- 1.5 L/min O2 과다 복용과 함께 5% 이소플루란을 투여하여 동물을 깊이 마취하고 참수로 출혈시킵니다.
- 먼저 복벽의 정중선을 따라 세로로 절단하고 장간막을 외부로 만든 다음 유문 괄약근 바로 아래의 연결부와 맹장 위의 ~2-3cm의 연결부와 직장과의 연결을 잘라내어 장간막 LV를 해부를 위해 전체 장간막을 분리합니다.
- 200mL의 얼음처럼 차가운 PSS로 절개된 장간막 전체를 세척한 다음 얼음처럼 차가운 PSS가 들어 있는 실리콘 라이닝(8-10mm) 페트리 접시(100mm)로 옮겨 핀으로 고정합니다.
- 실체현미경을 사용하여 주변 지방 및 결합 조직에서 2차 장간막 LV를 절제하고 Dumont #5 Inox 미세 겸자 및 Vanna 스프링 가위를 절개합니다. 조직에서 제거된 LVs의 끝부분을 식별하는 데 도움이 되도록 LV의 근위 끝에 작은 지방 조각을 남겨 두십시오.
- 유리 캐뉼라에서 캐뉼레이션을 위해 절개된 LV를 용기 관류 챔버로 옮깁니다.
- 림프 흐름의 방향을 모방하기 위해 P1 캐뉼라(유입)에 있는 LV의 말단 말단(유입)과 P2 캐뉼라(유출)에 있는 혈관의 근위 끝과 함께 LV를 캐뉼레이트하기 위해 두 개의 미리 연마된 Dumont #5 Inox Fine Forceps, 직선 팁(0.05 x 0.01mm)을 사용합니다.
알림: P1 및 P2 캐뉼러는 동일하며 LV의 끝이 연결되는 방식만 다릅니다. 얇은 혈관 벽을 쉽게 잡을 수 있도록 팁에서 완벽하게 만나고 손상 없이 집게를 사용하는 것이 중요합니다.- 미리 묶인 단일 매듭을 각 유리 캐뉼라에 밀어 넣어 나중에 용기를 캐뉼라에 고정합니다.
- LV 방향을 잡는 데 도움이 되는 작은 지방 조각을 사용하여 먼저 말단 끝을 P1에 캐뉼레이션합니다.
- 매듭을 캐뉼라 아래로 밀어 넣고 조여 LV를 고정합니다. 캐뉼라 팁을 과도하게 조이거나 부러뜨리지 않도록 하십시오.
- 관류 챔버에서 LV를 4-5mm Hg로 가압합니다.
알림: 우리의 목적을 위해 P1 및 P2 압력을 동일하게 설정합니다. 그러나 실험 조건에 따라 각 캐뉼라에서 압력을 조정하여 전단 응력 또는 역류를 유도할 수 있습니다. - 1.3.6.1-1.3.6.4 단계를 반복하여 LV의 근위 끝을 P2에 캐뉼레이팅합니다.
- 이산화탄소(CO2) 7%/산소(O2) 7%가 함유된 버블링스톤을 욕실에 넣어 생리적 pH를 유지합니다.
- 챔버를 온도 조절기에 연결하고 LV의 경우 37oC로 설정하여 안정적이고 자발적인 수축을 평형화하고 발달시킵니다(약 30분).
참고: 그림 1 은 이 설정을 자세히 보여줍니다.
2. LVs에서 [Ca2+]i 의 절대 농도 측정
- 캐뉼레이션 LV의 Fura-2AM 염색
- 자발적인 수축이 발생한 후(단계 1.3.8에서) LV를 Fura-2-acetoxymethyl ester(Fura-2AM, 2 μM 또는 10 μL/5 mL) 및 pluronic acid(PA; 0.02% W/V 또는 5 μL/5 mL of 20% PA)로 어두운 곳에서 30분 동안 배양합니다.
알림: Fura-2AM을 추가한 후 나머지 모든 단계는 어둠 속에서 수행해야 합니다. - 30분 후, 음압 진공으로 전체 수조 부피를 비우고 온도 일치(37 oC) 시약이 없는 PSS로 교체하여 관류 챔버의 용액을 3번 교체합니다.
알림: LV가 공중에 떠 있는 시간을 최소화하려면 이 작업을 신속하게 수행해야 합니다. 예를 들어, 오른손은 진공용으로, 왼손은 시약이 없는 새로운 PSS를 교체할 때 양손을 사용합니다. - 세척 후 LV를 어두운 곳에서 15분 동안 배양하여 과도한 지시약을 제거하고 탈에스테르화를 허용합니다.
- 자발적인 수축이 발생한 후(단계 1.3.8에서) LV를 Fura-2-acetoxymethyl ester(Fura-2AM, 2 μM 또는 10 μL/5 mL) 및 pluronic acid(PA; 0.02% W/V 또는 5 μL/5 mL of 20% PA)로 어두운 곳에서 30분 동안 배양합니다.
- Ca 포획2+ Fluorescence and Vessel Diameter (형광 및 용기 직경)
- 챔버를 LED 광원, 20x S Fluor 대물렌즈, 세포 프레이밍 어댑터, 15Hz에서 프레임별 형광 캡처가 가능한 고속 CMOS 비디오 카메라 시스템이 장착된 도립 형광 현미경 스테이지로 옮깁니다.
참고: 이 워크플로우 설정의 개략도는 그림 3에 나와 있습니다. Ca2+ 신호는 최소 15fps의 CCD 카메라를 사용하여 캡처할 수 있습니다. - 이미징 소프트웨어가 장착된 컴퓨터에 현미경을 연결하여 형광 및 가장자리 감지를 기록합니다.
참고: 참조된 소프트웨어는 동시 압력 기록도 가능하게 합니다. 그러나 여기에는 포함되지 않습니다. - LED 광원과 형광등 시스템 인터페이스를 켭니다.
참고: 여기에 설명된 소프트웨어 지침은 참조된 소프트웨어에 대한 것이지만 다른 소프트웨어를 사용하여 이 데이터를 얻을 수 있습니다. - 소프트웨어(IonWizard)를 엽니다.
- 파일 탭에서 새로 만들기를 선택합니다.
- Collect(수집) 탭에서 Experiment(실험)를 선택합니다.
- 원하는 실험 템플릿을 로드하고 OK를 클릭합니다.
참고: 측정할 매개변수가 있는 실험 템플릿을 설정해야 합니다. 템플릿 설정에 대한 지침은 소프트웨어 설명서29에서 찾을 수 있습니다. - 화면의 트레이스를 조정하여 Vessel Diameter, Numerator (340 신호), Denominator (380 신호) 및 Ratio 를 내림차순으로 확인합니다.
- 필요에 따라 y축 배율을 조정하여 추적을 시각화하는 데 도움이 됩니다.
- Traces(추적)에서 Edit User Limits(사용자 제한 편집)를 선택합니다. Automatic Limits(자동 제한)가 선택 취소되어 있는지 확인합니다.
- 조정할 매개변수를 선택하고 축의 최소값과 최대값을 입력한 다음 확인을 선택합니다.
- 실험을 시작하려면 화면 하단의 시작 을 클릭합니다.
- LV 직경을 동시에 측정하려면 이미징 시스템에 통합된 가장자리 감지 소프트웨어를 사용하여 3Hz에서 LV의 수축 흔적을 생성합니다. 이 측정값을 사용하여 섹션 3에 설명되어 있고 그림 4에 표시된 수축 및 리듬 매개변수를 분석합니다.
- LV 벽이 어두운 선으로 보이도록 조명을 조정하십시오.
- 지방과 이물질이 없는 관심 영역(ROI)을 선택합니다. 실험이 시작된 후에는 이 ROI를 이동하지 마십시오.
- 전체 수축 주기 동안 선박 벽 가장자리가 감지되도록 임계값이 설정되어 있는지 확인하십시오.
- 형광 측정을 위해 광전자 증배관(PMT)을 켭니다.
- LED 조명기를 사용하여 50ms 노출에서 340nm 및 380nm 파장을 번갈아 가며 비율계량 지표인 Fura-2를 자극하고 전체 이미징 필드에 걸쳐 15Hz에서 510nm의 방출 스펙트럼을 캡처합니다.
참고: 재현 가능한 Ca2+ 측정값을 얻기 위해 전체 실험 시리즈에서 모든 광학 매개변수(excitation settings, emission filter, objective lens 및 dichroic mirrors)를 동일하게 유지하는 것이 중요합니다. - 먼저 시야(신호) 중앙에서 LV로 340 및 380 형광을 얻은 다음 스테이지 매니퓰레이터를 사용하여 시야를 용기 없이 수조 가장자리로 이동하여(실리콘 라이닝 가장자리를 피하거나 수조에서 이물질을 제거하여) 배경을 캡처합니다.
알림: Ca2+ 측정을 위해 매번 용기의 원래 부분으로 다시 이동하는 것이 중요합니다. - 수조 용액을 온도에 맞는 시약이 없는 PSS로 교체하여 수조의 초과 지시약을 제거합니다. 과도한 Fura-2를 제거하기 위해 여러 번의 bath 교환이 필요할 수 있으므로 신호 대 배경 비율이 약 10:1이 될 때까지 이 교환을 반복합니다.
- 약 30분 동안 기준선 Fura-2 형광 신호와 자발적 수축을 기록한 후 전압 종속 Cav1.x 길항제인 니페디핀(NIF, 0.1-100nM)의 누적 농도 반응을 기록합니다. 각 약물 농도에 대한 배경 측정값을 얻습니다.
- 각 실험이 끝나면 온도에 맞는 Ca2+가 없는 PSS로 LV를 세척하여 Ca2+가 없는 경우 LV의 최소 Fura-2 형광 신호(Rmin) 및 최대 직경을 얻습니다. 배경을 측정해야 합니다.
참고: Ca2+-free PSS는 PSS와 조성은 동일하지만 CaCl2 가 없으며 EDTA는 1mM EGTA (C14H24N2O10) (pH ~ 7.5)로 대체됩니다. - 10mMCa2+ 및 ionomycin(10μM IONO),Ca2+ ionophore를 포함하는 온도 일치 PSS와 수조 용액을 교환하여 최대 Fura-2 형광 신호(Rmax) 및 Ca2+ 포화 조건에서 LV의 최소 직경을 얻습니다. 배경을 측정해야 합니다.
- 챔버를 LED 광원, 20x S Fluor 대물렌즈, 세포 프레이밍 어댑터, 15Hz에서 프레임별 형광 캡처가 가능한 고속 CMOS 비디오 카메라 시스템이 장착된 도립 형광 현미경 스테이지로 옮깁니다.
- 절대 [Ca2+]i를 측정하는 공식
- Rmin 및 Rmax 를 사용하여 340 및 380 nm 파장의 비율을 보정하고 절대 세포질이 없는 Ca2+ 농도([Ca2+]i)를 계산합니다.
- 방정식 (1)26을 사용하여 절대 세포질 유리 Ca2+ 농도([Ca2+]i)를 계산합니다.
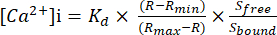 (1)
(1)
여기서 Kd = 225 nM (Fura-2에 대한 해리 상수) 26, R = 340/380 비율, Ra2+가없는 경우R min = 340/380 비율, 포화 Ca2 + 조건에서의 Rmax = 340/380 비율, Ca2+가없는 경우 Sfree = 380 신호, Sbound = 포화 Ca2 + 조건이있는 380 신호
알림: 모든 형광 신호는 배경 형광에 대해 보정되었습니다. - 그림 5는 기록되는 매개변수를 자세히 설명하는 Ca2+ 추적의 예입니다. 기준선 Ca2 +를 Ca2 + 스파이크 이전의 가장 낮은 휴식 Ca2 +로 정의하고 피크 Ca2 +를 Ca2 + 스파이크 동안 달성 된 가장 높은 Ca2 +로 정의합니다. 진폭은 피크와 기준선 Ca2+의 차이입니다. Ca2+ 스파이크의 수로 오프라인에서 계산되는 Ca2+ 스파이크의 빈도를 제외한 모든 매개변수를 이미징 소프트웨어에서 직접 내보냅니다. 다음은 이러한 매개변수를 얻기 위한 참조된 소프트웨어 내의 주요 단계입니다.
알림: 전체 트레이스를 .txt 파일로 내보낼 수 있으며 선택한 소프트웨어에서 모든 매개변수를 분석하거나 계산할 수 있습니다. - Rmin의 경우 Ca2+-free PSS 중 배경에 해당하는 Numerator 추적 섹션을 강조 표시합니다. 대화 상자가 열리고 추적의 이 부분에 대한 값이 제공됩니다.
- Operations(작업)에서 Constants(상수)를 선택합니다.
- Calcium-Numeric background를 선택하고 이전 단계의 Numerator 및 Denominator에 대한 배경 번호를 입력합니다. 확인을 클릭합니다.
- Ca2+-free PSS 동안 가장 낮은 비율에 해당하는 비율 추적 섹션을 강조 표시합니다. 이것은 Rmin입니다. 또한 이 섹션의 Denominator 값을 기록해 둡니다. 이것은 S무료입니다.
- 높은 Ca2+ 자유 PSS 및 가장 높은 비율에 해당하는 추적 섹션과 함께 Rmax 및 Sbound에 대해 2.3.4-2.3.7 단계를 반복합니다.
- Operations(작업)에서 Constants(상수)를 선택합니다.
- Calcium-Calcium Calibration을 선택하고 방정식 1에 나열된 값을 입력합니다. 확인을 클릭합니다.
- 2.2.8단계에 설명된 대로 화면의 추적 중 하나를 조정하여 Calcium-Numeric에서 Calcium을 뺀 것을 볼 수 있습니다.
- Monotonic Transient Analysis를 수행하여 나머지 파라미터를 획득합니다. 이에 대한 지침은 소프트웨어 설명서30에서 찾을 수 있습니다.
- 또는 내보내기에서 현재 추적을 선택합니다.
- .txt 파일을 내보낼 위치를 선택하고 확인을 클릭합니다.
참고: 내보내려는 개별 추적을 클릭해야 합니다. 전체 추적 또는 추적의 선택한 섹션을 내보낼 수 있습니다.
3. LV 수축성 및 리듬성 측정
- 이미징 시스템에 통합된 가장자리 감지 소프트웨어는 위에서 설명한 대로 LV 직경 측정을 위한 수축 추적을 생성합니다. 이러한 측정값을 사용하여 수축 및 리듬 매개변수를 분석할 수 있습니다. 그림 4 는 기록할 수축 매개변수를 자세히 설명하는 수축 추적의 예입니다. Diameter trace30에서 Monotonic Transient Analysis 기능을 사용하여 이미징 소프트웨어에서 직접 수축 빈도, 계산된 흐름 및 간격을 제외한 모든 매개변수를 내보냅니다.
알림: 전체 트레이스를 .txt 파일로 내보낼 수 있으며 아래 방정식을 사용하여 선택한 소프트웨어에서 모든 매개변수를 분석하거나 계산할 수 있습니다. - EDD, ESD, 진폭, 주파수 및 계산된 유량 측정
- LV가 리드미컬하고 자발적인 수축 중에 도달할 수 있는 최대 및 최소 직경(각각 이완기 말단경[EDD] 및 말수축기 지름[ESD])을 측정합니다.
- AMP(amplitude of contractions)를 EDD와 ESD의 차이로 계산합니다.
- 측정 기간당 수축 횟수(단위: s)로 빈도를 계산합니다.
- 방정식 (2)를 사용하여 μm당 계산된 유량을 계산합니다.
계산된 유량 = π/4(EDD2- ESD2)F (2)
여기서 EDD2 = 이완 상태에서의 용기 단면적, ESD2 = 수축 중 용기 단면적 측정, F = 수축 빈도/초
- 리듬: 수축 및 이완 시간:
- LV 리듬의 다른 측정은 수축 시간과 이완 시간입니다.
- 수축 시간을 LV가 각 수축할 때마다 ESD에 도달하는 데 걸리는 시간으로 정의합니다.
- 이완 시간을 LV가 각 이완에 대해 EDD에 도달하는 데 걸리는 시간으로 정의하며, 이는 특정 시간 프레임 내에서 절대 [Ca2+]i 와 상관 관계가 있는 리듬의 전반적인 표시를 제공합니다.
- 방정식 (3)에서 구간 시간(ΔT)을 계산합니다.
Δt = t2 (ESD2)-t1 (ESD1) (3)
결과
LV의 수축성 및 세포질, 유리 Ca2+([Ca2+]i)의 해당 변화는 다양한 농도의 니페디핀(NIF; 0.1-100nM)에 노출되었을 때 분리된 쥐 장간막 LV에서 평가되었습니다(그림 6). Ca2+ 스파이크 진폭, 기준선 Ca2+ 및 피크 Ca2+를 포함한 매개변수는 관류 챔버에 NIF를 증분 추가함으로써 농도 의존적 감소를 나타냈습니다(그림 7A). 동시에, 수축 진폭 및 계산된 유량과 같은 수축 매개변수도 단계적 감소를 보여주었습니다(그림 7B). NIF를 사용하면 EDD 직경이 약간 증가했습니다(그림 7B). Ca2+ 스파이크 빈도와 수축 빈도는 모두 또는 전혀 반응이 없는 것으로 보입니다. 그러나, 이 효과는 모든 LVs가 100 nM만큼 수축을 멈춘 반면, 하나의 LV에 대해 10 nM에서 발생했다. 따라서 결합된 데이터는 등급이 매겨진 농도 반응과 유사한 그래프를 생성합니다. 이 효과는 다른 제제에서 LV에 NIF를 사용한 이전 간행물과 일치합니다(와이어 및 압력 근조영술 13,14). 맨해튼 플롯은 간격, 수축 시간 및 이완 시간을 포함한 리듬 측정에 대한 개별 LV 반응을 보여줍니다(그림 7C). 이러한 유형의 데이터 표현을 통해 연구자는 이러한 전부 또는 전무 반응 또는 수축 리듬의 변동성을 파악하여 기본 메커니즘에 대한 추가 통찰력을 제공할 수 있습니다. 궁극적으로, 수축 진폭과 주파수의 감소는 이러한 고립된 LV를 통해 계산된 유량의 감소를 초래했으며, 이는 생체 내 기능에 대한 대리 지표 역할을 합니다. 전반적으로, LV 수축성의 감소는 [Ca2+]i의 감소와 상관관계가 있었습니다. 우리의 연구 결과는 100nM 범위 내에서 NIF가 림프근 세포(LMC)에 존재하는 Cav1.x 채널을 길항하여 LV의 수축 및 [Ca2+]i 진동을 효과적으로 중단시켰다는 직접적인 증거를 제공합니다.
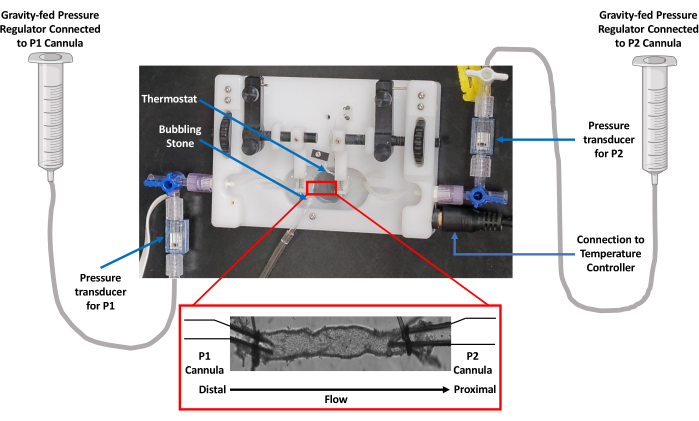
그림 1: 격리된 용기 챔버 설정 이미지. 혈관 관류 연구는 온도 조절기가 장착된 격리된 용기 챔버를 사용했습니다. 중력은 PSS 저장소를 통해 압력을 제어하는 데 사용되었습니다. 압력은 유입(P1) 및 유출(P2) 캐뉼라에 연결된 변환기에 의해 모니터링되었습니다. 약어: PSS = physiological salt solution. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 매듭 준비 과정을 한 눈에 볼 수 있습니다. (A) 3겹 실크 봉합사의 단일 필라멘트를 사용하여 해부 현미경으로 이중 루프를 준비하고, (B) 느슨한 끝을 잡고 양쪽 루프를 통해 당기고, (C) 양쪽 끝에서 매듭을 당겨 작은 구멍을 유지하고, (D) 양쪽에서 여분의 필라멘트를 절단하고 파란색 상자는 즉시 사용할 수 있는 완전한 이중 오버핸드 매듭을 보여줍니다. 축척 막대 = 1.5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
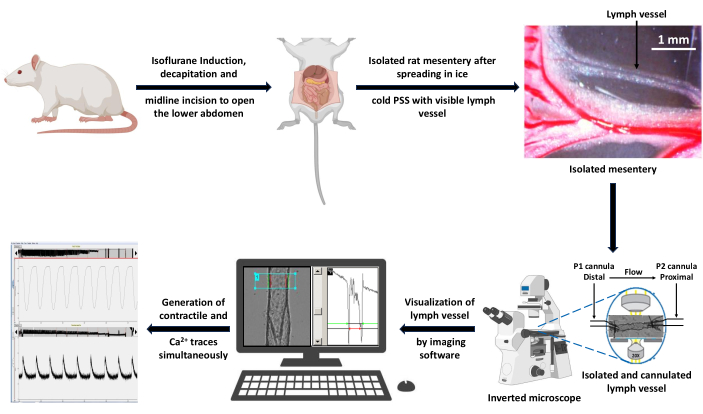
그림 3: 데이터 수집을 위한 실험 워크플로우 개략도. 건강한 쥐에게 5% 이소플루란 유도를 마취하고 몸통의 혈액을 제거하기 위해 참수를 실시했습니다. 장간막을 노출시키고 격리하기 위해 정중선 절개를 시행했습니다. 분리된 장간막을 얼음처럼 차가운 PSS 용액에 펴 바르고 LV를 분리된 혈관 관류 챔버에서 캐뉼레이션을 위해 지방이 없는 절개했습니다. 수조는 20x 대물 렌즈를 사용하여 도립 현미경의 스테이지에 배치되었습니다. 용기는 340 및 380 nm 파장의 광으로 번갈아 여기되었고 방출 형광 스펙트럼은 510 nm에서 CCD 카메라를 사용하여 수집되었습니다. 현미경에 연결된 컴퓨터는 형광 캡처 및 가장자리 검출 이미징 소프트웨어를 사용하여 수축성 및 Ca2+ 흔적을 생성했습니다. 눈금 막대 = 1mm. 약어: PSS = physiological salt solution; LV = 림프관; CCD = 전하 결합 소자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
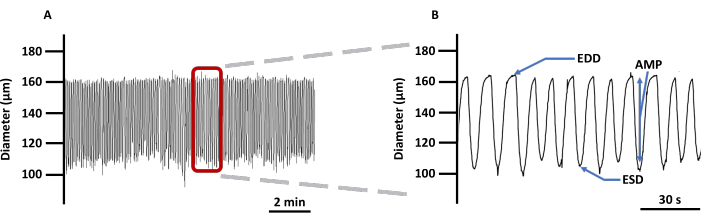
그림 4: 대표적인 LV 수축 추적. (A) PSS에서 Ca2+ 이미징 지표 Fura 2 AM이 로드된 캐뉼레이션 LV의 직경 변화 기록 예와 (B) 혈관 수축성과 관련된 모든 매개변수(EDD, ESD, AMP 및 주파수)를 보여주기 위한 확대 추적. 이 값은 리듬과 흐름을 계산하는 데 사용되었습니다. 약어: PSS = physiological salt solution; LV = 림프관; EDD = 이완기 말단 직경; ESD = 수축기 말단 직경; AMP = 진폭. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
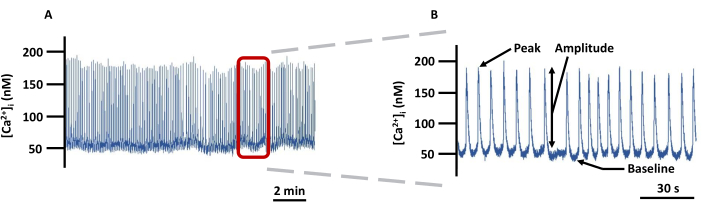
그림 5: 대표적인 LV Ca2+ 이미징 추적. (A) PSS에서 Fura-2가 로드된 캐뉼레이션 LV에서 절대 [Ca2+]i 의 변화 기록 예와 (B) [Ca2+]i (배경 보정되지 않음)와 관련된 모든 매개변수(피크, 진폭 및 기준선)를 표시하기 위한 확대 추적. 약어: PSS = physiological salt solution. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
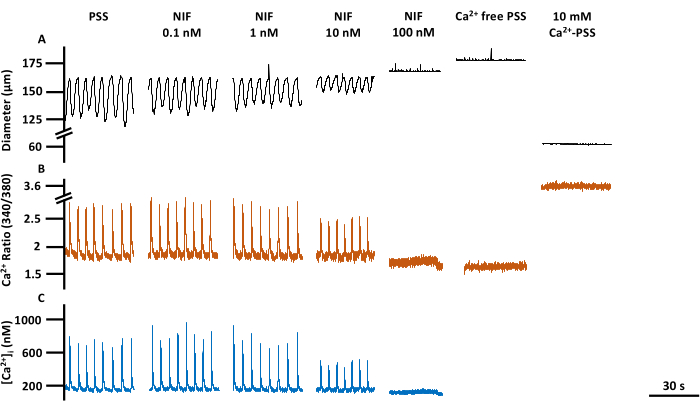
그림 6: LV 수축성 및 Ca2+ 이미징 한 눈에 보기. (A) 직경, (B) 340/380 비율 및 (C) PSS 기준선의 절대 [Ca2+]i , 니페디핀, Cav1.x(Ca2+) 채널 길항제, Rmin 및 Rmax를 포함한 농도 반응에 해당하는 대표 트레이스. 약어: PSS = physiological salt solution; LV = 림프관; NIF = 니페디핀; Rmin = 최소 Fura-2 형광 신호; Rmax = 최대 Fura-2 형광 신호. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
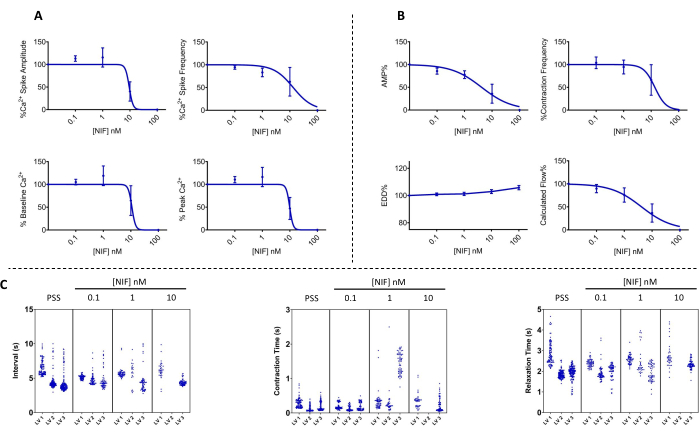
그림 7: LVs에서 니페디핀에 의해 차단된 Ca2+ 진동 및 해당 수축성 . (A) Ca2+ (n = 3) 및 (B) 수축(n = 3) 매개변수는 전압 종속 Cav1.x(Ca2+) 채널 길항제인 니페디핀을 추가하여 농도 의존적 방식으로 감소했습니다. (C) 대표적인 맨해튼 플롯은 수축과 수축 및 이완 시간 사이의 평균 시간 간격(Δt)을 보여줍니다. SEM± 평균으로 표시되는 데이터. 약어: PSS = physiological salt solution; LV = 림프관; NIF = 니페디핀; EDD = 이완기 말단 직경; AMP = 진폭. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
LV의 연약하고 작은 특성으로 인해 해부와 캐뉼레이션 과정 모두에서 최대한의 주의를 기울여야 합니다. 혈관에 경미한 손상이 있어도 생존 불가능한 LV가 발생하거나 [Ca2+]i 과도 상태에 이상이 발생할 수 있습니다. 여기 설정의 일관성은 대조군과 처리군 간의 [Ca2+]i 측정에서 비교 가능성을 보장하기 위해 전체 실험 시리즈에서 똑같이 중요합니다. 균일한 설정을 유지하지 못하면 실험 시리즈 내의 용기 전체에서 [Ca2+]i 를 과대평가하거나 과소평가할 상당한 위험이 있습니다. 마찬가지로, 각 실험에서 동일한 용기 영역을 정확하게 식별하고 모니터링하는 것도 마찬가지로 중요합니다.
비율계량 지표 Fura-2AM을 사용하면 단일 파장 염료에서 흔히 발생하는 문제인 불균일한 조직 두께, 형광단 분포/누출 또는 광표백으로 인한 형광 변화를 정상화할 수 있습니다. 31 이를 통해 이 프로토콜에 설명된 지속적인 모니터링이 가능합니다. 그러나 Fura-2는Ca2+를 킬레이트화하여 작용하기 때문에 LV에 과부하가 걸리고 수축 또는 약물 반응에 사용할 수 있는 [Ca2+]i 를 감소시킬 수 있습니다. 이러한 경우, 리드미컬한 수축이 없는 동안에도 Ca2+ 스파이크가 계속 관찰될 수 있습니다. LV 길이의 변화도 이러한 현상의 원인이 될 수 있습니다. 이러한 Ca2 + 측정은 여전히 유효 할 수 있지만 Ca2 + 및 직경 측정을 모두 성공적으로 달성하려면 복제 된 설정에서 Fura-2AM의 농도를 줄여야 할 수도 있습니다. 우리의 결과에는 기준선에서 Ca2+ 스파이크와 리듬 수축이 모두 존재하는 LV만 포함됩니다.
Rmin 및 Rmax 측정은 절대 [Ca2+]i를 계산하는 데 중요한 단계입니다. Rmin은 Ca2 +가없는 경우 Fura-2 비율이어야하기 때문에 잔류 Ca2 +의 킬레이트 화를 보장하기 위해 고농도의 EGTA가 Ca2 +-free PSS에 추가되었습니다. 초기 연구는 Ca2+-free PSS에서 EDTA로 수행되었으며, 이로 인해 해당 Ca2+ 스파이크와 함께 산발적인 혈관 수축이 발생했습니다. Rmax의 경우 [Ca2+]i 신호를 최대화하기 위해 이온단인 ionomycin과 함께 고농도의 Ca2+가 PSS에 추가되었습니다. 높은 Ca2+ 용액이 침전될 수 있으며, 이로 인해 PSS에서 EDTA를 제거해야 할 수 있습니다. 중요한 것은, Rmin 및 Rmax에 대한 이러한 추가 측정은 [Ca2+]i에서 생리학적으로 관련된 변화를 평가할 수 있는 기회를 제공하며, 이는 막 흥분성 및 수축성 메커니즘27에 대한 정보를 제공할 수 있을 뿐만 아니라 Fura-2에 대해 340/380 비율만 보고하는 프로토콜과 비교하여 실험 그룹 간의 기준선 비교를 가능하게 할 수 있습니다. 적절한 R최소값 및 R최대값을 달성하지 못하면 절대 [Ca2+]i를 계산할 수 없습니다.
LVs의 수축성 특성으로 인해, 이 방법은 마비된 혈관(32)에서 측정할 수 있는 국소적인 Ca2+ 방출 이벤트보다는 전반적인 Ca2+ 수준의 측정만을 제공할 수 있다. 그러나, 이 방법은 마비된 혈관 또는 개별 세포를 사용하는 방법에 비해 절대 [Ca2+]i 동역학의 변화를 수축성과 상관시키는데 유리하다(28,32). 이 접근법의 경우, 측정된 Ca2+의 대부분이 림프근 세포에서 유래한다고 가정합니다. 그러나, 이들 분리된 LV에도 존재하는 내피세포는 관찰된 총 Ca2+ 신호에 기여할 수 있다(33). 이 기여도는 내피34가 제거된 LV를 사용하여 추정할 수 있습니다. LV 수축은 또한 수축 주기 동안 혈관 벽이 약간 초점 안팎으로 이동하는 결과를 초래할 수 있습니다. 따라서 팽팽하게 당길 수 있지만 혈관을 늘리지 않는 짧은 혈관 세그먼트를 사용하는 것이 중요합니다.
LV에 적용하는 것 외에도 이 방법은 세동맥 및 정맥을 포함한 다른 혈관층에서 분리된 혈관을 연구하는 데 사용할 수 있으며 신경생물학 및 혈관 생물학의 다른 분야에서 잠재적인 활용을 약속합니다. 다양한 신호 전달 경로를 표적으로 하는 다양한 작용제 또는 길항제의 효과를 탐색하는 것은 근본적인 Ca2+ 역학을 조사하는 또 다른 방법입니다. 또한, 이 기술은 각 동물의 대조군 및 처리된 샘플을 포함하는 비교 연구에도 사용할 수 있습니다. 더욱이, 이 접근법은 고립된 림프근 세포와 같은 세포 수준에서의 구현에 적용할 수 있으며, 관류 챔버 및 현미경 대물렌즈에 대한 최소한의 조정이 필요합니다. 요약하면, 이 방법은 LV의 수축성 및 리듬성과 상관 관계가 있으므로 전체 Ca2+ 역학에 대한 생리학적으로 관련된 통찰력을 제공하고 LV 수집에서 Ca2+ 역학의 잠재적 조절자에 대한 강력한 평가를 제공합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health)의 지원을 받았으며, 여기에는 미국 국립보건원(National Institute of General Medical Sciences), COBRE(Centers of Biomedical Research Excellence), 암 치료에 대한 숙주 반응 연구 센터(Center for Studies of Host Response to Cancer Therapy)[P20-GM109005], 국립 암 연구소(National Cancer Institute)[1R37CA282349-01], 미국 심장 협회(American Heart Association) 박사전 펠로우십[수상 번호: 23PRE1020738; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]이 포함되었습니다. 내용은 전적으로 저자의 책임이며 NIH 또는 AHA의 공식 견해를 반드시 나타내는 것은 아닙니다. 그림 1 과 그림 3 은 BioRender.com 로 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
참고문헌
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유