A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تزايد كرويات سرطان البنكرياس ثلاثية الأبعاد Desmoplastic من الثقافة المشتركة
In This Article
Summary
لا يزال سرطان البنكرياس أحد أصعب أنواع السرطان التي يمكن علاجها. لذلك ، من الأهمية بمكان أن تكون النماذج قبل السريرية التي تقيم فعالية العلاج قابلة للتكرار وذات صلة سريريا. يصف هذا البروتوكول إجراء بسيطا للاستزراع المشترك لتوليد كرويات قابلة للتكرار وذات صلة سريريا.
Abstract
يعد سرطان البنكرياس الغدي القنوي (PDAC) أحد أكثر أنواع السرطان فتكا بمعدل بقاء لمدة 5 سنوات يبلغ <12٪. أكبر عائق أمام العلاج هو المصفوفة الكثيفة خارج الخلية (ECM) التي تحيط بالورم وتقلل من الأوعية الدموية ، والتي تسمى عموما desmoplasia. تم اختبار مجموعة متنوعة من تركيبات الأدوية والتركيبات لعلاج السرطان ، وعلى الرغم من أن العديد منها يظهر نجاحا قبل السريري ، إلا أنها تفشل سريريا. لذلك ، يصبح من المهم أن يكون لديك نموذج مناسب سريريا متاح يمكنه التنبؤ باستجابة الورم للعلاج. تم التحقق من صحة هذا النموذج مسبقا ضد الأورام السريرية المقطوعة. هنا يتم وصف بروتوكول بسيط لزراعة كرويات ثلاثية الأبعاد (3D) يمكن أن تولد بشكل طبيعي ECM قوي ولا تتطلب أي مصادر مصفوفة خارجية أو سقالة لدعم نموها.
لفترة وجيزة تستخدم خلايا نجمية البنكرياس البشرية (HPaSteC) وخلايا PANC-1 لإعداد معلق يحتوي على الخلايا بنسبة 1: 2 ، على التوالي. يتم طلاء الخلايا في لوحة U-well مطلية بالبولي HEMA و 96 بئرا منخفضة المرفق. يتم طرد اللوحة بالطرد المركزي للسماح للخلايا بتكوين حبيبات أولية. يتم تخزين اللوحة في الحاضنة عند 37 درجة مئوية مع 5٪ CO2 ، ويتم استبدال الوسائط كل 3 أيام. يمكن تصوير اللوحات على فترات زمنية محددة لقياس حجم الكرة الأرضية. بعد 14 يوما من الاستزراع ، تتشكل كرويات ديزموبلاستيك ناضجة (أي متوسط حجم 0.048 + 0.012 مم3 (451 ميكرومتر × 462.84 ميكرومتر)) ويمكن استخدامها لتقييم العلاج التجريبي. تشمل مكونات ECM الناضجة الكولاجين I وحمض الهيالورونيك والفبرونيكتين واللامينين.
Introduction
يرتبط التشخيص السيئ لسرطان البنكرياس بمجموعة متنوعة من الأسباب ، من بينها افتقاره إلى المؤشرات الحيوية التي يمكن اكتشافها بسهولة مما يؤدي إلى الكشف المتأخر. سبب رئيسي آخر هو السدى السميك المحيط بالأنسجة ، مما يؤدي إلى انخفاض إمدادات الدم. إن ترسب كميات كبيرة من المصفوفة خارج الخلية (ECM) ، والتفاعل بين الخلايا والخلايا ، والخلايا البطانية ، والخلايا المناعية المختلفة ، والخلايا المحيطة ، والخلايا الليفية العضلية المتكاثرة ، ومجموعات الخلايا الليفية ، ووجود الخلايا غير الورمية (التي تشكل معا التفاعل الديسيموسجي)1 ، تشكل السدى السميك المسؤول عن مقاومة العلاج الكيميائي والعلاج الإشعاعي ل PDAC2. السرطان والخلايا اللحمية لها تفاعل معقد وديناميكي وثنائي الاتجاه. على الرغم من أن بعض العناصر إما تخفف أو تسرع تطور المرض ، إلا أن معظم العمليات تكون قابلة للتكيف أثناء تطور الورم1. وهذا يوفر بيئة غنية بعوامل النمو وعوامل تولد الأوعية والبروتياز وجزيئات الالتصاق. هذه العوامل تعزز تكوين الأوعية الدموية ، وتكاثر الخلايا ، ورم خبيث ، والغزو 3,4. معا ، هم ملاذ مناعي ومتميز للأدوية للورم ، مما يؤدي إلى مقاومة الأدوية.
ال desmoplasia هو خليط معقد يتكون من بروتينات ECM مختلفة ، جنبا إلى جنب مع الخلايا المناعية والخلايا النجمية البنكرياس (PSC). معا ، تميل هذه إلى تشكيل سقالة لنمو الخلايا. PSCs هي واحدة من أكبر مكونات المقصورة اللحمية5. إن قدرتها على إنتاج إنزيمات مثل مصفوفة ميتالوبروتياز (MMP) ، ومثبطات الأنسجة لمصفوفة ميتالوبروتياز (TIMP) والخلايا الليفية المرتبطة بالسرطان (CAF)6 تعني أنها من المحتمل أن تلعب دورا حاسما في تطوير تفاعل التنسج الزجاجي. ECM ، الخلايا الليفية المرتبطة بالسرطان (CAF) ، والأوعية الدموية هي الجوانب الأساسية ل PDAC. من بين CAFs ، يعتقد أن الخلايا الليفية العضلية و CAFs الالتهابية تشارك في الحديث المتبادل النشط المسؤول عن الخصائص المؤيدة للورم7. كلما كانت التكوينات الليفية على الورم أكثر شمولا ، كان التشخيص أكثر فقرا8،9،10.
لا تزال زراعة الخلايا أحادية الطبقة من خلال خطوط الخلايا الراسخة أداة مفيدة لتحليل سمية الدواء وهي نقطة انطلاق جيدة لإثبات دراسات المفهوم والاكتشاف. ومع ذلك ، تفتقر خطوط زراعة الخلايا الراسخة إلى الحمض النووي للخط الجرثومي والملاءمة السريرية11. نظرا لأنها تنمو على أسطح مستوية ، فإنها تخضع لمعايير اختيار مختلفة في المختبر مقارنة بالوقت الذي تكون فيه جزءا من الورم ، وتنقسم بشكل غير طبيعي وتفقد النمط الظاهريالمتمايز 12. بشكل عام ، تحد مزارع الخلية المفردة من عدم تجانس الورم وبالتالي تفقد أهميتها السريرية. إنهم غير قادرين على تمثيل تعقيد البيئة المكروية للورم بدقة (على سبيل المثال ، ECM). يمكن لثقافة 3D تكرار البيئة المكروية المعقدة للورم بشكل أوثق.
تم تقديم ثقافة 3D في 1970 للخلايا السليمة ونظيراتها الأورام13. تم استخدام العديد من التقنيات لدراسة مورفولوجيا وهندسة الأنسجة الخبيثة من خلال الكرات14. يمكن للمزارع المشتركة مع الخلايا اللحمية نمذجة إشارات TME. شوهد تنظيم لعلامات EMT عندما تمت زراعة الخلايا مع الخلايا النجمية15. يمكن نمذجة كرويات PDAC وتفاعلها مع السدى من خلال الزراعة المشتركة مع مكونات ECM. تم الإبلاغ عن الزراعة المشتركة على وجه التحديد مع PSCs لإنتاج بيانات السمية الخلوية للأدوية ذات الصلة سريريا16،17،18. تساعد PSCs أيضا في مقاومة الأدوية عن طريق التهرب من موت الخلايا المبرمج وتحفيز تكاثر الخلايا السرطانية من خلال عوامل paracrine المختلفة19 وعن طريق تحفيز انتقال EMT. لذلك ، يصبح من الأهمية بمكان تضمين PSCs من مرحلة مبكرة في المعايير المستخدمة لتقييم نجاح الدواء أو نظام توصيل الدواء. كما شوهدت قدرة PSC على تعزيز الانتشار ودعم النمو الأسرع في تركيبة ، مقارنة بخلايا سرطان البنكرياس وحدها ، في الجسم الحي عندما تم تقييم حقن الجناح تحت الجلد لخطي الخلية في الفئران التي تعاني من نقص المناعة20.
تعد قدرة نوع الخلية على التفاعل مع مكونات ECM أمرا بالغ الأهمية أيضا يجب مراعاته عند زراعة كرويات مستزرعة بشكل مشترك. تم الإبلاغ عن أن BxPC-3 و PANC-1 لهما صلات متساوية في الارتباط بالكولاجين. يرتبط خطان خلويان أيضا بشكل مكافئ باللامينين ، على الرغم من وجود تقارير تفيد بأن BxPC-3 يرتبط بشكل أفضلب 21،22،23،24،25. من حيث الهجرة ، أظهر Stahle et al.26 حركة أسرع 5 مرات لخلايا PANC-1 مقارنة ب BxPC-3. كما تم الإبلاغ عن أن خلايا PANC-1 تهاجر بشكل أساسي كخلايا مفردة ، بينما تهاجر خلايا BxPC-3 كورقة معبأة بإحكام. يؤثر اختيار الخلايا أيضا على حجم الورم25. تبين أن أورام BxPC-3 أكبر27,28 من تلك التي تم الحصول عليها من PANC-1 ، بينما أظهرت إحدى الدراسات عكس29 حالة. على الرغم من اختلافاتهما في الحجم والحركة ، فقد تم الإبلاغ عن أن كلتا الخليتين تحتاجان إلى فترات طويلة من الكمون لتشكيل أورام في الفئران. يمكن أن تكون هذه المدة طويلة بشكل خاص ل BxPC-3 تتراوح من 4 أسابيع إلى 4 أشهر25. ومع ذلك ، هناك أيضا أدبيات حيث شكلت الخلايا الجذعية السرطانية BxPC-328 أو BxPC-330 أوراما مرئية بشكل أسرع ، مما يعني أنه قد يكون هناك اختلاف في فترات نمو الورم. لذلك ، يجب أن تكون الفترات المذكورة هنا بمثابة مبدأ توجيهي أولي لمعدلات نمو الورم.
تشكل خلايا BxPC-3 كرويات ذات خلايا فضفاضة على السطح ونوى كثيفة ، في حين تم الإبلاغ عن أن خلايا PANC-1 تشكل كرويات مسامية ولكنها قوية31 بالإضافة إلى كرويات مدمجة. كما تم الإبلاغ عن أن خلايا PANC-1 أقل تمايزا وأكثر عدوانية32. مع الحفاظ على الطبيعة العدوانية32 في المقدمة ، جنبا إلى جنب مع الحركة العالية لخلايا PANC-1 ، والقدرة على تكوين كرويات مدمجة ، والقدرة على التفاعل مع مكونات ECM ، تم اختيار خلايا PANC-1 للدراسات الكروية.
في السنوات القليلة الماضية ، شهدت الثقافة الكروية الكثير من النجاح في إظهار ميزة في أهميتها السريرية مقارنة بالثقافات ثنائية الأبعاد (2D). وقد تم الاستفادة من أهميتها في استخدام هذه التقنية كبديل للدراسات على ولفهم بيولوجيا الأورام بشكل أفضل. مكنت الأهمية السريرية للكرويات ، خاصة عند الاستزراع المشترك مع PSC من استخدامها لدراسة الوظائف المختلفة للكروية مثل الصلابة33 ، والتعبير عن TGF-β34،35،36،37،38 ، E-cadherin ، F-actin18،34،36،37 ، α-SMA34،35،37 ،38 ، نازعة هيدروجين اللاكتات (LDHA) 32 ، HIF-1α35,39 ، مقاومة الأدوية16،37،40 ، هجرة الخلايا41 ، غزو الخلايا37 ، التليف35 ، مقاومة الإشعاع42 ، التغيرات الظاهرية18 ، عدم التجانس36 ، المستويات الخلوية للتفاعلات39 وإظهار مكونات ECM37,38، 39. تعتمد العديد من البروتوكولات التي تم استخدامها للحصول على البيانات الموصوفة على Matrigel أو طريقة الإسقاط المعلق أو القوالب المطبوعة أو السقالات الأخرى للمساعدة في دعم نمو الكرة الأرضية و ECM. عادة ما تتضمن الدراسات أيضا استخدام الخلايا الليفية غير البشرية أو الخلايا النجمية المعزولة حديثا من المرضى. في حين أن استخدام الخلايا النجمية أمر بالغ الأهمية للأورام لتشبه الظروف في الجسم الحي ، فإن التباين بين المرضى المرتبط بعمليات الاستخراج الجديدة يجعل من الصعب تكرار هذه الدراسات.
يهدف هذا البروتوكول إلى إظهار نموذج سهل التطوير وقابل للتكرار وملائم سريريا وخالي من السقالات ، وبالتالي الاعتماد حصريا على قدرات الثقافات المشتركة على توليد ECM بشكل طبيعي. للقيام بذلك ، تم اختيار طريقة بسيطة للاستزراع المشترك تتضمن مزيجا من خلايا PANC-1 (بسبب ميلها الطبيعي للهجرة كخلايا مفردة) جنبا إلى جنب مع الخلايا النجمية البنكرياسية البشرية (HPaSteC) ، نظرا لقدرتها على التصرف مثل الخلايا الجذعية ومقاومة عالية للأدوية. باستخدام الدراسات التي أجراها Durymanov et al.38كخط أساس ، تم إنشاء البروتوكول المفصل أدناه بعد مزيد من تحسين المعلمات مثل نسب الخلايا والفترات بين تغييرات الوسائط. يمكن استخدام الأجسام الكروية الناتجة عن هذا البروتوكول كنظام نموذجي لتقييم الأدوية الجديدةالمرشحة 40.
بالإضافة إلى ذلك ، بالنسبة للمستخدمين الذين ليسوا على دراية بالثقافة الكروية ، قد يكون العمل Peirsman et al.43الذي يناقش تطوير قاعدة معارف MISpheroID مفيدا. يضع بعض المبادئ التوجيهية الحد الأدنى من المعلومات التي يمكن أن تساعد في التعامل مع عدم التجانس بين بروتوكولات المختبر. على الرغم من بعض القيود ، أظهر العمل أن اختيار وسائط الاستزراع ، وخطوط الخلايا ، وطريقة تكوين كروية ، وحجم كروي النهائي أمر بالغ الأهمية في تحديد الخصائص الظاهرية للكرويات.
Protocol
1. ثقافة الخلية 2D
- تنمو خلايا PANC-1 في وسط النسر المعدل (DMEM) من Dulbecco ، مع استكمال مصل بقري الجنين بنسبة 10٪ (FBS) في ظل ظروف معقمة. تنمو تصل إلى 70٪ -80٪ التقاء قبل الممرات ، ولا تستخدمبعد المقطع 20. راجع العملية الموضحة في الخطوة 4.2.1.
ملاحظة: كنقطة مرجعية ، تحتاج 1 × 106 خلايا في 20 مل من الوسائط إلى حوالي 2-3 أيام للوصول إلى التقاء 70-80٪. - تنمو خلايا HPaSteC في وسائط الخلايا النجمية المكملة ب 2٪ FBS و 1٪ PenStrep و 1٪ مكمل نمو الخلايا النجمية (SteCGS) باستخدام المجموعة التي توفرها الشركة المصنعة في ظل ظروف معقمة. تنمو وفقا لتعليمات الشركة المصنعة (مع بعض التعديلات) كما هو موضح في الخطوة 4.2.2 في دورق مطلي ب Poly-L-Lysine.
- تخطي خطوة تحييد FBS أثناء التربسين من بروتوكول الشركة المصنعة حيث يتم استخدام محلول تحييد التربسين (TNS). تحييد معلق الخلية بحجم إجمالي قدره 10 مل من TNS كما هو موضح في الخطوة 4.2.2.2.
ملاحظة: كنقطة مرجعية، تحتاج 0.5 × 106 خلايا و1 × 106 خلايا في 20 مل من الوسائط إلى 3 أيام ويومين على التوالي لتحقيق التقاء 90٪. - حصاد الخلايا عند التقاء 90٪. لا تستخدم الخلايا بعد المقطع 7.
- تخطي خطوة تحييد FBS أثناء التربسين من بروتوكول الشركة المصنعة حيث يتم استخدام محلول تحييد التربسين (TNS). تحييد معلق الخلية بحجم إجمالي قدره 10 مل من TNS كما هو موضح في الخطوة 4.2.2.2.
- الحفاظ على الخلايا عند 37 درجة مئوية ، مع 5٪ CO2 ، في حاضنات معقمة ذات رطوبة نسبية عند 90٪ -95٪. إجراء جميع دراسات زراعة الخلايا في قارورة T-75.
2. بولي (2 - هيدروكسي إيثيل ميثاكريلات (بولي هيما) طلاء محلول ل 96 لوحة بئر
- تحضير محلول بولي هيما عند 5 مجم / مل باستخدام 95٪ إيثانول عن طريق السماح بخلطه طوال الليل باستخدام محرك ساخن عند 37 درجة مئوية. (على سبيل المثال ، يحتاج 500 مل من المحلول إلى 2.5 جم من بولي هيما)
- حدد موقع مستوى صوت البدء قبل إضافة أداة التقمام. استخدم 95٪ إيثانول لتعويض أي خسارة في المحلول في اليوم التالي.
- قم بتصفية المحلول النهائي في غطاء معقم باستخدام مرشح 0.22 ميكرومتر وتخزينه في الثلاجة على حرارة 4 درجات مئوية.
ملاحظة: يستخدم Poly-HEMA لزيادة مقاومة الماء للسطح ، والذي يعمل كرادع للخلايا للالتصاق. نظرا لأن هذه الدراسة تتطلب من الخلايا عدم الالتصاق بالآبار والنمو كطبقة أحادية ، يتم استخدام poly-HEMA كرادع إضافي لميزة التعلق المنخفض الطبيعي للألواح ، مما يجعلها ألواح ربط منخفضة للغاية. - أضف 50 ميكرولتر من المحلول البارد إلى كل بئر من صفيحة ميكروويل مستديرة من البوليسترين مكونة من 96 بئرا داخل غطاء زراعة الخلايا لتغطية اللوحة.
- اترك الآبار مع الغطاء في فرن الهواء الساخن على حرارة 37 درجة مئوية لمدة 3 أيام للتأكد من جفاف الألواح تماما.
- تعقيم الألواح بالأشعة فوق البنفسجية لمدة 30 دقيقة في غطاء زراعة الخلايا قبل بذر الخلايا. يخزن في قفل سحاب مغلق بإحكام للتخزين طويل الأجل وتعقيمه قبل الاستخدام.
3. تخطيط ثقافة الخلية 2D
- حدد وقت التجربة بحيث تتوفر خلايا PANC-1 عند التقاء 70٪ -80٪ في نفس اليوم الذي تصل فيه خلايا HPaSteC إلى 90٪.
ملاحظة: تتطلب القوارير التي تحتوي على حوالي مليون خلية من PANC-1 أو HPaSteC ، عند رفعها من النيتروجين السائل في نفس اليوم ، مع بعض الاختلاف ، 8 أيام من ثقافة PANC-1 و 6-7 أيام من زراعة HPaSteC ليكون كلا خطي الخلية جاهزين في نفس اليوم.
نمو الثقافة 4. 3D
- ارجع إلى نظرة عامة على العملية بأكملها في الشكل 1 قبل بدء العملية.
تنبيه: كل من PANC-1 و HPaSteC من أصل بيولوجي. تعامل مع PANC-1 (خط الخلايا السرطانية) بعناية. - التربسينز وعد الخلايا
- التربسينزي وعد خلايا PANC-1:
- تخلص من المادة الطافية واغسل خلايا PANC-1 ب 9 مل من HBSS (3 مل في المرة الواحدة). تخلص من الكواشف المستخدمة في غطاء المحرك في محلول مبيض 20-25٪ V / V لضمان الموت الكامل للمواد الحية / القابلة للحياة.
- التربسين الخلايا مع 2 مل من التربسين. بعد ما يقرب من 10 دقائق (قد تحتاج إلى مزيد من الوقت) ، عندما يتم فصل جميع الخلايا ، قم بتحييد التعليق ب 10 مل من DMEM + 10٪ FBS. ابدأ ب 3 مل واتبعها بخطوات غسيل لاحقة باستخدام 1 مل لكل غسلة (7 غسلات متبقية) لضمان أقصى تجمع للخلايا التربسينية.
- اجمع كل قسمة متعادلة في نفس الأنبوب سعة 15 مل. سيكون الحجم النهائي في الأنبوب قريبا من 12 مل (~ 2 مل من التربسين الذي تم تحييده باستخدام وسائط 10 مل).
- أجهزة الطرد المركزي تعليق الخلية المحايدة عند 700 × ز لمدة 2 دقيقة و 30 ثانية. تخلص من المادة الطافية وأعد تعليق الحبيبات التي تم الحصول عليها في 1 مل من DMEM + 10٪ FBS. خذ حصة من هذا لحساب الخلايا وقم بتسمية القيمة التي تم الحصول عليها من هذا القسم باسم "العد أ".
- التربسينزي وعد خلايا HPaSteC.
- تخلص من المادة الطافية واغسل خلايا HPaSteC ب 9 مل من HBSS (3 مل في المرة الواحدة).
- التربسين الخلايا مع 2 مل من التربسين. بعد ما يقرب من 10 دقائق ، عندما يتم فصل جميع الخلايا ، قم بتحييد التعليق ب 10 مل من محلول تحييد التربسين. ابدأ ب 3 مل واتبعها بخطوات غسيل لاحقة باستخدام 1 مل لكل غسلة (7 غسلات متبقية) لضمان أقصى تجمع للخلايا التربسينية.
- اجمع كل قسمة متعادلة في نفس الأنبوب سعة 15 مل. سيكون الحجم النهائي في الأنبوب قريبا من 12 مل (~ 2 مل من التربسين الذي تم تحييده ب 10 مل من محلول التحييد).
- أجهزة الطرد المركزي تعليق الخلية المحايدة عند 700 × ز لمدة 2 دقيقة و 30 ثانية. تخلص من المادة الطافية وأعد تعليق الحبيبات التي تم الحصول عليها في 1 مل من وسائط الخلايا النجمية المكملة. خذ حصة من هذا لحساب الخلايا وقم بتسمية القيمة التي تم الحصول عليها من هذا القسم باسم "العد ب".
- التربسينزي وعد خلايا PANC-1:
- تمييع تعليق الخلية الأولية
- توقف مؤقتا عند هذه الخطوة إذا لزم الأمر (ليس أكثر من 0.5 ساعة) لفترة قصيرة بعد الحصول على كل من العددين A و B أو بعد التربسين وتحييد كل من PANC-1 و HPaSteC. الحفاظ على وسائط الاستزراع غير المستخدمة عند 37 درجة مئوية وتعليق الخلايا في درجة حرارة الغرفة (RT؛ 25 ± 2 درجة مئوية).
- استخدم العد A و Count B الذي تم الحصول عليه مسبقا ، لأخذ الحصص وإجراء التخفيفات ذات الصلة (في أنابيب منفصلة) بحيث يكون الحجم النهائي 1 مل (مخفف: DMEM + 10٪ FBS لكلا القارورين) ويتراوح العدد النهائي بين 110,000-140,000 خلية لكل نوع خلية. بمجرد إجراء هذا التخفيف ، تحقق من عدد الخلايا لكل تخفيف لإعطاء العد C (PANC-1) والعدد D (HPaSteC).
- توقف مؤقتا عند هذه الخطوة إذا لزم الأمر (ليس أكثر من 15-30 دقيقة) بعد الحصول على العد C والعدد D. لا تتوقف بمجرد إجراء التخفيفات النهائية في الخطوة 4.3.3.2 ؛ تجربة لتجنب استقرار الخلايا. الحفاظ على وسائط الاستزراع غير المستخدمة عند 37 درجة مئوية وتعليق الخلايا عند RT (25 ± 2 درجة مئوية).
- حافظ على العدد النهائي للخلايا المطلوبة لكل بئر في HPaSteC: PANC-1: 60: 120. استخدم 110 آبار لحساب الفائض. احسب بقيمة أساسية تبلغ 100 ميكرولتر من تعليق الخلية لكل بئر (إجمالي حجم التعليق هو 11 مل ل 110 بئر باستخدام HPaSteC: PANC-1: 60: 120). اصنع هذا التعليق في أنبوب طرد مركزي معقم سعة 50 مل لسهولة الخلط.
- استخدم Count C و Count D ، وقم برفع تعليق الخلايا بدرجة كافية في حل DMEM + 10٪ FBS للحصول على HPaSteC: PANC-1: 60: 120 في حجم نهائي يبلغ 11 مل (6,600 خلية HPaSteC و 13,200 خلية PANC-1 في 11 مل). امزج المحلول جيدا باستخدام ماصة سعة 1 مل عن طريق التحريك والامتصاص لأعلى ولأسفل. تجنب تكوين الزبد.
- بذر
- استخدم ماصة سعة 200 ميكرولتر أو 100 ميكرولتر لخلط التعليق النهائي (حرك عن طريق تحريك طرف الماصة مع السحب لأعلى ولأسفل) في كل خطوة قبل إضافة 100 ميكرولتر من التعليق لكل بئر. أضف 100 ميكرولتر برفق على طول زاوية البئر.
- أعد استخدام نفس الطرف لآبار متعددة ما لم يسقط. امزج ذهابا وإيابا وعد إلى 10 أو 15 (وليس ثانية) بين الإضافات إلى كل بئر للنصف الأول (تقريبا أول 43 بئرا) من اللوحة. خفض عدد الخلط إلى 5-10 بين كل بئر للنصف الثاني (43 بئرا متبقية) لأن حجم التعليق أقل ويتطلب مدة خلط أقل.
- لا تستخدم ماصة متكررة لأن طلاء poly-HEMA الكارهة للماء سيؤدي إلى ارتداد التعليق عن اللوحة ، مما يؤدي إلى توزيع غير متساو.
- تخلص من أي تعليق زائد بعد ملء جميع الآبار.
- استخدم ماصة سعة 200 ميكرولتر أو 100 ميكرولتر لخلط التعليق النهائي (حرك عن طريق تحريك طرف الماصة مع السحب لأعلى ولأسفل) في كل خطوة قبل إضافة 100 ميكرولتر من التعليق لكل بئر. أضف 100 ميكرولتر برفق على طول زاوية البئر.
- الطرد المركزي
- أجهزة الطرد المركزي اللوحة النهائية التي تحتوي على تعليق الخلية لجمع جميع الخلايا معا كحبيبات. لف اللوحة بعناية مع parafilm حول حدود اللوحة لمنع التلوث خلال هذه الخطوة. بعد التفاف ، الطرد المركزي لوحة مع موازنة في 1000 × غرام لمدة 2 دقيقة.
- خذ اللوحة مرة أخرى إلى غطاء زراعة الخلايا (استخدم قفازات رش الإيثانول للتعامل معها) ، وقم بإزالة البارافيلم ، وقم بتخزين الألواح في الحاضنة عند 37 درجة مئوية ، مع 5٪ CO2. لا ترش اللوحة بمزيج الإيثانول والماء في أي وقت.
- صيانة الثقافة
- شاهد الخلايا التي تتجمع معا لتشكيل كرويات تحت المجهر الضوئي عند تكبير 4x-5x بحلول اليوم 3. اتبع بروتوكول الحفاظ على الثقافة كما هو موضح أدناه.
- في اليوم الثالث ، قم بقياس 5-6 مل من DMEM + 10٪ FBS وأضف 50 ميكرولتر منه إلى كل بئر على طول جانب البئر.
- لا تخلط أو تحرك الوسائط بأي شكل من الأشكال أثناء الإضافة ، لأن ذلك سيؤدي إلى إتلاف الكرة أو يؤدي إلى إزالة كروية عرضية. سيكون الحجم النهائي لكل بئر ~ 150 ميكرولتر.
- بعد اليوم 3 ، راجع الشكل 2 للتعرف على بنية البئر وموقع انعكاس الضوء (بين الجزء الأسطواني والمنحني من البئر) الذي يظهر على الوسائط المشار إليها باسم الهالة. قم بإجراء عمليات قريبة من الهالة بحذر لضمان بقاء الأجسام الكروية غير تالفة.
- في اليوم السادس ، قم بقياس 10-11 مل من DMEM + 10٪ FBS. استخدم ماصة سعة 1 مل لسحب الوسائط بكميات كبيرة من آبار متعددة عن طريق سحب الوسائط حتى الهالة. افعل ذلك للوحة بأكملها ، متبوعا باستبدال الوسائط. اجمع المادة الطافية بكميات كبيرة وتخلص منها ، أو تخلص منها أثناء سحبها.
- استبدل الوسائط المهملة بوسائط جديدة بإضافة 100 ميكرولتر من الوسائط على طول جانب كل بئر. سيكون الحجم النهائي في البئر قريبا من 200 ميكرولتر.
- لا تسحب الوسائط إلى ما وراء الهالة ، لأنها تزيد من خطر سحب الكروية عن طريق الخطأ.
- في اليوم 10/11 ، قم بقياس 10-11 مل من DMEM + 10٪ FBS. استخدم ماصة سعة 1 مل لسحب الوسائط بكميات كبيرة من آبار متعددة عن طريق سحب الوسائط حتى الهالة. افعل ذلك للوحة بأكملها ، متبوعا باستبدال الوسائط. اجمع المادة الطافية بكميات كبيرة وتخلص منها ، أو تخلص منها أثناء سحبها.
- استبدل الوسائط المهملة بوسائط جديدة بإضافة 100 ميكرولتر من الوسائط على طول جانب كل بئر. سيكون الحجم النهائي في البئر قريبا من 200 ميكرولتر.
- في اليوم الثالث ، قم بقياس 5-6 مل من DMEM + 10٪ FBS وأضف 50 ميكرولتر منه إلى كل بئر على طول جانب البئر.
- شاهد الخلايا التي تتجمع معا لتشكيل كرويات تحت المجهر الضوئي عند تكبير 4x-5x بحلول اليوم 3. اتبع بروتوكول الحفاظ على الثقافة كما هو موضح أدناه.
- تقييم اليوم النهائي
- أداء العلاج من تعاطي المخدرات على كروية في اليوم 14. قم بتصوير الكائنات الكروية قبل استخدامها باستخدام مجهر برايت فيلد المقلوب تحت هدف 4x لتحديد حجم بدء الكروي. احسب الحجم (V) باستخدام الصيغة التالية:
V = 0.5 × لتر × ث2 - اتبع المعادلة لحساب أحجام كروية موصوفة أعلاه. هنا L هو طول المحور الرئيسي ، و W هو العرض (أطول خط عمودي على المحور الرئيسي). قم بتحويل جميع الوحدات الأصلية من ميكرومتر إلى ملليمتر للحصول على حجم بالمليمتر المكعب.
- يتراوح حجم البدء في كل بئر في اليوم 14 بين 150-200 ميكرولتر بسبب التبخر. بالنسبة للعلاجات الدوائية ، قم بإزالة الوسائط حتى يتم الوصول إلى الهالة من كل بئر واستبدلها ب 100 ميكرولتر من محلول الدواء بقوة 2x ، إلى جانب بعض الخلط اللطيف (امزج الوسائط برفق ذهابا وإيابا أثناء العد إلى 2 بين كل بئر).
- استخدم حلول قوة 2x للسماح لمحلول الدواء النهائي أن يكون عند 1x ولتجنب إزالة الوسائط القديمة تماما من الآبار ، وإلا فقد يتم إزعاج الكائنات الكروية. استخدم الأجسام الكروية في غضون 3 أيام من هذا الإطار الزمني.
- أداء العلاج من تعاطي المخدرات على كروية في اليوم 14. قم بتصوير الكائنات الكروية قبل استخدامها باستخدام مجهر برايت فيلد المقلوب تحت هدف 4x لتحديد حجم بدء الكروي. احسب الحجم (V) باستخدام الصيغة التالية:
- جمع كروي
- قم بقياس أحجام كروية قبل التجميع كما هو موضح في الخطوة 4.7.2.
- اجمع الكرات في اليوم 14 أو 17 ، حسب احتياجات التجربة ، عن طريق إزالة الوسائط من كل بئر حتى يتم الوصول إلى الهالة.
- استخدم ماصة سعة 1 مل لإزالة الوسائط وجمع المادة الطافية في أنبوب طرد مركزي مخروطي سعة 15 مل من آبار متعددة.
- بمجرد أن تحتوي جميع الآبار على وسائط على مستوى الهالة ، قم بتقليل الإعداد على ماصة 1 مل إلى ما بين 200-300 ميكرولتر.
- قم بمحاذاة اللوحة على خلفية غطاء المحرك أو الخلفية الداكنة (على سبيل المثال ، رف أنبوبي) لرؤية الأجسام الكروية المستقرة في الأسفل.
- أدخل الطرف برفق بالقرب من الكرة (اذهب أسفل الهالة) وماصة كمية صغيرة من الوسائط (على سبيل المثال ، تقدير مرئي لما يقرب من 50 ميكرولتر) ذهابا وإيابا لإزعاج الكروي. لا تضع الطرف مباشرة فوق الكروي ، لأن هذا يمكن أن يتلف هيكله.
- لا تسحب جميع الوسائط من البئر في هذه الخطوة. تحكم في حركة الإبهام بإحكام على مكبس الماصة.
- قم بإزاحة الوسائط حتى لا يبقى الكروي في المركز ويمكن رؤيته يتحرك في الخلفية. اسحب ما يكفي من الوسائط لامتصاص الكروي ونقله إلى الموقع المطلوب (على سبيل المثال ، قم بتجميعه مع كرويات أخرى في بئر يمثل جزءا من نفس مجموعة المعالجة).
- التخلص من النفايات
- تخلص من جميع العينات السائلة بمجرد تحييدها باستخدام المبيض وفقا لبروتوكولات إدارة البيئة والسلامة الصحية في المختبرات المعنية. الأوتوكلاف وتجاهل جميع الماصات والقوارير المستخدمة مع النفايات الخطرة بيولوجيا.
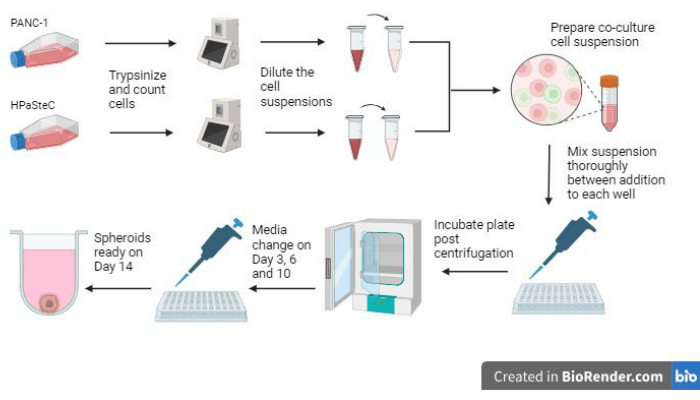
الشكل 1: نظرة عامة على عملية زراعة كرويات سرطان البنكرياس 3D desmoplastic (تم إنشاؤها باستخدام BioRender). ويقدم الشكل لمحة عامة عن العمليات الأساسية المعنية؛ وهي خلايا التربسينز ، باستخدام عدد الخلايا الأولي لعمل معلقات الخلايا المخففة ، وإعداد ثقافة مشتركة باستخدام معلقات الخلايا المخففة ، وإضافة معلقات الخلايا إلى كل بئر ، واحتضان الثقافات ، وإجراء صيانة الوسائط وتشكيل كروي نهائي كما هو متوقع في اليوم 14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: هيكل بئر قاع U. الصورة الصحيحة هي شكل مبالغ فيه لإظهار جزء "الهالة" من البئر. يهدف الشكل إلى تحديد مكان جزء "الهالة" من البئر حيث أن العمل فوق الهالة أمر بالغ الأهمية لزراعة الأجسام الكروية وتجنب الخسارة العرضية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تقييم مكونات ECM والمجهر متحد البؤر
- استخدم التلوين المناعي لتقييم استجابة ECM للعلاج الدوائي وفقا للبروتوكول الذي وصفه Durymanov et al.38.
- اجمع الكرويات معا واغسلها مرتين باستخدام 100 ميكرولتر من برنامج تلفزيوني. قم بتضمين وسط تضمين الأنسجة في درجة حرارة القطع المثلى (OCT) ، وقم بتجميدها والحفاظ عليها عند -80 درجة مئوية.
- قطع كتل الورم المجمدة إلى أقسام 10 ميكرومتر ، وتثبيت الأقسام في خليط الأسيتون والميثانول (1: 1) لمدة 15 دقيقة ، والسماح لها بالتجفيف في الهواء في RT.
- لتحديد مكونات ECM ، قم بتلطيخ عمليات التجميد بالأجسام المضادة الأولية أحادية النسيلة المضادة للفيبرونيكتين للأرانب ، والأجسام المضادة للكولاجين متعددة النسيلة من النوع الأول للأرانب ، والأجسام المضادة لللامينين متعددة النسيلة للأرانب ، والأجسام المضادة لحمض الهيالورونيك متعددة النسيلة للأغنام .
- استخدم IgG المضاد للأرانب الماعز المسمى ب Alexa Fluor 488 أو مضاد للأغنام للحمار مترافق مع Alexa Fluor 568 كأجسام مضادة ثانوية.
ملاحظة: تم تخفيف الأجسام المضادة الأولية والثانوية في 1: 200 و 1: 300 ، على التوالي. - احصل على صور لجميع الأقسام الكروية باستخدام مجهر مسح ليزر متحد البؤر مزود بعدسة موضوعية 20x / 0.45.
النتائج
ثلاث من أهم الخطوات التي ينطوي عليها نمو الكائنات الكروية هي عدد الخلايا الأولي ، وخطوات الخلط أثناء بذر الأجسام الكروية ، وإجراء تغييرات الوسائط في الوقت المناسب للسماح للكرويات بالنمو (الشكل 1). بالإضافة إلى ذلك ، فإن التعرف على الشكل 2
Discussion
استندت المدة ونسب الخلايا المختارة لزراعة الكائنات الكروية إلى دراسات كما ورد سابقا38. عند محاولة تحسين هذه الدراسات عن طريق استبدال خلايا NIH3T3 بخلايا HPaSteC ، تم العثور على أحجام كروية وأنماط موت الخلايا المبرمج تشبه إلى حد كبير المعلمات المحسنة المبلغ عنها (ت...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم العمل الموصوف من قبل مكتب التنمية الاقتصادية لحكام ولاية ساوث داكوتا ، وبرنامج منحة البحوث التنافسية لمجلس حكام ساوث داكوتا (SD-BOR-CRGP) ، وقسم العلوم الصيدلانية في جامعة ولاية ساوث داكوتا لدعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
References
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved