Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выращивание десмопластических трехмерных сфероидов рака поджелудочной железы из сокультуры
В этой статье
Резюме
Рак поджелудочной железы остается одним из самых сложных видов рака для лечения. Поэтому крайне важно, чтобы доклинические модели, оценивающие эффективность лечения, были воспроизводимыми и клинически значимыми. Этот протокол описывает простую процедуру совместного культивирования для получения воспроизводимых, клинически значимых десмопластичных сфероидов.
Аннотация
Протоковая аденокарцинома поджелудочной железы (PDAC) является одним из самых смертоносных видов рака с 5-летней выживаемостью <12%. Самым большим препятствием для терапии является плотный десмопластический внеклеточный матрикс (ВКМ), который окружает опухоль и снижает васкуляризацию, обычно называемую десмоплазией. Для лечения рака были протестированы различные комбинации лекарств и составы, и хотя многие из них показывают успех на доклинической стадии, они терпят неудачу клинически. Поэтому становится важным иметь клинически значимую модель, которая может предсказать реакцию опухоли на терапию. Эта модель ранее была валидирована в отношении резецированных клинических опухолей. Здесь описан простой протокол выращивания десмопластичных трехмерных (3D)-кокультурных сфероидов, которые могут естественным образом генерировать надежную ЭКМ и не требуют никаких внешних матричных источников или каркаса для поддержки их роста.
Вкратце, звездчатые клетки поджелудочной железы человека (HPaSteC) и клетки PANC-1 используются для приготовления суспензии, содержащей клетки в соотношении 1:2 соответственно. Ячейки покрыты 96-луночной U-образной пластиной с покрытием poly-HEMA и низким уровнем крепления. Пластина центрифугируется, чтобы позволить ячейкам сформировать начальную гранулу. Планшет хранится в инкубаторе при температуре 37 °C с 5%CO2, а среда заменяется каждые 3 дня. Пластины могут быть визуализированы через определенные промежутки времени для измерения объема сфероида. После 14 дней культивирования образуются зрелые десмопластические сфероиды (т.е. средний объем 0,048 + 0,012мм3 (451 мкм x 462,84 мкм)) и могут быть использованы для оценки экспериментальной терапии. Зрелые компоненты ВКМ включают коллаген-I, гиалуроновую кислоту, фибронектин и ламинин.
Введение
Плохой прогноз рака поджелудочной железы связан с целым рядом причин, среди которых отсутствие легко обнаруживаемых биомаркеров, что приводит к позднему выявлению. Еще одной важной причиной является толстая строма, окружающая ткань, что приводит к снижению кровоснабжения. Отложение большого количества внеклеточного матрикса (ВКМ), межклеточное взаимодействие, эндотелиальные клетки, различные иммунные клетки, перициты, пролиферирующие миофибробласты и популяция фибробластов, а также присутствие неопухолевых клеток (вместе составляющих десмопластическую реакцию)1 составляют толстую строму, которая отвечает за химио- и радиотерапевтическую резистентность PDAC2. Рак и стромальные клетки имеют сложное, динамическое и двунаправленное взаимодействие. Хотя некоторые элементы либо ослабляют, либо ускоряют прогрессирование заболевания, большинство процессов являются адаптивными во время развития опухоли1. Это обеспечивает среду, богатую факторами роста, проангиогенными факторами, протеазами и молекулами адгезии. Эти факторы способствуют ангиогенезу, пролиферации клеток, метастазированию и инвазии 3,4. Вместе они являются иммунным и привилегированным убежищем для опухоли, что приводит к лекарственной устойчивости.
Десмоплазия представляет собой сложную смесь, состоящую из различных белков ECM, а также иммунных клеток и звездчатых клеток поджелудочной железы (PSC). Вместе они, как правило, образуют каркас для роста клеток. ПСК являются одним из самых крупных компонентов стромального компартмента5. Их способность продуцировать ферменты, такие как матриксные металлопротеина (MMP), тканевые ингибиторы матриксных металлопротеиназ (TIMP) и ассоциированные с раком фибробласты (CAF)6, подразумевает, что они, вероятно, играют решающую роль в развитии десмопластической реакции. ВКМ, ассоциированные с раком фибробласты (CAF) и сосудистая сеть являются основными аспектами PDAC. Среди КАФ предполагается, что миофибробласты и воспалительные КАФ участвуют в активных перекрестных помехах, ответственных за проопухолевые свойства7. Чем обширнее фибробластические образования на опухоли, тем хуже прогноз 8,9,10.
Монослойная клеточная культура с помощью установленных клеточных линий продолжает оставаться полезным инструментом для анализа токсичности лекарств и является хорошей отправной точкой для доказательства концепции и научных исследований. Однако в установленных линиях клеточных культур отсутствует зародышевая ДНК и клиническая близость11. Поскольку они выращиваются на плоских поверхностях, они подвергаются другим критериям отбора in vitro по сравнению с тем, когда они являются частью опухоли, ненормально делятся и теряют свой дифференцированный фенотип12. В целом, одноклеточные культуры ограничивают гетерогенность опухоли и, следовательно, теряют клиническую значимость. Они не могут точно представить сложность микроокружения опухоли (например, ВКМ). 3D-культура может более точно воспроизводить сложное микроокружение опухоли.
3D-культура была введена в 1970-х годах для здоровых клеток и их неопластических аналогов13. Для изучения морфологии и архитектуры злокачественных тканей с помощью сфероидовбыло использовано несколько методов. Кокультуры со стромальными клетками могут моделировать сигналы ТМЭ. Повышение уровня маркеров ЭМП наблюдалось при совместном культивировании клеток со звездчатыми клетками15. Сфероиды PDAC и их взаимодействие со стромой могут быть смоделированы путем совместного культивирования с компонентами ECM. Сообщалось, что совместное культивирование конкретно с ПСК дает клинически значимые данные о цитотоксичности препарата 16,17,18. ПСК также способствуют лекарственной устойчивости, уклоняясь от апоптоза и стимулируя пролиферацию раковых клеток с помощью различных паракринных факторов19 и индуцируя переход ЭМП. Таким образом, становится критически важным включать ПСК с ранней стадии в критерии, используемые для оценки успешности лекарства или системы его доставки. Способность ПСХ усиливать пролиферацию и поддерживать более быстрый рост в комбинации, по сравнению с только раковыми клетками поджелудочной железы, также была замечена in vivo при оценке подкожных фланговых инъекций двух клеточных линий у мышейс ослабленным иммунитетом.
Способность типа клеток взаимодействовать с компонентами ECM также имеет решающее значение при выращивании сфероидов с совместным культивированием. Сообщалось, что BxPC-3 и PANC-1 имеют одинаковое сродство в связывании с коллагеном. Эти две клеточные линии также эквивалентно связываются с ламинином, хотя были сообщения, что BxPC-3 лучше связывается 21,22,23,24,25. С точки зрения миграции, Stahle et al.26 продемонстрировали в 5 раз более высокую подвижность клеток PANC-1 по сравнению с BxPC-3. Также сообщалось, что клетки PANC-1 мигрируют в основном в виде одиночных клеток, в то время как клетки BxPC-3 мигрируют в виде плотно упакованного листа. Выбор клеток также влияет на размер опухоли25. Было показано, что опухоли BxPC-3 в27,28 раза больше, чем опухоли, полученные из PANC-1, в то время как одно исследование продемонстрировало противоположный случай29. Несмотря на различия в размерах и подвижности, обе клетки, как сообщается, нуждаются в длительных латентных периодах для образования опухолей у мышей. Эта продолжительность может быть особенно длительной для BxPC-3 и составлять от 4 недель до 4 месяцев25 месяцев. Тем не менее, есть также литература, в которой говорится, что BxPC-328 или BxPC-3 раковые стволовые клетки30 формируют видимые опухоли быстрее, что подразумевает, что могут наблюдаться вариации в продолжительности роста опухоли. Таким образом, указанные здесь сроки должны служить только начальным ориентиром для темпов роста опухоли.
Клетки BxPC-3 образуют сфероиды со свободными клетками на поверхности и плотными ядрами, в то время как клетки PANC-1, как сообщается, образуют как пористые, но прочные сфероиды31 , так и компактные сфероиды. Также сообщалось, что клетки PANC-1 менее дифференцированы и более агрессивны32. Сохраняя во главу угла агрессивную природу32 в сочетании с более высокой подвижностью клеток PANC-1, способностью образовывать компактные сфероиды и способностью взаимодействовать с компонентами ВКМ, клетки PANC-1 были выбраны для исследования сфероидов.
В последние несколько лет сфероидальная культура добилась больших успехов в демонстрации преимущества в своей клинической значимости по сравнению с двумерными (2D) культурами. Его актуальность была использована для использования этого метода в качестве замены исследованиям на животных и для лучшего понимания биологии опухолей. Клиническая значимость сфероидов, особенно при совместном культивировании с ПСХ, позволила использовать их для изучения различных функций сфероида, таких как жесткость33, экспрессия TGF-β 34,35,36,37,38, E-кадгерин, F-актин 18,34,36,37, α-SMA 34,35,37,38, лактатдегидрогеназа (ЛДГА)32, HIF-1α35,39, лекарственная устойчивость 16,37,40, миграция клеток 41, клеточная инвазия37, фиброз35, радиационная резистентность42, фенотипические изменения18, гетерогенность36, клеточные уровни взаимодействий 39 и демонстрируют компоненты ВКМ37,38,39. Многие из протоколов, которые использовались для получения описанных данных, основаны на Matrigel, методе подвесных капель, печатных формах или других каркасах для поддержки роста сфероидов и ECM. Исследования также обычно включают использование либо фибробластических клеток, отличных от человека, либо свежевыделенных звездчатых клеток пациентов. В то время как использование звездчатых клеток имеет решающее значение для того, чтобы опухоли напоминали условия in vivo, вариабельность между пациентами, связанная со свежими экстракциями, затрудняет повторение этих исследований.
Этот протокол направлен на демонстрацию модели, которая проста в разработке, воспроизводима, клинически значима и свободна от строительных лесов, тем самым полагаясь исключительно на способности сокультур естественно генерировать ECM. Для этого был выбран простой метод совместного культивирования с использованием смеси клеток PANC-1 (из-за их естественной склонности мигрировать в виде одиночных клеток) вместе со звездчатыми клетками поджелудочной железы человека (HPaSteC) из-за их способности вести себя как стволовые клетки и быть высокоустойчивыми к лекарствам. Используя исследования Durymanov et al.38в качестве исходного уровня, протокол, подробно описанный ниже, был разработан после дальнейшей оптимизации таких параметров, как соотношения клеток и продолжительность между сменами среды. Сфероиды, полученные в результате применения этого протокола, могут быть использованы в качестве модельной системы для оценки новых лекарственных препаратов-кандидатов40.
Кроме того, для пользователей, не знакомых с культурой сфероидов, может быть полезна работа Peirsman et al.43, посвященная развитию базы знаний MISpheroID. Он устанавливает некоторые минимальные рекомендации по информации, которые могут помочь справиться с неоднородностью между лабораторными протоколами. Хотя и с некоторыми ограничениями, работа показала, что выбор питательных сред, клеточных линий, метода формирования сфероидов и конечного размера сфероида имеет решающее значение для определения фенотипических свойств сфероидов.
протокол
1. 2D культура клеток
- Выращивайте клетки PANC-1 в модифицированной среде Dulbecco Modified Eagle Medium (DMEM) с добавлением 10% фетальной бычьей сыворотки (FBS) в стерильных условиях. Наращивайте до 70%-80% слияния перед проходами, и не используйте дальше20-го прохода. Обратитесь к процессу, описанному в шаге 4.2.1.
ПРИМЕЧАНИЕ: В качестве ориентира, 1 x 106 клеток в 20 мл среды требуется около 2-3 дней, чтобы достичь 70-80% конфлюенции. - Выращивайте клетки HPaSteC в звездчатых клеточных средах с добавлением 2% FBS, 1% PenStrep и 1% добавки для роста звездчатых клеток (SteCGS) с использованием набора, предоставленного производителем, в стерильных условиях. Выращивайте в соответствии с инструкциями производителя (с некоторыми изменениями), как показано на шаге 4.2.2, в колбе с покрытием из поли-L-лизина.
- Пропустите этап нейтрализации FBS во время трипсинизации в протоколе производителя, так как используется раствор для нейтрализации трипсина (TNS). Нейтрализуйте клеточную суспензию общим объемом 10 мл TNS, как описано в шаге 4.2.2.2.
ПРИМЕЧАНИЕ: В качестве точки отсчета, 0,5 x 106 клеток и 1 x 106 клеток в 20 мл среды требуется 3 дня и 2 дня соответственно для достижения 90% конфлюенции. - Собирайте клетки при 90% конфлюенции. Не используйте ячейки за пределами Прохода 7.
- Пропустите этап нейтрализации FBS во время трипсинизации в протоколе производителя, так как используется раствор для нейтрализации трипсина (TNS). Нейтрализуйте клеточную суспензию общим объемом 10 мл TNS, как описано в шаге 4.2.2.2.
- Поддерживайте клетки при температуре 37 °C с 5%CO2 в стерильных инкубаторах с относительной влажностью 90%-95%. Проводите все исследования клеточных культур в колбе Т-75.
2. Покрытие на основе поли(2-гидроксиэтилметакрилата (поли-HEMA) для 96-луночной пластины
- Приготовьте раствор поли-HEMA в концентрации 5 мг/мл с использованием 95% этанола, дав ему перемешать в течение ночи с помощью нагретой мешалки при 37 °C. (например, на 500 мл раствора требуется 2,5 г поли-HEMA)
- Отметьте место начального объема перед добавлением мешалки. Используйте 95% этанол, чтобы компенсировать любые потери в растворе на следующий день.
- Окончательный раствор отфильтровать в стерильной вытяжке с помощью фильтра 0,22 мкм и хранить в холодильнике при температуре 4 °C.
Поли-HEMA используется для увеличения гидрофобности поверхности, что служит сдерживающим фактором для прикрепления клеток. Поскольку это исследование требует, чтобы клетки не прикреплялись к лункам и не росли в виде монослоя, поли-HEMA используется в качестве дополнительного сдерживающего фактора для естественного свойства пластин с низким уровнем прикрепления, тем самым делая их пластинами со сверхнизким уровнем прикрепления. - Добавьте 50 мкл холодного раствора в каждую лунку 96-луночного круглого полистирольного донного микролуночного планшета внутри колпака для клеточных культур, чтобы покрыть планшет.
- Оставьте лунки с закрытой крышкой в духовке с горячим воздухом при температуре 37 °C на 3 дня, чтобы убедиться, что пластины полностью высохли.
- УФ-стерилизация планшетов в течение 30 минут в колпаке для клеточных культур перед посевом клеток. Хранить в плотно закрытом замке на молнии для длительного хранения и стерилизовать перед использованием.
3. Планирование 2D клеточных культур
- Распланируйте время эксперимента таким образом, чтобы клетки PANC-1 были доступны при 70%-80% конфлюенции в тот же день, когда клетки HPaSteC достигают 90%.
ПРИМЕЧАНИЕ: Флаконы, содержащие около 1 миллиона клеток PANC-1 или HPaSteC, при выращивании из жидкого азота в один и тот же день, с некоторыми вариациями, требуют 8 дней культивирования PANC-1 и 6-7 дней культивирования HPaSteC, чтобы обе клеточные линии были готовы в один и тот же день.
4. 3D рост культуры
- Перед началом процесса ознакомьтесь с обзором всего процесса на рисунке 1 .
ВНИМАНИЕ: Как PANC-1, так и HPaSteC имеют биологическое происхождение. Обращайтесь с PANC-1 (раковой клеточной линией) с осторожностью. - Трипсингинг и подсчет ячеек
- Трипсинзе и подсчет клеток PANC-1:
- Выбросьте надосадочную жидкость и промойте клетки PANC-1 9 мл HBSS (3 мл за один раз). Избавьтесь от использованных реагентов в вытяжке в 20-25% растворе отбеливателя V/V для обеспечения полной гибели живого/жизнеспособного материала.
- Трипсинизируйте клетки 2 мл трипсина. Примерно через 10 минут (может потребоваться больше времени), когда все клетки будут отделены, нейтрализуйте суспензию 10 мл DMEM + 10% FBS. Начните с 3 мл и затем последуйте за последующими этапами промывки с использованием 1 мл на промывку (осталось 7 стирок), чтобы обеспечить максимальное собрание трипсинизированных клеток.
- Объедините каждую нейтрализованную аликвоту в ту же пробирку объемом 15 мл. Конечный объем в пробирке будет близок к 12 мл (~2 мл трипсина, нейтрализованного 10 мл среды).
- Центрифугируйте обезвреженную клеточную суспензию при давлении 700 х г в течение 2 мин и 30 с. Выбросьте надосадочную жидкость и повторно суспендируйте полученную гранулу в 1 мл DMEM +10% FBS. Возьмите аликвоту из него для подсчета ячеек и обозначьте значение, полученное из этого раздела, как "Count A".
- Трипсинзе и подсчет клеток HPaSteC.
- Выбросьте надосадочную жидкость и промойте клетки HPaSteC 9 мл HBSS (3 мл за один раз).
- Трипсинизируйте клетки 2 мл трипсина. Примерно через 10 минут, когда все клетки будут отделены, нейтрализуйте суспензию 10 мл раствора для нейтрализации трипсина. Начните с 3 мл и затем последуйте за последующими этапами промывки с использованием 1 мл на промывку (осталось 7 стирок), чтобы обеспечить максимальное собрание трипсинизированных клеток.
- Объедините каждую нейтрализованную аликвоту в ту же пробирку объемом 15 мл. Конечный объем в пробирке будет близок к 12 мл (~2 мл трипсина, который был нейтрализован 10 мл нейтрализующего раствора).
- Центрифугируйте обезвреженную клеточную суспензию при давлении 700 х г в течение 2 мин и 30 с. Выбросьте надосадочную жидкость и ресуспендируйте полученную гранулу в 1 мл добавленной среды звездчатых клеток. Возьмите из него аликвоту для подсчета ячеек и пометьте значение, полученное из этого раздела, как "Count B".
- Трипсинзе и подсчет клеток PANC-1:
- Разведение исходных клеточных суспензий
- При необходимости сделайте паузу на этом этапе (не более 0,5 ч) на короткое время после получения обоих счетов А и В или после трипсинизации и нейтрализации PANC-1 и HPaSteC. Неиспользованные питательные среды поддерживают при температуре 37 °C, а клеточные суспензии — при комнатной температуре (RT; 25 ± 2 °C).
- Используйте полученные ранее счетчики А и В, чтобы взять аликвоты и сделать соответствующие разведения (в отдельных пробирках) так, чтобы конечный объем составил 1 мл (разбавитель: DMEM + 10% FBS для обоих флаконов), а итоговый объем составил от 110 000 до 140 000 клеток для каждого типа клеток. После того, как это разведение будет сделано, проверьте количество клеток для каждого разведения, чтобы получить количество C (PANC-1) и количество D (HPaSteC).
- При необходимости сделайте паузу на этом шаге (не более 15-30 минут) после получения графа C и графа D. Не останавливайтесь после того, как будут произведены окончательные разведения на этапе 4.3.3.2; Экспериментируйте, чтобы избежать оседания клеток. Неиспользованные питательные среды должны храниться при температуре 37 °C, а клеточные суспензии — при RT (25 ± 2 °C).
- Поддерживайте конечное количество ячеек, необходимое для каждой лунки, на уровне HPaSteC: PANC-1: 60:120. Используйте 110 скважин для расчета с учетом избытка. Расчет с базовым значением 100 мкл клеточной суспензии на лунку (общий объем суспензии составляет 11 мл для 110 лунок с HPaSteC: PANC-1: 60:120). Приготовьте эту суспензию в стерильной центрифужной пробирке объемом 50 мл для удобства смешивания.
- Используйте счетчики C и D и добавьте достаточное количество клеточной суспензии в раствор DMEM + 10% FBS, чтобы получить HPaSteC: PANC-1: 60:120 в конечном объеме 11 мл (6 600 клеток HPaSteC и 13 200 клеток PANC-1 в 11 мл). Тщательно перемешайте раствор с помощью пипетки объемом 1 мл, помешивая и пипетируя вверх и вниз. Не допускайте образования пены.
- Посев
- С помощью пипетки объемом 200 μл или 100 μл перемешивайте окончательную суспензию (перемешивайте, перемещая наконечник пипетки в сочетании с пипетированием вверх и вниз) на каждом этапе перед добавлением 100 μл суспензии на лунку. Аккуратно добавьте 100 μL по углу лунки.
- Повторно используйте один и тот же наконечник для нескольких скважин, если он не отвалится. Перемешивайте взад и вперед и считайте до 10 или 15 (не секунд) между добавлениями в каждую лунку для первой половины (примерно первых 43 лунок) тарелки. Уменьшите количество перемешивания до 5-10 между каждой лункой для второй половины (оставшиеся 43 лунки), так как объем суспензии меньше и требует меньшей продолжительности смешивания.
- Не используйте повторяющийся пипеттор, так как гидрофобное покрытие поли-HEMA приведет к тому, что суспензия отскочит от пластины, что приведет к неравномерному распределению.
- Выбросьте лишнюю суспензию после того, как все колодцы будут заполнены.
- С помощью пипетки объемом 200 μл или 100 μл перемешивайте окончательную суспензию (перемешивайте, перемещая наконечник пипетки в сочетании с пипетированием вверх и вниз) на каждом этапе перед добавлением 100 μл суспензии на лунку. Аккуратно добавьте 100 μL по углу лунки.
- Центрифугирование
- Центрифугируйте конечную пластину, содержащую клеточную суспензию, чтобы собрать все клетки вместе в виде гранул. Аккуратно оберните пластину парапленкой вокруг края пластины, чтобы предотвратить загрязнение во время этого этапа. После упаковки центрифугируйте пластину с противовесом при давлении 1000 x g в течение 2 минут.
- Отнесите планшет обратно в колпак для клеточных культур (для работы используйте перчатки с распылением этанола), снимите парапленку и храните планшеты в инкубаторе при температуре 37 °C с 5%CO2. Ни в коем случае не распыляйте на пластину смесь этанола и воды.
- Уход за культурой
- Посмотрите, как клетки собираются вместе, образуя сфероиды, под световым микроскопом при увеличении 4x-5x на 3-й день. Следуйте протоколу ведения посева, как описано ниже.
- На 3-й день отмерьте 5-6 мл DMEM + 10% FBS и добавьте по 50 мл в каждую лунку вдоль стенки лунки.
- Ни в коем случае не перемешивайте и не перемешивайте среду во время добавления, так как это приведет к повреждению сфероида или случайному удалению сфероида. Итоговый объем на лунку составит ~150 μл.
- После дня 3 обратитесь к рисунку 2 , чтобы ознакомиться со структурой колодца и расположением отражения света (между цилиндрической и изогнутой частями колодца), видимого на носителе, называемом гало. Выполняйте операции вблизи ореола с осторожностью, чтобы убедиться, что сфероиды остаются неповрежденными.
- На 6 день отмерьте 10-11 мл DMEM + 10% FBS. Используйте пипетку объемом 1 мл для извлечения среды навалом из нескольких лунок, вытягивая среду до появления ореола. Проделайте это для всей пластины с последующей заменой носителя. Соберите надосадочную жидкость в большом количестве и выбросьте или выбросьте ее по мере извлечения.
- Замените выброшенный фильтрующий материал свежим, добавив по 100 мкл фильтрующего материала вдоль боковой части каждой лунки. Конечный объем в скважине будет близок к 200 μл.
- Не вытягивайте средства за пределы ореола, так как это повышает риск случайного выдергивания сфероида.
- На 10/11 день отмерьте 10-11 мл DMEM + 10% FBS. Используйте пипетку объемом 1 мл для извлечения среды навалом из нескольких лунок, вытягивая среду до появления ореола. Проделайте это для всей пластины с последующей заменой носителя. Соберите надосадочную жидкость в большом количестве и выбросьте или выбросьте ее по мере извлечения.
- Замените выброшенный фильтрующий материал свежим, добавив по 100 мкл фильтрующего материала вдоль боковой части каждой лунки. Конечный объем в скважине будет близок к 200 μл.
- На 3-й день отмерьте 5-6 мл DMEM + 10% FBS и добавьте по 50 мл в каждую лунку вдоль стенки лунки.
- Посмотрите, как клетки собираются вместе, образуя сфероиды, под световым микроскопом при увеличении 4x-5x на 3-й день. Следуйте протоколу ведения посева, как описано ниже.
- Оценка в последний день
- Проводите медикаментозное лечение сфероидов на 14 день. Визуализируйте сфероиды перед использованием с помощью светлопольного инвертированного микроскопа с объективом 4x для определения начального объема сфероида. Рассчитайте объем (V) по следующей формуле:
V = 0,5 × L × W2 - Следуйте уравнению для расчета объемов сфероида, описанному выше. Здесь L — длина большой оси, а W — ширина (самая длинная линия, перпендикулярная большой оси). Преобразуйте все исходные единицы измерения из микрометров в миллиметры, чтобы получить объем в кубических миллиметрах.
- Начальный объем в каждой скважине на 14-й день составляет от 150 до 200 мкл из-за испарения. Для медикаментозного лечения удаляйте среду до тех пор, пока не будет достигнут ореол из каждой лунки, и замените ее 100 мкл раствора лекарственного препарата с концентрацией в 2 раза, в сочетании с осторожным перемешиванием (осторожно перемешивайте среду вперед и назад, считая до 2 между каждой лункой).
- Используйте растворы с 2-кратной концентрацией, чтобы окончательный раствор препарата был в 1 раз и чтобы избежать полного удаления старых сред из лунок, в противном случае сфероиды могут быть нарушены. Используйте сфероиды в течение 3 дней после этого срока.
- Проводите медикаментозное лечение сфероидов на 14 день. Визуализируйте сфероиды перед использованием с помощью светлопольного инвертированного микроскопа с объективом 4x для определения начального объема сфероида. Рассчитайте объем (V) по следующей формуле:
- Коллекция сфероидов
- Измерьте объемы сфероидов перед сбором, как описано в шаге 4.7.2.
- Соберите сфероиды на 14 или 17 день, в зависимости от потребностей эксперимента, удаляя среду из каждой лунки до тех пор, пока не будет достигнут ореол.
- С помощью пипетки объемом 1 мл удалите среду и соберите надосадочную жидкость в коническую центрифужную пробирку объемом 15 мл из нескольких лунок.
- После того как во всех лунках будет среда на уровне ореола, уменьшите настройку пипетки объемом 1 мл до 200-300 мкл.
- Выровняйте пластину по фону капюшона или темному фону (например, штативу для трубок), чтобы увидеть, как сфероиды расположились внизу.
- Осторожно вставьте наконечник рядом со сфероидом (перейдите ниже ореола) и нанесите небольшое количество среды (например, визуальная оценка около 50 мкл) вперед и назад, чтобы потревожить сфероид. Не стоит класть кончик непосредственно на сфероид, так как это может повредить его структуру.
- Не вытаскивайте все носители из колодца на этом этапе. Держите движение большого пальца на поршне пипетки.
- Перемещайте среду до тех пор, пока сфероид больше не останется в центре и не будет виден движущимся на фоне. Вытяните достаточно среды, чтобы высосать сфероид и переместить его в нужное место (например, объедините его с другими сфероидами в лунке, которая является частью того же набора для обработки).
- Утилизация отходов
- Утилизируйте все жидкие образцы после нейтрализации отбеливателем в соответствии с протоколами отдела безопасности окружающей среды и здоровья соответствующих лабораторий. Автоклавируйте и выбросьте все использованные пипетки и колбы с биологически опасными отходами.
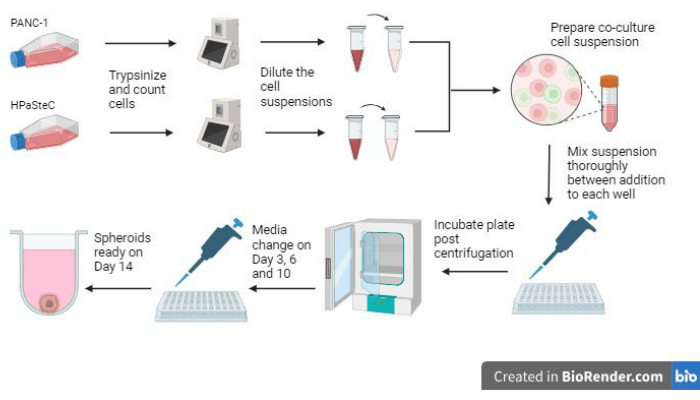
Рисунок 1: Обзор процесса выращивания 3D десмопластических сфероидов рака поджелудочной железы (сгенерировано с помощью BioRender). На рисунке представлен обзор основных задействованных процессов; А именно, трипсингирование клеток, использование начального количества клеток для получения разбавленных клеточных суспензий, приготовление кокультуры с использованием разбавленных клеточных суспензий, добавление клеточных суспензий в каждую лунку, инкубация культур, выполнение поддержания среды и окончательное формирование сфероидов, как ожидается на 14-й день. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Структура U-образной нижней скважины. Правое изображение представляет собой преувеличенную форму, чтобы продемонстрировать «ореол» части скважины. Рисунок направлен на то, чтобы определить, где находится «гало» в скважине, так как работа над гало имеет решающее значение для роста сфероидов и предотвращения случайных потерь. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Оценка компонентов ЭКМ и конфокальная микроскопия
- С помощью иммуноокрашивания оценивают реакцию ВКМ на лекарственную терапию в соответствии с протоколом, описанным Durymanov et al.38.
- Соберите сфероиды вместе и дважды промойте 100 μл PBS. Заложите в среду для встраивания ткани с оптимальной температурой резки (OCT), заморозьте и поддерживайте при температуре -80 °C.
- Разрежьте замороженные опухолевые блоки на срезы размером 10 мкм, зафиксируйте срезы в смеси ацетона и метанола (1:1) на 15 мин и дайте им высохнуть на воздухе при РТ.
- Для определения компонентов ВКМ иммуноокрашивание криосекций первичными моноклональными антифибронектиновыми первичными антителами, поликлональными антителами к коллагену I типа кролика, поликлональными антителами к ламинину кролика и поликлональными антителами к гиалуроновой кислоте овцы.
- В качестве вторичных антител используйте козий антикролик IgG, меченный Alexa Fluor 488, или ослиный антиовечий препарат, конъюгированный с Alexa Fluor 568.
Первичные и вторичные антитела разводили в 1:200 и 1:300 соответственно. - Получение изображений всех сфероидальных сечений с помощью конфокального лазерного сканирующего микроскопа, оснащенного объективом 20x/0,45.
Результаты
Тремя наиболее важными этапами, связанными с выращиванием сфероидов, являются начальный подсчет клеток, этапы смешивания при посеве сфероидов и выполнение своевременных изменений среды, чтобы позволить сфероидам расти (Рисунок 1). Кроме того, знакомс?...
Обсуждение
Продолжительность и соотношение клеток, выбранные для выращивания сфероидов, были основаны на исследованиях, о которых сообщалось ранее38. При попытке оптимизировать эти исследования путем замены клеток HPaSteC на клетки NIH3T3 было обнаружено, что объемы сфер...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Описанная работа была поддержана Управлением экономического развития губернаторов Южной Дакоты, Программой конкурсных исследовательских грантов Совета регентов Южной Дакоты (SD-BOR-CRGP) и Департаментом фармацевтических наук Университета штата Южная Дакота.
Материалы
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Ссылки
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены