Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Züchtung von desmoplastischen dreidimensionalen Pankreaskrebs-Sphäroiden aus Co-Kultur
In diesem Artikel
Zusammenfassung
Bauchspeicheldrüsenkrebs ist nach wie vor eine der am schwierigsten zu behandelnden Krebsarten. Daher ist es von entscheidender Bedeutung, dass präklinische Modelle zur Bewertung der Wirksamkeit der Behandlung reproduzierbar und klinisch relevant sind. Dieses Protokoll beschreibt ein einfaches Co-Kulturverfahren zur Erzeugung reproduzierbarer, klinisch relevanter desmoplastischer Sphäroide.
Zusammenfassung
Das duktale Adenokarzinom der Bauchspeicheldrüse (PDAC) ist mit einer 5-Jahres-Überlebensrate von <12 % eine der tödlichsten Krebsarten. Das größte Hindernis für die Therapie ist die dichte desmoplastische extrazelluläre Matrix (EZM), die den Tumor umgibt und die Vaskularisation reduziert, die allgemein als Desmoplasie bezeichnet wird. Eine Vielzahl von Medikamentenkombinationen und -formulierungen wurde getestet, um den Krebs zu behandeln, und obwohl viele von ihnen präklinisch Erfolg zeigen, versagen sie klinisch. Daher ist es wichtig, ein klinisch relevantes Modell zur Verfügung zu haben, das das Ansprechen des Tumors auf die Therapie vorhersagen kann. Dieses Modell wurde bereits gegen resezierte klinische Tumoren validiert. Hier wird ein einfaches Protokoll zur Züchtung von desmoplastischen dreidimensionalen (3D)-Cokultur-Sphäroiden beschrieben, die auf natürliche Weise eine robuste EZM erzeugen können und keine externen Matrixquellen oder Gerüste benötigen, um ihr Wachstum zu unterstützen.
Kurz gesagt werden humane Pankreas-Sternzellen (HPaSteC) und PANC-1-Zellen verwendet, um eine Suspension herzustellen, die die Zellen im Verhältnis 1:2 enthält. Die Zellen sind mit einer poly-HEMA-beschichteten, 96-Well-U-Well-Platte mit geringer Bindung beschichtet. Die Platte wird zentrifugiert, damit die Zellen ein erstes Pellet bilden können. Die Platte wird im Inkubator bei 37 °C mit 5 % CO2 gelagert und das Medium wird alle 3 Tage gewechselt. Die Platten können in bestimmten Intervallen abgebildet werden, um das Sphäroidvolumen zu messen. Nach 14-tägiger Kultivierung werden reife desmoplastische Sphäroide gebildet (d.h. ein durchschnittliches Volumen von 0,048 + 0,012mm3 (451 μm x 462,84 μm)) und können für die experimentelle Therapiebewertung verwendet werden. Zu den ausgereiften EZM-Komponenten gehören Kollagen-I, Hyaluronsäure, Fibronektin und Laminin.
Einleitung
Die schlechte Prognose von Bauchspeicheldrüsenkrebs ist mit einer Vielzahl von Gründen verbunden, darunter der Mangel an leicht nachweisbaren Biomarkern, die zu einer späten Erkennung führen. Ein weiterer Hauptgrund ist das dicke Stroma, das das Gewebe umgibt und zu einer verminderten Blutversorgung führt. Die Ablagerung großer Mengen an extrazellulärer Matrix (EZM), Zell-Zell-Interaktion, Endothelzellen, verschiedenen Immunzellen, Perizyten, proliferierenden Myofibroblasten und Fibroblastenpopulationen sowie das Vorhandensein nicht-neoplastischer Zellen (die zusammen die desmoplastische Reaktion bilden)1 bilden das dicke Stroma, das für die Chemo- und Strahlenresistenz von PDAC verantwortlich ist2. Krebs- und Stromazellen haben eine komplexe, dynamische und bidirektionale Wechselwirkung. Obwohl einige Elemente das Fortschreiten der Krankheit entweder abschwächen oder beschleunigen, sind die meisten Prozesse während der Entwicklung des Tumors adaptiv1. Dies bietet eine Umgebung, die reich an Wachstumsfaktoren, proangiogenen Faktoren, Proteasen und Adhäsionsmolekülen ist. Diese Faktoren fördern die Angiogenese, die Zellproliferation, die Metastasierung und die Invasion 3,4. Zusammen sind sie ein immun- und medikamentenprivilegierter Zufluchtsort für den Tumor, was zu einer Arzneimittelresistenz führt.
Die Desmoplasie ist ein komplexes Gemisch, das aus verschiedenen EZM-Proteinen, Immunzellen und Pankreas-Sternzellen (PSC) besteht. Zusammen bilden diese in der Regel ein Gerüst, auf dem die Zellen wachsen können. PSCs sind eine der größten Komponenten des Stromakompartiments5. Ihre Fähigkeit, Enzyme wie Matrix-Metalloproteasen (MMP), Gewebeinhibitoren von Matrix-Metalloproteasen (TIMP) und krebsassoziierte Fibroblasten (CAF)6 zu produzieren, deutet darauf hin, dass sie wahrscheinlich eine entscheidende Rolle bei der Entwicklung der desmoplastischen Reaktion spielen werden. Die EZM, die krebsassoziierten Fibroblasten (CAF) und das Gefäßsystem sind die zentralen Aspekte der PDAC. Bei den CAFs wird spekuliert, dass Myofibroblasten und inflammatorische CAFs an einer aktiven Wechselwirkung beteiligt sind, die für die pro-tumoralen Eigenschaften verantwortlich ist7. Je ausgedehnter die fibroblastischen Formationen am Tumor sind, desto schlechter ist die Prognose 8,9,10.
Die Monolayer-Zellkultur durch etablierte Zelllinien ist nach wie vor ein nützliches Werkzeug für die Analyse der Toxizität von Arzneimitteln und ein guter Ausgangspunkt für Proof-of-Concept- und Discovery-Studien. Etablierten Zellkulturlinien fehlt es jedoch an Keimbahn-DNA und klinischer Zuordenbarkeit11. Da sie auf ebenen Flächen gezüchtet werden, durchlaufen sie in vitro andere Selektionskriterien als wenn sie Teil des Tumors sind, teilen sich abnormal und verlieren ihren differenzierten Phänotyp12. Insgesamt begrenzen Einzelzellkulturen die Heterogenität des Tumors und verlieren daher an klinischer Relevanz. Sie sind nicht in der Lage, die Komplexität der Mikroumgebung des Tumors (z.B. der EZM) genau darzustellen. Die 3D-Kultur kann die komplexe Mikroumgebung des Tumors besser nachbilden.
Die 3D-Kultur wurde in den 1970er Jahren für gesunde Zellen und ihre neoplastischen Gegenstücke eingeführt13. Verschiedene Techniken wurden verwendet, um die Morphologie und Architektur von malignen Geweben durch Sphäroidezu untersuchen 14. Co-Kulturen mit Stromazellen können TME-Signale modellieren. Eine Hochregulation der EMT-Marker wurde beobachtet, wenn Zellen mit Sternzellen co-kultiviert wurden15. PDAC-Sphäroide und ihre Wechselwirkung mit dem Stroma können durch Co-Kultivierung mit ECM-Komponenten modelliert werden. Es wurde berichtet, dass die Co-Kultivierung speziell mit PSCs klinisch relevante Daten zur Zytotoxizität von Arzneimitteln liefert 16,17,18. PSCs unterstützen auch die Arzneimittelresistenz, indem sie die Apoptose umgehen und die Proliferation von Krebszellen durch verschiedene parakrine Faktorenstimulieren 19 und indem sie den EMT-Übergang induzieren. Daher ist es von entscheidender Bedeutung, die PSCs von Anfang an in die Kriterien einzubeziehen, die zur Bewertung des Erfolgs eines Arzneimittels oder eines Arzneimittelverabreichungssystems herangezogen werden. Die Fähigkeit des PSC, die Proliferation zu verstärken und ein schnelleres Wachstum in Kombination zu unterstützen, im Vergleich zu Bauchspeicheldrüsenkrebszellen allein, wurde auch in vivo beobachtet, als subkutane Flankeninjektionen der beiden Zelllinien bei immungeschwächten Mäusen untersucht wurden20.
Die Fähigkeit eines Zelltyps, mit EZM-Komponenten zu interagieren, ist auch bei der Züchtung von co-kultivierten Sphäroiden von entscheidender Bedeutung. Es wurde berichtet, dass BxPC-3 und PANC-1 gleiche Affinitäten bei der Bindung an Kollagen aufweisen. Die beiden Zelllinien binden auch äquivalent an Laminin, obwohl es Berichte gibt, dass BxPC-3 besserbindet 21,22,23,24,25. In Bezug auf die Migration zeigten Stahle et al.26 eine 5x schnellere Motilität für PANC-1-Zellen im Vergleich zu BxPC-3. Es wurde auch berichtet, dass PANC-1-Zellen hauptsächlich als Einzelzellen migrieren, während BxPC-3-Zellen als dicht gepackte Folie migrieren. Die Wahl der Zellen wirkt sich auch auf die Größe des Tumorsaus 25. Es zeigte sich, dass BxPC-3-Tumoren größer waren27,28 als solche, die mit PANC-1 gewonnen wurden, während eine Studie den gegenteiligen Fall zeigte29. Trotz ihrer Unterschiede in Größe und Beweglichkeit wurde berichtet, dass beide Zellen lange Latenzzeiten benötigen, um bei Mäusen Tumore zu bilden. Diese Dauer kann bei BxPC-3 besonders lang sein und reicht von 4 Wochen bis 4 Monaten25. Es gibt jedoch auch Literatur, in der BxPC-328 oder BxPC-3 Krebsstammzellen30 schneller sichtbare Tumore gebildet haben, was darauf hindeutet, dass es zu Schwankungen in der Tumorwachstumsdauer kommen könnte. Die hier angegebenen Dauern sollten daher nur als erster Richtwert für die Tumorwachstumsraten dienen.
BxPC-3-Zellen bilden Sphäroide mit losen Zellen auf der Oberfläche und dichten Kernen, während PANC-1-Zellen sowohl poröse, aber robuste Sphäroide31 als auch kompakte Sphäroide bilden. Es wurde auch berichtet, dass PANC-1-Zellen weniger differenziert und aggressiver sind32. Unter Beibehaltung der aggressiven Natur32 im Vordergrund, kombiniert mit der höheren Motilität der PANC-1-Zellen, der Fähigkeit, kompakte Sphäroide zu bilden, und der Fähigkeit, mit EZM-Komponenten zu interagieren, wurden PANC-1-Zellen für Sphäroidstudien ausgewählt.
In den letzten Jahren hat die Sphäroidkultur große Erfolge erzielt, indem sie einen Vorteil in ihrer klinischen Relevanz im Vergleich zu zweidimensionalen (2D) Kulturen demonstriert hat. Ihre Relevanz wurde genutzt, um diese Technik als Ersatz für Tierversuche und zum besseren Verständnis der Biologie der Tumore einzusetzen. Die klinische Relevanz von Sphäroiden, insbesondere wenn sie mit PSCs co-kultiviert werden, hat ihre Verwendung zur Untersuchung verschiedener Funktionen des Sphäroids ermöglicht, wie z. B. Steifigkeit33, Expression von TGF-β34,35,36,37,38, E-Cadherin, F-Aktin 18,34,36,37, α-SMA 34,35,37,38, Laktatdehydrogenase (LDHA)32, HIF-1α35,39, Arzneimittelresistenz 16,37,40, Zellmigration41, Zellinvasion37, Fibrose35, Strahlenresistenz42, phänotypische Veränderungen18, Heterogenität36, zelluläre Interaktionsniveaus39 und Nachweis von EZM-Komponenten 37,38,39. Viele der Protokolle, die zur Gewinnung der beschriebenen Daten verwendet wurden, basieren auf Matrigel, der Hanging Drop-Methode, gedruckten Formen oder anderen Gerüsten, um das Wachstum von Sphäroiden und ECM zu unterstützen. Die Studien beinhalten in der Regel auch die Verwendung von nicht-menschlichen fibroblastischen Zellen oder frisch isolierten Sternzellen von Patienten. Während die Verwendung von Sternzellen entscheidend ist, damit die Tumoren In-vivo-Bedingungen ähneln, erschwert die Variabilität zwischen den Patienten, die mit frischen Extraktionen verbunden ist, die Replikation dieser Studien.
Dieses Protokoll zielt darauf ab, ein Modell zu demonstrieren, das einfach zu entwickeln, reproduzierbar, klinisch relevant und frei von Gerüsten ist und sich dabei ausschließlich auf die Fähigkeiten der Kokulturen stützt, die EZM auf natürliche Weise zu erzeugen. Zu diesem Zweck wurde eine einfache Co-Kulturmethode gewählt, bei der eine Mischung aus PANC-1-Zellen (aufgrund ihrer natürlichen Tendenz, als Einzelzellen zu wandern) und humanen Pankreas-Sternzellen (HPaSteC) verwendet wird, da sie sich wie Stammzellen verhalten und hochgradig resistent sind. Unter Verwendung der Studien von Durymanov et al.38als Grundlage wurde das unten beschriebene Protokoll erstellt, nachdem Parameter wie Zellverhältnisse und die Dauer zwischen den Medienwechseln weiter optimiert wurden. Die aus diesem Protokoll resultierenden Sphäroide können als Modellsystem für die Evaluierung neuer Wirkstoffkandidaten verwendet werden40.
Darüber hinaus kann für Benutzer, die mit der Sphäroidkultur nicht vertraut sind, die Arbeit von Peirsman et al.43hilfreich sein, in der die Entwicklung der MISpheroID-Wissensdatenbank diskutiert wird. Es legt einige Mindestinformationsrichtlinien fest, die helfen könnten, mit der Heterogenität zwischen Laborprotokollen umzugehen. Wenn auch mit einigen Einschränkungen, zeigte die Arbeit, dass die Wahl des Kulturmediums, der Zelllinien, der Methode zur Sphäroidbildung und der endgültigen Sphäroidgröße entscheidend für die Bestimmung der phänotypischen Eigenschaften von Sphäroiden ist.
Protokoll
1. 2D-Zellkultur
- Züchten Sie PANC-1-Zellen in Dulbeccos modifiziertem Eagle Medium (DMEM), ergänzt mit 10 % fötalem Rinderserum (FBS) unter sterilen Bedingungen. Wachsen Sie bis zu 70%-80% Konfluenz vor Passagen und verwenden Sie sie nicht über die 20. Passage hinaus. Beziehen Sie sich auf den in Schritt 4.2.1 beschriebenen Prozess.
HINWEIS: Als Anhaltspunkt benötigen 1 x 106 Zellen in 20 mL Medium etwa 2-3 Tage, um eine Konfluenz von 70-80 % zu erreichen. - Züchten Sie HPaSteC-Zellen in Sternzellmedien, die mit 2 % FBS, 1 % PenStrep und 1 % Stellate Cell Growth Supplement (SteCGS) ergänzt sind, unter Verwendung des vom Hersteller bereitgestellten Kits unter sterilen Bedingungen. Wachsen Sie gemäß den Anweisungen des Herstellers (mit einigen Modifikationen), wie in Schritt 4.2.2 gezeigt, in einem mit Poly-L-Lysin beschichteten Kolben.
- Überspringen Sie den FBS-Neutralisationsschritt während der Trypsinisierung aus dem Protokoll des Herstellers, da die Trypsin-Neutralisationslösung (TNS) verwendet wird. Die Zellsuspension wird mit einem Gesamtvolumen von 10 ml TNS neutralisiert, wie in Schritt 4.2.2.2 beschrieben.
HINWEIS: Als Referenzpunkt benötigen 0,5 x 106 Zellen und 1 x 106 Zellen in 20 ml Medium 3 Tage bzw. 2 Tage, um eine Konfluenz von 90 % zu erreichen. - Ernten Sie Zellen mit einer Konfluenz von 90 %. Verwenden Sie keine Zellen nach Passage 7.
- Überspringen Sie den FBS-Neutralisationsschritt während der Trypsinisierung aus dem Protokoll des Herstellers, da die Trypsin-Neutralisationslösung (TNS) verwendet wird. Die Zellsuspension wird mit einem Gesamtvolumen von 10 ml TNS neutralisiert, wie in Schritt 4.2.2.2 beschrieben.
- Halten Sie die Zellen bei 37 °C mit 5 % CO2 in sterilen Inkubatoren mit einer relativen Luftfeuchtigkeit von 90 % bis 95 %. Führen Sie alle Zellkulturstudien in einem T-75-Kolben durch.
2. Poly(2-hydroxyethylmethacrylat (Poly-HEMA)-Lösungsbeschichtung für 96-Well-Platten
- Bereiten Sie eine Poly-HEMA-Lösung mit 5 mg/ml unter Verwendung von 95 % Ethanol vor, indem Sie sie über Nacht mit einem erhitzten Rührer bei 37 °C mischen lassen (z. B. 500 ml Lösung benötigen 2,5 g Poly-HEMA)
- Markieren Sie die Position des Startvolumens, bevor Sie den Rührer hinzufügen. Verwenden Sie 95%iges Ethanol, um den Verlust der Lösung am nächsten Tag auszugleichen.
- Die wird in einer sterilen Haube mit einem 0,22-μm-Filter filtriert und bei 4 °C im Kühlschrank gelagert.
HINWEIS: Poly-HEMA wird verwendet, um die Hydrophobie einer Oberfläche zu erhöhen, was als Abschreckungsmittel für die Anheftung von Zellen dient. Da diese Studie erfordert, dass sich die Zellen nicht an die Vertiefungen anheften und als Monoschicht wachsen, wird Poly-HEMA als zusätzliche Abschreckung gegen die natürliche geringe Bindung der Platten verwendet, wodurch sie zu Platten mit extrem geringer Bindung werden. - Geben Sie 50 μl der kalten Lösung in jede Vertiefung einer 96-Well-Mikrotiterplatte mit rundem Polystyrolboden in einer Zellkulturhaube, um die Platte zu beschichten.
- Lassen Sie die Vertiefungen mit geschlossenem Deckel 3 Tage lang bei 37 °C Heißluftofen stehen, damit die Platten vollständig trocken sind.
- Sterilisieren Sie die Platten vor der Zellaussaat 30 Minuten lang in der Zellkulturhaube mit UV-Sterilität. Für die Langzeitlagerung in einem fest verschlossenen Reißverschluss aufbewahren und vor Gebrauch sterilisieren.
3. Planung von 2D-Zellkulturen
- Planen Sie das Experiment so, dass PANC-1-Zellen mit einer Konfluenz von 70 % bis 80 % am selben Tag verfügbar sind, an dem die HPaSteC-Zellen 90 % erreichen.
HINWEIS: Durchstechflaschen mit etwa 1 Million Zellen PANC-1 oder HPaSteC, die am selben Tag aus flüssigem Stickstoff gezüchtet werden, erfordern mit einigen Abweichungen 8 Tage PANC-1-Kultur und 6-7 Tage HPaSteC-Kultur, um beide Zelllinien am selben Tag fertig zu haben.
4. 3D kulturelles Wachstum
- Sehen Sie sich die Übersicht über den gesamten Prozess in Abbildung 1 an, bevor Sie den Prozess starten.
ACHTUNG: Sowohl PANC-1 als auch HPaSteC sind biologischen Ursprungs. Gehen Sie vorsichtig mit PANC-1 (krebsartige Zelllinie) um. - Trypsinzierung und Zellzählung
- Trypsinze und Zählung PANC-1 Zellen:
- Entsorgen Sie den Überstand und waschen Sie die PANC-1-Zellen mit 9 ml HBSS (jeweils 3 ml). Entsorgen Sie gebrauchte Reagenzien in der Haube in einer 20-25%igen V/V-Bleichlösung, um den vollständigen Tod des lebenden/lebensfähigen Materials sicherzustellen.
- Trypsinisieren Sie die Zellen mit 2 ml Trypsin. Nach fast 10 Minuten (es kann mehr Zeit dauern), wenn alle Zellen abgelöst sind, neutralisieren Sie die Suspension mit 10 ml DMEM + 10% FBS. Beginnen Sie mit 3 mL und folgen Sie mit nachfolgenden Waschschritten mit 1 mL pro Waschgang (7 Waschgänge verbleibend), um eine maximale Sammlung trypsinisierter Zellen zu gewährleisten.
- Sammeln Sie jedes neutralisierte Aliquot in dasselbe 15-ml-Röhrchen. Das endgültige Volumen im Röhrchen liegt bei 12 mL (~2 mL Trypsin, das mit 10 mL Medium neutralisiert wurde).
- Die neutralisierte Zellsuspension bei 700 x g für 2 min und 30 s zentrifugieren. Den Überstand verwerfen und das in 1 ml DMEM +10 % FBS erhaltene Pellet resuspendieren. Nehmen Sie daraus ein Aliquot für die Zellzählung und beschriften Sie den aus diesem Abschnitt erhaltenen Wert als "Zählung A".
- Trypsinze und zählen HPaSteC-Zellen.
- Entsorgen Sie den Überstand und waschen Sie die HPaSteC-Zellen mit 9 ml HBSS (jeweils 3 mL).
- Trypsinisieren Sie die Zellen mit 2 ml Trypsin. Nach fast 10 Minuten, wenn alle Zellen abgelöst sind, neutralisieren Sie die Suspension mit 10 ml Trypsin-Neutralisationslösung. Beginnen Sie mit 3 mL und folgen Sie mit nachfolgenden Waschschritten mit 1 mL pro Waschgang (7 Waschgänge verbleibend), um eine maximale Sammlung trypsinisierter Zellen zu gewährleisten.
- Sammeln Sie jedes neutralisierte Aliquot in dasselbe 15-ml-Röhrchen. Das endgültige Volumen im Röhrchen liegt bei 12 mL (~2 mL Trypsin, das mit 10 mL Neutralisationslösung neutralisiert wurde).
- Die neutralisierte Zellsuspension bei 700 x g für 2 min und 30 s zentrifugieren. Der Überstand wird verworfen und das in 1 ml des supplementierten Sternzellmediums erhaltene Pellet resuspendiert. Nehmen Sie ein Aliquot daraus für die Zellzählung und beschriften Sie den aus diesem Abschnitt erhaltenen Wert als "Zählung B".
- Trypsinze und Zählung PANC-1 Zellen:
- Verdünnung der anfänglichen Zellsuspensionen
- Pausieren Sie bei Bedarf (nicht länger als 0,5 h) bei diesem Schritt für eine kurze Zeit, nachdem Sie entweder beide Zählungen A und B erhalten haben oder nachdem Sie sowohl PANC-1 als auch HPaSteC trypsinisiert und neutralisiert haben. Unbenutzte Nährmedien werden bei 37 °C und Zellsuspensionen bei Raumtemperatur (RT; 25 ± 2 °C) aufbewahrt.
- Verwenden Sie Count A und Count B, die Sie zuvor erhalten haben, um Aliquote zu entnehmen und entsprechende Verdünnungen (in separaten Röhrchen) vorzunehmen, so dass das endgültige Volumen 1 ml beträgt (Verdünnungsmittel: DMEM + 10 % FBS für beide Fläschchen) und die endgültige Zählung zwischen 110.000 und 140.000 Zellen für jeden Zelltyp liegt. Sobald diese Verdünnung erfolgt ist, überprüfen Sie die Zellzahlen für jede Verdünnung, um Count C (PANC-1) und Count D (HPaSteC) zu erhalten.
- Halten Sie bei Bedarf (nicht länger als 15-30 Minuten) bei diesem Schritt an, nachdem Sie Count C und Count D erhalten haben. Hören Sie nicht auf, sobald die endgültigen Verdünnungen in Schritt 4.3.3.2 vorgenommen wurden. Experimentieren Sie, um Zellablagerungen zu vermeiden. Nicht verwendete Nährmedien bei 37 °C und Zellsuspensionen bei RT (25 ± 2 °C) aufbewahren.
- Die endgültige Anzahl der pro Well benötigten Zellen bei HPaSteC wird beibehalten: PANC-1: 60:120. Verwenden Sie 110 Wells für die Berechnung, um den Überschuss zu berücksichtigen. Rechnen Sie mit einem Basiswert von 100 μl Zellsuspension pro Well (das Gesamtsuspensionsvolumen beträgt 11 mL für 110 Wells mit HPaSteC: PANC-1: 60:120). Stellen Sie diese Suspension in einem sterilen 50-ml-Zentrifugenröhrchen her, um das Mischen zu erleichtern.
- Verwenden Sie Count C und Count D und geben Sie genügend Zellsuspension in eine DMEM + 10%ige FBS-Lösung, um HPaSteC: PANC-1: 60:120 in einem Endvolumen von 11 mL (6.600 HPaSteC-Zellen und 13.200 PANC-1-Zellen in 11 mL) zu erhalten. Mischen Sie die Lösung gründlich mit einer 1-ml-Pipette, indem Sie umrühren und auf und ab pipettieren. Vermeiden Sie Schaumbildung.
- Bekeimung
- Verwenden Sie eine 200 μl oder 100 μl Pipette, um die endgültige Suspension bei jedem Schritt zu mischen (rühren Sie um, indem Sie die Pipettenspitze in Kombination mit dem Auf- und Abpipettieren bewegen), bevor Sie 100 μl der Suspension pro Vertiefung hinzufügen. Geben Sie die 100 μl vorsichtig an der Ecke der Vertiefung entlang.
- Verwenden Sie dieselbe Spitze für mehrere Vertiefungen, es sei denn, sie fällt ab. Mischen Sie hin und her und zählen Sie bis 10 oder 15 (nicht Sekunden) zwischen den Zugaben zu jeder Vertiefung für die erste Hälfte (ungefähr die ersten 43 Vertiefungen) der Platte. Verringern Sie die Mischzahl zwischen den einzelnen Vertiefungen für die zweite Hälfte (verbleibende 43 Vertiefungen) auf 5-10, da das Suspensionsvolumen geringer ist und eine kürzere Mischdauer erforderlich ist.
- Verwenden Sie keine Repeating-Pipette, da die hydrophobe Poly-HEMA-Beschichtung dazu führt, dass die Suspension von der Platte abprallt, was zu einer ungleichmäßigen Verteilung führt.
- Entsorgen Sie überschüssige Suspension, nachdem alle Vertiefungen gefüllt sind.
- Verwenden Sie eine 200 μl oder 100 μl Pipette, um die endgültige Suspension bei jedem Schritt zu mischen (rühren Sie um, indem Sie die Pipettenspitze in Kombination mit dem Auf- und Abpipettieren bewegen), bevor Sie 100 μl der Suspension pro Vertiefung hinzufügen. Geben Sie die 100 μl vorsichtig an der Ecke der Vertiefung entlang.
- Zentrifugation
- Zentrifugieren Sie die letzte Platte mit der Zellsuspension, um alle Zellen zu einem Pellet zusammenzuführen. Wickeln Sie die Platte vorsichtig mit Parafilm um den Rand der Platte, um eine Kontamination während dieses Schritts zu vermeiden. Nach dem Einwickeln die Platte mit einem Gegengewicht bei 1000 x g 2 min zentrifugieren.
- Nehmen Sie die Platte wieder in die Zellkulturhaube (verwenden Sie mit Ethanol besprühte Handschuhe zur Handhabung), entfernen Sie den Parafilm und lagern Sie die Platten im Inkubator bei 37 °C und 5 % CO2. Besprühen Sie die Platte an keiner Stelle mit einem Ethanol-Wasser-Gemisch.
- Kulturpflege
- Beobachten Sie, wie sich Zellen unter einem Lichtmikroskop bei 4- bis 5-facher Vergrößerung an Tag 3 zu Sphäroiden zusammenschließen. Befolgen Sie das Kulturwartungsprotokoll wie unten beschrieben.
- Messen Sie an Tag 3 5-6 mL DMEM + 10 % FBS ab und geben Sie 50 μl davon in jede Vertiefung an der Seite der Vertiefung.
- Mischen oder rühren Sie das Medium während der Zugabe in keiner Weise, da dies das Sphäroid beschädigt oder zu einer versehentlichen Entfernung des Sphäroids führt. Das endgültige Volumen pro Vertiefung beträgt ~150 μL.
- Nach Tag 3 können Sie sich in Abbildung 2 mit der Struktur des Bohrlochs und der Position der Lichtreflexion (zwischen dem zylindrischen und dem gekrümmten Teil des Bohrlochs) vertraut machen, die auf dem als Halo bezeichneten Medium zu sehen ist. Führen Sie Vorgänge in der Nähe des Halos mit Vorsicht durch, um sicherzustellen, dass die Sphäroide unbeschädigt bleiben.
- Messen Sie an Tag 6 10-11 ml DMEM + 10% FBS. Verwenden Sie eine 1-ml-Pipette, um Medien in großen Mengen aus mehreren Vertiefungen zu ziehen, indem Sie das Medium bis zum Halo herausziehen. Tun Sie dies für die gesamte Platte, gefolgt von einem Medienwechsel. Überstand in großen Mengen sammeln und entsorgen oder entsorgen, wenn er herausgezogen wird.
- Ersetzen Sie die ausrangierten Medien durch frische Medien, indem Sie 100 μl Medium an der Seite jeder Vertiefung hinzufügen. Das endgültige Volumen in der Vertiefung beträgt fast 200 μl.
- Ziehen Sie das Medium nicht über den Halo hinaus, da dies das Risiko eines versehentlichen Herausziehens des Sphäroids erhöht.
- Messen Sie am Tag 10/11 10-11 ml DMEM + 10% FBS. Verwenden Sie eine 1-ml-Pipette, um Medien in großen Mengen aus mehreren Vertiefungen zu ziehen, indem Sie das Medium bis zum Halo herausziehen. Tun Sie dies für die gesamte Platte, gefolgt von einem Medienwechsel. Überstand in großen Mengen sammeln und entsorgen oder entsorgen, wenn er herausgezogen wird.
- Ersetzen Sie die ausrangierten Medien durch frische Medien, indem Sie 100 μl Medium an der Seite jeder Vertiefung hinzufügen. Das endgültige Volumen in der Vertiefung beträgt fast 200 μl.
- Messen Sie an Tag 3 5-6 mL DMEM + 10 % FBS ab und geben Sie 50 μl davon in jede Vertiefung an der Seite der Vertiefung.
- Beobachten Sie, wie sich Zellen unter einem Lichtmikroskop bei 4- bis 5-facher Vergrößerung an Tag 3 zu Sphäroiden zusammenschließen. Befolgen Sie das Kulturwartungsprotokoll wie unten beschrieben.
- Bewertung am Abschlusstag
- Führen Sie an Tag 14 eine medikamentöse Behandlung der Sphäroide durch. Bilden Sie die Sphäroide vor der Verwendung mit einem inversen Hellfeldmikroskop unter einem 4-fach-Objektiv ab, um das Startvolumen des Sphäroids zu bestimmen. Berechnen Sie das Volumen (V) mit der folgenden Formel:
V = 0,5 × L × W2 - Befolgen Sie die oben beschriebene Gleichung zur Berechnung des Sphäroidvolumens. Dabei ist L die Länge der Hauptachse und W die Breite (längste Linie senkrecht zur Hauptachse). Rechnen Sie alle ursprünglichen Einheiten von Mikrometern in Millimeter um, um ein Volumen in Kubikmillimetern zu erhalten.
- Das Startvolumen in jeder Vertiefung an Tag 14 liegt aufgrund der Verdunstung zwischen 150 und 200 μl. Entfernen Sie bei medikamentösen Behandlungen das Medium, bis der Halo aus jeder Vertiefung erreicht ist, und ersetzen Sie es durch 100 μl der Arzneimittellösung mit 2-facher Stärke, gekoppelt mit etwas sanftem Mischen (mischen Sie das Medium vorsichtig hin und her, während Sie zwischen den einzelnen Vertiefungen bis 2 zählen).
- Verwenden Sie Lösungen mit einer Stärke von 2x, damit die endgültige Arzneimittellösung bei 1x liegt und um zu vermeiden, dass alte Medien vollständig aus den Vertiefungen entfernt werden, da andernfalls die Sphäroide gestört werden können. Verwenden Sie die Sphäroide innerhalb von 3 Tagen nach diesem Zeitraum.
- Führen Sie an Tag 14 eine medikamentöse Behandlung der Sphäroide durch. Bilden Sie die Sphäroide vor der Verwendung mit einem inversen Hellfeldmikroskop unter einem 4-fach-Objektiv ab, um das Startvolumen des Sphäroids zu bestimmen. Berechnen Sie das Volumen (V) mit der folgenden Formel:
- Sammlung von Sphäroiden
- Messen Sie die Sphäroidvolumina vor der Entnahme, wie in Schritt 4.7.2 beschrieben.
- Sammeln Sie die Sphäroide an Tag 14 oder 17, je nach Bedarf des Experiments, indem Sie das Medium aus jeder Vertiefung entfernen, bis der Halo erreicht ist.
- Verwenden Sie eine 1-ml-Pipette, um das Medium zu entfernen, und sammeln Sie den Überstand in einem konischen 15-ml-Zentrifugenröhrchen aus mehreren Vertiefungen.
- Sobald sich alle Vertiefungen mit Medien auf Halo-Ebene befinden, reduzieren Sie die Einstellung an der 1-ml-Pipette auf 200 bis 300 μl.
- Richten Sie die Platte gegen den Hintergrund der Haube oder einen dunklen Hintergrund (z. B. ein Rohrgestell) aus, um zu sehen, wie sich die Sphäroide am Boden absetzen.
- Führen Sie die Spitze vorsichtig in der Nähe des Sphäroids ein (gehen Sie unter den Halo) und pipettieren Sie eine kleine Menge des Mediums (z. B. eine visuelle Schätzung von fast 50 μl) hin und her, um das Sphäroid zu stören. Setzen Sie die Spitze nicht direkt über das Sphäroid, da dies dessen Struktur beschädigen kann.
- Ziehen Sie bei diesem Schritt nicht alle Medien aus dem Schacht. Kontrollieren Sie die Daumenbewegung fest am Kolben der Pipette.
- Verschieben Sie das Medium, bis das Sphäroid nicht mehr in der Mitte verbleibt und sich im Hintergrund bewegt. Ziehen Sie genügend Medium heraus, um das Sphäroid abzusaugen, und bringen Sie es an die gewünschte Stelle (z. B. poolen Sie es mit anderen Sphäroiden in einer Vertiefung, die Teil desselben Behandlungssets ist).
- Entsorgung von Abfällen
- Entsorgen Sie alle flüssigen Proben, sobald sie mit Bleichmittel neutralisiert wurden, gemäß den Protokollen der Abteilung für Umwelt- und Gesundheitssicherheit des jeweiligen Labors. Autoklavieren und entsorgen Sie alle gebrauchten Pipetten und Kolben mit biologisch gefährlichen Abfällen.
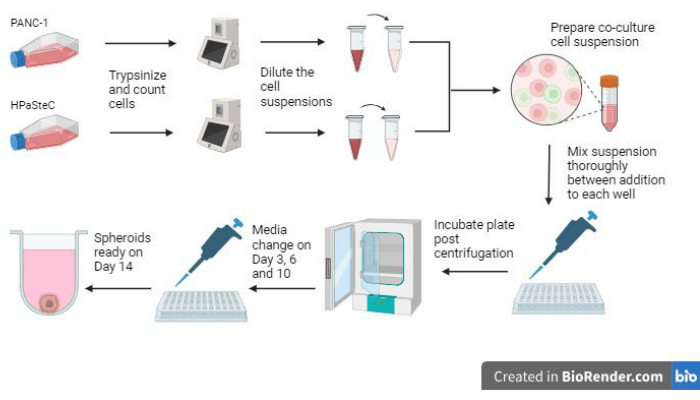
Abbildung 1: Überblick über den Prozess zur Züchtung von desmoplastischen Pankreaskrebs-Sphäroiden in 3D (Generiert mit BioRender). Die Abbildung gibt einen Überblick über die grundlegenden Prozesse; Nämlich das Trypsinzieren von Zellen, die Verwendung der anfänglichen Zellzahl zur Herstellung verdünnter Zellsuspensionen, das Vorbereiten einer Co-Kultur unter Verwendung der verdünnten Zellsuspensionen, das Hinzufügen von Zellsuspensionen zu jeder Vertiefung, das Inkubieren der Kulturen, das Durchführen der Medienwartung und die abschließende Sphäroidbildung, wie am Tag 14 erwartet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Aufbau des U-Bodenschachts. Das rechte Bild ist eine übertriebene Form, um den "Halo"-Teil des Bohrlochs zu demonstrieren. Die Abbildung zielt darauf ab, zu definieren, wo sich der "Halo"-Teil des Bohrlochs befindet, da die Arbeit oberhalb des Halos entscheidend ist, um die Sphäroide wachsen zu lassen und versehentliche Verluste zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Evaluierung von ECM-Komponenten und konfokaler Mikroskopie
- Verwenden Sie Immunfärbung, um das Ansprechen der EZM auf die medikamentöse Therapie gemäß dem von Durymanov et al. beschriebenen Protokoll zu bewerten38.
- Bündeln Sie die Sphäroide zusammen und waschen Sie sie zweimal mit 100 μl PBS. In das Gewebeeinbettungsmedium mit optimaler Schnitttemperatur (OCT) einbetten, einfrieren und bei -80 °C aufbewahren.
- Schneiden Sie die gefrorenen Tumorblöcke in 10 μm große Abschnitte, fixieren Sie die Schnitte 15 min lang in einem Aceton-Methanol-Gemisch (1:1) und lassen Sie sie bei RT an der Luft trocknen.
- Um die EZM-Komponenten zu bestimmen, färben Sie die Kryosektionen mit monoklonalen Kaninchen-Anti-Fibronektin-Primärantikörpern, polyklonalen Kaninchen-Anti-Typ-I-Kollagen-Antikörpern, polyklonalen Kaninchen-Anti-Laminin-Antikörpern und polyklonalen Anti-Hyaluronsäure-Antikörpern von Schafen.
- Als Sekundärantikörper verwenden Sie Ziegen-Anti-Kaninchen-IgG, markiert mit Alexa Fluor 488, oder Esel-Anti-Schafe, die mit Alexa Fluor 568 konjugiert sind.
HINWEIS: Primär- und Sekundärantikörper wurden bei 1:200 bzw. 1:300 verdünnt. - Erfassen Sie Bilder aller Sphäroidschnitte mit einem konfokalen Laser-Scanning-Mikroskop, das mit einer 20x/0,45-Objektivlinse ausgestattet ist.
Ergebnisse
Drei der wichtigsten Schritte bei der Züchtung der Sphäroide sind die anfängliche Zellzahl, die Mischschritte während der Aussaat der Sphäroide und die rechtzeitige Durchführung von Medienwechseln, damit die Sphäroide wachsen können (Abbildung 1). Darüber hinaus ist es wichtig, mit Abbildung 2 zu Medienänderungen nach Tag 3 vertraut zu sein, um aufgrund des erhöhten Medienvolumens pro Vertiefung effe...
Diskussion
Die Dauer und die Zellverhältnisse, die für das Wachstum der Sphäroide gewählt wurden, basierten auf Studien, wie zuvor berichtet38. Bei dem Versuch, diese Studien durch Substitution von HPaSteC-Zellen durch NIH3T3-Zellen zu optimieren, wurde festgestellt, dass die Sphäroidvolumina und Apoptosemuster den berichteten optimierten Parametern (berichtet für PANC-1: NIH3T3:: 120:12) sehr ähnlich waren, wenn die PANC-1: HPaSteC-Verhältnisse bei 120:60 lagen. Obw...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die beschriebene Arbeit wurde vom South Dakota Governors' Office of Economic Development, dem South Dakota Board of Regents Competitive Research Grant Program (SD-BOR-CRGP) und dem Department of Pharmaceutical Sciences der South Dakota State University für ihre Unterstützung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Referenzen
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten