Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ko-Kültürden Büyüyen Desmoplastik Üç Boyutlu Pankreas Kanseri Spferoidleri
Bu Makalede
Özet
Pankreas kanseri, tedavisi en zor kanserlerden biri olmaya devam ediyor. Bu nedenle, tedavi etkinliğini değerlendiren klinik öncesi modellerin tekrarlanabilir ve klinik olarak anlamlı olması kritik öneme sahiptir. Bu protokol, tekrarlanabilir, klinik olarak anlamlı desmoplastik sferoidler oluşturmak için basit bir ko-kültür prosedürünü tanımlar.
Özet
Pankreatik duktal adenokarsinom (PDAC) 5 yıllık sağkalım oranı %<12 ile en ölümcül kanserlerden biridir. Tedavinin önündeki en büyük engel, tümörü çevreleyen ve genellikle desmoplazi olarak adlandırılan vaskülarizasyonu azaltan yoğun desmoplastik hücre dışı matrikstir (ECM). Kanseri tedavi etmek için çeşitli ilaç kombinasyonları ve formülasyonları test edilmiştir ve bunların çoğu klinik öncesi başarı gösterse de klinik olarak başarısız olurlar. Bu nedenle, tümörün tedaviye yanıtını tahmin edebilecek klinik olarak ilgili bir modele sahip olmak önemli hale gelir. Bu model daha önce rezeke edilmiş klinik tümörlere karşı doğrulanmıştır. Burada, doğal olarak sağlam bir ECM oluşturabilen ve büyümelerini desteklemek için herhangi bir harici matris kaynağı veya iskele gerektirmeyen desmoplastik üç boyutlu (3D) kokültür sferoidlerini büyütmek için basit bir protokol açıklanmaktadır.
Kısaca insan pankreas yıldız hücreleri (HPaSteC) ve PANC-1 hücreleri, hücreleri sırasıyla 1:2 oranında içeren bir süspansiyon hazırlamak için kullanılır. Hücreler, poli-HEMA kaplı, 96 oyuklu düşük bağlantılı U-kuyucuklu bir plaka içinde kaplanmıştır. Plaka, hücrelerin bir başlangıç peleti oluşturmasına izin vermek için santrifüjlenir. Plaka, inkübatörde %5CO2 ile 37 °C'de saklanır ve ortam her 3 günde bir değiştirilir. Plakalar, küresel hacmi ölçmek için belirlenen aralıklarla görüntülenebilir. 14 günlük kültürden sonra, olgun desmoplastik sferoidler oluşur (ör. ortalama hacim 0.048 + 0.012mm3 (451 μm x 462.84 μm)) ve deneysel tedavi değerlendirmesi için kullanılabilir. Olgun ECM bileşenleri arasında kollajen-I, hyaluronik asit, fibronektin ve laminin bulunur.
Giriş
Pankreas kanserinin kötü prognozu, aralarında geç teşhise yol açan kolayca tespit edilebilir biyobelirteçlerin olmaması gibi çeşitli nedenlerle ilişkilidir. Bir diğer önemli neden, dokuyu çevreleyen kalın stromadır ve bu da kan akışının azalmasına neden olur. Büyük miktarlarda hücre dışı matriks (ECM), hücre-hücre etkileşimi, endotel hücreleri, çeşitli bağışıklık hücreleri, perisitler, proliferatif miyofibroblast ve fibroblast popülasyonunun birikmesi ve neoplastik olmayan hücrelerin varlığı (birlikte desmoplastik reaksiyonu oluşturur)1, PDAC'ın kemoterapisinden ve radyoterapötik direncinden sorumlu olan kalın stroma'yı oluşturur2. Kanser ve stromal hücreler karmaşık, dinamik ve çift yönlü bir etkileşime sahiptir. Bazı elementler hastalığın ilerlemesini azaltsa veya hızlandırsa da, çoğu süreç tümörüngelişimi sırasında uyarlanabilir 1. Bu, büyüme faktörleri, proanjiyojenik faktörler, proteazlar ve adezyon molekülleri açısından zengin bir ortam sağlar. Bu faktörler anjiyogenez, hücre proliferasyonu, metastaz ve invazyonu teşvik eder 3,4. Birlikte, tümör için bağışıklık ve ilaç ayrıcalıklı sığınaktırlar ve bu da ilaç direncine neden olur.
Desmoplazi, bağışıklık hücreleri ve pankreatik yıldız hücreleri (PSC) ile birlikte çeşitli ECM proteinlerinden oluşan karmaşık bir karışımdır. Bunlar birlikte, hücrelerin büyümesi için bir iskele oluşturma eğilimindedir. PSC'ler, stromal bölmenin5 en büyük bileşenlerinden biridir. Matriks metaloproteazlar (MMP), matriks metaloproteazların doku inhibitörleri (TIMP) ve kanserle ilişkili fibroblastlar (CAF)6 gibi enzimler üretme yetenekleri, desmoplastik reaksiyonun gelişiminde kritik bir rol oynayabileceklerini ima eder. ECM, kanserle ilişkili fibroblastlar (CAF) ve vaskülatür, PDAC'ın temel yönleridir. CAF'ler arasında, miyofibroblast ve inflamatuar CAF'lerin, pro-tümör özelliklerinden sorumlu aktif karışmada rol oynadığı tahmin edilmektedir7. Tümör üzerindeki fibroblastik oluşumlar ne kadar geniş olursa, prognoz o kadar kötü olur 8,9,10.
Yerleşik hücre hatları aracılığıyla tek katmanlı hücre kültürü, ilaç toksisitesini analiz etmek için yararlı bir araç olmaya devam etmektedir ve kavram kanıtı ve keşif çalışmaları için iyi bir başlangıç noktasıdır. Bununla birlikte, yerleşik hücre kültürü hatları, germ hattı DNA'sından ve klinik ilişkilendirilebilirlikten yoksundur11. Düz yüzeylerde büyüdükleri için, tümörün bir parçası oldukları, anormal şekilde bölündükleri ve farklılaşmış fenotiplerini kaybettikleri zamana kıyasla farklı in vitro seçim kriterlerine tabi tutulurlar12. Genel olarak, tek hücreli kültürler tümör heterojenliğini sınırlar ve bu nedenle klinik önemini kaybeder. Tümörün mikro çevresinin karmaşıklığını doğru bir şekilde temsil edemezler (örneğin, ECM). 3D kültür, karmaşık tümör mikro ortamını daha yakından kopyalayabilir.
3D kültür, 1970'lerde sağlıklı hücreler ve neoplastik muadilleri için tanıtıldı13. Spheroidler14 aracılığıyla malign dokuların morfolojisini ve mimarisini incelemek için çeşitli teknikler kullanılmıştır. Stromal hücrelerle ko-kültürler TME sinyallerini modelleyebilir. Hücreler yıldız hücreleri15 ile birlikte kültürlendiğinde EMT belirteçlerinde bir yukarı regülasyon görülmüştür. PDAC sferoidleri ve bunların stroma ile etkileşimleri, ECM bileşenleri ile birlikte kültürlenerek modellenebilir. Spesifik olarak PSC'lerle birlikte kültürlemenin klinik olarak anlamlı ilaç sitotoksisite verileri ürettiği bildirilmiştir 16,17,18. PSC'ler ayrıca apoptozdan kaçarak ve çeşitli parakrin faktörler19 yoluyla kanser hücrelerinin proliferasyonunu uyararak ve EMT geçişini indükleyerek ilaç direncine yardımcı olur. Bu nedenle, PSC'leri bir ilacın veya ilaç dağıtım sisteminin başarısını değerlendirmek için kullanılan kriterlere erken bir aşamadan itibaren dahil etmek kritik hale gelir. PSC'nin, tek başına pankreas kanseri hücrelerine kıyasla, proliferasyonu artırma ve kombinasyon halinde daha hızlı büyümeyi destekleme yeteneği, immün sistemi baskılanmış farelerde20 iki hücre hattının deri altı yan enjeksiyonları değerlendirildiğinde in vivo olarak da görülmüştür.
Bir hücre tipinin ECM bileşenleri ile etkileşime girme yeteneği, birlikte kültürlenmiş sferoidler yetiştirilirken de dikkate alınması gereken kritik öneme sahiptir. BxPC-3 ve PANC-1'in kollajene bağlanmada eşit afiniteye sahip olduğu bildirilmiştir. BxPC-3'ün 21,22,23,24,25 daha iyi bağlandığına dair raporlar olmasına rağmen, iki hücre hattı da laminine eşdeğer olarak bağlanır. Migrasyon açısından, Stahle ve ark.26, PANC-1 hücreleri için BxPC-3'e kıyasla 5 kat daha hızlı bir motilite göstermiştir. PANC-1 hücrelerinin ayrıca esas olarak tek hücreler olarak göç ettiği, BxPC-3 hücrelerinin ise sıkıca paketlenmiş bir tabaka olarak göç ettiği bildirilmiştir. Hücrelerin seçimi aynı zamanda tümörün boyutunu da etkiler25. BxPC-3 tümörlerinin PANC-1'den elde edilenleregöre 27,28 daha büyük olduğu gösterilirken, bir çalışmada bunun tersi29 olgu gösterilmiştir. Boyut ve hareketlilikteki farklılıklarına rağmen, her iki hücrenin de farelerde tümör oluşturmak için uzun gecikme sürelerine ihtiyaç duyduğu bildirilmiştir. Bu süre özellikle BxPC-3 için 4 hafta ile 4 ay25 arasında değişen uzun olabilir. Bununla birlikte, BxPC-328 veya BxPC-3 kanser kök hücrelerinin30'un daha hızlı görünür tümörler oluşturduğu literatür de vardır, bu da tümör büyüme sürelerinde görülen varyasyonlar olabileceğini ima eder. Bu nedenle, burada belirtilen süreler, tümör büyüme oranları için yalnızca bir başlangıç kılavuzu olarak hizmet etmelidir.
BxPC-3 hücreleri, yüzeyde gevşek hücreler ve yoğun çekirdekler ile sferoidler oluştururken, PANC-1 hücrelerinin hem gözenekli ancak sağlam sferoidler31 hem de kompakt sferoidler oluşturduğu bildirilmiştir. PANC-1 hücrelerinin ayrıca daha az farklılaşmış ve daha agresif olduğu bildirilmiştir32. PANC-1 hücrelerinin daha yüksek motilitesi, kompakt sferoidler oluşturma yeteneği ve ECM bileşenleri ile etkileşime girme yeteneği ile birlikte agresif doğayı32 ön planda tutarak, sferoid çalışmaları için PANC-1 hücreleri seçildi.
Son birkaç yılda, sferoid kültür, iki boyutlu (2D) kültürlere kıyasla klinik alaka düzeyinde bir avantaj göstermede çok başarılı olmuştur. Alaka düzeyi, bu tekniğin hayvan çalışmalarının yerine kullanılması ve tümörlerin biyolojisinin daha iyi anlaşılması için kullanılmıştır. Spheroidlerin klinik önemi, özellikle PSC'lerle birlikte kültürlendiğinde, sertlik33, TGF-βekspresyonu 34,35,36,37,38, E-kaderin, F-aktin 18,34,36,37, α-SMA 34,35,37 gibi sferoidin çeşitli fonksiyonlarını incelemek için kullanımlarını sağlamıştır.38, laktat dehidrojenaz (LDHA)32, HIF-1α35,39, ilaç direnci 16,37,40, hücre göçü41, hücre istilası37, fibroz35, radyasyon direnci42, fenotipik değişiklikler18, heterojenlik36, hücresel etkileşim seviyeleri39 ve ECM bileşenlerini gösterir37,38,39. Açıklanan verileri elde etmek için kullanılan protokollerin çoğu, küresel ve ECM büyümesini desteklemeye yardımcı olmak için Matrigel'e, asılı bırakma yöntemine, baskılı kalıplara veya diğer iskelelere dayanır. Çalışmalar ayrıca genellikle insan olmayan fibroblastik hücrelerin veya hastalardan yeni izole edilmiş yıldız hücrelerinin kullanımını da içerir. Yıldız hücrelerinin kullanılması, tümörlerin in vivo koşullara benzemesi için kritik öneme sahipken, taze ekstraksiyonlarla ilişkili hastalar arası değişkenlik bu çalışmaların tekrarlanmasını zorlaştırır.
Bu protokol, geliştirilmesi kolay, tekrarlanabilir, klinik olarak anlamlı ve iskele içermeyen bir model göstermeyi amaçlamaktadır, böylece yalnızca ECM'yi doğal olarak oluşturmak için ortak kültürlerin yeteneklerine güvenir. Bunu yapmak için, insan pankreas yıldız hücreleri (HPaSteC) ile birlikte PANC-1 hücrelerinin (tek hücreler olarak göç etme eğilimleri nedeniyle) bir karışımını içeren basit bir ko-kültür yöntemi, kök hücreler gibi davranma yetenekleri nedeniyle seçildi ve ilaca yüksek dirençli olmaları. Durymanov ve ark.38tarafından yapılan çalışmaları temel alarak, aşağıda ayrıntıları verilen protokol, hücre oranları ve ortam değişiklikleri arasındaki süreler gibi parametrelerin daha da optimize edilmesinden sonra oluşturulmuştur. Bu protokol sonucunda ortaya çıkan sferoidler, yeni ilaç adayı değerlendirmesi için model bir sistem olarak kullanılabilir40.
Ek olarak, küresel kültüre aşina olmayan kullanıcılar için, MISpheroID bilgi tabanının gelişimini tartışan Peirsman ve ark.43çalışması yardımcı olabilir. Laboratuvar protokolleri arasındaki heterojenlikle başa çıkmaya yardımcı olabilecek bazı minimum bilgi yönergeleri oluşturur. Bazı sınırlamalara rağmen, çalışma, kültür ortamının seçiminin, hücre hatlarının, küresel oluşum yönteminin ve nihai küresel boyutun, sferoidlerin fenotipik özelliklerinin belirlenmesinde kritik olduğunu göstermiştir.
Protokol
1. 2D hücre kültürü
- Steril koşullar altında% 10 fetal sığır serumu (FBS) ile desteklenmiş Dulbecco'nun Modifiye Kartal Ortamında (DMEM) PANC-1 hücrelerini büyütün. Pasajlardan önce% 70 -% 80'e kadar birleşin ve 20.pasajdan sonra kullanmayın. Adım 4.2.1'de açıklanan işleme bakın.
NOT: Bir referans noktası olarak, 20 mL ortamdaki 1 x 106 hücrenin% 70-80 birleşmeye ulaşması için yaklaşık 2-3 güne ihtiyacı vardır. - HPaSteC hücrelerini, steril koşullar altında üretici tarafından sağlanan kiti kullanarak %2 FBS, %1 PenStrep ve %1 Yıldız Hücre Büyüme Takviyesi (SteCGS) ile desteklenmiş yıldız hücre ortamında büyütün. Poli-L-Lizin kaplı bir şişede adım 4.2.2'de gösterildiği gibi üreticinin talimatlarına göre (bazı değişikliklerle) büyütün.
- Tripsin nötralizasyon çözeltisi (TNS) kullanıldığından, üreticinin protokolünden tripsinizasyon sırasında FBS nötralizasyon adımını atlayın. Hücre süspansiyonunu, adım 4.2.2.2'de açıklandığı gibi toplam 10 mL TNS hacmi ile nötralize edin.
NOT: Bir referans noktası olarak, 20 mL ortamdaki 0,5 x 106 hücre ve 1 x 106 hücrenin% 90 birleşme elde etmek için sırasıyla 3 gün ve 2 güne ihtiyacı vardır. - Hücreleri% 90 birleşimde hasat edin. Pasaj 7'nin ötesindeki hücreleri kullanmayın.
- Tripsin nötralizasyon çözeltisi (TNS) kullanıldığından, üreticinin protokolünden tripsinizasyon sırasında FBS nötralizasyon adımını atlayın. Hücre süspansiyonunu, adım 4.2.2.2'de açıklandığı gibi toplam 10 mL TNS hacmi ile nötralize edin.
- Hücreleri 37 ° C'de,% 5 CO2 ile% 90 -% 95 bağıl nem oranına sahip steril inkübatörlerde koruyun. Tüm hücre kültürü çalışmalarını bir T-75 şişesinde gerçekleştirin.
2. 96 oyuklu plaka için poli (2-hidroksietil metakrilat (poli-HEMA) çözelti kaplaması
- 37 ° C'de ısıtılmış bir karıştırıcı kullanılarak gece boyunca karıştırılmasına izin vererek% 95 etanol kullanarak 5 mg / mL'de poli-HEMA çözeltisi hazırlayın (örneğin, 500 mL çözelti 2.5 g poli-HEMA'ya ihtiyaç duyar)
- Karıştırıcıyı eklemeden önce başlangıç ses konumunu işaretleyin. Ertesi gün çözeltideki herhangi bir kaybı telafi etmek için% 95 etanol kullanın.
- Nihai çözeltiyi 0,22 μm'lik bir filtre kullanarak steril bir başlıkta filtreleyin ve buzdolabında 4 °C'de saklayın.
NOT: Poly-HEMA, hücrelerin yapışması için caydırıcı bir rol oynayan bir yüzeyin hidrofobikliğini artırmak için kullanılır. Bu çalışma, hücrelerin kuyucuklara yapışmamasını ve tek tabaka olarak büyümesini gerektirdiğinden, poli-HEMA, plakaların doğal düşük bağlanma özelliğine ek bir caydırıcı olarak kullanılır ve böylece onları ultra düşük bağlantı plakaları haline getirir. - Plakayı kaplamak için bir hücre kültürü davlumbazının içindeki 96 oyuklu yuvarlak polistiren tabanlı mikro kuyu plakasının her bir oyuğuna 50 μL soğuk çözelti ekleyin.
- Plakaların tamamen kuruduğundan emin olmak için kuyuları kapağı kapalı olarak 37 °C'de 3 gün sıcak hava fırınında bırakın.
- Hücre tohumlamadan önce plakaları hücre kültürü davlumbazında 30 dakika boyunca UV ile sterilize edin. Uzun süreli saklama için sıkıca kapalı bir kilitli kilitte saklayın ve kullanmadan önce sterilize edin.
3. 2D hücre kültürü planlaması
- Deneyi, PANC-1 hücrelerinin HPaSteC hücrelerinin %90'a ulaştığı gün %70-80 birleşmede mevcut olacak şekilde zamanlayın.
NOT: Yaklaşık 1 milyon PANC-1 veya HPaSteC hücresi içeren şişeler, aynı gün sıvı nitrojenden kaldırıldığında, bazı değişikliklerle, her iki hücre hattının da aynı gün hazır olması için 8 günlük PANC-1 kültürü ve 6-7 günlük HPaSteC kültürü gerektirir.
4. 3D kültürü büyümesi
- İşleme başlamadan önce Şekil 1'deki tüm sürecin genel görünümüne bakın.
DİKKAT: Hem PANC-1 hem de HPaSteC biyolojik kökenlidir. PANC-1'i (kanserli hücre hattı) dikkatli kullanın. - Hücrelerin denenmesi ve sayılması
- Tripsinze ve PANC-1 hücrelerini sayın:
- Süpernatanı atın ve PANC-1 hücrelerini 9 mL HBSS (bir seferde 3 mL) ile yıkayın. Canlı/canlı materyalin tamamen ölmesini sağlamak için davlumbazdaki kullanılmış reaktifleri %20-25 V/V'lik bir ağartma solüsyonunda atın.
- Hücreleri 2 mL tripsin ile tripsin yapın. Yaklaşık 10 dakika sonra (daha fazla zamana ihtiyaç duyabilir), tüm hücreler ayrıldığında, süspansiyonu 10 mL DMEM +% 10 FBS ile nötralize edin. 3 mL ile başlayın ve bunu, tripsinizli hücrelerin maksimum toplanmasını sağlamak için yıkama başına 1 mL (kalan 7 yıkama) kullanarak sonraki yıkama adımlarıyla takip edin.
- Her nötralize alikotu aynı 15 mL'lik tüpe koyun. Tüpteki son hacim 12 mL'ye yakın olacaktır (10 mL ortam ile nötralize edilmiş ~ 2 mL tripsin).
- Nötralize hücre süspansiyonunu 700 x g'da 2 dakika ve 30 saniye santrifüjleyin. Süpernatanı atın ve 1 mL DMEM +% 10 FBS'de elde edilen peleti yeniden süspanse edin. Hücre sayımı için bundan bir alikot alın ve bu bölümden elde edilen değeri "Sayı A" olarak etiketleyin.
- Tripsinze ve HPaSteC hücrelerini sayın.
- Süpernatanı atın ve HPaSteC hücrelerini 9 mL HBSS (bir seferde 3 mL) ile yıkayın.
- Hücreleri 2 mL tripsin ile tripsin yapın. Yaklaşık 10 dakika sonra, tüm hücreler ayrıldığında, süspansiyonu 10 mL tripsin nötralizasyon çözeltisi ile nötralize edin. 3 mL ile başlayın ve bunu, tripsinizli hücrelerin maksimum toplanmasını sağlamak için yıkama başına 1 mL (kalan 7 yıkama) kullanarak sonraki yıkama adımlarıyla takip edin.
- Her nötralize alikotu aynı 15 mL'lik tüpe koyun. Tüpteki son hacim 12 mL'ye yakın olacaktır (10 mL nötralizasyon çözeltisi ile nötralize edilmiş ~ 2 mL tripsin).
- Nötralize hücre süspansiyonunu 700 x g'da 2 dakika ve 30 saniye santrifüjleyin. Süpernatanı atın ve takviye edilmiş yıldız hücre ortamının 1 mL'sinde elde edilen peleti yeniden süspanse edin. Hücre sayımı için bundan bir alikot alın ve bu bölümden elde edilen değeri "Sayı B" olarak etiketleyin.
- Tripsinze ve PANC-1 hücrelerini sayın:
- İlk hücre süspansiyonlarının seyreltilmesi
- Gerekirse (0.5 saatten fazla olmamak üzere) hem A hem de B sayımlarını elde ettikten sonra veya hem PANC-1 hem de HPaSteC'yi tripnize ettikten ve nötralize ettikten sonra kısa bir süre duraklayın. Kullanılmayan kültür ortamını 37 ° C'de ve hücre süspansiyonlarını oda sıcaklığında (RT; 25 ± 2 ° C) tutun.
- Daha önce elde edilen Sayım A ve Sayım B'yi kullanın, alikotları almak ve ilgili seyreltmeleri (ayrı tüplerde) yapın, böylece nihai hacim 1 mL olur (seyreltici: DMEM +% 10 FBS) ve son sayım her hücre tipi için 110.000-140.000 hücre arasındadır. Bu seyreltme yapıldıktan sonra, Sayım C (PANC-1) ve Sayı D (HPaSteC) vermek için her seyreltme için hücre sayımlarını doğrulayın.
- Count C ve Count D'yi aldıktan sonra gerekirse (15-30 dakikadan fazla olmamak üzere) bu adımda duraklayın. Adım 4.3.3.2'de son seyreltmeler yapıldıktan sonra durmayın; Hücre çökelmesini önlemek için deney yapın. Kullanılmayan kültür ortamını 37 ° C'de ve hücre süspansiyonlarını RT'de (25 ± 2 ° C) tutun.
- HPaSteC: PANC-1: 60:120'de kuyu başına gereken son hücre sayısını koruyun. Fazlalığı hesaba katmak için hesaplama için 110 kuyu kullanın. Kuyucuk başına 100 μL hücre süspansiyonu temel değeri ile hesaplayın (HPaSteC ile 110 kuyu için toplam süspansiyon hacmi 11 mL'dir: PANC-1: 60:120). Karıştırma kolaylığı için bu süspansiyonu steril 50 mL'lik bir santrifüj tüpünde yapın.
- Sayım C ve Sayı D'yi kullanın ve HPaSteC: PANC-1: 60:120'yi 11 mL'lik bir son hacimde (11 mL'de 6.600 HPaSteC hücresi ve 13.200 PANC-1 hücresi) elde etmek için bir DMEM +% 10 FBS çözeltisine yeterli hücre süspansiyonunu hazırlayın. Çözeltiyi 1 mL'lik bir pipet kullanarak karıştırarak ve yukarı ve aşağı pipetleyerek iyice karıştırın. Köpük oluşumundan kaçının.
- Tohumlama
- Oyuk başına 100 μL süspansiyon eklemeden önce her adımda son süspansiyonu karıştırmak için 200 μL veya 100 μL'lik bir pipet kullanın (pipet ucunu pipetleme ile birlikte yukarı ve aşağı hareket ettirerek karıştırın). 100 μL'yi kuyunun köşesi boyunca nazikçe ekleyin.
- Düşmedikçe aynı ucu birden fazla kuyu için tekrar kullanın. İleri geri karıştırın ve plakanın ilk yarısı (kabaca ilk 43 kuyucuk) için her bir oyuğa yapılan eklemeler arasında 10 veya 15'e (saniye değil) kadar sayın. Süspansiyon hacmi daha az olduğundan ve daha az karıştırma süresi gerektirdiğinden, ikinci yarı (kalan 43 kuyucuk) için karıştırma sayısını her kuyu arasında 5-10'a düşürün.
- Hidrofobik poli-HEMA kaplama, süspansiyonun plakadan sıçramasına ve eşit olmayan dağılıma yol açacağından, tekrarlayan bir pipetleyici kullanmayın.
- Tüm kuyucuklar dolduktan sonra fazla süspansiyonu atın.
- Oyuk başına 100 μL süspansiyon eklemeden önce her adımda son süspansiyonu karıştırmak için 200 μL veya 100 μL'lik bir pipet kullanın (pipet ucunu pipetleme ile birlikte yukarı ve aşağı hareket ettirerek karıştırın). 100 μL'yi kuyunun köşesi boyunca nazikçe ekleyin.
- Santrifüj
- Tüm hücreleri bir pelet olarak bir araya getirmek için hücre süspansiyonunu içeren son plakayı santrifüjleyin. Bu adım sırasında kontaminasyonu önlemek için plakayı plakanın kenarına parafilm ile dikkatlice sarın. Sarma sonrası, plakayı 2 dakika boyunca 1000 x g'da bir karşı denge ile santrifüjleyin.
- Plakayı hücre kültürü başlığına geri alın (işlemek için etanol püskürtülmüş eldivenler kullanın), parafilmi çıkarın ve plakaları inkübatörde 37 °C'de,% 5 CO2 ile saklayın. Plakaya hiçbir noktada etanol-su karışımı püskürtmeyin.
- Kültür bakımı
- 3. güne kadar 4x-5x büyütmede ışık mikroskobu altında sferoidler oluşturmak için bir araya gelen hücreleri görüntüleyin. Aşağıda açıklandığı gibi kültür bakım protokolünü izleyin.
- 3. günde, 5-6 mL DMEM +% 10 FBS ölçün ve kuyu kenarı boyunca her bir oyuğa 50 μL ekleyin.
- Ekleme sırasında ortamı herhangi bir şekilde karıştırmayın veya çalkalamayın, çünkü bu küreye zarar verir veya kürenin yanlışlıkla çıkarılmasına yol açar. Kuyucuk başına nihai hacim ~ 150 μL olacaktır.
- 3. günün ötesinde, kuyunun yapısına ve hale olarak adlandırılan ortamda görülen ışık yansımasının konumuna (kuyunun silindirik ve kavisli kısmı arasında) aşina olmak için Şekil 2'ye bakın. Sferoidlerin hasar görmediğinden emin olmak için haloya yakın işlemleri dikkatli bir şekilde gerçekleştirin.
- 6. günde, 10-11 mL DMEM +% 10 FBS ölçün. Ortamı haleye kadar çekerek birden fazla kuyudan toplu olarak çıkarmak için 1 mL'lik bir pipet kullanın. Bunu tüm plaka için yapın, ardından ortam değiştirme işlemini yapın. Süpernatanı toplu olarak toplayın ve atın veya çıkarıldığı gibi atın.
- Her bir kuyucuğun kenarına 100 μL ortam ekleyerek atılan ortamı yeni ortamla değiştirin. Kuyudaki son hacim 200 μL'ye yakın olacaktır.
- Ortamı halenin ötesine çekmeyin, çünkü bu, sferoidi yanlışlıkla dışarı çekme riskini artırır.
- 10/11. günde, 10-11 mL DMEM +% 10 FBS ölçün. Ortamı haleye kadar çekerek birden fazla kuyudan toplu olarak çıkarmak için 1 mL'lik bir pipet kullanın. Bunu tüm plaka için yapın, ardından ortam değiştirme işlemini yapın. Süpernatanı toplu olarak toplayın ve atın veya çıkarıldığı gibi atın.
- Her bir kuyucuğun kenarına 100 μL ortam ekleyerek atılan ortamı yeni ortamla değiştirin. Kuyudaki son hacim 200 μL'ye yakın olacaktır.
- 3. günde, 5-6 mL DMEM +% 10 FBS ölçün ve kuyu kenarı boyunca her bir oyuğa 50 μL ekleyin.
- 3. güne kadar 4x-5x büyütmede ışık mikroskobu altında sferoidler oluşturmak için bir araya gelen hücreleri görüntüleyin. Aşağıda açıklandığı gibi kültür bakım protokolünü izleyin.
- Son gün değerlendirmesi
- 14. günde sferoidler üzerinde ilaç tedavisi uygulayın. Sferoidin başlangıç hacmini belirlemek için 4x objektif altında parlak alan ters çevrilmiş bir mikroskop kullanarak kullanmadan önce sferoidleri görüntüleyin. Aşağıdaki formülü kullanarak Hacmi (V) hesaplayın:
V = 0,5 × L × W2 - Küresel hacimleri hesaplamak için yukarıda açıklanan denklemi takip edin. Burada L, ana eksenin uzunluğudur ve W genişliktir (ana eksene dik olan en uzun çizgi). Milimetre küp cinsinden bir hacim elde etmek için tüm orijinal birimleri mikrometreden milimetreye dönüştürün.
- 14. günde her bir kuyucuktaki başlangıç hacmi buharlaşma nedeniyle 150-200 μL arasındadır. İlaç tedavileri için, her bir oyuktan haloya ulaşılana kadar ortamı çıkarın ve bunu 2x kuvvetinde 100 μL ilaç çözeltisi ile değiştirin, biraz yumuşak karıştırma ile birlikte (her bir kuyucuk arasında 2'ye kadar sayarken ortamı hafifçe ileri geri karıştırın).
- Nihai ilaç çözeltisinin 1x'te olmasına izin vermek ve eski ortamın kuyulardan tamamen çıkarılmasını önlemek için 2x mukavemetli solüsyonlar kullanın, aksi takdirde sferoidler bozulabilir. Sferoidleri bu zaman diliminden sonraki 3 gün içinde kullanın.
- 14. günde sferoidler üzerinde ilaç tedavisi uygulayın. Sferoidin başlangıç hacmini belirlemek için 4x objektif altında parlak alan ters çevrilmiş bir mikroskop kullanarak kullanmadan önce sferoidleri görüntüleyin. Aşağıdaki formülü kullanarak Hacmi (V) hesaplayın:
- Sferoid koleksiyonu
- Toplamadan önce sferoid hacimlerini adım 4.7.2'de açıklandığı gibi ölçün.
- Deneyin ihtiyaçlarına bağlı olarak 14. veya 17. günde, haleye ulaşılana kadar her kuyucuktan ortamı çıkararak sferoidleri toplayın.
- Ortamı çıkarmak için 1 mL'lik bir pipet kullanın ve süpernatanı birden fazla kuyudan 15 mL'lik bir konik santrifüj tüpünde toplayın.
- Tüm kuyucuklar halo seviyesinde ortama sahip olduğunda, 1 mL pipet üzerindeki ayarı 200-300 μL arasına düşürün.
- Sferoidlerin tabana yerleştiğini görmek için plakayı kaputun arka planına veya koyu arka plana (örn. bir tüp rafı) hizalayın.
- Ucu yavaşça sferoidin yanına yerleştirin (halenin altına inin) ve sferoidi rahatsız etmek için az miktarda ortamı (örneğin, 50 μL'ye yakın görsel bir tahmin) ileri geri pipetleyin. Yapısına zarar verebileceği için ucu doğrudan sferoidin üzerine koymayın.
- Bu adımda tüm medyayı kuyudan çekmeyin. Pipetin pistonundaki başparmak hareketini sıkıca kontrol edin.
- Sferoid artık merkezde kalmayana ve arka plana karşı hareket ederken görülebilene kadar medyanın yerini değiştirin. Sferoidi emmek için yeterli besiyerini yukarı çekin ve istenen yere taşıyın (örneğin, aynı tedavi setinin bir parçası olan bir kuyucukta diğer sferoidlerle birleştirin).
- Atıkların atılması
- Çamaşır suyu ile nötralize edildikten sonra tüm sıvı numuneleri, ilgili laboratuvarların Çevre ve Sağlık Güvenliği Departmanının protokollerine göre atın. Kullanılmış tüm pipetleri ve şişeleri biyolojik olarak tehlikeli atıklarla otoklavlayın ve atın.
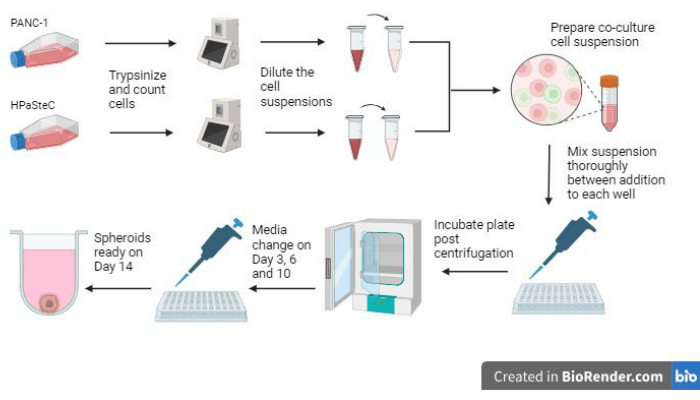
Şekil 1: 3D desmoplastik pankreas kanseri sferoidlerini büyütme sürecine genel bakış (BioRender kullanılarak oluşturulmuştur). Şekil, ilgili temel süreçlere genel bir bakış sunar; yani, seyreltik hücre süspansiyonları yapmak için ilk hücre sayımını kullanarak hücrelerin tripsinezlenmesi, seyreltilmiş hücre süspansiyonlarını kullanarak bir ko-kültür hazırlanması, her bir oyuğa hücre süspansiyonlarının eklenmesi, kültürlerin inkübe edilmesi, ortam bakımının gerçekleştirilmesi ve 14. günde beklendiği gibi son sferoid oluşumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: U alt kuyusunun yapısı. Doğru görüntü, kuyunun "hale" kısmını göstermek için abartılı bir şekildir. Şekil, kuyunun "halo" kısmının nerede olduğunu tanımlamayı amaçlamaktadır, çünkü halenin üzerinde çalışmak, sferoidleri büyütmek ve kazara kayıpları önlemek için kritik öneme sahiptir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. ECM bileşenlerinin değerlendirilmesi ve konfokal mikroskopi
- Durymanov ve ark.38 tarafından tarif edilen protokole göre ECM'nin ilaç tedavisine yanıtını değerlendirmek için immün boyama kullanın.
- Sferoidleri bir araya getirin ve 100 μL PBS ile iki kez yıkayın. Optimum kesme sıcaklığına (OCT) doku gömme ortamına gömün, dondurun ve -80 ° C'de tutun.
- Donmuş tümör bloklarını 10 μm'lik bölümlere kesin, bölümleri aseton-metanol (1: 1) karışımında 15 dakika sabitleyin ve RT'de kurumaya bırakın.
- ECM bileşenlerini belirlemek için, kriyosekesörleri tavşan monoklonal anti-fibronektin primer antikorları, tavşan poliklonal anti-tip I kollajen antikorları, tavşan poliklonal anti-laminin antikorları ve koyun poliklonal anti-hyaluronik asit antikorları ile immünostain.
- İkincil antikorlar olarak Alexa Fluor 488 ile etiketlenmiş keçi antirabbit IgG veya Alexa Fluor 568 ile konjuge eşek anti-koyun kullanın.
NOT: Primer ve sekonder antikorlar sırasıyla 1:200 ve 1:300'de seyreltildi. - 20x/0.45 objektif lens ile donatılmış konfokal lazer tarama mikroskobu kullanarak tüm küresel bölümlerin görüntülerini elde edin.
Sonuçlar
Sferoidlerin büyümesinde yer alan en kritik adımlardan üçü, ilk hücre sayımı, sferoidleri tohumlarken karıştırma adımları ve sferoidlerin büyümesine izin vermek için zamanında ortam değişikliklerinin gerçekleştirilmesidir (Şekil 1). Ek olarak, 3. günden sonraki medya değişikliklerine ilişkin Şekil 2'ye aşina olmak, kuyu başına artan medya hacmi nedeniyle etkili medya değişiklikl...
Tartışmalar
Sferoidleri büyütmek için seçilen süre ve hücre oranları, daha önce38 bildirildiği gibi çalışmalara dayanıyordu. HPaSteC hücreleri için NIH3T3 hücrelerini ikame ederek bu çalışmaları optimize etmeye çalışırken, sferoid hacimleri ve apoptoz paternlerinin, PANC-1: HPaSteC oranları 120: 60 iken, bildirilen optimize edilmiş parametrelere (PANC-1: NIH3T3 :: 120: 120) çok benzer olduğu bulundu. Bu çalışmalar sadece 14. güne kadar apoptozu...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Açıklanan çalışma, Güney Dakota Valiliği Ekonomik Kalkınma Ofisi, Güney Dakota Mütevelli Heyeti Rekabetçi Araştırma Hibe Programı (SD-BOR-CRGP) ve Güney Dakota Eyalet Üniversitesi Farmasötik Bilimler Bölümü tarafından destekleri için desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Referanslar
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır