Method Article
ثقافة شريحة النمط العضوي للحبل الشوكي للفأر على المدى الطويل كمنصة للتحقق من صحة زرع الخلايا في إصابة الحبل الشوكي
In This Article
Summary
في هذه الورقة ، نقدم طريقة قابلة للتكرار لتوليد والحفاظ على شرائح النمط العضوي للحبل الشوكي على المدى الطويل المزروعة بالخلايا الجذعية العصبية كنموذج خارج الجسم الحي لاختبار علاجات الاستبدال الخلوي.
Abstract
لا تزال العلاجات الحلولية لإصابات الحبل الشوكي (SCIs) غير موجودة ، بسبب الفيزيولوجيا المرضية المعقدة. يعتمد أحد أكثر الأساليب التجديدية الواعدة على زرع الخلايا الجذعية لاستبدال الأنسجة المفقودة وتعزيز الانتعاش الوظيفي. يجب مواصلة استكشاف هذا النهج بشكل أفضل في المختبر وخارج الجسم الحي من أجل السلامة والفعالية قبل الشروع في إجراء اختبارات حيوانية أكثر تكلفة واستهلاكا للوقت. في هذا العمل ، نظهر إنشاء منصة طويلة الأجل تعتمد على شرائح النمط العضوي للحبل الشوكي للفأر (SC) المزروعة بالخلايا الجذعية العصبية البشرية لاختبار علاجات الاستبدال الخلوي لإصابات النخاع الشوكي.
يتم الحفاظ على الثقافات العضوية القياسية SC لمدة 2 أو 3 أسابيع في المختبر. هنا ، نصف بروتوكولا محسنا للصيانة طويلة الأجل (≥ 30 يوما) لمدة تصل إلى 90 يوما. كما تم تحسين الوسط المستخدم لزراعة شرائح SC على المدى الطويل لزرع الخلايا الجذعية العصبية في نموذج النمط العضوي. تم زرع الخلايا الجذعية العصبية الظهارية المشتقة من SC (h-SC-NES) التي تحمل مراسل بروتين الفلورسنت الأخضر (GFP) في شرائح SC للفئران. بعد ثلاثين يوما من عملية الزرع ، لا تزال الخلايا تظهر تعبير GFP ومعدل موت الخلايا المبرمج المنخفض ، مما يشير إلى أن البيئة المثلى حافظت على بقائها وتكاملها داخل الأنسجة. يمثل هذا البروتوكول مرجعا قويا لاختبار علاجات استبدال الخلايا بكفاءة في أنسجة SC. ستسمح هذه المنصة للباحثين بإجراء فحص مسبق خارج الجسم الحي لعلاجات زرع الخلايا المختلفة ، مما يساعدهم على اختيار الإستراتيجية الأنسب قبل الشروع في التجارب في الجسم الحي .
Introduction
إصابات الحبل الشوكي الرضحية (SCI) لها عواقب جسدية ونفسية واقتصادية مدمرة على المرضى ومقدمي الرعاية1. بذلت العديد من المحاولات لتعزيز تجديد المحور العصبي في اصابات النخاع الشوكي بطرق مختلفة2،3،4 وتم إثبات بعض الآثار المفيدة من خلال تكوين مرحلات عصبية بين الخلايا العصبية القريبة والبعيدة في موقع الإصابة من خلال علاجات استبدال الخلايا. لا يزال الاهتمام بالعلاجات الخلوية ينمو5 لأن الخلايا المزروعة يمكن أن تلعب العديد من الأدوار ، بما في ذلك توفير الدعم الغذائي ، والتعديل المناعي ، وتجديد الدوائر العصبية المفقودة من خلال تحريض اللدونة ، واستبدال الخلايا ، وإعادة الميالين المحوري6.
في الآونة الأخيرة ، ركز الجهد الرئيسي في هذا المجال على الخلايا الجذعية / السلفية العصبية البشرية (NSCs / NPCs) 7. تشير العديد من الدراسات إلى أن NSCs / NPCs تعدل استجابة الخلايا النجمية8 ، وتعزز إفراز عوامل التجدد 9,10 ، وتحل محل الخلايا العصبية المفقودة في SCI11,12. ومع ذلك ، فإن الدراسات التي تدعم تمايز الخلايا المزروعة إلى خلايا عصبية وظيفية لا تزال ضعيفة. علاوة على ذلك ، فإن بقاء الخلايا المزروعة والتمايز في الحبل الشوكي المصاب (SC) منخفض13 ، ربما لأن الخلايا المزروعة تستغرق عدة أسابيع ، وحتى أشهر ، للتمايز في الجسم الحي. بالإضافة إلى ذلك ، لم توضح الدراسات الحالية بشكل كامل العديد من الجوانب البيوكيميائية والجزيئية والخلوية والوظيفية لعلاجات استبدال الخلايا. في هذا السياق ، هناك حاجة إلى نماذج بسيطة وسريعة وفعالة من حيث التكلفة لدراسة آليات تطعيم الخلايا ، وقدرة الخلايا المطعمة على التكاثر ، والتمايز إلى أنواع محددة أو مجموعات فرعية من الخلايا ، وتشكيل نقاط الاشتباك العصبي مع الخلايا العصبية المقيمة.
يعد دمج الدراسات النسيجية في التسجيل الفيزيولوجي الكهربي والتنميط النسخي والبروتيني ضروريا لفهم كامل للسلسلة الجزيئية التي تحدث بعد زرع الخلايا. سيؤدي هذا بالتأكيد إلى تسريع تصميم علاجات استبدال الخلايا الجديدة والتحقق من صحتها في النماذج قبل السريرية والدراسات السريرية. في الواقع ، حتى الآن ، كان استخدام القوارض الكبيرة والرئيسيات غير البشرية مفيدا لتوضيح العديد من العمليات الخلوية بعد الزرع14. ومع ذلك ، نظرا للتكلفة العالية ، والتأثير الأخلاقي العالي ، فضلا عن تعقيد الكائن الحي ، فإن استخدامها غالبا ما يكون غير مباشر أو غير كاف لكشف العمليات الكيميائية الحيوية والجزيئية. بالإضافة إلى ذلك ، قد يقدمون العديد من العيوب المرتبطة بالاختلافات البيولوجية ، سواء بين الأنواع (التمثيل الغذائي) أو التباين داخل الأنواع (الجنس ، العمر). هذه العوامل ، جنبا إلى جنب مع العوامل الخارجية مثل المواقف العصيبة ، يمكن أن تغير نتائج التجربة وإمكانية التنبؤ بها من حيث الترجمة العلاجية للبشر15،16،17.
وبالتالي ، فإن العديد من المجموعات تستخدم 2D في زراعة الخلايا المختبرية وشرائح النمط العضوي خارج الجسم الحي (الثقافات خارج الجسم الحي) بالإضافة إلى النماذج الحيوانية. ثقافة الخلايا 2D هي النظام الأكثر استخداما لدراسة عمليات بيولوجية محددة على مستوى خلية واحدة و / أو خلية السكان. ومع ذلك ، فإن ثقافات الخلايا أحادية الطبقة لا تعكس التعقيد الموجود في الكائن الحي بأكمله. لا يسمح نقص هياكل الأنسجة والبيئة الفسيولوجية لأنظمة الثقافة ثنائية الأبعاد بمحاكاة الجوانب الهيكلية والمورفولوجية والوظيفية الرئيسية للأنسجة التي تم التحقيق فيها18،19،20. يمكن للثقافات العضوية التغلب على بعض هذه القضايا. تعتمد نماذج النمط العضوي على زرع جزء من نسيج أو عضو والحفاظ عليه خارج الجسم الحي لفترة محدودة21,22. على وجه الخصوص ، يتم إنشاء شرائح من الأنسجة المزروعة بسمك دقيق يسمح للمغذيات بالوصول بسهولة إلى جميع الخلايا الموجودة في الشرائح تقريبا. يمكن أن تتولد من مناطق مختلفة من الجهاز العصبي المركزي ، مثل الحصين ، ما تحت المهاد ، المخيخ ، المهاد ، القشرة الدماغية ، المادة السوداء والمخطط ، والحبل الشوكي23. تحتفظ الثقافات العضوية ببنية الأنسجة ، والتوزيع المكاني للخلايا ، والتنوع الخلوي ، والبيئة (أي تكوين المصفوفة خارج الخلية) للعضو الأصلي. علاوة على ذلك ، فإنها تحافظ على النشاط العصبي الأصلي ، والوصلات بين الخلايا ، وعلى وجه الخصوص ، الدوائر قصيرة المسافات بعد الزرع.
توفر هذه الجوانب بعض المزايا للثقافات خارج الجسم الحي فيما يتعلق بكل من الثقافات أحادية الطبقة والنماذج الحيوانية. يحتفظون بميزات الأنسجة الرئيسية الموجودة في الجسم الحي ولكن مع تقليل التكاليف وإمكانية إجراء أنواع مختلفة من التجارب الجزيئية والخلوية والوظيفية مع تنظيم دقيق للمعلمات البيئية للثقافة24،25،26،27،28،29. يمكن أيضا استغلال شرائح النمط العضوي لتطوير نماذج للاضطرابات العصبية المختلفة من خلال تشبه السمات النسيجية المرضية الرئيسية لحالات معينة30. علاوة على ذلك ، فإن الاحتفاظ ببيئة الأنسجة الأصلية متعددة الخلايا يجعلها منصات مناسبة لفحص الأدوية واختبار الجزيئات والمواد العصبية والتجديدية العصبية.
في هذا العمل ، نقترح استخدام ثقافات النمط العضوي SC كنموذج لتحسين عمليات زرع NSC. هذا ليس تافها لأن ظروف الاستزراع المثلى مطلوبة لضمان بقاء كل من المضيف (أنسجة SC) والزرع (NSCs) لأسابيع. مجموعات بحثية مختلفة منخرطة في ثقافات النمط العضوي ، مشتقة من الدماغ ومشتقة من SC ، أنواع مختلفة من الخلايا. أظهرت معظم الأعمال زرع الخلايا الجذعية الوسيطة31،32،33 ، أو خلايا التغليف الشمي34 ، أو NSCs35،36،37،38،39،40 وتقييم تفاعلات الخلايا المطعمة مع الخلايا المضيفة ، وبقاء النظام بأكمله ، وما إذا كانت الخلايا المزروعة متمايزة إلى خلايا عصبية أو خلايا شبيهة بالخلايا العصبية داخل بيئة الأنسجة خارج الجسم الحي 32،33،41. قام بعضهم بتقييم الإمكانات التجديدية للخلايا بعد الزرع ، ومراقبة نموها المحوري داخل الأنسجة37،40،41 ، والقدرة الميالينية للسلائف المطعمة من oligodendrocytes42 ، وهجرة الخلايا المطعمة إلى النسيج المضيف43 ، وما إذا كانت الخلايا المزروعة تطلق عوامل تدفع نحو بيئة التجدد31. أحد قيود الدراسات الحالية هو أنها لا تستكشف النقش لفترة طويلة الأجل.
بالنظر إلى أن NSCs يبدو أنها تتطلب عدة أسابيع للتمييز في الجسم الحي44,45 ، تركز هذه الدراسة على كيفية إنشاء وصيانة شرائح SC للفأر على المدى الطويل (≥30 يوما) لمدة تصل إلى 90 يوما. تم العثور على شرائح للاحتفاظ بهيكلها التشريحي الأصلي والحفاظ على معدل موت الخلايا المبرمج منخفض ومستقر بمرور الوقت وقابلية عالية للخلية. لاحظنا تعبيرا منتشرا عن علامات الحمض النووي الريبي المرتبطة ب fox-1 homolog 3 (RBFOX3) وسلسلة ضوء الخيوط العصبية (NFL) ، حيث أظهر الأخير اتجاها متزايدا للنبتات المحورية حول الشرائح بمرور الوقت ، مما يشهد على حالتها الصحية. علاوة على ذلك ، نجحنا في زرع الخلايا الجذعية العصبية الظهارية البشرية المشتقة من SC (h-SC-NES) في المراحل الأولى من التمايز العصبي في شرائح SC التي تعبر عن GFP في المراحل الأولى من التمايز العصبي. تم الحفاظ على طعم NSC لمدة 30 يوما بعد الزرع وأظهرت الخلايا تعبير GFP طوال الفترة في الثقافة. كما وجد أن معدل موت الخلايا المبرمج للخلايا في اليوم التالي للزرع (DPT) 30 يتماشى مع قيمة معدل موت الخلايا المبرمج التي لوحظت في DPT 7 في نفس الخلايا40. بدا أن الخلايا تنغمس في بيئة الأنسجة وبقيت على قيد الحياة لعدة أسابيع.
باختصار ، توضح بياناتنا أنه من الممكن الحفاظ على شرائح النمط العضوي SC في الثقافة لمدة 3 أشهر دون المساس ببنيتها الخلوية الأصلية وبيئة الأنسجة. الأهم من ذلك ، يمكن استغلالها لاختبار العلاجات الخلوية قبل الشروع في تجربة في الجسم الحي ، وبالتالي تقليل التكاليف والوقت التجريبي. هنا ، نوضح بالتفصيل جميع الممرات لإنشاء شرائح النمط العضوي SC الماوس وكيفية الحفاظ عليها لفترات طويلة الأجل (≥30 يوما). علاوة على ذلك ، نوضح بعمق كيفية إجراء زرع NPC في الشرائح وكيفية الحفاظ عليها لتحليل المصب.
Protocol
تم تنفيذ الإجراءات الحيوانية في الامتثال الصارم للبروتوكولات المعتمدة من قبل وزارة الصحة العامة الإيطالية واللجنة الأخلاقية المحلية لجامعة بيزا ، وفقا للتوجيه 2010/63 / EU (ترخيص المشروع رقم 39E1C. N.5Q7 صدر في 30/10/2021). تم الاحتفاظ بالفئران C57BL / 6J في بيئة منظمة (23 ± 1 درجة مئوية ، رطوبة 50 ± 5٪) مع دورة 12 ساعة من الضوء والظلام مع الطعام والماء حسب الحاجة.
تم تنفيذ جميع الأعمال المتعلقة بخلايا h-SC-NES وفقا لإرشادات المعاهد الوطنية للصحة لاقتناء وتوزيع الأنسجة البشرية لأغراض البحث الطبي الحيوي وبموافقة لجان التحقيق البشري ولجان الأخلاقيات المؤسسية لكل معهد تم الحصول على العينات منه. تم الحصول على الموافقة النهائية من لجنة أخلاقيات البيولوجيا بجامعة بيزا (مراجعة رقم 29/2020). تم توفير عينات بشرية مجهولة الهوية من خلال منحة MRC / Wellcome Trust المشتركة (099175 / Z / 12 / Z) ، وموارد بيولوجيا النمو البشري (www.hdbr.org). وتم الحصول على الموافقة المستنيرة المناسبة، وسجلت جميع المعلومات المتاحة غير المحددة لكل عينة. تم التعامل مع الأنسجة وفقا للمبادئ التوجيهية واللوائح الأخلاقية للاستخدام البحثي لأنسجة الدماغ البشري المنصوص عليها في المعاهد الوطنية للصحة (http://bioethics.od.nih.gov/humantissue. html) وإعلان WMA لهلسنكي (http://www.wma.net/en/30publications/10policies/b3/index.html).
1. إعداد المحاليل والمعدات لعزل الحبل الشوكي (SC) وزراعته
- حل طلاء لإدراج الغشاء
- تحضير محلول الطلاء (الجدول 1): محلول مائي يحتوي على 0.1 مجم من الكولاجين mL-1 ، و 0.01 مجم mL-1 poly-L-lysine ، و 0.01 مجم من اللامينين mL-1.
- ضع كل إدخال غشاء في طبق 35 مم أو طبق 6 آبار.
- أضف إلى الجزء العلوي من الغشاء 1 مل من محلول الطلاء: احتضان المحلول لمدة 4 ساعات في درجة حرارة الغرفة (RT) ؛ ثم قم بإزالته واترك الغشاء يجف طوال الليل (ON). قم بتخزين حشوات الغشاء عند 4 درجات مئوية حتى استخدامها.
ملاحظة: يجب إجراء جميع الممرات في ظروف معقمة. يجب حفظ طلاء الغشاء لمدة أقصاها 1 أسبوع عند 4 درجات مئوية قبل الاستخدام لتجنب تدهور البروتين والتصاق الشريحة دون المستوى الأمثل بالغشاء.
- تحضير الوسائط: وسط النمط العضوي ، وسط التشريح ، وسط الكسب غير المشروع
- تحضير الوسط العضوي (OM ، الجدول 1).
- تحضير وسيط التشريح كما هو موضح في الجدول 1.
- تحضير وسط الكسب غير المشروع (GM ، محسن من Onorati et al.46 ، الجدول 1).
ملاحظة: يجب تحضير المحاليل في ظروف معقمة وقبل استخدامها مباشرة (1 يوم قبل أو نفس يوم التجربة).
- إعداد المواد للجراحة
- في خزانة السلامة الأحيائية ، احتفظ بما يلي جاهزا للاستخدام: المجهر المجسم للتشريح والأدوات الجراحية: زوجان من المقصات الدقيقة ، وزوجان من الملقط المستقيم ، وزوجان من الملقط المنحني.
- في خزانة السلامة البيولوجية ، قم بإعداد أداة المروحية عن طريق تجهيزها بشفرة لتقطيع SC إلى شرائح. قم بتدوير برغي المروحية لرفع الذراع المعدني حيث يجب وضع الشفرة. ضع الشفرة في الموقع المحدد ، واخفض الذراع المعدني بالشفرة حتى تلامس سطح القطع ، وقم بإصلاحه عن طريق شد المسمار الآمن بمفتاح سداسي حتى يتم تثبيت الشفرة بإحكام. قم بتدوير المسمار الميكرومتري إلى سمك الشريحة المطلوب (بشكل عام 350 ميكرومتر). تحقق مما إذا كانت الشفرة موضوعة بدقة بشكل عمودي على سطح القطع.
ملاحظة: يعد وضع الشفرة بشكل عمودي بدقة فيما يتعلق بسطح القطع ضروريا لإجراء القطع بشكل صحيح. - تحضير في خزانة السلامة البيولوجية: اثنين من ماصات باستور البلاستيكية (ضرورية لنقل SC المعزولة والشرائح) ، ما لا يقل عن أربعة أطباق 35 مم وطبقين 60 مم ، وصندوق من الثلج الطازج.
- تعقيم جميع الأدوات بنسبة 70٪ من الإيثانول والأشعة فوق البنفسجية (دورة واحدة مدتها 20 دقيقة) قبل استخدامها مباشرة للحفاظ على عقم الثقافة.
2. عزل الماوس SC وتوليد الشرائح
- عزل الماوس SC
- التضحية بجراء الفأر بعد الولادة في اليوم الثالث (P3) وفقا لترخيص المشروع.
- من خلال بضع البطن في خط الوسط باستخدام المقص الدقيق ، قم بعزل المنطقة القطنية من العمود الفقري عن بقية جسم الفأر ووضعها في وسط تشريح بارد في طبق 35 مم.
- باستخدام المجهر المجسم للتشريح والمقص الدقيق ، قم بقص العمود الفقري على طول المحور السهمي ، واستخدم ملاقط مستقيمة لإزالة SC برفق من تجويف العمود الفقري.
- انزع السحايا بعناية من المنطقة القطنية المعزولة في SC باستخدام ملاقط مستقيمة.
- نقل واحتضان المنطقة القطنية المعزولة SC في وسط تشريح بارد وطازج لمدة 10-15 دقيقة قبل متابعة الخطوة التالية.
- توليد شرائح
- باستخدام ماصة باستور بلاستيكية واحدة ، خذ منطقة أسفل الظهر SC المعزولة من وسط التشريح وضعها على سطح القطع لأداة المروحية ، بشكل عمودي على الشفرة.
ملاحظة: يعد تحديد الموضع الصحيح ل SC فيما يتعلق بالشفرة (عموديا) ضروريا لإنشاء شرائح SC بشكل صحيح. - قم بإزالة وسيط التشريح المتبقي على السطح حول SC بمساعدة ماصة باستور والورق المعقم الماص. تابع التقسيم الآلي ل SC.
- بمجرد إنشاء الشرائح ، ضع بعض وسائط التشريح الطازجة باستخدام ماصة باستور على سطح التقطيع مع الشرائح. ثم اجمع الشرائح في طبق 35 مم مع وسط تشريح طازج واحتضنها لمدة 15 دقيقة.
- أثناء حضانة الشريحة ، اغسل سطح الغشاء الذي يدرج 3x باستخدام OM باستخدام ماصة باستور بلاستيكية. ثم اترك 1 مل من OM في الجزء السفلي من كل إدراج غشاء.
- تحقق من الشرائح تحت المجهر المجسم التشريح. قم بزرع العدد المطلوب من الشرائح على إدخالات الغشاء المشروط عن طريق نقلها باستخدام ماصة باستور بلاستيكية.
- حرك الشرائح في الاتجاه المفضل والموضع المطلوب على إدخالات الغشاء بمساعدة الملقط المستقيم. قم بإزالة الفائض من الوسط باستخدام ماصة باستور للسماح للشرائح بالالتصاق بشكل أفضل بسطح الغشاء.
ملاحظة: يجب إجراء تحريك وتوجيه الشرائح باستخدام الملقط المستقيم برفق لتجنب تلف الأنسجة أو الغشاء. - بعد 30 دقيقة من الحضانة عند 37 درجة مئوية ، انقل الملحق في طبق بتري جديد.
ملاحظة: المس الحلقة البلاستيكية ولكن ليس الأغشية أثناء التغيير المتوسط. - أضف 1 مل من OM الطازج المكمل بعامل التغذية العصبية المشتق من خط الخلايا الدبقية (GDNF) 100 ميكروغرام mL-1 في الجزء السفلي من إدخال الغشاء.
- احتضان الشرائح على حرارة 37 درجة مئوية. ارجع إلى اليوم الأول في الثقافة على أنه يوم خارج الجسم الحي (DEV) 0.
- باستخدام ماصة باستور بلاستيكية واحدة ، خذ منطقة أسفل الظهر SC المعزولة من وسط التشريح وضعها على سطح القطع لأداة المروحية ، بشكل عمودي على الشفرة.
3. زراعة طويلة الأجل من شرائح النمط العضوي
- الحفاظ على الشرائح في الثقافة عند 37 درجة مئوية حتى النقاط الزمنية المطلوبة.
- استبدل الوسيط ب OM جديد في DEV 1 كما هو موضح في الخطوات 2.2.7-2.2.8.
- في DEV 3 ، قم بتبديل الوسيط إلى GM لتهيئة البيئة المناسبة لزرع الخلايا الجذعية في اليوم التالي. استبدل الوسط ب GM جديد كل 48 ساعة (على سبيل المثال ، DEV 5 ، DEV 7 ...).
- أضف GDNF الطازج (التركيز النهائي 100 ميكروغرام مل -1) إلى الوسط كل يوم حتى DEV 7. بعد DEV 7 ، قم بإضافته فقط عند تغيير الوسيط (الخطوة 3.3).
4. زراعة الخلايا h-SC-NES
ملاحظة: يتم الاحتفاظ بخلايا h-SC-NES في المزرعة في وجود عوامل النمو (وسط NES، الخطوة 4.1.1). قبل الزرع ، يتم طلاء الخلايا في حالة تمايز مسبق لمدة 7 أيام عن طريق إزالة عوامل النمو من الوسط (وسط ما قبل التمايز: وسط NES بدون عامل نمو الخلايا الليفية 2 (FGF-2) وعامل نمو البشرة (EGF) ، الخطوة 4.1.2). بعد ذلك ، يتم طلاء الخلايا في حالة التمايز (وسط التمايز ، الخطوة 4.1.3) لمدة يومين قبل الزرع. يتم دعم التمايز عن طريق إضافة مكملات التغذية العصبية (عامل التغذية العصبية المشتق من الدماغ ، BDNF) إلى وسط التمايز. يتم وصف الصيانة والانقسام والتمايز المسبق والتمايز بين خلايا h-SC-NES12,46 بالتفصيل أدناه.
- إعداد وسائل الإعلام: NES ، وسائط التمايز المسبق والتمايز
- تحضير وسط صيانة الخلايا h-SC-NES (وسط NES ، الجدول 1).
- تحضير وسط التمايز المسبق لخلايا h-SC-NES (وسط التمايز المسبق ، الجدول 1).
- تحضير وسط تمايز الخلايا h-SC-NES (وسط التمايز ، الجدول 1). أضف BDNF حديثا عند تغيير الوسط أو عندما يتم طلاء الخلايا لأول مرة في حالة التمايز.
ملاحظة: يجب تحضير جميع الوسائط في ظروف معقمة ويجب ترشيحها باستخدام مرشحات 0.22 ميكرومتر.
- حل طلاء لخلايا h-SC-NES
ملاحظة: يتم الاحتفاظ بخلايا h-SC-NES في دعامات الثقافة المغلفة ب POLFN (POLFN = بولي-L-أورنيثين ، لامينين ، فيبرونيكتين).- تحضير محلول الطلاء في أنبوب: محلول بولي-L-Ornithine مع Laminin (5 μg mL−1) و Fibronectin (1 μg mL−1).
- انقل محلول الطلاء المحضر إلى دعامة زراعة الخلايا ، مع الحرص على إضافة ما يكفي لتغطية كامل سطح دعم زراعة الخلايا. احتضان الطلاء لمدة 1 ساعة عند 37 درجة مئوية أو طوال الليل عند 4 درجات مئوية.
- قم بإزالة محلول الطلاء من دعامات زراعة الخلايا.
ملاحظة: يمكن إعادة تدوير محلول POLFN مرتين أخريين ، ولكن يجب إضافة Laminin و Fibronectin طازجا في كل مرة. - اغسل الطلاء 3x بالماء المعقم بدرجة زراعة الخلايا. قم بتخزين الطلاء في درجة حرارة 4 درجات مئوية أو استخدمه.
ملاحظة: يجب استخدام الطلاء في غضون 1 أسبوع. بعد ذلك ، تعتبر الطلاءات منتهية الصلاحية بسبب عمليات تدهور البروتينات المضافة.
- صيانة الخلايا h-SC-NES
- الحفاظ على خلايا h-SC-NES في الثقافة في وسط NES. افحص الخلايا كل يوم تحت المجهر لمراقبة وقت وصولها إلى نقطة التقاء.
- تغيير نصف المتوسطة كل يومين: إزالة نصف الوسط المشروط وإضافة واحدة جديدة (النظر في معدل التبخر 20 ٪).
- إذا وصلت الخلايا إلى نقطة التقاء، فتابع الانقسام، كما هو موضح في الخطوة 4.4.
- ممر خلية h-SC-NES
ملاحظة: يتم تقسيم الخلايا على النحو التالي12:- قم بإزالة الوسط المكيف واغسل الخلايا مرة واحدة باستخدام محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) بدون Ca2 + / Mg2+.
- قم بإزالة DPBS وأضف محلول التربسين / EDTA إلى الخلايا لإجراء انفصال إنزيمي. احتضان الخلايا عند 37 درجة مئوية لمدة 30 ثانية إلى 1 دقيقة.
- بعد الحضانة ، تحقق من الخلايا الموجودة تحت المجهر: إذا لم تكن منفصلة ، فانقر قليلا على دعم زراعة الخلايا لإجراء انفصال ميكانيكي واحتضانها عند 37 درجة مئوية لمدة 30 ثانية أخرى.
- بعد الحضانة ، قم بتعطيل التربسين / EDTA عن طريق إضافة 4 مجلدات من محلول DPBS / مصل بقري الجنين (FBS) (10٪ حجم / مجلد) إلى دعم زراعة الخلايا مع الخلايا والتربسين / EDTA. ماصة بلطف الحل على سطح دعم زراعة الخلايا صعودا وهبوطا لمساعدة جميع الخلايا على الانفصال. جمع تعليق الخلية في أنبوب.
- أجهزة الطرد المركزي تعليق الخلية في 200 × غرام لمدة 3 دقائق. تخلص من المادة الطافية وأعد تعليق الحبيبات في وسط NES جديد.
- عد الخلايا وقم بوضعها على كل دعامة استزراع جديدة مغلفة ب POLFN بكثافة ̴0.5-1 × 105 خلايا / سم2.
- أضف Y-27632 (10 ميكرومتر) وضع الخلايا عند 37 درجة مئوية. تحقق منها كل يوم حتى التقاء ثم قسمها مرة أخرى للصيانة / التوسع أو الخدمات المصرفية الخلوية.
- التمايز المسبق لخلايا h-SC-NES
- تقسيم الخلايا كما هو موضح في الخطوة 4.4.
- صفيحة الخلايا على دعامات زراعة الخلايا المغلفة ب POLFN بكثافة ̴0.5-1 × 105 خلايا / سم2 في وسط ما قبل التمايز. أضف Y-27632 (10 ميكرومتر) بعد الانقسام. اتصل باليوم الأول في يوم التمايز المسبق في المختبر (DIV) 0.
- قم بتغيير نصف الوسط كل 2-3 أيام (انظر الخطوة 4.3.2).
- حافظ على الخلايا في حالة تمايز مسبق حتى DIV 7 ثم تابع الخطوة 4.6.
- تمايز خلايا h-SC-NES
- في DIV 7 من التمايز المسبق ، قم بتقسيم الخلايا كما هو موضح في الخطوة 4.4.
- صفيحة الخلايا على دعامات زراعة الخلايا المغلفة ب POLFN بكثافة ̴1-1.5 × 105خلايا / سم2في وسط التمايز. أضف Y-27632 (10 ميكرومتر) و BDNF (30 نانوغرام مل −1) بعد الانقسام.
- بعد يومين من التمايز (DIV 10) ، قسم الخلايا للزرع إلى شرائح.
5. نقل خلايا h-SC-NES مع ناقلات الفيروسات العدسية الحاملة ل GFP
ملاحظة: يتم إجراء نقل الخلايا أثناء مرحلة صيانة خلايا h-SC-NES. عندما يتم تحويل الخلايا بشكل صحيح ، يمكن توسيعها وتطبيق بروتوكولات التمايز والتمايز المسبقة الموصوفة سابقا (الخطوتان 4.5 و 4.6).
- تحضير وسط نقل الخلايا
ملاحظة: يتم تحضير وسط نقل الخلايا عن طريق خلط حجم معين من وسط NES وحجم دقيق من تحضير مخزون ناقلات الفيروسات العدسية (LVS) وفقا لمعايير مختلفة: MOI المطلوب (تعدد العدوى = نسبة عدد الجسيمات الفيروسية إلى أعداد الخلايا المضيفة في وسط عدوى معين) ؛ عدد الخلايا المطلية ؛ التركيز الأولي لإعداد LVS (= LVS PFU ، وحدة تشكيل البلاك) ؛ مساحة سطح وعاء الاستزراع المستخدم.- احسب الحجم الصحيح لإعداد LVS المراد إضافته إلى وسط NES ، وفقا ل MOI المختار باستخدام المعادلتين (1) و (2).
(n الخلايا إلى لوحة / سم2) × سم2 من دعم زراعة الخلايا × MOI = LVS PFU ل MOI المختار (1)
LVS PFU: Tot الأولي LVS Vol (μL) = LVS PFU ل MOI: LVS Vol للإضافة إلى الوسط (μL) (2)
ملاحظة: يتم إعطاء LVS PFU (PFU الأولي ل LVS) وإجمالي حجم LVS الأولي من قبل الشركة المصنعة. يتم حساب LVS PFU ل MOI المختار كما هو موضح في المعادلة (1). وبالتالي ، يمكننا الحصول على حجم إعداد LVS الذي يجب إضافته إلى الحجم الكلي لوسط NES (بناء على دعم زراعة الخلايا) ل MOI المختار ، كما هو موضح في المعادلة (2).
مثال: استخدمنا MOI 3 ، بناء على الخبرة المعملية السابقة (يمكن أن يختلف MOI اعتمادا على خط الخلية المستخدم والمستحضر الفيروسي). إذا كان MOI المطلوب هو 3 ، فإن عدد الخلايا المراد طلاءها هو 0.5 × 105 / سم2 ، ودعم الاستزراع هو 1 بئر MW24 (2 سم2) ، بافتراض أن LVS PFU / TU (وحدة تشكيل البلاك / وحدة التحويل) الأولية هي 25 × 106 PFU في 1 مل (1000 ميكرولتر = حجم LVS الأولي) ، الحسابات هي كما يلي:
خلايا مطلية في 1 بئر MW24 (2 سم2) = 0.5 × 105 خلايا × 2 سم2 = 1 × 105 خلايا
1 × 105 خلايا × 3 (وزارة الداخلية) = 3 × 105 PFU = LVS PFU ل MOI 3
25 × 106 PFU: 1,000 ميكرولتر = 3 × 105 PFU: x ميكرولتر
x ميكرولتر = 12 ميكرولتر = حجم LVS لإضافته إلى الوسط
وبالتالي ، لتحويل الخلايا باستخدام وسط نقل الخلايا مع بئر MOI 3 في 1 MW24 ، أضف 12 ميكرولتر من تحضير LVS الأولي إلى وسط NES (238 ميكرولتر) المحضر لبئر واحد من MW24. الحجم الإجمالي النهائي هو 250 ميكرولتر.
ملاحظة: عادة ما يتم تحضير الوسط طازجا في يوم النقل في ظل ظروف معقمة.
- احسب الحجم الصحيح لإعداد LVS المراد إضافته إلى وسط NES ، وفقا ل MOI المختار باستخدام المعادلتين (1) و (2).
- بروتوكول نقل h-SC-NES
- خلايا الصفيحة h-SC-NES عند ممر منخفض على صفيحة بئر متعددة 24 مطلية ب POLFN (أو في أي دعامة استزراع أخرى) بكثافة 0.5 × 105 / سم2 في وسط NES.
- في اليوم التالي ، اجمع وسيط NES المشروط من الآبار حيث تم طلاء الخلايا. اعتمادا على دعم الاستزراع المختار ، أضف إلى الخلايا أقل حجم من وسط نقل الخلايا الطازجة اللازم لتغطية سطح البذر بشكل موحد (على سبيل المثال ، 250 ميكرولتر / بئر من صفيحة متعددة الآبار 24).
- ثم احتضان خلايا h-SC-NES لمدة 6 ساعات عند 37 درجة مئوية. بعد ذلك ، أضف الوسط المكيف الذي تم جمعه مسبقا إلى الخلايا (200 ميكرولتر / بئر من صفيحة متعددة الآبار 24) واحتضان الخلايا عند 37 درجة مئوية.
- في اليوم التالي ، اغسل خلايا h-SC-NES مرة واحدة باستخدام DPBS وقم بإجراء تغيير متوسط كلي (متوسط NES).
- في الأيام التالية ، تحقق من الخلايا تحت مجهر مضان لمراقبة تعبير GFP.
- قم بتوسيع خلايا h-SC-NES لتخزين الخلايا وزرعها.
6. زرع الخلايا في شرائح SC والزراعة المشتركة
- إعداد microneedles الزجاج
- استخدم مجتذبا للحصول على إبر دقيقة من الشعيرات الدموية الزجاجية البورسليكات. اضبط الساحب على النحو التالي: HEAT 990 ، PULL 350.
ملاحظة: من الشعيرات الدموية ، من الممكن الحصول على إبرتين دقيقتين.
- استخدم مجتذبا للحصول على إبر دقيقة من الشعيرات الدموية الزجاجية البورسليكات. اضبط الساحب على النحو التالي: HEAT 990 ، PULL 350.
- تحضير الخلايا للزراعة
- تقسيم الخلايا كما هو موضح في الخطوة 4.4.
ملاحظة: إذا كانت الخلايا لا تعبر عن مراسل الفلورسنت ، فقم بتسميتها بصبغة تتبع الخلية لمراقبتها باستخدام مجهر مضان بعد الزرع وأثناء الزراعة طويلة الأجل. اتبع بروتوكول الشركة المصنعة المختارة لخطوة وضع العلامات. - عد الخلايا بعد الانقسام وأجهزة الطرد المركزي عند 200 × جم لمدة 3 دقائق. قم بتعليق الحبيبات التي تم الحصول عليها بوسط جديد + Y-27632 (10 ميكرومتر) للحصول على التركيز المطلوب للخلايا (عادة ما يتراوح بين 30000-50000 خلية μL-1).
- انقل معلق الخلية إلى أنبوب سعة 500 ميكرولتر أو 1.5 مل وضعه على الجليد. الخلايا جاهزة للزرع.
- تقسيم الخلايا كما هو موضح في الخطوة 4.4.
- زرع الخلايا في شرائح النمط العضوي
ملاحظة: قم بإجراء عمليات زرع خلايا h-SC-NES في شرائح النمط العضوي SC للفأر باستخدام حاقن هواء دقيق وإبر زجاجية دقيقة.- قم بتحميل إبرة زجاجية مجهرية ب 4 ميكرولتر من تعليق الخلية باستخدام ماصة دقيقة وأطراف محمل صغير.
ملاحظة: تجنب تكوين فقاعة الهواء في الإبرة لأنها قد تعيق عملية الحقن المجهري. إذا تم تشكيل فقاعات ، فقم بإزالتها باستخدام الماصة الدقيقة. - ضع الإبرة في الدعم المخصص للحاقن الدقيق وكسر طرف الإبرة باستخدام الملقط المستقيم.
ملاحظة: اكسر الإبرة الزجاجية بالقرب من الطرف لتجنب تكوين ثقوب كبيرة. - قبل الزرع في الشرائح ، اضبط معلمات الحقن المجهري. اضبط الضغط على 10 رطل / بوصة مربعة.
ملاحظة: يمكن تغيير قيمة الضغط بناء على الحاقن الدقيق وملاحظات المشغل: يجب أن يكون الضغط كافيا للحقن الدقيق لتعليق الخلية ، وتجنب تلف الأنسجة. - على شريحة زجاجية معايرة ، ضع قطرة من الزيت المعدني مع ماصة باستور وقم بحقن تعليق الخلية في القطرة. يرتبط قطر المجال الذي تم الحصول عليه من تعليق الخلية في قطرة الزيت بحجم حقن دقيق محدد. قم بتغيير معلمات الحقن المجهري حسب الحاجة للوصول إلى قطر كرة تعليق الخلية 0.2 مم لحقن 4nL.
- بعد ضبط الحجم الصحيح ، قم بحقن تعليق الخلية بسرعة في الشرائح. تحقق تحت المجهر المجسم الفلوري لوجود الخلايا في الشرائح للتحقق من نجاح الحقن المجهري / الزرع.
ملاحظة: قد يؤدي تعليق الخلية في بعض الأحيان إلى إعاقة الإبرة: في هذه الحالة ، حاول إزالة انسداد تعليق الخلية عن طريق تعديل معلمات الحقن أو تحميل إبرة جديدة بتعليق خلية جديدة. - بعد الزرع ، ضع الشرائح عند 37 درجة مئوية و 5٪ CO2حتى النقطة الزمنية المطلوبة وقم بإجراء تغيير متوسط كل يومين كما هو موضح في الخطوات 2.2.7-2.2.8.
- قم بتحميل إبرة زجاجية مجهرية ب 4 ميكرولتر من تعليق الخلية باستخدام ماصة دقيقة وأطراف محمل صغير.
7. تلطيخ المناعي
- اليوم 1
- قم بإزالة الوسط من أسفل غشاء الإدراج واغسل الشرائح 3x باستخدام DPBS المسخن مسبقا.
- ثبت الشرائح باستخدام الفورمالديهايد المسخن مسبقا بنسبة 4٪ (FA): قم بإزالة DPBS وأضف 1.5 مل من 4٪ FA في الجزء السفلي من الغشاء مع الشرائح. بعد 15 دقيقة من الحضانة في RT ، أضف 1 مل أكثر من 4٪ FA على السطح العلوي لإدخال الغشاء واحتضانه لمدة 15 دقيقة في RT. إجمالي وقت التثبيت: 30 دقيقة في RT
- قم بإزالة 4٪ FA واغسل الشرائح لمدة 3 × 10 دقائق باستخدام DPBS.
- قم بقطع غشاء الملحق بشكل محيطي بسكين جراحي ، وافصل الغشاء بالشرائح عن المكون البلاستيكي للإدخال ، وتابع خطوات التألق المناعي.
ملاحظة: بعد هذه الخطوة ، يطفو الغشاء مع الشرائح في DPBS في الطبق. - تتخلل مع 1 مل / غشاء من محلول مع 0.7٪ Triton في DPBS لمدة 10 دقائق في RT.
- قم بإزالة محلول النفاذية واحتضان العينات لمدة 4 ساعات عند 4 درجات مئوية مع 1 مل / غشاء من محلول الحجب المكون من 0.5٪ Triton ، 10٪ FBS في DPBS.
- قم بإزالة محلول الحجب وأضف إلى الشرائح الأجسام المضادة الأولية عند تخفيفها العامل ، على سبيل المثال ، الجسم المضاد للخيوط العصبية (NFL) للفأر ، 1: 500 ؛ أرنب مضاد لاتحاد كرة القدم الأميركي ، 1: 500 ؛ أرنب مضاد ل RBFOX3 (NeuN) ، 1: 400 ؛ أرنب مضاد نشط Caspase-3 (aCASP3) ، 1: 400 ؛ نوى الفأر المضادة للإنسان ، (Hu-Nu) ، 1: 400 ؛ أرنب مضاد هو نو ، 1: 400 ؛ الماوس المضاد ل GFP ، 1: 400 (كما ورد في الجدول 1) في 1 مل من محلول الأجسام المضادة المكون من 0.5٪ Triton ، 1٪ FBS في DPBS. احتضان ON عند 4 درجات مئوية.
- اليوم 2
- اغسل الأغشية لمدة 3 × 10 دقائق باستخدام 1-2 مل من DPBS.
- احتضان الغشاء بالأجسام المضادة الثانوية (على سبيل المثال ، الجسم المضاد الثانوي IgG (H + L) للماعز ، Alexa Fluor 488 ، 1: 500 ؛ الجسم المضاد الثانوي للماعز IgG (H + L) ، Alexa Fluor 568 ، 1: 500 ؛ الجسم المضاد الثانوي IgG (H + L) المضاد للماعز ، Alexa Fluor 647 ، 1: 500 ؛ الجسم المضاد الثانوي IgG (H + L) المضاد للأرانب ، Alexa Fluor 647 ، 1: 500 كما ورد في الجدول 1) و Hoechst / DAPI للنوى المخففة في 1 مل / غشاء من محلول الأجسام المضادة (Triton 0.5٪ + FBS 1٪ في DPBS) لمدة 3 ساعات في RT.
ملاحظة: احم العينات بعناية من الضوء لتجنب تبييض الأجسام المضادة الثانوية أثناء الحضانة وفي الخطوات التالية. - قم بإزالة محلول الأجسام المضادة واغسله لمدة 3 × 10 دقائق باستخدام DPBS (1-2 مل).
- استبدل DPBS ب DPBS جديد وقم بتخزينه في درجة حرارة 4 درجات مئوية في ظروف محمية من الضوء.
- في نهاية بروتوكول التألق المناعي ، قم بتركيب الأغشية على شرائح زجاجية. ضع قطرة 200 ميكرولتر من محلول التركيب على شريحة زجاجية. بمساعدة ملاقط مستقيمة ، انقل الغشاء العائم من الطبق مقاس 35 مم إلى زلة غطاء ، ثم انقل الغشاء إلى الشريحة الزجاجية باستخدام محلول التثبيت.
- ضع قطرة من 100 ميكرولتر من محلول التركيب على غطاء جديد وقم بتغطية الغشاء به ، وتثبيته على الشريحة الزجاجية. اتركه يجف طوال الليل تحت الغطاء الكيميائي في ظروف محمية من الضوء.
- قم بتخزين العينات في درجة حرارة 4 درجات مئوية في الظلام أو قم بإجراء تحليل التصوير.
8. مقايسة حية / ميتة
- قم بإعداد محلول العمل عن طريق تسطير 700 ميكرولتر لكل طبق من الوسط الطازج وأضف في تخفيف العمل الصحيح Sytox (على سبيل المثال ، المكون B ، 1: 2,000) و Calcein AM (على سبيل المثال ، المكون A ، 1: 2,000).
ملاحظة: نظرا لأن الكواشف حساسة للضوء ، قم بحماية محلول العمل من الضوء. - قم بتقييم الحجم المتوسط في الجزء السفلي من الغشاء وأضف Sytox و Calcein AM بنفس تخفيف العمل الموضح في الخطوة 8.1.
- أضف قطرتين من 30 ميكرولتر لكل منهما أعلى كل شريحة من محلول العمل المعد في الخطوة 8.1.
ملاحظة: احم الطبق من الضوء بوضعه في ظروف مظلمة. - احتضان الشرائح لمدة 30 دقيقة في RT.
- بعد الحضانة ، قم بقطع الغشاء محيطيا من الإدخال بسكين جراحي: بعد ذلك ، يطفو الغشاء مع الشرائح في محلول العمل.
- ضع الغشاء بدون محلول التثبيت رأسا على عقب على غطاء بمساعدة ملاقط مستقيمة وأضف 100 ميكرولتر من DPBS فوق الأغشية للحفاظ على رطوبتها.
- احصل على صور حية باستخدام المجهر متحد البؤر في أسرع وقت ممكن.
ملاحظة: أضف 2 قطرات من 40 ميكرولتر لكل من DPBS على الجزء العلوي من الغشاء كل 30 دقيقة أثناء التقاط الصورة لمنع الغشاء من الجفاف.
9. التصوير
- التصوير البؤري للعينات الثابتة
- للتحليل النوعي ، احصل على الصور باستخدام مجهر متحد البؤر مع معلمات الاستحواذ التالية: اضبط خيار الصورة الكبيرة (اختر: 4 × 4) ، واستخدم 10 × هدف ، بدون مكدسات ، ودقة 3,634 × 3,634 بكسل.
- للتحليل الكمي (aCASP3 و Calcein و Sytox للشرائح و aCASP3 للخلايا) ، احصل على صور باستخدام المجهر متحد البؤر مع معلمات الاستحواذ التالية: 20 × هدف ، دقة 1,024 × 1,024 بكسل مع خطوة Z تبلغ 3 ميكرومتر.
- التصوير الحي للشرائح المزروعة باستخدام المجهر المجسم
ملاحظة: التقط الصور باستخدام المجهر المجسم في وضعي برايت فيلد وفرط التألق.- باستخدام إعداد برايت فيلد ، احصل على صور للشرائح (1 × هدف مع تكبير 3x مستخدم هنا).
ملاحظة: قم بتعديل الضوء اعتمادا على المجهر المستخدم واستخدم الألياف الضوئية إذا لزم الأمر. - باستخدام إعداد التألق ، احصل على صور للخلايا المزروعة بنفس الهدف والتكبير المستخدم للشرائح (انظر الخطوة 9.2.1). استخدم المعلمات التالية للاستحواذ: كسب 1 ، التعرض 200-500 مللي ثانية ، إزاحة -10.
- باستخدام إعداد برايت فيلد ، احصل على صور للشرائح (1 × هدف مع تكبير 3x مستخدم هنا).
- التصوير الحي بعد الفحص الحي / الميت باستخدام المجهر متحد البؤر
- التقط الصور باستخدام مجهر متحد البؤر مع معلمات الاستحواذ التالية: هدف 20x ، دقة 1,024 × 1,024 بكسل مع خطوة Z تبلغ 3 ميكرومتر.
10. تحليل الصور بواسطة ImageJ
- تحليل منطقة NFL و RBFOX3 و DAPI
- افتح برنامج ImageJ (https://imagej.net/software/imagej/).
- افتح صورة الملف بالنقر فوق ملف | فتح | حدد ملف | فتح.
- في النافذة المنبثقة، حدد عرض المكدس | هايبر ستاك ووضع الألوان | افتراضي (مع مقياس تلقائي).
- في شريط الأدوات، حدد صورة | اللون | تقسيم القنوات.
- اختر القنوات المطلوبة لتحليلها: القناة الخضراء ل NFL (علامة محورية) ، والقناة الحمراء ل RBFOX 3 (علامة الخلايا العصبية) ، والقناة الزرقاء ل DAPI (تلطيخ نووي).
- لتحليل NFL ، تابع الخطوات التالية: في شريط الأدوات حدد صورة | ضبط | العتبة | حدد المعلمات (خلفية داكنة ، خوارزمية ، على سبيل المثال ، افتراضي) وحرك المؤشر على شريط القيمة (أسفل / فوق) لتغطية وتقييد كل منطقة الأعصاب (يتم تمييز الخلايا العصبية باللون الأبيض في خلفية داكنة) | مجموعة | تطبيق.
- حدد من شريط الأدوات أداة التتبع Wand واستخدمها لتحديد المنطقة البيضاء التي يغطيها NFL تلقائيا. تحليل صحفي | قياس | قيمة المساحة بالميكرومتر2.
- لتحليل DAPI و RBFOX3 ، تابع الخطوات التالية: في شريط الأدوات ، حدد صورة | ضبط | العتبة | حدد المعلمات (خلفية بيضاء ، خوارزمية ، على سبيل المثال ، افتراضي) وحرك المؤشر على شريط القيمة (أسفل / فوق) لتغطية وتقييد كل منطقة RBFOX3 أو DAPI | مجموعة | تطبيق.
- في شريط الأدوات، حدد عملية | إف إف تي | مرشح ممر النطاق. استخدم شريط قيمة العتبة لضبط المنطقة البيضاء التي يغطيها RBFOX3 أو DAPI ، المقابلة لإشارة التألق الخاصة بهم.
- من شريط الأدوات ، حدد أداة التتبع Wand واستخدمها لتحديد المنطقة التي يغطيها RBFOX3 أو DAPI تلقائيا. تحليل صحفي | قياس | قيمة المساحة بالميكرومتر2.
- تحليل موت الخلايا المبرمج بواسطة ImageJ
- افتح برنامج ImageJ (https://imagej.net/software/imagej/).
- افتح صورة ملف Z-stack بالنقر فوق ملف | فتح | حدد ملف | فتح.
- في النافذة المنبثقة، حدد عرض المكدس | هايبر ستاك ووضع الألوان | افتراضي (مع مقياس تلقائي).
- في شريط الأدوات، حدد صورة | اللون | تقسيم القنوات.
- اختر القنوات المطلوبة: قناة حمراء ل aCASP3 (علامة موت الخلايا المبرمج للتحليل) والأزرق أو السماوي ل DAPI أو Hu-Nu للنوى. ثم قم بتراكب القنوات عن طريق التحديد في شريط الأدوات صورة | اللون | دمج القنوات | إنشاء مركب.
- اسحب شريط Z في أسفل الصورة لتصفح مكدس Z للصورة وتحديد الحزم المكدسة في المنطقة الوسطى من الشرائح بإيجابية aCASP3.
- في شريط الأدوات، حدد المكونات الإضافية | حلل | عداد الخلية.
- في النافذة المنبثقة المفتوحة ، حدد تهيئة لإعداد الصورة للعد ؛ بعد ذلك ، حدد نوع عداد (على سبيل المثال ، النوع 1) وأعد تسميته ككائن للعد (على سبيل المثال ، خلايا aCASP3 + ). أعد تسمية أنواع العدادات الأخرى كما هو موضح أعلاه لحساب الكائنات الأخرى (على سبيل المثال ، خلايا DAPI + أو Hu-Nu + لإجمالي عدد الخلايا).
- في النافذة المنبثقة ، حدد نوع العداد المقابل للكائن المراد عده (على سبيل المثال ، خلايا aCASP3 + ) ، ثم حدد أداة النقطة في شريط الأدوات وابدأ في حساب عدد الخلايا المبرمج يدويا ، الموجب ل aCASP3 ، والنقر فوق كل خلية موجبة في الصورة المفتوحة.
- حدد نوع عداد آخر في نافذة عداد الخلية وابدأ في حساب العدد الإجمالي للخلايا (خلايا DAPI + ، للشرائح ؛ خلايا Hu-Nu + ، للخلايا المزروعة).
- تحليل مقايسة الأحياء / الأموات بواسطة ImageJ
- افتح برنامج ImageJ (https://imagej.net/software/imagej/).
- افتح صورة ملف Z-stack بالنقر فوق ملف | فتح | حدد ملف | فتح.
- في النافذة المنبثقة، حدد عرض المكدس | هايبر ستاك ووضع الألوان | افتراضي (مع مقياس تلقائي).
- في أشرطة الأدوات، حدد صورة | اللون | تقسيم القنوات.
- اختر القنوات المطلوبة: القناة الخضراء للكالسيين (علامة حيوية للتحليل) وقناة سماوية ل Sytox (علامة ميتة). ثم قم بتراكب القنوات عن طريق التحديد في شريط الأدوات صورة | اللون | دمج القنوات | حدد إنشاء مركب.
- اسحب شريط Z في أسفل الصورة لتصفح مكدس Z للصورة وتحديد المكدسات في المنطقة المركزية للشرائح بإيجابية Calcein و Sytox.
- في شريط الأدوات، حدد المكونات الإضافية | حلل | عداد الخلية.
- في النافذة المنبثقة المفتوحة ، حدد تهيئة لإعداد الصورة للعد ؛ ثم حدد نوع عداد (على سبيل المثال ، النوع 1) وأعد تسميته ككائن للعد (على سبيل المثال ، خلايا Calcein + ). أعد تسمية أنواع العدادات الأخرى كما هو موضح أعلاه إذا كان من الضروري حساب كائن آخر (على سبيل المثال ، خلايا Sytox + ).
- في النافذة المنبثقة ، حدد نوع العداد المقابل للكائن المراد حسابه ؛ ثم حدد أداة Point في شريط الأدوات وابدأ في حساب عدد خلايا Calcein + يدويا ، والنقر فوق كل خلية موجبة في الصورة المفتوحة.
- حدد نوع عداد آخر في نافذة عداد الخلية واحسب خلايا Sytox + كما هو موضح في Calcein.
11. الرسوم البيانية والتحليل الإحصائي
- قم بإجراء جميع التحليلات الإحصائية والرسوم البيانية باستخدام البرنامج الذي تختاره.
النتائج
تسمح الطرق الموصوفة بإنشاء شرائح SC العضوية من الفئران في المرحلة P3 وصيانتها في الثقافة لفترة طويلة في ظروف صحية. علاوة على ذلك ، نعرض بروتوكولا لزرع الخلايا في الشرائح وللزراعة المشتركة لمدة تصل إلى 30 يوما (الشكل 1). أولا ، نعرض تحسين ظروف الاستزراع وبروتوكول مناسب للزراعة المطولة لشرائح SC بالخلايا المزروعة (الشكل 2 أ). يتم إنشاء الشرائح وصيانتها من DEV 0 حتى DEV 2 في OM ، والتي تم اقتراحها في الأصل كوسيط مثالي لصيانة شرائح SC47. ومع ذلك ، نظرا لوجود بروتينات المصل ، يمكن أن يكون هذا الوسط دون المستوى الأمثل للحفاظ على التمايز العصبي ونضج خلايا السلائف العصبية المزروعة. في الواقع ، في DEV 3 ، اختبرنا التبديل من OM إلى GM ، وهي تركيبة تحتوي على Neurobasal plus B27 ، والتي تدعم البقاء العصبي ، وبدون مصل ، مما يمنع التمايز العصبي الصحيح ، ويعزز بدلا من ذلك مصير الدبقية48,49.
يوضح الشكل 2B النتائج التي تم تحقيقها من خلال تبديل الوسيط في DEV 3 من OM إلى GM ، مقارنة بشرائح SC التي لا تتلقى المفتاح (تم استزراع شرائح التحكم في OM). استخدمنا توزيع إشارة NFL داخل الشرائح كعلامة لسلامة الخلايا العصبية (الشكل 2B ، C). كانت الشرائح في DEV 7 صحية في كلتا حالتي الاستزراع ، مما يدل على التوزيع المنتشر للخيوط العصبية (NFL ، باللون الأخضر) بداخلها. في DEV 10 ، بدت الشرائح المستزرعة في GM أكثر صحة فيما يتعلق بشرائح التحكم المستزرعة في OM ، كما هو موثق من خلال توزيع تلطيخ NFL. قمنا أيضا بتقدير مساحة NFL + (٪ NFL + Area / DAPI + Area) للشرائح الموضحة في الصور التمثيلية للشكل 2B. يتم تمثيل منطقة NFL + المقدرة في الرسوم البيانية في الشكل 2C ، مما يؤكد أن إشارة NFL موزعة بشكل منتشر في الشرائح عند DEV 7 في كلتا الحالتين. ومع ذلك ، في DEV 10 ، تنخفض المساحة المقدرة التي يغطيها تلطيخ NFL لحالة زراعة OM.
وتشير هذه البيانات إلى أن التحول إلى الآلية العالمية في DEV 3 أمر جيد التحمل للاستزراع المطول لشرائح SC (DEV 10). وكخطوة تالية، اختبرنا جنرال موتورز في نقاط زمنية أطول: DEV 30 وDEV 60 وDEV 90. كما هو موضح في الشكل 3 أ ، ب ، تم الحفاظ على الشرائح صحية في الثقافة حتى DEV 90. تم العثور على تلطيخ NFL على نطاق واسع في الشرائح في كل نقطة زمنية ، مع انتشار منتشر حول شرائح الخلايا العصبية المغادرة من المنطقة الوسطى. في الواقع ، قمنا بتقدير مساحة NFL + للشرائح الموضحة في الشكل 3A وزادت بمرور الوقت كما هو موضح في الرسوم البيانية للشكل 3B. لاحظنا أيضا إيجابية للعلامة العصبية RBFOX3 ، مما يوفر خطا آخر من الأدلة على التمايز العصبي للشرائح. في كل نقطة زمنية ، تحققنا أيضا من معدل موت الخلايا المبرمج من خلال تقييم عدد الخلايا الموجبة إلى aCASP3 في شرائح مختلفة (الشكل 4 أ ، ب). تم إجراء التحليل كما هو موضح في قسم البروتوكول 10.2. وجد أن معدل موت الخلايا المبرمج (٪ خلايا aCASP3 + / إجمالي عدد خلايا DAPI +) منخفض جدا في كل نقطة زمنية (0.85 ± 0.52٪ ، 0.71 ± 0.27٪ ، 0.66 ± 0.45٪ ل DEV 30 و 60 و 90 على التوالي) مع عدم وجود فروق ذات دلالة إحصائية بين النقاط الزمنية الثلاث المدروسة (القيمة p > 0.05 ، الشكل 4B). تشير هذه البيانات إلى أن معدل موت الخلايا المبرمج المرتبط ب aCASP3 يظل مستقرا خلال الوقت ، جنبا إلى جنب مع التوزيع الواسع ل NFL في الشرائح (الشكل 4 أ) ، يؤكد بقاء الشرائح في كل نقطة زمنية.
دعما للبيانات السابقة ، أجرينا أيضا مقايسة حية / ميتة لتقييم صلاحية الشرائح في النقاط الزمنية الثلاث المختلفة. استخدمنا Calcein (تلطيخ أخضر) لتسمية الخلايا القابلة للحياة والنشطة الأيضية و Sytox (تلطيخ السماوي) لتقييم موت الخلايا. كما هو موضح في الرسوم البيانية في الشكل 4C ، تزداد النسبة المئوية للخلايا النشطة الأيضية قليلا من DEV 30 إلى DEV 90 (93.17 ± 5.21٪ ، 96.43 ± 3.02٪ ، 96.33 ± 3.10٪ ل DEV 30 و 60 و 90 ، على التوالي) ، وتستقر بين النقطتين الزمنيتين الأخيرتين (DEV 30 مقابل DEV 60 p-value = 0.018 ؛ DEV 30 مقابل DEV 60 p-value = 0.018 ؛ DEV 30 مقابل DEV 60 p-value = 0.018; DEV 30 مقابل DEV 90 p القيمة = 0.027 ؛ DEV 60 مقابل DEV 90 p-value = 0.99). وجدنا مستويات منخفضة من موت الخلايا التي انخفضت بمرور الوقت (6.83 ± 5.21٪ ، 3.57 ± 3.02٪ ، 3.66 ± 3.10٪ ل DEV 30 و 60 و 90 على التوالي) وتم العثور على فرق كبير بين DEV 30 والنقاط الزمنية اللاحقة ، DEV 60 و DEV 90 (DEV 30 مقابل DEV 60 p-value = 0.018; DEV 30 مقابل DEV 90 p القيمة = 0.027 ؛ DEV 60 مقابل DEV 90 p القيمة = 0.99). تؤكد هذه البيانات ، بالاقتران مع معدل موت الخلايا المبرمج ، بقاء الشريحة بمرور الوقت وتدعم فعالية بروتوكول الاستزراع طويل الأجل الذي يتم إجراؤه.
بمجرد إثبات جدوى الزراعة المطولة لشرائح SC ، تحدينا النظام عن طريق زرع خلايا h-SC-NES في المراحل الأولى من التمايز العصبي. اختبرنا خلايا h-SC-NES لأنها أظهرت نتائج واعدة لعلاج اصابات النخاعالشوكي 12. يتم وصف إجراء زرع خلايا h-SC-NES في شرائح SC للماوس في قسم البروتوكول 6. تم الحفاظ على شرائح SC وخلايا h-SC-NES المزروعة حتى DPT 30. تم تطعيم الخلايا في DIV 10 من التمايز (مرحلة السلائف العصبية) في شرائح النمط العضوي DEV 4 ، كما هو موضح في مخطط البروتوكول في الشكل 5A. تمت مراقبة الخلايا المزروعة للتعبير عن GFP في الثقافة لمدة تصل إلى 30 يوما. يوضح الشكل 5B صورا حية تمثيلية ، عند DPT مختلفة ، لشريحة SC مع خلايا GFP + المزروعة. يشير التعبير المستقر ل GFP بمرور الوقت (الشكل 5B والشكل 6A) إلى أن الخلايا نجت في نسيج SC في ظروف المزرعة المحسنة سابقا. تحققنا أيضا من معدل موت الخلايا المبرمج للخلايا المزروعة كما هو موضح في قسم البروتوكول 10.2. وجد أن معدل موت الخلايا المبرمج (٪ خلايا aCASP3 + / إجمالي عدد خلايا Hu-Nu + ) منخفض جدا (0.44 ± 0.34٪) بعد 30 DPT (الشكل 6B). علاوة على ذلك ، وجد أن معدل موت الخلايا المبرمج عند DPT 30 يتماشى مع المعدل الموجود لنفس النوع من الخلايا في DPT 7 ، كما تم الإبلاغ عنه سابقا40 ، مما يوثق أن الثقافات تستقر بمرور الوقت.
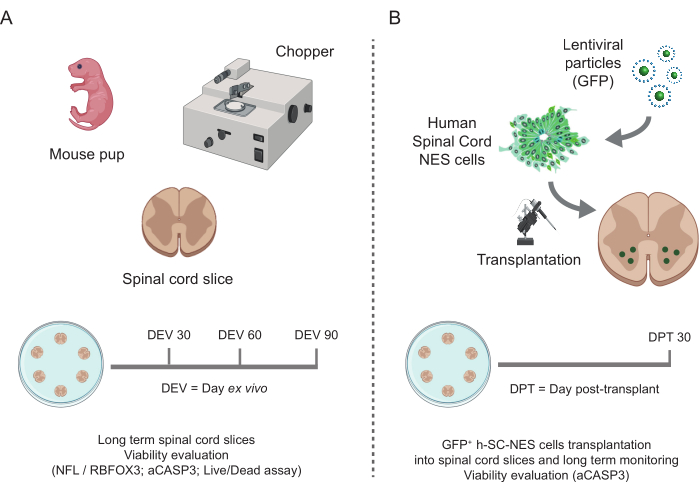
الشكل 1: سير عمل البروتوكول. مخطط تمثيلي يوضح سير العمل العام للبروتوكول الذي تم إجراؤه. (أ) على اليسار ، مخطط يلخص توليد شريحة SC للفأر من SC المعزولة لجراء الفئران في P3 والاستزراع طويل الأجل لشرائح النمط العضوي SC. (ب) على اليمين، مخطط يلخص زرع خلايا h-SC-NES التي تعبر عن GFP في شرائح النمط العضوي SC للفأر. يتم الحفاظ على الخلايا المطعمة لمدة 30 يوما بعد الزرع. الاختصارات: h-SC-NES = الجذع الظهاري العصبي المشتق من الحبل الشوكي البشري. GFP = بروتين الفلورسنت الأخضر ؛ DEV = يوم خارج الجسم الحي ؛ DPT = يوم ما بعد الزرع ؛ NFL = سلسلة ضوء الخيوط العصبية ؛ RBFOX3 = الحمض النووي الريبي ملزمة الثعلب -1 متجانسة 3 ؛ aCASP3 = كاسباس-3 نشط؛ SC = الحبل الشوكي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
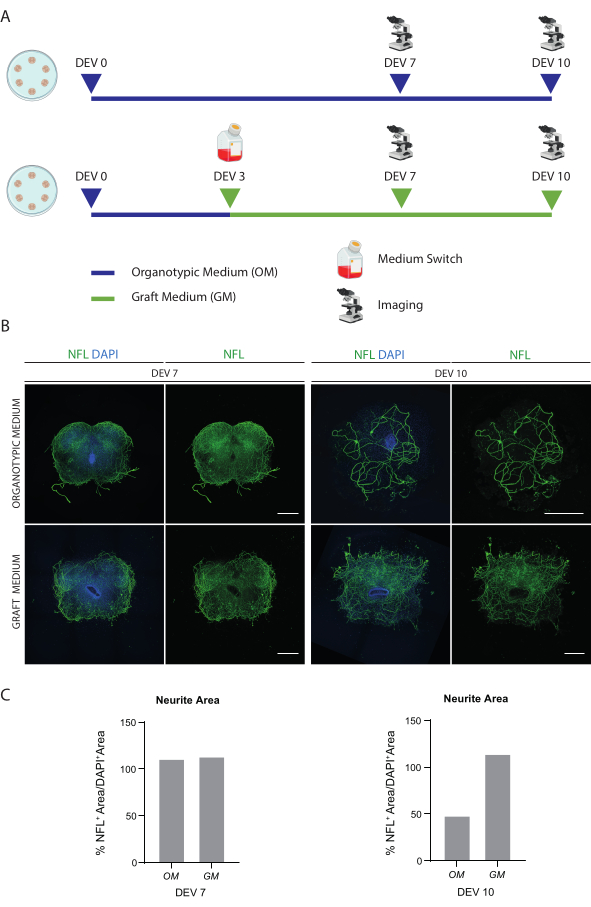
الشكل 2: تحسين ظروف الاستزراع على المدى الطويل. (أ) مخطط تمثيلي لبروتوكول اختبار OM و GM. يتم الاحتفاظ ب OM حتى DEV 7-10 للمجموعة الضابطة. يتم تحويل الوسيط إلى GM في DEV 3 للشرائح المعالجة ؛ بعد ذلك ، يتم إصلاحها في DEV 7-10 للمقارنة مع عناصر التحكم. (ب) صور تمثيلية تقارن شرائح النمط العضوي SC للفأر في DEV 7 و 10 المزروعة في ظروف مختلفة. يتم تلطيخ شرائح للخيوط العصبية للعلامة الهيكلية الخلوية (NFL ، الأخضر). يشير التوزيع الواسع لتلطيخ اتحاد كرة القدم الأميركي في شرائح مستزرعة مع جنرال موتورز إلى بقاء وتمايز شامل. النوى ملطخة ب DAPI. شريط المقياس = 500 ميكرومتر. (ج) الرسوم البيانية التمثيلية لتقدير المساحة التي يغطيها اتحاد كرة القدم الأميركي في الشرائح الموضحة في الشكل 1 ب. في DEV 10 ، تنخفض مساحة سطح NFL في حالة زراعة OM. الاختصارات: DEV = يوم خارج الجسم الحي ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ NFL = سلسلة ضوء الخيوط العصبية. OM = وسط عضوي ؛ GM = وسط الكسب غير المشروع ؛ SC = الحبل الشوكي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
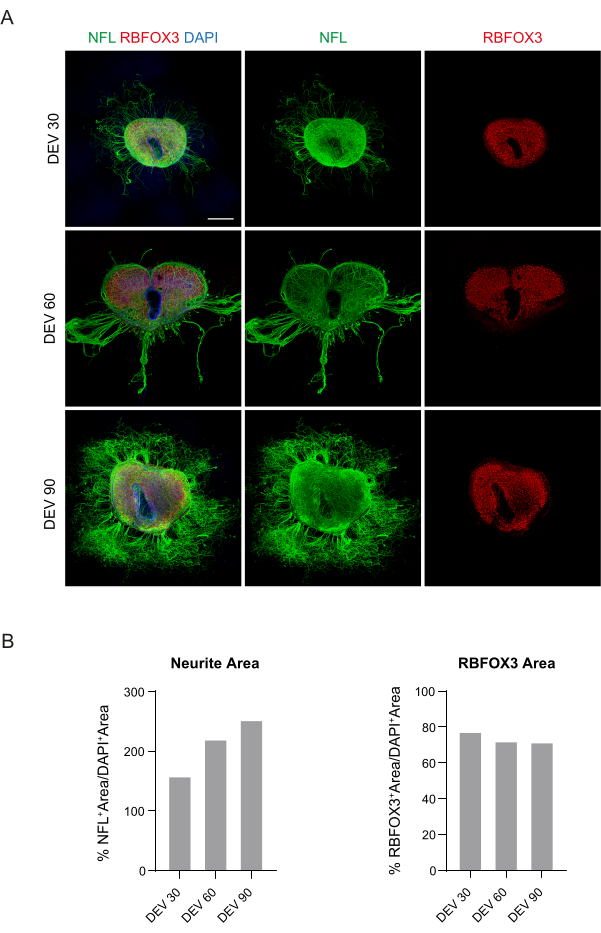
الشكل 3: شرائح النمط العضوي SC للفأر المستزرع على المدى الطويل. (أ) يتم الاحتفاظ بالشرائح في الثقافة حتى DEV 90. يكشف اختبار التألق المناعي عن توزيع واسع للخيوط العصبية للعلامة الهيكلية الخلوية (NFL ، الأخضر) والعلامة العصبية النووية RBFOX3 (الحمراء) ، مما يشهد على حالتها الصحية وهويتها العصبية بعد الزراعة طويلة الأجل. من الجدير بالذكر أن محاور NFL + تنبت بشكل منتشر حول الشرائح بمرور الوقت. النوى ملطخة ب DAPI. شريط المقياس = 500 ميكرومتر. (B) الرسوم البيانية التمثيلية لتقدير مساحة ووقت NFL + ومنطقة RBFOX3 + للشرائح الموضحة في اللوحة A. تزداد مساحة NFL + العصبية بمرور الوقت. الاختصارات: DEV = يوم خارج الجسم الحي ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ NFL = سلسلة ضوء الخيوط العصبية ؛ SC = الحبل الشوكي. RBFOX3 = الحمض النووي الريبي ملزمة الثعلب -1 متجانسة 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
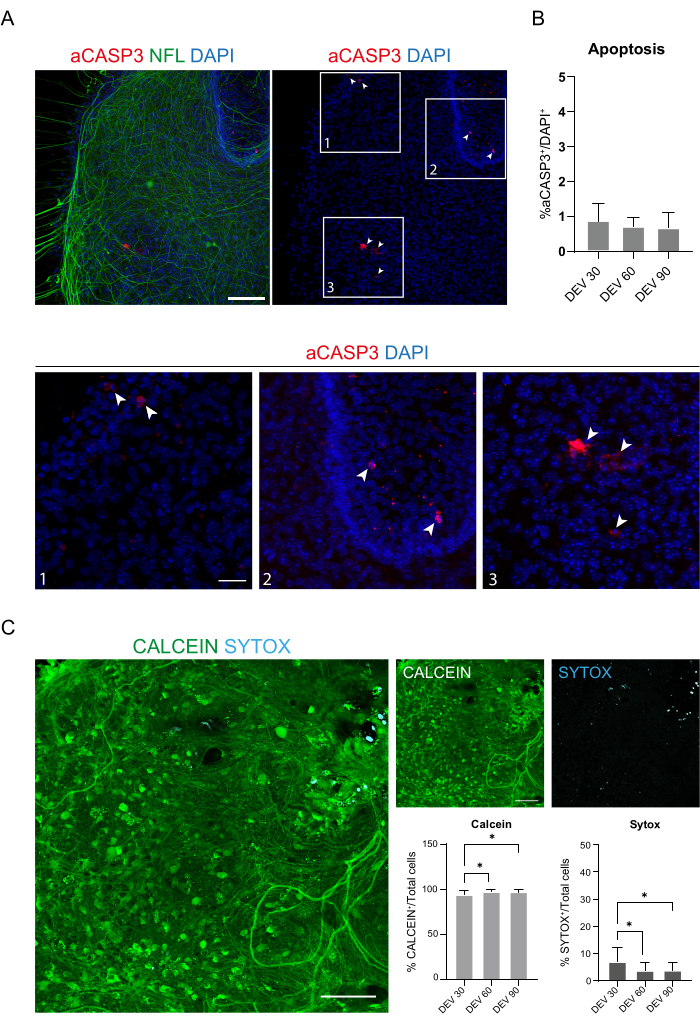
الشكل 4: تقييم صلاحية الخلية في شرائح SC بمرور الوقت. (أ) صور تمثيلية لشرائح النمط العضوي في DEV 60 مصبوغة ل aCASP3 (أحمر) و NFL (أخضر). شريط المقياس = 100 ميكرومتر. يظهر اتحاد كرة القدم الأميركي نمطا منتشرا. الخلايا النادرة إيجابية للعلامة المبرمج aCASP3 (أقحم: 1-2-3). ب: تحليل معدل موت الخلايا المبرمج في شرائح في نقاط زمنية مختلفة. متوسط ± SD ، N (النسخ المتماثل) = 6 شرائح ، n (إجمالي الخلايا) > 1000 لكل شريحة ، اختبار Kruskal-Wallis ، مقارنة متعددة ، قيمة p > 0.05. معدل موت الخلايا المبرمج مستقر بمرور الوقت. في الأجزاء الداخلية 1-2-3 من اللوحة A ، من الممكن ملاحظة تفاصيل الخلايا الإيجابية ل aCASP3 (تلطيخ أحمر ، أسهم بيضاء). تشير النقاط الحمراء الصغيرة إلى حطام الخلايا ونوى pyknotic . شريط المقياس = 50 ميكرومتر. (C) صور تمثيلية للمقايسة الحية / الميتة التي أجريت على شرائح SC في DEV 90: يتم تمييز الخلايا النشطة الأيضية باللون الأخضر مع Calcein ، بينما يتم تمييز الخلايا الميتة والتالفة باللون الأزرق الفاتح (السماوي) مع Sytox. يظهر المدرجان التكراريان النسبة المئوية للخلايا الموجبة للكالسيين (على اليسار) و Sytox (على اليمين) على إجمالي عدد الخلايا. لكل من متوسط ± SD ، N (النسخ المتماثل) = 6 شرائح ، n (إجمالي الخلايا) > 1000 لكل شريحة ، اختبار Kruskal-Wallis ، مقارنة متعددة ، DEV 30 مقابل DEV 60 قيمة p = 0.018 ؛ DEV 30 مقابل DEV 90 p القيمة = 0.027 ؛ DEV 60 مقابل DEV 90 p القيمة > 0.99. الاختصارات: DEV = يوم خارج الجسم الحي ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ NFL = سلسلة ضوء الخيوط العصبية ؛ SC = الحبل الشوكي. aCASP3 = كاسباس -3 نشط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
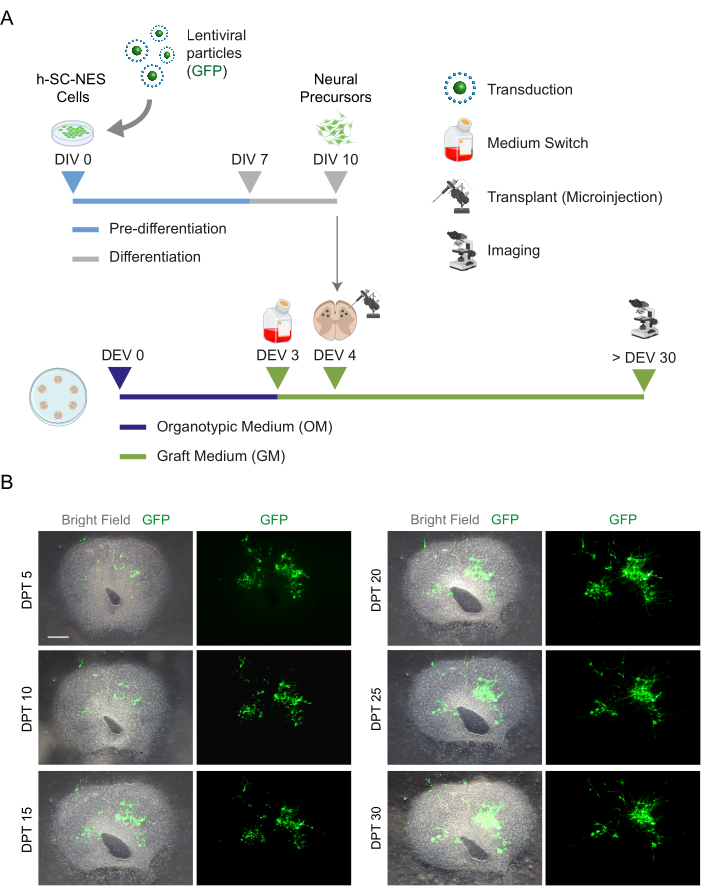
الشكل 5: زرع خلايا h-SC-NES في شرائح النمط العضوي للفأر. (أ) مخطط تمثيلي لبروتوكول الزرع. يتم زرع الخلايا كسلائف عصبية في DIV 10 من التمايز إلى شرائح DEV 4 العضوية. (ب) صور تمثيلية لشرائح النمط العضوي للفأر المزروعة بخلايا h-SC-NES المعبرة عن GFP بمرور الوقت حتى DPT 30. يتم تحويل الخلايا بناقل فيروسي عدسي يحمل جين GFP . يؤكد تعبير GFP بمرور الوقت قابليتها للتطبيق والتكيف مع بيئة الشريحة. شريط المقياس = 500 ميكرومتر. الاختصارات: DIV = اليوم الأول في ما قبل التمايز ؛ h-SC-NES = جذع ظهاري عصبي مشتق من الحبل الشوكي البشري ؛ GFP = بروتين الفلورسنت الأخضر ؛ DEV = يوم خارج الجسم الحي ؛ OM = وسط عضوي ؛ GM = وسط الكسب غير المشروع ؛ DPT = أيام بعد الزرع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
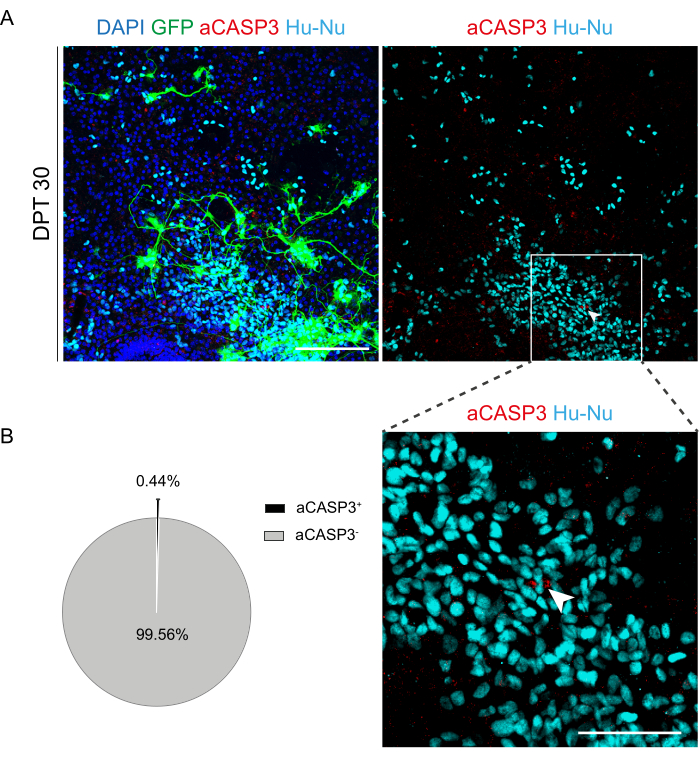
الشكل 6: تقييم معدل موت الخلايا المبرمج لخلايا h-SC-NES المزروعة بعد 30 يوما من الزرع. (أ) صورة تمثيلية لشريحة نمطية عضوية للفأر مزروعة بخلايا h-SC-NES المعبرة عن GFP. يتم تحويل الخلايا بناقل عدسي فيروسي يحمل جين GFP لمراقبتها في الشرائح بعد الزرع. يؤكد تعبير GFP بمرور الوقت قابليتها للتطبيق والتكيف مع بيئة الشريحة. النقطة الزمنية الموضحة هي DPT 30 ؛ الخلايا ملطخة بالنوى البشرية (سماوي) و aCASP3 (أحمر). شريط المقياس = 150 ميكرومتر. (B) على اليسار ، مخطط دائري تمثيلي لتحليل موت الخلايا المبرمج للخلايا المزروعة في شرائح عند DPT 30 (N (تكرار) = 5 شرائح ، n (خلايا) = 5000) ، وعلى اليمين ، أقحم داخلي لخلايا Hu-Nu + وتفاصيل خلية موجبة إلى aCASP3 (سهم أبيض). شريط المقياس = 75 ميكرومتر. تشير النقاط الحمراء الصغيرة إلى حطام الخلايا ونوى pyknotic . الاختصارات: h-SC-NES = الجذع الظهاري العصبي المشتق من الحبل الشوكي البشري. GFP = بروتين الفلورسنت الأخضر ؛ DPT = يوم ما بعد الزرع ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ NFL = سلسلة ضوء الخيوط العصبية ؛ aCASP3 = كاسباس -3 نشط ؛ Hu-Nu = نوى بشرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تكوين الحلول المستخدمة في هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
لا يوجد حتى الآن علاج فعال للمرضى الذين يعانون من اصابات النخاع الشوكي. تم اختبار مناهج مختلفة وأحد أكثرها واعدة يعتمد على استبدال الخلايا الإستراتيجية المتجددة. في الوقت الحالي ، تتطلب التطورات في مجال الطب التجديدي منصات جديدة لاختبار فعالية وسلامة عمليات زرع الخلايا ، بمفردها أو بالاشتراك مع طرق أخرى. التحقق من صحتها قبل السريرية ضروري لمتابعة المزيد من الدراسات السريرية. تعد ثقافات النمط العضوي SC منصة مفيدة لدراسة الجوانب المختلفة للتنكس العصبي ، والتجديد العصبي ، والنمو العصبي ، وللتحقيق في فعالية الأساليب العلاجية الجديدة23. على وجه الخصوص ، تعد السمات المحددة للثقافات العضوية مثل الحفاظ على العمارة النسيجية الأصلية وتكوين الخلية والبيئة الدقيقة مفيدة لكشف ديناميكيات الزرع ، مثل نقش الخلايا والتكامل والتمايز والنضج.
تماشيا مع البروتوكولات المنشورة ، يمكن الحفاظ على شرائح النمط العضوي SC في الثقافة لمدة 2-3 أسابيع تقريبا في ظروف صحية ، مما يحد من استخدامها للتحقيقات طويلة الأجل والفحص الوظيفي المطلوب لاختبار مخططات العلاج الخلوي. يتطلب استكشاف العمليات المهمة مثل التمايز والنضج نحو المصير الصحيح للخلايا المزروعة داخل أنسجة SC مراقبة طويلة الأجل. هذه العمليات الخلوية حاسمة أثناء عمليات الزرع الشائعة في النماذج الحيوانية. إن توفر نظام خارج الجسم الحي يحاكي العديد من الميزات الموجودة في الجسم الحي سيكون مفيدا في مرحلة الفحص قبل السريري.
لهذا السبب ، في هذا العمل ، نقترح طريقة مثالية طويلة الأجل (≥30 يوما) للنمط العضوي SC تسمح بالحفاظ على شرائح SC قابلة للحياة لمدة تصل إلى 90 يوما ، مما يضاعف الإطار الزمني المعتاد للاستزراع ثلاث مرات. علاوة على ذلك ، نعرض نقشا مستقرا لخلايا h-SC-NES داخل شرائح SC والحفاظ على ثقافة الزرع لمدة تصل إلى 30 يوما. لقد راقبنا نقش الخلايا بمرور الوقت من خلال مراقبة تعبير GFP للتحقق من بقاء الخلية حتى DPT 30. بعد 30 DPT ، قمنا بتقييم معدل موت الخلايا المبرمج. في الأدبيات ، تم الإبلاغ عن تقييم موت الخلايا المبرمج لخلايا h-SC-NES المزروعة في شرائح SC عند 7 DPT40. هنا ، قمنا بتوسيع تحليل موت الخلايا المبرمج عند DPT 30 لمقارنة معدل موت الخلايا المبرمج فيما يتعلق بالنقطة الزمنية السابقة (DPT 7). اكتشفنا أن بياناتنا تتماشى مع الأدبيات ، مما يشير إلى أن خلايا h-SC-NES المزروعة تعيش أيضا في وقت لاحق إذا تم الحفاظ عليها في حالة الثقافة المحسنة في عملنا. ستساعد هذه المنصة المحسنة خارج الجسم الحي على المدى الطويل وحدها وفي تكوين الزرع الباحثين في الفحص قبل السريري لعمليات زرع الخلايا الجذعية لإصابات النخاع الشوكي. سيسمح لهم ذلك بتحديد أفضل خلية مرشحة لمزيد من الدراسات في الجسم الحي التي تعزز نجاح عمليات الزرع. علاوة على ذلك ، بعد الفحص الأولي ، يمكن أيضا استخدام شرائح النمط العضوي SC بالتوازي مع الدراسات في الجسم الحي لتأكيد وتأكيد الديناميات والسلوكيات الخلوية طويلة المدى التي لوحظت في النماذج الحيوانية أو لدعم الدراسات الآلية.
يصف بروتوكولنا بالتفصيل كيفية إنشاء هذا النموذج العضوي طويل المدى ، ولكن يجب أيضا مناقشة بعض الخطوات الحاسمة. فيما يتعلق بتوليد الثقافات العضوية SC ، هناك بعض التحديات أثناء الجراحة والمراحل الأولى من الثقافة. يعد إجراء الجراحة الذي يتم إجراؤه جيدا أمرا ضروريا لإنشاء شرائح تحافظ على العمارة النسيجية الأصلية. إذا تم تدمير SC أثناء العزل ، يمكن أن تفقد الشرائح هيكلها التشريحي النموذجي ويمكن أن يؤدي تلف الأنسجة إلى إهانة مفرطة مؤيدة للالتهابات تؤدي إلى ظروف غير صحية وموت الخلايا. المرحلة الأكثر تحديا أثناء الجراحة هي استخراج SC من العمود الفقري وإزالة السحايا من SC المعزول. يعتمد نجاح هذه الخطوات على خبرة المشغل ؛ لذلك ، يوصى بفترة تدريب قبل البدء في التجارب.
يعد التقسيم الإكليلي للجنة العليا من خلال المروحية أيضا مرحلة صعبة. يجب وضع SC المعزول على سطح القطع بشكل عمودي تماما على الشفرة. يجب على المشغل أيضا وضع الشفرة بشكل عمودي على سطح القطع. هذه الاحتياطات ضرورية لضمان توليد شرائح قابلة للتكرار بين نفس التجارب والتجارب المختلفة. قضية أخرى مهمة هي أن وقت الجراحة محدود: يجب أن يستغرق إجراء توليد الشرائح بالكامل ~ 30 دقيقة. إذا قضى المشغل وقتا أطول في الجراحة والقطع ، فستعاني أنسجة SC وهذا يمكن أن يضعف نجاح الثقافة والخطوات التالية للتجربة.
بمجرد وضع الشرائح على غشاء الثقافة ، من المهم إطعامها بشكل صحيح. GDNF ضروري للحفاظ على استعادة الأنسجة والبقاء على قيد الحياة. يعد القطع باستخدام المروحية أمرا مؤلما للأنسجة ، ولهذا السبب ، يتم وضع الشرائح بعد فترة وجيزة من القطع في وسط تشريح بارد لتنظيف الجزيئات الزائدة المؤيدة للالتهابات والمعززة للموت. بعد ذلك ، يتم وضع شرائح على أغشية المزرعة (إدخالات زراعة الخلايا) مع وسط جديد معدل باستخدام GDNF لتعزيز التعافي بشكل أسرع والتصاق الشرائح بالغشاء. يجب إضافة GDNF إلى الوسط كل يوم للأسبوع الأول في الثقافة بسبب عمر النصف القصير50,51. لاحظنا أن الشرائح تحتاج إلى الوجود المستمر ل GDNF خلال الأيام الأولى في الثقافة لتعزيز استعادة الأنسجة وصلاحيتها. على أي حال ، نظرا لأن وجود GDNF مهم لفترة الاستزراع بأكملها ، فلا ينصح بشدة بمقاطعة إدارة GDNF في نقاط زمنية أخرى.
خلال الأسبوع الأول في الثقافة ، من المهم أيضا فحص الشرائح مجهريا بالعين والمجهر. الأنسجة الشفافة وشفافية الحدود هي علامات على التصاق الشرائح بشكل صحيح بالغشاء والأنسجة القابلة للحياة. ستظهر الأنسجة الميتة بيضاء للغاية عند المنظر العياني الأول وستظهر المناطق الميتة رمادية داكنة عند المجهر. بعد بضعة أسابيع في الثقافة ، قد يتغير مورفولوجيا الأنسجة: يمكن أن تؤثر حركات الخلايا والتصاق الأنسجة بالغشاء على هذه العملية. لاحظنا ، على سبيل المثال ، فقدان التجويف المركزي في بعض الشرائح المملوءة بالخلايا وفقدان مورفولوجيا القرن الظهري والبطني. يحدث هذا بشكل أساسي مع شرائح أصغر ، في حين أن معظمها سيحافظ على بنية تشريحية قريبة من البنية الأصلية. عادة ما يتم إنشاء الشرائح من المناطق القطنية أو الصدرية لأنه بهذه الطريقة يمكن أن يكون لها الحجم المناسب للحفاظ على بنيتها النسيجية الأصلية بمرور الوقت: إذا كانت صغيرة جدا ، فإنها تفقد هندستها المعمارية بينما ، إذا كانت كبيرة جدا ، يمكن أن تتعرض المنطقة الوسطى للنخر. وبالتالي ، استخدمنا المنطقة القطنية لجراء الفئران لتوليد شرائح بالحجم المناسب للزراعة المثلى على المدى الطويل ، ولكن من حيث المبدأ ، يمكن اعتبار شرائح أخرى. علاوة على ذلك ، اخترنا استخدام المنطقة القطنية ، لأن المناطق البطنية والظهرية يمكن تمييزها عن بعضها البعض. بالإضافة إلى ذلك ، تقدم هذه المنطقة مناطق الأنسجة مع نسبة أعلى من الخلايا العصبية الحركية والمادة الرمادية ، والتي هي مواقع ذات أهمية لعلاجات استبدال الخلايا في اصابات النخاع الشوكي. فيما يتعلق بزرع الخلايا في الشرائح ، تتعلق المشكلة الرئيسية بكسر طرف الإبرة المجهرية الزجاجية. إذا كان ثقب مرور الخلايا كبيرا جدا ، فقد يتسبب ذلك في تلف أنسجة SC أثناء الحقن المجهري. إذا كانت صغيرة جدا ، يمكن أن يؤدي تكديس الخلايا إلى إعاقة الإبرة ، مما يعيق عملية الزرع. يجب إكمال عملية الزرع في غضون 1 ساعة لتقليل معاناة الخلايا وموتها.
يوفر البروتوكول المقترح أداة مثالية ومتعددة الاستخدامات لأنواع مختلفة من التحقيقات. هنا ، نطبق منصتنا طويلة المدى للتحقق من صحة زرع خلايا h-SC-NES في المراحل الأولى من التمايز داخل أنسجة SC للفأر لمدة 30 يوما. الجدة الرئيسية للنهج المقترح هي تحسين بروتوكول الثقافة المشتركة. تحافظ مكونات الكائنات المعدلة وراثيا على بقاء الخلايا العصبية على المدى الطويل لشرائح SC وخلايا h-SC-NES المزروعة. في الواقع ، فإن GM ، كونها وسيطا خاليا من المصل ، تحافظ على تمايز الخلايا المزروعة نحو مصير الخلايا العصبية فيما يتعلق بالوسط المستخدم سابقا لثقافة الشرائح العضوية47.
فيما يتعلق بالنماذج المقترحة ل SCI ، عادة ما يتم إجراء التجارب على الفئران البالغة. حتى الآن ، ترتبط أهم الاختلافات بين SC حديثي الولادة والبالغين بإمكانات التجدد الأعلى الموجودة في حديثي الولادة فيما يتعلق بالفئران البالغة52. ومع ذلك ، فإن مثل هذه الاختلافات ليس لها أي تأثير على نوع البروتوكول الذي نقترحه ، لأننا نركز هنا على استجابة الخلايا المطعمة لبيئة الأنسجة المضيفة بدلا من قدرات تجديد الخلايا العصبية المقيمة. هناك اختلاف آخر بين الفئران حديثي الولادة والبالغين بعد اصابات النخاع الشوكي يتعلق بتكوين الندبة الدبقية التي تحدث عند البالغين. لا يؤخذ هذا الجانب في الاعتبار في النموذج المقترح ، والذي لا يأخذ في الاعتبار العمليات الفسيولوجية المرضية المعقدة الناتجة عن الإصابات الأولية والثانوية.
فيما يتعلق بالتطبيقات ، يمكن أيضا استخدام المنصة للتحقيق في التكامل بين الخلايا المزروعة مع الدوائر المقيمة الموجودة في نموذج النمط العضوي SC. تم استخدام أدوات الهندسة الوراثية بالفعل في الجهاز العصبي المركزي لتقييم الاتصال المشبكي ويمكن استغلالها في هذا الصدد53،54،55. على وجه الخصوص ، يمكن التحقيق في التكامل والتحقق من صحته من خلال تقييم تكوين نقاط الاشتباك العصبي بين الخلايا المطعمة والأنسجة SC خارج الجسم الحي . يمكن أيضا استغلال هذه الثقافات العضوية طويلة المدى لاختبار عوامل الحماية العصبية والتجدد العصبي أو الجزيئات / المواد الجديدة أو لدراسة الاضطرابات التنكسية العصبية التي تنطوي على SC. لدراسة اضطرابات تنكسية عصبية محددة ، يجب تكييف البروتوكول لزراعة شرائح SC المتولدة من النماذج ذات الصلة ، مثل الفئران المعدلة وراثيا التي تحمل طفرات محددة مرتبطة بعلم الأمراض ، في المرحلة ذات الصلة لعلم الأمراض (أي حديثي الولادة والأحداث والبالغين). في الختام ، فإن بروتوكولنا وثقافاتنا العضوية بشكل عام ، كونها نباتات لعضو معين ، تقدم ميزات تسد الفجوة بين ثقافات الخلايا 2D والنماذج في الجسم الحي ، مما يؤكد أنها أداة لا تقدر بثمن لكل من البحوث الأساسية والاختبارات قبل السريرية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم الدراسة من قبل مؤسسة Wings for Life (WFL-IT- 20/21) ، وخطة الاتحاد الأوروبي للتعافي والمرونة الوطنية للاتحاد الأوروبي (NRRP) - المهمة 4 المكون 2 ، والاستثمار رقم 1.4-CUP N. B83C22003930001 (النظام البيئي الصحي في توسكانا - THE ، Spoke 8) ، ومارينا رومولي أونلوس. تعكس هذه المخطوطة وجهات نظر المؤلفين وآرائهم فقط، ولا يمكن اعتبار الاتحاد الأوروبي أو المفوضية الأوروبية مسؤولين عنها. تتوفر البيانات والبيانات الوصفية على Zenodo 10.5281 / zenodo.10433147. تم إنشاء الصور باستخدام Biorender https://www.biorender.com/.
Materials
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
References
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved