Method Article
Long-Term Mouse Spinal Cord Organotypic Slice Culture as a Platform for validating Cell transplantation in Spinal Cord (척수 손상에서 세포 이식을 검증하기 위한 플랫폼으로서의 장기 마우스 척수 유기형 절편 배양)
요약
이 논문에서는 세포 대체 요법을 테스트하기 위한 생체 외 모델로 신경 줄기 세포로 이식된 장기 척수 기관형 절편을 생성하고 유지하기 위한 재현 가능한 방법을 제공합니다.
초록
척수 손상(SCI)에 대한 해결책적 치료법은 복잡한 병태생리학으로 인해 여전히 부족합니다. 가장 유망한 재생 접근법 중 하나는 손실된 조직을 대체하고 기능 회복을 촉진하기 위한 줄기 세포 이식을 기반으로 합니다. 이 접근법은 더 비싸고 시간이 많이 소요되는 동물 실험을 진행하기 전에 안전성과 효능을 위해 in vitro 및 ex vivo 에서 더 잘 연구되어야 합니다. 이 연구에서는 인간 신경 줄기 세포를 이식한 쥐 척수(SC) 유기형 절편을 기반으로 SCI에 대한 세포 대체 요법을 테스트하기 위한 장기 플랫폼 구축을 보여줍니다.
표준 SC 유기형 배양은 in vitro에서 약 2주 또는 3주 동안 유지됩니다. 여기에서는 최대 90일 동안 장기 유지 관리(≥30일)를 위한 최적화된 프로토콜에 대해 설명합니다. SC 절편의 장기 배양에 사용되는 배지는 신경 줄기 세포를 기관형 모델에 이식하는 데에도 최적화되었습니다. 녹색 형광 단백질(GFP) 리포터를 운반하는 인간 SC 유래 신경상피 줄기(h-SC-NES) 세포를 마우스 SC 절편에 이식했습니다. 이식 후 30일이 지난 후에도 세포는 여전히 GFP 발현과 낮은 세포사멸 속도를 보이며, 이는 최적화된 환경이 조직 내에서 세포의 생존과 통합을 유지했음을 시사합니다. 이 프로토콜은 SC 조직에서 세포 대체 요법을 효율적으로 테스트하기 위한 강력한 참조를 나타냅니다. 이 플랫폼을 통해 연구자들은 다양한 세포 이식 요법에 대한 생체 외 사전 스크리닝을 수행할 수 있어 생체 내 실험을 진행하기 전에 가장 적절한 전략을 선택할 수 있습니다.
서문
외상성 척수 손상(SCI)은 환자와 간병인에게 파괴적인 신체적, 심리적, 경제적 결과를 초래합니다1. 다양한접근법으로 SCI에서 축삭 재생을 촉진하기 위한 많은 시도가 이루어졌으며, 2,3,4 세포 교체 요법을 통해 손상 부위의 근위 뉴런과 원위 뉴런 사이의 뉴런 릴레이 형성에 의해 일부 유익한 효과가 입증되었습니다. 이식된 세포는 영양 지원, 면역 조절, 가소성 유도를 통한 잃어버린 신경 회로 재생, 세포 교체, 축삭 재수초화 등 많은 역할을 할 수있기 때문에 세포 치료에 대한 관심은 여전히 증가하고 있다6.
최근에는 인간 신경 줄기/전구 세포(NSC/NPC)에 대한 연구가 주력되고 있습니다7. 여러 연구에 따르면 NSCs/NPCs는 성상세포 반응(astrocyte response)8을 조절하고, 재생 인자(proregenerative factor)9,10의 분비를 촉진하며, SCI11,12에서 누락된 신경 세포를 대체한다. 그러나 이식된 세포가 기능적 뉴런으로 분화하는 것을 뒷받침하는 연구는 여전히 빈약합니다. 더욱이, 손상된 척수(SC)에서 이식된 세포의 생존 및 분화율은 낮은데13, 이는 이식된 세포가 in vivo에서 분화하는 데 몇 주, 심지어 몇 달이 걸리기 때문일 수 있다. 또한 현재 연구는 세포 교체 요법의 많은 생화학적, 분자적, 세포 및 기능적 측면을 완전히 설명하지 못했습니다. 이러한 맥락에서 세포 생착 메커니즘, 생착된 세포의 증식 능력, 세포의 특정 유형 또는 하위 집단으로 분화하고 상주 뉴런과 시냅스를 형성하는 능력을 연구하기 위해 간단하고 빠르며 비용 효율적인 모델이 필요합니다.
조직학적 연구를 전기생리학적 기록과 전사체 및 단백질체 프로파일링에 통합하는 것은 세포 이식 후 발생하는 분자 캐스케이드를 완전히 이해하기 위해 필요합니다. 이는 확실히 전임상 모델 및 임상 연구에서 새로운 세포 대체 요법의 설계 및 검증을 가속화할 것입니다. 실제로, 현재까지 설치류, 대형 동물 및 비인간 영장류의 사용은 이식 후 많은 세포 과정을 설명하는 데 가치가 있었다14. 그러나 높은 비용, 높은 윤리적 영향 및 유기체의 복잡성으로 인해 그 사용은 종종 간단하지 않거나 생화학 및 분자 과정을 밝히는 데 적합하지 않습니다. 또한, 생물학적 차이, 종간(신진대사) 및 종내 변동성(성별, 연령) 모두와 관련된 많은 단점을 제시할 수 있습니다. 이러한 요인은 스트레스가 많은 상황과 같은 외부 요인과 함께 실험의 결과와 인간에 대한 치료적 번역 측면에서 예측 가능성을 변경할 수 있습니다 15,16,17.
따라서 많은 그룹에서 동물 모델 외에도 2D in vitro cell culture 및 ex vivo organotypic slices (ex vivo cultures)를 사용합니다. 2D 세포 배양은 단일 세포 및/또는 세포 집단 수준에서 특정 생물학적 과정을 연구하기 위해 가장 일반적으로 사용되는 시스템입니다. 그럼에도 불구하고, 단층 세포 배양은 전체 유기체에서 발견되는 복잡성을 반영하지 않습니다. 조직 구조 및 생리학적 환경의 부족으로 인해 2D 배양 시스템이 조사된 조직18,19,20의 주요 구조적, 형태학적, 기능적 측면을 완전히 모방할 수 없습니다. 유기형 배양은 이러한 문제 중 일부를 극복할 수 있습니다. 유기체형 모델(organotypic model)은 조직 또는 장기의 일부를 이식하고 제한된 기간 동안 생체 외(ex vivo)로 유지하는 것을 기반으로 한다21,22. 특히, 이식된 조직의 절편은 영양분이 절편의 거의 모든 세포에 쉽게 도달할 수 있도록 정확한 두께로 생성됩니다. 이들은 해마(hippocampus), 시상하부(hypothalamus), 소뇌(cerebellum), 시상(thalamus), 대뇌피질(cerebral cortex), 흑질(substantia nigra) 및 선조체(striatum), 척수(spinal cord)와 같은 중추신경계의 다양한 영역에서 생성될 수 있다 23. 기관형 배양은 조직 구조, 세포의 공간적 분포, 세포 다양성 및 기원 기관의 환경(즉, 세포외 기질 구성)을 유지합니다. 더욱이, 그들은 원래의 신경 활동, 세포 사이의 연결, 특히 이식 후 단거리 회로를 보존합니다.
이러한 측면은 단층 배양 및 동물 모델 모두와 관련하여 생체 외 배양에 몇 가지 이점을 제공합니다. 그들은 생체 내에서 발견되는 주요 조직 기능을 유지하지만 비용을 절감하고 배양 환경 매개변수 24,25,26,27,28,29의 정확한 조절로 다양한 유형의 분자, 세포 및 기능성 실험을 수행할 수 있습니다. 기관형 절편은 또한 특정 상태의 주요 조직병리학적 특징을 유사하게 함으로써 다양한 신경학적 장애에 대한 모델을 개발하기 위해 활용될 수 있다30. 더욱, 본래 다세포 조직 환경의 보유는 그(것)들에게 약 검열 그리고 신경 보호와 신경 재생 분자 및 물자 시험을 위한 적합한 플랫폼을 만듭니다.
이 연구에서는 NSC 이식을 최적화하기 위한 모델로 SC 기관형 배양을 사용할 것을 제안합니다. 몇 주 동안 숙주(SC 조직)와 이식(NSC)의 생존을 보장하기 위해 최적의 배양 조건이 필요하기 때문에 이는 사소한 일이 아닙니다. 유기형 배양, 뇌 유래 및 SC 유래, 다양한 유형의 세포에 이식된 다양한 연구 그룹. 대부분의 연구는 중간엽 줄기 세포(31,32,33), 후각 피복 세포(34) 또는 NSC (35,36,37,38,39,40)의 이식을 보여주었고 생착 된 세포와 숙주 세포의 상호 작용, 전체 시스템의 생존 및 이식 된 세포가 뉴런 또는 뉴런 유사 세포로 분화하는지 여부를 평가했습니다 생체 외 조직 환경내부 32,33,41. 그들 중 일부는 이식 후 세포의 재생 잠재력을 평가하고, 조직 내부의 축삭 성장(37,40,41), 희소돌기아교세포(42)의 생착된 전구체의 수초화 능력, 생착된 세포가 숙주 조직(43)으로 이동하는 것, 그리고 이식된 세포가 재생 환경(31)으로 밀어내는 인자를 방출하는지 여부를 관찰했다. 현재 연구의 한 가지 한계는 장기간 동안 생착을 탐색하지 않는다는 것입니다.
NSC가 in vivo44,45에서 분화하는 데 몇 주가 걸리는 것으로 보인다는 점을 고려하여, 이 연구는 최대 90일 동안 장기(≥30일) 마우스 SC 절편을 생성하고 유지하는 방법에 초점을 맞춥니다. 절편은 원래의 해부학적 구조를 유지하고 시간이 지남에 따라 낮고 안정적인 세포사멸률과 높은 세포 생존율을 유지하는 것으로 밝혀졌습니다. 우리는 신경 표지자 RNA 결합 fox-1 homolog 3(RBFOX3) 및 신경 필라멘트 경쇄(NFL)의 확산 발현을 관찰했으며, 후자는 시간이 지남에 따라 절편 주위에 축삭 돌기가 증가하는 추세를 보여 건강한 상태를 입증했습니다. 또한, 신경 세포 분화의 첫 단계에서 SC 슬라이스 GFP 발현 인간 SC 유래 신경 상피 줄기 세포(h-SC-NES) 세포에 성공적으로 이식했습니다. NSC 이식편은 이식 후 30일 동안 유지되었으며 세포는 배양 기간 내내 GFP 발현을 보였습니다. 이식 후 일일(DPT)(30)에 세포의 자가사멸 속도는 또한 동일한 세포(40)에서 DPT 7에서 관찰된 세포사멸 속도 값과 일치하는 것으로 밝혀졌다. 세포는 조직 환경에 생착하는 것처럼 보였고 최대 몇 주까지 생존했습니다.
요약하면, 우리의 데이터는 원래의 세포 구조와 조직 환경을 손상시키지 않고 배양 SC 유기형 절편을 3개월 동안 유지할 수 있음을 보여줍니다. 가장 중요한 것은 in vivo 실험을 진행하기 전에 세포 요법을 테스트하는 데 활용할 수 있어 비용과 실험 시간을 줄일 수 있다는 것입니다. 여기에서는 마우스 SC 유기형 절편을 생성하는 모든 과정과 이를 장기간(≥30일) 동안 유지하는 방법을 자세히 설명합니다. 또한 절편에 NPC 이식을 수행하는 방법과 다운스트림 분석을 위해 이를 유지하는 방법에 대해 자세히 설명합니다.
프로토콜
동물 시술은 지침 2010/63/EU(프로젝트 라이선스 번호 39E1C)에 따라 이탈리아 공중 보건부와 피사 대학의 지역 윤리 위원회가 승인한 프로토콜을 엄격히 준수하여 수행되었습니다. N.5Q7은 2021년 10월 30일에 출시됨). C57BL/6J 마우스는 조절된 환경(23 ± 1°C, 50 ± 5% 습도)에서 음식과 물을 추가로 섭취하는 12시간 연암 주기로 보관했습니다.
h-SC-NES 세포와 관련된 모든 연구는 생물의학 연구 목적의 인체 조직 획득 및 배포에 대한 NIH 지침에 따라 수행되었으며 샘플을 얻은 각 기관의 인간 조사 위원회 및 기관 윤리 위원회의 승인을 받았습니다. 피사 대학교 생명윤리위원회(Review No. 29/2020)로부터 최종 승인을 받았습니다. 비식별화된 인간 표본은 Joint MRC/Wellcome Trust grant(099175/Z/12/Z), Human Developmental Biology Resource(www.hdbr.org)에 의해 제공되었습니다. 적절한 정보에 입각한 동의를 얻었고, 각 표본에 대해 사용 가능한 모든 비식별 정보를 기록했습니다. 조직은 NIH(http://bioethics.od.nih.gov/humantissue. html) 및 WMA 헬싱키 선언(http://www.wma.net/en/30publications/10policies/b3/index.html)에서 정한 인간 뇌 조직의 연구 사용에 대한 윤리 지침 및 규정에 따라 처리되었습니다.
1. 척수(SC) 분리 및 배양을 위한 용액 및 장비 준비
- 멤브레인 인서트용 코팅 솔루션
- 코팅 용액(표 1)을 제조합니다: 0.1mg mL-1 콜라겐, 0.01mg mL-1 폴리-L-라이신 및 0.01mg mL-1 라미닌이 포함된 수용액.
- 각 멤브레인 인서트를 35mm 접시 또는 6웰 플레이트에 놓습니다.
- 멤브레인 상단에 코팅 용액 1mL를 추가합니다 : 실온 (RT)에서 4 시간 동안 용액을 배양합니다. 그런 다음 제거하고 멤브레인 인서트를 밤새 건조시키십시오(ON). 멤브레인 인서트를 사용할 때까지 4°C에서 보관하십시오.
알림: 모든 통로는 멸균 상태에서 수행해야 합니다. 멤브레인 코팅은 단백질 분해 및 멤브레인에 대한 최적이 아닌 슬라이스 접착을 방지하기 위해 사용하기 전에 4°C에서 최대 1주일 동안 보존해야 합니다.
- 배지 준비: 유기형 배지, 해부 배지, 이식 배지
- 유기형 배지를 준비합니다(OM, 표 1).
- 표 1에 설명된 대로 절개 매체를 준비합니다.
- 그라프트 배지를 준비합니다(GM, Onorati et al.46, 표 1에서 최적화됨).
참고: 용액은 멸균 상태에서 사용 직전(실험 1일 전 또는 당일)에 준비해야 합니다.
- 수술을 위한 재료 준비
- 생물 안전 캐비닛에는 해부 실체 현미경과 수술 기구 (마이크로 가위 2 쌍, 직선 핀셋 2 쌍, 곡선 핀셋 2 쌍)를 사용할 수 있도록 준비하십시오.
- 생물 안전 캐비닛에서 SC를 조각으로 자르는 칼날을 장착하여 초퍼 기기를 준비합니다. 초퍼의 나사를 돌려 블레이드를 놓아야 할 금속 암을 들어 올립니다. 칼날을 지정된 위치에 놓고 칼날이 있는 금속 암을 절단 데크에 닿을 때까지 내린 다음 날이 단단히 고정될 때까지 육각 키로 고정 나사를 조여 고정합니다. 마이크로미터 나사를 원하는 슬라이스 두께(일반적으로 350μm)로 회전합니다. 날이 절단 데크에 정확히 수직으로 배치되었는지 확인하십시오.
알림: 절단을 올바르게 수행하려면 절단 데크를 기준으로 날을 정확하게 수직으로 배치해야 합니다. - 생물 안전성 캐비닛에서 준비하십시오 : 2 개의 플라스틱 파스퇴르 피펫 (분리 된 SC와 슬라이스를 이동하는 데 필요), 최소 4 개의 35 mm 접시 및 2 개의 60 mm 접시, 신선한 얼음 상자.
- 배양 멸균 상태를 유지하기 위해 사용 직전에 모든 기기를 70% 에탄올과 UV(20분 1주기)로 멸균합니다.
2. 마우스 SC의 분리와 slice generation
- 마우스 SC의 분리
- 프로젝트 라이센스에 따라 출생 후 3일차(P3) 새끼 쥐를 희생합니다.
- 마이크로 가위를 사용한 정중선 개복술을 통해 척추의 요추 부위를 마우스 몸의 나머지 부분과 분리하고 35mm 접시에 담긴 차가운 박리 매체에 넣습니다.
- 해부 실체현미경과 마이크로 가위를 사용하여 시상축을 따라 척추를 자르고 직선 핀셋을 사용하여 척추강에서 SC를 부드럽게 제거합니다.
- 직선 핀셋을 사용하여 SC의 고립된 요추 부위에서 수막을 조심스럽게 떼어냅니다.
- 다음 단계를 진행하기 전에 분리된 SC 요추 부위를 차갑고 신선한 절개 배지에 10-15분 동안 옮기고 배양합니다.
- 슬라이스 생성
- 하나의 플라스틱 파스퇴르 피펫을 사용하여 해부 매체에서 분리된 SC 요추 영역을 가져와 블레이드에 수직으로 초퍼 기기의 절단 데크에 놓습니다.
알림: 블레이드(수직)를 기준으로 SC를 올바르게 배치하는 것은 SC 슬라이스를 적절하게 생성하는 데 필수적입니다. - 파스퇴르 피펫과 멸균 흡수지를 사용하여 SC 주변의 데크에 있는 잔류 해부 매체를 제거합니다. SC 자동 단면화를 진행합니다.
- 슬라이스가 생성되면 파스퇴르 피펫이 있는 새로운 해부 매체를 슬라이스가 있는 절단 데크에 놓습니다. 그런 다음 신선한 해부 배지가 있는 35mm 접시에 조각을 모으고 15분 동안 배양합니다.
- slice incubation하는 동안 플라스틱 파스퇴르 피펫을 사용하여 멤브레인 인서트의 표면을 OM으로 3번 세척합니다. 그런 다음 각 멤브레인 인서트의 바닥에 1mL의 OM을 남겨 둡니다.
- dissection stereomicroscope 아래의 slices를 확인합니다. 플라스틱 파스퇴르 피펫으로 옮겨 조절된 멤브레인 인서트에 원하는 수의 슬라이스를 파종합니다.
- 직선 핀셋을 사용하여 원하는 방향과 원하는 위치로 슬라이스를 멤브레인 인서트에 이동합니다. 파스퇴르 피펫으로 과도한 매체를 제거하여 슬라이스가 멤브레인 표면에 더 잘 부착될 수 있도록 합니다.
알림: 직선 핀셋으로 슬라이스를 이동하고 방향을 잡는 것은 조직이나 멤브레인 삽입물의 손상을 방지하기 위해 부드럽게 수행해야 합니다. - 37°C에서 30분 배양한 후 인서트를 새 페트리 접시에 옮깁니다.
알림: 매체 교환 중에는 플라스틱 링을 만지지만 멤브레인은 만지지 마십시오. - 멤브레인 인서트 하단에 신경교세포주 유래 신경영양인자(GDNF) 100ug mL-1이 보충된 신선한 OM 1mL를 추가합니다.
- 37 °C에서 슬라이스를 배양합니다. 문화의 첫 번째 날을 DEV(Day ex Vivo ) 0이라고 합니다.
- 하나의 플라스틱 파스퇴르 피펫을 사용하여 해부 매체에서 분리된 SC 요추 영역을 가져와 블레이드에 수직으로 초퍼 기기의 절단 데크에 놓습니다.
3. 유기형 절편의 장기 배양
- 원하는 시점이 될 때까지 37°C에서 배양 중인 슬라이스를 유지합니다.
- 2.2.7-2.2.8 단계에 설명된 대로 DEV 1에서 매체를 새 OM으로 교체합니다.
- DEV 3에서 배지를 GM으로 전환하여 다음날 줄기 세포를 이식할 수 있는 적절한 환경을 만듭니다. 48시간마다 매체를 새 GM으로 교체합니다(예: DEV 5, DEV 7...).
- DEV 7까지 매일 새로운 GDNF(최종 농도 100μg mL-1)를 배지에 추가합니다. DEV 7 이후에는 매체가 변경될 때만 추가합니다(3.3단계).
4. h-SC-NES 세포 배양
참고: h-SC-NES 세포는 성장 인자(NES 배지, 단계 4.1.1)가 있는 상태에서 배양된 상태로 유지됩니다. 이식 전에 배지에서 성장 인자를 제거하여 7일 동안 전분화 상태로 세포를 도말합니다(전분화 배지: 섬유아세포 성장 인자 2(FGF-2) 및 표피 성장 인자(EGF)가 없는 NES 배지, 단계 4.1.2). 그런 다음 이식 전 2일 동안 분화 조건(분화 배지, 단계 4.1.3)에서 세포를 도금합니다. 분화는 분화 배지에 신경 영양 보충제(뇌 유래 신경 영양 인자, BDNF)를 추가하여 지원됩니다. h-SC-NES 세포(12,46)의 유지, 분할, 전-분화 및 분화는 이하에서 상세히 설명된다.
- 배지 준비: NES, 사전 분화 및 분화 배지
- h-SC-NES 세포 유지 매체를 준비합니다(NES 배지, 표 1).
- h-SC-NES 세포 전분화 배지를 준비합니다(사전 분화 배지, 표 1).
- h-SC-NES 세포 분화 배지를 준비합니다(분화 배지, 표 1). 배지가 변경되거나 분화 조건에서 셀이 처음으로 도금될 때 BDNF를 새로 첨가합니다.
알림: 모든 매체는 멸균 조건에서 준비해야 하며 0.22μm 필터로 여과해야 합니다.
- h-SC-NES 셀용 코팅 솔루션
참고: h-SC-NES 세포는 POLFN 코팅 배양 지지체(POLFN = Poly-L-Ornithine, Laminin, Fibronectin)에서 유지됩니다.- 튜브에 코팅 용액을 준비합니다 : 라미닌 (5 μg mL-1) 및 피브로넥틴 (1 μg mL-1)이 함유 된 Poly-L-Ornithine 용액.
- 준비된 코팅 용액을 세포 배양 지지체에 옮기고 세포 배양 지지체의 전체 표면을 덮을 수 있을 만큼 충분히 추가하도록 주의합니다. 37 ° C에서 1 시간 동안 또는 4 ° C에서 밤새 코팅을 배양합니다.
- 세포 배양 지지체에서 코팅 용액을 제거합니다.
참고: POLFN 용액은 두 번 더 재활용할 수 있지만 라미닌과 피브로넥틴은 매번 신선하게 추가해야 합니다. - 세포 배양 등급의 멸균수로 코팅을 3번 세척합니다. 코팅은 4 °C에서 보관하거나 사용하십시오.
알림: 코팅은 1주일 이내에 사용해야 합니다. 그 후, 코팅은 첨가된 단백질의 분해 과정으로 인해 만료된 것으로 간주됩니다.
- h-SC-NES 셀 유지보수
- NES 배지에서 배양 중인 h-SC-NES 세포를 유지합니다. 세포가 합류점에 도달하는 시점을 모니터링하기 위해 매일 현미경으로 세포를 확인하십시오.
- 2일마다 절반 매체 교체: 조절된 매체의 절반을 제거하고 새 매체를 추가합니다(20% 증발률 고려).
- 세포가 합류점에 도달하면 4.4단계에 설명된 대로 분할을 진행합니다.
- h-SC-NES 세포 통로
참고: 셀은 다음과 같이 분할됩니다12:- 컨디셔닝된 배지를 제거하고 Ca2+/Mg2+가 없는 Dulbecco의 인산염 완충 식염수(DPBS)로 세포를 한 번 세척합니다.
- DPBS를 제거하고 trypsin/EDTA 용액을 세포에 추가하여 효소 분리를 수행합니다. 37°C에서 30초에서 1분 동안 세포를 배양합니다.
- 배양 후 현미경으로 세포를 확인하십시오: 세포가 분리되지 않은 경우 세포 배양 지지대를 약간 두드려 기계적 분리를 수행하고 37°C에서 30초 동안 더 배양합니다.
- 배양 후 세포 및 트립신/EDTA로 세포 배양 지원에 DPBS/소 태아 혈청(FBS)(10% vol/vol) 용액 4권을 추가하여 트립신/EDTA를 비활성화합니다. 세포 배양 지지체에 용액을 부드럽게 피펫팅하여 모든 세포가 분리되도록 합니다. 튜브에 세포 현탁액을 수집합니다.
- 셀 현탁액을 200× g 에서 3분 동안 원심분리합니다. 상층액을 버리고 펠릿을 새 NES 매체에 재현탁시킵니다.
- 세포를 세고 ̴0.5-1 × 105 cells/cm2의 밀도로 각각의 새로운 POLFN 코팅 배양 지지체에 플레이트합니다.
- Y-27632(10μM)를 넣고 세포를 37°C에 둡니다. 합류할 때까지 매일 확인한 다음 유지 관리/확장 또는 세포 뱅킹을 위해 다시 분할합니다.
- h-SC-NES 세포 전분화
- 4.4단계에 설명된 대로 셀을 분할합니다.
- POLFN 코팅된 세포 배양 지지체에 세포를 전분화 배지에서 ̴0.5-1 × 105 cells/cm2의 밀도로 플레이트합니다. 분할 후 Y-27632(10μM)를 추가합니다. 시험 관 외(DIV) 0의 사전 분화일의 첫 번째 날을 호출합니다.
- 2-3일마다 매체의 절반을 교체합니다(4.3.2단계 참조).
- DIV 7까지 세포를 사전 분화 상태로 유지한 다음 4.6단계를 진행합니다.
- h-SC-NES 세포 분화
- 전분화의 DIV 7에서 4.4단계에서 설명한 대로 셀을 분할합니다.
- 분화 배지에서 ́1-1.5 × 105cells/cm2의 밀도로 POLFN 코팅된 세포 배양 지지체에 세포를 플레이트합니다. 분할 후 Y-27632(10μM)와 BDNF(30ng mL−1)를 추가합니다.
- 2일 분화(DIV 10) 후 이식을 위한 세포를 조각으로 분할합니다.
5. GFP 운반 렌티바이러스 벡터를 이용한 h-SC-NES 세포 transduction
참고: 세포 transduction은 h-SC-NES 세포의 유지 단계에서 수행됩니다. 세포가 정확하게 형질도입되면, 이들은 확장될 수 있고, 이전에 설명한 전분화 및 분화 프로토콜이 적용될 수 있다(단계 4.5 및 4.6).
- 세포 형질도입 배지의 준비
참고: 세포 형질도입 배지는 특정 부피의 NES 배지와 정확한 부피의 렌티바이러스 벡터 스톡(LVS) 제제를 서로 다른 파라미터에 따라 혼합하여 제조합니다: 원하는 MOI(감염 다중성 = 주어진 감염 배지에서 숙주 세포 수에 대한 바이러스 입자 수의 비율); 도금된 셀의 수; LVS 제제의 초기 농도 (=LVS PFU, 플라크 형성 단위); 사용된 배양 용기의 표면적.- 방정식 (1) 및 (2)를 사용하여 선택한 MOI에 따라 NES 배지에 추가할 LVS 준비의 올바른 부피를 계산합니다.
(n cells to plate/cm2) 세포 배양 지원의 × cm2 × MOI = 선택한 MOI에 대한 LVS PFU (1)
LVS PFU : Tot 초기 LVS Vol (μL) = MOI에 대한 LVS PFU : 매체에 추가할 LVS Vol (μL)(2)
참고: LVS PFU (LVS의 초기 PFU) 및 총 초기 LVS 볼륨은 제조업체에서 제공합니다. 선택된 MOI에 대한 LVS PFU는 수학식 1과 같이 계산된다. 따라서, 방정식 (2)에 설명된 바와 같이 선택한 MOI에 대해 NES 배지의 총 부피(세포 배양 지원 기반)에 추가해야 하는 LVS 제제의 부피를 얻을 수 있습니다.
예: 이전 실험실 경험을 기반으로 MOI 3을 사용했습니다(MOI는 사용된 세포주와 바이러스 제제에 따라 달라질 수 있음). 원하는 MOI가 3이고, 도금할 세포의 수가 0.5 × 105/cm2이고, 배양 지지체가 1 well-MW24(2cm2)인 경우, 초기 LVS PFU/TU(플라크 형성 단위/형질도입 단위)가 1mL에서 25 × 106 PFU(1,000 μL = 초기 LVS vol)라고 가정하면 계산은 다음과 같습니다.
1 웰 -MW24 (2cm2) = 0.5 × 105 셀 × 2cm2 = 1 × 105 셀
1 × 105 셀 × 3 (MOI) = 3 × 105 PFU = LVS PFU (MOI 3의 경우)
25 × 106 PFU:1,000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = 배지에 추가할 LVS 부피
따라서, 1 웰-MW24에서 MOI3를 갖는 세포 형질주입 배지 로 세포를 형질도입하려면, MW24 웰 1웰을 위해 제조된 NES 배지 (238 μL)에 초기 LVS 제제 12 μL를 첨가한다. 최종 총 부피는 250μL입니다.
참고: 배지는 일반적으로 멸균 상태에서 형질도입 당일에 신선하게 준비됩니다.
- 방정식 (1) 및 (2)를 사용하여 선택한 MOI에 따라 NES 배지에 추가할 LVS 준비의 올바른 부피를 계산합니다.
- h-SC-NES 변환 프로토콜
- NES 배지에서 0.5 × 105/cm2 의 밀도로 POLFN 코팅된 24-멀티 웰 플레이트(또는 기타 배양 지지체)의 낮은 통로에 h-SC-NES 세포를 플레이트합니다.
- 다음 날, 세포가 도판된 웰에서 조절된 NES 배지를 수집합니다. 선택한 배양 지지체에 따라 파종 표면을 균일하게 덮는 데 필요한 가장 낮은 부피의 신선한 세포 형질 주입 배지를 세포에 추가합니다(예: 24-멀티웰 플레이트의 250μL/웰).
- 그런 다음 37°C에서 6시간 동안 h-SC-NES 세포를 배양합니다. 그 후, 이전에 수집된 조절된 배지를 세포(24-멀티웰 플레이트의 200 μL/웰)에 추가하고 37°C에서 세포를 ON으로 배양합니다.
- 다음 날, DPBS로 h-SC-NES 세포를 한 번 세척하고 총 배지 변화(NES 배지)를 수행합니다.
- 다음 날에는 형광 현미경으로 세포를 확인하여 GFP 발현을 관찰합니다.
- 세포 은행 및 이식을 위해 h-SC-NES 세포를 확장합니다.
6. SC 절편으로의 세포 이식 및 공동 배양
- 유리 마이크로니들의 준비
- 풀러를 사용하여 붕규산 유리 모세관에서 가는 바늘을 얻습니다. 풀러를 HEAT 990, PULL 350으로 설정합니다.
알림: 하나의 모세관에서 두 개의 미세한 바늘을 얻을 수 있습니다.
- 풀러를 사용하여 붕규산 유리 모세관에서 가는 바늘을 얻습니다. 풀러를 HEAT 990, PULL 350으로 설정합니다.
- 이식을 위한 세포 준비
- 4.4단계에 설명된 대로 셀을 분할합니다.
참고: 세포가 형광 리포터를 발현하지 않는 경우 세포 추적 염료로 라벨링하여 이식 후 및 장기 배양 중에 형광 현미경을 사용하여 모니터링하십시오. 라벨링 단계에 대해 선택한 제조업체의 프로토콜을 따릅니다. - 분할 후 세포를 세고 200× g 에서 3분 동안 원심분리합니다. 얻어진 펠릿을 신선한 배지 + Y-27632 (10 μM)로 현탁시켜 원하는 세포 농도 (보통 30,000-50,000 세포 μL-1 범위)를 갖도록한다.
- 세포 현탁액을 500 μL 또는 1.5 mL 튜브에 옮기고 얼음 위에 놓습니다. 세포는 이식할 준비가 되었습니다.
- 4.4단계에 설명된 대로 셀을 분할합니다.
- 기관형 절편에 세포 이식
참고: 공기 미세주입기와 유리 미세바늘을 사용하여 마우스 SC 유기형 절편에 h-SC-NES 세포 이식을 수행합니다.- 마이크로피펫과 마이크로로더 팁을 사용하여 4 μL의 세포 현탁액이 있는 유리 마이크로니들을 로드합니다.
알림: 바늘에 기포가 형성되면 미세 주입 과정을 방해할 수 있으므로 피하십시오. 기포가 형성되면 마이크로피펫으로 기포를 제거하십시오. - 마이크로인젝터의 지정된 지지대에 바늘을 놓고 직선 핀셋을 사용하여 바늘 끝을 부러뜨립니다.
알림: 큰 구멍이 생기지 않도록 유리 바늘을 팁에 더 가깝게 부러뜨리십시오. - 슬라이스에 이식하기 전에 미세 주입 매개 변수를 설정하십시오. 압력을 10psi로 설정합니다.
참고: 압력 값은 마이크로인젝터와 작업자의 관찰에 따라 변경될 수 있습니다: 압력은 세포 현탁액을 미세주입하기에 충분해야 하여 조직 손상을 방지해야 합니다. - 보정된 유리 슬라이드에 파스퇴르 피펫으로 미네랄 오일 한 방울을 넣고 세포 현탁액을 방울에 미세 주입합니다. 오일 방울에서 얻어진 셀 현탁액 구의 직경은 특정 미세주입 부피와 상관관계가 있습니다. 4nL를 주입하기 위한 셀 현탁구 직경 0.2mm에 도달하기 위해 필요에 따라 미세주입 매개변수를 변경합니다.
- 올바른 부피를 설정한 후 세포 현탁액을 슬라이스에 빠르게 미세주입합니다. 형광 실체현미경 아래에서 절편에 세포가 있는지 확인하여 미세주입/이식이 성공적이었는지 확인합니다.
참고: 세포 현탁액은 때때로 바늘을 막을 수 있습니다: 이 경우 주입 매개변수를 수정하여 세포 현탁액의 막힘을 제거하거나 새 바늘에 새로운 세포 현탁액을 로드하십시오. - 이식 후 원하는 시점까지 37 ° C 및 5 % CO2에 슬라이스를 놓고 2.2.7-2.2.8 단계에 설명 된대로 격일로 매체 교체를 수행합니다.
- 마이크로피펫과 마이크로로더 팁을 사용하여 4 μL의 세포 현탁액이 있는 유리 마이크로니들을 로드합니다.
7. 면역형광 염색
- 1일차
- 인서트 멤브레인 바닥에서 매체를 제거하고 예열된 DPBS로 슬라이스를 3번 세척합니다.
- 미리 데워진 4% 포름알데히드(FA)로 슬라이스 고정: DPBS를 제거하고 슬라이스가 있는 멤브레인 인서트 바닥에 1.5mL의 4% FA를 추가합니다. RT에서 15분 배양 후 멤브레인 삽입체의 상부 표면에 4% FA 1mL를 더 추가하고 RT에서 15분 동안 배양합니다. 총 고정 시간: RT에서 30분
- 4% FA를 제거하고 DPBS로 3 x 10분 동안 슬라이스를 세척합니다.
- 수술용 칼로 삽입물의 멤브레인을 원주방향으로 자르고 삽입물의 플라스틱 구성 요소에서 조각이 있는 멤브레인을 분리한 다음 면역형광 단계를 진행합니다.
알림: 이 단계가 끝나면 조각이 있는 멤브레인이 접시의 DPBS에 떠 있습니다. - RT에서 10분 동안 DPBS에서 0.7% 트리톤이 포함된 용액의 1mL/멤브레인으로 투과시킵니다.
- 투과화 용액을 제거하고 0.5% Triton, DPBS의 10% FBS로 구성된 1mL/멤브레인의 차단 용액을 사용하여 4°C에서 4시간 동안 샘플을 배양합니다.
- 차단 용액을 제거하고 작동 희석시 1 차 항체를 슬라이스에 첨가하십시오 (예 : 마우스 항 신경 필라멘트 (NFL) 항체, 1 : 500; 토끼 안티 NFL, 1:500; 토끼 항-RBFOX3 (NeuN) 항체, 1:400; 토끼 항활성 카스파제-3(aCASP3), 1:400; 쥐 반 인간 핵, (Hu-Nu), 1:400; 토끼 안티 Hu-Nu, 1:400; 마우스 항-GFP, 1:400(보고된 표 1과 같이) 0.5% 트리톤, DPBS의 1% FBS로 구성된 항체 용액 1mL. 4 °C에서 ON으로 배양합니다.
- 2일차
- 1-2mL의 DPBS로 3 x 10분 동안 멤브레인을 세척합니다.
- 멤브레인을 2차 항체(예: Goat anti-Mouse IgG (H+L) 2차 항체, Alexa Fluor 488, 1:500; 염소 항-토끼 IgG (H+L) 2차 항체, Alexa Fluor 568, 1:500; 염소 항-마우스 IgG (H+L) 2차 항체, Alexa Fluor 647, 1:500; 염소 항-토끼 IgG(H+L) 2차 항체, Alexa Fluor 647, 1:500(표 1) 및 항체 용액 1mL/막에 희석된 핵용 Hoechst/DAPI(Triton 0.5% + FBS 1% in DPBS)를 RT에서 3시간 동안 투여.
참고: 배양 중 및 다음 단계에서 2차 항체 표백을 방지하기 위해 샘플을 빛으로부터 조심스럽게 보호하십시오. - 항체 용액을 제거하고 DPBS(1-2mL)로 3 x 10분 동안 세척합니다.
- DPBS를 새 DPBS로 교체하고 4°C에서 빛이 차단된 조건에서 보관하십시오.
- 면역형광 프로토콜이 끝나면 유리 슬라이드에 멤브레인을 장착합니다. 유리 슬라이드에 200μL의 장착 용액을 떨어뜨립니다. 직선 핀셋을 사용하여 35mm 접시의 플로팅 멤브레인을 커버 슬립으로 옮긴 다음 장착 용액을 사용하여 멤브레인을 유리 슬라이드로 옮깁니다.
- 새 커버슬립에 100μL의 장착 용액을 한 방울 떨어뜨리고 멤브레인을 덮어 유리 슬라이드에 고정합니다. 빛이 차단된 조건에서 화학 후드 아래에서 밤새 말리십시오.
- 샘플을 4°C의 어두운 곳에 보관하거나 이미징 분석을 수행합니다.
8. Live/Dead 분석
- 신선한 배지 접시당 700μL를 분취하여 작업 용액을 준비하고 Sytox(예: 성분 B, 1:2,000) 및 Calcein AM(예: 성분 A, 1:2,000)을 올바른 작업 희석액에 추가합니다.
알림: 시약은 빛에 민감하므로 작업 용액을 빛으로부터 보호하십시오. - 멤브레인 바닥의 중간 부피를 평가하고 8.1단계에서 설명한 것과 동일한 작업 희석액에서 Sytox와 Calcein AM을 추가합니다.
- 30 단계에서 준비한 작업 용액의 각 조각 위에 각각 30 μL 2 방울을 8.1 방울 떨어뜨립니다.
알림: 접시를 어두운 곳에 두어 빛으로부터 보호하십시오. - RT에서 30분 동안 슬라이스를 배양합니다.
- 배양 후, 수술 용 칼로 삽입물에서 멤브레인을 원주형으로 잘라냅니다 : 그 후, 슬라이스가있는 멤브레인이 작업 용액에 떠 있습니다.
- 장착 용액이 없는 멤브레인을 직선 핀셋을 사용하여 커버슬립에 거꾸로 놓고 멤브레인 위에 100μL의 DPBS를 추가하여 수분을 유지합니다.
- 컨포칼 현미경을 사용하여 가능한 한 빨리 실시간 이미지를 획득할 수 있습니다.
참고: 멤브레인이 건조되는 것을 방지하기 위해 이미지 획득 중 30분마다 멤브레인 상단에 DPBS 40μL 2방울을 추가합니다.
9. 이미징
- 고정 샘플의 컨포칼 이미징
- 정성 분석의 경우, 다음 획득 매개변수로 컨포칼 현미경을 사용하여 이미지를 획득합니다: 대형 이미지 옵션 설정(선택: 4 x 4), 10 x 대물렌즈 사용, 스택 없음, 3,634 x 3,634 픽셀의 해상도.
- 정량 분석(절편의 경우 aCASP3, Calcein, Sytox, 세포의 경우 aCASP3)의 경우 20 x 대물렌즈, 1,024 x 1,024 픽셀의 해상도, 3 μm의 Z-step과 같은 획득 매개변수로 컨포칼 현미경을 사용하여 이미지를 획득합니다.
- 실체현미경을 사용한 이식된 절편의 실시간 이미징
NOTE: brightfield 및 epifluorescence 모드에서 stereomicroscope를 사용하여 이미지를 캡처합니다.- 명시야 설정을 사용하여 슬라이스의 이미지를 획득합니다(여기서는 3배 줌이 사용된 1 x 대물렌즈).
알림: 사용하는 현미경에 따라 빛을 수정하고 필요한 경우 광섬유를 사용하십시오. - 형광 설정을 사용하여 슬라이스에 사용된 동일한 대물렌즈와 확대/축소로 이식된 세포의 이미지를 획득합니다(9.2.1단계 참조). 획득을 위해 다음 매개변수를 사용하십시오: 게인 1, 노출 200-500 ms, 오프셋 -10.
- 명시야 설정을 사용하여 슬라이스의 이미지를 획득합니다(여기서는 3배 줌이 사용된 1 x 대물렌즈).
- 컨포칼 현미경을 사용한 Live/Dead 분석 후 실시간 이미징
- 컨포칼 현미경을 사용하여 20x 대물렌즈, 해상도 1,024 x 1,024 픽셀, 3 μm의 Z-step으로 이미지를 획득합니다.
10. ImageJ에 의한 이미지 분석
- NFL, RBFOX3 및 DAPI 영역 분석
- ImageJ 소프트웨어(https://imagej.net/software/imagej/)를 엽니다.
- 파일 | 열기 | 파일 선택 | 열기를 클릭하여 파일 이미지를 엽니다.
- 팝업 창에서 Stack viewing | 하이퍼스택 및 컬러 모드 | 기본값(자동 크기 조정 포함)입니다.
- 도구 모음에서 Image | 색상 | 채널 분할.
- NFL(축삭 마커)의 경우 녹색 채널, RBFOX 3(신경 마커)의 경우 빨간색 채널, DAPI(핵 염색)의 경우 파란색 채널 등 분석할 채널을 선택합니다.
- NFL 분석의 경우 다음 단계를 진행하십시오. 도구 모음에서 Image | 조정 | 임계값 | 매개변수(어두운 배경, 알고리즘, 예: 기본값)를 선택하고 값 표시줄(아래/위)에서 커서를 이동하여 모든 신경돌기 영역을 덮고 둘러쌉니다(신경돌기는 어두운 배경에서 흰색으로 강조 표시됨) | 세트 | 대다.
- 도구 모음에서 추적 도구 Wand를 선택하고 이를 사용하여 NFL에서 다루는 흰색 영역을 자동으로 정의합니다. 보도 자료 분석 | 측정 | μm2의 면적 값.
- DAPI 및 RBFOX3 분석의 경우 도구 모음에서 이미지 | 조정 | 임계값 | 매개변수(흰색 배경, 알고리즘, 예: 기본값)를 선택하고 값 표시줄(아래/위)에서 커서를 이동하여 모든 RBFOX3 또는 DAPI 영역을 덮고 둘러쌉니다. 세트 | 대다.
- 도구 모음에서 Process | 증권 시세 표시기 | 대역 통과 필터. 임계값 막대 를 사용하여 형광 신호에 해당하는 RBFOX3 또는 DAPI가 커버하는 흰색 영역을 조정합니다.
- 도구 모음에서 추적 도구 Wand를 선택하고 이를 사용하여 RBFOX3 또는 DAPI가 적용되는 영역을 자동으로 정의합니다. 보도 자료 분석 | 측정 | μm2의 면적 값.
- ImageJ에 의한 세포사멸 분석
- ImageJ 소프트웨어(https://imagej.net/software/imagej/)를 엽니다.
- 파일 | 열기 | 파일 선택 | 열기를 클릭하여 Z-stack 파일 이미지를 엽니다.
- 팝업 창에서 Stack viewing | 하이퍼스택 및 컬러 모드 | 기본값(자동 크기 조정 포함)입니다.
- 도구 모음에서 Image | 색상 | 채널 분할.
- 원하는 채널을 선택합니다: aCASP3(분석할 세포자멸사 마커)의 경우 빨간색 채널, DAPI의 경우 파란색 또는 청록색, 핵의 경우 Hu-Nu. 그런 다음 도구 모음에서 Image | 색상 | 채널 병합 | 복합체를 만듭니다.
- 이미지 하단의 Z-바를 드래그하여 이미지의 Z-스택을 탐색하고 aCASP3 양성이 있는 슬라이스의 중앙 영역에 있는 스택을 식별합니다.
- 툴바에서 Plugins | 분석 | 세포 카운터.
- 열린 팝업 창에서 초기화를 선택하여 카운트를 위해 이미지를 준비합니다. 그런 다음 카운터 유형(예: 유형 1)을 선택하고 계산할 개체(예: aCASP3+ 셀)로 이름을 바꿉니다. 위에서 설명한 대로 다른 카운터 유형의 이름을 변경하여 다른 개체(예: 총 셀 수에 대한 DAPI+ 또는 Hu-Nu+ 셀)를 계산합니다.
- 팝업 창에서 계수할 개체에 해당하는 카운터 유형(예: aCASP3+ 셀)을 선택한 다음 도구 모음에서 포인트 도구를 선택하고 열린 이미지에서 각 양수를 클릭하여 aCASP3에 대해 양수인 자가사멸 세포의 수를 수동으로 계산하기 시작합니다.
- 셀 카운터 창에서 다른 카운터 유형을 선택하고 총 셀 수(슬라이스의 경우 DAPI+ 셀, 슬라이스의 경우)를 계산하기 시작합니다. Hu-Nu+ 세포, 이식된 세포의 경우).
- ImageJ에 의한 Live/Dead 분석 분석
- ImageJ 소프트웨어(https://imagej.net/software/imagej/)를 엽니다.
- 파일 | 열기 | 파일 선택 | 열기를 클릭하여 Z-stack 파일 이미지를 엽니다.
- 팝업 창에서 Stack viewing | 하이퍼스택 및 컬러 모드 | 기본값(자동 크기 조정 포함)입니다.
- 도구 모음에서 Image | 색상 | 채널 분할.
- Calcein(분석할 활력 마커)의 녹색 채널과 Sytox(데드 마커)의 청록색 채널 중에서 원하는 채널을 선택합니다. 그런 다음 도구 모음에서 Image | 색상 | 채널 병합 | 컴포지트 생성을 선택합니다.
- 이미지 아래쪽에 있는 Z-바를 드래그하여 이미지의 Z-스택을 탐색하고 슬라이스의 중앙 영역에 있는 스택을 Calcein 및 Sytox 양성으로 식별합니다.
- 툴바에서 Plugins | 분석 | 세포 카운터.
- 열린 팝업 창에서 초기화를 선택하여 카운트를 위해 이미지를 준비합니다. 그런 다음 카운터 유형(예: 유형 1)을 선택하고 계산할 개체(예: Calcein+ cells)로 이름을 바꿉니다. 다른 개체(예: Sytox+ 셀)를 계산해야 하는 경우 위에서 설명한 대로 다른 카운터 유형의 이름을 바꿉니다.
- 팝업 창에서 계산할 개체에 해당하는 카운터 유형을 선택합니다. 그런 다음 도구 모음에서 포인트 도구를 선택하고 열린 이미지에서 각 양수 셀을 클릭하여 Calcein+ 셀의 수를 수동으로 계산하기 시작합니다.
- 셀 카운터 창에서 다른 카운터 유형을 선택하고 Calcein에 대해 설명된 대로 Sytox+ 셀을 계산합니다.
11. 그래프 및 통계 분석
- 선택한 소프트웨어를 사용하여 모든 통계 분석을 수행하고 그래프를 플롯합니다.
결과
설명된 방법은 P3 단계의 마우스에서 SC 유기형 절편을 확립하고 건강한 조건에서 장기간 동안 배양에서 유지할 수 있도록 합니다. 또한, 세포를 절편에 이식하고 최대 30일 동안 공동 배양하기 위한 프로토콜을 보여줍니다(그림 1). 먼저, 배양 조건의 최적화와 이식된 세포로 SC 절편의 장기 배양에 적합한 프로토콜을 보여줍니다(그림 2A). 슬라이스는 OM에서 DEV 0부터 DEV 2까지 생성되고 유지되며, 이는 원래 SC 슬라이스(47)의 유지 관리를 위한 최적의 매체로 제안되었습니다. 그러나, 혈청 단백질의 존재로 인해, 이 배지는 이식된 신경 전구 세포의 신경 세포 분화 및 성숙을 유지하기에 차선책이 될 수 있습니다. 실제로, DEV 3에서 우리는 신경 생존을 지원하는 Neurobasal과 B27을 함유하고 올바른 신경 세포 분화를 억제하는 혈청을 사용하지 않고 대신 신경교 운명을 촉진하는 제형인 OM에서 GM으로의 전환을 테스트했습니다48,49.
그림 2B는 스위치를 수신하지 않은 SC 절편과 비교하여 DEV 3에서 배지를 OM에서 GM으로 전환하여 얻은 결과를 보여줍니다(대조군 절편은 OM에서 배양됨). 우리는 슬라이스 내부의 NFL 신호 분포를 뉴런 무결성의 마커로 사용했습니다(그림 2B, C). DEV 7의 슬라이스는 두 배양 조건 모두에서 건강했으며, 이는 내부의 신경 필라멘트(NFL, 녹색)의 확산 분포를 보여주었습니다. DEV 10에서 GM에서 배양된 절편은 NFL 염색 분포에 의해 문서화된 바와 같이 OM에서 배양된 대조군 절편에 비해 더 건강한 것으로 나타났습니다. 또한 그림 2B의 대표 이미지에 표시된 슬라이스의 NFL+ 면적(% NFL+ Area/DAPI+ Area)을 추정했습니다. 추정된 NFL+ 면적은 그림 2C의 히스토그램으로 표시되며, 이는 NFL 신호가 두 조건 모두에서 DEV 7의 슬라이스에 확산 분포되어 있음을 확인합니다. 그러나 DEV 10에서 NFL 염색이 적용되는 추정 면적은 OM 배양 조건에 대해 감소합니다.
이러한 데이터는 DEV 3에서 GM으로 전환하는 것이 SC 슬라이스의 장기간 배양에 잘 견디는 것임을 시사합니다(DEV 10). 다음 단계로, DEV 30, DEV 60, DEV 90 등 더 긴 시간 동안 GM을 테스트했습니다. 그림 3A,B에서 볼 수 있듯이, 절편은 DEV 90까지 배양에서 건강하게 유지되었습니다. NFL 염색은 각 시점의 절편에서 널리 발견되었으며, 중앙 영역에서 출발하는 신경돌기 절편 주위에 확산성이 싹을 틔우고 있었습니다. 실제로, 그림 3A에 표시된 슬라이스의 NFL+ 면적을 추정했으며 그림 3B의 히스토그램에서 볼 수 있듯이 시간이 지남에 따라 증가했습니다. 우리는 또한 신경 세포 마커 RBFOX3에 대한 양성을 관찰하여 절편의 신경 세포 분화에 대한 또 다른 증거를 제공했습니다. 각 시점에서 aCASP3에 양성인 세포의 수를 서로 다른 절편에서 평가하여 세포사멸 속도도 확인했습니다(그림 4A,B). 분석은 프로토콜 섹션 10.2에 설명된 대로 수행되었습니다. 세포사멸률(% aCASP3+ 세포/총 DAPI+ 세포 수)은 각 시점에서 매우 낮았으며(DEV 30, 60 및 90에 대해 각각 0.85 ± 0.52%, 0.71 ± 0.27%, 0.66 ± 0.45%), 고려된 세 가지 시점(p-값 > 0.05, 그림 4B) 간에 유의한 차이가 없었습니다. 이러한 데이터는 aCASP3와 관련된 세포사멸 속도가 시간이 지남에 따라 안정적으로 유지되며, 슬라이스에서 NFL의 광범위한 분포(그림 4A)와 함께 각 시점에서 슬라이스의 생존을 확인한다는 것을 시사합니다.
이전 데이터를 뒷받침하기 위해, 우리는 또한 세 가지 다른 시점에서 절편의 생존 가능성을 평가하기 위해 라이브/데드 분석을 수행했습니다. Calcein(녹색 염색)을 사용하여 생존 가능하고 대사적으로 활동적인 세포를 라벨링하고 Sytox(청록색 염색)를 사용하여 세포 사멸을 평가했습니다. 그림 4C의 히스토그램에서 볼 수 있듯이 대사 활성 세포의 비율은 DEV 30에서 DEV 90까지 약간 증가하고(DEV 30, 60 및 90± 각각 93.17 ± 5.21%, 96.43 ± 3.02%, 96.33 3.10%), 마지막 두 시점 사이에서 안정화됩니다(DEV 30 대 DEV 60 p-값 = 0.018; DEV 30 대 DEV 90 p-값 = 0.027; DEV 60 대 DEV 90 p-값 = 0.99). 시간이 지남에 따라 감소하는 낮은 수준의 세포 사멸을 발견했으며(DEV 30, 60 및 90의 경우 각각 6.83 ± 5.21%, 3.57 ± 3.02%, 3.66 ± 3.10%), DEV 30과 그 이후의 시점인 DEV 60 및 DEV 90 간에 유의한 차이가 발견되었습니다(DEV 30 대 DEV 60 p-값 = 0.018; DEV 30 대 DEV 90 p-값 = 0.027; DEV 60 대 DEV 90 p-값 = 0.99). 이러한 데이터는 세포사멸 비율과 관련하여 시간 경과에 따른 절편 생존을 확인하고 수행된 장기 배양 프로토콜의 효과를 뒷받침합니다.
SC 절편의 장기 배양이 가능하다는 것이 확인되자, 우리는 신경 세포 분화의 첫 단계에서 h-SC-NES 세포를 이식하여 시스템에 도전했습니다. h-SC-NES 세포는 SCI 치료에 대한 유망한 결과를 보였기 때문에테스트했습니다 12. h-SC-NES 세포를 마우스 SC 절편에 이식하는 절차는 프로토콜 섹션 6에 설명되어 있습니다. SC 절편 및 이식된 h-SC-NES 세포는 DPT 30까지 유지하였다. 세포는 그림 5A의 프로토콜 체계와 같이 분화(신경 전구체 단계)의 DIV 10에서 DEV 4 기관형 절편에 이식되었습니다. 이식된 세포는 최대 30일 동안 배양에서 GFP의 발현을 모니터링했습니다. 그림 5B 는 GFP+ 세포가 이식된 SC 절편에서 서로 다른 DPT에서 대표적인 라이브 이미지를 보여줍니다. 시간이 지남에 따라 GFP의 안정적인 발현(그림 5B 및 그림 6A)은 세포가 이전에 최적화된 배양 조건에서 SC 조직으로 살아남았다는 것을 시사합니다. 또한 프로토콜 섹션 10.2에 설명된 대로 이식된 세포의 자가사멸 속도를 확인했습니다. 세포사멸률(% aCASP3+ 세포/총 Hu-Nu+ 세포 수)은 30 DPT 후 매우 낮은 것으로 나타났습니다(0.44 ± 0.34%). 더욱이, DPT 30에서의 자가사멸 속도는 이전에 보고된40과 같이 DPT 7에서 동일한 유형의 세포에서 발견되는 것과 일치하는 것으로 나타났으며, 이는 배양이 시간이 지남에 따라 안정화됨을 문서화합니다.
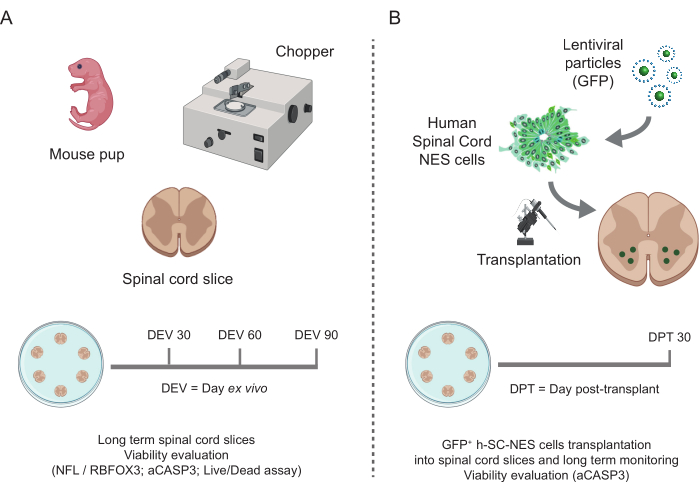
그림 1: 프로토콜의 워크플로우. 수행된 프로토콜의 일반적인 워크플로우를 보여주는 대표 체계입니다. (A) 왼쪽은 P3에서 분리된 새끼 쥐의 SC에서 마우스 SC 슬라이스 생성과 SC 유기체형 슬라이스의 장기 배양을 요약한 계획입니다. (B) 오른쪽은 GFP를 발현하는 h-SC-NES 세포를 마우스 SC-유기형 절편에 이식하는 과정을 요약한 계획. 이식된 세포는 이식 후 30일 동안 유지됩니다. 약어: h-SC-NES = 인간 척수 유래 신경 상피 줄기; GFP = 녹색 형광 단백질; DEV = 생체 외 일; DPT = 이식 후 일; NFL = 신경 필라멘트 경쇄; RBFOX3 = RNA 결합 fox-1 상동 3; aCASP3 = 활성 카스파제-3; SC= 척수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
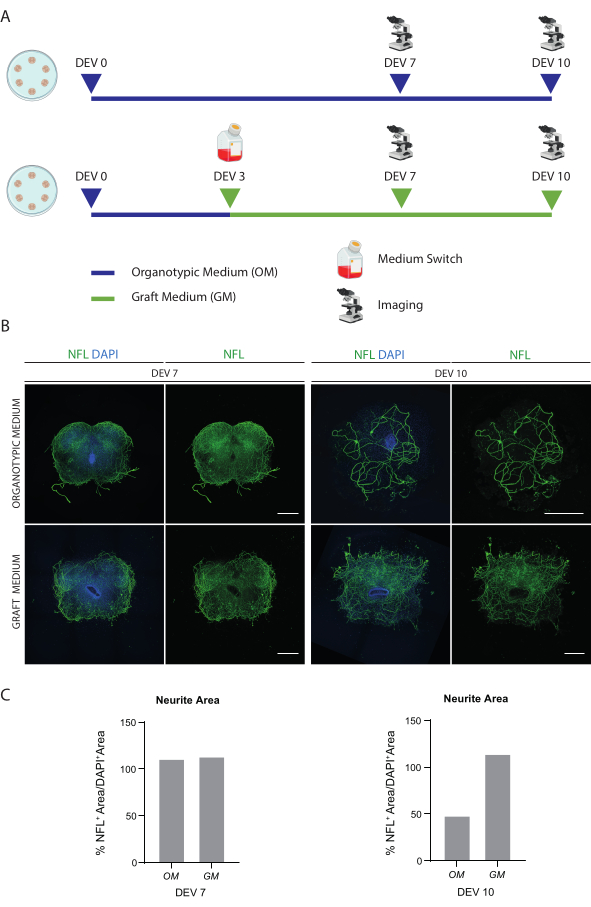
그림 2: 장기 배양 조건의 최적화. (A) OM 및 GM을 테스트하기 위한 프로토콜의 대표 체계. OM은 대조군에 대해 DEV 7-10까지 유지됩니다. 매체는 처리된 슬라이스에 대해 DEV 3에서 GM으로 전환됩니다. 그런 다음 컨트롤과 비교하기 위해 DEV 7-10에서 고정됩니다. (B) DEV 7 및 10에서 서로 다른 조건에서 배양된 마우스 SC 유기형 절편을 비교한 대표 이미지. 세포골격 마커 신경 필라멘트(NFL, 녹색)에 대해 절편이 염색됩니다. GM으로 배양된 절편에서 NFL 염색이 광범위하게 분포되어 있다는 것은 전반적인 생존과 차별화를 시사합니다. 핵은 DAPI로 대조염색됩니다. 스케일 바 = 500 μm. (C) 그림 1B에 표시된 슬라이스에서 NFL이 커버하는 면적 추정치의 대표 히스토그램. DEV 10에서 NFL 표면적은 OM 배양 조건에서 감소합니다. 약어: DEV = day ex vivo; DAPI = 4', 6- 디아 미디노 -2- 페닐 린돌; NFL = 신경 필라멘트 경쇄.; OM = 유기형 배지; GM = 접목 매체; SC = 척수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
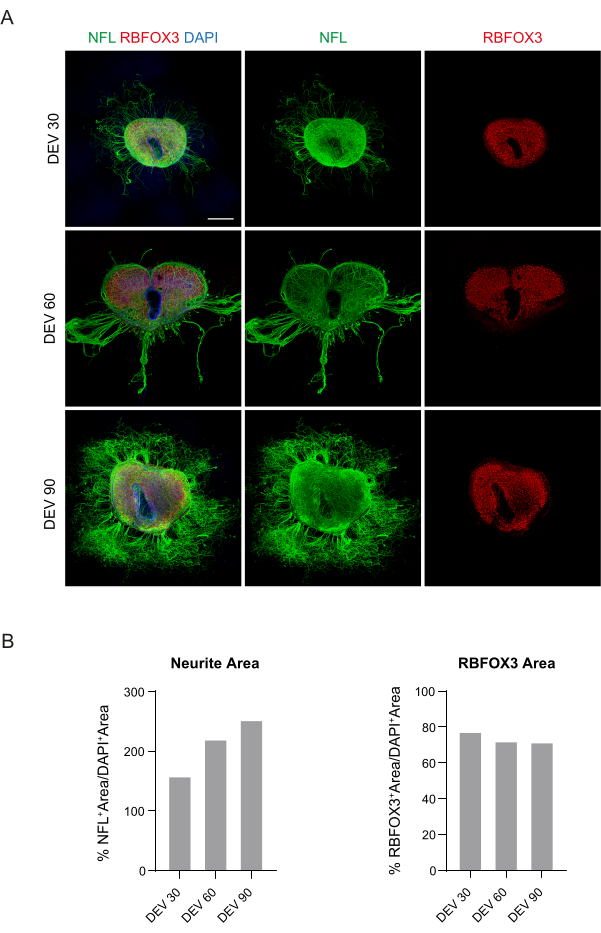
그림 3: 장기 배양된 마우스 SC 유기형 절편 . (A) 절편은 DEV 90까지 배양액으로 유지됩니다. 면역형광 분석은 세포골격 마커 신경 필라멘트(NFL, 녹색)와 핵 신경 마커 RBFOX3(빨간색)의 광범위한 분포를 보여주며, 이는 장기 배양 후 건강한 상태와 신경 세포 정체성을 입증합니다. 주목할 점은 NFL+ 축삭돌기가 시간이 지남에 따라 슬라이스 주변에서 확산적으로 싹을 틔운다는 것입니다. 핵은 DAPI로 대조염색됩니다. 스케일 바 = 500 μm. (B) 패널 A에 표시된 슬라이스의 NFL+ 면적 및 시간 및 RBFOX3+ 면적 추정치의 대표 히스토그램 . NFL+ 신경돌기 면적은 시간이 지남에 따라 증가합니다. 약어: DEV = day ex vivo; DAPI = 4', 6- 디아 미디노 -2- 페닐 린돌; NFL = 신경 필라멘트 경쇄; SC = 척수; RBFOX3= RNA 결합 fox-1 상동체 3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
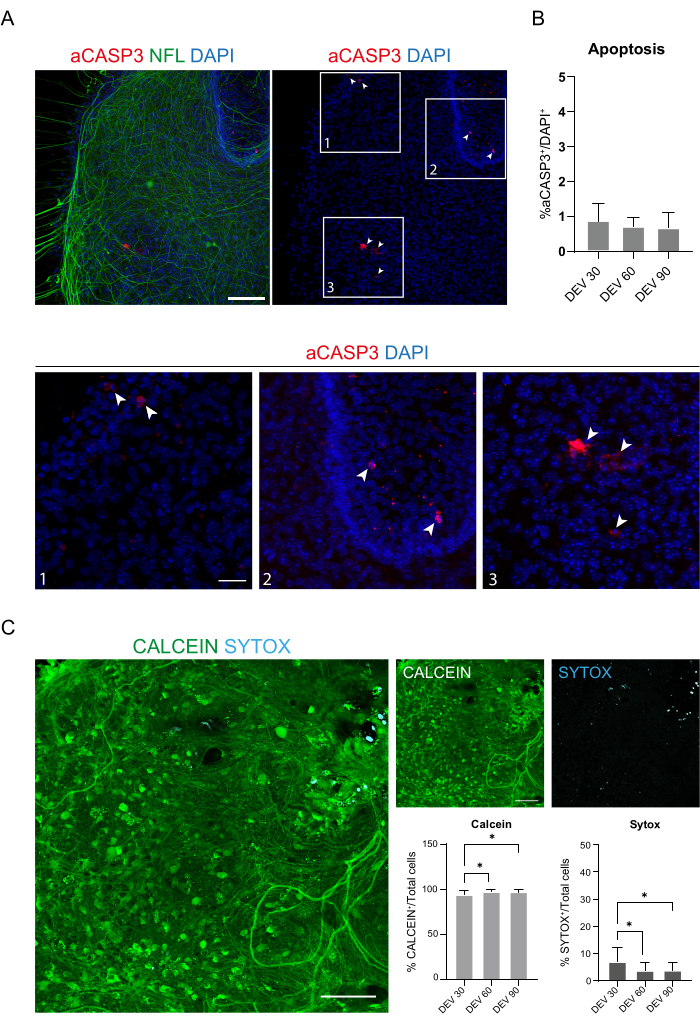
그림 4: 시간 경과에 따른 SC 절편의 세포 생존율 평가. (A) aCASP3(빨간색) 및 NFL(녹색)에 대해 염색된 DEV 60의 유기형 절편의 대표 이미지. 스케일 바 = 100 μm. NFL은 확산 패턴을 보여줍니다. 희귀 세포는 apoptotic marker aCASP3에 대해 양성입니다(삽입: 1-2-3). (B) 서로 다른 시점에서 조각으로 세포 사멸 속도 분석. 평균 ± SD, N(반복실험) = 6개 슬라이스, 각 슬라이스에 대해 n(총 셀 수) > 1,000, Kruskal-Wallis 검정, 다중 비교, p-값 > 0.05. 세포사멸 속도는 시간이 지남에 따라 안정적입니다. 패널 A의 삽입물 1-2-3에서 aCASP3에 양성인 세포의 세부 정보(빨간색 염색, 흰색 화살표)를 관찰할 수 있습니다. 작은 빨간 점은 세포 파편과 pyknotic nuclei를 표시합니다. 스케일 바 = 50 μm. (C) DEV 90에서 SC 절편에서 수행된 라이브/데드 분석의 대표 이미지: 대사 활성 세포는 Calcein으로 녹색으로 라벨링되고, 죽은 세포와 손상된 세포는 Sytox로 연한 파란색(청록색)으로 라벨링됩니다. 두 히스토그램은 총 세포 수에서 Calcein(왼쪽) 및 Sytox(오른쪽)에 대해 양성인 세포의 %를 보여줍니다. 평균 ± SD, N(반복실험) = 6개 슬라이스, n(총 셀) > 각 슬라이스에 대해 1,000, Kruskal-Wallis 검정, 다중 비교, DEV 30 대 DEV 60 p-값 = 0.018; DEV 30 대 DEV 90 p-값 = 0.027; DEV 60 대 DEV 90 p-값 > 0.99. 약어: DEV = day ex vivo; DAPI = 4', 6- 디아 미디노 -2- 페닐 린돌; NFL = 신경 필라멘트 경쇄; SC = 척수; aCASP3 = 활성 카스파제-3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
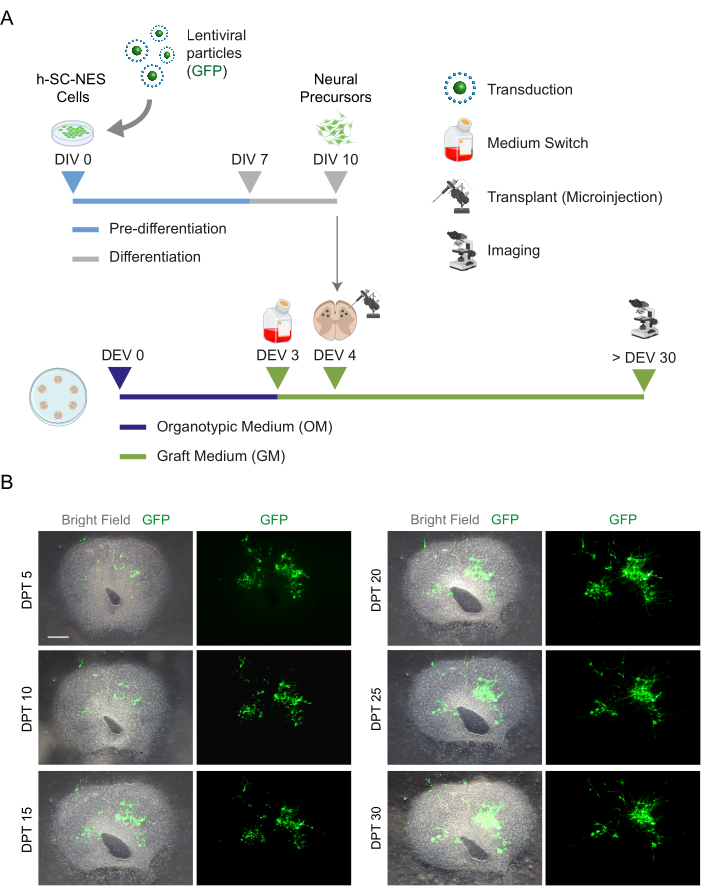
그림 5: h-SC-NES 세포를 마우스 유기형 절편에 이식. (A) 이식 프로토콜의 대표 계획. 세포는 분화의 DIV 10에서 신경 전구체로서 DEV 4 유기형 절편으로 이식됩니다. (B) DPT 30까지 시간이 지남에 따라 GFP 발현 h-SC-NES 세포로 이식된 마우스 유기형 절편의 대표 이미지. 세포는 GFP 유전자를 운반하는 렌티바이러스 벡터로 transduction됩니다. 시간 경과에 따른 GFP 발현은 슬라이스 환경에 대한 생존 가능성과 적응을 확인합니다. 스케일 바 = 500 μm. 약어: DIV = 사전 분화의 첫날; h-SC-NES = 인간 척수 유래 신경 상피 줄기; GFP = 녹색 형광 단백질; DEV = 생체 외 일; OM = 유기형 배지; GM = 접목 매체; DPT = 이식 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
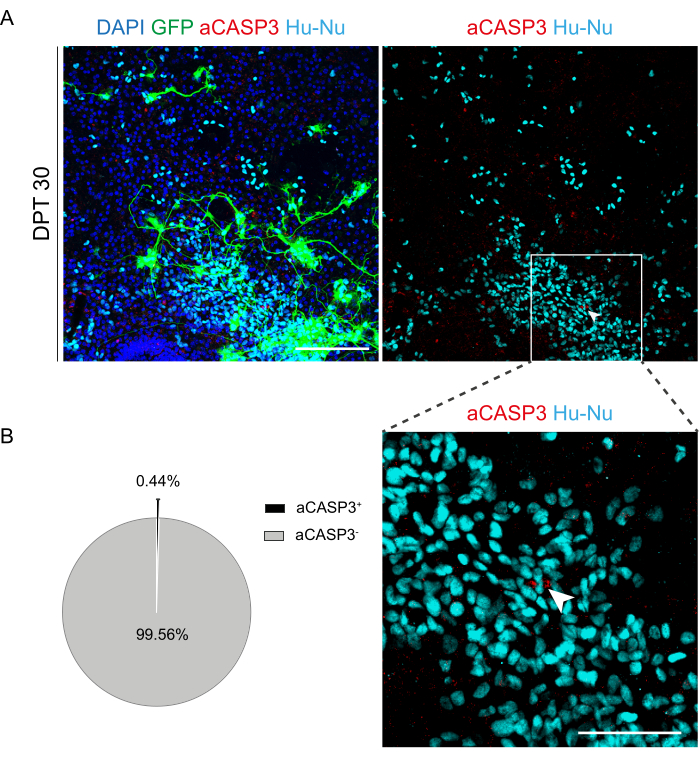
그림 6: 이식 후 30일 후 이식된 h-SC-NES 세포의 세포사멸 속도 평가. (A) GFP 발현 h-SC-NES 세포가 이식된 마우스 기관형 절편의 대표 이미지. 세포는 이식 후 절편으로 세포를 모니터링하기 위해 GFP 유전자를 운반하는 렌티바이러스 벡터로 transduction됩니다. 시간 경과에 따른 GFP 발현은 슬라이스 환경에 대한 생존 가능성과 적응을 확인합니다. 표시된 시점은 DPT 30입니다. 세포는 인간 핵(청록색) 및 aCASP3(빨간색)에 대해 염색됩니다. 스케일 바 = 150 μm. (B) 왼쪽은 DPT 30 (N(반복) = 5 슬라이스, n(셀) = 5,000)에서 슬라이스로 이식된 세포의 세포 사멸 분석의 대표적인 파이 차트, 오른쪽은 Hu-Nu+ 셀의 삽입과 aCASP3에 양성인 셀의 세부 정보(흰색 화살표). 눈금 막대 = 75 μm. 작은 빨간 점은 세포 파편과 pyknotic nuclei를 표시합니다. 약어: h-SC-NES = 인간 척수 유래 신경 상피 줄기; GFP = 녹색 형광 단백질; DPT = 이식 후 일; DAPI = 4', 6- 디아 미디노 -2- 페닐 린돌; NFL = 신경 필라멘트 경쇄; aCASP3 = 활성 카스파제-3; Hu-Nu = 인간의 핵. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 이 프로토콜에 사용된 솔루션의 구성. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
SCI 환자를 위한 효과적인 치료법은 아직 없습니다. 다양한 접근법이 테스트되었으며 가장 유망한 접근법 중 하나는 재생 전략 세포 교체를 기반으로 합니다. 현재 재생 의학 분야의 발전은 세포 이식의 효능과 안전성을 단독으로 또는 다른 접근법과 결합하여 테스트할 수 있는 새로운 플랫폼을 요구하고 있습니다. 이들의 전임상 검증은 추가 임상 연구를 진행하는 데 필수적입니다. SC 기관형 배양은 신경 퇴행, 신경 재생 및 신경 발달의 다양한 측면을 연구하고 새로운 치료 접근법의 효과를 조사하는 데 유용한 플랫폼입니다23. 특히, 원래의 조직구조(histoarchitecture)와 세포 및 미세환경 조성(cell and microenvironment composition)의 유지와 같은 유기형 배양(organotypic culture)의 특정 특징은 세포 생착(cell engraftment), 통합(integration), 분화(differentiation) 및 성숙(maturation)과 같은 이식 역학을 밝히는 데 유리합니다.
발표된 프로토콜과 일관되게 SC 기관형 절편은 건강한 조건에서 약 2-3주 동안 배양액을 유지할 수 있으며, 이는 세포 치료의 테스트 계획에 필요한 장기 조사 및 기능 스크리닝에 대한 사용을 제한합니다. SC 조직 내에서 이식된 세포의 올바른 운명을 향한 분화 및 성숙과 같은 중요한 과정을 탐색하려면 장기적인 모니터링이 필요합니다. 이러한 세포 과정은 동물 모델의 일반적인 이식 과정에서 매우 중요합니다. 생체 내에 존재하는 많은 특징을 모방하는 생체 외 시스템의 가용성은 전임상 스크리닝 단계에서 도움이 될 것입니다.
이러한 이유로 이 연구에서는 최대 90일 동안 생존 가능한 SC 절편을 유지하여 일반적인 배양 기간을 3배로 늘릴 수 있는 최적의 장기(≥30일) SC 유기형 배양 방법을 제안합니다. 또한, SC 절편 내에서 안정적인 h-SC-NES 세포 생착과 최대 30일 동안 이식 배양이 유지되는 것을 보여줍니다. DPT 30까지 세포 생존을 확인하기 위해 GFP 발현을 관찰하여 시간 경과에 따른 세포 생착을 모니터링했습니다. 30 DPT 후, 세포 사멸 속도를 평가했습니다. 문헌에서, 7 DPT에서 SC-절편에서 이식된 h-SC-NES 세포의 세포사멸 평가가 보고되었다40. 여기에서는 DPT 30에서 세포 사멸 분석을 확장하여 이전 시점(DPT 7)에 대한 자가사멸 속도를 비교했습니다. 우리는 우리의 데이터가 문헌과 일치한다는 것을 알게 되었으며, 이는 이식된 h-SC-NES 세포가 우리 연구에서 최적화된 배양 조건에서 유지될 경우 나중에 시점에서도 생존할 수 있음을 시사합니다. 이 개선된 장기 생체 외 플랫폼 단독으로 그리고 이식 구성에서 SCI를 위한 줄기세포 기반 이식에 대한 전임상 스크리닝에서 연구자들에게 도움이 될 것입니다. 이를 통해 이식의 성공을 촉진하는 추가 생체 내 연구를 위한 최상의 세포 후보를 식별할 수 있습니다. 또한, 초기 스크리닝 후 SC 기관형 절편을 생체 내 연구와 병행하여 동물 모델에서 관찰된 장기적인 세포 역학 및 거동을 확인 및 확증하거나 기계론적 연구를 지원하기 위해 사용할 수도 있습니다.
당사의 프로토콜은 이러한 장기 유기형 모델을 생성하는 방법을 자세히 설명하지만 몇 가지 중요한 단계도 논의해야 합니다. SC organotypic 배양의 생성과 관련하여, 수술 및 배양의 첫 단계에서 몇 가지 어려움이 있습니다. 잘 수행된 수술 절차는 원래의 조직 구조를 유지하는 절편을 생성하는 데 필수적입니다. 격리 중에 SC가 손상되면 절편은 전형적인 해부학적 구조를 잃을 수 있으며 조직 손상은 과도한 염증 유발을 유발하여 건강에 해로운 상태와 세포 사멸을 초래할 수 있습니다. 수술 중 가장 어려운 단계는 척추에서 SC를 추출하고 분리된 SC에서 수막을 제거하는 것입니다. 이러한 단계의 성공 여부는 운영자의 경험에 달려 있습니다. 따라서 실험을 시작하기 전에 훈련 기간을 두는 것이 좋습니다.
헬리콥터를 통한 SC의 관상 절개도 어려운 단계입니다. 격리된 SC는 블레이드에 정확히 수직인 절단 데크에 배치해야 합니다. 작업자는 또한 블레이드를 절단 데크에 수직으로 배치해야 합니다. 이러한 예방 조치는 동일하고 다른 실험 간에 재현 가능한 슬라이스를 생성하는 데 필요합니다. 또 다른 중요한 문제는 수술 시간이 제한되어 있다는 것입니다: 전체 절편 생성 절차는 ~30분이 소요되어야 합니다. 작업자가 수술과 절단에 더 많은 시간을 할애하면 SC 조직에 문제가 발생하여 배양의 성공과 실험의 다음 단계를 손상시킬 수 있습니다.
절편을 배양막에 올려놓으면 올바르게 공급하는 것이 중요합니다. GDNF는 조직 회복과 생존을 유지하는 데 필요합니다. 헬리콥터로 절단하는 것은 조직에 충격을 주며, 이러한 이유로 절단 직후 얼음처럼 차가운 해부 매체에 조각을 넣어 염증 유발 및 사망 촉진 분자의 과잉을 제거합니다. 그런 다음 GDNF로 개질된 신선한 배지로 절편을 배양막(세포 배양 삽입물)에 올려 멤브레인에 대한 더 빠른 회수와 절편 접착을 촉진합니다. GDNF는 그것의 짧은 반감기 때문에 문화에 있는 첫번째 주 동안 매체에 매일 추가되어야 한다50,51. 우리는 절편이 조직 회복과 생존력을 촉진하기 위해 배양 첫 날 동안 GDNF의 지속적인 존재가 필요하다는 것을 관찰했습니다. 어쨌든 GDNF의 존재는 전체 배양 기간 동안 중요하므로 추가 시점에서 GDNF 투여를 중단하는 것은 강력히 권장되지 않습니다.
배양 첫 주에는 육안과 현미경으로 절편을 거시적으로 확인하는 것도 중요합니다. 반투명 조직과 테두리의 투명성은 절편이 멤브레인과 생존 가능한 조직에 적절하게 접착되었다는 신호입니다. 괴사 조직은 처음 거시적으로 볼 때 매우 하얗게 보이고 괴사 부위는 현미경에서 짙은 회색으로 보입니다. 배양에서 몇 주 후에 조직의 형태가 바뀔 수 있습니다: 세포의 움직임과 막에 대한 조직 접착이 이 과정에 영향을 미칠 수 있습니다. 예를 들어, 우리는 세포로 채워진 일부 조각에서 중앙 내강이 손실되고 등쪽 및 배쪽 뿔 형태가 손실되는 것을 관찰했습니다. 이것은 주로 더 작은 조각에서 발생하지만 대부분은 원래 조각에 가까운 해부학적 구조를 유지합니다. 슬라이스는 일반적으로 요추 또는 흉부 영역에서 생성되는데, 이러한 방식으로 시간이 지남에 따라 원래의 조직 구조를 유지할 수 있는 적절한 크기를 가질 수 있기 때문입니다: 너무 작으면 구조를 잃고 너무 크면 중앙 영역이 괴사를 겪을 수 있습니다. 따라서 우리는 최적의 장기 배양을 위해 적절한 크기의 절편을 생성하기 위해 새끼 쥐의 요추 영역을 사용했지만 원칙적으로 다른 세그먼트를 고려할 수 있습니다. 또한, 우리는 요추 부위를 사용하기로 결정했는데, 이는 복부 영역과 등쪽 부위가 서로 더 잘 구별되기 때문입니다. 또한, 이 영역은 SCI에서 세포 교체 요법의 관심 부위인 운동 뉴런과 회백질의 비율이 더 높은 조직 영역을 나타냅니다. 세포를 절편에 이식하는 것과 관련하여 주요 문제는 유리 마이크로니들 팁의 파손과 관련이 있습니다. 세포가 통과하기 위한 구멍이 너무 크면 미세주입 중에 SC 조직에 손상을 줄 수 있습니다. 너무 작으면 세포 적층이 바늘을 막아 이식 과정을 방해할 수 있습니다. 이식 절차는 세포의 고통과 사멸을 최소화하기 위해 1시간 이내에 완료되어야 합니다.
제안된 프로토콜은 다양한 유형의 조사를 위한 최적의 다재다능한 도구를 제공합니다. 여기에서는 장기 플랫폼을 적용하여 30일 동안 마우스 SC 조직 내에서 분화의 첫 단계에서 h-SC-NES 세포의 이식을 검증합니다. 제안된 접근 방식의 주요 참신함은 공동 문화 프로토콜의 최적화입니다. GM의 구성 요소는 SC 절편과 이식된 h-SC-NES 세포의 장기 신경 세포 생존을 유지합니다. 실제로, GM은 무혈청 배지로서, 이전에 유기형 절편 배양에 사용된 배지와 관련하여 신경 세포의 운명을 향하여 이식된 세포의 분화를 유지한다47.
SCI에 대해 제안된 모델과 관련하여, 실험은 일반적으로 성체 마우스를 대상으로 수행됩니다. 지금까지, 신생아와 성체 SC 사이의 가장 중요한 차이점은 성체 마우스에 비해 신생아에서 발견되는 더 높은 재생 잠재력과 관련이 있다(52). 그러나 이러한 차이는 우리가 제안하는 프로토콜의 유형에 영향을 미치지 않는데, 여기서는 상주 뉴런의 재생 능력보다는 호스팅 조직 환경에 대한 이식된 세포의 반응에 초점을 맞추기 때문입니다. SCI 후 신생아 마우스와 성인 마우스의 또 다른 차이점은 성인에서 발생하는 신경교 반흔의 형성과 관련이 있습니다. 이 측면은 1 차 및 2 차 부상으로 인한 복잡한 생리 병리학 적 과정을 고려하지 않는 제안 된 모델에서 고려되지 않습니다.
응용 분야와 관련하여, 이 플랫폼은 SC 유기형 모델에 존재하는 상주 회로와 이식된 세포 간의 통합을 조사하는 데에도 사용할 수 있습니다. 유전 공학 도구는 이미 시냅스 연결성을 평가하기 위해 CNS에서 사용되었으며 이와 관련하여 활용 될 수 있습니다 53,54,55. 특히, 생착된 세포와 SC 체외 조직 사이의 시냅스 형성을 평가하여 통합을 조사하고 검증할 수 있습니다. 이러한 장기 유기형 배양은 신경 보호 및 신경 재생제 또는 새로운 분자/물질을 테스트하거나 SC와 관련된 신경 퇴행성 질환을 연구하는 데에도 활용될 수 있습니다. 특정 신경퇴행성 질환을 연구하기 위해서는 병리학 관련 단계(즉, 신생아, 청소년, 성인)에서 특정 병리학 관련 돌연변이를 보유한 형질전환 마우스와 같은 관련 모델에서 생성된 SC 절편을 배양하기 위해 프로토콜을 조정해야 합니다. 결론적으로, 당사의 프로토콜 및 기관형 배양은 일반적으로 특정 장기의 이식물로서 2D 세포 배양과 in vivo 모델 간의 격차를 해소하는 기능을 제시하여 기초 연구와 전임상 테스트 모두에 귀중한 도구임을 확인합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 Wings for Life Foundation(WFL-IT-20/21), European Union Next-Generation EU-National Recovery and Resilience Plan(NRRP)-mission 4 component 2, investment n. 1.4-CUP N. B83C22003930001(Tuscany Health Ecosystem-THE, Spoke 8) 및 Marina Romoli Onlus의 지원을 받았습니다. 이 원고는 저자의 견해와 의견만을 반영하며, 유럽연합이나 유럽연합 집행위원회는 이에 대한 책임을 지지 않습니다. 데이터 및 메타데이터는 Zenodo 10.5281/zenodo에서 사용할 수 있습니다.10433147. 이미지는 Biorender https://www.biorender.com/ 로 생성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
참고문헌
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유