Method Article
Cultivo a largo plazo de cortes organotípicos de médula espinal de ratón como plataforma para validar el trasplante de células en lesiones de la médula espinal
En este artículo
Resumen
En este artículo, proporcionamos un método reproducible para generar y mantener cortes organotípicos de la médula espinal a largo plazo trasplantados con células madre neurales como modelo ex vivo para probar terapias de reemplazo celular.
Resumen
Todavía faltan curas resolutivas para las lesiones de la médula espinal (LME), debido a la compleja fisiopatología. Uno de los enfoques regenerativos más prometedores se basa en el trasplante de células madre para reemplazar el tejido perdido y promover la recuperación funcional. Este enfoque debería explorarse más a fondo in vitro y ex vivo para determinar su seguridad y eficacia antes de proceder a los ensayos con animales, que son más caros y requieren mucho tiempo. En este trabajo, mostramos el establecimiento de una plataforma a largo plazo basada en cortes organotípicos de médula espinal (SC) de ratón trasplantados con células madre neurales humanas para probar terapias de reemplazo celular para las LME.
Los cultivos organotípicos SC estándar se mantienen durante unas 2 o 3 semanas in vitro. Aquí, describimos un protocolo optimizado para el mantenimiento a largo plazo (≥30 días) durante un máximo de 90 días. El medio utilizado para el cultivo a largo plazo de cortes de SC también se optimizó para el trasplante de células madre neurales al modelo organotípico. Las células madre neuroepiteliales humanas derivadas de SC (h-SC-NES) que portaban un indicador de proteína fluorescente verde (GFP) se trasplantaron a cortes de SC de ratón. Treinta días después del trasplante, las células aún muestran expresión de GFP y una tasa apoptótica baja, lo que sugiere que el ambiente optimizado mantuvo su supervivencia e integración dentro del tejido. Este protocolo representa una referencia sólida para probar de manera eficiente las terapias de reemplazo celular en el tejido SC. Esta plataforma permitirá a los investigadores realizar un precribado ex vivo de diferentes terapias de trasplante de células, lo que les ayudará a elegir la estrategia más adecuada antes de proceder a los experimentos in vivo .
Introducción
La lesión traumática de la médula espinal (LME) tiene consecuencias físicas, psicológicas y económicas devastadoras para los pacientesy los cuidadores. Se han realizado muchos intentos para promover la regeneración axonal en la LM con diferentes enfoques 2,3,4 y se demostraron algunos efectos beneficiosos mediante la formación de relés neuronales entre las neuronas proximales y distales en el sitio de la lesión mediante terapias de reemplazo celular. El interés por las terapias celulares sigue creciendo5 ya que las células trasplantadas pueden desempeñar muchas funciones, como el apoyo trófico, la modulación inmunitaria, la regeneración de circuitos neuronales perdidos mediante la inducción de la plasticidad, el reemplazo celular y la remielinización de axones6.
Recientemente, el principal esfuerzo en este campo se centró en las células madre/progenitoras neurales humanas (NSCs/NPCs)7. Varios estudios sugieren que las NSCs/NPCs modulan la respuesta de los astrocitos8, promueven la secreción de factores proregenerativos 9,10 y reemplazan las células neuronales faltantes en la LME11,12. Sin embargo, los estudios que apoyan la diferenciación de las células trasplantadas en neuronas funcionales son todavía escasos. Además, la supervivencia y diferenciación de las células trasplantadas en la médula espinal (CS) lesionada es baja13, posiblemente porque las células trasplantadas tardan varias semanas, incluso meses, en diferenciarse in vivo. Además, los estudios actuales no han dilucidado completamente muchos aspectos bioquímicos, moleculares, celulares y funcionales de las terapias de reemplazo celular. En este contexto, se requieren modelos simples, rápidos y rentables para estudiar los mecanismos del injerto celular, la capacidad de las células injertadas para proliferar, diferenciarse en tipos específicos o subpoblaciones de células y formar sinapsis con las neuronas residentes.
La integración de los estudios histológicos en el registro electrofisiológico y el perfil del transcriptoma y el proteoma es necesaria para una comprensión completa de la cascada molecular que ocurre después del trasplante de células. Sin duda, esto acelerará el diseño y la validación de nuevas terapias de reemplazo celular en modelos preclínicos y estudios clínicos. De hecho, hasta la fecha, el uso de roedores, animales grandes y primates no humanos ha sido valioso para dilucidar muchos procesos celulares después del trasplante14. Sin embargo, debido al alto costo, el alto impacto ético, así como la complejidad del organismo, su uso a menudo no es sencillo o no es adecuado para desentrañar los procesos bioquímicos y moleculares. Además, pueden presentar muchas desventajas correlacionadas con las diferencias biológicas, tanto entre especies (metabolismo) como dentro de las especies (sexo, edad). Estos factores, junto con factores externos como situaciones estresantes, podrían alterar el resultado de un experimento y su predictibilidad en términos de traslación terapéutica a humanos 15,16,17.
Por lo tanto, muchos grupos emplean cultivos celulares in vitro 2D y cortes organotípicos ex vivo (cultivos ex vivo) además de modelos animales. El cultivo celular 2D es el sistema más utilizado para estudiar procesos biológicos específicos a nivel de célula única y/o población celular. Sin embargo, los cultivos celulares monocapa no reflejan la complejidad que se encuentra en un organismo completo. La falta de estructuras tisulares y del ambiente fisiológico no permite que los sistemas de cultivo 2D emulen completamente los aspectos estructurales, morfológicos y funcionales clave del tejido investigado 18,19,20.Los cultivos organotípicos pueden superar algunos de estos problemas. Los modelos organotípicos se basan en la explantación de un fragmento de un tejido u órgano y su mantenimiento ex vivo durante un período limitado21,22. En particular, se generan rodajas del tejido explantado con un grosor preciso que permite que los nutrientes lleguen fácilmente a casi todas las células de las rodajas. Pueden generarse a partir de varias regiones del sistema nervioso central, como el hipocampo, el hipotálamo, el cerebelo, el tálamo, la corteza cerebral, la sustancia negra y el cuerpo estriado, y la médula espinal23. Los cultivos organotípicos conservan la arquitectura de los tejidos, la distribución espacial de las células, la diversidad celular y el entorno (es decir, la composición de la matriz extracelular) del órgano de origen. Además, conservan la actividad neuronal original, las conexiones entre células y, en particular, los circuitos de corta distancia después del explante.
Estos aspectos proporcionan algunas ventajas para los cultivos ex vivo con respecto tanto a los cultivos monocapa como a los modelos animales. Conservan las características tisulares clave que se encuentran in vivo, pero con la reducción de los costos y la posibilidad de realizar diferentes tipos de experimentos moleculares, celulares y funcionales con una regulación precisa de los parámetros ambientales del cultivo 24,25,26,27,28,29. Los cortes organotípicos también pueden aprovecharse para desarrollar modelos para diferentes trastornos neurológicos, asemejándose a las características histopatológicas clave de condiciones específicas30. Además, la retención del entorno original del tejido multicelular los convierte en plataformas adecuadas para el cribado de fármacos y para el ensayo de moléculas y materiales neuroprotectores y neuro-regenerativos.
En este trabajo, proponemos el uso de cultivos organotípicos de SC como modelo para optimizar los trasplantes de NSC. Esto no es baladí, ya que se requieren unas condiciones óptimas de cultivo para garantizar la supervivencia tanto del huésped (tejido SC) como del trasplante (NSCs) durante semanas. Diferentes grupos de investigación injertaron en cultivos organotípicos, derivados del cerebro y derivados del SC, varios tipos de células. La mayoría de los trabajos mostraron el trasplante de células madre mesenquimales 31,32,33, células de envoltura olfativa 34 o NSCs 35,36,37,38,39,40 y evaluaron las interacciones de las células injertadas con las células huésped, la supervivencia de todo el sistema y si las células trasplantadas se diferenciaban en neuronas o células similares a las neuronas dentro del entorno tisular ex vivo 32,33,41. Algunos de ellos evaluaron el potencial regenerativo de las células después del trasplante, observando su crecimiento axonal dentro del tejido 37,40,41, la capacidad mielinizante de los precursores injertados de oligodendrocitos 42, la migración de las células injertadas al tejido huésped43, y si las células trasplantadas liberaban factores que empujaban hacia un ambiente proregenerativo31. Una limitación de los estudios actuales es que no exploran el injerto a largo plazo.
Teniendo en cuenta que las NSC parecen requerir varias semanas para diferenciarse in vivo44,45, este estudio se centra en cómo generar y mantener a largo plazo (≥30 días) cortes de SC de ratón durante un máximo de 90 días. Se encontró que los cortes conservan su estructura anatómica original y mantienen una tasa de apoptótica baja y estable a lo largo del tiempo y una alta viabilidad celular. Observamos la expresión difusa de los marcadores neuronales RNA binding fox-1 homólogo 3 (RBFOX3) y la cadena ligera de neurofilamentos (NFL), mostrando este último una tendencia creciente de brote axonal alrededor de las rodajas a lo largo del tiempo, lo que atestigua su estado saludable. Además, trasplantamos con éxito a las células madre neuroepiteliales humanas derivadas de SC (H-SC-NES) que expresan GFP en las primeras etapas de la diferenciación neuronal. El injerto NSC se mantuvo durante 30 días después del trasplante y las células mostraron expresión de GFP durante todo el período en cultivo. También se encontró que la tasa apoptótica de células al día post-trasplante (DPT) 30 estaba en línea con el valor de la tasa apoptótica observada en DPT 7 en las mismas células40. Las células parecían injertarse en el entorno del tejido y sobrevivían hasta varias semanas.
En resumen, nuestros datos demuestran que es posible mantener en cultivo cortes organotípicos SC durante 3 meses sin comprometer su citoarquitectura original y el entorno tisular. Y lo que es más importante, pueden aprovecharse para probar terapias celulares antes de proceder a un experimento in vivo , reduciendo así los costes y el tiempo experimental. Aquí, ilustramos en detalle todos los pasos para generar cortes organotípicos SC de ratón y cómo mantenerlos a largo plazo (≥30 días). Además, explicamos en profundidad cómo realizar el trasplante de NPC en las rodajas y cómo mantenerlas para el análisis posterior.
Protocolo
Los procedimientos con animales se llevaron a cabo en estricto cumplimiento de los protocolos aprobados por el Ministerio de Salud Pública italiano y el Comité de Ética local de la Universidad de Pisa, de conformidad con la Directiva 2010/63/UE (licencia de proyecto n.º 39E1C. N.5T7 publicado el 30/10/2021). Los ratones C57BL/6J se mantuvieron en un ambiente regulado (23 ± 1 °C, 50 ± 5% de humedad) con un ciclo de luz-oscuridad de 12 h con alimento y agua ad libitum.
Todo el trabajo relacionado con las células h-SC-NES se realizó de acuerdo con las directrices de los NIH para la adquisición y distribución de tejido humano con fines de investigación biomédica y con la aprobación de los Comités de Investigación en Humanos y los Comités de Ética Institucional de cada instituto del que se obtuvieron las muestras. Se obtuvo la aprobación final del Comité de Bioética de la Universidad de Pisa (Revisión n.º 29/2020). Los especímenes humanos no identificados fueron proporcionados por la subvención conjunta del MRC/Wellcome Trust (099175/Z/12/Z), Human Developmental Biology Resource (www.hdbr.org). Se obtuvo el consentimiento informado adecuado y se registró toda la información no identificativa disponible para cada espécimen. El tejido se manipuló de acuerdo con las directrices éticas y las regulaciones para el uso en investigación del tejido cerebral humano establecidas por los NIH (http://bioethics.od.nih.gov/humantissue. html) y la Declaración de Helsinki de la WMA (http://www.wma.net/en/30publications/10policies/b3/index.html).
1. Preparación de soluciones y equipos para el aislamiento y cultivo de la médula espinal (SC)
- Solución de recubrimiento para insertos de membrana
- Prepare la solución de recubrimiento (Tabla 1): una solución acuosa con 0,1 mg mL-1 de colágeno, 0,01 mg mL-1 de poli-L-lisina y 0,01 mg mL-1 de laminina.
- Coloque cada inserto de membrana en un plato de 35 mm o en una placa de 6 pocillos.
- Añadir a la parte superior de la membrana 1 mL de solución de recubrimiento: incubar la solución durante 4 h a temperatura ambiente (RT); luego, retírelo y deje que el inserto de membrana se seque durante la noche (ON). Guarde los insertos de membrana a 4 °C hasta su uso.
NOTA: Todos los pasajes deben realizarse en condiciones estériles. El recubrimiento de la membrana debe conservarse durante un máximo de 1 semana a 4 °C antes de su uso para evitar la degradación de proteínas y la adhesión subóptima de la rebanada a la membrana.
- Preparación del medio: medio organotípico, medio de disección, medio de injerto
- Preparar medio organotípico (OM, Tabla 1).
- Prepare el medio de disección como se describe en la Tabla 1.
- Preparar el medio de injerto (GM, optimizado a partir de Onorati et al.46, Tabla 1).
NOTA: Las soluciones deben prepararse en condiciones estériles y justo antes de su uso (1 día antes o el mismo día del experimento).
- Preparación del material para la cirugía
- En el gabinete de bioseguridad, mantenga listo para su uso: el microscopio estereoscópico de disección y los instrumentos quirúrgicos: dos pares de microtijeras, dos pares de pinzas rectas y dos pares de pinzas curvas.
- En el gabinete de bioseguridad, prepare el instrumento picador equipándolo con una cuchilla para cortar el SC en rodajas. Gire un tornillo de la picadora para levantar el brazo metálico donde se debe colocar la cuchilla. Coloque la cuchilla en el sitio designado, baje el brazo metálico con la cuchilla hasta que entre en contacto con la plataforma de corte y fíjela apretando el tornillo de seguridad con una llave hexagonal hasta que la hoja esté firmemente asegurada. Gire el tornillo micrométrico hasta el grosor de corte deseado (generalmente 350 μm). Compruebe si la cuchilla está colocada exactamente perpendicular a la plataforma de corte.
NOTA: La colocación perpendicular precisa de la cuchilla con respecto a la plataforma de corte es necesaria para realizar el corte correctamente. - Prepare en la cabina de bioseguridad: dos pipetas Pasteur de plástico (necesarias para mover el SC aislado y las rodajas), al menos cuatro platos de 35 mm y dos de 60 mm, y una caja de hielo fresco.
- Esterilizar todos los instrumentos con etanol al 70% y UV (un ciclo de 20 min) justo antes de su uso para preservar la esterilidad del cultivo.
2. Aislamiento de SC de ratón y generación de cortes
- Aislamiento de SC de ratón
- Sacrificar cachorros de ratón postnatal día 3 (P3) de acuerdo con la licencia del proyecto.
- A través de una laparotomía de línea media con las microtijeras, aísle la región lumbar de la columna vertebral del resto del cuerpo del ratón y colóquela en un medio de disección frío en un plato de 35 mm.
- Usando un microscopio estereoscópico de disección y las microtijeras, corte la columna vertebral a lo largo del eje sagital y use pinzas rectas para quitar suavemente el SC de la cavidad de la columna vertebral.
- Despegue con cuidado las meninges de la región lumbar aislada del SC utilizando pinzas rectas.
- Transfiera e incube la región lumbar SC aislada en un medio de disección frío y fresco durante 10-15 minutos antes de continuar con el siguiente paso.
- Generación de rebanadas
- Utilizando una pipeta Pasteur de plástico, tome la región lumbar SC aislada del medio de disección y colóquela en la plataforma de corte del instrumento picador, perpendicularmente a la cuchilla.
NOTA: El posicionamiento correcto del SC con respecto a la cuchilla (perpendicular) es esencial para generar correctamente los cortes de SC. - Retire el medio de disección residual en la cubierta alrededor del SC con la ayuda de la pipeta Pasteur y el papel absorbente estéril. Proceda con el seccionamiento automatizado SC.
- Una vez generadas las rodajas, coloque un poco de medio de disección fresco con una pipeta Pasteur en la plataforma de corte con las rodajas. A continuación, recoge las rodajas en un plato de 35 mm con medio de disección fresco e incuba durante 15 min.
- Durante la incubación de las rebanadas, lave la superficie de los insertos de membrana 3 veces con OM con una pipeta Pasteur de plástico. A continuación, deje 1 ml de OM en la parte inferior de cada inserto de membrana.
- Revise las rebanadas bajo el microscopio estereoscópico de disección. Siembre el número deseado de rodajas en los insertos de membrana acondicionados transfiriéndolos con una pipeta Pasteur de plástico.
- Mueva las rodajas en la orientación preferida y en la posición deseada sobre los insertos de la membrana con la ayuda de las pinzas rectas. Retire el exceso de medio con una pipeta Pasteur para permitir que las rodajas se adhieran mejor a la superficie de la membrana.
NOTA: Mover y orientar las rodajas con las pinzas rectas debe realizarse con cuidado para evitar daños en el tejido o la membrana. - Después de 30 minutos de incubación a 37 °C, transfiera el inserto a una nueva placa de Petri.
NOTA: Toque el anillo de plástico pero no las membranas durante el cambio de medio. - Añadir 1 mL de OM fresco suplementado con factor neurotrófico derivado de línea celular glial (GDNF) 100 ug mL-1 en la parte inferior del inserto de la membrana.
- Incubar las rodajas a 37 °C. Refiérase al primer día en cultivo como día ex vivo (DEV) 0.
- Utilizando una pipeta Pasteur de plástico, tome la región lumbar SC aislada del medio de disección y colóquela en la plataforma de corte del instrumento picador, perpendicularmente a la cuchilla.
3. Cultivo a largo plazo de rodajas organotípicas
- Mantener las rodajas en cultivo a 37 °C hasta los puntos de tiempo deseados.
- Reemplace el medio con OM nuevo en DEV 1 como se describe en los pasos 2.2.7-2.2.8.
- En el DEV 3, cambie el medio al GM para crear el entorno adecuado para el trasplante de células madre al día siguiente. Reemplace el medio con GM fresco cada 48 h (por ejemplo, DEV 5, DEV 7...).
- Agregue GDNF fresco (concentración final 100 μg mL-1) al medio todos los días hasta DEV 7. Después de DEV 7, agréguelo solo cuando se cambie el medio (paso 3.3).
4. Cultivo celular h-SC-NES
NOTA: las células h-SC-NES se mantienen en cultivo en presencia de factores de crecimiento (medio NES, paso 4.1.1). Antes del trasplante, las células se siembran en condiciones de prediferenciación durante 7 días mediante la eliminación de los factores de crecimiento del medio (medio de prediferenciación: medio NES sin factor de crecimiento de fibroblastos 2 (FGF-2) y factor de crecimiento epidérmico (EGF), paso 4.1.2). A continuación, las células se siembran en condiciones de diferenciación (medio de diferenciación, paso 4.1.3) durante 2 días antes del trasplante. La diferenciación se apoya mediante la adición de suplementos neurotróficos (factor neurotrófico derivado del cerebro, BDNF) al medio de diferenciación. A continuación se describe en detalle el mantenimiento, la división, la prediferenciación y la diferenciación de las células h-SC-NES12,46.
- Preparación de medios: NES, medios de prediferenciación y diferenciación
- Prepare el medio de mantenimiento de la célula h-SC-NES (medio NES, Tabla 1).
- Prepare el medio de prediferenciación celular h-SC-NES (medio de prediferenciación, Tabla 1).
- Prepare el medio de diferenciación celular h-SC-NES (Medio de diferenciación, Tabla 1). Agregue BDNF fresco cuando se cambie el medio o cuando las células se plateen por primera vez en la condición de diferenciación.
NOTA: Todos los medios deben prepararse en condiciones estériles y deben filtrarse con filtros de 0,22 μm.
- Solución de recubrimiento para células h-SC-NES
NOTA: las células h-SC-NES se mantienen en soportes de cultivo recubiertos de POLFN (POLFN = Poli-L-Ornitina, Laminina, Fibronectina).- Prepare la solución de recubrimiento en un tubo: una solución de poli-L-ornitina con laminina (5 μg mL-1) y fibronectina (1 μg mL-1).
- Transfiera la solución de recubrimiento preparada al soporte de cultivo celular, teniendo cuidado de agregar suficiente para cubrir toda la superficie del soporte de cultivo celular. Incubar el recubrimiento durante 1 h a 37 °C o toda la noche a 4 °C.
- Retire la solución de recubrimiento de los soportes de cultivo celular.
NOTA: La solución de POLFN podría reciclarse dos veces más, pero la laminina y la fibronectina deben agregarse frescamente cada vez. - Lave el recubrimiento 3 veces con agua estéril de grado de cultivo celular. Guarde los recubrimientos a 4 °C o utilícelo.
NOTA: Los recubrimientos deben usarse dentro de 1 semana. Después de eso, los recubrimientos se consideran caducados debido a los procesos de degradación de las proteínas añadidas.
- Mantenimiento de la célula h-SC-NES
- Mantener las células h-SC-NES en cultivo en medio NES. Revise las células todos los días bajo el microscopio para monitorear cuándo llegan a la confluencia.
- Cambie la mitad del medio cada 2 días: retire la mitad del medio acondicionado y agregue el fresco (considere una tasa de evaporación del 20%).
- Si las celdas alcanzan la confluencia, proceda con la división, como se describe en el paso 4.4.
- Paso de la célula h-SC-NES
NOTA: Las celdas se dividen de la siguiente manera12:- Retire el medio acondicionado y lave las células una vez con solución salina tamponada con fosfato (DPBS) de Dulbecco sin Ca2+/Mg2+.
- Retire el DPBS y agregue una solución de tripsina/EDTA a las células para realizar el desprendimiento enzimático. Incubar las células a 37 °C durante 30 s a 1 min.
- Después de la incubación, compruebe las células bajo el microscopio: si no están separadas, golpee ligeramente el soporte de cultivo celular para realizar el desprendimiento mecánico e incube a 37 °C durante 30 s más.
- Después de la incubación, inactive la tripsina/EDTA añadiendo 4 volúmenes de solución de DPBS/suero fetal bovino (FBS) (10% vol/vol) al soporte de cultivo celular con células y tripsina/EDTA. Pipetear suavemente la solución en la superficie de soporte del cultivo celular hacia arriba y hacia abajo para ayudar a que todas las células se desprendan. Recoja la suspensión celular en un tubo.
- Centrifugar la suspensión celular a 200 × g durante 3 min. Deseche el sobrenadante y vuelva a suspender el pellet en un medio NES fresco.
- Cuente las células y póngalas en cada nuevo soporte de cultivo recubierto de POLFN a una densidad de 0,5-1 × 105 células/cm2.
- Añadir Y-27632 (10 μM) y colocar las celdas a 37 °C. Revíselos todos los días hasta la confluencia y luego vuelva a dividirlos para su mantenimiento/expansión o banco de células.
- Prediferenciación celular h-SC-NES
- Divida las celdas como se describe en el paso 4.4.
- Coloque las células en los soportes de cultivo celular recubiertos de POLFN a una densidad de 0,5-1 × 105 células/cm2 en medio de prediferenciación. Agregue Y-27632 (10 μM) después de la división. Llamar el primer día en día de prediferenciación in vitro (DIV) 0.
- Cambie la mitad del medio cada 2-3 días (consulte el paso 4.3.2).
- Mantenga las celdas en condiciones de prediferenciación hasta DIV 7 y luego continúe con el paso 4.6.
- Diferenciación de células h-SC-NES
- En la DIV 7 de prediferenciación, divida las células como se describe en el paso 4.4.
- Coloque las células en soportes de cultivo celular recubiertos de POLFN a una densidad de 1-1,5 × 105células/cm2en medio de diferenciación. Agregue Y-27632 (10 μM) y BDNF (30 ng mL-1) después de la división.
- Después de 2 días de diferenciación (DIV 10), dividir las células para el trasplante en rodajas.
5. Transducción de células h-SC-NES con vectores lentivirales portadores de GFP
NOTA: La transducción celular se realiza durante la fase de mantenimiento de las celdas h-SC-NES. Cuando las células se transducen correctamente, estas pueden expandirse y se aplican los protocolos de prediferenciación y diferenciación descritos anteriormente (pasos 4.5 y 4.6).
- Preparación del medio de transducción celular
NOTA: El medio de transducción celular se prepara mezclando un volumen específico de medio NES y un volumen preciso de preparación de stock de vectores lentivirales (LVS) de acuerdo con diferentes parámetros: el MOI deseado (multiplicidad de infección = relación entre el número de partículas virales y el número de células huésped en un medio de infección dado); el número de células plateadas; la concentración inicial de la preparación de la VIS (=UFP de la VIS, unidad formadora de placa); la superficie del recipiente de cultivo utilizado.- Calcule el volumen correcto de preparación de LVS que se agregará al medio NES, de acuerdo con el MOI elegido utilizando las ecuaciones (1) y (2).
(n células a placa/cm2) ×cm2 de MOI de soporte de cultivo celular × = PFU LVS para el MOI elegido (1)
LVS PFU : Tot inicial LVS Vol (μL) = LVS PFU para MOI : LVS Vol para agregar al medio (μL)(2)
NOTA: El fabricante indica la PFU del LVS (PFU inicial del LVS) y el volumen inicial total del LVS . La PFU del LVS para el MOI elegido se calcula como se describe en la ecuación (1). De este modo, podemos obtener el volumen de preparación de LVS que hay que añadir al volumen total del medio NES (en función del soporte del cultivo celular) para el MOI elegido, tal y como se describe en la ecuación (2).
Ejemplo: Utilizamos el MOI 3, basándonos en la experiencia previa del laboratorio (el MOI puede variar en función de la línea celular utilizada y de la preparación viral). Si el MOI deseado es 3, el número de células a sembrar es de 0,5 × 105/cm2 y el soporte de cultivo es de 1 pocillo-MW24 (2cm2), suponiendo que la UFP/TU inicial de la SVB (unidad formadora de placa/unidad de transducción) es de 25 × 106 UFP en 1 mL (1.000 μL = volumen inicial de la VIS), los cálculos son los siguientes:
Celdas sembradas en 1 pocillo-MW24 (2 cm2) = 0,5 × 105 células × 2 cm2 = 1 × 105 células
1 × 105 celdas × 3 (MOI) = 3 × 105 PFU = LVS PFU para MOI 3
25 × 106 UFP: 1.000 μL = 3 × 105 UFP: x μL
x μL = 12 μL = Volumen del VIS para añadir al medio
Por lo tanto, para transducir las células con medio de transducción celular con MOI 3 en 1 pocillo-MW24, agregue 12 μL de preparación inicial del LVS al medio NES (238 μL) preparado para 1 pocillo de MW24. El volumen total final es de 250 μL.
NOTA: El medio generalmente se prepara fresco el día de la transducción en condiciones estériles.
- Calcule el volumen correcto de preparación de LVS que se agregará al medio NES, de acuerdo con el MOI elegido utilizando las ecuaciones (1) y (2).
- Protocolo de transducción h-SC-NES
- Placa de células h-SC-NES en un paso bajo en una placa de 24 pocillos múltiples recubierta de POLFN (o en cualquier otro soporte de cultivo) a una densidad de 0,5 × 105/cm2 en medio NES.
- Al día siguiente, recoja el medio NES acondicionado de los pocillos donde se colocaron las celdas. Dependiendo del soporte de cultivo elegido, agregue a las celdas el volumen más bajo de medio de transducción de células frescas necesario para cubrir uniformemente la superficie de siembra (por ejemplo, 250 μL/pocillo de una placa de 24 pocillos múltiples).
- A continuación, incubar las células h-SC-NES durante 6 h a 37 °C. A continuación, añada a las células el medio acondicionado recogido previamente (200 μL/pocillo de una placa multipocillo de 24 pocillos) e incube las células ON a 37 °C.
- Al día siguiente, lavar las células h-SC-NES una vez con DPBS y realizar un cambio total de medio (medio NES).
- En los días siguientes, se examinan las células al microscopio de fluorescencia para observar la expresión de GFP.
- Ampliar las células h-SC-NES para el almacenamiento y el trasplante de células.
6. Trasplante de células en cortes de SC y co-cultivo
- Preparación de microagujas de vidrio
- Utilice un extractor para obtener agujas finas de capilares de vidrio de borosilicato. Configure el tirador de la siguiente manera: HEAT 990, PULL 350.
NOTA: De un capilar es posible obtener dos agujas finas.
- Utilice un extractor para obtener agujas finas de capilares de vidrio de borosilicato. Configure el tirador de la siguiente manera: HEAT 990, PULL 350.
- Preparación celular para trasplante
- Divida las celdas como se describe en el paso 4.4.
NOTA: Si las células no emiten un indicador fluorescente, etiquételas con un tinte de seguimiento celular para monitorearlas con un microscopio de fluorescencia después del trasplante y durante el cultivo a largo plazo. Siga el protocolo del fabricante elegido para el paso de etiquetado. - Cuente las células después de la división y centrifugue a 200 × g durante 3 minutos. Suspender el pellet obtenido con medio fresco + Y-27632 (10 μM) para tener la concentración deseada de células (normalmente un rango entre 30.000-50.000 células μL-1).
- Transfiera la suspensión celular a un tubo de 500 μL o 1,5 mL y colóquelo en hielo. Las células están listas para el trasplante.
- Divida las celdas como se describe en el paso 4.4.
- Trasplante de células en cortes organotípicos
NOTA: Realice trasplantes de células h-SC-NES en cortes organotípicos SC de ratón utilizando un microinyector de aire y microagujas de vidrio.- Cargue una microaguja de vidrio con 4 μL de suspensión celular utilizando una micropipeta y puntas de microcargador.
NOTA: Evite la formación de burbujas de aire en la aguja, ya que podría dificultar el proceso de microinyección. Si se forman burbujas, retírelas con la micropipeta. - Coloque la aguja en el soporte asignado del microinyector y rompa la punta de la aguja con las pinzas rectas.
NOTA: Rompa la aguja de vidrio más cerca de la punta para evitar la formación de grandes agujeros. - Antes de trasplantar a las rodajas, configure los parámetros de microinyección. Ajuste la presión a 10 psi.
NOTA: El valor de la presión puede modificarse en función del microinyector y de las observaciones del operador: la presión debe ser suficiente para microinyectar la suspensión celular, evitando daños en los tejidos. - En un portaobjetos de vidrio calibrado, coloque una gota de aceite mineral con una pipeta Pasteur y microinyecte la suspensión celular en la gota. El diámetro de la esfera de suspensión celular obtenida en la gota de aceite se correlaciona con un volumen específico de microinyección. Cambie los parámetros de microinyección según sea necesario para alcanzar un diámetro de la esfera de suspensión celular de 0,2 mm para inyectar 4nL.
- Después de ajustar el volumen correcto, microinyecte rápidamente la suspensión celular en las rodajas. Compruebe con el microscopio estereoscópico de fluorescencia la presencia de células en los cortes para verificar que la microinyección/trasplante fue exitosa.
NOTA: La suspensión celular a veces puede obstruir la aguja: en este caso, intente eliminar la obstrucción de la suspensión celular modificando los parámetros de inyección o cargue una nueva aguja con suspensión celular fresca. - Después del trasplante, coloque las rodajas a 37 °C y 5% de CO2hasta el punto de tiempo deseado y realice el cambio de medio cada dos días como se describe en los pasos 2.2.7-2.2.8.
- Cargue una microaguja de vidrio con 4 μL de suspensión celular utilizando una micropipeta y puntas de microcargador.
7. Tinción de inmunofluorescencia
- Día 1
- Retire el medio de la parte inferior de la membrana del inserto y lave las rodajas 3 veces con DPBS precalentado.
- Fije las rodajas con formaldehído (FA) precalentado al 4%: retire el DPBS y agregue 1,5 mL de 4% FA en la parte inferior del inserto de la membrana con las rodajas. Después de 15 min de incubación en RT, agregue 1 mL más de 4% de AG en la superficie superior del inserto de membrana e incube durante 15 min en RT. Tiempo total de fijación: 30 min en RT
- Retire el 4% de FA y lave las rodajas durante 3 x 10 min con DPBS.
- Corte la membrana del inserto circunferencialmente con un bisturí, separe la membrana con las rodajas del componente plástico del inserto y continúe con los pasos de inmunofluorescencia.
NOTA: Después de este paso, la membrana con las rodajas flota en DPBS en el plato. - Permeabilizar con 1 mL/membrana de una solución con Triton al 0,7% en DPBS durante 10 min en RT.
- Retirar la solución de permeabilización e incubar las muestras durante 4 h a 4 °C con 1 mL/membrana de solución de bloqueo compuesta por 0,5% de Triton, 10% de FBS en DPBS.
- Retire la solución de bloqueo y agregue a las rodajas los anticuerpos primarios en su dilución de trabajo, por ejemplo, anticuerpo anti-neurofilamento (NFL) de ratón, 1:500; conejo anti-NFL, 1:500; anticuerpo anti-RBFOX3 (NeuN) de conejo, 1:400; conejo anti-activo caspasa-3 (aCASP3), 1:400; Núcleos antihumanos de ratón, (Hu-Nu), 1:400; conejo anti-Hu-Nu, 1:400; anti-GFP en ratón, 1:400 (según se informa en la Tabla 1) en 1 mL de solución de anticuerpos compuesta por Triton al 0,5%, FBS al 1% en DPBS. Incubar ON a 4 °C.
- Día 2
- Lave las membranas durante 3 x 10 min con 1-2 mL de DPBS.
- Incubar la membrana con anticuerpos secundarios (p. ej., anticuerpo secundario IgG (H+L) anti-ratón de cabra, Alexa Fluor 488, 1:500; Anticuerpo secundario IgG (H+L) anti-conejo de cabra, Alexa Fluor 568, 1:500; Anticuerpo secundario IgG (H+L) anti-ratón de cabra, Alexa Fluor 647, 1:500; Anticuerpo secundario IgG (H+L) anti-conejo de cabra, Alexa Fluor 647, 1:500 según lo informado en la Tabla 1) y Hoechst/DAPI para núcleos diluidos en 1 mL/membrana de solución de anticuerpo (Triton 0,5% + FBS 1% en DPBS) durante 3 h en RT.
NOTA: Proteja cuidadosamente las muestras de la luz para evitar el blanqueo secundario de anticuerpos durante la incubación y en los siguientes pasos. - Retire la solución de anticuerpos y lave durante 3 x 10 min con DPBS (1-2 mL).
- Sustituya el DPBS por un DPBS nuevo y guárdelo a 4 °C en condiciones de protección contra la luz.
- Al final del protocolo de inmunofluorescencia, monte las membranas en portaobjetos de vidrio. Coloque una gota de 200 μL de solución de montaje en un portaobjetos de vidrio. Con la ayuda de pinzas rectas, transfiera la membrana flotante del plato de 35 mm a un cubreobjetos y, a continuación, transfiera la membrana al portaobjetos de vidrio con la solución de montaje.
- Coloque una gota de 100 μL de solución de montaje en un cubreobjetos nuevo y cubra la membrana con ella, fijándola en el portaobjetos de vidrio. Deje que se seque durante la noche bajo la cubierta química en condiciones de protección contra la luz.
- Almacene las muestras a 4 °C en la oscuridad o realice análisis de imagen.
8. Ensayo de vivo/muerto
- Prepare la solución de trabajo alícuota 700 μL por plato de medio fresco y añada en la dilución de trabajo correcta el Sytox (p. ej., Componente B, 1:2.000) y la Calceína AM (p. ej., Componente A, 1:2.000).
NOTA: Como los reactivos son sensibles a la luz, proteja la solución de trabajo de la luz. - Evalúe el volumen del medio en la parte inferior de la membrana y agregue el Sytox y la Calceína AM en la misma dilución de trabajo descrita en el paso 8.1.
- Añadir 2 gotas de 30 μL cada una en la parte superior de cada rebanada de la solución de trabajo preparada en el paso 8.1.
NOTA: Proteja el plato de la luz colocándolo en condiciones oscuras. - Incubar las rodajas durante 30 min a RT.
- Después de la incubación, corte la membrana circunferencial del inserto con un bisturí: después de eso, la membrana con las rodajas flota en la solución de trabajo.
- Coloque la membrana sin la solución de montaje boca abajo sobre un cubreobjetos con la ayuda de pinzas rectas y agregue 100 μL de DPBS encima de las membranas para mantenerlas hidratadas.
- Adquiera imágenes en vivo utilizando el microscopio confocal lo más rápido posible.
NOTA: Agregue 2 gotas de 40 μL de DPBS en la parte superior de la membrana cada 30 minutos durante la adquisición de la imagen para evitar que la membrana se seque.
9. Imágenes
- Obtención de imágenes confocales de muestras fijas
- Para el análisis cualitativo, adquiera imágenes utilizando un microscopio confocal con los siguientes parámetros de adquisición: configure la opción de imagen grande (elija: 4 x 4), use un objetivo de 10 x, sin pilas y una resolución de 3.634 x 3.634 píxeles.
- Para el análisis cuantitativo (aCASP3, Calcein y Sytox para cortes y aCASP3 para células), adquiera imágenes utilizando el microscopio confocal con los siguientes parámetros de adquisición: objetivo 20 x, resolución de 1.024 x 1.024 píxeles con un paso Z de 3 μm.
- Imágenes en vivo de cortes trasplantados usando el microscopio estereoscópico
NOTA: Capture imágenes utilizando el microscopio estereoscópico en los modos de campo claro y epifluorescencia.- Usando la configuración de campo claro , adquiera imágenes de los cortes (1 objetivo x con zoom de 3x utilizado aquí).
NOTA: Modificar la luz en función del microscopio utilizado y utilizar las fibras ópticas si es necesario. - Utilizando el ajuste de fluorescencia , adquiera imágenes de las células trasplantadas con el mismo objetivo y zoom que se utilizó para las cortes (consulte el paso 9.2.1). Utilice los siguientes parámetros para la adquisición: ganancia 1, exposición 200-500 ms, desplazamiento -10.
- Usando la configuración de campo claro , adquiera imágenes de los cortes (1 objetivo x con zoom de 3x utilizado aquí).
- Obtención de imágenes en vivo después de la prueba de vivo/muerto con el microscopio confocal
- Adquiera imágenes utilizando un microscopio confocal con los siguientes parámetros de adquisición: objetivo 20x, resolución 1.024 x 1.024 píxeles con un paso Z de 3 μm.
10. Análisis de imágenes por ImageJ
- Análisis de área de NFL, RBFOX3 y DAPI
- Abra el software ImageJ (https://imagej.net/software/imagej/).
- Abra la imagen del archivo haciendo clic en Archivo | abrir | seleccionar archivo | abrir.
- En la ventana emergente, seleccione Visualización de pila | Hyperstack y modo de color | Predeterminado (con escalabilidad automática).
- En la barra de herramientas, seleccione Imagen | Colores | Canales divididos.
- Elija los canales deseados para analizar: canal verde para NFL (marcador axonal), canal rojo para RBFOX 3 (marcador neuronal) y canal azul para DAPI (tinción nuclear).
- Para el análisis de la NFL, continúe con los siguientes pasos: en la barra de herramientas, seleccione Imagen | Ajustar | Umbral | Seleccione los parámetros (fondo oscuro, algoritmo, por ejemplo, predeterminado) y mueva el cursor sobre la barra de valores (debajo/sobre) para cubrir y circunscribir toda el área de neuritas (las neuritas se resaltan en blanco sobre un fondo oscuro) | Conjunto | Aplicar.
- Seleccione en la barra de herramientas la herramienta de trazado Varita y utilícela para definir automáticamente el área blanca cubierta por NFL. Presione Analizar | Medir | Valor del área en μm2.
- Para el análisis DAPI y RBFOX3, siga estos pasos: en la barra de herramientas, seleccione Imagen | Ajustar | Umbral | Seleccione los parámetros (fondo blanco, algoritmo, por ejemplo, predeterminado) y mueva el cursor sobre la barra de valores (debajo/encima) para cubrir y circunscribir toda el área RBFOX3 o DAPI | Conjunto | Aplicar.
- En la barra de herramientas, seleccione Proceso | FFT | Filtro de paso de banda. Utilice la barra de valores de umbral para ajustar el área blanca cubierta por RBFOX3 o DAPI, correspondiente a su señal de fluorescencia.
- En la barra de herramientas, seleccione la herramienta de trazado Varita y utilícela para definir automáticamente el área cubierta por RBFOX3 o DAPI. Presione Analizar | Medir | Valor del área en μm2.
- Análisis de la apoptosis por ImageJ
- Abra el software ImageJ (https://imagej.net/software/imagej/).
- Abra la imagen del archivo Z-stack haciendo clic en Archivo | abrir | seleccionar archivo | abrir.
- En la ventana emergente, seleccione Visualización de pila | Hyperstack y modo de color | Predeterminado (con escalabilidad automática).
- En la barra de herramientas, seleccione Imagen | Colores | Canales divididos.
- Elija los canales deseados: canal rojo para aCASP3 (marcador de apoptosis a analizar) y azul o cian para DAPI o Hu-Nu para núcleos. A continuación, superponga los canales seleccionando en la barra de herramientas Imagen | Colores | Fusionar canales | Crear compuesto.
- Arrastre la barra Z en la parte inferior de la imagen para navegar por la pila Z de la imagen e identificar las pilas en la región central de los sectores con positividad aCASP3.
- En la barra de herramientas, selecciona Plugins | Analizar | Contador de células.
- En la ventana emergente que se abre, seleccione Inicializar para preparar la imagen para el recuento; A continuación, seleccione un tipo de contador (por ejemplo, Tipo 1) y cámbiele el nombre por el objeto que se va a contar (por ejemplo, celdas aCASP3+ ). Cambie el nombre de otros tipos de contadores como se describió anteriormente para contar otros objetos (por ejemplo, celdas DAPI+ o Hu-Nu+ para el número total de celdas).
- En la ventana emergente, seleccione el tipo de contador correspondiente al objeto a contar (por ejemplo, celdas aCASP3+ ), luego seleccione la herramienta Punto en la barra de herramientas y comience a contar manualmente el número de celdas apoptóticas, positivas para aCASP3, haciendo clic en cada una positiva en la imagen abierta.
- Seleccione otro tipo de contador en la ventana del contador de celdas y comience a contar el número total de celdas (celdas DAPI+ , para porciones; Células Hu-Nu+ , para células trasplantadas).
- Análisis del ensayo Vivo/Muerto por ImageJ
- Abra el software ImageJ (https://imagej.net/software/imagej/).
- Abra la imagen del archivo Z-stack haciendo clic en Archivo | abrir | seleccionar archivo | abrir.
- En la ventana emergente, seleccione Visualización de pila | Hyperstack y modo de color | Predeterminado (con escalabilidad automática).
- En las barras de herramientas, seleccione Imagen | Colores | Canales divididos.
- Elija los canales deseados: canal verde para Calceína (marcador de vitalidad a analizar) y canal cian para Sytox (marcador muerto). A continuación, superponga los canales seleccionando en la barra de herramientas Imagen | Colores | Fusionar canales | Seleccione Crear composición.
- Arrastre la barra Z en la parte inferior de la imagen para navegar por la pila Z de la imagen e identificar las pilas en la región central de los cortes con positividad de Calcein y Sytox.
- En la barra de herramientas, selecciona Plugins | Analizar | Contador de células.
- En la ventana emergente que se abre, seleccione Inicializar para preparar la imagen para el recuento; y, a continuación, seleccione un tipo de contador (por ejemplo, Tipo 1) y cámbiele el nombre por el objeto que se va a contar (por ejemplo, celdas de Calceína+ ). Cambie el nombre de otros tipos de contadores como se describió anteriormente si es necesario contar otro objeto (por ejemplo, células Sytox+ ).
- En la ventana emergente, seleccione el tipo de contador correspondiente al objeto que desea contar; luego seleccione la herramienta Punto en la barra de herramientas y comience a contar manualmente el número de celdas de Calceína+ , haciendo clic en cada una positiva en la imagen abierta.
- Seleccione otro tipo de contador en la ventana de contador de celdas y cuente las células Sytox+ como se describe para Calceína.
11. Gráficos y análisis estadísticos
- Realice todos los análisis estadísticos y trace gráficos utilizando el software de su elección.
Resultados
Los métodos descritos permiten el establecimiento de cortes organotípicos SC de ratones en estadio P3 y su mantenimiento en cultivo durante un tiempo prolongado en condiciones saludables. Además, mostramos un protocolo para el trasplante de células en las rodajas y para co-cultivarlas durante un máximo de 30 días (Figura 1). En primer lugar, mostramos la optimización de las condiciones de cultivo y un protocolo adecuado para el cultivo prolongado de las lonchas de SC con células trasplantadas (Figura 2A). Los cortes se generan y mantienen desde el DEV 0 hasta el DEV 2 en el OM, que originalmente se propuso como un medio óptimo para el mantenimiento de los segmentos SC47. Sin embargo, debido a la presencia de proteínas séricas, este medio podría ser subóptimo para mantener la diferenciación y maduración neuronal de las células precursoras neurales trasplantadas. De hecho, en DEV 3, probamos el cambio de OM a GM, una formulación que contiene Neurobasal plus B27, que apoya la supervivencia neuronal, y sin suero, que inhibe la correcta diferenciación neuronal, promoviendo en cambio un destino glial48,49.
La Figura 2B muestra los resultados obtenidos al cambiar el medio en DEV 3 de OM a GM, en comparación con los cortes de SC que no recibieron el interruptor (los cortes de control se cultivaron en OM). Utilizamos la distribución de la señal de la NFL dentro de los cortes como marcador de la integridad neuronal (Figura 2B,C). Los cortes en DEV 7 fueron saludables en ambas condiciones de cultivo, mostrando la distribución difusa de neurofilamento (NFL, en verde) dentro de ellos. En el DEV 10, los cortes cultivados en GM parecieron ser más saludables con respecto a los cortes de control cultivados en MO, como se documentó en la distribución de tinción de la NFL. También estimamos el área NFL+ (% NFL+ Area/DAPI+ Area) de los cortes que se muestran en las imágenes representativas de la Figura 2B. El área estimada de NFL+ está representada en los histogramas de la Figura 2C, lo que confirma que la señal de la NFL se distribuye de forma difusa en los segmentos de DEV 7 en ambas condiciones. Sin embargo, en el DEV 10, el área estimada cubierta por la tinción de la NFL disminuye para la condición de cultivo de OM.
Estos datos sugieren que el cambio a la GM en DEV 3 es bien tolerado para el cultivo prolongado de cortes de SC (DEV 10). Como siguiente paso, probamos GM en puntos de tiempo más prolongados: DEV 30, DEV 60 y DEV 90. Como se muestra en la Figura 3A,B, las rodajas se mantuvieron sanas en cultivo hasta DEV 90. La tinción de NFL se encontró ampliamente presente en los cortes en cada punto de tiempo, con brotes difusos alrededor de los cortes de neuritas que partían de la región central. De hecho, estimamos el área NFL+ de los cortes que se muestran en la Figura 3A y aumentó con el tiempo, como se muestra en los histogramas de la Figura 3B. También observamos positividad para el marcador neuronal RBFOX3, proporcionando otra línea de evidencia de la diferenciación neuronal de los cortes. En cada punto de tiempo, también verificamos la tasa de apoptosis evaluando en diferentes cortes el número de células positivas a aCASP3 (Figura 4A,B). El análisis se realizó como se describe en la sección 10.2 del protocolo. Se encontró que la tasa de apoptótica (% de células aCASP3+/número total de células DAPI+) era muy baja en cada punto de tiempo (0,85 ± 0,52%, 0,71 ± 0,27%, 0,66 ± 0,45% para DEV 30, 60 y 90, respectivamente) sin diferencias significativas entre los tres puntos de tiempo considerados (valor p > 0,05, Figura 4B). Estos datos sugieren que la tasa de apoptótica asociada a aCASP3 se mantiene estable en el tiempo y, junto con la amplia distribución de NFL en los cortes (Figura 4A), confirman la supervivencia de los cortes en cada punto de tiempo.
En apoyo de los datos anteriores, también realizamos un ensayo vivo/muerto para evaluar la viabilidad de los cortes en los tres puntos de tiempo diferentes. Utilizamos calceína (tinción verde) para marcar las células viables y metabólicamente activas y Sytox (tinción cian) para evaluar la muerte celular. Como se muestra en los histogramas de la Figura 4C, el porcentaje de células metabólicamente activas aumenta ligeramente de DEV 30 a DEV 90 (93,17 ± 5,21%, 96,43 ± 3,02%, 96,33 ± 3,10% para DEV 30, 60 y 90, respectivamente), estabilizándose entre los dos últimos puntos de tiempo (valor p de DEV 30 vs DEV 60 = 0,018; DEV 30 vs DEV 90 valor p = 0,027; DEV 60 vs DEV 90 valor p = 0,99). Se encontraron bajos niveles de muerte celular que disminuyeron con el tiempo (6,83 ± 5,21%, 3,57 ± 3,02%, 3,66 ± 3,10% para los DEV 30, 60 y 90, respectivamente) y se encontró una diferencia significativa entre los puntos de tiempo DEV 30 y posteriores, DEV 60 y DEV 90 (valor p de DEV 30 vs DEV 60 = 0,018; DEV 30 vs DEV 90 valor p = 0,027; DEV 60 vs DEV 90 valor p = 0,99). Estos datos, en asociación con la tasa de apoptosis, confirman la supervivencia del corte a lo largo del tiempo y respaldan la efectividad del protocolo de cultivo a largo plazo realizado.
Una vez que se estableció la factibilidad del cultivo prolongado de las rodajas de SC, desafiamos el sistema mediante el trasplante de células h-SC-NES en las primeras etapas de la diferenciación neuronal. Probamos las células h-SC-NES porque han mostrado resultados prometedores para el tratamiento de la LME12. El procedimiento de trasplante de células h-SC-NES en cortes de SC de ratón se describe en la sección 6 del protocolo. Los cortes de SC y las células h-SC-NES trasplantadas se mantuvieron hasta DPT 30. Las células se injertaron en DIV 10 de diferenciación (etapa precursora neural) en cortes organotípicos de DEV 4, como se muestra en el esquema de protocolo de la Figura 5A. Las células trasplantadas se monitorizaron para determinar la expresión de GFP en cultivo durante un máximo de 30 días. La Figura 5B muestra imágenes representativas en vivo, en diferentes DPT, de un corte de SC con células GFP+ trasplantadas. La expresión estable de GFP a lo largo del tiempo (Figura 5B y Figura 6A) sugiere que las células sobrevivieron en el tejido SC en las condiciones de cultivo previamente optimizadas. También se comprobó la tasa de apoptótica de las células trasplantadas, tal y como se describe en la sección 10.2 del protocolo. Se encontró que la tasa apoptótica (% de células aCASP3+ /número total de células Hu-Nu+ ) era muy baja (0,44 ± 0,34%) después de 30 DPT (Figura 6B). Además, se encontró que la tasa apoptótica en DPT 30 estaba en línea con la encontrada para el mismo tipo de células en DPT 7, como se informó anteriormente40, lo que documenta que los cultivos se estabilizan con el tiempo.
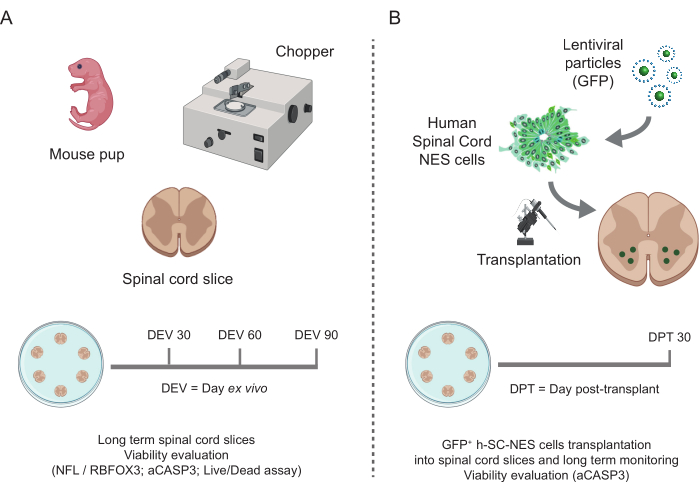
Figura 1: Flujo de trabajo del protocolo. Esquema representativo que muestra el flujo de trabajo general del protocolo realizado. (A) A la izquierda, un esquema que resume la generación de cortes SC de ratón a partir de SC aislados de cachorros de ratón en P3 y el cultivo a largo plazo de cortes organotípicos SC. (B) A la derecha, un esquema que resume el trasplante de células h-SC-NES que expresan GFP en cortes organotípicos SC de ratón. Las células injertadas se mantienen durante 30 días después del trasplante. Abreviaturas: h-SC-NES = tronco neuroepitelial derivado de la médula espinal humana; GFP = proteína verde fluorescente; DEV = día ex vivo; DPT = día después del trasplante; NFL = cadena ligera de neurofilamento; RBFOX3= ARN de unión a fox-1 homólogo 3; aCASP3 = Caspasa-3 activa; SC= médula espinal. Haga clic aquí para ver una versión más grande de esta figura.
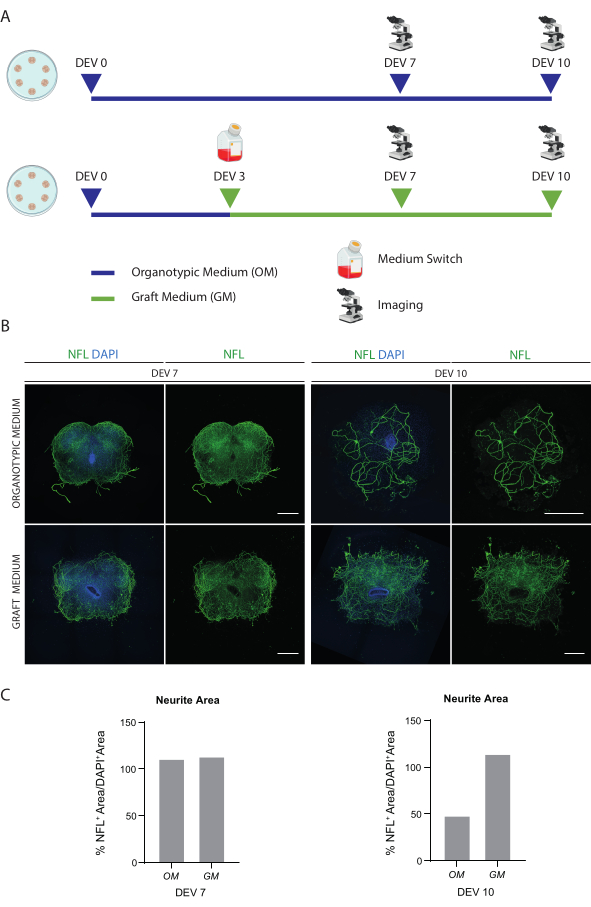
Figura 2: Optimización de las condiciones de cultivo a largo plazo. (A) Esquema representativo del protocolo para la prueba de OM y GM. La MO se mantiene hasta DEV 7-10 para el grupo control. El medio se cambia al GM en DEV 3 para las lonchas tratadas; luego, se fijan en DEV 7-10 para su comparación con los controles. (B) Imágenes representativas comparando cortes organotípicos de SC de ratón en DEV 7 y 10 cultivados en diferentes condiciones. Las rodajas se tiñen para el neurofilamento marcador del citoesqueleto (NFL, verde). La amplia distribución de la tinción de NFL en cortes cultivados con GM sugiere una supervivencia y diferenciación general. Los núcleos se contratiñen con DAPI. Barra de escala = 500 μm. (C) Histogramas representativos de la estimación del área cubierta por NFL en los cortes que se muestran en la Figura 1B. En DEV 10, el área de superficie de la NFL disminuye en la condición de cultivo OM. Abreviaturas: DEV = día ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadena ligera de neurofilamento.; MO = medio organotípico; GM = medio de injerto; SC = médula espinal. Haga clic aquí para ver una versión más grande de esta figura.
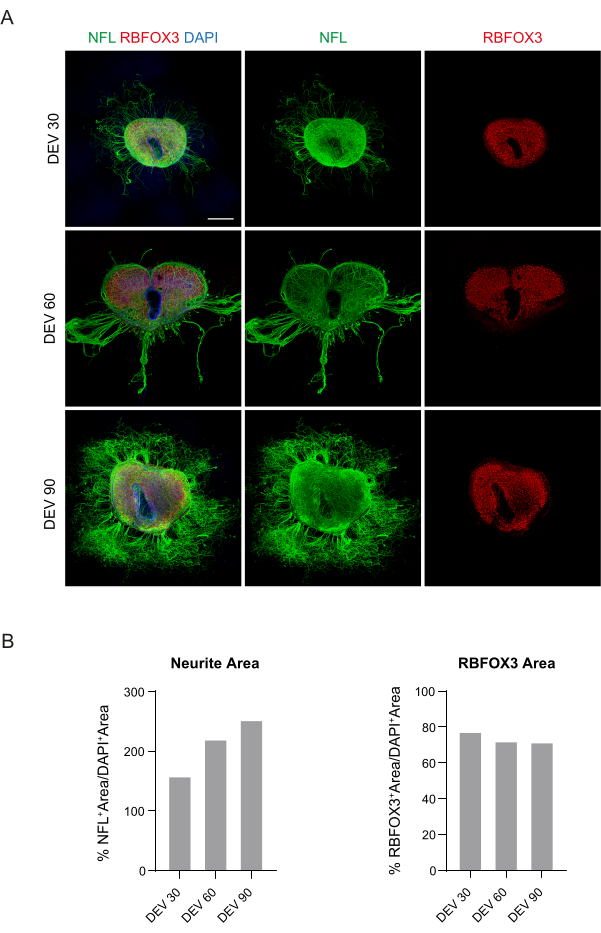
Figura 3: Cortes organotípicos SC de ratón cultivados a largo plazo. (A) Los cortes se mantienen en cultivo hasta DEV 90. El ensayo de inmunofluorescencia revela una amplia distribución del marcador citoesquelético neurofilamento (NFL, verde) y el marcador neuronal nuclear RBFOX3 (rojo), lo que atestigua su estado de salud e identidad neuronal después del cultivo a largo plazo. Cabe destacar que los axones de NFL+ brotan difusamente alrededor de las rodajas con el tiempo. Los núcleos se contratiñen con DAPI. Barra de escala = 500 μm. (B) Histogramas representativos de la estimación del área y el tiempo NFL+ y el área RBFOX3+ de los cortes que se muestran en el panel A. El área de neuritas de la NFL+ aumenta con el tiempo. Abreviaturas: DEV = día ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadena ligera de neurofilamento; SC = médula espinal; RBFOX3= ARN de unión a fox-1 homólogo 3. Haga clic aquí para ver una versión más grande de esta figura.
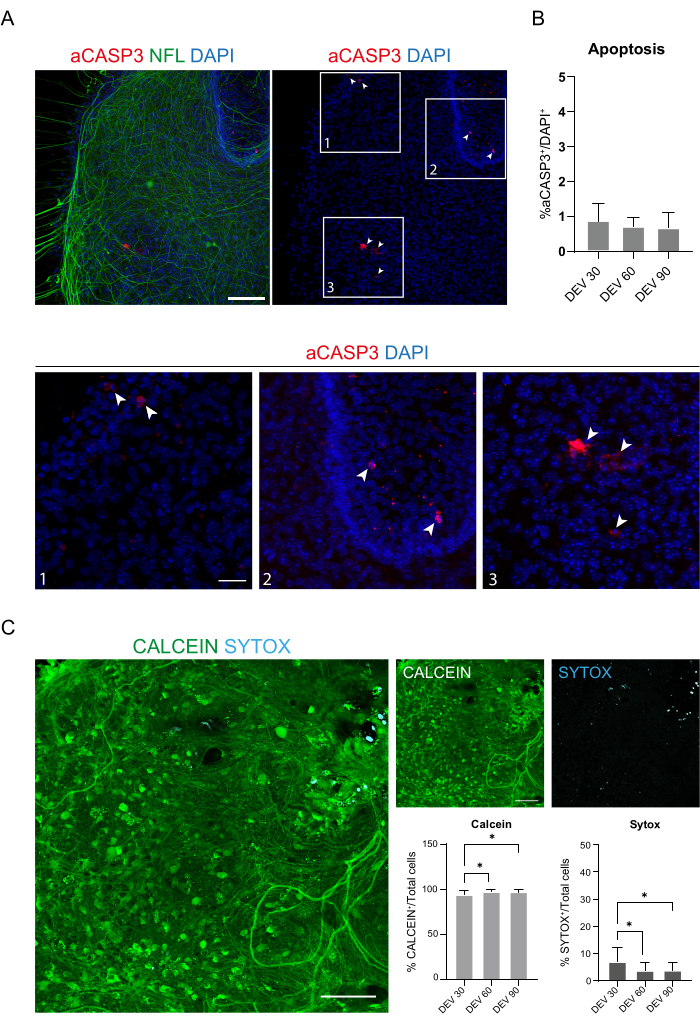
Figura 4: Evaluación de la viabilidad celular en los cortes de SC a lo largo del tiempo. (A) Imágenes representativas de cortes organotípicos en DEV 60 teñidos para aCASP3 (rojo) y NFL (verde). Barra de escala = 100 μm. NFL muestra un patrón difuso. Las células raras son positivas para el marcador apoptótico aCASP3 (Recuadros: 1-2-3). (B) Análisis de la tasa de apoptosis en cortes en diferentes momentos temporales. Media ± DE, N (réplicas) = 6 cortes, n (células totales) > 1,000 para cada corte, prueba de Kruskal-Wallis, comparación múltiple, valor p > 0.05. La tasa apoptótica es estable en el tiempo. En los recuadros 1-2-3 del panel A, es posible observar detalles de células positivas para aCASP3 (tinción roja, flechas blancas). Pequeños puntos rojos etiquetan los restos celulares y los núcleos picnóticos. Barra de escala = 50 μm. (C) Imágenes representativas de ensayos vivos/muertos realizados en cortes de SC en DEV 90: las células metabólicamente activas se marcan en verde con calceína, mientras que las células muertas y dañadas se marcan en azul claro (cian) con Sytox. Los dos histogramas muestran el porcentaje de células positivas para Calceína (a la izquierda) y Sytox (a la derecha) en el número total de células. Para ambos promedios ± DE, N (réplicas) = 6 cortes, n (celdas totales) > 1,000 para cada corte, prueba de Kruskal-Wallis, comparación múltiple, valor p de DEV 30 vs DEV 60 = 0.018; DEV 30 vs DEV 90 valor p = 0,027; El valor p de DEV 60 frente a DEV 90 > 0,99. Abreviaturas: DEV = día ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadena ligera de neurofilamento; SC = médula espinal; aCASP3 = caspasa-3 activa. Haga clic aquí para ver una versión más grande de esta figura.
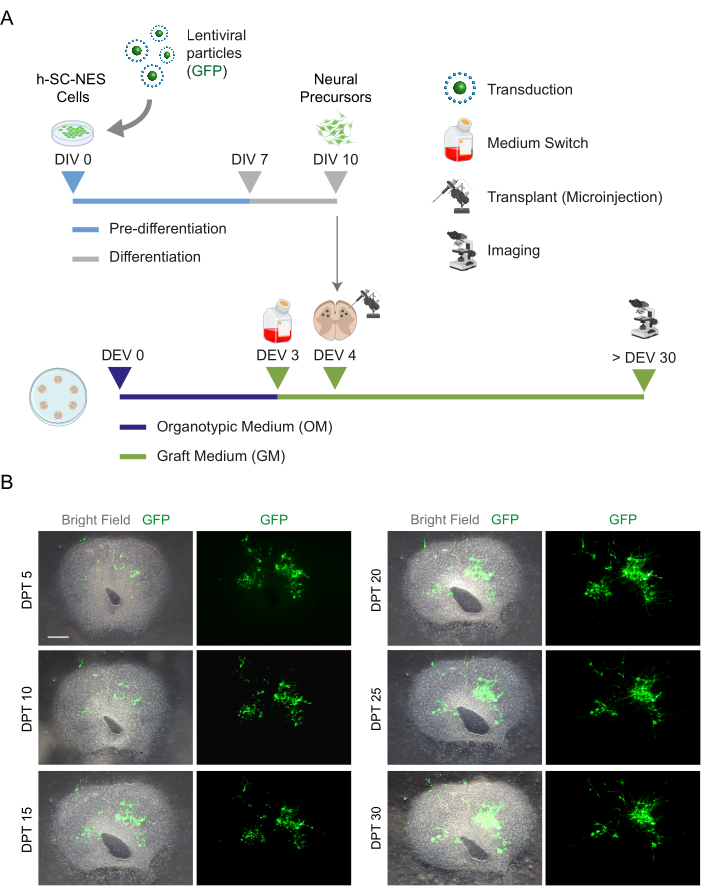
Figura 5: Trasplante de células h-SC-NES en cortes organotípicos de ratón. (A) Esquema representativo del protocolo de trasplante. Las células se trasplantan como precursores neurales en DIV 10 de diferenciación en cortes organotípicos de DEV 4. (B) Imágenes representativas de cortes organotípicos de ratón trasplantados con células h-SC-NES que expresan GFP a lo largo del tiempo hasta DPT 30. Las células se transducen con un vector lentiviral portador del gen GFP . La expresión de GFP a lo largo del tiempo confirma su viabilidad y adaptación al entorno de corte. Barra de escala = 500 μm. Abreviaturas: DIV = primer día en prediferenciación; h-SC-NES = tronco neuroepitelial derivado de la médula espinal humana; GFP = proteína verde fluorescente; DEV = día ex vivo; MO = medio organotípico; GM = medio de injerto; DPT = días después del trasplante. Haga clic aquí para ver una versión más grande de esta figura.
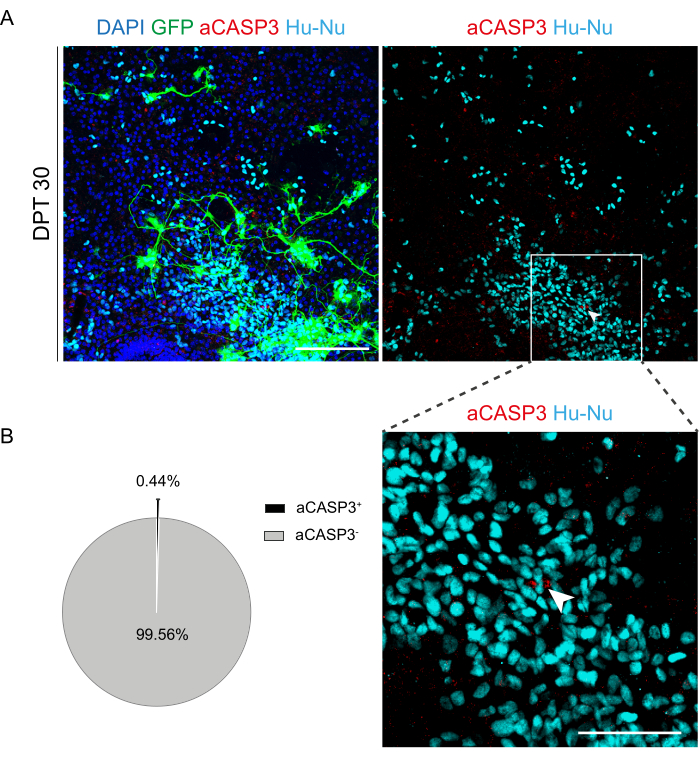
Figura 6: Evaluación de la tasa de apoptosis de las células h-SC-NES trasplantadas después de 30 días desde el trasplante. (A) Imagen representativa de un corte organotípico de ratón trasplantado con células h-SC-NES que expresan GFP. Las células se transducen con un vector lentiviral portador del gen GFP para monitorearlas en las rodajas después del trasplante. La expresión de GFP a lo largo del tiempo confirma su viabilidad y adaptación al entorno de corte. El punto de tiempo que se muestra es DPT 30; Las células se tiñen para núcleos humanos (cian) y aCASP3 (rojo). Barra de escala = 150 μm. (B) A la izquierda, gráfico circular representativo del análisis de apoptosis de células trasplantadas en cortes a DPT 30 (N (réplicas) = 5 cortes, n (células) = 5.000), y a la derecha, un recuadro de células Hu-Nu+ y un detalle de una célula positiva a aCASP3 (flecha blanca). Barra de escala = 75 μm. Pequeños puntos rojos etiquetan los restos celulares y los núcleos picnóticos. Abreviaturas: h-SC-NES = tronco neuroepitelial derivado de la médula espinal humana; GFP = proteína verde fluorescente; DPT = día después del trasplante; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadena ligera de neurofilamento; aCASP3 = caspasa-3 activa; Hu-Nu = núcleos humanos. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Composición de las soluciones utilizadas en este protocolo. Haga clic aquí para descargar esta tabla.
Discusión
Todavía no existe un tratamiento eficaz para los pacientes con LME, se han ensayado diferentes enfoques y uno de los más prometedores se basa en una estrategia regenerativa: el reemplazo celular. Actualmente, los avances en el campo de la medicina regenerativa exigen nuevas plataformas para probar la eficacia y seguridad de los trasplantes de células, solos o en combinación con otros enfoques. Su validación preclínica es esencial para llevar a cabo estudios clínicos posteriores. Los cultivos organotípicos SC son una plataforma útil para estudiar diferentes aspectos de la neurodegeneración, la regeneración neuronal y el neurodesarrollo, y para investigar la eficacia de nuevos enfoques terapéuticos23. En particular, las características específicas de los cultivos organotípicos, como el mantenimiento de la arquitectura histológica original y la composición celular y del microambiente, son ventajosas para desentrañar la dinámica del trasplante, como el injerto celular, la integración, la diferenciación y la maduración.
De acuerdo con los protocolos publicados, los cortes organotípicos SC se pueden mantener en cultivo durante aproximadamente 2-3 semanas en condiciones saludables, lo que limita su uso para las investigaciones a largo plazo y el cribado funcional requerido para los esquemas de prueba de terapia celular. Explorar procesos importantes como la diferenciación y la maduración hacia el destino correcto de las células trasplantadas dentro del tejido SC requiere un seguimiento a largo plazo. Estos procesos celulares son críticos durante los trasplantes comunes en modelos animales. La disponibilidad de un sistema ex vivo que imite muchas de las características presentes in vivo sería útil en la fase de cribado preclínico.
Por esta razón, en este trabajo proponemos un método óptimo de cultivo organotípico de SC a largo plazo (≥30 días) que permite mantener cortes de SC viables hasta por 90 días, triplicando su marco de tiempo de cultivo habitual. Además, mostramos un injerto estable de células h-SC-NES dentro de cortes de SC y el mantenimiento del cultivo de trasplante hasta por 30 días. Monitorizamos el injerto celular a lo largo del tiempo mediante la observación de la expresión de GFP para verificar la supervivencia celular hasta DPT 30. Después de 30 DPT, se evaluó la tasa de apoptosis celular. En la literatura, se ha descrito la evaluación de la apoptosis de células h-SC-NES trasplantadas en cortes de SC a 7 DPT40. Aquí, ampliamos el análisis de apoptosis celular en DPT 30 para comparar la tasa apoptótica con respecto al punto de tiempo anterior (DPT 7). Descubrimos que nuestros datos están en línea con la literatura, lo que sugiere que las células h-SC-NES trasplantadas sobreviven también en un momento posterior si se mantienen en la condición de cultivo optimizada en nuestro trabajo. Esta plataforma ex vivo mejorada a largo plazo, por sí sola y en la configuración de trasplante, ayudará a los investigadores en el cribado preclínico de trasplantes basados en células madre para la LME. Esto les permitirá identificar la mejor célula candidata para futuros estudios in vivo que promuevan el éxito de los trasplantes. Además, después del cribado inicial, los cortes organotípicos de SC también podrían utilizarse en paralelo a los estudios in vivo para confirmar y corroborar la dinámica y los comportamientos celulares a largo plazo observados en modelos animales o para apoyar estudios mecanicistas.
Nuestro protocolo describe en detalle cómo generar este modelo organotípico a largo plazo, pero también se deben discutir algunos pasos críticos. En cuanto a la generación de los cultivos organotípicos SC, existen algunos desafíos durante la cirugía y las primeras etapas del cultivo. Un procedimiento quirúrgico bien realizado es esencial para generar cortes que mantengan la histoarquitectura original. Si el SC se arruina durante el aislamiento, los cortes pueden perder su estructura anatómica típica y el daño tisular puede inducir un daño proinflamatorio excesivo que conduce a condiciones insalubres y a la muerte celular. La fase más desafiante durante la cirugía es la extracción del SC de la columna vertebral y la extirpación de las meninges del SC aislado. El éxito de estos pasos depende de la experiencia del operador; Por lo tanto, se recomienda un período de entrenamiento antes de comenzar con los experimentos.
El corte coronal del SC a través de un picador también es una fase desafiante. El SC aislado debe colocarse en la plataforma de corte exactamente perpendicular a la cuchilla. El operador también debe colocar la cuchilla perpendicularmente a la plataforma de corte. Estas precauciones son necesarias para garantizar la generación de cortes reproducibles entre el mismo experimento y experimentos diferentes. Otra cuestión importante es que el tiempo para la cirugía es limitado: todo el procedimiento de generación de cortes debe durar ~30 minutos. Si el operador dedica más tiempo a la cirugía y al corte, el tejido SC se verá afectado y esto puede perjudicar el éxito del cultivo y los siguientes pasos del experimento.
Una vez que las rodajas se colocan en la membrana de cultivo, es importante alimentarlas correctamente. El GDNF es necesario para mantener la recuperación y la supervivencia de los tejidos. El corte con una picadora es traumático para el tejido y, por esta razón, las rodajas se colocan poco después del corte en un medio de disección helado para limpiar el exceso de moléculas proinflamatorias y promotoras de la muerte. A continuación, se colocan cortes en las membranas de cultivo (insertos de cultivo celular) con medio fresco modificado con GDNF para promover una recuperación más rápida y la adhesión del corte a la membrana. El GDNF debe añadirse al medio todos los días durante la primera semana de cultivo debido a su corta vida media50,51. Observamos que los cortes necesitan la presencia continua de GDNF durante los primeros días de cultivo para promover la recuperación y viabilidad del tejido. En cualquier caso, dado que la presencia de GDNF es importante durante todo el período de cultivo, se desaconseja encarecidamente interrumpir la administración de GDNF en otros momentos.
Durante la primera semana en cultivo, también es importante revisar macroscópicamente las rodajas a ojo y al microscopio. El tejido translúcido y la transparencia de los bordes son signos de una correcta adhesión de las rodajas a la membrana y de tejido viable. El tejido necrótico aparecerá extremadamente blanco a primera vista macroscópica y las áreas necróticas aparecerán gris oscuro en el microscopio. Después de algunas semanas en cultivo, la morfología del tejido puede cambiar: los movimientos celulares y la adhesión del tejido a la membrana pueden influir en este proceso. Observamos, por ejemplo, la pérdida de la luz central en algunos cortes llenos de células y la pérdida de la morfología del asta dorsal y ventral. Esto sucede principalmente con rebanadas más pequeñas, mientras que la mayoría de ellas mantendrán una estructura anatómica cercana a la original. Los cortes suelen generarse a partir de las regiones lumbar o torácica porque de esta manera pueden tener el tamaño adecuado para mantener su histoarquitectura original a lo largo del tiempo: si son demasiado pequeños, pierden su arquitectura mientras que, si son demasiado grandes, la región central puede sufrir una necrosis. Así, utilizamos la región lumbar de las crías de ratón para generar rodajas con el tamaño adecuado para un cultivo óptimo a largo plazo pero, en principio, se pueden considerar otros segmentos. Además, optamos por utilizar la región lumbar, porque las regiones ventral y dorsal son más distinguibles entre sí. Además, esta región presenta áreas de tejido con un mayor porcentaje de neuronas motoras y sustancia gris, que son sitios de interés para las terapias de reemplazo celular en la LM. En cuanto al trasplante de células en los cortes, el problema principal está relacionado con la rotura de la punta de la microaguja de vidrio. Si el orificio para el paso de las células es demasiado grande, puede causar daño al tejido SC durante la microinyección. Si es demasiado pequeño, el apilamiento de células puede obstruir la aguja, dificultando el proceso de trasplante. El procedimiento de trasplante debe completarse dentro de 1 hora para minimizar el sufrimiento y la muerte celular.
El protocolo propuesto proporciona una herramienta óptima y versátil para diferentes tipos de investigaciones. Aquí, aplicamos nuestra plataforma a largo plazo para validar el trasplante de células h-SC-NES en las primeras etapas de diferenciación dentro del tejido SC de ratón durante 30 días. La principal novedad del enfoque propuesto es la optimización del protocolo de co-cultivo. Los componentes de la GM mantienen la supervivencia neuronal a largo plazo de las células SC y de las células h-SC-NES trasplantadas. En efecto, la transgénico, al ser un medio libre de suero, sostiene la diferenciación de las células trasplantadas hacia el destino neuronal con respecto al medio utilizado previamente para el cultivo de cortes organotípicos47.
En cuanto a los modelos propuestos para la LME, los experimentos se suelen realizar en ratones adultos. Hasta el momento, las diferencias más importantes entre el SC neonatal y el adulto están relacionadas con el mayor potencial regenerativo encontrado en el neonatal con respecto a los ratones adultos52. Sin embargo, tales diferencias no tienen ningún impacto en el tipo de protocolo que estamos proponiendo, ya que aquí nos centramos en la respuesta de las células injertadas al entorno del tejido huésped más que en las capacidades de regeneración de las neuronas residentes. Otra diferencia entre ratones neonatos y adultos después de una lesión de la médula espinal está relacionada con la formación de la cicatriz glial que se produce en los adultos. Este aspecto no se tiene en cuenta en el modelo propuesto, que no considera los complejos procesos fisiopatológicos derivados de lesiones primarias y secundarias.
En cuanto a las aplicaciones, la plataforma también podría utilizarse para investigar la integración entre las células trasplantadas con circuitos residentes presentes en el modelo organotípico SC. Las herramientas de ingeniería genética ya se utilizaban en el SNC para evaluar la conectividad sináptica y podrían ser explotadas en este sentido 53,54,55. En particular, la integración podría investigarse y validarse evaluando la formación de sinapsis entre las células injertadas y el tejido SC ex vivo. Estos cultivos organotípicos a largo plazo también podrían aprovecharse para probar agentes neuroprotectores y neuroregenerativos o nuevas moléculas/materiales o para estudiar trastornos neurodegenerativos que involucren al SC. Para estudiar trastornos neurodegenerativos específicos, es necesario adaptar el protocolo para cultivar cortes de SC generados a partir de modelos relevantes, como ratones transgénicos portadores de mutaciones asociadas a patologías específicas, en la etapa relevante para la patología (es decir, neonatal, juvenil, adulto). En conclusión, nuestro protocolo y los cultivos organotípicos en general, al ser explantes de un órgano específico, presentan características que cierran la brecha entre los cultivos celulares 2D y los modelos in vivo, confirmándolos como una herramienta invaluable tanto para la investigación básica como para las pruebas preclínicas.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
El estudio contó con el apoyo de la Fundación Wings for Life (WFL-IT-20/21), el Plan Nacional de Recuperación y Resiliencia (NRRP) de la Unión Europea de Próxima Generación de la UE-misión 4 componente 2, inversión n. 1.4-CUP N. B83C22003930001 (Tuscany Health Ecosystem-THE, Spoke 8), y el Marina Romoli Onlus. Este manuscrito refleja únicamente los puntos de vista y opiniones de los autores, ni la Unión Europea ni la Comisión Europea pueden ser consideradas responsables de los mismos. Los datos y metadatos están disponibles en Zenodo 10.5281/zenodo.10433147. Las imágenes se generaron con Biorender https://www.biorender.com/.
Materiales
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
Referencias
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados