Method Article
Cultura de fatias organotípicas da medula espinhal de camundongo de longo prazo como plataforma para validação de transplante de células em lesão medular
Neste Artigo
Resumo
Neste artigo, fornecemos um método reprodutível para gerar e manter fatias organotípicas da medula espinhal de longo prazo transplantadas com células-tronco neurais como um modelo ex vivo para testar terapias de reposição celular.
Resumo
Faltam curas resolutivas para as lesões medulares (LMEs), devido à complexa fisiopatologia. Uma das abordagens regenerativas mais promissoras é baseada no transplante de células-tronco para repor o tecido perdido e promover a recuperação funcional. Esta abordagem deve ser melhor explorada in vitro e ex vivo para segurança e eficácia antes de prosseguir com testes em animais mais caros e demorados. Neste trabalho, mostramos o estabelecimento de uma plataforma de longo prazo baseada em fatias organotípicas da medula espinhal (SC) de camundongos transplantadas com células-tronco neurais humanas para testar terapias de substituição celular para LMEs.
As culturas organotípicas SC padrão são mantidas por cerca de 2 ou 3 semanas in vitro. Aqui, descrevemos um protocolo otimizado para manutenção de longo prazo (≥30 dias) por até 90 dias. O meio usado para cultura de longo prazo de fatias SC também foi otimizado para transplante de células-tronco neurais para o modelo organotípico. As células-tronco neuroepiteliais derivadas de SC humano (h-SC-NES) carregando um repórter de proteína fluorescente verde (GFP) foram transplantadas em fatias de SC de camundongo. Trinta dias após o transplante, as células ainda apresentam expressão de GFP e baixa taxa apoptótica, sugerindo que o ambiente otimizado sustentou sua sobrevivência e integração dentro do tecido. Este protocolo representa uma referência robusta para testar eficientemente terapias de reposição celular no tecido SC. Esta plataforma permitirá aos investigadores realizar uma pré-triagem ex vivo de diferentes terapias de transplante celular, ajudando-os a escolher a estratégia mais adequada antes de prosseguirem com as experiências in vivo .
Introdução
A lesão medular traumática (LM) tem consequências físicas, psicológicas e econômicas devastadoras para pacientes e cuidadores1. Muitas tentativas foram feitas para promover a regeneração axonal na LME com diferentes abordagens 2,3,4 e alguns efeitos benéficos foram demonstrados pela formação de relés neuronais entre neurônios proximais e distais no local da lesão por meio de terapias de substituição celular. O interesse em terapias celulares ainda está crescendo5, uma vez que as células transplantadas podem desempenhar muitos papéis, incluindo suporte trófico, modulação imunológica, regeneração de circuitos neurais perdidos por meio da indução de plasticidade, substituição celular e remielinização do axônio6.
Recentemente, o principal esforço no campo se concentrou em células-tronco neurais / progenitoras humanas (NSCs / NPCs) 7. Vários estudos sugerem que NSCs/NPCs modulam a resposta dos astrócitos8, promovem a secreção de fatores pró-regenerativos 9,10 e substituem células neuronais ausentes na LME11,12. No entanto, estudos que apoiam a diferenciação de células transplantadas em neurônios funcionais ainda são pobres. Além disso, a sobrevivência e diferenciação das células transplantadas na medula espinhal lesada (SC) são baixas13, possivelmente porque as células transplantadas levam várias semanas, até meses, para se diferenciar in vivo. Além disso, os estudos atuais não elucidaram completamente muitos aspectos bioquímicos, moleculares, celulares e funcionais das terapias de reposição celular. Nesse contexto, modelos simples, rápidos e econômicos são necessários para estudar os mecanismos de enxerto celular, a capacidade das células enxertadas de proliferar, diferenciar-se em tipos específicos ou subpopulações de células e formar sinapses com neurônios residentes.
A integração de estudos histológicos no registro eletrofisiológico e no perfil do transcriptoma e do proteoma é necessária para uma compreensão completa da cascata molecular que ocorre após o transplante de células. Isso certamente acelerará o projeto e a validação de novas terapias de reposição celular em modelos pré-clínicos e estudos clínicos. De fato, até o momento, o uso de roedores, animais de grande porte e primatas não humanos tem valido a pena para elucidar muitos processos celulares após o transplante14. No entanto, devido ao alto custo, ao alto impacto ético, bem como à complexidade do organismo, seu uso muitas vezes não é simples ou inadequado para desvendar processos bioquímicos e moleculares. Além disso, podem apresentar muitas desvantagens correlacionadas com diferenças biológicas, tanto interespécies (metabolismo) quanto variabilidade intraespécies (sexo, idade). Esses fatores, juntamente com fatores externos, como situações estressantes, podem alterar o resultado de um experimento e sua previsibilidade em termos de tradução terapêutica para humanos 15,16,17.
Assim, muitos grupos empregam cultura de células in vitro 2D e fatias organotípicas ex vivo (culturas ex vivo), além de modelos animais. A cultura de células 2D é o sistema mais comumente usado para estudar processos biológicos específicos em um nível de célula única e/ou população de células. No entanto, as culturas de células de monocamada não refletem a complexidade encontrada em um organismo inteiro. A falta de estruturas teciduais e ambiente fisiológico não permite que os sistemas de cultura 2D emulem completamente os principais aspectos estruturais, morfológicos e funcionais do tecido investigado 18,19,20.As culturas organotípicas podem superar alguns desses problemas. Os modelos organotípicos baseiam-se no explante de um fragmento de um tecido ou órgão e na sua manutenção ex vivo por um período limitado21,22. Em particular, fatias do tecido explantado são geradas com uma espessura precisa que permite que os nutrientes cheguem facilmente a quase todas as células das fatias. Podem ser gerados a partir de várias regiões do sistema nervoso central, como hipocampo, hipotálamo, cerebelo, tálamo, córtex cerebral, substância negra e estriado e medula espinhal23. As culturas organotípicas retêm a arquitetura do tecido, a distribuição espacial das células, a diversidade celular e o ambiente (ou seja, composição da matriz extracelular) do órgão de origem. Além disso, eles preservam a atividade neural original, as conexões entre as células e, em particular, os circuitos de curta distância após o explante.
Esses aspectos fornecem algumas vantagens para culturas ex vivo em relação a culturas de monocamada e modelos animais. Eles mantêm as principais características teciduais encontradas in vivo, mas com a redução dos custos e a possibilidade de realizar diferentes tipos de experimentos moleculares, celulares e funcionais com uma regulação precisa dos parâmetros ambientais da cultura 24,25,26,27,28,29. Fatias organotípicas também podem ser exploradas para desenvolver modelos para diferentes distúrbios neurológicos, assemelhando-se às principais características histopatológicas de condições específicas30. Além disso, a retenção do ambiente original do tecido multicelular os torna plataformas apropriadas para triagem de drogas e para testar moléculas e materiais neuroprotetores e neuro-regenerativos.
Neste trabalho, propomos o uso de culturas organotípicas SC como modelo para otimizar transplantes de NSC. Isso não é trivial, pois são necessárias condições ideais de cultura para garantir a sobrevivência do hospedeiro (tecido SC) e do transplante (NSCs) por semanas. Diferentes grupos de pesquisa enxertados em culturas organotípicas, derivadas do cérebro e derivadas de SC, vários tipos de células. A maioria dos trabalhos mostrou o transplante de células-tronco mesenquimais 31,32,33, células de revestimento olfativo 34 ou NSCs 35,36,37,38,39,40 e avaliou as interações das células enxertadas com as células hospedeiras, a sobrevivência de todo o sistema e se as células transplantadas se diferenciaram em neurônios ou células semelhantes a neurônios dentro do ambiente tecidual ex vivo 32,33,41. Alguns deles avaliaram o potencial regenerativo das células após o transplante, observando seu crescimento axonal dentro do tecido 37,40,41, a capacidade mielinizante de precursores enxertados de oligodendrócitos 42, a migração de células enxertadas para o tecido hospedeiro43 e se as células transplantadas liberaram fatores que impulsionam um ambiente pró-regenerativo31. Uma limitação dos estudos atuais é que eles não exploram o enxerto por um período de longo prazo.
Considerando que os NSCs parecem exigir várias semanas para se diferenciar in vivo44,45, este estudo se concentra em como gerar e manter fatias de SC de camundongo de longo prazo (≥30 dias) por até 90 dias. Verificou-se que as fatias mantêm sua estrutura anatômica original e mantêm uma taxa apoptótica baixa e estável ao longo do tempo e alta viabilidade celular. Observamos expressão difusa dos marcadores neuronais RNA binding fox-1 homólogo 3 (RBFOX3) e cadeia leve de neurofilamento (NFL), com este último mostrando uma tendência crescente de brotamento axonal ao redor das fatias ao longo do tempo, atestando sua condição saudável. Além disso, transplantamos com sucesso para as fatias SC células-tronco neuroepiteliais derivadas de SC humanas que expressam GFP (h-SC-NES) nos primeiros estágios da diferenciação neuronal. O enxerto NSC foi mantido por 30 dias após o transplante e as células apresentaram expressão de GFP durante todo o período em cultura. A taxa apoptótica de células no dia pós-transplante (DPT) 30 também foi encontrada em linha com o valor da taxa apoptótica observada no DPT 7 nas mesmas células40. As células pareciam enxertar no ambiente do tecido e sobreviveram por várias semanas.
Em resumo, nossos dados demonstram que é possível manter em cultura cortes organotípicos SC por 3 meses sem comprometer sua citoarquitetura original e o ambiente tecidual. Mais importante ainda, eles podem ser explorados para testar terapias celulares antes de prosseguir com um experimento in vivo , reduzindo assim os custos e o tempo experimental. Aqui, ilustramos em detalhes todas as passagens para gerar fatias organotípicas SC de camundongos e como mantê-las por períodos de longo prazo (≥30 dias). Além disso, explicamos profundamente como realizar o transplante de NPC nas fatias e como mantê-las para análise a jusante.
Protocolo
Os procedimentos em animais foram realizados em estrita conformidade com os protocolos aprovados pelo Ministério da Saúde Pública italiano e pelo Comitê de Ética local da Universidade de Pisa, em conformidade com a Diretiva 2010/63/UE (licença do projeto nº 39E1C. N.5Q7 lançado em 30/10/2021). Camundongos C57BL/6J foram mantidos em ambiente regulado (23 ± 1 °C, 50 ± 5% de umidade) com ciclo claro-escuro de 12 h com comida e água ad libitum.
Todo o trabalho relacionado às células h-SC-NES foi realizado de acordo com as diretrizes do NIH para aquisição e distribuição de tecido humano para fins de pesquisa biomédica e com aprovação dos Comitês de Investigação em Humanos e Comitês de Ética Institucionais de cada instituto de onde as amostras foram obtidas. A aprovação final foi obtida do Comitê de Bioética da Universidade de Pisa (Parecer nº 29/2020). Espécimes humanos não identificados foram fornecidos pela concessão conjunta MRC / Wellcome Trust (099175 / Z / 12 / Z), Human Developmental Biology Resource (www.hdbr.org). O consentimento informado apropriado foi obtido e todas as informações não identificáveis disponíveis foram registradas para cada espécime. O tecido foi manuseado de acordo com as diretrizes e regulamentos éticos para o uso de pesquisa de tecido cerebral humano estabelecidos pelo NIH (http://bioethics.od.nih.gov/humantissue. html) e pela Declaração de Helsinque da WMA (http://www.wma.net/en/30publications/10policies/b3/index.html).
1. Preparação de soluções e equipamentos para isolamento e cultura da medula espinhal (SC)
- Solução de revestimento para insertos de membrana
- Prepare a solução de revestimento (Tabela 1): uma solução aquosa com 0,1 mg mL-1 de colágeno, 0,01 mg mL-1 de poli-L-lisina e 0,01 mg mL-1 de laminada.
- Coloque cada inserção de membrana em um prato de 35 mm ou em uma placa de 6 poços.
- Adicionar ao topo da membrana 1 mL de solução de revestimento: incubar a solução por 4 h à temperatura ambiente (RT); em seguida, remova-o e deixe a inserção da membrana secar durante a noite (ON). Conservar as membranas a 4 °C até à sua utilização.
NOTA: Todas as passagens devem ser realizadas em condições estéreis. O revestimento da membrana deve ser conservado por no máximo 1 semana a 4 °C antes do uso para evitar a degradação da proteína e a adesão do corte abaixo do ideal à membrana.
- Preparação do meio: meio organotípico, meio de dissecação, meio de enxerto
- Preparar o meio organotípico (OM, Tabela 1).
- Prepare o meio de dissecção conforme descrito na Tabela 1.
- Preparar o meio de enxerto (GM, otimizado de Onorati et al.46, Tabela 1).
NOTA: As soluções devem ser preparadas em condições estéreis e imediatamente antes de seu uso (1 dia antes ou no mesmo dia do experimento).
- Preparação de material para cirurgia
- Na cabine de biossegurança, mantenha prontos para uso: o estereomicroscópio de dissecção e os instrumentos cirúrgicos: dois pares de microtesouras, dois pares de pinças retas e dois pares de pinças curvas.
- No gabinete de biossegurança, prepare o instrumento picador equipando-o com uma lâmina para cortar o SC em fatias. Gire um parafuso do picador para levantar o braço metálico onde a lâmina deve ser colocada. Coloque a lâmina no local designado, abaixe o braço metálico com a lâmina até que entre em contato com a plataforma de corte e fixe-o apertando o parafuso de fixação com uma chave sextavada até que a lâmina esteja firmemente presa. Gire o parafuso micrométrico para a espessura de corte desejada (geralmente 350 μm). Verifique se a lâmina está colocada precisamente perpendicularmente à plataforma de corte.
NOTA: A colocação precisa perpendicular da lâmina em relação à plataforma de corte é necessária para realizar o corte corretamente. - Prepare na cabine de biossegurança: duas pipetas de plástico Pasteur (necessárias para mover o SC isolado e as fatias), pelo menos quatro pratos de 35 mm e dois de 60 mm e uma caixa de gelo fresco.
- Esterilize todos os instrumentos com etanol a 70% e UV (um ciclo de 20 min) imediatamente antes de seu uso para preservar a esterilidade da cultura.
2. Isolamento de SC de camundongo e geração de fatias
- Isolamento de SC de camundongo
- Sacrifique filhotes de camundongos pós-natal no dia 3 (P3) de acordo com a licença do projeto.
- Através de uma laparotomia de linha média com a microtesoura, isole a região lombar da coluna vertebral do resto do corpo do camundongo e coloque-a em um meio de dissecção a frio em uma placa de 35 mm.
- Usando um estereomicroscópio de dissecção e a microtesoura, corte a espinha dorsal ao longo do eixo sagital e use uma pinça reta para remover suavemente o SC da cavidade da espinha dorsal.
- Retire cuidadosamente as meninges da região lombar isolada do SC usando uma pinça reta.
- Transfira e incube a região lombar SC isolada em meio de dissecção frio e fresco por 10-15 min antes de prosseguir com a etapa seguinte.
- Geração de fatias
- Usando uma pipeta Pasteur de plástico, pegue a região lombar SC isolada do meio de dissecção e coloque-a na plataforma de corte do instrumento picador, perpendicularmente à lâmina.
NOTA: O posicionamento correto do SC em relação à lâmina (perpendicular) é essencial para gerar fatias de SC corretamente. - Remova o meio de dissecção residual no convés ao redor do SC com a ajuda da pipeta Pasteur e papel absorvente estéril. Prossiga com o seccionamento automatizado SC.
- Assim que as fatias forem geradas, coloque um meio de dissecação fresco com uma pipeta Pasteur na plataforma de corte com as fatias. Em seguida, recolher as fatias para uma placa de 35 mm com meio de dissecção fresco e incubá-las durante 15 min.
- Durante a incubação das fatias, lave a superfície das inserções da membrana 3x com OM usando uma pipeta Pasteur de plástico. Em seguida, deixe 1 mL de OM na parte inferior de cada inserção de membrana.
- Verifique as fatias sob o estereomicroscópio de dissecação. Semeie o número desejado de fatias nas inserções de membrana condicionadas, transferindo-as com uma pipeta de plástico Pasteur.
- Mova as fatias na orientação preferida e na posição desejada para as inserções da membrana com a ajuda das pinças retas. Remova o excesso de meio com uma pipeta Pasteur para permitir que as fatias adiram melhor à superfície da membrana.
NOTA: Mover e orientar as fatias com a pinça reta deve ser realizado suavemente para evitar danos ao tecido ou à inserção da membrana. - Após 30 min de incubação a 37 °C, transferir o inserto para uma nova placa de Petri.
NOTA: Toque no anel de plástico, mas não nas membranas durante a troca média. - Adicione 1 mL de MO fresco suplementado com fator neurotrófico derivado da linhagem de células gliais (GDNF) 100 ug mL-1 na parte inferior da inserção da membrana.
- Incubar as fatias a 37 °C. Referir-se ao primeiro dia na cultura como dia ex vivo (DEV) 0.
- Usando uma pipeta Pasteur de plástico, pegue a região lombar SC isolada do meio de dissecção e coloque-a na plataforma de corte do instrumento picador, perpendicularmente à lâmina.
3. Cultura a longo prazo de fatias organotípicas
- Manter as fatias em cultura a 37 °C até aos momentos desejados.
- Substitua o meio por OM novo no DEV 1 conforme descrito nas etapas 2.2.7 a 2.2.8.
- No DEV 3, mude o meio para o GM para criar o ambiente apropriado para o transplante de células-tronco no dia seguinte. Substitua o meio por GM novo a cada 48 h (por exemplo, DEV 5, DEV 7...).
- Adicionar GDNF fresco (concentração final de 100 μg mL-1) ao meio todos os dias até DEV 7. Após o DEV 7, adicione-o somente quando a mídia for alterada (etapa 3.3).
4. cultura de células h-SC-NES
NOTA: as células h-SC-NES são mantidas em cultura na presença de fatores de crescimento (meio NES, etapa 4.1.1). Antes do transplante, as células são plaqueadas em condição de pré-diferenciação por 7 dias, removendo os fatores de crescimento do meio (meio de pré-diferenciação: meio NES sem fator de crescimento de fibroblastos 2 (FGF-2) e fator de crescimento epidérmico (EGF), etapa 4.1.2). Em seguida, as células são plaqueadas em condição de diferenciação (meio de diferenciação, etapa 4.1.3) por 2 dias antes do transplante. A diferenciação é apoiada pela adição de suplementos neurotróficos (fator neurotrófico derivado do cérebro, BDNF) ao meio de diferenciação. A manutenção, a divisão, a pré-diferenciação e a diferenciação das células h-SC-NES12,46 são descritas em detalhes a seguir.
- Preparação de meios: NES, meios de pré-diferenciação e diferenciação
- Prepare o meio de manutenção das células h-SC-NES (meio NES, Tabela 1).
- Preparar o meio de pré-diferenciação das células h-SC-NES (meio de pré-diferenciação, quadro 1).
- Prepare o meio de diferenciação celular h-SC-NES (Meio de diferenciação, Tabela 1). Adicione BDNF recentemente quando o meio for trocado ou quando as células forem plaqueadas pela primeira vez na condição de diferenciação.
NOTA: Todos os meios devem ser preparados em condições estéreis e devem ser filtrados com filtros de 0,22 μm.
- Solução de revestimento para células h-SC-NES
NOTA: as células h-SC-NES são mantidas em suportes de cultura revestidos com POLFN (POLFN = Poli-L-Ornitina, Laminina, Fibronectina).- Prepare a solução de revestimento em um tubo: uma solução de poli-L-ornitina com laminina (5 μg mL−1) e fibronectina (1 μg mL−1).
- Transfira a solução de revestimento preparada para o suporte de cultura de células, tomando cuidado para adicionar o suficiente para cobrir toda a superfície do suporte de cultura de células. Incubar o revestimento durante 1 h a 37 °C ou durante a noite a 4 °C.
- Remova a solução de revestimento dos suportes de cultura de células.
NOTA: A solução de POLFN pode ser reciclada mais duas vezes, mas a laminina e a fibronectina devem ser adicionadas frescas a cada vez. - Lave o revestimento 3x com água estéril de grau de cultura de células. Armazene os revestimentos a 4 °C ou use-os.
NOTA: Os revestimentos devem ser usados dentro de 1 semana. Depois disso, os revestimentos são considerados vencidos devido aos processos de degradação das proteínas adicionadas.
- Manutenção da célula h-SC-NES
- Manter as células h-SC-NES em cultura em meio NES. Verifique as células todos os dias ao microscópio para monitorar quando elas atingem a confluência.
- Troque meio meio meio a cada 2 dias: remova metade do meio condicionado e adicione o novo (considere 20% de taxa de evaporação).
- Se as células atingirem a confluência, prossiga com a divisão, conforme descrito na etapa 4.4.
- passagem de células h-SC-NES
NOTA: As células são divididas da seguinte forma12:- Remova o meio condicionado e lave as células uma vez com solução salina tamponada com fosfato de Dulbecco (DPBS) sem Ca2+/Mg2+.
- Remova o DPBS e adicione solução de tripsina / EDTA às células para realizar o descolamento enzimático. Incubar as células a 37 °C durante 30 s a 1 min.
- Após a incubação, verifique as células ao microscópio: se não estiverem destacadas, bata levemente no suporte da cultura de células para realizar o descolamento mecânico e incube-as a 37 ° C por mais 30 s.
- Após a incubação, inative a tripsina / EDTA adicionando 4 volumes de solução de DPBS / soro fetal bovino (FBS) (10% vol / vol) ao suporte de cultura de células com células e tripsina / EDTA. Pipete suavemente a solução na superfície de suporte da cultura de células para cima e para baixo para ajudar todas as células a se separarem. Recolha a suspensão celular em um tubo.
- Centrifugue a suspensão celular a 200 × g por 3 min. Rejeitar o sobrenadante e ressuspender o sedimento em meio NES fresco.
- Contar as células e colocá-las em placas em cada novo suporte de cultura revestido com POLFN a uma densidade de ̴0,5-1 × 105 células/cm2.
- Adicionar Y-27632 (10 μM) e colocar as células a 37 °C. Verifique-os todos os dias até a confluência e, em seguida, divida-os novamente para manutenção/expansão ou banco de células.
- Pré-diferenciação de células h-SC-NES
- Divida as células conforme descrito na etapa 4.4.
- Colocar as células nos suportes de cultura de células revestidas com POLFN a uma densidade de ̴0,5-1 × 105 células/cm2 em meio de pré-diferenciação. Adicionar Y-27632 (10 μM) após a divisão. Chame o primeiro dia de dia de pré-diferenciação in vitro (DIV) de 0.
- Troque metade do meio a cada 2-3 dias (consulte a etapa 4.3.2).
- Manter as células em condições de pré-diferenciação até à DIV 7 e, em seguida, avançar para o passo 4.6.
- Diferenciação de células h-SC-NES
- Na DIV 7 de pré-diferenciação, dividir as células conforme descrito no passo 4.4.
- Plaquear as células em suportes de cultura de células revestidas com POLFN a uma densidade de ̴1-1,5 × 105células/cm2em meio de diferenciação. Adicione Y-27632 (10 μM) e BDNF (30 ng mL−1) após a divisão.
- Após 2 dias de diferenciação (DIV 10), divida as células para o transplante em fatias.
5. Transdução de células h-SC-NES com vetores lentivirais portadores de GFP
NOTA: A transdução celular é realizada durante a fase de manutenção das células h-SC-NES. Quando as células são transduzidas corretamente, elas podem ser expandidas e os protocolos de pré-diferenciação e diferenciação descritos anteriormente são aplicados (etapas 4.5 e 4.6).
- Preparação do meio de transdução celular
NOTA: O meio de transdução celular é preparado misturando um volume específico de meio NES e um volume preciso de preparação de estoque de vetor lentiviral (LVS) de acordo com diferentes parâmetros: o MOI desejado (multiplicidade de infecção = razão entre o número de partículas virais e o número de células hospedeiras em um determinado meio de infecção); o número de células plaqueadas; a concentração inicial de preparação do LVS (= LVS PFU, unidade formadora de placa); A superfície do recipiente de cultura utilizado.- Calcular o volume correto de preparação do LVS a ser adicionado ao meio NES, de acordo com o MOI escolhido, usando as equações (1) e (2).
(n células para placa/cm2) × cm2 de suporte de cultura celular × MOI = LVS PFU para o MOI escolhido (1)
LVS PFU: Tot Initial LVS Vol (μL) = LVS PFU para MOI: LVS Vol para adicionar ao meio (μL)(2)
NOTA: A UFP LVS (UFP inicial do LVS) e o volume total inicial do LVS são fornecidos pelo fabricante. O LVS PFU para o MOI escolhido é calculado conforme descrito na equação (1). Assim, podemos obter o volume de preparação de LVS que deve ser adicionado ao volume total do meio NES (com base no suporte de cultura celular) para o MOI escolhido, conforme descrito na equação (2).
Exemplo: Usamos o MOI 3, com base na experiência anterior de laboratório (o MOI pode variar dependendo da linhagem celular usada e da preparação viral). Se o MOI desejado for 3, o número de células a serem plaqueadas é de 0,5 × 105/cm2, e o suporte de cultura é um 1 poço-MW24 (2 cm2), assumindo que o LVS PFU/TU inicial (unidade formadora de placa/unidade transdutora) é 25 × 106 PFU em 1 mL (1.000 μL = LVS vol inicial), os cálculos são os seguintes:
Células semeadas em 1 poço-MW24 (2 cm2) = 0,5 × 105 células × 2 cm2 = 1 × 105 células
1 × 105 células × 3 (MOI) = 3 × 105 PFU = LVS PFU para MOI 3
25 × 106 PFU:1.000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = volume LVS para adicionar ao meio
Assim, para transduzir as células com meio de transdução celular com MOI 3 em 1 poço-MW24, adicione 12 μL de preparação inicial de LVS ao meio NES (238 μL) preparado para 1 poço de MW24. O volume total final é de 250 μL.
NOTA: O meio é geralmente preparado na hora no dia da transdução em condições estéreis.
- Calcular o volume correto de preparação do LVS a ser adicionado ao meio NES, de acordo com o MOI escolhido, usando as equações (1) e (2).
- Protocolo de transdução h-SC-NES
- Células h-SC-NES em uma passagem baixa em placa de 24 poços múltiplos revestida com POLFN (ou em qualquer outro suporte de cultura) a uma densidade de 0,5 × 105 / cm2 em meio NES.
- No dia seguinte, colete o meio NES condicionado dos poços onde as células foram plaqueadas. Dependendo do suporte de cultura escolhido, adicione às células o menor volume de meio de transdução de células frescas necessário para cobrir uniformemente a superfície de semeadura (por exemplo, 250 μL / poço de uma placa de 24 multipoços).
- Em seguida, incubar as células h-SC-NES durante 6 h a 37 °C. Em seguida, adicionar o meio condicionado previamente recolhido às células (200 μL/alvéolo de uma placa de 24 poços múltiplos) e incubar as células ON a 37 °C.
- No dia seguinte, lave as células h-SC-NES uma vez com DPBS e realize uma troca total do meio (meio NES).
- Nos dias seguintes, verifique as células em um microscópio de fluorescência para observar a expressão de GFP.
- Expandir as células h-SC-NES para banco de células e transplante.
6. Transplante de células em fatias SC e co-cultura
- Preparação de microagulhas de vidro
- Use um extrator para obter agulhas finas de capilares de vidro borossilicato. Ajuste o extrator da seguinte forma: HEAT 990, PULL 350.
NOTA: De um capilar, é possível obter duas agulhas finas.
- Use um extrator para obter agulhas finas de capilares de vidro borossilicato. Ajuste o extrator da seguinte forma: HEAT 990, PULL 350.
- Preparação celular para transplante
- Divida as células conforme descrito na etapa 4.4.
NOTA: Se as células não expressarem um repórter fluorescente, marque-as com um corante de rastreamento celular para monitorá-las usando um microscópio de fluorescência após o transplante e durante a cultura de longo prazo. Siga o protocolo do fabricante escolhido para a etapa de rotulagem. - Contar as células após a divisão e centrifugar a 200 × g durante 3 min. Suspenda o pellet obtido com meio fresco + Y-27632 (10 μM) para ter a concentração desejada de células (geralmente uma faixa entre 30.000-50.000 células μL-1).
- Transfira a suspensão celular para um tubo de 500 μL ou 1,5 mL e coloque-o no gelo. As células estão prontas para transplante.
- Divida as células conforme descrito na etapa 4.4.
- Transplante de células em fatias organotípicas
NOTA: Realize transplantes de células h-SC-NES nas fatias organotípicas SC de camundongo usando um microinjetor de ar e microagulhas de vidro.- Carregue uma microagulha de vidro com 4 μL de suspensão celular usando uma micropipeta e pontas de micro-carregador.
NOTA: Evite a formação de bolhas de ar na agulha, pois isso pode dificultar o processo de microinjeção. Se forem formadas bolhas, remova-as com a micropipeta. - Coloque a agulha no suporte designado do microinjetor e quebre a ponta da agulha usando a pinça reta.
NOTA: Quebre a agulha de vidro mais perto da ponta para evitar a formação de grandes orifícios. - Antes de transplantar para as fatias, defina os parâmetros de microinjeção. Defina a pressão em 10 psi.
NOTA: O valor da pressão pode ser alterado com base nas observações do microinjetor e do operador: a pressão deve ser suficiente para microinjetar a suspensão celular, evitando danos aos tecidos. - Em uma lâmina de vidro calibrada, coloque uma gota de óleo mineral com uma pipeta Pasteur e microinjete a suspensão celular na gota. O diâmetro da esfera de suspensão celular obtida na gota de óleo se correlaciona com um volume específico de microinjeção. Altere os parâmetros de microinjeção conforme necessário para atingir um diâmetro da esfera de suspensão celular de 0,2 mm para injetar 4nL.
- Depois de definir o volume correto, microinjete a suspensão celular rapidamente nas fatias. Verifique no estereomicroscópio de fluorescência a presença de células nas fatias para verificar se a microinjeção / transplante foi bem-sucedida.
NOTA: A suspensão celular às vezes pode obstruir a agulha: neste caso, tente remover o entupimento da suspensão celular modificando os parâmetros de injeção ou carregue uma nova agulha com suspensão celular nova. - Após o transplante, coloque as fatias a 37 °C e 5% de CO2até o ponto de tempo desejado e realize a troca do meio em dias alternados, conforme descrito nas etapas 2.2.7-2.2.8.
- Carregue uma microagulha de vidro com 4 μL de suspensão celular usando uma micropipeta e pontas de micro-carregador.
7. Coloração de imunofluorescência
- Dia 1
- Remova o meio da parte inferior da membrana de inserção e lave as fatias 3x com DPBS pré-aquecido.
- Fixe as fatias com formaldeído (FA) a 4% pré-aquecido: remova o DPBS e adicione 1,5 mL de FA a 4% na parte inferior da inserção da membrana com as fatias. Após 15 min de incubação em RT, adicione 1 mL a mais de 4% de AG na superfície superior da inserção da membrana e incube por 15 min em RT. Tempo total de fixação: 30 min em RT
- Remova o AG a 4% e lave as fatias por 3 x 10 min com DPBS.
- Corte a membrana do inserto circunferencialmente com uma faca cirúrgica, separe a membrana com as fatias do componente plástico do inserto e prossiga com as etapas de imunofluorescência.
NOTA: Após esta etapa, a membrana com as fatias está flutuando em DPBS no prato. - Permeabilize com 1 mL / membrana de uma solução com 0,7% de Triton em DPBS por 10 min em RT.
- Remover a solução de permeabilização e incubar as amostras durante 4 h a 4 °C com 1 ml/membrana de solução de bloqueio composta por 0,5% de Tritão, 10% de FBS em DPBS.
- Remova a solução de bloqueio e adicione às fatias os anticorpos primários em sua diluição de trabalho, por exemplo, anticorpo anti-neurofilamento de camundongo (NFL), 1:500; coelho anti-NFL, 1:500; anticorpo anti-RBFOX3 (NeuN) de coelho, 1:400; caspase-3 anti-ativa de coelho (aCASP3), 1:400; núcleos anti-humanos de camundongo, (Hu-Nu), 1:400; coelho anti-Hu-Nu, 1:400; anti-GFP de camundongo, 1:400 (conforme relatado na Tabela 1) em 1 mL de solução de anticorpo composta por 0,5% de Triton, 1% de FBS em DPBS. Incubar ON a 4 °C.
- Dia 2
- Lave as membranas por 3 x 10 min com 1-2 mL de DPBS.
- Incube a membrana com anticorpos secundários (por exemplo, anticorpo secundário IgG (H+L) de cabra anti-camundongo, Alexa Fluor 488, 1:500; Anticorpo secundário anti-Rabbit IgG (H+L) de cabra, Alexa Fluor 568, 1:500; Anticorpo secundário anti-IgG (H+L) de cabra anti-camundongo, Alexa Fluor 647, 1:500; Anticorpo secundário anti-Rabbit IgG (H+L) de cabra, Alexa Fluor 647, 1:500 conforme relatado na Tabela 1) e Hoechst/DAPI para núcleos diluídos em 1 mL/membrana de solução de anticorpo (Triton 0,5% + FBS 1% em DPBS) por 3 h em RT.
NOTA: Proteja cuidadosamente as amostras da luz para evitar o branqueamento secundário de anticorpos durante a incubação e nas etapas a seguir. - Remova a solução de anticorpos e lave por 3 x 10 min com DPBS (1-2 mL).
- Substitua o DPBS por um novo DPBS e armazene a 4 °C em condições de proteção contra a luz.
- No final do protocolo de imunofluorescência, monte as membranas em lâminas de vidro. Coloque uma gota de 200 μL de solução de montagem em uma lâmina de vidro. Com a ajuda de uma pinça reta, transfira a membrana flutuante do prato de 35 mm para uma lamínula e, em seguida, transfira a membrana para a lâmina de vidro com a solução de montagem.
- Coloque uma gota de 100 μL de solução de montagem em uma nova lamínula e cubra a membrana com ela, fixando-a na lâmina de vidro. Deixe secar durante a noite sob a capa química em condições protegidas contra a luz.
- Armazene as amostras a 4 °C no escuro ou faça análises de imagem.
8. Ensaio vivo/morto
- Preparar a solução de trabalho alíquota de 700 μL por placa de meio fresco e adicionar na diluição de trabalho correcta o Sytox (por exemplo, componente B, 1:2.000) e a calceína AM (por exemplo, componente A, 1:2.000).
NOTA: Como os reagentes são sensíveis à luz, proteja a solução de trabalho da luz. - Avaliar o volume do meio na parte inferior da membrana e adicionar o Sytox e a Calceína AM à mesma diluição de trabalho descrita no passo 8.1.
- Adicione 2 gotas de 30 μL cada no topo de cada fatia da solução de trabalho preparada na etapa 8.1.
NOTA: Proteja o prato da luz colocando-o em condições escuras. - Incube as fatias por 30 min em RT.
- Após a incubação, corte a membrana circunferencialmente do inserto com uma faca cirúrgica: depois disso, a membrana com as fatias flutua na solução de trabalho.
- Coloque a membrana sem a solução de montagem de cabeça para baixo em uma lamínula com a ajuda de uma pinça reta e adicione 100 μL de DPBS em cima das membranas para mantê-las hidratadas.
- Adquira imagens ao vivo usando o microscópio confocal o mais rápido possível.
NOTA: Adicione 2 gotas de 40 μL cada DPBS na parte superior da membrana a cada 30 minutos durante a aquisição da imagem para evitar que a membrana seque.
9. Imagem
- Imagem confocal de amostras fixas
- Para análise qualitativa, adquira imagens usando um microscópio confocal com os seguintes parâmetros de aquisição: defina a opção de imagem grande (escolha: 4 x 4), use objetiva de 10 x, sem pilhas e uma resolução de 3.634 x 3.634 pixels.
- Para análise quantitativa (aCASP3, Calceína e Sytox para fatias e aCASP3 para células), adquirir imagens usando o microscópio confocal com os seguintes parâmetros de aquisição: objetiva de 20 x, resolução de 1.024 x 1.024 pixels com passo Z de 3 μm.
- Imagens ao vivo de fatias transplantadas usando o estereomicroscópio
NOTA: Capture imagens usando o estereomicroscópio nos modos de campo claro e epifluorescência.- Usando a configuração de campo claro , adquira imagens das fatias (objetiva 1 x com zoom de 3x usada aqui).
NOTA: Modifique a luz dependendo do microscópio usado e use as fibras ópticas se necessário. - Usando a configuração de fluorescência , adquira imagens das células transplantadas com a mesma objetiva e zoom usados para as fatias (consulte a etapa 9.2.1). Use os seguintes parâmetros para a aquisição: ganho 1, exposição 200-500 ms, deslocamento -10.
- Usando a configuração de campo claro , adquira imagens das fatias (objetiva 1 x com zoom de 3x usada aqui).
- Imagens ao vivo após ensaio Live/Dead usando o microscópio confocal
- Adquira imagens usando um microscópio confocal com os seguintes parâmetros de aquisição: objetiva de 20x, resolução de 1.024 x 1.024 pixels com um passo Z de 3 μm.
10. Análise de imagem por ImageJ
- Análise de área da NFL, RBFOX3 e DAPI
- Abra o software ImageJ (https://imagej.net/software/imagej/).
- Abra a imagem do arquivo clicando em Arquivo | abrir | selecionar arquivo | abrir.
- Na janela pop-up, selecione Exibição de pilha | Hyperstack e modo de cor | Padrão (com dimensionamento automático).
- Na barra de ferramentas, selecione Imagem | Cor | Canais divididos.
- Escolha os canais desejados para analisar: canal verde para NFL (marcador axonal), canal vermelho para RBFOX 3 (marcador neuronal) e canal azul para DAPI (coloração nuclear).
- Para análise de NFL, prossiga com as seguintes etapas: na barra de ferramentas, selecione Imagem | Ajustar | Limiar | Selecione os parâmetros (fundo escuro, algoritmo, por exemplo, padrão) e mova o cursor na barra de valores (abaixo/sobre) para cobrir e circunscrever toda a área do neurite (os neurites são destacados em branco em um fundo escuro) | Conjunto | Aplicar.
- Selecione na barra de ferramentas a ferramenta de rastreamento Varinha e use-a para definir automaticamente a área branca coberta pela NFL. Pressione Analisar | Medida | Valor da área em μm2.
- Para análise DAPI e RBFOX3, prossiga com as seguintes etapas: na barra de ferramentas, selecione Imagem | Ajustar | Limiar | Selecione os parâmetros (fundo branco, algoritmo, por exemplo, padrão) e mova o cursor na barra de valores (abaixo/acima) para cobrir e circunscrever toda a área RBFOX3 ou DAPI | Conjunto | Aplicar.
- Na barra de ferramentas, selecione Processo | FFT | Filtro passa-banda. Use a barra de valores limite para ajustar a área branca coberta por RBFOX3 ou DAPI, correspondente ao seu sinal de fluorescência.
- Na barra de ferramentas, selecione a ferramenta de rastreamento Wand e use-a para definir automaticamente a área coberta pelo RBFOX3 ou DAPI. Pressione Analisar | Medida | Valor da área em μm2.
- Análise de apoptose por ImageJ
- Abra o software ImageJ (https://imagej.net/software/imagej/).
- Abra a imagem de arquivo Z-stack clicando em Arquivo | abrir | selecionar arquivo | abrir.
- Na janela pop-up, selecione Exibição de pilha | Hyperstack e modo de cor | Padrão (com dimensionamento automático).
- Na barra de ferramentas, selecione Imagem | Cor | Canais divididos.
- Escolha os canais desejados: canal vermelho para aCASP3 (marcador de apoptose para analisar) e azul ou ciano para DAPI ou Hu-Nu para núcleos. Em seguida, sobreponha os canais selecionando na barra de ferramentas Imagem | Cor | Mesclar canais | Criar composto.
- Arraste a barra Z na parte inferior da imagem para navegar pela pilha Z da imagem e identificar pilhas na região central das fatias com positividade aCASP3.
- Na barra de ferramentas, selecione Plug-ins | Analisar | Contador de células.
- Na janela pop-up aberta, selecione Inicializar para preparar a imagem para a contagem; em seguida, selecione um tipo de contador (por exemplo, Tipo 1) e renomeie-o como o objeto a ser contado (por exemplo, células aCASP3+ ). Renomeie outros tipos de contadores conforme descrito acima para contar outros objetos (por exemplo, células DAPI+ ou Hu-Nu+ para o número total de células).
- Na janela pop-up, selecione o tipo de contador correspondente ao objeto a ser contado (por exemplo, células aCASP3+ ), selecione a ferramenta Ponto na barra de ferramentas e comece a contar manualmente o número de células apoptóticas, positivo para aCASP3, clicando em cada uma positiva na imagem aberta.
- Selecione outro tipo de contador na janela do contador de células e comece a contar o número total de células (células DAPI+ , para fatias; Células Hu-Nu+ , para células transplantadas).
- Análise do ensaio Vivo/Morto por ImageJ
- Abra o software ImageJ (https://imagej.net/software/imagej/).
- Abra a imagem do arquivo Z-stack clicando em Arquivo | abrir | selecionar arquivo | abrir.
- Na janela pop-up, selecione Exibição de pilha | Hyperstack e modo de cor | Padrão (com dimensionamento automático).
- Nas barras de ferramentas, selecione Imagem | Cor | Canais divididos.
- Escolha os canais desejados: canal verde para Calceína (marcador de vitalidade a analisar) e canal ciano para Sytox (marcador morto). Em seguida, sobreponha os canais selecionando na barra de ferramentas Imagem | Cor | Mesclar canais | Selecione Criar composto.
- Arraste a barra Z na parte inferior da imagem para navegar pela pilha Z da imagem e identificar pilhas na região central das fatias com positividade de Calceína e Sitox.
- Na barra de ferramentas, selecione Plug-ins | Analisar | Contador de células.
- Na janela pop-up aberta, selecione Inicializar para preparar a imagem para a contagem; em seguida, selecione um tipo de contador (por exemplo, Tipo 1) e renomeie-o como o objeto a ser contado (por exemplo, células Calcein+ ). Renomeie outros tipos de contadores conforme descrito acima se for necessário contar outro objeto (por exemplo, células Sytox+ ).
- Na janela pop-up, selecione o tipo de contador correspondente ao objeto a ser contado; em seguida, selecione a ferramenta Ponto na barra de ferramentas e comece a contar manualmente o número de células Calcein+ , clicando em cada uma positiva na imagem aberta.
- Selecione outro tipo de contador na janela do contador de células e conte as células Sytox+ conforme descrito para Calcein.
11. Gráficos e análise estatística
- Realize todas as análises estatísticas e plote gráficos usando o software de sua escolha.
Resultados
Os métodos descritos permitem o estabelecimento de fatias organotípicas de SC de camundongos no estágio P3 e sua manutenção em cultura por um tempo prolongado em condições saudáveis. Além disso, mostramos um protocolo para transplantar células para as fatias e co-cultivá-las por até 30 dias (Figura 1). Primeiro, mostramos a otimização das condições de cultura e um protocolo adequado para cultura prolongada das fatias SC com células transplantadas (Figura 2A). As fatias são geradas e mantidas do DEV 0 até o DEV 2 na MO, que foi originalmente proposta como um meio ótimo para a manutenção das fatias SC47. No entanto, devido à presença de proteínas séricas, esse meio pode ser subótimo para sustentar a diferenciação neuronal e a maturação das células precursoras neurais transplantadas. De fato, no DEV 3, testamos a mudança de OM para GM, uma formulação contendo Neurobasal mais B27, que suporta a sobrevivência neural, e sem soro, que inibe a diferenciação neuronal correta, promovendo um destino glial48,49.
A Figura 2B mostra os resultados alcançados com a troca do meio no DEV 3 de OM para GM, em comparação com as fatias SC que não receberam a troca (as fatias de controle foram cultivadas em OM). Usamos a distribuição do sinal NFL dentro dos cortes como um marcador de integridade neuronal (Figura 2B,C). As fatias no DEV 7 foram saudáveis em ambas as condições de cultivo, mostrando a distribuição difusa de neurofilamento (NFL, em verde) dentro delas. No DEV 10, as fatias cultivadas em GM pareciam ser mais saudáveis em relação às fatias de controle cultivadas em MO, conforme documentado pela distribuição de coloração da NFL. Também estimamos a área NFL+ (% NFL+ Area/DAPI+ Area) dos cortes mostrados nas imagens representativas da Figura 2B. A área estimada da NFL+ é representada nos histogramas da Figura 2C, confirmando que o sinal da NFL é distribuído difusamente nas fatias no DEV 7 em ambas as condições. No entanto, no DEV 10, a área estimada coberta pela coloração NFL diminui para a condição de cultura OM.
Esses dados sugerem que a mudança para o GM no DEV 3 é bem tolerada para cultura prolongada de fatias SC (DEV 10). Como próximo passo, testamos o GM em pontos de tempo mais prolongados: DEV 30, DEV 60 e DEV 90. Conforme mostrado na Figura 3A,B, as fatias foram mantidas saudáveis em cultura até o DEV 90. A coloração NFL foi amplamente presente nas fatias em cada ponto de tempo, com brotos difusos ao redor das fatias de neuritos que partem da região central. De fato, estimamos a área NFL+ das fatias mostradas na Figura 3A e ela aumentou ao longo do tempo, conforme mostrado nos histogramas da Figura 3B. Também observamos positividade para o marcador neuronal RBFOX3, fornecendo outra linha de evidência da diferenciação neuronal das fatias. Em cada momento, também verificamos a taxa de apoptose avaliando em diferentes fatias o número de células positivas para aCASP3 (Figura 4A,B). A análise foi realizada conforme descrito na seção 10.2 do protocolo. A taxa apoptótica (% de células aCASP3+/número total de células DAPI+) foi muito baixa em cada ponto de tempo (0,85 ± 0,52%, 0,71 ± 0,27%, 0,66 ± 0,45% para DEV 30, 60 e 90, respectivamente) sem diferenças significativas entre os três pontos de tempo considerados (valor de p > 0,05, Figura 4B). Esses dados sugerem que a taxa apoptótica associada ao aCASP3 permanece estável ao longo do tempo e, juntamente com a ampla distribuição da NFL nos cortes (Figura 4A), confirmam a sobrevivência dos cortes em cada momento.
Em apoio aos dados anteriores, também realizamos um ensaio vivo/morto para avaliar a viabilidade das fatias nos três momentos diferentes. Usamos Calceína (coloração verde) para marcar as células viáveis e metabolicamente ativas e Sytox (coloração ciano) para avaliar a morte celular. Conforme mostrado nos histogramas da Figura 4C, a porcentagem de células metabolicamente ativas aumenta ligeiramente de DEV 30 para DEV 90 (93,17 ± 5,21%, 96,43 ± 3,02%, 96,33 ± 3,10% para DEV 30, 60 e 90, respectivamente), estabilizando-se entre os dois últimos pontos de tempo (DEV 30 vs DEV 60 valor de p = 0,018; DEV 30 vs DEV 90 valor de p = 0,027; DEV 60 vs DEV 90 valor de p = 0,99). Encontramos baixos níveis de morte celular que diminuíram ao longo do tempo (6,83 ± 5,21%, 3,57 ± 3,02%, 3,66 ± 3,10% para DEV 30, 60 e 90, respectivamente) e uma diferença significativa foi encontrada entre DEV 30 e pontos de tempo posteriores, DEV 60 e DEV 90 (DEV 30 vs DEV 60 valor de p = 0,018; DEV 30 vs DEV 90 valor de p = 0,027; DEV 60 vs DEV 90 valor de p = 0,99). Esses dados, em associação com a taxa de apoptose, confirmam a sobrevida do corte ao longo do tempo e apoiam a eficácia do protocolo de cultura de longo prazo realizado.
Uma vez estabelecida a viabilidade da cultura prolongada das fatias de SC, desafiamos o sistema pelo transplante de células h-SC-NES nos primeiros estágios da diferenciação neuronal. Testamos as células h-SC-NES porque elas mostraram resultados promissores para o tratamento da LME12. O procedimento de transplante de células h-SC-NES nas fatias SC de camundongo é descrito na seção 6 do protocolo. As fatias SC e as células h-SC-NES transplantadas foram mantidas até o DPT 30. As células foram enxertadas no DIV 10 de diferenciação (estágio precursor neural) em fatias organotípicas de DEV 4, conforme mostrado no esquema de protocolo da Figura 5A. As células transplantadas foram monitoradas quanto à expressão de GFP em cultura por até 30 dias. A Figura 5B mostra imagens ao vivo representativas, em diferentes DPT, de uma fatia SC com células GFP+ transplantadas. A expressão estável de GFP ao longo do tempo (Figura 5B e Figura 6A) sugere que as células sobreviveram no tecido SC nas condições de cultura previamente otimizadas. Também verificamos a taxa apoptótica de células transplantadas, conforme descrito na seção 10.2 do protocolo. A taxa apoptótica (% de células aCASP3+ /número total de células Hu-Nu+ ) foi muito baixa (0,44 ± 0,34%) após 30 DPT (Figura 6B). Além disso, a taxa apoptótica no DPT 30 estava alinhada com a encontrada para o mesmo tipo de células no DPT 7, conforme relatado anteriormente40, documentando que as culturas se estabilizam com o tempo.
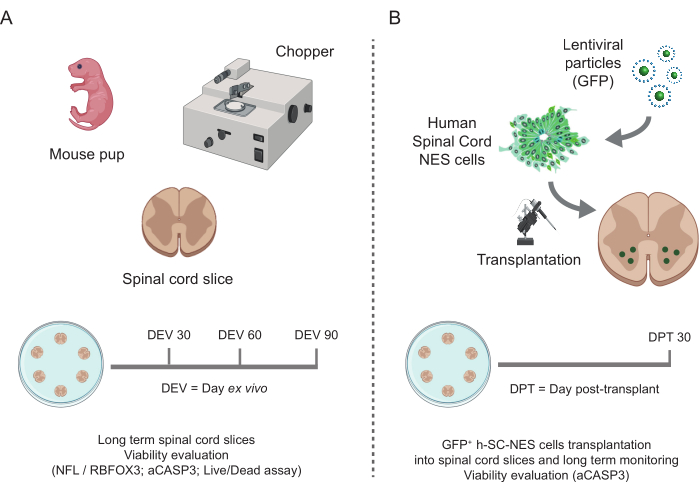
Figura 1: Fluxo de trabalho do protocolo. Esquema representativo mostrando o fluxo de trabalho geral do protocolo realizado. (A) À esquerda, um esquema resumindo a geração de fatias SC de camundongos a partir de SC isolado de filhotes de camundongos em P3 e cultura de longo prazo de fatias organotípicas SC. (B) À direita, um esquema resumindo o transplante de células h-SC-NES que expressam GFP em fatias organotípicas SC de camundongo. As células enxertadas são mantidas por 30 dias após o transplante. Abreviaturas: h-SC-NES = tronco neuroepitelial derivado da medula espinhal humana; GFP = proteína fluorescente verde; DEV = dia ex vivo; DPT = dia pós-transplante; NFL = cadeia leve de neurofilamento; RBFOX3= Homólogo fox-1 de ligação ao RNA 3; aCASP3 = Caspase-3 ativa; SC= medula espinhal. Clique aqui para ver uma versão maior desta figura.
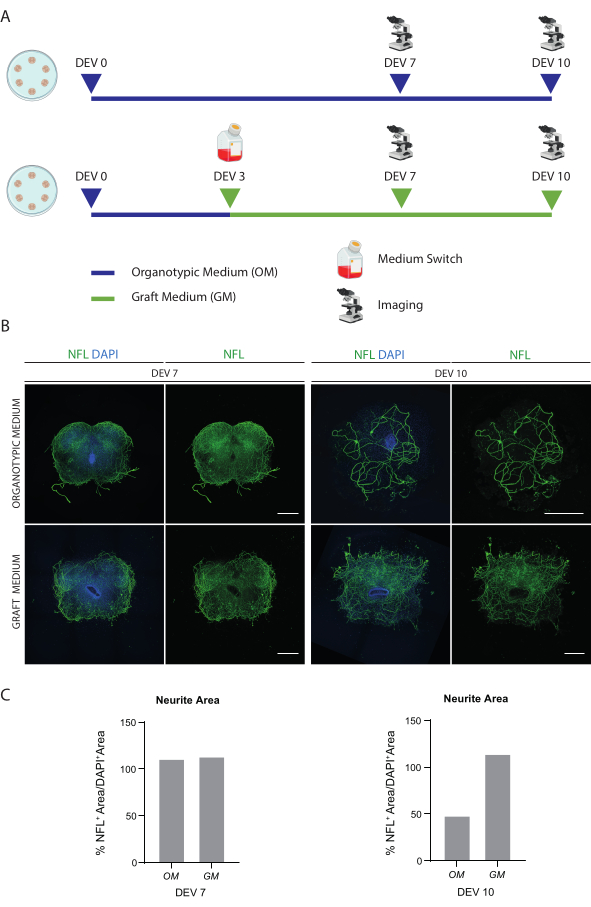
Figura 2: Otimização das condições de cultura a longo prazo. (A) Esquema representativo do protocolo para teste de MO e GM. A MO é mantida até DEV 7-10 para o grupo controle. O meio é comutado para o GM no DEV 3 para as fatias tratadas; em seguida, eles são fixados no DEV 7-10 para comparação com os controles. (B) Imagens representativas comparando fatias organotípicas de SC de camundongos em DEV 7 e 10 cultivadas em diferentes condições. As fatias são coradas para o neurofilamento marcador do citoesqueleto (NFL, verde). A ampla distribuição da coloração NFL em fatias cultivadas com GM sugere uma sobrevida e diferenciação global. Os núcleos são contracorados com DAPI. Barra de escala = 500 μm. (C) Histogramas representativos da estimativa da área coberta pela NFL nas fatias mostradas na Figura 1B. No DEV 10, a área de superfície da NFL diminui na condição de cultura OM. Abreviaturas: DEV = dia ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadeia leve de neurofilamento.; MO = meio organotípico; GM = meio de enxerto; SC = medula espinhal. Clique aqui para ver uma versão maior desta figura.
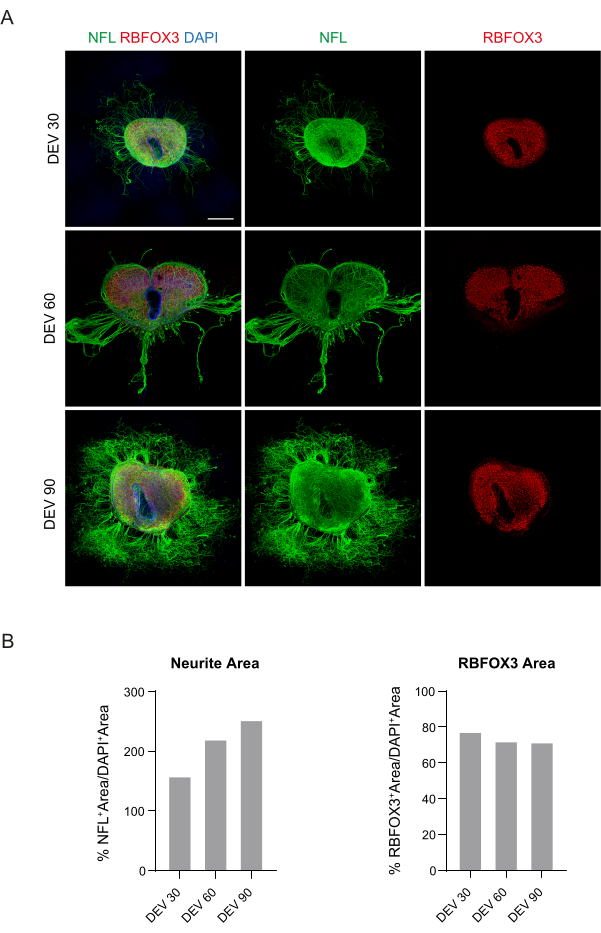
Figura 3: Fatias organotípicas SC de camundongos cultivadas a longo prazo. (A) As fatias são mantidas em cultura até DEV 90. O ensaio de imunofluorescência revela uma ampla distribuição do marcador neurofilamento do citoesqueleto (NFL, verde) e do marcador neuronal nuclear RBFOX3 (vermelho), atestando sua condição saudável e identidade neuronal após cultura de longo prazo. É importante notar que os axônios NFL+ brotam difusamente ao redor das fatias ao longo do tempo. Os núcleos são contracorados com DAPI. Barra de escala = 500 μm. (B) Histogramas representativos da estimativa da área e tempo NFL+ e da área RBFOX3+ das fatias mostradas no painel A. A área de neuritos da NFL+ aumenta com o tempo. Abreviaturas: DEV = dia ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadeia leve de neurofilamento; SC = medula espinhal; RBFOX3= Homólogo fox-1 de ligação ao RNA 3. Clique aqui para ver uma versão maior desta figura.
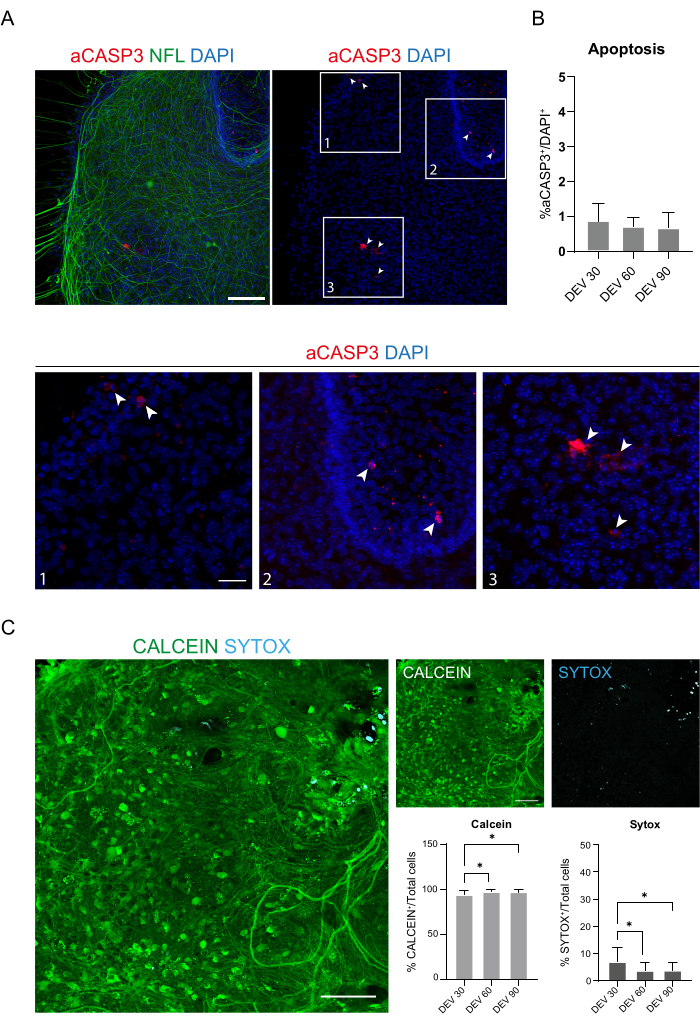
Figura 4: Avaliação da viabilidade celular nas fatias SC ao longo do tempo. (A) Imagens representativas de fatias organotípicas em DEV 60 coradas para aCASP3 (vermelho) e NFL (verde). Barra de escala = 100 μm. NFL mostra um padrão difuso. Células raras são positivas para o marcador apoptótico aCASP3 (Inserções: 1-2-3). (B) Análise da taxa de apoptose em fatias em diferentes momentos. Média ± DP, N (repetições) = 6 fatias, n (células totais) > 1.000 para cada fatia, teste de Kruskal-Wallis, comparação múltipla, valor de p > 0,05. A taxa apoptótica é estável ao longo do tempo. Nas inserções 1-2-3 do painel A, é possível observar detalhes de células positivas para aCASP3 (coloração vermelha, setas brancas). Pequenos pontos vermelhos rotulam detritos celulares e núcleos picnóticos. Barra de escala = 50 μm. (C) Imagens representativas do ensaio vivo/morto realizado em fatias SC no DEV 90: as células metabolicamente ativas são marcadas em verde com calceína, enquanto as células mortas e danificadas são marcadas em azul claro (ciano) com Sytox. Os dois histogramas mostram a % de células positivas para Calceína (à esquerda) e Sytox (à direita) no número total de células. Para ambos os ± médios, N (repetições) = 6 fatias, n (células totais) > 1.000 para cada fatia, teste de Kruskal-Wallis, comparação múltipla, DEV 30 vs DEV 60 valor de p = 0,018; DEV 30 vs DEV 90 valor de p = 0,027; DEV 60 vs DEV 90 valor de p > 0,99. Abreviaturas: DEV = dia ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadeia leve de neurofilamento; SC = medula espinhal; aCASP3 = caspase-3 ativa. Clique aqui para ver uma versão maior desta figura.
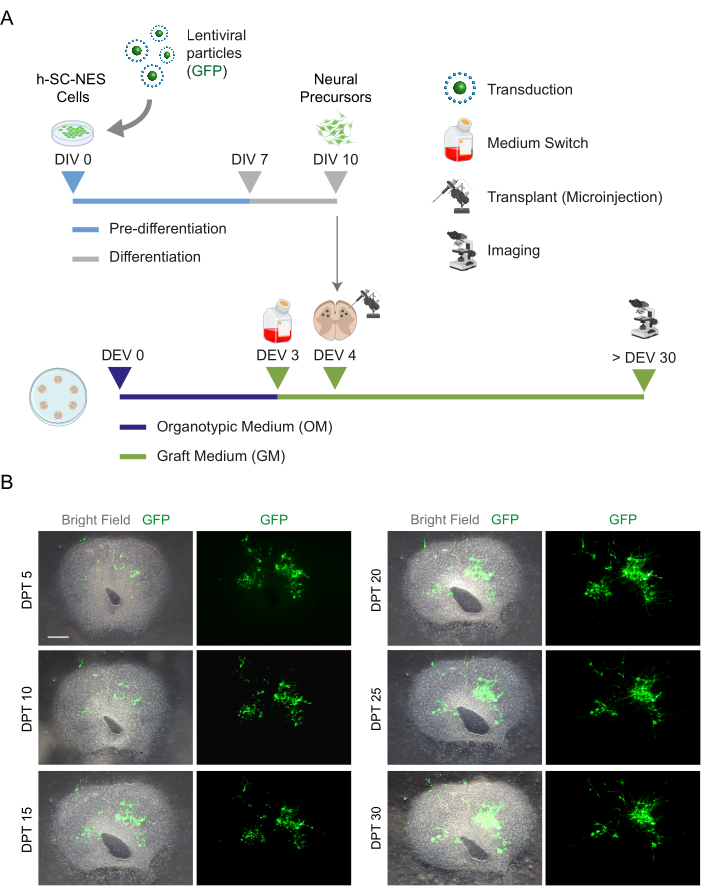
Figura 5: Transplante de células h-SC-NES em fatias organotípicas de camundongos. (A) Esquema representativo do protocolo de transplante. As células são transplantadas como precursores neurais no DIV 10 de diferenciação em fatias organotípicas DEV 4. (B) Imagens representativas de fatias organotípicas de camundongos transplantadas com células h-SC-NES que expressam GFP ao longo do tempo até DPT 30. As células são transduzidas com um vetor lentiviral que carrega o gene GFP . A expressão de GFP ao longo do tempo confirma sua viabilidade e adaptação ao ambiente de fatia. Barra de escala = 500 μm. Abreviaturas: DIV = primeiro dia na pré-diferenciação; h-SC-NES = tronco neuroepitelial derivado da medula espinhal humana; GFP = proteína fluorescente verde; DEV = dia ex vivo; MO = meio organotípico; GM = meio de enxerto; DPT = dias pós-transplante. Clique aqui para ver uma versão maior desta figura.
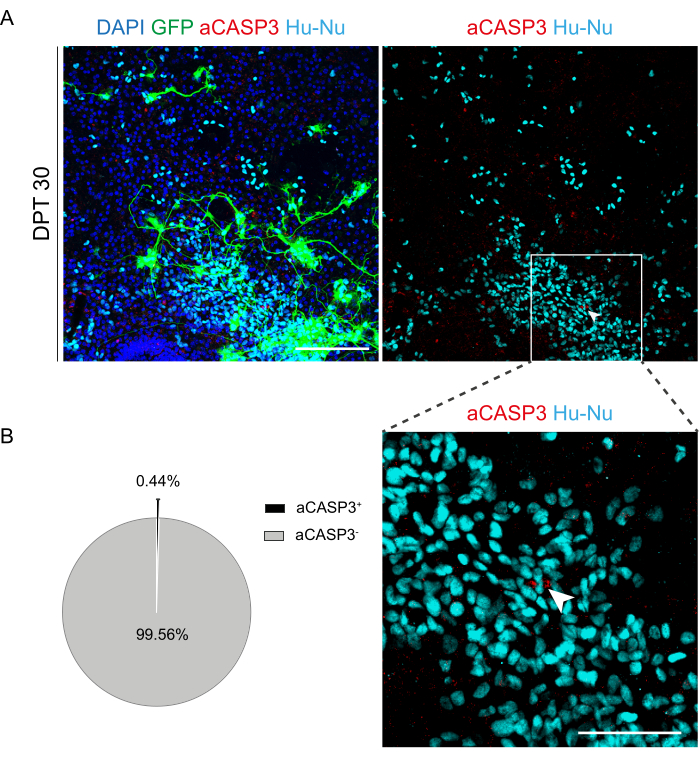
Figura 6: Avaliação da taxa de apoptose de células h-SC-NES transplantadas após 30 dias do transplante. (A) Imagem representativa de uma fatia organotípica de camundongo transplantada com células h-SC-NES que expressam GFP. As células são transduzidas com um vetor lentiviral que carrega o gene GFP para monitorá-las nas fatias após o transplante. A expressão de GFP ao longo do tempo confirma sua viabilidade e adaptação ao ambiente de fatia. O ponto de tempo mostrado é DPT 30; as células são coradas para núcleos humanos (ciano) e aCASP3 (vermelho). Barra de escala = 150 μm. (B) À esquerda, gráfico de pizza representativo da análise de apoptose de células transplantadas em fatias em DPT 30 (N (réplicas) = 5 fatias, n (células) = 5.000) e, à direita, uma inserção de células Hu-Nu+ e um detalhe de uma célula positiva para aCASP3 (seta branca). Barra de escala = 75 μm. Pequenos pontos vermelhos rotulam detritos celulares e núcleos picnóticos. Abreviaturas: h-SC-NES = tronco neuroepitelial derivado da medula espinhal humana; GFP = proteína fluorescente verde; DPT = dia pós-transplante; DAPI = 4',6-diamidino-2-fenilindol; NFL = cadeia leve de neurofilamento; aCASP3 = caspase-3 ativa; Hu-Nu = núcleos humanos. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Composição das soluções utilizadas neste protocolo. Clique aqui para baixar esta tabela.
Discussão
Ainda não existe um tratamento eficaz para pacientes com LME. Diferentes abordagens têm sido testadas e uma das mais promissoras é baseada em uma estratégia regenerativa de reposição celular. Atualmente, os avanços no campo da medicina regenerativa exigem novas plataformas para testar a eficácia e a segurança dos transplantes de células, isoladamente ou em combinação com outras abordagens. Sua validação pré-clínica é essencial para a realização de novos estudos clínicos. As culturas organotípicas SC são uma plataforma útil para estudar diferentes aspectos da neurodegeneração, regeneração neural e neurodesenvolvimento, e para investigar a eficácia de novas abordagens terapêuticas23. Em particular, características específicas das culturas organotípicas, como a manutenção da histoarquitetura original e da composição celular e do microambiente, são vantajosas para desvendar a dinâmica do transplante, como enxerto celular, integração, diferenciação e maturação.
De acordo com os protocolos publicados, as fatias organotípicas SC podem ser mantidas em cultura por aproximadamente 2-3 semanas em condições saudáveis, o que limita seu uso para as investigações de longo prazo e triagem funcional necessárias para testar esquemas de terapia celular. Explorar processos importantes, como diferenciação e maturação para o destino correto das células transplantadas dentro do tecido SC, requer monitoramento de longo prazo. Esses processos celulares são críticos durante transplantes comuns em modelos animais. A disponibilidade de um sistema ex vivo que imita muitos recursos presentes in vivo seria útil na fase de triagem pré-clínica.
Por esse motivo, neste trabalho, propomos um método de cultura organotípica SC ideal de longo prazo (≥30 dias) que permite manter fatias SC viáveis por até 90 dias, triplicando seu tempo normal de cultura. Além disso, mostramos enxerto de células h-SC-NES estável dentro de fatias SC e a manutenção da cultura de transplante por até 30 dias. Monitoramos o enxerto celular ao longo do tempo, observando a expressão de GFP para verificar a sobrevivência celular até DPT 30. Após 30 DPT, avaliamos a taxa de apoptose celular. Na literatura, a avaliação da apoptose de células h-SC-NES transplantadas em fatias SC a 7 DPT tem sido relatada40. Aqui, estendemos a análise de apoptose celular no DPT 30 para comparar a taxa de apoptose em relação ao ponto de tempo anterior (DPT 7). Descobrimos que nossos dados estão de acordo com a literatura, sugerindo que as células h-SC-NES transplantadas sobrevivem também em um momento posterior se forem mantidas na condição de cultura otimizada em nosso trabalho. Esta plataforma ex vivo aprimorada de longo prazo sozinha e na configuração de transplante ajudará os pesquisadores na triagem pré-clínica para transplantes baseados em células-tronco para LME. Isso permitirá que eles identifiquem o melhor candidato celular para estudos in vivo que promovam o sucesso dos transplantes. Além disso, após a triagem inicial, as fatias organotípicas SC também podem ser usadas em paralelo aos estudos in vivo para confirmar e corroborar a dinâmica celular e os comportamentos de longo prazo observados em modelos animais ou para apoiar estudos mecanísticos.
Nosso protocolo descreve em detalhes como gerar esse modelo organotípico de longo prazo, mas algumas etapas críticas também devem ser discutidas. No que diz respeito à geração das culturas organotípicas de SC, existem alguns desafios durante a cirurgia e os primeiros estágios da cultura. Um procedimento cirúrgico bem realizado é essencial para gerar cortes que mantenham a histoarquitetura original. Se o SC for arruinado durante o isolamento, as fatias podem perder sua estrutura anatômica típica e o dano tecidual pode induzir um insulto pró-inflamatório excessivo, levando a condições insalubres e morte celular. A fase mais desafiadora durante a cirurgia é a extração do SC da espinha dorsal e a remoção das meninges do SC isolado. O sucesso dessas etapas depende da experiência do operador; portanto, recomenda-se um período de treinamento antes de iniciar os experimentos.
O seccionamento coronal do SC por meio de um helicóptero também é uma fase desafiadora. O SC isolado deve ser colocado na plataforma de corte exatamente perpendicular à lâmina. O operador também deve colocar a lâmina perpendicularmente à plataforma de corte. Esses cuidados são necessários para garantir a geração de fatias reprodutíveis entre os mesmos e diferentes experimentos. Outra questão importante é que o tempo para a cirurgia é limitado: todo o procedimento de geração de fatias deve levar ~ 30 min. Se o operador gastar mais tempo em cirurgia e corte, o tecido SC sofrerá e isso pode prejudicar o sucesso da cultura e as próximas etapas do experimento.
Uma vez que as fatias são colocadas na membrana de cultura, é importante alimentá-las corretamente. O GDNF é necessário para sustentar a recuperação e a sobrevivência do tecido. O corte com um picador é traumático para o tecido e, por esse motivo, as fatias são colocadas logo após o corte em um meio de dissecção gelado para limpar o excesso de moléculas pró-inflamatórias e promotoras de morte. Em seguida, as fatias são colocadas nas membranas de cultura (inserções de cultura de células) com meio fresco modificado com GDNF para promover uma recuperação mais rápida e adesão da fatia à membrana. O GDNF deve ser adicionado ao meio todos os dias durante a primeira semana na cultura devido à sua meia-vida curta50,51. Observamos que os cortes necessitam da presença contínua de GDNF durante os primeiros dias em cultura para promover a recuperação e viabilidade tecidual. Em qualquer caso, como a presença de GDNF é importante para todo o período de cultura, é fortemente desencorajado interromper a administração de GDNF em outros momentos.
Durante a primeira semana de cultura, também é importante verificar os cortes macroscopicamente a olho nu e ao microscópio. O tecido translúcido e a transparência das bordas são sinais de adesão adequada dos cortes à membrana e do tecido viável. O tecido necrótico parecerá extremamente branco à primeira vista macroscópica e as áreas necróticas aparecerão cinza escuro ao microscópio. Após algumas semanas em cultura, a morfologia do tecido pode mudar: os movimentos celulares e a adesão do tecido à membrana podem influenciar esse processo. Observamos, por exemplo, a perda da luz central em alguns cortes preenchidos por células e a perda da morfologia dorsal e ventral do corno. Isso acontece principalmente com fatias menores, enquanto a maioria delas manterá uma estrutura anatômica próxima à original. Os cortes geralmente são gerados a partir das regiões lombar ou torácica, pois desta forma podem ter o tamanho adequado para manter sua histoarquitetura original ao longo do tempo: se forem muito pequenos, perdem sua arquitetura enquanto, se muito grandes, a região central pode sofrer necrose. Assim, usamos a região lombar de filhotes de camundongos para gerar fatias com o tamanho apropriado para uma cultura ideal a longo prazo, mas, em princípio, outros segmentos podem ser considerados. Além disso, optou-se por utilizar a região lombar, pois as regiões ventral e dorsal são mais distinguíveis entre si. Além disso, essa região apresenta áreas teciduais com maior percentual de neurônios motores e substância cinzenta, que são locais de interesse para terapias de reposição celular na LME. Em relação ao transplante de células para as fatias, a principal questão está relacionada à quebra da ponta da microagulha de vidro. Se o orifício para a passagem das células for muito grande, pode causar danos ao tecido SC durante a microinjeção. Se for muito pequeno, o empilhamento de células pode obstruir a agulha, dificultando o processo de transplante. O procedimento de transplante deve ser concluído em 1 h para minimizar o sofrimento e a morte celular.
O protocolo proposto fornece uma ferramenta ideal e versátil para diferentes tipos de investigações. Aqui, aplicamos nossa plataforma de longo prazo para validar o transplante de células h-SC-NES nos primeiros estágios de diferenciação dentro do tecido SC de camundongo por 30 dias. A principal novidade da abordagem proposta é a otimização do protocolo de co-cultura. Os componentes do GM sustentam a sobrevivência neuronal a longo prazo das fatias SC e das células h-SC-NES transplantadas. De fato, o GM, sendo um meio livre de soro, sustenta a diferenciação das células transplantadas em direção ao destino neuronal em relação ao meio anteriormente usado para cultura de fatias organotípicas47.
Em relação aos modelos propostos para LME, os experimentos são geralmente realizados em camundongos adultos. Até o momento, as diferenças mais importantes entre as CT neonatais e adultas estão relacionadas ao maior potencial regenerativo encontrado no neonatoral em relação aos camundongos adultos52. No entanto, tais diferenças não têm impacto no tipo de protocolo que estamos propondo, uma vez que aqui nos concentramos na resposta das células enxertadas ao ambiente do tecido hospedeiro, e não nas capacidades de regeneração dos neurônios residentes. Outra diferença entre camundongos neonatais e adultos após uma LME está relacionada à formação da cicatriz glial que ocorre em adultos. Esse aspecto não é levado em consideração no modelo proposto, que não considera os complexos processos fisiopatológicos decorrentes de lesões primárias e secundárias.
Em relação às aplicações, a plataforma também poderá ser utilizada para investigar a integração entre as células transplantadas com circuitos residentes presentes no modelo organotípico SC. Ferramentas de engenharia genética já eram utilizadas no SNC para avaliar a conectividade sináptica e poderiam ser exploradas nesse sentido 53,54,55. Em particular, a integração pode ser investigada e validada avaliando a formação de sinapses entre as células enxertadas e o tecido SC ex vivo. Essas culturas organotípicas de longo prazo também podem ser exploradas para testar agentes neuroprotetores e neuroregenerativos ou novas moléculas/materiais ou para estudar distúrbios neurodegenerativos que envolvem o CS. Para estudar distúrbios neurodegenerativos específicos, o protocolo precisa ser adaptado para a cultura de fatias SC geradas a partir de modelos relevantes, como camundongos transgênicos portadores de mutações específicas associadas à patologia, no estágio relevante para a patologia (ou seja, neonatal, juvenil, adulto). Em conclusão, nosso protocolo e culturas organotípicas em geral, sendo explantes de um órgão específico, apresentam características que preenchem a lacuna entre culturas de células 2D e modelos in vivo, confirmando-os como uma ferramenta inestimável tanto para pesquisa básica quanto para testes pré-clínicos.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
O estudo foi apoiado pela Wings for Life Foundation (WFL-IT-20/21), o Plano Nacional de Recuperação e Resiliência da UE de Próxima Geração da União Europeia (NRRP) - missão 4 componente 2, investimento n. 1.4-CUP N. B83C22003930001 (Ecossistema de Saúde da Toscana-THE, Spoke 8) e Marina Romoli Onlus. Este manuscrito reflete apenas os pontos de vista e opiniões dos autores, nem a União Europeia nem a Comissão Europeia podem ser considerados responsáveis por eles. Dados e metadados estão disponíveis em Zenodo 10.5281/zenodo.10433147. As imagens foram geradas com Biorender https://www.biorender.com/.
Materiais
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
Referências
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados