Method Article
Organotypische Schnittkultur des Rückenmarks der Maus als Plattform zur Validierung der Zelltransplantation bei Rückenmarksverletzungen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir eine reproduzierbare Methode zur Generierung und Erhaltung von organotypischen Schnitten des Rückenmarks vor, die mit neuralen Stammzellen transplantiert wurden, als ex vivo-Modell für die Erprobung von zellulären Ersatztherapien.
Zusammenfassung
Lösende Heilmittel für Rückenmarksverletzungen (SCI) fehlen aufgrund der komplexen Pathophysiologie immer noch. Einer der vielversprechendsten regenerativen Ansätze basiert auf der Stammzelltransplantation, um verlorenes Gewebe zu ersetzen und die funktionelle Wiederherstellung zu fördern. Dieser Ansatz sollte im Hinblick auf Sicherheit und Wirksamkeit in vitro und ex vivo weiter untersucht werden, bevor mit teureren und zeitaufwändigeren Tierversuchen fortgefahren wird. In dieser Arbeit zeigen wir die Etablierung einer Langzeitplattform auf der Grundlage von organotypischen Schnitten des Rückenmarks der Maus, die mit humanen neuralen Stammzellen transplantiert wurden, um zelluläre Ersatztherapien für Querschnittlähmungen zu testen.
Organotypische Standardkulturen des SC werden in vitro etwa 2 bis 3 Wochen lang aufbewahrt. Hier beschreiben wir ein optimiertes Protokoll für die Langzeitwartung (≥30 Tage) für bis zu 90 Tage. Das Medium, das für die Langzeitkultivierung von SC-Schnitten verwendet wird, wurde auch für die Transplantation von neuralen Stammzellen in das organotypische Modell optimiert. Humane SC-abgeleitete neuroepitheliale Stammzellen (h-SC-NES), die einen grün fluoreszierenden Protein-Reporter (GFP) tragen, wurden in SC-Schnitte von Mäusen transplantiert. Dreißig Tage nach der Transplantation zeigen die Zellen immer noch eine GFP-Expression und eine niedrige apoptotische Rate, was darauf hindeutet, dass die optimierte Umgebung ihr Überleben und ihre Integration in das Gewebe aufrechterhielt. Dieses Protokoll stellt eine robuste Referenz für die effiziente Erprobung von Zellersatztherapien im SC-Gewebe dar. Diese Plattform wird es Forschern ermöglichen, ein Ex-vivo-Vorscreening verschiedener Zelltransplantationstherapien durchzuführen und ihnen dabei zu helfen, die am besten geeignete Strategie zu wählen, bevor sie mit In-vivo-Experimenten fortfahren.
Einleitung
Eine traumatische Rückenmarksverletzung (SCI) hat verheerende physische, psychische und wirtschaftliche Folgen für Patienten und Betreuer1. Es wurden viele Versuche unternommen, die axonale Regeneration bei Querschnittlähmung mit unterschiedlichen Ansätzen zu fördern 2,3,4 und einige vorteilhafte Effekte wurden durch die Bildung von neuronalen Relais zwischen proximalen und distalen Neuronen in der Verletzungsstelle durch Zellersatztherapien gezeigt. Das Interesse an Zelltherapien wächst weiter5, da transplantierte Zellen viele Rollen spielen können, darunter trophische Unterstützung, Immunmodulation, Regeneration verlorener neuronaler Schaltkreise durch Induktion von Plastizität, Zellersatz und Axonremyelinisierung6.
In jüngster Zeit konzentrierten sich die Hauptbemühungen auf menschliche neurale Stamm-/Vorläuferzellen (NSCs/NPCs)7. Mehrere Studien deuten darauf hin, dass NSCs/NPCs die Astrozytenantwort modulieren8, die Sekretion von proregenerativen Faktorenfördern 9,10 und fehlende neuronale Zellen bei Querschnittlähmung ersetzen11,12. Studien, die die Differenzierung von transplantierten Zellen in funktionsfähige Neuronen unterstützen, sind jedoch noch dürftig. Darüber hinaus sind das Überleben und die Differenzierung transplantierter Zellen im verletzten Rückenmark (SC) gering13, möglicherweise weil transplantierte Zellen mehrere Wochen oder sogar Monate benötigen, um sich in vivo zu differenzieren. Darüber hinaus haben aktuelle Studien viele biochemische, molekulare, zelluläre und funktionelle Aspekte von Zellersatztherapien nicht vollständig aufgeklärt. In diesem Zusammenhang sind einfache, schnelle und kostengünstige Modelle erforderlich, um die Mechanismen der Zelltransplantation zu untersuchen, die Fähigkeit transplantierter Zellen, sich zu vermehren, sich in bestimmte Zelltypen oder Subpopulationen zu differenzieren und Synapsen mit ansässigen Neuronen zu bilden.
Die Integration histologischer Untersuchungen in die elektrophysiologische Aufzeichnung und das Transkriptom- und Proteom-Profiling ist notwendig, um die molekulare Kaskade, die nach einer Zelltransplantation auftritt, vollständig zu verstehen. Dies wird sicherlich das Design und die Validierung neuer Zellersatztherapien in präklinischen Modellen und klinischen Studien beschleunigen. Tatsächlich hat sich der Einsatz von Nagetieren, Großtieren und nichtmenschlichen Primaten bisher gelohnt, um viele zelluläre Prozesse nach der Transplantation aufzuklären14. Aufgrund der hohen Kosten, der hohen ethischen Auswirkungen sowie der Komplexität des Organismus ist ihre Anwendung jedoch oft nicht einfach oder nicht ausreichend, um biochemische und molekulare Prozesse zu entschlüsseln. Darüber hinaus können sie viele Nachteile aufweisen, die mit biologischen Unterschieden korrelieren, sowohl zwischen den Arten (Stoffwechsel) als auch innerhalb der Arten (Geschlecht, Alter). Diese Faktoren, zusammen mit externen Faktoren wie Stresssituationen, könnten das Ergebnis eines Experiments und ihre Vorhersagbarkeit im Hinblick auf die therapeutische Umsetzung auf den Menschen verändern 15,16,17.
Daher verwenden viele Gruppen neben Tiermodellen auch 2D-in-vitro-Zellkulturen und ex vivo organotypische Schnitte (ex vivo-Kulturen). Die 2D-Zellkultur ist das am häufigsten verwendete System zur Untersuchung spezifischer biologischer Prozesse auf Einzelzell- und/oder Zellpopulationsebene. Dennoch spiegeln Monolayer-Zellkulturen nicht die Komplexität wider, die in einem ganzen Organismus zu finden ist. Das Fehlen von Gewebestrukturen und physiologischer Umgebung erlaubt es den 2D-Kultursystemen nicht, wichtige strukturelle, morphologische und funktionelle Aspekte des untersuchten Gewebes vollständig zu emulieren 18,19,20.Organotypische Kulturen können einige dieser Probleme überwinden. Organotypische Modelle basieren auf der Explantation eines Fragments eines Gewebes oder Organs und dessen Ex-vivo-Konservierung für einen begrenzten Zeitraum 21,22. Insbesondere werden Scheiben des explantierten Gewebes mit einer präzisen Dicke erzeugt, die es ermöglicht, dass die Nährstoffe fast alle Zellen in den Scheiben leicht erreichen können. Sie können aus verschiedenen Regionen des Zentralnervensystems gebildet werden, wie z. B. dem Hippocampus, dem Hypothalamus, dem Kleinhirn, dem Thalamus, der Großhirnrinde, der Substantia nigra und dem Striatum sowie dem Rückenmark23. Organotypische Kulturen bewahren die Gewebearchitektur, die räumliche Verteilung der Zellen, die zelluläre Vielfalt und die Umgebung (d.h. die Zusammensetzung der extrazellulären Matrix) des Ursprungsorgans. Darüber hinaus bewahren sie die ursprüngliche neuronale Aktivität, die Verbindungen zwischen den Zellen und insbesondere die Kurzstreckenschaltkreise nach der Explantation.
Diese Aspekte bieten einige Vorteile für ex vivo-Kulturen sowohl in Bezug auf Monolayer-Kulturen als auch auf Tiermodelle. Sie behalten wichtige Gewebemerkmale bei, die in vivo gefunden werden, jedoch mit einer Reduzierung der Kosten und der Möglichkeit, verschiedene Arten von molekularen, zellulären und funktionellen Experimenten mit einer genauen Regulierung der Umweltparameter der Kultur durchzuführen 24,25,26,27,28,29. Organotypische Schnitte können auch genutzt werden, um Modelle für verschiedene neurologische Erkrankungen zu entwickeln, indem sie wichtigen histopathologischen Merkmalen bestimmter Erkrankungen ähneln30. Darüber hinaus sind sie durch die Beibehaltung der ursprünglichen multizellulären Gewebeumgebung geeignete Plattformen für das Wirkstoffscreening und für die Erprobung neuroprotektiver und neuroregenerativer Moleküle und Materialien.
In dieser Arbeit schlagen wir die Verwendung von organotypischen SC-Kulturen als Modell zur Optimierung von NSC-Transplantationen vor. Dies ist nicht trivial, da optimale Kultivierungsbedingungen erforderlich sind, um das Überleben sowohl des Wirts (SC-Gewebe) als auch des Transplantats (NSCs) über Wochen zu gewährleisten. Verschiedene Forschungsgruppen transplantierten in organotypische Kulturen, aus dem Gehirn und aus SC, verschiedene Zelltypen. Die meisten Arbeiten zeigten die Transplantation von mesenchymalen Stammzellen 31,32,33, olfaktorischen Hüllzellen34 oder NSCs 35,36,37,38,39,40 und bewerteten die Wechselwirkungen der transplantierten Zellen mit den Wirtszellen, das Überleben des gesamten Systems und ob sich die transplantierten Zellen in Neuronen oder neuronenähnliche Zellen differenzierten in der ex vivo Gewebeumgebung 32,33,41. Einige von ihnen untersuchten das regenerative Potenzial von Zellen nach der Transplantation, indem sie ihr axonales Wachstum im Gewebebeobachteten 37,40,41, die myelinisierende Fähigkeit von transplantierten Vorläufern von Oligodendrozyten42, die Migration transplantierter Zellen in das Wirtsgewebe43 und ob die transplantierten Zellen Faktoren freisetzten, die in Richtung einer proregenerativen Umgebung drängen31. Eine Einschränkung der aktuellen Studien besteht darin, dass sie die Transplantation nicht über einen längeren Zeitraum untersuchen.
In Anbetracht der Tatsache, dass NSCs anscheinend mehrere Wochen benötigen, um in vivo zu differenzieren 44,45, konzentriert sich diese Studie auf die Generierung und Aufrechterhaltung langfristiger (≥30 Tage) Maus-SC-Schnitte für bis zu 90 Tage. Es wurde festgestellt, dass die Schnitte ihre ursprüngliche anatomische Struktur beibehalten und über die Zeit eine niedrige und stabile apoptotische Rate sowie eine hohe Zellviabilität aufweisen. Wir beobachteten eine diffuse Expression der neuronalen Marker RNA-binding fox-1 homolog 3 (RBFOX3) und neurofilament light chain (NFL), wobei letztere im Laufe der Zeit einen zunehmenden Trend der axonalen Keimung um die Schnitte zeigten, was ihren gesunden Zustand bestätigt. Darüber hinaus haben wir in den ersten Stadien der neuronalen Differenzierung erfolgreich GFP-exprimierende humane SC-abgeleitete neuroepitheliale Stammzellen (h-SC-NES) in die SC-Schnitte transplantiert. Das NSC-Transplantat wurde 30 Tage nach der Transplantation aufbewahrt und die Zellen zeigten während des gesamten Kulturzeitraums eine GFP-Expression. Es wurde auch festgestellt, dass die apoptotische Rate der Zellen am Tag nach der Transplantation (DPT) 30 in Bezug auf den apoptotischen Ratenwert übereinstimmte, der bei DPT 7 in denselben Zellenbeobachtet wurde 40. Die Zellen schienen sich in die Gewebeumgebung einzunisten und überlebten bis zu mehreren Wochen.
Zusammenfassend zeigen unsere Daten, dass es möglich ist, organotypische Scheiben in Kultur für 3 Monate zu erhalten, ohne ihre ursprüngliche Zytoarchitektur und das Gewebemilieu zu beeinträchtigen. Am wichtigsten ist, dass sie genutzt werden können, um Zelltherapien zu testen, bevor mit einem In-vivo-Experiment fortgefahren wird, wodurch die Kosten und die Versuchszeit reduziert werden. Im Folgenden veranschaulichen wir im Detail alle Passagen zur Generierung von organotypischen Slices für Maus-SC und wie sie über einen längeren Zeitraum (≥30 Tage) aufrechterhalten werden können. Darüber hinaus erklären wir ausführlich, wie eine NPC-Transplantation in die Schichten durchgeführt und wie sie für die nachgelagerte Analyse aufbewahrt werden.
Protokoll
Die Tierverfahren wurden unter strikter Einhaltung der vom italienischen Gesundheitsministerium und der lokalen Ethikkommission der Universität Pisa genehmigten Protokolle in Übereinstimmung mit der Richtlinie 2010/63/EU (Projektlizenz Nr. 39E1C) durchgeführt. N.5Q7, veröffentlicht am 30.10.2021). C57BL/6J-Mäuse wurden in einer regulierten Umgebung (23 ± 1 °C, 50 ± 5 % Luftfeuchtigkeit) mit einem 12-stündigen Hell-Dunkel-Zyklus mit Futter und Wasser ad libitum gehalten.
Alle Arbeiten im Zusammenhang mit h-SC-NES-Zellen wurden gemäß den NIH-Richtlinien für die Gewinnung und Verteilung von menschlichem Gewebe für biomedizinische Forschungszwecke und mit Genehmigung der Humanuntersuchungsausschüsse und institutionellen Ethikkommissionen jedes Instituts, von dem die Proben entnommen wurden, durchgeführt. Die endgültige Genehmigung wurde vom Ausschuss für Bioethik der Universität Pisa eingeholt (Review No. 29/2020). Die anonymisierten menschlichen Proben wurden durch den Joint MRC/Wellcome Trust Grant (099175/Z/12/Z), Human Developmental Biology Resource (www.hdbr.org), zur Verfügung gestellt. Es wurde eine entsprechende Einwilligungserklärung eingeholt und alle verfügbaren nicht identifizierenden Informationen wurden für jede Probe aufgezeichnet. Das Gewebe wurde in Übereinstimmung mit den ethischen Richtlinien und Vorschriften für die Forschungsnutzung von menschlichem Hirngewebe behandelt, die von den NIH (http://bioethics.od.nih.gov/humantissue. html) und der WMA-Deklaration von Helsinki (http://www.wma.net/en/30publications/10policies/b3/index.html) festgelegt wurden.
1. Vorbereitung von Lösungen und Geräten für die Isolierung und Kultivierung des Rückenmarks (SC)
- Beschichtungslösung für Membraneinlagen
- Bereiten Sie die Beschichtungslösung vor (Tabelle 1): eine wässrige Lösung mit 0,1 mg mL-1 Kollagen, 0,01 mg mL-1 Poly-L-Lysin und 0,01 mg mL-1 Laminin.
- Legen Sie jeden Membraneinsatz in eine 35-mm-Schale oder eine 6-Well-Platte.
- Geben Sie 1 mL Beschichtungslösung auf die Oberseite der Membran: Inkubieren Sie die Lösung 4 Stunden lang bei Raumtemperatur (RT); Entfernen Sie es dann und lassen Sie die Membraneinlage über Nacht trocknen (EIN). Lagern Sie die Membraneinlagen bis zu ihrer Verwendung bei 4 °C.
HINWEIS: Alle Passagen sollten unter sterilen Bedingungen durchgeführt werden. Die Membranbeschichtung sollte vor der Verwendung maximal 1 Woche bei 4 °C konserviert werden, um einen Proteinabbau und eine suboptimale Schichtadhäsion auf der Membran zu vermeiden.
- Medienvorbereitung: organotypisches Medium, Präpariermedium, Transplantatmedium
- Organotypisches Medium (OM, Tabelle 1) herstellen.
- Bereiten Sie das Seziermedium wie in Tabelle 1 beschrieben vor.
- Bereiten Sie das Transplantatmedium vor (GM, optimiert nach Onorati et al.46, Tabelle 1).
HINWEIS: Die Lösungen sollten unter sterilen Bedingungen und kurz vor ihrer Verwendung (1 Tag vor oder am selben Tag des Versuchs) hergestellt werden.
- Materielle Vorbereitung für die Operation
- Halten Sie in der Biosicherheitswerkbank Folgendes griffbereit: das Präparierstereomikroskop und die chirurgischen Instrumente: zwei Paar Mikroscheren, zwei Paar gerade Pinzetten und zwei Paar gebogene Pinzetten.
- Bereiten Sie in der Biosicherheitswerkbank das Zerkleinerungsinstrument vor, indem Sie es mit einer Klinge ausstatten, um den SC in Scheiben zu schneiden. Drehen Sie eine Schraube des Häckslers, um den Metallarm an der Stelle anzuheben, an der die Klinge platziert werden soll. Platzieren Sie die Klinge an der dafür vorgesehenen Stelle, senken Sie den Metallarm mit der Klinge ab, bis er das Schneiddeck berührt, und fixieren Sie ihn, indem Sie die sichere Schraube mit einem Inbusschlüssel festziehen, bis die Klinge fest sitzt. Drehen Sie die mikrometrische Schraube auf die gewünschte Scheibendicke (in der Regel 350 μm). Prüfen Sie, ob das Messer genau senkrecht zum Mähdeck platziert ist.
HINWEIS: Eine genaue senkrechte Platzierung der Klinge in Bezug auf das Mähdeck ist erforderlich, um den Schnitt korrekt durchzuführen. - Bereiten Sie in der Biosicherheitswerkbank vor: zwei Pasteurpipetten aus Kunststoff (notwendig, um die isolierten SC und die Scheiben zu bewegen), mindestens vier 35-mm- und zwei 60-mm-Schalen sowie eine Schachtel mit frischem Eis.
- Sterilisieren Sie alle Instrumente kurz vor ihrer Verwendung mit 70 % Ethanol und UV (ein Zyklus von 20 Minuten), um die Sterilität der Kultur zu erhalten.
2. Isolierung von Maus-SC und Slice-Generierung
- Isolierung des Maus-SC
- Opfern Sie Mauswelpen am postnatalen Tag 3 (P3) gemäß der Projektlizenz.
- Durch eine Mittellinien-Laparotomie mit der Mikroschere isolieren Sie den Lendenwirbelbereich der Wirbelsäule vom Rest des Mauskörpers und legen ihn in ein Kaltdissektionsmedium in einer 35-mm-Schale.
- Schneiden Sie mit einem Präparierstereomikroskop und der Mikroschere das Rückgrat entlang der Sagittalachse und entfernen Sie mit einer geraden Pinzette das SC vorsichtig aus der Wirbelsäulenhöhle.
- Ziehen Sie die Hirnhäute vorsichtig mit einer geraden Pinzette aus dem isolierten Lendenwirbelbereich des SC ab.
- Übertragen und inkubieren Sie die isolierte SC-Lendenwirbelsäule 10-15 Minuten lang in kaltem und frischem Dissektionsmedium, bevor Sie mit dem folgenden Schritt fortfahren.
- Generierung von Slices
- Nehmen Sie mit einer Pasteurpipette aus Kunststoff den isolierten SC-Lendenbereich aus dem Präpariermedium und legen Sie ihn senkrecht zur Klinge auf das Schneiddeck des Chopper-Instruments.
HINWEIS: Die korrekte Positionierung des SC in Bezug auf die Klinge (senkrecht) ist für die korrekte Erzeugung von SC-Scheiben unerlässlich. - Entfernen Sie das restliche Seziermedium auf dem Deck um den SC mit Hilfe der Pasteurpipette und sterilem Saugpapier. Fahren Sie mit der automatischen Schnitterstellung von SC fort.
- Sobald die Scheiben erzeugt sind, geben Sie mit den Scheiben etwas frisches Seziermedium mit einer Pasteurpipette auf das Schneidedeck. Dann die Scheiben in eine 35-mm-Schale mit frischem Seziermedium geben und 15 Minuten lang inkubieren.
- Waschen Sie während der Scheibeninkubation die Oberfläche der Membraneinsätze 3x mit OM mit einer Pasteur-Kunststoffpipette. Lassen Sie dann 1 ml OM an der Unterseite jedes Membraneinsatzes.
- Überprüfen Sie die Scheiben unter dem Präparierstereomikroskop. Säen Sie die gewünschte Anzahl von Scheiben auf die konditionierten Membraneinsätze, indem Sie sie mit einer Pasteurpipette aus Kunststoff übertragen.
- Schieben Sie die Scheiben mit Hilfe der geraden Pinzette in die gewünschte Ausrichtung und Position auf die Membraneinsätze. Entfernen Sie den Überschuss an Medium mit einer Pasteur-Pipette, damit die Scheiben besser an der Membranoberfläche haften können.
HINWEIS: Das Bewegen und Ausrichten der Scheiben mit der geraden Pinzette sollte vorsichtig durchgeführt werden, um eine Beschädigung des Gewebes oder der Membraneinlage zu vermeiden. - Nach 30 min Inkubation bei 37 °C wird der Einsatz in eine neue Petrischale umgefüllt.
HINWEIS: Berühren Sie während des Mediumwechsels den Kunststoffring, aber nicht die Membranen. - Geben Sie 1 ml frisches OM, ergänzt mit dem von Gliazelllinien abgeleiteten neurotrophen Faktor (GDNF) 100 μg ml-1 an die Unterseite des Membraneinsatzes.
- Die Scheiben bei 37 °C inkubieren. Bezeichnen Sie den ersten Tag in der Kultur als Tag ex vivo (DEV) 0.
- Nehmen Sie mit einer Pasteurpipette aus Kunststoff den isolierten SC-Lendenbereich aus dem Präpariermedium und legen Sie ihn senkrecht zur Klinge auf das Schneiddeck des Chopper-Instruments.
3. Langfristige Kultivierung organotypischer Scheiben
- Halten Sie die Scheiben bis zum gewünschten Zeitpunkt bei 37 °C in Kultur.
- Ersetzen Sie das Medium durch frisches OM bei DEV 1, wie in den Schritten 2.2.7-2.2.8 beschrieben.
- Schalten Sie bei DEV 3 das Medium auf den GM um, um die geeignete Umgebung für die Transplantation von Stammzellen am nächsten Tag zu schaffen. Ersetzen Sie das Medium alle 48 Stunden durch frisches GM (z. B. DEV 5, DEV 7...).
- Geben Sie täglich frisches GDNF (Endkonzentration 100 μg mL-1) bis DEV 7 in das Medium. Fügen Sie es nach DEV 7 nur hinzu, wenn das Medium gewechselt wird (Schritt 3.3).
4. h-SC-NES-Zellkultivierung
HINWEIS: h-SC-NES-Zellen werden in Kultur in Gegenwart von Wachstumsfaktoren aufbewahrt (NES-Medium, Schritt 4.1.1). Vor der Transplantation werden die Zellen 7 Tage lang im Prädifferenzierungszustand plattiert, indem die Wachstumsfaktoren aus dem Medium entfernt werden (Prädifferenzierungsmedium: NES-Medium ohne Fibroblasten-Wachstumsfaktor 2 (FGF-2) und epidermalen Wachstumsfaktor (EGF), Schritt 4.1.2). Anschließend werden die Zellen vor der Transplantation 2 Tage lang im Differenzierungszustand (Differenzierungsmedium, Schritt 4.1.3) plattiert. Die Differenzierung wird durch die Zugabe von neurotrophen Supplementen (brain-derived neurotrophic factor, BDNF) zum Differenzierungsmedium unterstützt. Die Erhaltung, die Spaltung, die Vordifferenzierung und die Differenzierung von h-SC-NES-Zellen12,46 werden im Folgenden ausführlich beschrieben.
- Medienvorbereitung: NES, Prädifferenzierungs- und Differenzierungsmedien
- Bereiten Sie das Erhaltungsmedium für h-SC-NES-Zellen vor (NES-Medium, Tabelle 1).
- Bereiten Sie das h-SC-NES-Zellvordifferenzierungsmedium vor (Vordifferenzierungsmedium, Tabelle 1).
- Bereiten Sie das h-SC-NES-Zelldifferenzierungsmedium vor (Differenzierungsmedium, Tabelle 1). BDNF frisch zugeben, wenn das Medium gewechselt wird oder wenn die Zellen im Differenzierungszustand zum ersten Mal plattiert werden.
HINWEIS: Alle Medien sollten unter sterilen Bedingungen hergestellt und mit 0,22-μm-Filtern gefiltert werden.
- Beschichtungslösung für h-SC-NES-Zellen
HINWEIS: h-SC-NES-Zellen werden in POLFN-beschichteten Kulturträgern (POLFN = Poly-L-Ornithin, Laminin, Fibronektin) aufbewahrt.- Bereiten Sie die Beschichtungslösung in einer Tube vor: eine Poly-L-Ornithin-Lösung mit Laminin (5 μg mL-1) und Fibronektin (1 μg mL-1).
- Übertragen Sie die vorbereitete Beschichtungslösung in den Zellkulturträger und achten Sie darauf, dass Sie so viel hinzufügen, dass die gesamte Oberfläche des Zellkulturträgers bedeckt ist. Inkubieren Sie die Beschichtung 1 h bei 37 °C oder über Nacht bei 4 °C.
- Entfernen Sie die Beschichtungslösung von den Zellkulturträgern.
HINWEIS: Die POLFN-Lösung kann noch zwei weitere Male recycelt werden, aber Laminin und Fibronektin sollten jedes Mal frisch hinzugefügt werden. - Waschen Sie die Beschichtung 3x mit sterilem Wasser in Zellkulturqualität. Lagern Sie die Beschichtungen bei 4 °C oder verwenden Sie sie.
HINWEIS: Beschichtungen sollten innerhalb von 1 Woche verwendet werden. Danach gelten die Beschichtungen aufgrund von Abbauprozessen der zugesetzten Proteine als abgelaufen.
- Wartung der h-SC-NES-Zellen
- Bewahren Sie h-SC-NES-Zellen in Kultur im NES-Medium auf. Überprüfen Sie die Zellen jeden Tag unter dem Mikroskop, um zu überwachen, wann sie den Konfluenz erreichen.
- Wechseln Sie alle 2 Tage die Hälfte des Mediums: Entfernen Sie die Hälfte des konditionierten Mediums und fügen Sie das frische hinzu (berücksichtigen Sie eine Verdunstungsrate von 20%).
- Wenn die Zellen die Konfluenz erreichen, fahren Sie mit der Teilung fort, wie in Schritt 4.4 beschrieben.
- h-SC-NES-Zellpassage
HINWEIS: Die Zellen werden wie folgt geteilt12:- Entfernen Sie das konditionierte Medium und waschen Sie die Zellen einmal mit Dulbecco's phosphatgepufferter Kochsalzlösung (DPBS) ohne Ca2+/Mg2+.
- Entfernen Sie das DPBS und fügen Sie den Zellen Trypsin/EDTA-Lösung hinzu, um eine enzymatische Ablösung durchzuführen. Inkubieren Sie die Zellen bei 37 °C für 30 s bis 1 min.
- Überprüfen Sie nach der Inkubation die Zellen unter dem Mikroskop: Wenn sie nicht abgelöst sind, klopfen Sie leicht auf die Zellkulturhalterung, um eine mechanische Ablösung durchzuführen, und inkubieren Sie sie bei 37 °C für weitere 30 Sekunden.
- Nach der Inkubation inaktivieren Sie das Trypsin/EDTA, indem Sie 4 Volumina DPBS/fötales Rinderserum (FBS) (10 % vol/vol) Lösung zur Zellkulturträger mit Zellen und Trypsin/EDTA hinzufügen. Pipettieren Sie die Lösung vorsichtig auf der Stützfläche der Zellkultur nach oben und unten, damit sich alle Zellen ablösen können. Sammeln Sie die Zellsuspension in einem Röhrchen.
- Die Zellsuspension bei 200 × g 3 min lang zentrifugieren. Entsorgen Sie den Überstand und suspendieren Sie das Pellet in frischem NES-Medium.
- Zählen Sie die Zellen und plattieren Sie sie auf jedem neuen POLFN-beschichteten Kulturträger mit einer Dichte von ̴0,5-1 × 105 Zellen/cm2.
- Fügen Sie Y-27632 (10 μM) hinzu und stellen Sie die Zellen auf 37 °C. Überprüfen Sie sie jeden Tag bis zum Zusammenfluss und teilen Sie sie dann wieder für die Wartung/Erweiterung oder das Zellbanking auf.
- Vordifferenzierung der h-SC-NES-Zellen
- Teilen Sie die Zellen wie in Schritt 4.4 beschrieben.
- Plattieren Sie die Zellen auf den POLFN-beschichteten Zellkulturträgern mit einer Dichte von ̴0,5-1 × 105 Zellen/cm2 in Vordifferenzierungsmedium. Nach der Teilung wird Y-27632 (10 μM) zugegeben. Nennen Sie den ersten Tag in der Prädifferenzierung Tag in vitro (DIV) 0.
- Wechseln Sie die Hälfte des Mediums alle 2-3 Tage (siehe Schritt 4.3.2).
- Halten Sie die Zellen bis DIV 7 im Prädifferenzierungszustand und fahren Sie dann mit Schritt 4.6 fort.
- h-SC-NES-Zelldifferenzierung
- Bei DIV 7 der Prädifferenzierung teilen Sie die Zellen wie in Schritt 4.4 beschrieben.
- Plattieren Sie die Zellen auf POLFN-beschichteten Zellkulturträgern mit einer Dichte von ̴1-1,5 × 105Zellen/cm2in Differenzierungsmedium. Nach der Teilung werden Y-27632 (10 μM) und BDNF (30 ng mL-1) zugegeben.
- Nach 2 Tagen Differenzierung (DIV 10) werden die Zellen für die Transplantation in Scheiben gespalten.
5. h-SC-NES-Zelltransduktion mit GFP-tragenden lentiviralen Vektoren
HINWEIS: Die Zelltransduktion wird während der Erhaltungsphase der h-SC-NES-Zellen durchgeführt. Wenn Zellen korrekt transduziert sind, können diese expandiert werden und die zuvor beschriebenen Vordifferenzierungs- und Differenzierungsprotokolle werden angewendet (Schritte 4.5 und 4.6).
- Vorbereitung des Zelltransduktionsmediums
HINWEIS: Das Zelltransduktionsmedium wird hergestellt, indem ein bestimmtes Volumen des NES-Mediums und ein genaues Volumen der lentiviralen Vektorbasis (LVS) nach verschiedenen Parametern gemischt werden: dem gewünschten MOI (Multiplizität der Infektion = Verhältnis der Anzahl der Viruspartikel zur Anzahl der Wirtszellen in einem gegebenen Infektionsmedium); die Anzahl der plattierten Zellen; die Anfangskonzentration des LVS-Präparats (=LVS PFU, plaquebildende Einheit); die Oberfläche des verwendeten Kulturgefäßes.- Berechnen Sie das korrekte Volumen des LVS-Präparats, das dem NES-Medium zugesetzt werden soll, entsprechend dem gewählten Trägheitsmoment unter Verwendung der Gleichungen (1) und (2).
(n Zellen auf Platte/cm 2) × cm2 Zellkulturträger × MOI = LVS PFU für den gewählten MOI (1)
LVS PFU : Tot Initial LVS Vol (μL) = LVS PFU für MOI : LVS Vol zum Hinzufügen zum Medium (μL)(2)
HINWEIS: Die LVS-PFU (anfängliche PFU von LVS) und das gesamte anfängliche LVS-Volumen werden vom Hersteller angegeben. Die LVS-PFU für das gewählte MOI wird wie in Gleichung (1) beschrieben berechnet. Auf diese Weise können wir das Volumen des LVS-Präparats erhalten, das zum Gesamtvolumen des NES-Mediums (basierend auf der Zellkulturunterstützung) für das gewählte MOI addiert werden muss, wie in Gleichung (2) beschrieben.
Beispiel: Wir haben MOI 3 verwendet, basierend auf früheren Laborerfahrungen (das MOI kann je nach verwendeter Zelllinie und viralem Präparat variieren). Wenn das gewünschte MOI 3 beträgt, die Anzahl der zu plattierenden Zellen 0,5 × 105/cm2 beträgt und der Kulturträger ein 1-Well-MW24 (2 cm2) ist, unter der Annahme, dass die anfängliche LVS PFU/TU (Plaque forming Unit/Transducing Unit) 25 × 106 PFU in 1 mL (1.000 μL = initial LVS vol) beträgt, lauten die Berechnungen wie folgt:
Küvetten plattiert in 1 Well-MW24 (2 cm2) = 0,5 × 105 Zellen × 2 cm2 = 1 × 105 Zellen
1 × 105 Zellen × 3 (MOI) = 3 × 105 PFU = LVS PFU für MOI 3
25 × 106 PFU:1.000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = LVS-Volumen, das dem Medium hinzugefügt werden soll
Um die Zellen mit Zelltransduktionsmedium mit MOI 3 in 1 Well-MW24 zu transduzieren, fügen Sie 12 μl der anfänglichen LVS-Vorbereitung zu dem NES-Medium (238 μl) hinzu, das für 1 Well MW24 vorbereitet wurde. Das endgültige Gesamtvolumen beträgt 250 μL.
HINWEIS: Das Medium wird in der Regel am Tag der Transduktion unter sterilen Bedingungen frisch aufbereitet.
- Berechnen Sie das korrekte Volumen des LVS-Präparats, das dem NES-Medium zugesetzt werden soll, entsprechend dem gewählten Trägheitsmoment unter Verwendung der Gleichungen (1) und (2).
- h-SC-NES-Transduktionsprotokoll
- Platte h-SC-NES-Zellen mit niedrigem Durchgang auf einer POLFN-beschichteten 24-Multiwell-Platte (oder in einem anderen Kultivierungsträger) mit einer Dichte von 0,5 × 105/cm2 in NES-Medium.
- Sammeln Sie am nächsten Tag das konditionierte NES-Medium aus den Vertiefungen, in denen die Zellen plattiert wurden. Abhängig von der gewählten Kultivierungsunterstützung fügen Sie den Zellen das geringste Volumen an frischem Zelltransduktionsmedium hinzu, das erforderlich ist, um die Aussaatoberfläche gleichmäßig zu bedecken (z. B. 250 μl/Vertiefung einer 24-Multiwell-Platte).
- Inkubieren Sie dann die h-SC-NES-Zellen für 6 Stunden bei 37 °C. Danach wird das zuvor gesammelte konditionierte Medium zu den Zellen gegeben (200 μl/Well einer 24-Multiwell-Platte) und die Zellen bei 37 °C inkubiert.
- Waschen Sie am nächsten Tag die h-SC-NES-Zellen einmal mit DPBS und führen Sie einen Totalmedienwechsel (NES-Medium) durch.
- Überprüfen Sie die Zellen in den folgenden Tagen unter einem Fluoreszenzmikroskop, um die GFP-Expression zu beobachten.
- Erweitern Sie die h-SC-NES-Zellen für Zellbanken und Transplantationen.
6. Zelltransplantation in SC-Schnitte und Co-Kultivierung
- Präparation von Mikronadeln aus Glas
- Verwenden Sie einen Abzieher, um feine Nadeln aus Borosilikatglaskapillaren zu gewinnen. Stellen Sie den Abzieher wie folgt ein: HEAT 990, PULL 350.
HINWEIS: Aus einer Kapillare können zwei feine Nadeln gewonnen werden.
- Verwenden Sie einen Abzieher, um feine Nadeln aus Borosilikatglaskapillaren zu gewinnen. Stellen Sie den Abzieher wie folgt ein: HEAT 990, PULL 350.
- Zellvorbereitung für die Transplantation
- Teilen Sie die Zellen wie in Schritt 4.4 beschrieben.
HINWEIS: Wenn die Zellen keinen fluoreszierenden Reporter exprimieren, markieren Sie sie mit einem Zellverfolgungsfarbstoff, um sie nach der Transplantation und während der Langzeitkultur mit einem Fluoreszenzmikroskop zu überwachen. Befolgen Sie das Protokoll des gewählten Herstellers für den Etikettierungsschritt. - Zählen Sie die Zellen nach der Teilung und zentrifugieren Sie sie bei 200 × g für 3 min. Suspendieren Sie das erhaltene Pellet mit frischem Medium + Y-27632 (10 μM), um die gewünschte Zellkonzentration zu erhalten (normalerweise ein Bereich zwischen 30.000 und 50.000 Zellen μL-1).
- Übertragen Sie die Zellsuspension in ein 500 μL oder 1,5 mL Röhrchen und legen Sie es auf Eis. Die Zellen sind bereit für die Transplantation.
- Teilen Sie die Zellen wie in Schritt 4.4 beschrieben.
- Zelltransplantation in organotypische Scheiben
HINWEIS: Führen Sie h-SC-NES-Zelltransplantationen in die organotypischen SC-Scheiben der Maus mit einem Luft-Mikroinjektor und Glasmikronadeln durch.- Laden Sie eine Mikronadel aus Glas mit 4 μl Zellsuspension mit einer Mikropipette und Mikroladerspitzen.
HINWEIS: Vermeiden Sie die Bildung von Luftblasen in der Nadel, da diese den Mikroinjektionsprozess behindern könnten. Wenn sich Blasen bilden, entfernen Sie diese mit der Mikropipette. - Platzieren Sie die Nadel in der dafür vorgesehenen Halterung des Mikroinjektors und brechen Sie die Nadelspitze mit der geraden Pinzette.
HINWEIS: Brechen Sie die Glasnadel näher an der Spitze, um die Bildung großer Löcher zu vermeiden. - Stellen Sie vor dem Umpflanzen in die Scheiben die Mikroinjektionsparameter ein. Stellen Sie den Druck auf 10 psi ein.
HINWEIS: Der Druckwert kann je nach Mikroinjektor und Beobachtungen des Bedieners geändert werden: Der Druck sollte ausreichen, um die Zellsuspension zu mikroinjizieren, um Gewebeschäden zu vermeiden. - Geben Sie auf einen kalibrierten Objektträger einen Tropfen Mineralöl mit einer Pasteurpipette und injizieren Sie die Zellsuspension in den Tropfen. Der Durchmesser der erhaltenen Kugel der Zellsuspension im Öltropfen korreliert mit einem spezifischen Mikroinjektionsvolumen. Ändern Sie die Mikroinjektionsparameter nach Bedarf, um einen Durchmesser der Zellsuspensionskugel von 0,2 mm für die Injektion von 4 nL zu erreichen.
- Nachdem Sie das richtige Volumen eingestellt haben, injizieren Sie die Zellsuspension schnell in die Scheiben. Überprüfen Sie unter dem Fluoreszenzstereomikroskop, ob die Zellen in den Scheiben vorhanden sind, um sicherzustellen, dass die Mikroinjektion/Transplantation erfolgreich war.
HINWEIS: Die Zellsuspension kann manchmal die Nadel verstopfen: Versuchen Sie in diesem Fall, die Verstopfung der Zellsuspension zu beseitigen, indem Sie die Injektionsparameter ändern oder eine neue Nadel mit frischer Zellsuspension beladen. - Nach der Transplantation legen Sie die Scheiben bei 37 °C und 5 % CO2bis zum gewünschten Zeitpunkt und führen Sie jeden zweiten Tag einen Mediumwechsel durch, wie in den Schritten 2.2.7-2.2.8 beschrieben.
- Laden Sie eine Mikronadel aus Glas mit 4 μl Zellsuspension mit einer Mikropipette und Mikroladerspitzen.
7. Immunfluoreszenz-Färbung
- Tag 1
- Entfernen Sie das Medium von der Unterseite der Einlegebahn und waschen Sie die Scheiben 3x mit vorgewärmtem DPBS.
- Fixieren Sie die Scheiben mit vorgewärmtem 4%igem Formaldehyd (FA): Entfernen Sie das DPBS und geben Sie 1,5 mL 4% FA an die Unterseite des Membraneinsatzes mit den Scheiben. Nach 15 min Inkubation bei RT 1 ml mehr 4 % FA auf die Oberseite des Membraneinsatzes geben und 15 min bei RT inkubieren. Gesamtfixierungszeit: 30 min bei RT
- Die 4% FA entfernen und die Scheiben 3 x 10 min mit DPBS waschen.
- Schneiden Sie die Membran des Einsatzes mit einem chirurgischen Messer umlaufend ein, trennen Sie die Membran mit den Scheiben von der Kunststoffkomponente des Einsatzes und fahren Sie mit den Immunfluoreszenzschritten fort.
HINWEIS: Nach diesem Schritt schwimmt die Membran mit den Scheiben in DPBS in der Schale. - Permeabilisieren Sie mit 1 ml/Membran einer Lösung mit 0,7% Triton in DPBS für 10 min bei RT.
- Die Permeabilisierungslösung wird entfernt und die Proben 4 Stunden lang bei 4 °C mit 1 ml/Membran Blockierungslösung inkubiert, die aus 0,5 % Triton und 10 % FBS in DPBS besteht.
- Entfernen Sie die Blockierungslösung und fügen Sie den Scheiben die primären Antikörper in ihrer Arbeitsverdünnung hinzu, z. B. Maus-Anti-Neurofilament (NFL)-Antikörper, 1:500; Kaninchen Anti-NFL, 1:500; Kaninchen-Anti-RBFOX3 (NeuN)-Antikörper, 1:400; antiaktives Caspase-3 (aCASP3) für Kaninchen, 1:400; Maus-Anti-Mensch-Kerne, (Hu-Nu), 1:400; Kaninchen Anti-Hu-Nu, 1:400; Maus-Anti-GFP, 1:400 (wie in Tabelle 1 berichtet) in 1 ml Antikörperlösung, bestehend aus 0,5 % Triton, 1 % FBS in DPBS. Inkubieren Sie ON bei 4 °C.
- Tag 2
- Waschen Sie die Membranen 3 x 10 min lang mit 1-2 mL DPBS.
- Inkubieren Sie die Membran mit Sekundärantikörpern (z. B. Ziegen-Anti-Maus-IgG (H+L)-Sekundärantikörper, Alexa Fluor 488, 1:500; Ziegen-Anti-Kaninchen-IgG (H+L)-Sekundärantikörper, Alexa Fluor 568, 1:500; Ziegen-Anti-Maus-IgG (H+L)-Sekundärantikörper, Alexa Fluor 647, 1:500; Ziegen-Anti-Kaninchen-IgG (H+L)-Sekundärantikörper, Alexa Fluor 647, 1:500 wie in Tabelle 1) und Hoechst/DAPI für Zellkerne, verdünnt in 1 ml/Membran der Antikörperlösung (Triton 0,5 % + FBS 1 % in DPBS) für 3 h bei RT.
HINWEIS: Schützen Sie die Proben sorgfältig vor Licht, um ein Ausbleichen der Sekundärantikörper während der Inkubation und in den folgenden Schritten zu vermeiden. - Entfernen Sie die Antikörperlösung und waschen Sie sie 3 x 10 min lang mit DPBS (1-2 mL).
- Ersetzen Sie das DPBS durch frisches DPBS und lagern Sie es bei 4 °C unter lichtgeschützten Bedingungen.
- Am Ende des Immunfluoreszenzprotokolls montieren Sie die Membranen auf Objektträgern. Geben Sie einen Tropfen mit 200 μl Einbettlösung auf einen Objektträger. Übertragen Sie mit Hilfe einer geraden Pinzette die schwimmende Membran aus der 35-mm-Schale auf ein Deckglas und übertragen Sie dann die Membran mit der Befestigungslösung auf den Objektträger.
- Geben Sie einen Tropfen 100 μl Eindecklösung auf ein neues Deckglas und bedecken Sie die Membran damit, indem Sie sie auf dem Objektträger fixieren. Lassen Sie es über Nacht unter der Chemikalienhaube unter lichtgeschützten Bedingungen trocknen.
- Lagern Sie die Proben bei 4 °C im Dunkeln oder führen Sie bildgebende Analysen durch.
8. Lebend-/Tot-Assay
- Die Arbeitslösung wird durch Aliquotierung von 700 μl pro Schale Frischmedium hergestellt und in der richtigen Arbeitsverdünnung das Sytox (z. B. Komponente B, 1:2.000) und das Calcein AM (z. B. Komponente A, 1:2.000) zugegeben.
HINWEIS: Da die Reagenzien lichtempfindlich sind, schützen Sie die Arbeitslösung vor Licht. - Bestimmen Sie das mittlere Volumen am Boden der Membran und fügen Sie das Sytox und das Calcein AM in der gleichen Arbeitsverdünnung hinzu, die in Schritt 8.1 beschrieben wurde.
- 2 Tropfen à 30 μl auf jede Scheibe der in Schritt 8.1 hergestellten Arbeitslösung geben.
HINWEIS: Schützen Sie die Schüssel vor Licht, indem Sie sie an einen dunklen Ort stellen. - Inkubieren Sie die Scheiben 30 Minuten lang bei RT.
- Nach der Inkubation schneiden Sie die Membran mit einem chirurgischen Messer umlaufend aus dem Einsatz aus: Danach schwimmt die Membran mit den Scheiben in der Arbeitslösung.
- Legen Sie die Membran ohne die Einbettlösung mit Hilfe einer geraden Pinzette kopfüber auf ein Deckglas und geben Sie 100 μl DPBS auf die Membranen, um sie mit Feuchtigkeit zu versorgen.
- Nehmen Sie so schnell wie möglich Live-Bilder mit dem Konfokalmikroskop auf.
HINWEIS: Geben Sie während der Bildaufnahme alle 30 Minuten 2 Tropfen mit je 40 μl DPBS auf die Membran, um ein Austrocknen der Membran zu verhindern.
9. Bildgebung
- Konfokale Bildgebung von fixierten Proben
- Für die qualitative Analyse nehmen Sie Bilder mit einem konfokalen Mikroskop mit den folgenden Erfassungsparametern auf: Stellen Sie die Option "Großes Bild" ein (wählen Sie: 4 x 4), verwenden Sie ein 10-fach-Objektiv, keine Stapel und eine Auflösung von 3.634 x 3.634 Pixeln.
- Für die quantitative Analyse (aCASP3, Calcein und Sytox für Schnitte und aCASP3 für Zellen) nehmen Sie Bilder mit dem konfokalen Mikroskop mit den folgenden Erfassungsparametern auf: 20 x Objektiv, Auflösung von 1.024 x 1.024 Pixeln mit einem Z-Schritt von 3 μm.
- Live-Imaging von transplantierten Schnitten mit dem Stereomikroskop
HINWEIS: Nehmen Sie Bilder mit dem Stereomikroskop im Hellfeld- und Epifluoreszenzmodus auf.- Erfassen Sie mit der Hellfeldeinstellung Bilder der Schichten (hier wird 1 x Objektiv mit 3-fachem Zoom verwendet).
HINWEIS: Ändern Sie das Licht je nach verwendetem Mikroskop und verwenden Sie bei Bedarf die optischen Fasern. - Nehmen Sie mit der Fluoreszenzeinstellung Bilder der transplantierten Zellen mit dem gleichen Objektiv und Zoom auf, das für die Schnitte verwendet wird (siehe Schritt 9.2.1). Verwenden Sie die folgenden Parameter für die Erfassung: Gain 1, Belichtung 200-500 ms, Offset -10.
- Erfassen Sie mit der Hellfeldeinstellung Bilder der Schichten (hier wird 1 x Objektiv mit 3-fachem Zoom verwendet).
- Live-Bildgebung nach Lebend-/Tot-Assay mit dem konfokalen Mikroskop
- Erfassen Sie Bilder mit einem konfokalen Mikroskop mit den folgenden Erfassungsparametern: 20x Objektiv, Auflösung 1.024 x 1.024 Pixel mit einem Z-Schritt von 3 μm.
10. Bildanalyse durch ImageJ
- NFL-, RBFOX3- und DAPI-Bereichsanalyse
- Öffnen Sie die ImageJ-Software (https://imagej.net/software/imagej/).
- Öffnen Sie das Datei-Image, indem Sie auf Datei | Öffnen | Datei auswählen | Öffnen klicken.
- Wählen Sie im Popup-Fenster Stapelansicht | Hyperstack und Farbmodus | Standard (mit automatischer Skalierung).
- Wählen Sie in der Symbolleiste Bild | Farbe | Geteilte Kanäle.
- Wählen Sie die gewünschten Kanäle für die Analyse aus: grüner Kanal für NFL (axonaler Marker), roter Kanal für RBFOX 3 (neuronaler Marker) und blauer Kanal für DAPI (Kernfärbung).
- Gehen Sie für die NFL-Analyse wie folgt vor: Wählen Sie in der Symbolleiste Bild | Anpassen | Schwelle | Wählen Sie die Parameter (dunkler Hintergrund, Algorithmus, z.B. Default) und bewegen Sie den Cursor auf die Werteleiste (unter/über), um den gesamten Neuritenbereich abzudecken und zu umschreiben (Neuriten werden weiß auf dunklem Hintergrund hervorgehoben) | Setzen | Bewerben Sie sich.
- Wählen Sie in der Symbolleiste das Nachzeichnerwerkzeug Zauberstab aus und verwenden Sie es, um automatisch den weißen Bereich zu definieren, der von NFL abgedeckt wird. Presse Analysieren | Messen | Flächenwert inμm 2.
- Führen Sie für die DAPI- und RBFOX3-Analyse die folgenden Schritte aus: Wählen Sie in der Symbolleiste Bild | Anpassen | Schwelle | Wählen Sie die Parameter (weißer Hintergrund, Algorithmus, z.B. Standard) aus und bewegen Sie den Cursor auf die Werteleiste (unter/über), um den gesamten RBFOX3- oder DAPI-Bereich abzudecken und zu umschreiben | Setzen | Bewerben Sie sich.
- Wählen Sie in der Symbolleiste Prozess | FFT | Bandpass-Filter. Verwenden Sie die Schwellenwertleiste , um den von RBFOX3 oder DAPI abgedeckten weißen Bereich entsprechend ihrem Fluoreszenzsignal anzupassen.
- Wählen Sie in der Symbolleiste das Nachzeichnerwerkzeug Zauberstab aus und verwenden Sie es, um automatisch den Bereich zu definieren, der von RBFOX3 oder DAPI abgedeckt wird. Presse Analysieren | Messen | Flächenwert inμm 2.
- Analyse der Apoptose mit ImageJ
- Öffnen Sie die ImageJ-Software (https://imagej.net/software/imagej/).
- Öffnen Sie das Z-Stapel-Datei-Image, indem Sie auf Datei | Öffnen | Datei auswählen | Öffnen klicken.
- Wählen Sie im Popup-Fenster Stapelansicht | Hyperstack und Farbmodus | Standard (mit automatischer Skalierung).
- Wählen Sie in der Symbolleiste Bild | Farbe | Geteilte Kanäle.
- Wählen Sie die gewünschten Kanäle: roter Kanal für aCASP3 (Apoptosemarker für die Analyse) und blau oder cyan für DAPI oder Hu-Nu für Zellkerne. Überlagern Sie dann die Kanäle, indem Sie in der Symbolleiste Bild | Farbe | Kanäle zusammenführen | Erstellen Sie ein Komposit.
- Ziehen Sie die Z-Leiste am unteren Rand des Bildes, um den Z-Stapel des Bildes zu durchsuchen und Stapel im mittleren Bereich der Slices mit aCASP3-Positivität zu identifizieren.
- Wählen Sie in der Symbolleiste Plug-ins | Analysieren | Zähler für Zellen.
- Wählen Sie im geöffneten Popup-Fenster Initialisieren aus, um das Bild für die Zählung vorzubereiten. Wählen Sie dann einen Indikatortyp aus (z. B. Typ 1), und benennen Sie ihn in das zu zählende Objekt um (z. B. aCASP3+ -Zellen). Benennen Sie andere Indikatortypen wie oben beschrieben um, um andere Objekte zu zählen (z. B. DAPI+ - oder Hu-Nu+ -Zellen für die Gesamtzahl der Zellen).
- Wählen Sie im Popup-Fenster den Zählertyp aus, der dem zu zählenden Objekt entspricht (z. B. aCASP3+ -Zellen), wählen Sie dann das Punktwerkzeug in der Symbolleiste aus und beginnen Sie, die Anzahl der apoptotischen Zellen, positiv für aCASP3, manuell zu zählen, indem Sie auf jede positive Zelle im geöffneten Bild klicken.
- Wählen Sie im Zellindikatorfenster einen anderen Indikatortyp aus, und beginnen Sie mit der Zählung der Gesamtzahl der Zellen (DAPI+ -Zellen für Segmente; Hu-Nu+ -Zellen, für transplantierte Zellen).
- Analyse des Lebend-/Tot-Assays mit ImageJ
- Öffnen Sie die ImageJ-Software (https://imagej.net/software/imagej/).
- Öffnen Sie das Z-Stack-Datei-Image, indem Sie auf Datei | Öffnen | Datei auswählen | Öffnen klicken.
- Wählen Sie im Popup-Fenster Stapelansicht | Hyperstack und Farbmodus | Standard (mit automatischer Skalierung).
- Wählen Sie in der Symbolleiste Bild | Farbe | Geteilte Kanäle.
- Wählen Sie die gewünschten Kanäle: grüner Kanal für Calcein (zu analysierender Vitalitätsmarker) und cyanfarbener Kanal für Sytox (toter Marker). Überlagern Sie dann die Kanäle, indem Sie in der Symbolleiste Bild | Farbe | Kanäle zusammenführen | Wählen Sie Komposition erstellen aus.
- Ziehen Sie den Z-Balken am unteren Rand des Bildes, um den Z-Stapel des Bildes zu durchsuchen und Stapel im mittleren Bereich der Segmente mit Calcein- und Sytox-Positivität zu identifizieren.
- Wählen Sie in der Symbolleiste Plug-ins | Analysieren | Zähler für Zellen.
- Wählen Sie im geöffneten Popup-Fenster Initialisieren aus, um das Bild für die Zählung vorzubereiten. Wählen Sie dann einen Indikatortyp aus (z. B. Typ 1) und benennen Sie ihn als das zu zählende Objekt um (z. B. Calcein+ -Zellen). Benennen Sie andere Indikatortypen wie oben beschrieben um, wenn ein anderes Objekt gezählt werden muss (z. B. Sytox+ -Zellen).
- Wählen Sie im Popup-Fenster den Indikatortyp aus, der dem zu zählenden Objekt entspricht. Wählen Sie dann das Punktwerkzeug in der Symbolleiste aus und beginnen Sie, die Anzahl der Calcein+ -Zellen manuell zu zählen, indem Sie auf jede positive Zelle im geöffneten Bild klicken.
- Wählen Sie im Zellzählerfenster einen anderen Zählertyp aus und zählen Sie die Sytox+ -Zellen wie für Calcein beschrieben.
11. Grafiken und statistische Analysen
- Führen Sie alle statistischen Analysen und Diagramme mit der Software Ihrer Wahl durch.
Ergebnisse
Die beschriebenen Methoden ermöglichen die Etablierung von subkutanen organotypischen Schnitten von Mäusen im Stadium P3 und deren Konservierung in Kultur über einen längeren Zeitraum unter gesunden Bedingungen. Darüber hinaus zeigen wir ein Protokoll für die Transplantation von Zellen in die Scheiben und für deren Co-Kultivierung für bis zu 30 Tage (Abbildung 1). Zunächst zeigen wir die Optimierung der Kulturbedingungen und ein Protokoll, das für eine längere Kultivierung der SC-Schnitte mit transplantierten Zellen geeignet ist (Abbildung 2A). Slices werden von DEV 0 bis DEV 2 im OM erzeugt und gepflegt, das ursprünglich als optimales Medium für die Pflege der SC-Slices47 vorgeschlagen wurde. Aufgrund des Vorhandenseins von Serumproteinen könnte dieses Medium jedoch suboptimal sein, um die neuronale Differenzierung und Reifung der transplantierten neuralen Vorläuferzellen aufrechtzuerhalten. In der Tat testeten wir bei DEV 3 den Wechsel von OM zu GM, einer Formulierung, die Neurobasal plus B27 enthält, das das neuronale Überleben unterstützt, und ohne Serum, das die korrekte neuronale Differenzierung hemmt und stattdessen ein gliales Schicksal fördert48,49.
Abbildung 2B zeigt die Ergebnisse, die durch das Umschalten des Mediums bei DEV 3 von OM auf GM erzielt wurden, verglichen mit den SC-Schnitten, die den Wechsel nicht erhielten (die Kontrollschnitten wurden in OM kultiviert). Wir nutzten die Verteilung des NFL-Signals innerhalb der Schichten als Marker für die neuronale Integrität (Abbildung 2B,C). Die Schnitte bei DEV 7 waren unter beiden Kultivierungsbedingungen gesund, was die diffuse Verteilung von Neurofilament (NFL, in grün) in ihnen zeigt. Bei DEV 10 schienen in GM kultivierte Scheiben im Vergleich zu den in OM kultivierten Kontrollscheiben gesünder zu sein, wie durch die NFL-Färbeverteilung dokumentiert wurde. Wir haben auch die NFL+-Fläche (% NFL+-Fläche/DAPI+-Fläche) der Schichten geschätzt, die in den repräsentativen Bildern in Abbildung 2B gezeigt sind. Die geschätzte NFL+-Fläche ist in den Histogrammen in Abbildung 2C dargestellt, was bestätigt, dass das NFL-Signal unter beiden Bedingungen diffus in den Schichten bei DEV 7 verteilt ist. Bei DEV 10 nimmt jedoch die geschätzte Fläche, die von der NFL-Färbung bedeckt ist, für die OM-Kultivierungsbedingung ab.
Diese Daten deuten darauf hin, dass die Umstellung auf den GM bei DEV 3 für eine längere Kultivierung von SC-Scheiben (DEV 10) gut vertragen wird. Als nächsten Schritt haben wir GM zu längeren Zeitpunkten getestet: DEV 30, DEV 60 und DEV 90. Wie in Abbildung 3A,B gezeigt, wurden die Scheiben in Kultur bis DEV 90 gesund gehalten. NFL-Färbungen wurden in den Schichten zu jedem Zeitpunkt weit verbreitet gefunden, wobei diffuse Sprossen um die Neuritenscheiben herum sprießen, die von der zentralen Region ausgehen. Tatsächlich haben wir die NFL+-Fläche der in Abbildung 3A gezeigten Schichten geschätzt und sie hat sich im Laufe der Zeit vergrößert, wie in den Histogrammen von Abbildung 3B gezeigt. Wir beobachteten auch eine Positivität des neuronalen Markers RBFOX3, was einen weiteren Beweis für die neuronale Differenzierung der Schichten liefert. Zu jedem Zeitpunkt überprüften wir auch die Apoptoserate, indem wir in verschiedenen Schichten die Anzahl der Zellen auswerteten, die positiv für aCASP3 waren (Abbildung 4A,B). Die Analyse wurde wie in Protokollabschnitt 10.2 beschrieben durchgeführt. Es wurde festgestellt, dass die Apoptoserate (% aCASP3+-Zellen/Gesamtzahl der DAPI+-Zellen) zu jedem Zeitpunkt sehr niedrig war (0,85 ± 0,52 %, 0,71 ± 0,27 %, 0,66 ± 0,45 % für DEV 30, 60 bzw. 90) ohne signifikante Unterschiede zwischen den drei betrachteten Zeitpunkten (p-Wert > 0,05, Abbildung 4B). Diese Daten deuten darauf hin, dass die mit aCASP3 assoziierte apoptotische Rate über die Zeit stabil bleibt und zusammen mit der breiten Verteilung von NFL in den Schichten (Abbildung 4A) das Überleben der Schichten zu jedem Zeitpunkt bestätigt.
Zur Unterstützung früherer Daten führten wir auch einen Lebend-/Tot-Assay durch, um die Lebensfähigkeit der Scheiben zu den drei verschiedenen Zeitpunkten zu bewerten. Wir verwendeten Calcein (grüne Färbung), um die lebensfähigen und metabolisch aktiven Zellen zu markieren, und Sytox (Cyan-Färbung), um den Zelltod zu beurteilen. Wie in den Histogrammen in Abbildung 4C gezeigt, steigt der Prozentsatz der metabolisch aktiven Zellen von DEV 30 auf DEV 90 leicht an (93,17 ± 5,21 %, 96,43 ± 3,02 %, 96,33 ± 3,10 % für DEV 30, 60 bzw. 90) und stabilisiert sich zwischen den letzten beiden Zeitpunkten (DEV 30 vs. DEV 60 p-Wert = 0,018; DEV 30 vs. DEV 90 p-Wert = 0,027; DEV 60 vs. DEV 90 p-Wert = 0,99). Wir fanden einen niedrigen Zelltod, der im Laufe der Zeit abnahm (6,83 ± 5,21 %, 3,57 ± 3,02 %, 3,66 ± 3,10 % für DEV 30, 60 bzw. 90), und es wurde ein signifikanter Unterschied zwischen DEV 30 und späteren Zeitpunkten, DEV 60 und DEV 90, festgestellt (DEV 30 vs. DEV 60 p-Wert = 0,018; DEV 30 vs. DEV 90 p-Wert = 0,027; DEV 60 vs. DEV 90 p-Wert = 0,99). Diese Daten bestätigen in Verbindung mit der Apoptoserate das Überleben der Scheibe im Laufe der Zeit und unterstützen die Wirksamkeit des durchgeführten Langzeitkultivierungsprotokolls.
Nachdem die Machbarkeit einer längeren Kultivierung der SC-Schnitte festgestellt wurde, forderten wir das System durch die Transplantation von h-SC-NES-Zellen in den ersten Stadien der neuronalen Differenzierung heraus. Wir haben die h-SC-NES-Zellen getestet, da sie vielversprechende Ergebnisse für die Behandlung von Rückenmarksverletzungen gezeigt haben12. Das Transplantationsverfahren von h-SC-NES-Zellen in die SC-Schnitte der Maus ist in Protokollabschnitt 6 beschrieben. Die SC-Schnitte und transplantierten h-SC-NES-Zellen wurden bis DPT 30 aufbewahrt. Die Zellen wurden bei DIV 10 der Differenzierung (neuronales Vorläuferstadium) in organotypische Scheiben von DEV 4 transplantiert, wie im Protokollschema in Abbildung 5A gezeigt. Transplantierte Zellen wurden bis zu 30 Tage lang auf die Expression von GFP in Kultur überwacht. Abbildung 5B zeigt repräsentative Live-Bilder eines SC-Schnitts mit transplantierten GFP+ -Zellen bei unterschiedlichen DPT. Die stabile Expression von GFP über die Zeit (Abbildung 5B und Abbildung 6A) deutet darauf hin, dass die Zellen unter den zuvor optimierten Kulturbedingungen in das SC-Gewebe überlebten. Wir überprüften auch die apoptotische Rate der transplantierten Zellen, wie in Protokollabschnitt 10.2 beschrieben. Die apoptotische Rate (% aCASP3+ -Zellen/Gesamtzahl der Hu-Nu+ -Zellen) erwies sich nach 30 DPT als sehr niedrig (0,44 ± 0,34%) (Abbildung 6B). Darüber hinaus wurde festgestellt, dass die apoptotische Rate bei DPT 30 mit der für denselben Zelltyp bei DPT 7 übereinstimmte, wie zuvor berichtet40, was dokumentiert, dass sich die Kulturen im Laufe der Zeit stabilisieren.
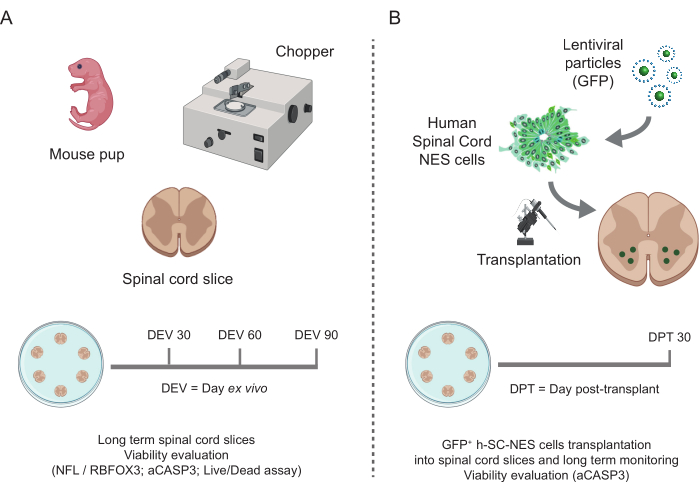
Abbildung 1: Ablauf des Protokolls. Repräsentatives Schema, das den allgemeinen Arbeitsablauf des durchgeführten Protokolls zeigt. (A) Auf der linken Seite ein Schema, das die Erzeugung von Maus-SC-Scheiben aus isolierten SC von Maus-Jungtieren an P3 und die Langzeitkultivierung von SC-organotypischen Schnitten zusammenfasst. (B) Auf der rechten Seite ein Schema, das die Transplantation von h-SC-NES-Zellen, die GFP exprimieren, in SC-organotypische Mausschnitte zusammenfasst. Die transplantierten Zellen werden 30 Tage nach der Transplantation aufbewahrt. Abkürzungen: h-SC-NES = human spinal cord-derived neuroepithelial stem; GFP = grün fluoreszierendes Protein; DEV = Tag ex vivo; DPT = Tag nach der Transplantation; NFL = Neurofilament-Leichtkette; RBFOX3= RNA-Bindung Fox-1 Homolog 3; aCASP3 = aktive Caspase-3; SC = Rückenmark. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
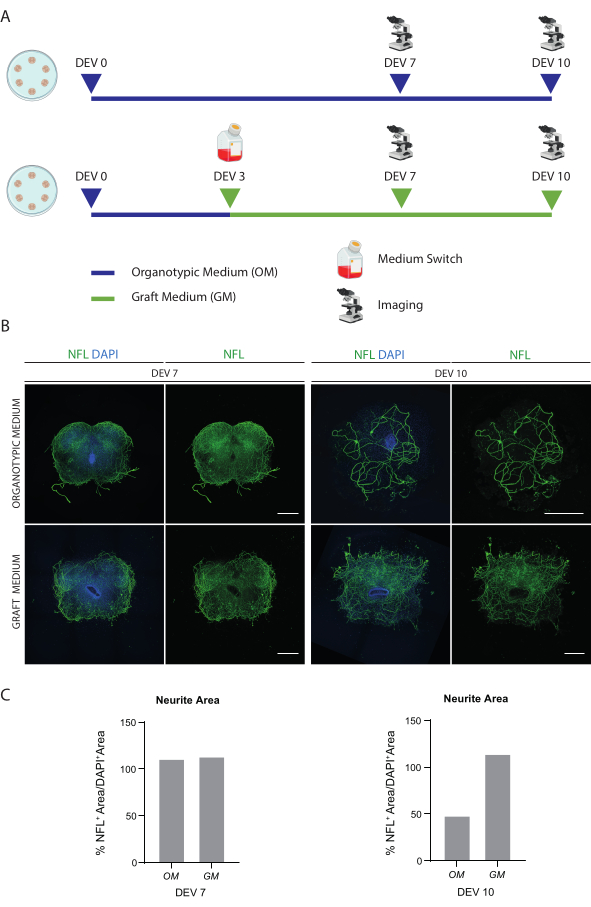
Abbildung 2: Optimierung der Langzeit-Kultivierungsbedingungen. (A) Repräsentatives Schema des Protokolls für die Prüfung von OM und GM. OM wird für die Kontrollgruppe bis DEV 7-10 beibehalten. Das Medium wird bei DEV 3 für die behandelten Scheiben auf den GM umgeschaltet; dann werden sie zum Vergleich mit den Steuerungen auf DEV 7-10 fixiert. (B) Repräsentative Bilder zum Vergleich von organotypischen Schnitten von Maus-SC bei DEV 7 und 10, die unter verschiedenen Bedingungen kultiviert wurden. Die Scheiben werden auf den Zytoskelettmarker Neurofilament (NFL, grün) gefärbt. Die weite Verbreitung der NFL-Färbung in Scheiben, die mit GM kultiviert wurden, deutet auf ein Gesamtüberleben und eine Differenzierung hin. Die Zellkerne werden mit DAPI gegengefärbt. Maßstabsbalken = 500 μm. (C) Repräsentative Histogramme der Schätzung des von NFL abgedeckten Gebiets in den in Abbildung 1B gezeigten Schichten. Bei DEV 10 nimmt die NFL-Oberfläche im OM-Kultivierungszustand ab. Abkürzungen: DEV = Tag ex vivo; DAPI = 4',6-diamidino-2-phenylindol; NFL = Neurofilament-Leichtkette.; OM = organotypisches Medium; GM = Transplantatmedium; SC = Rückenmark. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
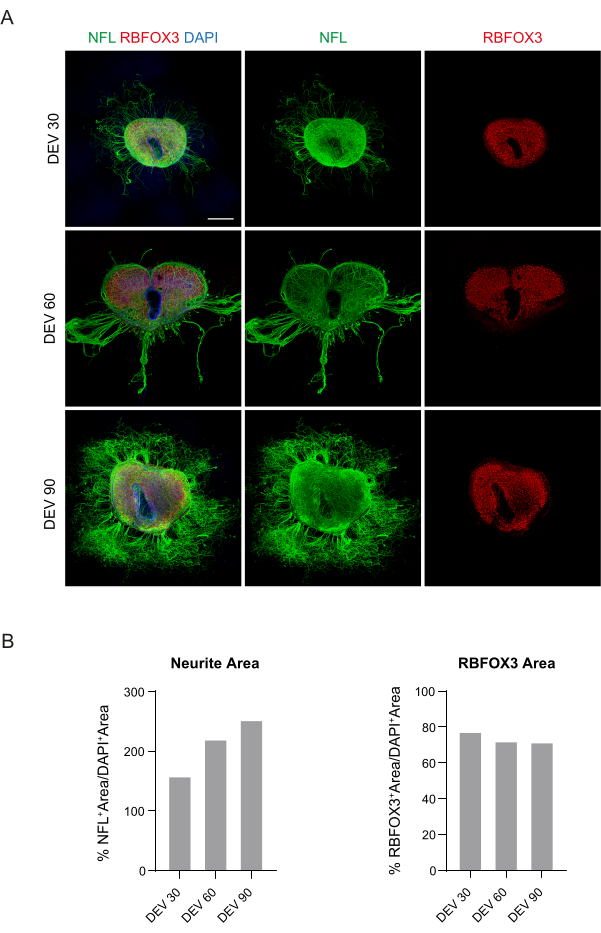
Abbildung 3: Organotypische Scheiben aus dem Langzeitkulturell von Mausen. (A) Die Scheiben werden bis DEV 90 in Kultur gehalten. Der Immunfluoreszenz-Assay zeigt eine weite Verteilung des Zytoskelettmarkers Neurofilament (NFL, grün) und des nukleären neuronalen Markers RBFOX3 (rot), was ihren gesunden Zustand und ihre neuronale Identität nach Langzeitkultivierung bescheinigt. Bemerkenswert ist, dass NFL+ -Axone im Laufe der Zeit diffus um die Scheiben herum sprießen. Die Zellkerne werden mit DAPI gegengefärbt. Maßstabsbalken = 500 μm. (B) Repräsentative Histogramme der Schätzung der NFL+ -Fläche und -Zeit sowie der RBFOX3+ -Fläche der in Feld A gezeigten Schichten . Der NFL+ -Neuritenbereich nimmt mit der Zeit zu. Abkürzungen: DEV = Tag ex vivo; DAPI = 4',6-diamidino-2-phenylindol; NFL = Neurofilament-Leichtkette; SC = Rückenmark; RBFOX3= RNA-bindendes Fox-1-Homolog 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
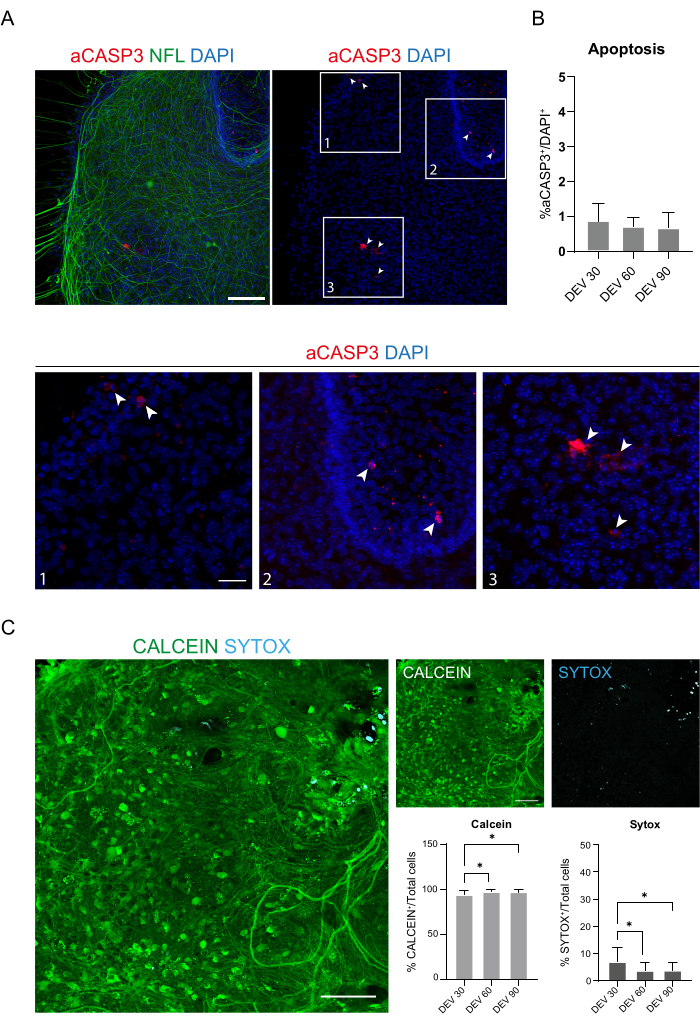
Abbildung 4: Bewertung der Zellviabilität in den SC-Schnitten über die Zeit. (A) Repräsentative Bilder von organotypischen Schnitten bei DEV 60, gefärbt für aCASP3 (rot) und NFL (grün). Maßstabsleiste = 100 μm. NFL zeigt ein diffuses Muster. Seltene Zellen sind positiv für den apoptotischen Marker aCASP3 (Einschübe: 1-2-3). (B) Analyse der Apoptoserate in Schichten zu verschiedenen Zeitpunkten. Mittelwert ± SD, N (repliziert) = 6 Schichten, n (Gesamtzellen) > 1.000 für jede Schicht, Kruskal-Wallis-Test, Mehrfachvergleich, p-Wert > 0,05. Die apoptotische Rate ist über die Zeit stabil. In den Einschüben 1-2-3 von Panel A ist es möglich, Details von Zellen zu beobachten, die positiv für aCASP3 sind (rote Färbung, weiße Pfeile). Kleine rote Punkte markieren Zelltrümmer und pyknotische Zellkerne. Maßstabsbalken = 50 μm. (C) Repräsentative Bilder von Lebend-/Tot-Assays, die an SC-Schnitten bei DEV 90 durchgeführt wurden: Stoffwechselaktive Zellen werden mit Calcein grün markiert, während tote und geschädigte Zellen mit Sytox in Hellblau (Cyan) markiert sind. Die beiden Histogramme zeigen den prozentualen Anteil der Zellen, die positiv für Calcein (links) und Sytox (rechts) sind, bezogen auf die Gesamtzahl der Zellen. Für beide mittleren ± SD ist N (repliziert) = 6 Schichten, n (Gesamtzellen) > 1.000 für jede Schicht, Kruskal-Wallis-Test, Mehrfachvergleich, DEV 30 vs. DEV 60 p-Wert = 0,018; DEV 30 vs. DEV 90 p-Wert = 0,027; DEV 60 vs DEV 90 p-Wert > 0.99. Abkürzungen: DEV = Tag ex vivo; DAPI = 4',6-diamidino-2-phenylindol; NFL = Neurofilament-Leichtkette; SC = Rückenmark; aCASP3 = aktive Caspase-3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
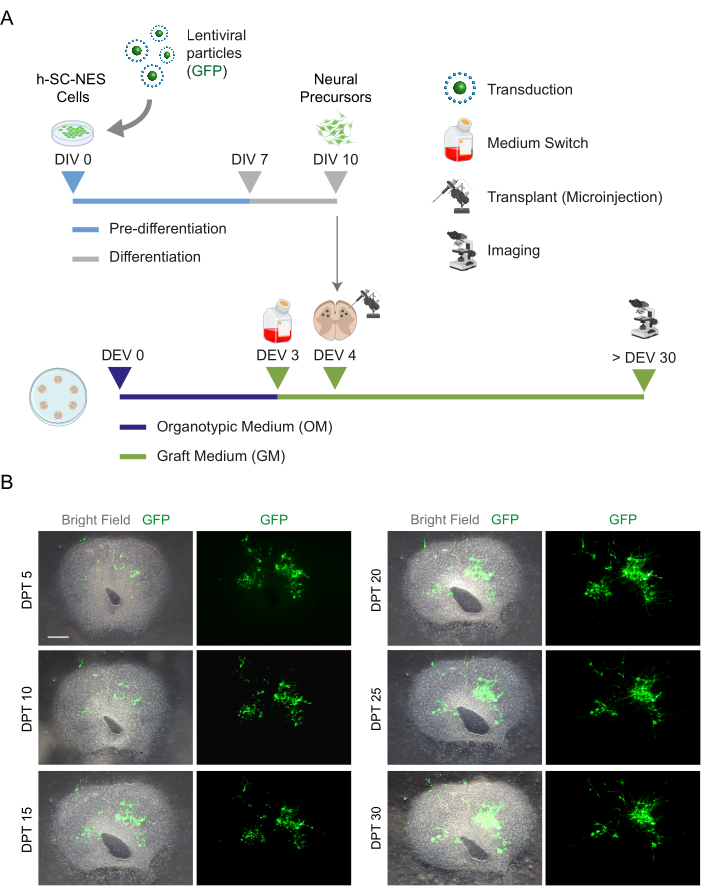
Abbildung 5: h-SC-NES-Zelltransplantation in organotypische Mausschnitte. (A) Repräsentatives Schema des Transplantationsprotokolls. Zellen werden als neuronale Vorläufer bei DIV 10 der Differenzierung in organotypische DEV-4-Schnitte transplantiert. (B) Repräsentative Bilder von organotypischen Mausschnitten, die im Laufe der Zeit bis DPT 30 mit GFP-exprimierenden h-SC-NES-Zellen transplantiert wurden. Die Zellen werden mit einem lentiviralen Vektor transduziert, der das GFP-Gen trägt. Die GFP-Expression im Laufe der Zeit bestätigt ihre Lebensfähigkeit und Anpassung an die Schnittumgebung. Maßstabsleiste = 500 μm. Abkürzungen: DIV = erster Tag in der Vordifferenzierung; h-SC-NES = aus dem menschlichen Rückenmark gewonnener neuroepithelialer Stamm; GFP = grün fluoreszierendes Protein; DEV = Tag ex vivo; OM = organotypisches Medium; GM = Transplantatmedium; DPT = Tage nach der Transplantation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
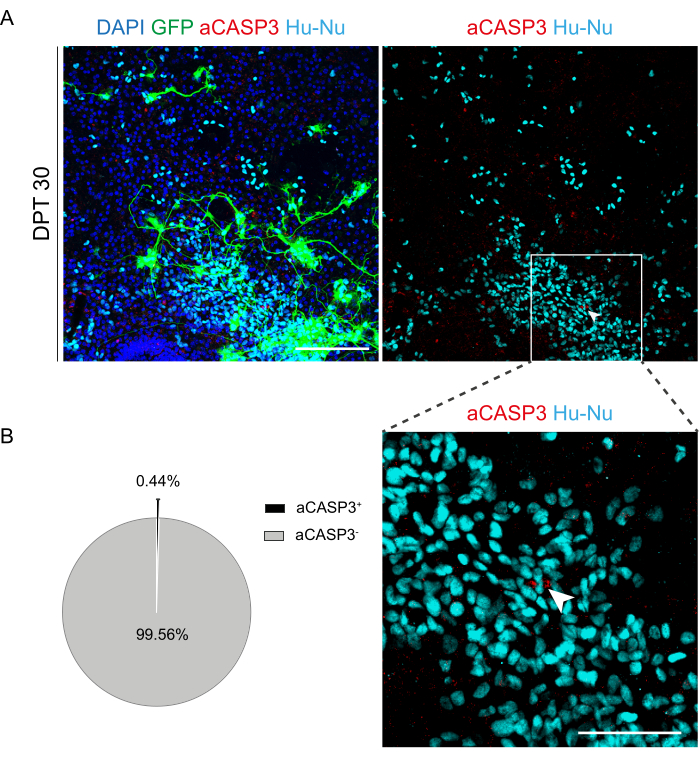
Abbildung 6: Bewertung der Apoptoserate von transplantierten h-SC-NES-Zellen nach 30 Tagen nach der Transplantation. (A) Repräsentatives Bild eines organotypischen Mausschnitts, der mit GFP-exprimierenden h-SC-NES-Zellen transplantiert wurde. Die Zellen werden mit einem lentiviralen Vektor transduziert, der das GFP-Gen trägt, um sie nach der Transplantation in die Schnitte zu überwachen. Die GFP-Expression im Laufe der Zeit bestätigt ihre Lebensfähigkeit und Anpassung an die Schnittumgebung. Der angezeigte Zeitpunkt ist DPT 30; Die Zellen werden für menschliche Zellkerne (cyan) und aCASP3 (rot) gefärbt. Maßstabsbalken = 150 μm. (B) Links ein repräsentatives Tortendiagramm der Apoptose-Analyse von Zellen, die in Schichten bei DPT 30 transplantiert wurden (N (Replikate) = 5 Schichten, n (Zellen) = 5.000), und rechts ein Ausschnitt von Hu-Nu+ -Zellen und ein Detail einer Zelle, die positiv auf aCASP3 ist (weißer Pfeil). Maßstabsleiste = 75 μm. Kleine rote Punkte markieren Zelltrümmer und pyknotische Zellkerne. Abkürzungen: h-SC-NES = human spinal cord-derived neuroepithelial stem; GFP = grün fluoreszierendes Protein; DPT = Tag nach der Transplantation; DAPI = 4',6-diamidino-2-phenylindol; NFL = Neurofilament-Leichtkette; aCASP3 = aktive Caspase-3; Hu-Nu = menschliche Zellkerne. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Zusammensetzung der in diesem Protokoll verwendeten Lösungen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Es gibt immer noch keine wirksame Behandlung für Patienten mit Querschnittlähmung. Verschiedene Ansätze wurden getestet, und einer der vielversprechendsten basiert auf einer regenerativen Strategie - dem Zellersatz. Derzeit erfordern die Fortschritte im Bereich der regenerativen Medizin neuartige Plattformen, um die Wirksamkeit und Sicherheit von Zelltransplantaten allein oder in Kombination mit anderen Ansätzen zu testen. Ihre präklinische Validierung ist für die Durchführung weiterer klinischer Studien unerlässlich. Organotypische Kulturen des SC sind eine nützliche Plattform, um verschiedene Aspekte der Neurodegeneration, der neuronalen Regeneration und der Neuroentwicklung zu untersuchen und die Wirksamkeit neuartiger therapeutischer Ansätze zu untersuchen23. Insbesondere spezifische Merkmale der organotypischen Kulturen, wie die Beibehaltung der ursprünglichen Histoarchitektur und der Zell- und Mikroumgebungszusammensetzung, sind vorteilhaft, um die Transplantationsdynamik zu entschlüsseln, wie z. B. Zelltransplantation, Integration, Differenzierung und Reifung.
In Übereinstimmung mit den veröffentlichten Protokollen können subkutanische organotypische Schnitte unter gesunden Bedingungen etwa 2-3 Wochen lang in Kultur gehalten werden, was ihre Verwendung für Langzeituntersuchungen und funktionelles Screening einschränkt, die für Testschemata der Zelltherapie erforderlich sind. Die Erforschung wichtiger Prozesse wie Differenzierung und Reifung hin zum korrekten Verbleib transplantierter Zellen im SC-Gewebe erfordert eine Langzeitüberwachung. Diese zellulären Prozesse sind bei gängigen Transplantationen in Tiermodellen von entscheidender Bedeutung. Die Verfügbarkeit eines ex vivo-Systems , das viele in vivo vorhandene Merkmale nachahmt, wäre in der präklinischen Screening-Phase hilfreich.
Aus diesem Grund schlagen wir in dieser Arbeit eine optimale langfristige (≥30 Tage) organotypische SC-Kulturmethode vor, die es ermöglicht, lebensfähige SC-Scheiben für bis zu 90 Tage zu erhalten und damit ihren üblichen Kulturzeitraum zu verdreifachen. Darüber hinaus zeigen wir eine stabile h-SC-NES-Zelltransplantation in SC-Schnitten und die Aufrechterhaltung der Transplantatkultur für bis zu 30 Tage. Wir überwachten die Zelltransplantation im Laufe der Zeit, indem wir die GFP-Expression beobachteten, um das Überleben der Zellen bis zu DPT 30 zu verifizieren. Nach 30 DPT bewerteten wir die Apoptoserate der Zellen. In der Literatur wurde über die Bewertung der Apoptose von transplantierten h-SC-NES-Zellen in SC-Schnitten bei 7 DPT berichtet40. In dieser Arbeit haben wir die Zellapoptose-Analyse an DPT 30 erweitert, um die apoptotische Rate in Bezug auf den früheren Zeitpunkt (DPT 7) zu vergleichen. Wir fanden heraus, dass unsere Daten mit der Literatur übereinstimmen, was darauf hindeutet, dass transplantierte h-SC-NES-Zellen auch zu einem späteren Zeitpunkt überleben, wenn sie unter den in unserer Arbeit optimierten Kulturbedingungen gehalten werden. Diese verbesserte Langzeit-Ex-vivo-Plattform allein und in der Transplantationskonfiguration wird Forschern beim präklinischen Screening auf stammzellbasierte Transplantationen auf Rückenmarksverletzung helfen. Auf diese Weise können sie den besten Zellkandidaten für weitere in vivo-Studien identifizieren, die den Erfolg der Transplantationen fördern. Darüber hinaus könnten nach einem ersten Screening auch organotypische Schnitte parallel zu den In-vivo-Studien verwendet werden, um die in Tiermodellen beobachtete langfristige zelluläre Dynamik und Verhaltensweisen zu bestätigen und zu bestätigen oder um mechanistische Studien zu unterstützen.
Unser Protokoll beschreibt im Detail, wie dieses langfristige organotypische Modell generiert werden kann, aber es sollten auch einige kritische Schritte besprochen werden. Bei der Generierung der organotypischen SC-Kulturen gibt es einige Herausforderungen während der Operation und in den ersten Phasen der Kultur. Ein gut durchgeführter chirurgischer Eingriff ist unerlässlich, um Slices zu erzeugen, die die ursprüngliche Histoarchitektur beibehalten. Wenn der SC während der Isolierung ruiniert wird, können die Scheiben ihre typische anatomische Struktur verlieren und die Gewebeschädigung kann zu einer übermäßigen entzündungsfördernden Beleidigung führen, die zu ungesunden Bedingungen und zum Zelltod führt. Die schwierigste Phase während der Operation ist die Extraktion des SC aus der Wirbelsäule und die Entfernung der Hirnhäute aus dem isolierten SC. Der Erfolg dieser Schritte hängt von der Erfahrung des Bedieners ab. Daher wird eine Einarbeitungsphase empfohlen, bevor mit den Experimenten begonnen wird.
Auch die koronale Sektion des SC durch einen Hubschrauber ist eine herausfordernde Phase. Der isolierte SC sollte genau senkrecht zur Klinge auf dem Mähdeck platziert werden. Der Bediener sollte das Messer auch senkrecht zum Mähdeck platzieren. Diese Vorsichtsmaßnahmen sind notwendig, um die Erzeugung reproduzierbarer Schichten zwischen demselben und unterschiedlichen Experimenten zu gewährleisten. Ein weiterer wichtiger Punkt ist, dass die Zeit für die Operation begrenzt ist: Die gesamte Schnitterzeugung muss ~30 Minuten dauern. Wenn der Bediener mehr Zeit für die Operation und das Schneiden aufwendet, leidet das SC-Gewebe, was den Erfolg der Kultur und die nächsten Schritte des Experiments beeinträchtigen kann.
Sobald die Scheiben auf die Kulturmembran gelegt wurden, ist es wichtig, sie richtig zu füttern. GDNF ist notwendig, um die Erholung und das Überleben des Gewebes aufrechtzuerhalten. Das Schneiden mit einem Zerkleinerer ist traumatisch für das Gewebe und aus diesem Grund werden die Scheiben kurz nach dem Schnitt in ein eiskaltes Seziermedium gelegt, um den Überschuss an entzündungsfördernden und todfördernden Molekülen zu entfernen. Dann werden die Scheiben mit frischem Medium auf die Kulturmembranen (Zellkulturinsertionen) gelegt, das mit GDNF modifiziert ist, um eine schnellere Erholung und die Adhäsion der Scheiben an der Membran zu fördern. GDNF sollte dem Medium in der ersten Woche in Kultur wegen seiner kurzen Halbwertszeit täglich zugesetzt werden50,51. Wir haben beobachtet, dass die Scheiben in den ersten Tagen der Kultur die kontinuierliche Anwesenheit von GDNF benötigen, um die Regeneration und Lebensfähigkeit des Gewebes zu fördern. Da die GDNF-Präsenz für den gesamten Kulturzeitraum wichtig ist, wird in jedem Fall dringend davon abgeraten, die GDNF-Verabreichung zu einem späteren Zeitpunkt zu unterbrechen.
In der ersten Woche in Kultur ist es auch wichtig, die Scheiben makroskopisch mit dem Auge und am Mikroskop zu überprüfen. Durchscheinendes Gewebe und Transparenz der Ränder sind Zeichen für eine gute Haftung der Scheiben an der Membran und für lebensfähiges Gewebe. Das nekrotische Gewebe erscheint auf den ersten makroskopischen Blick extrem weiß und die nekrotischen Bereiche erscheinen am Mikroskop dunkelgrau. Nach einigen Wochen in Kultur kann sich die Morphologie des Gewebes verändern: Zellbewegungen und die Adhäsion des Gewebes an der Membran können diesen Prozess beeinflussen. Wir beobachteten zum Beispiel den Verlust des zentralen Lumens in einigen mit Zellen gefüllten Schnitten und den Verlust der Morphologie des Hinter- und Bauchhorns. Dies geschieht vor allem bei kleineren Scheiben, während die meisten von ihnen eine anatomische Struktur beibehalten, die der ursprünglichen nahe kommt. Schnitte werden in der Regel aus dem lumbalen oder thorakalen Bereich erzeugt, da sie auf diese Weise die entsprechende Größe haben können, um ihre ursprüngliche Histoarchitektur im Laufe der Zeit beizubehalten: Wenn sie zu klein sind, verlieren sie ihre Architektur, während sie, wenn sie zu groß sind, in der zentralen Region in Nekrose geraten können. So haben wir die Lendenwirbelsäule von Mausjungtieren verwendet, um Scheiben mit der richtigen Größe für eine optimale Langzeitkultivierung zu erzeugen, aber im Prinzip können auch andere Segmente in Betracht gezogen werden. Darüber hinaus haben wir uns für die Lendenwirbelsäule entschieden, da ventrale und dorsale Regionen besser voneinander unterscheidbar sind. Darüber hinaus weist diese Region Gewebebereiche mit einem höheren Anteil an Motoneuronen und grauer Substanz auf, die für Zellersatztherapien bei Rückenmarksverletzung von Interesse sind. Bei der Transplantation von Zellen in die Scheiben hängt das Hauptproblem mit dem Bruch der Glasmikronadelspitze zusammen. Wenn das Loch für den Zelldurchgang zu groß ist, kann es während der Mikroinjektion zu einer Schädigung des SC-Gewebes kommen. Wenn sie zu klein ist, kann das Stapeln von Zellen die Nadel verstopfen und den Transplantationsprozess behindern. Die Transplantation sollte innerhalb von 1 Stunde abgeschlossen sein, um das Leiden und den Tod der Zellen zu minimieren.
Das vorgeschlagene Protokoll bietet ein optimales und vielseitiges Werkzeug für verschiedene Arten von Untersuchungen. Hier setzen wir unsere Langzeitplattform ein, um die Transplantation von h-SC-NES-Zellen in den ersten Stadien der Differenzierung in SC-Gewebe der Maus für 30 Tage zu validieren. Die wichtigste Neuerung des vorgeschlagenen Ansatzes ist die Optimierung des Co-Kulturprotokolls. Die Bestandteile von GM sorgen für das langfristige neuronale Überleben der SC-Schnitte und der transplantierten h-SC-NES-Zellen. In der Tat erhält GM, da es sich um ein serumfreies Medium handelt, die Differenzierung der transplantierten Zellen in Bezug auf das neuronale Schicksal im Vergleich zu dem Medium, das zuvor für die organotypische Schnittkultur verwendet wurde,aufrecht 47.
Was die vorgeschlagenen Modelle für die Querschnittlähmung betrifft, so werden die Experimente in der Regel an erwachsenen Mäusen durchgeführt. Bisher hängen die wichtigsten Unterschiede zwischen neonatalen und adulten subkutanen Mäusen mit dem höheren Regenerationspotenzial zusammen, das bei neonatalen Mäusen im Vergleich zu adulten Mäusen gefunden wurde52. Solche Unterschiede haben jedoch keinen Einfluss auf die Art des Protokolls, das wir vorschlagen, da wir uns hier auf die Reaktion transplantierter Zellen auf die Umgebung des Wirtsgewebes konzentrieren und nicht auf die Regenerationsfähigkeiten der ansässigen Neuronen. Ein weiterer Unterschied zwischen neonatalen und adulten Mäusen nach einer Querschnittlähmung hängt mit der Bildung der Glianarbe zusammen, die bei Erwachsenen auftritt. Dieser Aspekt wird in dem vorgeschlagenen Modell nicht berücksichtigt, das die komplexen physiopathologischen Prozesse, die sich aus primären und sekundären Verletzungen ergeben, nicht berücksichtigt.
Was die Anwendungen betrifft, so könnte die Plattform auch genutzt werden, um die Integration zwischen den transplantierten Zellen und den residenten Schaltkreisen zu untersuchen, die im organotypischen SC-Modell vorhanden sind. Gentechnische Werkzeuge wurden bereits im ZNS zur Bewertung der synaptischen Konnektivität eingesetzt und könnten in dieser Hinsicht genutzt werden 53,54,55. Insbesondere konnte die Integration untersucht und validiert werden, indem die Bildung von Synapsen zwischen den transplantierten Zellen und dem SC ex vivo Gewebe untersucht und validiert wurde. Diese organotypischen Langzeitkulturen könnten auch zur Erprobung neuroprotektiver und neuroregenerativer Wirkstoffe oder neuartiger Moleküle/Materialien oder zur Untersuchung neurodegenerativer Erkrankungen, an denen der SC beteiligt ist, genutzt werden. Um spezifische neurodegenerative Erkrankungen zu untersuchen, muss das Protokoll für die Kultivierung von SC-Schnitten angepasst werden, die aus relevanten Modellen generiert wurden, wie z. B. transgenen Mäusen mit spezifischen pathologieassoziierten Mutationen, in dem für die Pathologie relevanten Stadium (d. h. Neugeborene, Jungtiere, Erwachsene). Zusammenfassend lässt sich sagen, dass unser Protokoll und unsere organotypischen Kulturen im Allgemeinen, da es sich um Explantate eines bestimmten Organs handelt, Merkmale aufweisen, die die Lücke zwischen 2D-Zellkulturen und In-vivo-Modellen schließen und sie als unschätzbares Werkzeug sowohl für die Grundlagenforschung als auch für präklinische Tests bestätigen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Die Studie wurde unterstützt von der Wings for Life Foundation (WFL-IT- 20/21), dem EU-Nationalen Aufbau- und Resilienzplan (NRRP) der Europäischen Union Next-Generation – Mission 4 Komponente 2, der Investition Nr. 1.4-CUP N. B83C22003930001 (Tuscany Health Ecosystem-THE, Spoke 8) und der Marina Romoli Onlus. Dieses Manuskript gibt nur die Ansichten und Meinungen der Autoren wieder, weder die Europäische Union noch die Europäische Kommission können dafür verantwortlich gemacht werden. Daten und Metadaten sind auf Zenodo 10.5281/zenodo verfügbar.10433147. Die Bilder wurden mit Biorender https://www.biorender.com/ erzeugt.
Materialien
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
Referenzen
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten