Method Article
Omurilik Yaralanmasında Hücre Transplantasyonunu Doğrulamak için Bir Platform Olarak Uzun Süreli Fare Omurilik Organotipik Dilim Kültürü
Bu Makalede
Özet
Bu yazıda, hücresel replasman tedavilerini test etmek için ex vivo bir model olarak nöral kök hücrelerle nakledilen uzun süreli omurilik organotipik dilimleri oluşturmak ve sürdürmek için tekrarlanabilir bir yöntem sunuyoruz.
Özet
Karmaşık patofizyoloji nedeniyle omurilik yaralanmaları (SCI'ler) için kalıcı tedaviler hala eksiktir. En umut verici rejeneratif yaklaşımlardan biri, kaybedilen dokuyu yerine koymak ve fonksiyonel iyileşmeyi desteklemek için kök hücre transplantasyonuna dayanmaktadır. Bu yaklaşım, daha pahalı ve zaman alıcı hayvan testlerine devam etmeden önce güvenlik ve etkinlik için in vitro ve ex vivo olarak daha iyi araştırılmalıdır. Bu çalışmada, SCI'ler için hücresel replasman tedavilerini test etmek için insan nöral kök hücreleri ile nakledilen fare omuriliği (SC) organotipik dilimlerine dayanan uzun vadeli bir platformun kurulmasını gösteriyoruz.
Standart SC organotipik kültürler in vitro olarak yaklaşık 2 veya 3 hafta korunur. Burada, 90 güne kadar uzun süreli bakım (≥30 gün) için optimize edilmiş bir protokol açıklıyoruz. SC dilimlerinin uzun süreli kültürlenmesi için kullanılan besiyeri, nöral kök hücrelerin organotipik modele nakli için de optimize edilmiştir. Yeşil floresan protein (GFP) raportörü taşıyan insan SC kaynaklı nöroepitelyal kök (h-SC-NES) hücreleri, fare SC dilimlerine nakledildi. Nakilden otuz gün sonra, hücreler hala GFP ekspresyonu ve düşük bir apoptotik oran gösteriyor, bu da optimize edilmiş ortamın hayatta kalmalarını ve doku içindeki entegrasyonlarını sürdürdüğünü gösteriyor. Bu protokol, SC dokusunda hücre replasman tedavilerini verimli bir şekilde test etmek için sağlam bir referansı temsil eder. Bu platform, araştırmacıların farklı hücre nakli tedavilerinin ex vivo ön taramasını yapmalarına olanak tanıyacak ve in vivo deneylere devam etmeden önce en uygun stratejiyi seçmelerine yardımcı olacaktır.
Giriş
Travmatik omurilik yaralanmasının (SKY) hastalar ve bakıcılar için yıkıcı fiziksel, psikolojik ve ekonomik sonuçları vardır1. Farklı yaklaşımlarla SCI'de aksonal rejenerasyonu teşvik etmek için birçok girişimde bulunulmuştur 2,3,4 ve hücre replasman tedavileri yoluyla yaralanma bölgesindeki proksimal ve distal nöronlar arasında nöronal rölelerin oluşumu ile bazı yararlı etkiler gösterilmiştir. Hücre tedavilerine olan ilgi hala artmaktadır5 çünkü nakledilen hücreler trofik destek sağlama, bağışıklık modülasyonu, plastisite indüksiyonu yoluyla kayıp nöral devrelerin yenilenmesi, hücre replasmanı ve akson remiyelinizasyonu6 dahil olmak üzere birçok rol oynayabilir.
Son zamanlarda, bu alandaki ana çaba insan nöral kök/progenitör hücrelerine (NSC'ler/NPC'ler) odaklanmıştır7. Birkaç çalışma, NSC'lerin/NPC'lerin astrosit yanıtı8'i modüle ettiğini, prorejeneratif faktörlerin9,10 salgılanmasını teşvik ettiğini ve SCI 11,12'deki eksik nöronal hücrelerin yerini aldığını göstermektedir. Bununla birlikte, nakledilen hücrelerin fonksiyonel nöronlara farklılaşmasını destekleyen çalışmalar hala zayıftır. Ayrıca, yaralı omurilikte (SC) nakledilen hücre sağkalımı ve farklılaşması düşüktür13, çünkü muhtemelen nakledilen hücrelerin in vivo olarak farklılaşması birkaç hafta, hatta aylar alır. Ek olarak, mevcut çalışmalar hücre replasman tedavilerinin birçok biyokimyasal, moleküler, hücresel ve fonksiyonel yönünü tam olarak aydınlatmamıştır. Bu bağlamda, hücre aşılama mekanizmalarını, aşılanmış hücrelerin çoğalma, belirli hücre tiplerine veya alt popülasyonlarına farklılaşma ve yerleşik nöronlarla sinapslar oluşturma yeteneklerini incelemek için basit, hızlı ve uygun maliyetli modeller gereklidir.
Histolojik çalışmaların elektrofizyolojik kayıtlara ve transkriptom ve proteom profillemesine entegre edilmesi, hücre transplantasyonundan sonra meydana gelen moleküler kaskadının tam olarak anlaşılması için gereklidir. Bu kesinlikle klinik öncesi modellerde ve klinik çalışmalarda yeni hücre replasman tedavilerinin tasarımını ve doğrulanmasını hızlandıracaktır. Gerçekten de, bugüne kadar, kemirgenlerin, büyük hayvanların ve insan olmayan primatların kullanımı, transplantasyondan sonraki birçok hücresel süreci aydınlatmak için değerli olmuştur14. Bununla birlikte, yüksek maliyet, yüksek etik etki ve organizmanın karmaşıklığı nedeniyle, kullanımları genellikle basit değildir veya biyokimyasal ve moleküler süreçleri çözmek için yeterli değildir. Ek olarak, hem türler arası (metabolizma) hem de tür içi değişkenlik (cinsiyet, yaş) gibi biyolojik farklılıklarla ilişkili birçok dezavantaj sunabilirler. Bu faktörler, stresli durumlar gibi dış faktörlerle birlikte, bir deneyin sonucunu ve insanlara terapötik çeviri açısından öngörülebilirliğini değiştirebilir 15,16,17.
Bu nedenle, birçok grup, hayvan modellerine ek olarak 2D in vitro hücre kültürü ve ex vivo organotipik dilimler (ex vivo kültürler) kullanır. 2D hücre kültürü, tek hücre ve/veya hücre popülasyonu düzeyinde belirli biyolojik süreçleri incelemek için en yaygın kullanılan sistemdir. Bununla birlikte, tek katmanlı hücre kültürleri, bütün bir organizmada bulunan karmaşıklığı yansıtmaz. Doku yapılarının ve fizyolojik ortamın olmaması, 2D kültür sistemlerinin araştırılan dokunun temel yapısal, morfolojik ve fonksiyonel yönlerini tamamen taklit etmesine izin vermez 18,19,20.Organotipik kültürler bu sorunların bazılarının üstesinden gelebilir. Organotipik modeller, bir doku veya organın bir parçasının çıkarılmasına ve sınırlı bir süre için ex vivo olarak korunmasına dayanır21,22. Özellikle, ekilen dokunun dilimleri, besin maddelerinin dilimlerdeki hemen hemen tüm hücrelere kolayca ulaşmasını sağlayan kesin bir kalınlıkta üretilir. Hipokampus, hipotalamus, beyincik, talamus, serebral korteks, substantia nigra ve striatum ve omurilik gibi merkezi sinir sisteminin çeşitli bölgelerinden üretilebilirler23. Organotipik kültürler, doku mimarisini, hücrelerin mekansal dağılımını, hücresel çeşitliliği ve orijin organın çevresini (yani hücre dışı matris bileşimini) korur. Ayrıca, orijinal nöral aktiviteyi, hücreler arasındaki bağlantıları ve özellikle eksplanttan sonra kısa mesafeli devreleri korurlar.
Bu yönler, hem tek katmanlı kültürler hem de hayvan modelleri açısından ex vivo kültürler için bazı avantajlar sağlar. İn vivo bulunan temel doku özelliklerini korurlar, ancak maliyetlerin azaltılması ve kültür çevresel parametrelerinin doğru bir şekilde düzenlenmesi ile farklı türde moleküler, hücresel ve fonksiyonel deneyler gerçekleştirme imkanı ile 24,25,26,27,28,29. Organotipik dilimler, belirli durumların temel histopatolojik özelliklerine benzeyerek farklı nörolojik bozukluklar için modeller geliştirmek için de kullanılabilir30. Ayrıca, orijinal çok hücreli doku ortamının korunması, onları ilaç taraması ve nöroprotektif ve nöro-rejeneratif molekülleri ve materyalleri test etmek için uygun platformlar haline getirir.
Bu çalışmada, NSC nakillerini optimize etmek için SC organotipik kültürlerin bir model olarak kullanılmasını öneriyoruz. Bu önemsiz değildir, çünkü hem konakçının (SC dokusu) hem de naklin (NSC'ler) haftalarca hayatta kalmasını garanti etmek için optimal kültür koşulları gereklidir. Organotipik kültürlerde, beyin kaynaklı ve SC türevli, çeşitli hücre tiplerinde aşılanmış farklı araştırma grupları. Çalışmaların çoğu mezenkimal kök hücrelerin (31,32,33), koku alma kılıf hücrelerinin34 veya NSC'lerin35,36,37,38,39,40 transplantasyonunu gösterdi ve aşılanmış hücrelerin konak hücrelerle etkileşimlerini, tüm sistemin hayatta kalmasını ve nakledilen hücrelerin nöronlara mı yoksa nöron benzeri hücrelere mi farklılaştığını değerlendirdi ex vivo doku ortamı içinde 32,33,41. Bazıları, nakil sonrası hücrelerin rejeneratif potansiyelini değerlendirdi, doku içindeki aksonal büyümelerinigözlemledi 37,40,41, oligodendrositlerin42 aşılanmış öncülerinin miyelinasyon yeteneğini, aşılanmış hücrelerin konakçı dokuya göçünü43 ve nakledilen hücrelerin prorejeneratif bir ortama doğru iten faktörleri serbest bırakıp bırakmadığını31. Mevcut çalışmaların bir sınırlaması, uzun süreli bir süre boyunca aşılamayı araştırmamalarıdır.
NSC'lerin in vivo 44,45 ayırt etmek için birkaç haftaya ihtiyaç duyduğu göz önüne alındığında, bu çalışma uzun süreli (≥30 gün) fare SC dilimlerinin nasıl oluşturulacağına ve 90 güne kadar nasıl sürdürüleceğine odaklanmaktadır. Dilimlerin orijinal anatomik yapılarını korudukları ve zaman içinde düşük ve stabil bir apoptotik oranı ve yüksek hücre canlılığını korudukları bulundu. Nöronal belirteçler RNA bağlayıcı fox-1 homolog 3 (RBFOX3) ve nörofilament hafif zincirin (NFL) yaygın ekspresyonunu gözlemledik, ikincisi zamanla dilimlerin etrafında artan bir aksonal filizlenme eğilimi gösterdi ve sağlıklı durumlarını doğruladı. Ayrıca, nöronal farklılaşmanın ilk aşamalarında SC dilimleri GFP eksprese eden insan SC türevli nöroepitelyal kök (h-SC-NES) hücrelerine başarılı bir şekilde nakledildi. NSC grefti, nakilden sonra 30 gün boyunca korundu ve hücreler kültürdeki tüm süre boyunca GFP ekspresyonu gösterdi. Nakil sonrası gün (DPT) 30'daki hücrelerin apoptotik oranının, aynı hücrelerde40 DPT 7'de gözlenen apoptotik hız değerine göre de uyumlu olduğu bulundu. Hücreler doku ortamına aşılanmış gibi görünüyordu ve birkaç haftaya kadar hayatta kaldı.
Özetle, verilerimiz SK organotipik dilimlerin orijinal sitomimarisinden ve doku ortamından ödün vermeden 3 ay boyunca kültürde tutulmasının mümkün olduğunu göstermektedir. En önemlisi, in vivo bir deneye devam etmeden önce hücre tedavilerini test etmek için kullanılabilirler, böylece maliyetleri ve deney süresini azaltırlar. Burada, fare SC organotipik dilimleri oluşturmak için tüm pasajları ve bunların uzun süreli süreler boyunca (≥30 gün) nasıl korunacağını ayrıntılı olarak gösteriyoruz. Ayrıca, dilimlere NPC naklinin nasıl gerçekleştirileceğini ve bunların aşağı akış analizi için nasıl korunacağını derinlemesine açıklıyoruz.
Protokol
Hayvan prosedürleri, İtalya Halk Sağlığı Bakanlığı ve Pisa Üniversitesi yerel Etik Komitesi tarafından 2010/63/EU sayılı Direktife (proje lisansı no. 39E1C) uygun olarak onaylanan protokollere sıkı sıkıya bağlı olarak gerçekleştirilmiştir. N.5Q7 30/10/2021 tarihinde yayınlandı). C57BL / 6J fareleri, yiyecek ve su ad libitum ile 12 saatlik bir aydınlık-karanlık döngüsü ile düzenlenmiş bir ortamda (23 ± 1 °C, 50 ±% 5 nem) tutuldu.
H-SC-NES hücreleri ile ilgili tüm çalışmalar, biyomedikal araştırma amacıyla insan dokusunun elde edilmesi ve dağıtılması için NIH yönergelerine göre ve örneklerin alındığı her enstitünün İnsan Araştırma Komiteleri ve Kurumsal Etik Komiteleri tarafından onaylanarak gerçekleştirilmiştir. Nihai onay, Pisa Üniversitesi Biyoetik Komitesi'nden alındı (İnceleme No. 29/2020). Kimliği gizlenmiş insan örnekleri, Ortak MRC/Wellcome Trust hibesi (099175/Z/12/Z), İnsan Gelişimsel Biyoloji Kaynağı (www.hdbr.org) tarafından sağlandı. Uygun bilgilendirilmiş onam alındı ve her örnek için mevcut tüm tanımlayıcı olmayan bilgiler kaydedildi. Doku, NIH (http://bioethics.od.nih.gov/humantissue. html) ve WMA Helsinki Bildirgesi (http://www.wma.net/en/30publications/10policies/b3/index.html) tarafından belirlenen insan beyin dokusunun araştırma kullanımına ilişkin etik yönergelere ve düzenlemelere uygun olarak ele alındı.
1. Omurilik (SC) izolasyonu ve kültürü için çözelti ve ekipmanların hazırlanması
- Membran ekler için kaplama çözeltisi
- Kaplama çözeltisini hazırlayın (Tablo 1): 0.1 mg mL-1 kollajen, 0.01 mg mL-1 poli-L-lizin ve 0.01 mg mL-1 laminin içeren sulu bir çözelti.
- Her bir membran ekini 35 mm'lik bir tabağa veya 6 oyuklu bir plakaya yerleştirin.
- Membranın üstüne 1 mL kaplama çözeltisi ekleyin: çözeltiyi oda sıcaklığında (RT) 4 saat inkübe edin; daha sonra çıkarın ve zarın gece boyunca kurumasını bekleyin (AÇIK). Membran eklerini kullanılıncaya kadar 4 °C'de saklayın.
NOT: Tüm geçişler steril koşullarda yapılmalıdır. Membran kaplama, protein bozulmasını ve membrana optimal olmayan dilim yapışmasını önlemek için kullanımdan önce 4 °C'de en fazla 1 hafta korunmalıdır.
- Besiyeri hazırlama: organotipik besiyeri, diseksiyon besiyeri, greft besiyeri
- Organotipik besiyeri hazırlayın (OM, Tablo 1).
- Diseksiyon ortamını Tablo 1'de anlatıldığı gibi hazırlayın.
- Greft ortamını hazırlayın (GM, Onorati ve ark.46'dan optimize edilmiştir, Tablo 1).
NOT: Çözeltiler steril koşullarda ve kullanımdan hemen önce (deneyden 1 gün önce veya aynı gün) hazırlanmalıdır.
- Ameliyat için materyal hazırlama
- Biyogüvenlik kabininde aşağıdakileri kullanıma hazır bulundurun: diseksiyon stereomikroskobu ve cerrahi aletler: iki çift mikro makas, iki çift düz cımbız ve iki çift kavisli cımbız.
- Biyogüvenlik kabininde, SC'yi dilimler halinde kesmek için bir bıçakla donatarak doğrayıcı aleti hazırlayın. Bıçağın yerleştirilmesi gereken metal kolu kaldırmak için doğrayıcının bir vidasını döndürün. Bıçağı belirlenen yere yerleştirin, metal kolu bıçakla birlikte kesme tablasına temas edene kadar indirin ve bıçak sıkıca sabitlenene kadar güvenli vidayı altıgen bir anahtarla sıkarak sabitleyin. Mikrometrik vidayı istenen dilim kalınlığına (genellikle 350 μm) döndürün. Bıçağın kesme tablasına tam olarak dik olarak yerleştirilip yerleştirilmediğini kontrol edin.
NOT: Kesimin doğru bir şekilde gerçekleştirilmesi için bıçağın kesme tablasına göre tam olarak dik olarak yerleştirilmesi gerekir. - Biyogüvenlik kabininde hazırlayın: iki plastik Pasteur pipeti (izole SC'yi ve dilimleri taşımak için gereklidir), en az dört adet 35 mm ve iki adet 60 mm'lik tabak ve bir kutu taze buz.
- Kültür sterilitesini korumak için tüm aletleri kullanımdan hemen önce %70 etanol ve UV (20 dakikalık bir döngü) ile sterilize edin.
2. Fare SC'sinin izolasyonu ve dilim oluşturma
- Fare SC'nin izolasyonu
- Doğum sonrası 3. gün (P3) fare yavrularını proje lisansına göre kurban edin.
- Mikro makasla orta hat laparotomisi yaparak, omurganın bel bölgesini fare vücudunun geri kalanından izole edin ve 35 mm'lik bir tabakta soğuk bir diseksiyon ortamına koyun.
- Bir diseksiyon stereomikroskobu ve mikro makas kullanarak, omurgayı sagital eksen boyunca kesin ve SC'yi omurga boşluğundan nazikçe çıkarmak için düz cımbız kullanın.
- Düz cımbız kullanarak SC'nin izole edilmiş bel bölgesinden meninksleri dikkatlice soyun.
- İzole edilmiş SC lomber bölgesini soğuk ve taze diseksiyon ortamında 10-15 dakika boyunca aktarın ve inkübe edin ve bir sonraki adıma geçin.
- Dilimlerin oluşturulması
- Bir plastik Pasteur pipeti kullanarak, izole edilmiş SC bel bölgesini diseksiyon ortamından alın ve bıçağa dik olarak doğrayıcı aletin kesme tablasına yerleştirin.
NOT: SC dilimlerini düzgün bir şekilde oluşturmak için SC'nin bıçağa göre (dikey) doğru konumlandırılması çok önemlidir. - Pasteur pipeti ve steril emici kağıt yardımıyla SC'nin etrafındaki güvertede kalan diseksiyon ortamını çıkarın. SC otomatik bölümleme ile devam edin.
- Dilimler oluşturulduktan sonra, dilimlerle birlikte kesme tablasına bir Pasteur pipeti ile biraz taze diseksiyon ortamı koyun. Daha sonra dilimleri taze diseksiyon ortamı ile 35 mm'lik bir tabağa toplayın ve 15 dakika inkübe edin.
- Dilim inkübasyonu sırasında, plastik bir Pasteur pipeti kullanarak membran eklerinin yüzeyini 3x OM ile yıkayın. Ardından, her bir membran ekinin altında 1 mL OM bırakın.
- Diseksiyon stereomikroskobu altındaki dilimleri kontrol edin. Şartlandırılmış membran eklerine istenen sayıda dilim eklerini plastik bir Pasteur pipeti ile aktararak tohumlayın.
- Dilimleri tercih edilen yönde ve istenen pozisyonda düz cımbız yardımıyla membran eklerinin üzerine taşıyın. Dilimlerin membran yüzeyine daha iyi yapışmasını sağlamak için fazla ortamı bir Pasteur pipeti ile temizleyin.
NOT: Doku veya zar ekinin hasar görmesini önlemek için dilimleri düz cımbızla hareket ettirme ve yönlendirme, nazikçe yapılmalıdır. - 37 °C'de 30 dakikalık inkübasyondan sonra, eki yeni bir Petri kabına aktarın.
NOT: Orta değişim sırasında plastik halkaya dokunun, ancak membranlara dokunmayın. - Membran ekinin altına glial hücre hattından türetilmiş nörotrofik faktör (GDNF) 100 ug mL-1 ile desteklenmiş 1 mL taze OM ekleyin.
- Dilimleri 37 °C'de inkübe edin. Kültürdeki ilk günü day ex vivo (DEV) 0 olarak adlandırın.
- Bir plastik Pasteur pipeti kullanarak, izole edilmiş SC bel bölgesini diseksiyon ortamından alın ve bıçağa dik olarak doğrayıcı aletin kesme tablasına yerleştirin.
3. Organotipik dilimlerin uzun süreli kültürlenmesi
- İstenilen zaman noktalarına kadar dilimleri kültürde 37 ° C'de tutun.
- Ortamı, adım 2.2.7-2.2.8'de açıklandığı gibi DEV 1'de taze OM ile değiştirin.
- DEV 3'te, ertesi gün kök hücrelerin nakli için uygun ortamı oluşturmak için ortamı GM'ye geçirin. Ortamı her 48 saatte bir taze GM ile değiştirin (örneğin, DEV 5, DEV 7...).
- DEV 7'ye kadar her gün ortama taze GDNF (son konsantrasyon 100 μg mL-1) ekleyin. DEV 7'den sonra, yalnızca ortam değiştirildiğinde ekleyin (adım 3.3).
4. h-SC-NES hücre kültürü
NOT: h-SC-NES hücreleri, büyüme faktörlerinin varlığında kültürde tutulur (NES ortamı, adım 4.1.1). Transplantasyondan önce hücreler 7 gün boyunca besiyerinden büyüme faktörleri uzaklaştırılarak ön diferansiyasyon durumunda kaplanır (Prediferansiyasyon besiyeri: Fibroblast büyüme faktörü 2 (FGF-2) ve epidermal büyüme faktörü (EGF) içermeyen NES besiyeri, adım 4.1.2). Daha sonra, hücreler transplantasyondan 2 gün önce farklılaşma durumunda (Diferansiyasyon ortamı, adım 4.1.3) kaplanır. Farklılaşma, Farklılaşma ortamına nörotrofik takviyeler (beyin kaynaklı nörotrofik faktör, BDNF) eklenerek desteklenir. h-SC-NES hücrelerinin12,46 bakımı, bölünmesi, ön farklılaşması ve farklılaşması aşağıda ayrıntılı olarak açıklanmıştır.
- Medya hazırlama: NES, farklılaşma öncesi ve farklılaşma medyası
- h-SC-NES hücre bakım ortamını hazırlayın (NES ortamı, Tablo 1).
- h-SC-NES hücre ön farklılaşma ortamını hazırlayın (Ön farklılaşma ortamı, Tablo 1).
- h-SC-NES hücre farklılaşma ortamını hazırlayın (Farklılaşma ortamı, Tablo 1). Ortam değiştiğinde veya hücreler farklılaşma durumunda ilk kez kaplandığında BDNF'yi taze olarak ekleyin.
NOT: Tüm ortamlar steril koşullarda hazırlanmalı ve 0,22 μm filtrelerle filtrelenmelidir.
- h-SC-NES hücreleri için kaplama çözeltisi
NOT: h-SC-NES hücreleri, POLFN kaplı kültür desteklerinde tutulur (POLFN = Poli-L-Ornitin, Laminin, Fibronektin).- Kaplama çözeltisini bir tüp içinde hazırlayın: Laminin (5 μg mL-1) ve Fibronektin (1 μg mL-1) içeren bir Poli-L-Ornitin çözeltisi.
- Hazırlanan kaplama solüsyonunu, hücre kültürü desteğinin tüm yüzeyini kaplayacak kadar eklemeye özen göstererek hücre kültürü desteğine aktarın. Kaplamayı 37 °C'de 1 saat veya gece boyunca 4 °C'de inkübe edin.
- Kaplama çözeltisini hücre kültürü desteklerinden çıkarın.
NOT: POLFN çözeltisi iki kez daha geri dönüştürülebilir, ancak Laminin ve Fibronektin her seferinde taze olarak eklenmelidir. - Kaplamayı 3x hücre kültürü dereceli steril su ile yıkayın. Kaplamaları 4 °C'de saklayın veya kullanın.
NOT: Kaplamalar 1 hafta içinde kullanılmalıdır. Bundan sonra, eklenen proteinlerin bozunma süreçleri nedeniyle kaplamaların süresi dolmuş olarak kabul edilir.
- h-SC-NES hücre bakımı
- NES ortamında kültürde h-SC-NES hücrelerini koruyun. Birleşme noktasına ulaştıklarında izlemek için hücreleri her gün mikroskop altında kontrol edin.
- Her 2 günde bir yarım ortamı değiştirin: şartlandırılmış ortamın yarısını çıkarın ve yenisini ekleyin (% 20 buharlaşma oranını göz önünde bulundurun).
- Hücreler birleşim noktasına ulaşırsa, adım 4.4'te açıklandığı gibi bölünmeye devam edin.
- h-SC-NES hücre geçişi
NOT: Hücreler aşağıdaki gibi bölünür12:- Şartlandırılmış ortamı çıkarın ve hücreleri Ca2 + / Mg2 + içermeyen Dulbecco'nun fosfat tamponlu salini (DPBS) ile bir kez yıkayın.
- DPBS'yi çıkarın ve enzimatik ayırma gerçekleştirmek için hücrelere tripsin / EDTA çözeltisi ekleyin. Hücreleri 37 ° C'de 30 s ila 1 dakika inkübe edin.
- İnkübasyondan sonra, hücreleri mikroskop altında kontrol edin: ayrılmamışlarsa, mekanik ayırma işlemini gerçekleştirmek için hücre kültürü desteğine hafifçe vurun ve 37 ° C'de 30 saniye daha inkübe edin.
- İnkübasyondan sonra, hücreler ve tripsin / EDTA ile hücre kültürü desteğine 4 hacim DPBS / fetal sığır serumu (FBS) (% 10 hacim / hacim) çözeltisi ekleyerek tripsin / EDTA'yı inaktive edin. Tüm hücrelerin ayrılmasına yardımcı olmak için çözeltiyi hücre kültürü destek yüzeyine yukarı ve aşağı nazikçe pipetleyin. Hücre süspansiyonunu bir tüpte toplayın.
- Hücre süspansiyonunu 200 × g'da 3 dakika santrifüjleyin. Süpernatanı atın ve peleti taze NES ortamında yeniden süspanse edin.
- Hücreleri sayın ve her yeni POLFN kaplı kültür desteğinin üzerine ̴0.5-1 × 105 hücre/cm2 yoğunlukta yerleştirin.
- Y-27632 (10 μM) ekleyin ve hücreleri 37 °C'ye yerleştirin. Birleşene kadar her gün kontrol edin ve ardından bakım/genişletme veya hücre bankacılığı için tekrar bölün.
- h-SC-NES hücre ön farklılaşması
- Hücreleri adım 4.4'te açıklandığı gibi bölün.
- Hücreleri, Ön Farklılaşma ortamında ̴0.5-1 × 105 hücre/cm2 yoğunlukta POLFN kaplı hücre kültürü destekleri üzerine yerleştirin. Bölmeden sonra Y-27632 (10 μM) ekleyin. Farklılaşma öncesi ilk günü in vitro (DIV) 0 olarak adlandırın.
- Ortamın yarısını her 2-3 günde bir değiştirin (bkz. adım 4.3.2).
- Hücreleri DIV 7'ye kadar ön farklılaşma durumunda tutun ve ardından adım 4.6 ile devam edin.
- h-SC-NES hücre farklılaşması
- Ön farklılaşmanın DIV 7'sinde, hücreleri adım 4.4'te açıklandığı gibi bölün.
- Hücreleri, Farklılaşma ortamında ́1-1.5 × 105hücre/cm2yoğunlukta POLFN kaplı hücre kültürü destekleri üzerine yerleştirin. Bölmeden sonra Y-27632 (10 μM) ve BDNF (30 ng mL-1) ekleyin.
- 2 günlük farklılaşmadan sonra (DIV 10), nakil için hücreleri dilimlere bölün.
5. GFP taşıyan lentiviral vektörler ile h-SC-NES hücre transdüksiyonu
NOT: Hücre transdüksiyonu, h-SC-NES hücrelerinin bakım aşamasında gerçekleştirilir. Hücreler doğru bir şekilde transdüksiyon yaptığında, bunlar genişletilebilir ve daha önce açıklanan ön farklılaşma ve farklılaşma protokolleri uygulanır (adım 4.5 ve 4.6).
- Hücre transdüksiyon ortamının hazırlanması
NOT: Hücre transdüksiyon ortamı, farklı parametrelere göre belirli bir hacimde NES ortamı ve kesin bir hacimde lentiviral vektör stoğu (LVS) hazırlığının karıştırılmasıyla hazırlanır: istenen MOI (enfeksiyonun çokluğu = viral partiküllerin sayısının belirli bir enfeksiyon ortamındaki konakçı hücrelerin sayısına oranı); kaplanmış hücrelerin sayısı; LVS preparatının başlangıç konsantrasyonu (= LVS PFU, plak oluşturan birim); Kullanılan kültür kabının yüzey alanı.- Denklem (1) ve (2)'yi kullanarak seçilen MOI'ye göre NES ortamına eklenecek doğru LVS hazırlık hacmini hesaplayın.
(n hücreye plaka/cm2) ×cm2 hücre kültürü desteği × MOI = Seçilen MOI için LVS PFU (1)
LVS PFU : Tot Başlangıç LVS Hacmi (μL) = MOI için LVS PFU : Ortama eklenecek LVS Hacmi (μL)(2)
NOT: LVS PFU'su (LVS'nin ilk PFU'su) ve toplam ilk LVS hacmi üretici tarafından verilmiştir. Seçilen MOI için LVS PFU, denklem (1)'de açıklandığı gibi hesaplanır. Böylece, denklem (2)'de açıklandığı gibi, seçilen MOI için toplam NES ortamı hacmine (hücre kültürü desteğine dayalı olarak) eklenmesi gereken LVS preparat hacmini elde edebiliriz.
Örnek: Önceki laboratuvar deneyimlerine dayanarak MOI 3'ü kullandık (MOI, kullanılan hücre hattına ve viral preparasyona bağlı olarak değişebilir). İstenen MOI 3 ise, kaplanacak hücre sayısı 0,5 × 105/cm2 ve kültür desteği 1 kuyu-MW24 (2cm2) ise, ilk LVS PFU/TU'nun (plak oluşturan birim/dönüştürücü birim) 1 mL'de (1.000 μL = başlangıç LVS hacmi) 25 ×10 6 PFU olduğu varsayılarak, hesaplamalar aşağıdaki gibidir:
1 kuyucuğa kaplanmış hücreler-MW24 (2cm2) = 0.5 × 105 hücre × 2 cm2 = 1 × 105 hücre
1 × 105 hücre × 3 (MOI) = 3 × 105 PFU = MOI 3 için LVS PFU
25 × 106 PFU:1.000 μL = 3 × 105 PFU:x μL
x μL = 12 μL = ortama eklenecek LVS hacmi
Bu nedenle, hücreleri MOI 3'ü 1 arada MW24 ile hücre transdüksiyon ortamı ile dönüştürmek için, 1 kuyu MW24 için hazırlanan NES ortamına (238 μL) 12 μL başlangıç LVS preparatını ekleyin. Nihai toplam hacim 250 μL'dir.
NOT: Ortam genellikle steril koşullar altında transdüksiyon gününde taze olarak hazırlanır.
- Denklem (1) ve (2)'yi kullanarak seçilen MOI'ye göre NES ortamına eklenecek doğru LVS hazırlık hacmini hesaplayın.
- h-SC-NES iletim protokolü
- NES ortamında 0,5 × 105 /cm2 yoğunlukta POLFN kaplı 24 çok kuyulu plaka (veya başka herhangi bir kültür desteğinde) üzerinde düşük bir geçişte plaka h-SC-NES hücreleri.
- Ertesi gün, şartlandırılmış NES ortamını hücrelerin kaplandığı kuyulardan toplayın. Seçilen kültür desteğine bağlı olarak, hücrelere, tohumlama yüzeyini düzgün bir şekilde kaplamak için gerekli olan en düşük hacimde taze hücre transdüksiyon ortamı ekleyin (örneğin, 24 çok oyuklu bir plakanın 250 μL / oyuğu).
- Ardından, h-SC-NES hücrelerini 37 ° C'de 6 saat inkübe edin. Bundan sonra, önceden toplanan şartlandırılmış ortamı hücrelere ekleyin (24 çok oyuklu bir plakanın 200 μL / oyu) ve hücreleri 37 ° C'de inkübe edin.
- Ertesi gün, h-SC-NES hücrelerini DPBS ile bir kez yıkayın ve toplam ortam değişimi (NES ortamı) gerçekleştirin.
- Sonraki günlerde, GFP ekspresyonunu gözlemlemek için hücreleri bir floresan mikroskobu altında kontrol edin.
- Hücre bankacılığı ve transplantasyon için h-SC-NES hücrelerini genişletin.
6. SC dilimlerine hücre nakli ve birlikte kültürleme
- Cam mikroiğnelerin hazırlanması
- Borosilikat cam kılcal damarlardan ince iğneler elde etmek için bir çektirme kullanın. Çektirmeyi şu şekilde ayarlayın: ISI 990, ÇEKİM 350.
NOT: Bir kılcal damardan iki ince iğne elde etmek mümkündür.
- Borosilikat cam kılcal damarlardan ince iğneler elde etmek için bir çektirme kullanın. Çektirmeyi şu şekilde ayarlayın: ISI 990, ÇEKİM 350.
- Transplantasyon için hücre hazırlığı
- Hücreleri adım 4.4'te açıklandığı gibi bölün.
NOT: Hücreler bir floresan raportör ifade etmiyorsa, transplantasyondan sonra ve uzun süreli kültür sırasında bir floresan mikroskobu kullanarak izlemek için bunları bir hücre izleme boyası ile etiketleyin. Etiketleme adımı için seçilen üreticinin protokolünü izleyin. - Bölündükten sonra hücreleri sayın ve 3 dakika boyunca 200 × g'da santrifüjleyin. İstenilen hücre konsantrasyonuna (genellikle 30.000-50.000 hücre μL-1 arasında bir aralık) sahip olmak için elde edilen peleti taze ortam + Y-27632 (10 μM) ile askıya alın.
- Hücre süspansiyonunu 500 μL veya 1.5 mL'lik bir tüpe aktarın ve buzun üzerine yerleştirin. Hücreler nakil için hazırdır.
- Hücreleri adım 4.4'te açıklandığı gibi bölün.
- Organotipik dilimlere hücre nakli
NOT: Bir hava mikroenjektörü ve cam mikroiğneler kullanarak fare SC organotipik dilimlerine h-SC-NES hücre nakli gerçekleştirin.- Bir mikropipet ve mikro yükleyici uçları kullanarak 4 μL hücre süspansiyonlu bir cam mikro iğne yükleyin.
NOT: Mikroenjeksiyon işlemini engelleyebileceğinden iğnede hava kabarcığı oluşumunu önleyin. Kabarcıklar oluşursa, bunları mikropipetle çıkarın. - İğneyi mikroenjektörün atanmış desteğine yerleştirin ve düz cımbız kullanarak iğne ucunu kırın.
NOT: Büyük deliklerin oluşmasını önlemek için cam iğneyi uca daha yakın kırın. - Dilimlere nakledilmeden önce mikroenjeksiyon parametrelerini ayarlayın. Basıncı 10 psi'ye ayarlayın.
NOT: Basınç değeri, mikroenjektöre ve operatör gözlemlerine bağlı olarak değiştirilebilir: basınç, doku hasarını önleyerek hücre süspansiyonunu mikroenjekte etmek için yeterli olmalıdır. - Kalibre edilmiş bir cam slayt üzerine, bir Pasteur pipeti ile bir damla mineral yağ koyun ve hücre süspansiyonunu damlaya mikroenjekte edin. Yağ damlasında elde edilen hücre süspansiyonu küresinin çapı, belirli bir mikroenjeksiyon hacmi ile ilişkilidir. 4nL enjekte etmek için 0,2 mm'lik bir hücre süspansiyon küresinin çapına ulaşmak için mikroenjeksiyon parametrelerini gerektiği gibi değiştirin.
- Doğru hacmi ayarladıktan sonra, hücre süspansiyonunu hızlı bir şekilde dilimlere mikroenjekte edin. Mikroenjeksiyon / transplantasyonun başarılı olduğunu doğrulamak için dilimlerdeki hücrelerin varlığını floresan stereomikroskop altında kontrol edin.
NOT: Hücre süspansiyonu bazen iğneyi tıkayabilir: bu durumda, enjeksiyon parametrelerini değiştirerek hücre süspansiyonunun tıkanıklığını gidermeye çalışın veya yeni hücre süspansiyonu olan yeni bir iğne yükleyin. - Transplantasyondan sonra, dilimleri istenen zaman noktasına kadar 37 ° C ve% 5 CO2'yeyerleştirin ve adım 2.2.7-2.2.8'de açıklandığı gibi her gün orta değişiklik yapın.
- Bir mikropipet ve mikro yükleyici uçları kullanarak 4 μL hücre süspansiyonlu bir cam mikro iğne yükleyin.
7. İmmünofloresan boyama
- 1. Gün
- Ortamı ek membranın altından çıkarın ve dilimleri 3 kez önceden ısıtılmış DPBS ile yıkayın.
- Dilimleri önceden ısıtılmış %4 formaldehit (FA) ile sabitleyin: DPBS'yi çıkarın ve dilimlerle birlikte membran ekinin altına 1,5 mL %4 FA ekleyin. RT'de 15 dakikalık inkübasyondan sonra, membran ekinin üst yüzeyine 1 mL daha fazla% 4 FA ekleyin ve RT'de 15 dakika inkübe edin. Toplam fiksasyon süresi: RT'de 30 dakika
- % 4 FA'yı çıkarın ve dilimleri DPBS ile 3 x 10 dakika yıkayın.
- Ek parçanın zarını bir cerrahi bıçakla çevresel olarak kesin, zarı dilimlerle birlikte ek parçanın plastik bileşeninden ayırın ve immünofloresan adımlarına devam edin.
NOT: Bu adımdan sonra, dilimlerin bulunduğu zar tabakta DPBS'de yüzer. - RT'de 10 dakika boyunca DPBS'de% 0.7 Triton içeren bir çözeltinin 1 mL / membranı ile geçirgenleştirin.
- Geçirgenleştirme solüsyonunu çıkarın ve numuneleri DPBS'de %0.5 Triton, %10 FBS'den oluşan 1 mL / membran blokaj çözeltisi ile 4 ° C'de 4 saat inkübe edin.
- Bloke edici çözeltiyi çıkarın ve dilimlere, çalışma seyreltmelerinde birincil antikorları ekleyin, örneğin, fare anti-Nörofilament (NFL) antikoru, 1:500; tavşan anti-NFL, 1:500; tavşan anti-RBFOX3 (NeuN) antikoru, 1:400; tavşan anti-aktif kaspaz-3 (aCASP3), 1:400; fare anti-insan Çekirdekleri, (Hu-Nu), 1:400; tavşan anti-Hu-Nu, 1:400; fare anti-GFP, 1:400 (Tablo 1'de bildirildiği gibi) DPBS'de% 0.5 Triton,% 1 FBS'den oluşan 1 mL antikor çözeltisinde. 4 ° C'de inkübe edin.
- 2. Gün
- Membranları 1-2 mL DPBS ile 3 x 10 dakika yıkayın.
- Membranı ikincil antikorlarla inkübe edin (örneğin, Keçi anti-Fare IgG (H + L) ikincil antikoru, Alexa Fluor 488, 1:500; Keçi anti-Tavşan IgG (H + L) ikincil antikoru, Alexa Fluor 568, 1:500; Keçi anti-Fare IgG (H + L) ikincil antikoru, Alexa Fluor 647, 1:500; Keçi anti-Tavşan IgG (H + L) ikincil antikoru, Alexa Fluor 647, bildirildiği gibi 1: 500 Tablo 1) ve 1 mL / membran antikor çözeltisi (Triton% 0.5 + FBS% 1) içinde seyreltilmiş çekirdekler için Hoechst / DAPI RT'de 3 saat boyunca.
NOT: İnkübasyon sırasında ve sonraki adımlarda ikincil antikor ağartımını önlemek için numuneleri ışıktan dikkatlice koruyun. - Antikor solüsyonunu çıkarın ve DPBS (1-2 mL) ile 3 x 10 dakika yıkayın.
- DPBS'yi yeni DPBS ile değiştirin ve ışık korumalı koşullarda 4 °C'de saklayın.
- İmmünofloresan protokolünün sonunda, membranları cam slaytlara monte edin. Bir cam slayt üzerine 200 μL'lik bir damla montaj solüsyonu koyun. Düz cımbız yardımıyla, yüzen membranı 35 mm'lik çanaktan bir kapak kızağına aktarın ve ardından membranı montaj solüsyonu ile cam sürgünün üzerine aktarın.
- Yeni bir lamel üzerine 100 μL'lik bir damla montaj solüsyonu koyun ve membranı bununla kaplayın, cam kızak üzerine sabitleyin. Işıktan korunan koşullarda kimyasal davlumbazın altında gece boyunca kurumaya bırakın.
- Numuneleri karanlıkta 4 °C'de saklayın veya görüntüleme analizi yapın.
8. Canlı / Ölü tahlil
- Taze ortamın tabağı başına 700 μL'yi alıntılayarak çalışma çözeltisini hazırlayın ve doğru çalışma seyreltmesinde Sytox (örneğin, Bileşen B, 1: 2.000) ve Calcein'yi (örneğin, Bileşen A, 1: 2.000) ekleyin.
NOT: Reaktifler ışığa duyarlı olduğundan, çalışma solüsyonunu ışıktan koruyun. - Membranın altındaki orta hacmi değerlendirin ve adım 8.1'de açıklanan aynı çalışma seyreltmesinde Sytox ve Calcein'yi ekleyin.
- Adım 8.1'de hazırlanan çalışma solüsyonunun her diliminin üzerine her biri 30 μL'lik 2 damla ekleyin.
NOT: Çanağı karanlık koşullara yerleştirerek ışıktan koruyun. - Dilimleri RT'de 30 dakika inkübe edin.
- İnkübasyondan sonra, zarı bir cerrahi bıçakla ek parçadan çevresel olarak kesin: bundan sonra, dilimlerin bulunduğu zar çalışma çözeltisi içinde yüzer.
- Membranı montaj solüsyonu olmadan düz cımbız yardımıyla bir lamel üzerine baş aşağı yerleştirin ve nemli kalmaları için membranların üzerine 100 μL DPBS ekleyin.
- Konfokal mikroskobu kullanarak mümkün olduğunca hızlı bir şekilde canlı görüntüler elde edin.
NOT: Membranın kurumasını önlemek için görüntü alımı sırasında her 30 dakikada bir membranın üstüne 2 damla 40 μL DPBS ekleyin.
9. Görüntüleme
- Sabit numunelerin konfokal görüntülenmesi
- Kalitatif analiz için, aşağıdaki edinme parametrelerine sahip bir konfokal mikroskop kullanarak görüntüler elde edin: büyük görüntü seçeneğini ayarlayın (seçin: 4 x 4), 10 x objektif kullanın, yığın yok ve 3.634 x 3.634 piksel çözünürlük kullanın.
- Kantitatif analiz için (dilimler için aCASP3, Calcein ve Sytox ve hücreler için aCASP3), aşağıdaki edinim parametrelerine sahip konfokal mikroskobu kullanarak görüntüler elde edin: 20 x objektif, 1,024 x 1,024 piksel çözünürlük 3 μm'lik bir Z adımı.
- Nakledilen dilimlerin stereomikroskop kullanılarak canlı görüntülenmesi
NOT: Stereomikroskobu kullanarak parlak alan ve epifloresan modlarında görüntü yakalayın.- Parlak alan ayarını kullanarak dilimlerin görüntülerini elde edin (burada 3x yakınlaştırma ile 1 x objektif kullanılmıştır).
NOT: Kullanılan mikroskoba bağlı olarak ışığı değiştirin ve gerekirse optik fiberleri kullanın. - Floresan ayarını kullanarak, dilimler için kullanılan aynı objektif ve yakınlaştırma ile nakledilen hücrelerin görüntülerini elde edin (bkz. adım 9.2.1). Çekim için aşağıdaki parametreleri kullanın: kazanç 1, pozlama 200-500 ms, ofset -10.
- Parlak alan ayarını kullanarak dilimlerin görüntülerini elde edin (burada 3x yakınlaştırma ile 1 x objektif kullanılmıştır).
- Konfokal mikroskop kullanılarak Canlı/Ölü testinden sonra canlı görüntüleme
- Aşağıdaki toplama parametrelerine sahip bir konfokal mikroskop kullanarak görüntüler elde edin: 20x objektif, çözünürlük 1,024 x 1,024 piksel, 3 μm'lik bir Z adımı.
10. ImageJ ile görüntü analizi
- NFL, RBFOX3 ve DAPI alan analizi
- ImageJ yazılımını açın (https://imagej.net/software/imagej/).
- Dosya | aç | dosya seç | aç'a tıklayarak dosya görüntüsünü açın.
- Açılır pencerede, Yığın görüntüleme | Hyperstack ve Renk modu | Varsayılan (otomatik ölçeklendirme ile).
- Araç çubuğunda, Görüntü | Renk | Kanalları ayırın.
- Analiz etmek istediğiniz kanalları seçin: NFL (aksonal işaretleyici) için yeşil kanal, RBFOX 3 için kırmızı kanal (nöronal işaretleyici) ve DAPI (nükleer boyama) için mavi kanal.
- NFL analizi için aşağıdaki adımlarla ilerleyin: araç çubuğunda Görüntü | Ayarla | Eşik | Parametreleri seçin (koyu arka plan, algoritma, örn. varsayılan) ve tüm nörit alanını kaplamak ve çevrelemek için imleci değer çubuğunun (alt/üst) üzerine getirin (nöritler koyu bir arka planda beyaz renkle vurgulanır) | Ayarlamak | Uygula.
- Araç çubuğundan izleme aracını seçin ve NFL'nin kapsadığı beyaz alanı otomatik olarak tanımlamak için kullanın. Basın Analizi | Ölçün | μm cinsinden alan değeri2.
- DAPI ve RBFOX3 analizi için aşağıdaki adımlarla ilerleyin: araç çubuğunda Görüntü | Ayarla | Eşik | Parametreleri seçin (beyaz arka plan, algoritma, örn. varsayılan) ve tüm RBFOX3 veya DAPI alanını kaplamak ve sınırlamak için imleci değer çubuğunun (alt/üst) üzerine getirin | Ayarlamak | Uygula.
- Araç çubuğunda İşlem | FFT | Bant Geçiren Filtre. Floresan sinyallerine karşılık gelen RBFOX3 veya DAPI'nin kapladığı beyaz alanı ayarlamak için eşik değer çubuğunu kullanın.
- Araç çubuğundan, izleme aracı Değnek'i seçin ve RBFOX3 veya DAPI'nin kapsadığı alanı otomatik olarak tanımlamak için kullanın. Basın Analizi | Ölçün | μm cinsinden alan değeri2.
- ImageJ ile apoptoz analizi
- ImageJ yazılımını açın (https://imagej.net/software/imagej/).
- Dosya | aç | dosya seç | aç'a tıklayarak Z yığını dosya görüntüsünü açın.
- Açılır pencerede, Yığın görüntüleme | Hyperstack ve Renk modu | Varsayılan (otomatik ölçeklendirme ile).
- Araç çubuğunda, Görüntü | Renk | Kanalları ayırın.
- İstediğiniz kanalları seçin: aCASP3 için kırmızı kanal (analiz etmek için apoptoz işaretleyicisi) ve DAPI için mavi veya camgöbeği veya çekirdekler için Hu-Nu. Ardından, araç çubuğunda öğesini seçerek kanalları üst üste bindirin Görüntü | Renk | Kanalları birleştirme | Kompozit oluşturun.
- Görüntünün Z yığınına göz atmak ve aCASP3 pozitifliğine sahip dilimlerin orta bölgesindeki yığınları belirlemek için görüntünün altındaki Z çubuğunu sürükleyin.
- Araç çubuğunda Eklentiler | Analiz Et | Hücre sayacı.
- Açılan açılır pencerede, görüntüyü sayıma hazırlamak için Başlat'ı seçin; daha sonra bir sayaç türü seçin (örneğin, Tip 1) ve sayılacak nesne olarak yeniden adlandırın (örneğin, aCASP3+ hücreleri). Diğer nesneleri saymak için diğer sayaç türlerini yukarıda açıklandığı gibi yeniden adlandırın (örneğin, toplam hücre sayısı için DAPI+ veya Hu-Nu+ hücreleri).
- Açılır pencerede, sayılacak nesneye karşılık gelen sayaç türünü seçin (örneğin, aCASP3+ hücreleri), ardından araç çubuğundaki Nokta aracını seçin ve aCASP3 için pozitif olan apoptotik hücrelerin sayısını manuel olarak saymaya başlayın, açılan görüntüdeki her bir pozitif hücreye tıklayın.
- Hücre sayacı penceresinde başka bir sayaç türü seçin ve toplam hücre sayısını saymaya başlayın (dilimler için DAPI+ hücreleri; Hu-Nu+ hücreleri, nakledilen hücreler için).
- ImageJ ile Canlı/Ölü tahlilinin analizi
- ImageJ yazılımını açın (https://imagej.net/software/imagej/).
- Dosya | aç | dosya seç | aç'a tıklayarak Z-stack dosya görüntüsünü açın.
- Açılır pencerede, Yığın görüntüleme | Hyperstack ve Renk modu | Varsayılan (otomatik ölçeklendirme ile).
- Araç çubuklarında Görüntü | Renk | Kanalları ayırın.
- İstediğiniz kanalları seçin: Calcein için yeşil kanal (analiz edilecek canlılık işaretçisi) ve Sytox için camgöbeği kanalı (ölü işaretleyici). Ardından, araç çubuğunda öğesini seçerek kanalları üst üste bindirin Görüntü | Renk | Kanalları birleştirme | Bileşik Oluştur'u seçin.
- Görüntünün Z yığınına göz atmak ve dilimlerin orta bölgesindeki yığınları Calcein ve Sytox pozitifliğiyle belirlemek için görüntünün altındaki Z çubuğunu sürükleyin.
- Araç çubuğunda Eklentiler | Analiz Et | Hücre sayacı.
- Açılan açılır pencerede, görüntüyü sayıma hazırlamak için Başlat'ı seçin; daha sonra bir sayaç türü seçin (örneğin, Tip 1) ve sayılacak nesne olarak yeniden adlandırın (örneğin, Calcein+ hücreleri). Başka bir nesneyi saymak gerekiyorsa (örneğin, Sytox+ hücreleri) diğer sayaç türlerini yukarıda açıklandığı gibi yeniden adlandırın.
- Açılan pencerede, sayılacak nesneye karşılık gelen sayaç türünü seçin; ardından araç çubuğundaki Nokta aracını seçin ve açılan görüntüdeki her bir pozitif hücreye tıklayarak Calcein+ hücrelerinin sayısını manuel olarak saymaya başlayın.
- Hücre sayacı penceresinde başka bir sayaç türü seçin ve Sytox+ hücrelerini Calcein için açıklandığı gibi sayın.
11. Grafikler ve istatistiksel analiz
- Tercih ettiğiniz yazılımı kullanarak tüm istatistiksel analizleri gerçekleştirin ve grafikleri çizin.
Sonuçlar
Tarif edilen yöntemler, P3 evresindeki farelerden SC organotipik dilimlerinin oluşturulmasına ve bunların sağlıklı koşullarda uzun süre kültürde tutulmasına izin verir. Ayrıca, hücrelerin dilimlere nakledilmesi ve 30 güne kadar birlikte kültürlenmesi için bir protokol gösteriyoruz (Şekil 1). İlk olarak, kültür koşullarının optimizasyonunu ve SC dilimlerinin nakledilen hücrelerle uzun süreli kültürlenmesi için uygun bir protokolü gösteriyoruz (Şekil 2A). Dilimler, başlangıçta SC dilimlerinin47 bakımı için en uygun ortam olarak önerilen OM'de DEV 0'dan DEV 2'ye kadar üretilir ve korunur. Bununla birlikte, serum proteinlerinin varlığına bağlı olarak, bu ortam, nakledilen nöral öncü hücrelerin nöronal farklılaşmasını ve olgunlaşmasını sürdürmek için yetersiz olabilir. Gerçekten de, DEV 3'te, nöral sağkalımı destekleyen Nörobazal artı B27 içeren bir formülasyon olan OM'den GM'ye geçişi test ettik ve serum olmadan, doğru nöronal farklılaşmayı inhibe eden ve bunun yerine glial bir kaderi teşvik eden48,49.
Şekil 2B, anahtarı almayan SC dilimlerine kıyasla, DEV 3'teki ortamın OM'den GM'ye değiştirilmesiyle elde edilen sonuçları göstermektedir (kontrol dilimleri OM'de kültürlenmiştir). NFL sinyalinin dilimler içindeki dağılımını nöronal bütünlük için bir belirteç olarak kullandık (Şekil 2B,C). DEV 7'deki dilimler, her iki kültür koşulunda da sağlıklıydı ve içlerindeki nörofilamentin (NFL, yeşil renkte) dağınık dağılımını gösterdi. DEV 10'da, GM'de kültürlenen dilimler, NFL boyama dağılımı tarafından belgelendiği gibi, OM'de kültürlenen kontrol dilimlerine göre daha sağlıklı görünüyordu. Ayrıca, Şekil 2B'nin temsili görüntülerinde gösterilen dilimlerin NFL+ alanını (% NFL+ Alanı/DAPI+ Alanı) tahmin ettik. Tahmini NFL + alanı, Şekil 2C'deki histogramlarda temsil edilir ve NFL sinyalinin her iki koşul altında DEV 7'deki dilimlerde dağınık bir şekilde dağıldığını doğrular. Bununla birlikte, DEV 10'da, OM kültür koşulu için NFL boyamanın kapsadığı tahmini alan azalır.
Bu veriler, DEV 3'te GM'ye geçişin, SC dilimlerinin uzun süreli kültürü için iyi tolere edildiğini göstermektedir (DEV 10). Bir sonraki adım olarak, GM'yi daha uzun zaman noktalarında test ettik: DEV 30, DEV 60 ve DEV 90. Şekil 3A,B'de gösterildiği gibi, dilimler DEV 90'a kadar kültürde sağlıklı tutulmuştur. NFL boyama, her zaman noktasında dilimlerde yaygın olarak bulundu ve merkezi bölgeden ayrılan nörit dilimlerinin etrafında yaygın filizlenme oldu. Gerçekten de, Şekil 3A'da gösterilen dilimlerin NFL+ alanını tahmin ettik ve Şekil 3B'nin histogramlarında gösterildiği gibi zamanla arttı. Ayrıca, nöronal belirteç RBFOX3'te pozitiflik gözlemledik ve bu da dilimlerin nöronal farklılaşmasına dair başka bir kanıt çizgisi sağladı. Her zaman noktasında, aCASP3'e pozitif hücre sayısını farklı dilimlerde değerlendirerek apoptoz oranını da kontrol ettik (Şekil 4A, B). Analiz, protokol bölümü 10.2'de açıklandığı gibi gerçekleştirildi. Apoptotik oran (% aCASP3+ hücre / toplam DAPI+ hücre sayısı) her zaman noktasında çok düşük bulundu (DEV 30, 60 ± 90 için sırasıyla 0.85 %0.52, 0.71 ± %0.27, 0.66 ± %0.45) dikkate alınan üç zaman noktası arasında anlamlı bir fark yoktu (p değeri > 0.05, Şekil 4B). Bu veriler, aCASP3 ile ilişkili apoptotik oranın zaman boyunca sabit kaldığını ve dilimlerdeki NFL'nin geniş dağılımı ile birlikte (Şekil 4A), dilimlerin her zaman noktasında hayatta kaldığını doğruladığını göstermektedir.
Önceki verileri desteklemek için, dilimlerin üç farklı zaman noktasında canlılığını değerlendirmek için canlı / ölü bir test de gerçekleştirdik. Canlı ve metabolik olarak aktif hücreleri etiketlemek için Calcein (yeşil boyama) ve hücre ölümünü değerlendirmek için Sytox (camgöbeği boyama) kullandık. Şekil 4C'deki histogramlarda gösterildiği gibi, metabolik olarak aktif hücrelerin yüzdesi DEV 30'dan DEV 90'a hafifçe artar (DEV 30, 60 ± 90 için sırasıyla% 93.21, 96.43 ±% 3.02, 96.33 ±% 3.10), son iki zaman noktası arasında stabilize olur (DEV 30 ve DEV 60 p-değeri = 0.018; DEV 30 ve DEV 90 p değeri = 0.027; DEV 60 ve DEV 90 p değeri = 0.99). Zamanla azalan düşük hücre ölümü seviyeleri bulduk (DEV 30, 60 ± 90 için sırasıyla% 6.83 %5.21, 3.57 ±% 3.02, 3.66 ± %3.10) ve DEV 30 ve sonraki zaman noktaları, DEV 60 ve DEV 90 arasında anlamlı bir fark bulundu (DEV 30 ve DEV 60 p-değeri = 0.018; DEV 30 ve DEV 90 p değeri = 0.027; DEV 60 ve DEV 90 p değeri = 0.99). Bu veriler, apoptoz oranı ile ilişkili olarak, zaman içinde dilim sağkalımını doğrular ve gerçekleştirilen uzun vadeli kültür protokolünün etkinliğini destekler.
SC dilimlerinin uzun süreli kültürlenmesinin fizibilitesi belirlendikten sonra, nöronal farklılaşmanın ilk aşamalarında h-SC-NES hücrelerinin transplantasyonu ile sisteme meydan okuduk. H-SC-NES hücrelerini test ettik çünkü SCI tedavisi12 için umut verici sonuçlar gösterdiler. H-SC-NES hücrelerinin fare SC dilimlerine transplantasyon prosedürü protokol bölüm 6'da açıklanmıştır. SC dilimleri ve nakledilen h-SC-NES hücreleri DPT 30'a kadar muhafaza edildi. Hücreler, Şekil 5A'daki protokol şemasında gösterildiği gibi, farklılaşmanın DIV 10'unda (nöral öncü aşama) DEV 4 organotipik dilimlere aşılandı. Nakledilen hücreler, kültürde GFP ekspresyonu açısından 30 güne kadar izlendi. Şekil 5B , nakledilen GFP + hücreleri ile bir SC diliminin farklı DPT'de temsili canlı görüntülerini göstermektedir. GFP'nin zaman içindeki kararlı ekspresyonu (Şekil 5B ve Şekil 6A), hücrelerin daha önce optimize edilmiş kültür koşullarında SC dokusuna hayatta kaldığını göstermektedir. Ayrıca, protokol bölümü 10.2'de açıklandığı gibi nakledilen hücrelerin apoptotik oranını da kontrol ettik. 30 DPT'den sonra apoptotik oran (% aCASP3+ hücre / toplam Hu-Nu + hücre sayısı) çok düşük (% 0.44 ± %0.34) bulundu (Şekil 6B). Ayrıca, DPT 30'daki apoptotik oranın, daha önce bildirildiği gibi DPT 7'deki aynı tip hücreler için bulunanla uyumlu olduğu bulundu40, bu da kültürlerin zamanla stabilize olduğunu belgeledi.
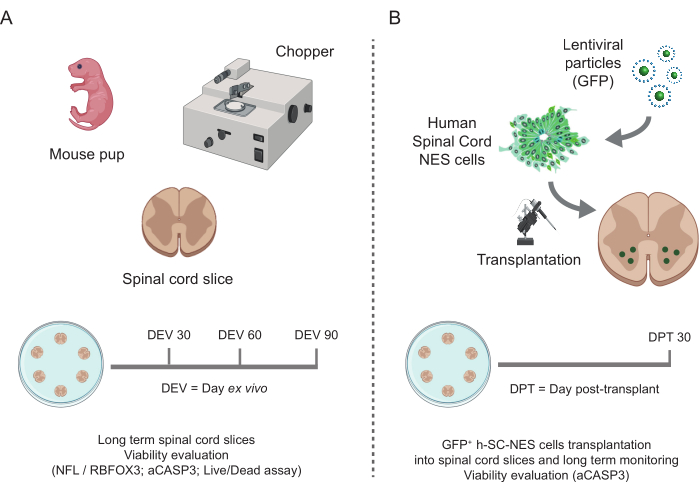
Şekil 1: Protokolün iş akışı. Gerçekleştirilen protokolün genel iş akışını gösteren temsili şema. (A) Solda, P3'teki fare yavrularının izole edilmiş SC'sinden fare SC-dilimi üretimini ve SC organotipik dilimlerinin uzun süreli kültürlenmesini özetleyen bir şema. (B) Sağda, GFP'yi eksprese eden h-SC-NES hücrelerinin fare SC-organotipik dilimlerine transplantasyonunu özetleyen bir şema. Aşılanan hücreler nakilden sonraki 30 gün boyunca korunur. Kısaltmalar: h-SC-NES = insan omuriliğinden türetilmiş nöroepitel sapı; GFP = yeşil floresan proteini; DEV = gün ex vivo; DPT = nakil sonrası gün; NFL = nörofilament hafif zincir; RBFOX3= RNA bağlayıcı tilki-1 homologu 3; aCASP3 = aktif Kaspaz-3; SC= omurilik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
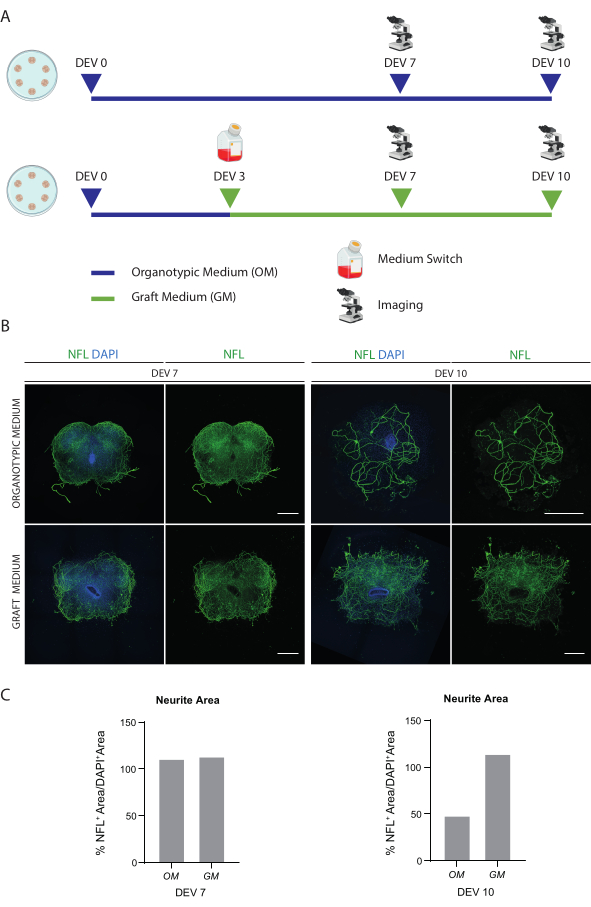
Şekil 2: Uzun vadeli kültür koşullarının optimizasyonu. (A) OM ve GM'yi test etmek için protokolün temsili şeması. OM, kontrol grubu için DEV 7-10'a kadar sürdürülür. Ortam, işlenmiş dilimler için DEV 3'te GM'ye geçirilir; daha sonra, kontrollerle karşılaştırma için DEV 7-10'da sabitlenirler. (B) Farklı koşullarda kültürlenmiş DEV 7 ve 10'da fare SC organotipik dilimlerini karşılaştıran temsili görüntüler. Hücre iskeleti işaretleyici nörofilament (NFL, yeşil) için dilimler boyanır. GM ile kültürlenmiş dilimlerde NFL boyamanın geniş dağılımı, genel bir sağkalım ve farklılaşma olduğunu düşündürmektedir. Çekirdekler DAPI ile karşı boyanır. Ölçek çubuğu = 500 μm. (C) Şekil 1B'de gösterilen dilimlerde NFL'nin kapsadığı alanın tahmininin temsili histogramları. DEV 10'da, OM kültür koşulunda NFL yüzey alanı azalır. Kısaltmalar: DEV = gün ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = nörofilament hafif zincir.; OM = organotipik ortam; GM = greft ortamı; SC = omurilik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
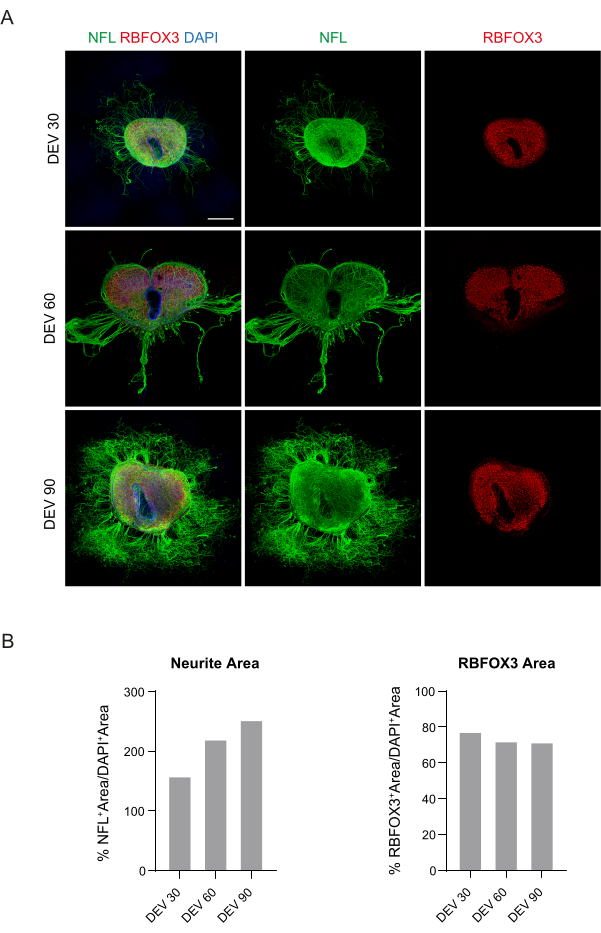
Şekil 3: Uzun süreli kültürlenmiş fare SC organotipik dilimleri. (A) Dilimler DEV 90'a kadar kültürde tutulur. İmmünofloresan testi, hücre iskeleti belirteci nörofilamentin (NFL, yeşil) ve nükleer nöronal belirteç RBFOX3'ün (kırmızı) geniş bir dağılımını ortaya çıkarır ve uzun süreli kültürlemeden sonra sağlıklı durumlarını ve nöronal kimliklerini kanıtlar. Dikkat çekici bir şekilde, NFL+ aksonları zamanla dilimlerin etrafında dağınık bir şekilde filizlenir. Çekirdekler DAPI ile karşı boyanır. Ölçek çubuğu = 500 μm. (B) Panel A'da gösterilen dilimlerin NFL+ alanı ve zamanı ve RBFOX3+ alanı tahmininin temsili histogramları. NFL + nörit alanı zamanla artar. Kısaltmalar: DEV = gün ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = nörofilament hafif zincir; SC = omurilik; RBFOX3= RNA bağlayıcı tilki-1 homologu 3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
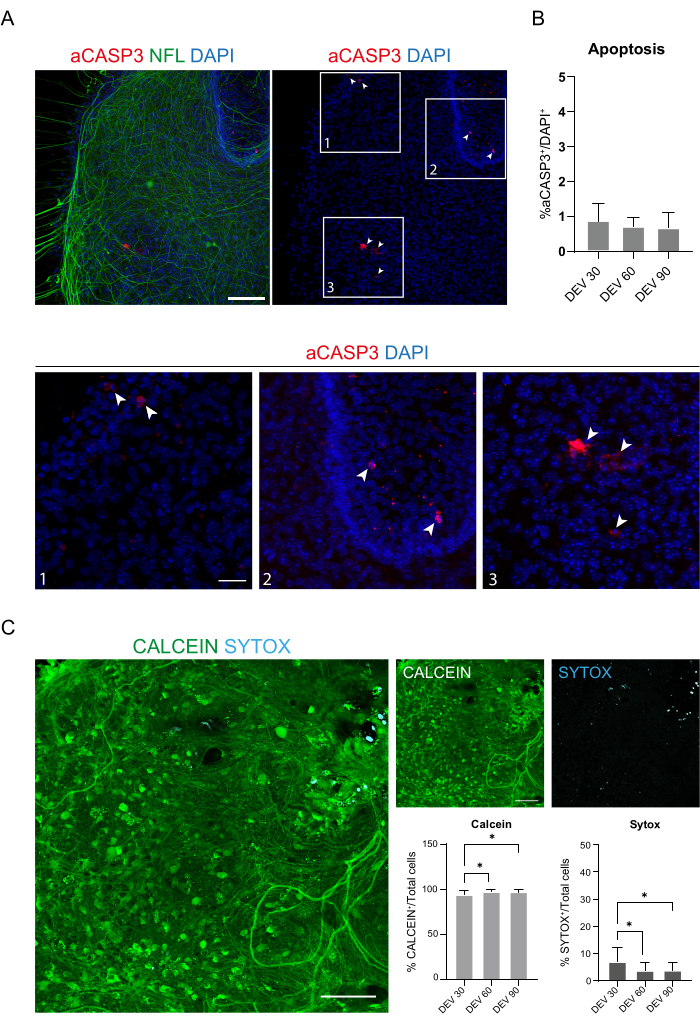
Şekil 4: SC dilimlerinde zaman içinde hücre canlılığının değerlendirilmesi. (A) aCASP3 (kırmızı) ve NFL (yeşil) için boyanmış DEV 60'taki organotipik dilimlerin temsili görüntüleri. Ölçek Çubuğu = 100 μm. NFL dağınık bir desen gösterir. Nadir hücreler apoptotik belirteç aCASP3 için pozitiftir (İç kısım: 1-2-3). (B) Farklı zaman noktalarında dilimler halinde apoptoz oranının analizi. Ortalama ± SD, N (replikasyonlar) = 6 dilim, n (toplam hücre) > her dilim için 1.000, Kruskal-Wallis testi, çoklu karşılaştırma, p-değeri > 0.05. Apoptotik oran zamanla stabildir. Panel A'nın 1-2-3 iç kısımlarında, aCASP3 için pozitif hücrelerin ayrıntılarını (kırmızı boyama, beyaz oklar) gözlemlemek mümkündür. Küçük kırmızı noktalar hücre kalıntılarını ve piknotik çekirdekleri etiketler. Ölçek çubuğu = 50 μm. (C) DEV 90'da SC dilimleri üzerinde gerçekleştirilen canlı/ölü tahlillerin temsili görüntüleri: metabolik olarak aktif hücreler Calcein ile yeşil renkle etiketlenirken, ölü ve hasarlı hücreler Sytox ile açık mavi (camgöbeği) ile etiketlenir. İki histogram, toplam hücre sayısında Calcein (solda) ve Sytox (sağda) için pozitif hücrelerin yüzdesini gösterir. Her iki ortalama ± SD için, N (replikatörler) = 6 dilim, n (toplam hücre) > her dilim için 1.000, Kruskal-Wallis testi, çoklu karşılaştırma, DEV 30 ve DEV 60 p-değeri = 0.018; DEV 30 ve DEV 90 p değeri = 0.027; DEV 60 ve DEV 90 p değeri > 0.99. Kısaltmalar: DEV = gün ex vivo; DAPI = 4',6-diamidino-2-fenilindol; NFL = nörofilament hafif zincir; SC = omurilik; aCASP3 = aktif kaspaz-3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
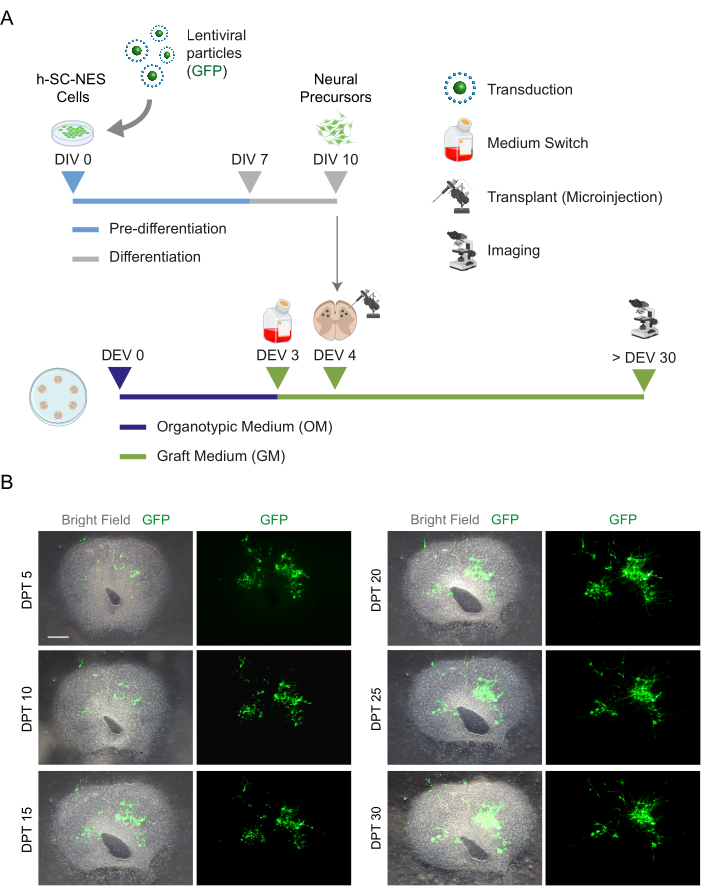
Şekil 5: Fare organotipik dilimlerine h-SC-NES hücre transplantasyonu. (A) Transplantasyon protokolünün temsili şeması. Hücreler, farklılaşmanın DIV 10'unda nöral öncüler olarak DEV 4 organotipik dilimlere nakledilir. (B) DPT 30'a kadar zaman içinde GFP eksprese eden h-SC-NES hücreleri ile nakledilen fare organotipik dilimlerinin temsili görüntüleri. Hücreler, GFP genini taşıyan bir lentiviral vektör ile dönüştürülür. Zaman içindeki GFP ekspresyonu, canlılıklarını ve dilim ortamına adaptasyonlarını doğrular. Ölçek çubuğu = 500 μm. Kısaltmalar: DIV = ön türevdeki ilk gün; h-SC-NES = insan omuriliğinden türetilmiş nöroepitel sapı; GFP = yeşil floresan proteini; DEV = gün ex vivo; OM = organotipik ortam; GM = greft ortamı; DPT = nakilden sonraki günler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
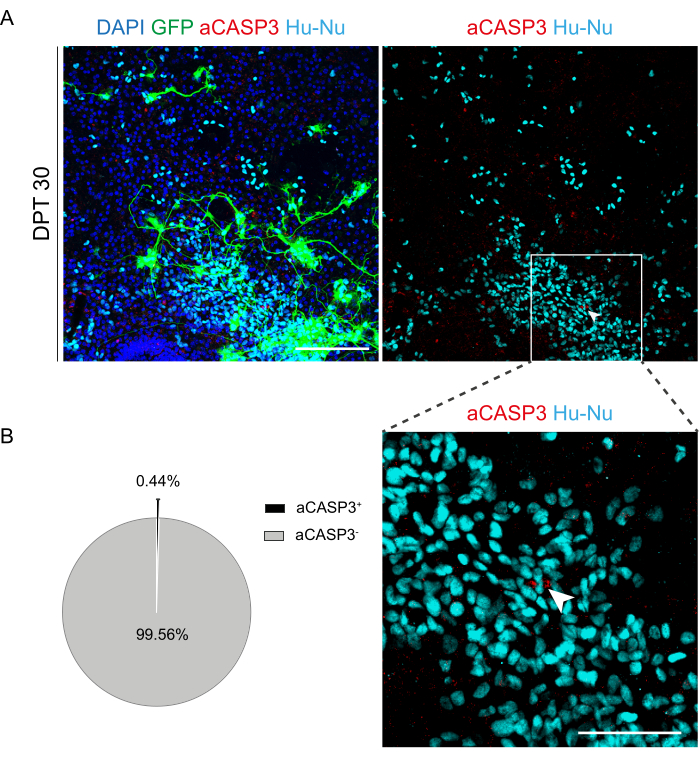
Şekil 6: Nakilden 30 gün sonra nakledilen h-SC-NES hücrelerinin apoptoz hızı değerlendirmesi. (A) GFP eksprese eden h-SC-NES hücreleri ile nakledilen bir fare organotipik diliminin temsili görüntüsü. Hücreler, transplantasyondan sonra dilimlere izlenmesi için GFP genini taşıyan bir lentiviral vektör ile dönüştürülür. Zaman içindeki GFP ekspresyonu, canlılıklarını ve dilim ortamına adaptasyonlarını doğrular. Gösterilen zaman noktası DPT 30'dur; hücreler insan çekirdeği (camgöbeği) ve aCASP3 (kırmızı) için boyanır. Ölçek Çubuğu = 150 μm. (B) Solda, DPT 30'da dilimler halinde nakledilen hücrelerin apoptoz analizinin temsili pasta grafiği (N (çoğaltır) = 5 dilim, n (hücreler) = 5.000) ve sağda, Hu-Nu+ hücrelerinin bir iç kısmı ve aCASP3'e pozitif bir hücrenin ayrıntısı (beyaz ok). Ölçek çubuğu = 75 μm. Küçük kırmızı noktalar hücre kalıntılarını ve piknotik çekirdekleri etiketler. Kısaltmalar: h-SC-NES = insan omuriliğinden türetilmiş nöroepitel sapı; GFP = yeşil floresan proteini; DPT = nakil sonrası gün; DAPI = 4',6-diamidino-2-fenilindol; NFL = nörofilament hafif zincir; aCASP3 = aktif kaspaz-3; Hu-Nu = insan çekirdeği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Bu protokolde kullanılan çözeltilerin bileşimi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Farklı yaklaşımlar test edilmiştir ve en umut verici olanlardan biri rejeneratif bir strateji hücre replasmanına dayanmaktadır. Şu anda, rejeneratif tıp alanındaki gelişmeler, hücre nakillerinin etkinliğini ve güvenliğini tek başına veya diğer yaklaşımlarla kombinasyon halinde test etmek için yeni platformlar gerektirmektedir. Klinik öncesi doğrulamaları, daha ileri klinik çalışmalara devam etmek için esastır. SK organotipik kültürler, nörodejenerasyon, nöral rejenerasyon ve nörogelişimin farklı yönlerini incelemek ve yeni terapötik yaklaşımların etkinliğini araştırmak için yararlı bir platformdur23. Özellikle, organotipik kültürlerin orijinal histomimarisinin ve hücre ve mikroçevre bileşiminin korunması gibi spesifik özellikleri, hücre aşılaması, entegrasyon, farklılaşma ve olgunlaşma gibi transplantasyon dinamiklerini çözmek için avantajlıdır.
Yayınlanmış protokollerle tutarlı olarak, SC organotipik dilimler sağlıklı koşullarda yaklaşık 2-3 hafta kültürde tutulabilir, bu da hücre tedavisinin test şemaları için gerekli olan uzun süreli araştırmalar ve fonksiyonel tarama için kullanımlarını sınırlar. SK dokusu içinde nakledilen hücrelerin doğru kaderine doğru farklılaşma ve olgunlaşma gibi önemli süreçleri araştırmak, uzun süreli izleme gerektirir. Bu hücresel süreçler, hayvan modellerinde yaygın nakiller sırasında kritik öneme sahiptir. İn vivo olarak mevcut birçok özelliği taklit eden bir ex vivo sistemin varlığı, klinik öncesi tarama aşamasında yardımcı olacaktır.
Bu nedenle, bu çalışmada, canlı SC dilimlerinin 90 güne kadar korunmasına izin veren ve normal kültür zaman çerçevelerini üç katına çıkaran optimal bir uzun vadeli (≥30 gün) SC organotipik kültür yöntemi öneriyoruz. Ayrıca, SC dilimleri içinde stabil h-SC-NES hücre engraftmanı ve nakil kültürünün 30 güne kadar sürdürüldüğünü gösteriyoruz. DPT 30'a kadar hücre sağkalımını doğrulamak için GFP ekspresyonunu gözlemleyerek zaman içinde hücre aşılamasını izledik. 30 DPT sonrası hücre apoptoz oranını değerlendirdik. Literatürde, nakledilen h-SC-NES hücrelerinin 7 DPT'de SC-kesitlerde apoptozisinin değerlendirilmesi bildirilmiştir40. Burada, apoptotik oranı daha önceki zaman noktasına (DPT 7) göre karşılaştırmak için DPT 30'da hücre apoptoz analizini genişlettik. Verilerimizin literatürle uyumlu olduğunu bulduk, bu da nakledilen h-SC-NES hücrelerinin, çalışmamızda optimize edilmiş kültür koşullarında tutuldukları takdirde daha sonraki bir zaman noktasında da hayatta kaldıklarını gösteriyor. Bu geliştirilmiş uzun vadeli ex vivo platform tek başına ve nakil konfigürasyonunda, araştırmacılara SCI için kök hücre bazlı nakiller için klinik öncesi taramada yardımcı olacaktır. Bu, nakillerin başarısını teşvik eden daha ileri in vivo çalışmalar için en iyi hücre adayını belirlemelerine olanak sağlayacaktır. Ayrıca, ilk taramadan sonra, SC organotipik dilimler, hayvan modellerinde gözlemlenen uzun vadeli hücresel dinamikleri ve davranışları doğrulamak ve desteklemek veya mekanik çalışmaları desteklemek için in vivo çalışmalara paralel olarak da kullanılabilir.
Protokolümüz, bu uzun vadeli organotipik modelin nasıl oluşturulacağını ayrıntılı olarak açıklamaktadır, ancak bazı kritik adımların da tartışılması gerekmektedir. SK organotipik kültürlerin oluşumu ile ilgili olarak, cerrahi ve kültürün ilk aşamaları sırasında bazı zorluklar vardır. Orijinal histomimariyi koruyan dilimler oluşturmak için iyi yapılmış bir cerrahi prosedür şarttır. İzolasyon sırasında SC bozulursa, dilimler tipik anatomik yapılarını kaybedebilir ve doku hasarı, sağlıksız koşullara ve hücre ölümüne yol açan aşırı bir pro-inflamatuar hakarete neden olabilir. Ameliyat sırasında en zorlu aşama omurgadan SK'nin çıkarılması ve izole edilen SK'den meninkslerin çıkarılmasıdır. Bu adımların başarısı operatörün deneyimine bağlıdır; Bu nedenle, deneylere başlamadan önce bir eğitim dönemi önerilir.
SC'nin bir kıyıcı aracılığıyla koronal kesit alınması da zorlu bir aşamadır. İzole edilmiş SC, bıçağa tam olarak dik olarak kesme tablasına yerleştirilmelidir. Operatör ayrıca bıçağı kesme tablasına dik olarak yerleştirmelidir. Bu önlemler, aynı ve farklı deneyler arasında tekrarlanabilir dilimlerin oluşturulmasını sağlamak için gereklidir. Bir diğer önemli konu ise ameliyat için zamanın sınırlı olmasıdır: tüm dilim oluşturma işleminin ~ 30 dakika sürmesi gerekir. Operatör ameliyat ve kesme için daha fazla zaman harcarsa, SC dokusu zarar görür ve bu da kültürün başarısını ve deneyin sonraki adımlarını bozabilir.
Dilimler kültür zarına yerleştirildikten sonra, onları doğru şekilde beslemek önemlidir. GDNF, doku iyileşmesini ve sağkalımını sürdürmek için gereklidir. Bir kıyıcı ile kesmek doku için travmatiktir ve bu nedenle, pro-enflamatuar ve ölümü teşvik eden moleküllerin fazlalığını temizlemek için kesimden kısa bir süre sonra buz gibi soğuk bir diseksiyon ortamına dilimler yerleştirilir. Daha sonra, daha hızlı bir toparlanma ve zara dilim yapışmasını teşvik etmek için GDNF ile modifiye edilmiş taze besiyeri ile kültür zarlarına (hücre kültürü ekleri) dilimler yerleştirilir. GDNF, kısa yarılanma ömrü50,51 nedeniyle kültürdeki ilk hafta boyunca her gün ortama eklenmelidir. Doku iyileşmesini ve canlılığını desteklemek için dilimlerin kültürdeki ilk günlerde sürekli GDNF varlığına ihtiyaç duyduğunu gözlemledik. Her halükarda, GDNF'nin varlığı tüm kültürleme dönemi için önemli olduğundan, GDNF uygulamasının daha sonraki zaman noktalarında kesintiye uğratılması kesinlikle önerilmez.
Kültürdeki ilk hafta boyunca, dilimleri makroskopik olarak gözle ve mikroskopta kontrol etmek de önemlidir. Yarı saydam doku ve sınırların şeffaflığı, dilimlerin zara ve canlı dokuya düzgün bir şekilde yapıştığının işaretleridir. Nekrotik doku ilk makroskopik bakışta son derece beyaz görünecek ve nekrotik alanlar mikroskopta koyu gri görünecektir. Kültürde birkaç hafta sonra, dokunun morfolojisi değişebilir: hücre hareketleri ve zara doku yapışması bu süreci etkileyebilir. Örneğin, hücrelerle dolu bazı dilimlerde merkezi lümen kaybını ve dorsal ve ventral boynuz morfolojisinin kaybını gözlemledik. Bu, esas olarak daha küçük dilimlerde olurken, çoğu orijinaline yakın bir anatomik yapıyı koruyacaktır. Dilimler genellikle lomber veya torasik bölgelerden üretilir, çünkü bu şekilde zaman içinde orijinal histomimarilerini korumak için uygun boyuta sahip olabilirler: çok küçüklerse mimarilerini kaybederler, çok büyüklerse merkezi bölge nekroza girebilir. Bu nedenle, optimum uzun vadeli kültürleme için uygun boyutta dilimler oluşturmak için fare yavrularının bel bölgesini kullandık, ancak prensip olarak diğer segmentler de düşünülebilir. Ayrıca ventral ve dorsal bölgeler birbirinden daha belirgin olduğu için lomber bölgeyi kullanmayı tercih ettik. Ek olarak, bu bölge, SCI'de hücre replasman tedavileri için ilgi alanları olan daha yüksek oranda motor nöronlar ve gri cevher içeren doku alanları sunar. Hücrelerin dilimlere nakli ile ilgili asıl sorun, cam mikroiğne ucunun kırılması ile ilgilidir. Hücrelerin geçişi için delik çok büyükse, mikroenjeksiyon sırasında SC dokusuna zarar verebilir. Çok küçükse, hücre istiflenmesi iğneyi tıkayarak nakil sürecini engelleyebilir. Hücre acısını ve ölümünü en aza indirmek için transplantasyon prosedürü 1 saat içinde tamamlanmalıdır.
Önerilen protokol, farklı araştırma türleri için optimal ve çok yönlü bir araç sağlar. Burada, 30 gün boyunca fare SC dokusu içindeki farklılaşmanın ilk aşamalarında h-SC-NES hücrelerinin transplantasyonunu doğrulamak için uzun vadeli platformumuzu uyguluyoruz. Önerilen yaklaşımın ana yeniliği, ko-kültür protokolünün optimizasyonudur. GM'nin bileşenleri, SC dilimlerinin ve nakledilen h-SC-NES hücrelerinin uzun süreli nöronal sağkalımını sürdürür. Gerçekten de, serum içermeyen bir ortam olan GM, daha önce organotipik dilim kültürü47 için kullanılan ortama göre nakledilen hücrelerin nöronal kadere doğru farklılaşmasını sürdürür.
SCI için önerilen modellerle ilgili olarak, deneyler genellikle yetişkin fareler üzerinde gerçekleştirilir. Şimdiye kadar, yenidoğan ve yetişkin SK arasındaki en önemli farklar, yetişkin farelere göre yenidoğanda bulunan daha yüksek rejeneratif potansiyel ile ilgilidir52. Bununla birlikte, bu tür farklılıkların önerdiğimiz protokol türü üzerinde hiçbir etkisi yoktur, çünkü burada aşılanmış hücrelerin yerleşik nöronların rejenerasyon yeteneklerinden ziyade ev sahibi doku ortamına verdiği tepkiye odaklanıyoruz. SCI'den sonra yenidoğan ve yetişkin fareler arasındaki diğer bir fark, yetişkinlerde ortaya çıkan glial skar oluşumu ile ilgilidir. Bu husus, birincil ve ikincil yaralanmalardan kaynaklanan karmaşık fizyopatolojik süreçleri dikkate almayan önerilen modelde dikkate alınmamaktadır.
Uygulamalarla ilgili olarak, platform, nakledilen hücreler ile SC organotipik modelinde bulunan yerleşik devreler arasındaki entegrasyonu araştırmak için de kullanılabilir. Genetik mühendisliği araçları, sinaptik bağlantıyı değerlendirmek için CNS'de zaten kullanılıyordu ve bu bağlamda kullanılabilirdi 53,54,55. Özellikle, engrafta hücreler ve SC ex vivo doku arasındaki sinaps oluşumu değerlendirilerek entegrasyon araştırılabilir ve doğrulanabilir. Bu uzun süreli organotipik kültürler, nöroprotektif ve nörorejeneratif ajanları veya yeni molekülleri/materyalleri test etmek veya SK'yi içeren nörodejeneratif bozuklukları incelemek için de kullanılabilir. Spesifik nörodejeneratif bozuklukları incelemek için, protokolün, patoloji için ilgili aşamada (yani yenidoğan, genç, yetişkin) spesifik patoloji ile ilişkili mutasyonları taşıyan transgenik fareler gibi ilgili modellerden üretilen SC dilimlerinin kültürlenmesi için uyarlanması gerekir. Sonuç olarak, protokolümüz ve genel olarak organotipik kültürlerimiz, belirli bir organın eksplantları olarak, 2D hücre kültürleri ile in vivo modeller arasındaki boşluğu dolduran özellikler sunar ve bunları hem temel araştırmalar hem de klinik öncesi testler için paha biçilmez bir araç olarak onaylar.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Çalışma, Wings for Life Vakfı (WFL-IT- 20/21), Avrupa Birliği Yeni Nesil AB-Ulusal Toparlanma ve Dayanıklılık Planı (NRRP)-misyon 4 bileşen 2, yatırım n. 1.4-CUP N. B83C22003930001 (Toskana Sağlık Ekosistemi-THE, Spoke 8) ve Marina Romoli Onlus tarafından desteklenmiştir. Bu yazı sadece yazarların görüş ve düşüncelerini yansıtmaktadır, ne Avrupa Birliği ne de Avrupa Komisyonu bunlardan sorumlu tutulamaz. Veriler ve meta veriler Zenodo 10.5281/zenodo üzerinde mevcuttur.10433147. Görüntüler Biorender https://www.biorender.com/ ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| anti-cleaved Caspase-3, (Asp175) (5A1E) (Rabbit) | Cell Signaling Technology | 9661S | 1:400 |
| anti-GFP (Mouse) - monoclonal | Sigma/Merck | G6539 | 1:400 |
| anti-Human Nuclei (Mouse) - monoclonal, clone 235-1 | Sigma/Merck | MAB1281 | 1:400 |
| anti-Human Nuclei (Rabbit) | NeoBiotechnologies | RBM5-346-P1 | 1:400 |
| anti-NeuN (RBFOX3) (Rabbit) - polyclonal | Sigma/Merck | ABN78 | 1:400 |
| anti-NFL (Mouse) | Sigma/Merck | MAB1615 | 1:400 |
| anti-NFL H-Phospho (Rabbit) -polyclonal | Biologend | 840801 | 1:500 |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| B-27 | Gibco | 17504-044 | |
| BDNF | Gibco | PHC7074 | |
| Blades | Leica | 118364227 | |
| Cell culture graded water | Sigma/Merck | W3500-500ML | |
| Collagen from rat tail | Sigma/Merck | C7661 | |
| Confocal microscope - A1 Confocal Microscope (Eclipse Ti) | Nikon | ||
| D(+)-Glucose | Sigma/Merck | G7021 | |
| Dissecting Forceps | World Precision Instruments | 15915 | |
| DMEM/F12 | Gibco | 31330 | |
| DPBS | Sigma/Merck | D8537 | |
| EGF | Sigma/Merck | gf144 | |
| FBS | Gibco | 10270-106 | |
| FGF-2 | Stemgent | 03-0002 | |
| GDNF | Sigma/Merck | SRP3200 | |
| Glass capillaries, 3.5" | Drummond Scientific Company | 3-000-203-G/X | |
| Glutamax | Gibco | 35050-038 | |
| Goat-anti Mouse IgG Alexa Fluor 488 | Thermo Fisher Scientific | A11029 | |
| Goat-anti Mouse IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21236 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:500 |
| Goat-anti Rabbit IgG Alexa Fluor 647 | Thermo Fisher Scientific | A21244 | 1:500 |
| Graph Pad-Prism | Dotmatics | Software for Statistical Analysis | |
| HBSS | Gibco | 14025-050 | 1:500 |
| HEPES | Gibco | 15630-056 | |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Horse Serum | Gibco | 16050-122 | |
| Insulin | Sigma/Merck | I9278 | |
| Laminin | Sigma/Merck | L2020 | |
| Lentiviral prep | Addgene | 17446-LV | |
| L-Glutamine | Thermo Fisher Scientific | 25030024 | |
| LIVE/DEAD Viability/Cytotoxicity assay kit | Thermo Fisher Scientific | L32250 | |
| McIlwain Tissue Chopper | World Precision Instruments | ||
| MEM | Gibco | 11090-081 | |
| Microloader tips | Eppendorf | 5242956003 | to load cells in the needle for transplantation |
| Microscope slides | VWR | 631-0909 | |
| Millicell cell culture membrane | Sigma/Merck | PICM0RG50 | |
| Miscroscope cover glasses | VWR | ECN 631-1572 | |
| N-2 | Gibco | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Petri dish (35mm) | VWR | 734-2317 | |
| PFA | Sigma/Merck | P6148-500G | |
| Plastic pasteur pipette | Sarstedt | 86.1171.010 | |
| Pneumatic PicoPump | World Precision Instruments | PV830 | Microinjector for transplantation |
| Poly-L-lysine | Sigma/Merck | P4707 | |
| Scalpel blade No 10 Sterile Stainless Steel | VWR International | SWAN3001 | |
| Scalpel handle #3 | World Precision Instruments | 500236 | |
| Spring Scissors | World Precision Instruments | 501235 | |
| Stereomicroscope for imaging and acquisition | Nikon | SMZ18 | |
| Stereomicroscope for surgery | VWR | ||
| Triton X-100 | Merck | T8787 | |
| Tweezers-Dumont #5-inox | World Precision Instruments | 501985 | |
| Vannas Scissors, 8.5 cm | World Precision Instruments | 500086 | |
| Vertical micropipette puller | Shutter Instrument | P-30 | |
| Y-27632 | R&D Systems | 1254/50 |
Referanslar
- Ding, W., et al. Spinal cord injury: The global incidence, prevalence, and disability from the Global Burden of Disease Study 2019. Spine. 47 (21), Phila Pa. 1532-1540 (2022).
- Yang, B., et al. Strategies and prospects of effective neural circuits reconstruction after spinal cord injury. Cell Death Dis. 11 (6), 439(2020).
- Liu, K., et al. PTEN deletion enhances the regenerative ability of adult corticospinal neurons. Nat Neurosci. 13 (9), 1075-1081 (2010).
- Anderson, M. A., et al. Required growth facilitators propel axon regeneration across complete spinal cord injury. Nature. 561 (7723), 396-400 (2018).
- de Freria, C. M., Van Niekerk, E., Blesch, A., Lu, P. Neural stem cells: promoting axonal regeneration and spinal cord connectivity. Cells. 10 (12), 3296(2021).
- Badner, A., Siddiqui, A. M., Fehlings, M. G. Spinal cord injuries: how could cell therapy help. Expert Opin Biol Ther. 17 (5), 529-541 (2017).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Ishii, K., et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury. J Neurosci Res. 84 (8), 1669-1681 (2006).
- Zhang, Y. W., Denham, J., Thies, R. S. Oligodendrocyte progenitor cells derived from human embryonic stem cells express neurotrophic factors. Stem Cells Dev. 15 (6), 943-952 (2006).
- Faulkner, J., Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitors for the treatment of spinal cord injury. Transpl Immunol. 15 (2), 131-142 (2005).
- Kadoya, K., et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 22 (5), 479-487 (2016).
- Dell' Anno, M. T., et al. Human neuroepithelial stem cell regional specificity enables spinal cord repair through a relay circuit. Nat Commun. 9 (1), 3419(2018).
- Wu, S., FitzGerald, K. T., Giordano, J. On the viability and potential value of stem cells for repair and treatment of central neurotrauma: overview and speculations. Front Neurol. 9, 602(2018).
- Nardone, R., et al. Rodent, large animal and non-human primate models of spinal cord injury. Zoology. 123, 101-114 (2017).
- Hartung, T. Thoughts on limitations of animal models. Parkinsonism Relat Disord. 14, SUPPL.2 (2008).
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, Ethics, and Humanities in Medicine. 4 (1), 2(2009).
- Dawson, T. M., Golde, T. E., Lagier-Tourenne, C. Animal models of neurodegenerative diseases. Nat Neurosci. 21 (10), 1370-1379 (2018).
- Hayden, P. J., Harbell, J. W. Special review series on 3D organotypic culture models: Introduction and historical perspective. In Vitro Cell Dev Biol Anim. 57 (2), 95(2021).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Front Mol Biosci. 7, 33(2020).
- Mirbagheri, M., et al. Advanced cell culture platforms: a growing quest for emulating natural tissues. Materials Horizons. 6 (1), 45-71 (2019).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Pandamooz, S., Nabiuni, M., Miyan, J., Ahmadiani, A., Dargahi, L. Organotypic spinal cord culture: a proper platform for the functional screening. Mol Neurobiol. 53 (7), 4659-4674 (2016).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, (2007).
- Gertz, C. C., Lui, J. H., LaMonica, B. E., Wang, X., Kriegstein, A. R. Diverse behaviors of outer radial glia in developing ferret and human cortex. J Neurosci. 34 (7), 2559-2570 (2014).
- Ballerini, L., Galante, M. Network bursting by organotypic spinal slice cultures in the presence of bicuculline and/or strychnine is developmentally regulated. Eur J Neurosci. 10 (9), 2871-2879 (1998).
- Avossa, D., Rosato-Siri, M. D., Mazzarol, F., Ballerini, L. Spinal circuits formation: a study of developmentally regulated markers in organotypic cultures of embryonic mouse spinal cord. Neuroscience. 122 (2), 391-405 (2003).
- Lossi, L., Merighi, A. The use of ex vivo rodent platforms in neuroscience translational research with attention to the 3RS philosophy. Front Vet Sci. 5, 164(2018).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594(2022).
- Qi, X. R., et al. Human brain slice culture: a useful tool to study brain disorders and potential therapeutic compounds. Neurosci Bull. 35 (2), 244(2019).
- Park, H. W., et al. Human mesenchymal stem cell-derived Schwann cell-like cells exhibit neurotrophic effects, via distinct growth factor production, in a model of spinal cord injury. Glia. 58 (9), 1118-1132 (2010).
- Charrière, K., Risold, P. Y., Fellmann, D. In vitro interactions between bone marrow stromal cells and hippocampal slice cultures. C R Biol. 333 (8), 582-590 (2010).
- Jeong, D. K., Taghavi, C. E., Song, K. J., Lee, K. B., Kang, H. W. Organotypic human spinal cord slice culture as an alternative to direct transplantation of human bone marrow precursor cells for treating spinal cord injury. World Neurosurg. 75 (3-4), 533-539 (2011).
- Riggio, C., et al. Generation of magnetized olfactory ensheathing cells for regenerative studies in the central and peripheral nervous tissue. Int J Mol Sci. 14 (6), 10852-10868 (2013).
- Kamei, N., et al. Neural progenitor cells promote corticospinal axon growth in organotypic co-cultures. Neuroreport. 15 (17), 2579-2583 (2004).
- Kamei, N., et al. NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures. Spine. 32 (12), Phila Pa. 1272-1278 (2007).
- Hamasaki, T., et al. Magnetically labeled neural progenitor cells, which are localized by magnetic force, promote axon growth in organotypic cocultures. Spine. 32 (21), Phila Pa. 2300-2305 (2007).
- Kim, H. M., Lee, H. J., Lee, M. Y., Kim, S. U., Kim, B. G. Organotypic spinal cord slice culture to study neural stem/progenitor cell microenvironment in the injured spinal cord. Exp Neurobiol. 19 (2), 106-113 (2010).
- Liu, X., Chu, T. H., Su, H., Guo, A., Wu, W. Neural progenitor cell apoptosis and differentiation were affected by activated microglia in spinal cord slice culture. Neurol Sci. 35 (3), 415-419 (2014).
- De Vincentiis, S., et al. Low forces push the maturation of neural precursors into neurons. Small. 19 (30), 2205871(2023).
- Abouelfetouh, A., Kondoh, T., Ehara, K., Kohmura, E. Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice. Brain Res. 1029 (1), 114-119 (2004).
- Sypecka, J., Koniusz, S., Kawalec, M., Sarnowska, A. The organotypic longitudinal spinal cord slice culture for stem cell study. Stem Cells Int. 2015, 471216(2015).
- Tanvig, M., et al. A brain slice culture model for studies of endogenous and exogenous precursor cell migration in the rostral migratory stream. Brain Res. 1295, 1-12 (2009).
- Tennstaedt, A., et al. Human neural stem cell intracerebral grafts show spontaneous early neuronal differentiation after several weeks. Biomaterials. 44, 143-154 (2015).
- Vogel, S., et al. The in vivo timeline of differentiation of engrafted human neural progenitor cells. Stem Cell Res. 37, 101429(2019).
- Onorati, M., et al. Zika virus disrupts phospho-TBK1 localization and mitosis in human neuroepithelial stem cells and radial glia. Cell Rep. 16 (10), 2576-2592 (2016).
- Vyas, A., et al. An in vitro model of adult mammalian nerve repair. Exp Neurol. 223 (1), 112-118 (2010).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- De Vries, G. H., Boullerne, A. I. Glial cell lines: an overview. Neurochem Res. 35 (12), 1978-2000 (2010).
- Ziv-Polat, O., et al. The role of neurotrophic factors conjugated to iron oxide nanoparticles in peripheral nerve regeneration: in vitro studies. Biomed Res Int. 2014, 267808(2014).
- Mesa-Infante, V., Afonso-Oramas, D., Salas-Hernández, J., Rodríguez-Núñez, J., Barroso-Chinea, P. Long-term exposure to GDNF induces dephosphorylation of Ret, AKT, and ERK1/2, and is ineffective at protecting midbrain dopaminergic neurons in cellular models of Parkinson's disease. Mol Cell Neurosci. 118, 103684(2022).
- Montero, A. M., Huang, A. H. The regenerative capacity of neonatal tissues. Development. 149 (12), (2022).
- Feng, L., Kwon, O., Lee, B., Oh, W. C., Kim, J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 9 (10), 2425-2437 (2014).
- Il Choi, D., Kaang, B. -K. Interrogating structural plasticity among synaptic engrams. Curr Opin Neurobiol. 75, 102552(2022).
- Choi, J. -H., et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 360 (6387), 430-435 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır