Method Article
نموذج الفئران المعدلة وراثيا ثلاثي الألوان لدراسة إصابة صفيحة النمو
In This Article
Summary
يصف هذا البروتوكول نموذج فأر محسن لإصابات صفيحة نمو عظام المراهقين. باستخدام الفئران المعدلة وراثيا مع مراسلي الفلورسنت ثلاثي السلالات لأنواع الكولاجين الأول والثاني والعاشر ، المصفوفات الأولية المرتبطة بثلاث طبقات فرعية مختلفة من صفيحة النمو ، يتم توجيه وضع الإصابة من خلال التألق الأصلي تحت المجهر.
Abstract
تمكن صفائح نمو الغضاريف في عظام الأطفال من إطالة الأطراف ولكنها ضعيفة بالنسبة للعظام ، مما يجعلها عرضة للكسر عندما تكون العظام محملة بشكل زائد. هناك حاجة إلى علاجات أفضل لألواح النمو المكسورة بشدة لأن الاستجابة للإصابة هي جسر عظمي يدمج صفيحة النمو قبل الأوان ، مما يؤدي إلى تقزم الأطراف و / أو ملتوية. تعد نماذج الفئران لإصابة صفيحة النمو مفيدة للدراسات الميكانيكية ، ولكنها صعبة لأنه من الصعب تصور وإصابة صفائح النمو الصغيرة بدقة في الفئران الصغيرة. نصف هنا نموذجا محسنا لإصابة صفيحة النمو باستخدام الفئران المعدلة وراثيا مع مراسلين الفلورسنت ثلاثي السلالات لأنواع الكولاجين الأول والثاني والعاشر.
تظهر هذه الفئران مضان أصلي مرتبط بالطبقات التحتية الأساسية الثلاث لصفيحة النمو. يتم إنشاء إصابة صفيحة نمو مماثلة لإصابة Salter-Harris من النوع الثاني بشكل متكرر باستخدام bur باستخدام القسم الضخامي من صفيحة النمو كمرجع أثناء التصوير المباشر تحت توجيه المجهر الاستريو الفلوري. يبسط تحليل الأنسجة المجمدة للتألق الأصلي تقييم الاستجابة الخلوية للإصابة. تمثل هذه المنهجية قفزة كبيرة في أبحاث إصابة صفائح النمو ، مما يوفر طريقة مفصلة وقابلة للتكرار للتحقيق في علم الأمراض وتقييم الاستراتيجيات العلاجية الجديدة.
Introduction
تلعب صفائح نمو العظام دورا محوريا في النمو الطولي للعظام الطويلة أثناء الطفولة والمراهقة1. تقع صفيحة النمو في نهايات العظام الطويلة ، وتتألف من مناطق متعددة ، مع كون الخلايا الغضروفية هي المكونات الخلوية الرئيسية المسؤولة عن إنتاج منطقة النمو الديناميكية هذه والحفاظ عليها. يحدث التعظم داخل الغضروف لصفيحة النمو لإطالة وتوسيع العظام من خلال تقدم متسلسل لتكاثر الخلايا الغضروفية ، والتضخم ، وموت الخلايا المبرمج ، وغزو الأوعية الدموية ، وتجنيد الخلايا العظمية السلفية ، وأخيرا ، تكوين العظام2. نظرا لأن صفيحة النمو أكثر ليونة نسبيا من العظام ، فهي معرضة بشدة للكسر عندما تكون العظام محملة بشكل زائد أثناء ممارسة الرياضة أو الأنشطة الأخرى. يحدد تصنيف Salter-Harris خمسة أنواع متميزة من إصابات صفيحة النمو3. الكسر من النوع الثاني من خلال المنطقة الضخامية لصفيحة النمو والأنسجة العظمية السفلية المجاورة هو الأكثر انتشارا4. غالبا ما يتشكل الجسر العظمي استجابة لإصابات المنطقة الضخامية أو العظم المجاور ويؤدي إلى الانصهار المبكر لأقسام العظام الطويلة المجاورة5. الجسور العظمية تعيق التوسع الطبيعي لصفيحة النمو. حاليا ، لا تتوفر علاجات وقائية لتشكيل الجسر العظمي ، ويترك بعضها دون علاج اعتمادا على عمر المريض وحجم الجسر العظمي وموقعه6. عندما يكون تشوه الأطراف شديدا ، تشمل الخيارات الجراحية الإزالة تليها زرع مواد متداخلة مثل الدهون أو مطاط السيليكون أو قطع العظم التصحيحي وإجراءات إطالة العظام. ومع ذلك ، قد يستمر الجسر العظمي في إصلاح6. هناك حاجة إلى مزيد من البحث لمنع تكوين الجسر العظمي وتحسين نتائج الأطفال الذين يعانون من إصابات صفيحة نمو العظام.
تم إنشاء العديد من النماذج الحيوانية لاستكشاف الآليات الأساسية وتطوير استراتيجيات جديدة لمنع ضعف الجسر العظمي لألواح النمو بعد الإصابة7،8،9،10،11،12. تركز هذه النماذج الحيوانية بشكل متكرر على صفيحة نمو الظنبوب القريبة وصفيحة نمو عظم الفخذ البعيدة كموقع إصابة أساسي ، نظرا لأن هذا هو المكان الذي تحدث فيه الإصابات البشرية عادة. يتم إنشاء عيوب عظام إما عن طريق نهج جانبي مشابه لمسار الكسر الفعلي أو نهج من أعلى أو أسفل صفيحة النمو مما يؤدي إلى ثقب حفر مركزي في صفيحة النمو. في نموذج الفئران الذي تم الإبلاغ عنه سابقا ، يتم إنشاء عيب في صفيحة النمو عن طريق إدخال بر الأسنان من خلال نافذة قشرية في العمود الأوسط الظنبوبي والحفر لأعلى من خلال النخاع باتجاه مفصل الركبة لإصابة صفيحة النمو مركزيا 7,13. بدلا من ذلك ، يستخدم نموذج الماوس الحديث نهجا جانبيا بإبرة صغيرة التجويف لإنشاء مسار إبرة مستو عبر لوحة النمو8. في نموذج الفئران المستخدم على نطاق واسع ، يتم إنشاء العيب في صفيحة نمو عظم الفخذ البعيد عن طريق الحفر من خلال الغضروف المفصلي بين اللقمات 9,14. في الكبيرة مثل الأرانب والأغنام ، تم تحفيز عيوب صفيحة النمو بشكل جانبي مباشرة في الساق القريبة وعظم الفخذ البعيد عن طريق الحفر أو القطع في صفيحة النمو أو عن طريق الاقتراب من الأسفل وخلق عيب مركزي يترك حواف صفيحة النمو دون تغيير10،11،12،15.
تعد نماذج الفئران لإصابات صفيحة النمو مفيدة للدراسات الميكانيكية التي يمكن تحقيقها مع الفئران المعدلة وراثيا ، مثل دراسات تتبع نسب الخلايا الجذعية8. ومع ذلك ، فإن التحدي الكبير في النماذج الحيوانية للفئران أو الفئران هو تحقيق إصابة متسقة ودقيقة لمنطقة فرعية معينة من صفيحة النمو. مطلوب إصابة مناطق معينة من صفيحة النمو والعظام المجاورة لتقليد أحد مسارات الكسر ذات الصلة سريريا الموصوفة في تصنيفات Salter-Harris. ترجع التحديات حتى الآن في نماذج القوارض في المقام الأول إلى عدم وجود وسيلة بصرية لتحديد الطبقات التحتية لصفيحة النمو أثناء الإنشاء الجراحي للإصابة. يصف هذا البروتوكول تقنية محسنة لإنشاء عيوب صفيحة النمو في الطبقات التحتية المستهدفة من صفيحة نمو الفئران من خلال استخدام الفئران المعدلة وراثيا الثلاثية التي تعبر عن الكولاجين I و II و X مراسلي الفلورسنت16،17،18. يسمح التألق الملون المختلف لهذه الكولاجين في كل منطقة من المناطق الأساسية للوحة النمو بالتمييز البصري للأقسام المختلفة من صفيحة النمو تحت مجهر ستيريو مضان أثناء الإنشاء الجراحي لإصابة صفيحة النمو. يسمح استخدام هذه الفئران المعدلة وراثيا بدقة إصابة غير مسبوقة في فأر صغير في مرحلة نمو مماثلة للأطفال المصابين.
Protocol
تم إجراء البحث وفقا للمبادئ التوجيهية المؤسسية. تمت الموافقة على جميع الإجراءات الحيوانية من قبل اللجنة المؤسسية لرعاية واستخدام في المركز الصحي بجامعة كونيتيكت (IACUC) قبل بدء العمل. تم وصف مخطط للبروتوكول في الشكل 1 التخطيطي.

الشكل 1: الخطوط العريضة لبروتوكول إصابة صفيحة النمو في الفئران مراسلة الكولاجين ثلاثية الألوان. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
1. تربية الفئران والتحضير للجراحة
- قم بتربية الفئران مراسل الكولاجين المعدلة وراثيا ثلاثية الألوان التي تعبر عن Col1a1-GFPTpz و Col2a1-CFP و Col10a1-mCherry16،17،18،19،20،21 لكل إجراءات تربية قياسية للحصول على الجراء للجراحة التي يبلغ عمرها أسبوعين (± يوم واحد). تحقق من التعبير الجيني الثلاثي عن طريق التنميط الجيني لجزء طرف الذيل تحت المجهر الفلوري. استخدم فقط الفئران الموجبة لجميع الألوان الثلاثة لتحقيق أقصى استفادة من نظام المراسل أثناء التحليل النسيجي اللاحق.
ملاحظة: يتم اختيار هذا العمر من 2 أسابيع (± 1 يوم) لأن لوحات نمو العظام الخاصة بهم هي في مرحلة مماثلة من التطور للمراهقالبشري 22. ينطبق هذا البروتوكول على كلا الجنسين من الفئران. - في يوم الجراحة أو قبل يوم واحد ، حدد بشكل فريد كل فأر يستخدم في الجراحة باستخدام لكمة الأذن بعد تطهير الأذن وثقب الأذن باستخدام ضمادات مطهرة كحولية ، ووزن كل فأر ، وتسجيل القيمة.
- حلق الطرف الخلفي الأيمن بالكامل من الورك إلى القدم باستخدام مقص كهربائي بينما يكون الفأر تحت تأثير تخدير الأيزوفلوران. للحث على التخدير في الفئران ، استخدم مزيجا من الأيزوفلوران (2-3٪) والأكسجين بنسبة 100٪ ، يتم إعطاؤه بمعدل تدفق 1 لتر / دقيقة داخل غرفة تحريض 1-2 لتر. قم بإزالة الماوس وتأكد من أن عمق التخدير كاف مع قرصة إصبع القدم التي لا ينبغي أن تتسبب في تحرك الماوس.
ملاحظة: سيستمر عمق التخدير هذا لفترة كافية لإجراء الحلاقة دون الحاجة إلى مخروط الأنف للتخدير. - استخدم التصوير بالأشعة السينية مع إعداد طاقة 26 كيلو فولت (800 مللي أمبير) لالتقاط صور الظنبوب في الفئران الحية تحت التخدير الناجم عن الأيزوفلوران لتسجيل طول الطرف الأولي.
- قبل وضع الفئران في خزانة الأشعة السينية ، قم بإحداث حالة تخدير عميقة باستخدام مزيج من الأيزوفلوران (2-3٪) والأكسجين بنسبة 100٪ ، يتم إعطاؤه بمعدل تدفق 1 لتر / دقيقة داخل غرفة تحريض 1-2 لتر.
- ضع ثلاثة فئران مخدرة في وقت واحد بالتوازي على بطونهم في خزانة الأشعة السينية على ارتفاع رف يسمح بالحصول على صورة واحدة تشمل الفئران الثلاثة. قم بتحريك الساقين حتى لا يتم حجب عظام الظنبوب تحت الماوس. لتحسين دقة القياس ، ضع مقياسا للأشعة بالقرب من الماوس أثناء التصوير (الشكل 2 أ).
- أعد الفئران المحضرة إلى قفصها السكني مع الفأر الأم لانتظار العمليات الجراحية اللاحقة.
2. إعداد المستلزمات الجراحية ومنطقة العمل المعقمة
- تعقيم العناصر التالية: 10-20 وسادة شاش ، مسحات قضيب ذات رؤوس قطنية ، أزيز أسنان (قطر 0.5 مم) ، مقابض أسنان ، ملقط Graefe ، ملقط مرقئ مرقئ البعوض المنحني ، مقص ناعم منحني ، حاملات إبر ، مجسات اللثة ، ونحاتون قرصيون كليويد للأسنان.
- اجمع الإمدادات المعقمة الإضافية الضرورية: تعليق قابل للحقن من البوبرينورفين ، 20 جم إبر ، 1 مل محاقن ، ستائر مناشف ، 5-0 غير مصبوغة ، مضفرة ، مغلفة ، خيوط فيكريل ، بوفيدون اليود ، محلول ملحي مخزن بالفوسفات ، وسادات مطهرة كحولية ، # 15 مشارط ، قفازات جراحية ، أنبوب حاجز سطحي بيئي ، مواد تشحيم للعين ، رذاذ إيثانول 70٪. قم بتشغيل معقم بالخرز الزجاجي لتعقيم إضافي للعناصر أثناء الجراحة ووسادة التدفئة الكهربائية تحت قفص فأر نظيف مع فراش معقم.
- قم بتنظيف وتعقيم مرحلة المجهر المجسم الفلوري والأسطح المجاورة وحامل الأدوات الجراحية باستخدام 70٪ من الإيثانول. قم بتغطية هذه المناطق التي ستصبح مساحة العمل الجراحية بستائر مناشف معقمة.
- قم بتجميع نظام حفر الأسنان الإلكتروني عالي السرعة. قم بتوصيل وحدة التحكم الإلكترونية بالقدم بوحدة التحكم وقم بتغطية سلك القبضة بأنبوب حاجز سطحي مطهر. نعلق معقمة 0.5 مم جولة الأسنان بر. قم بتشغيل وحدة التحكم واضبطها على نسبة محرك 1: 1 وبحد أقصى 30000 دورة في الدقيقة.
- قم بتأمين خرطوم آلة isoflurane المرن الذي ينتهي بمخروط الأنف المغطى بأنبوب حاجز سطحي مطهر sox على مرحلة المجهر المجسم الفلوري.
- قم بتشغيل المجهر المجسم الفلوري والمعدات المساعدة وافتح برنامج الحصول على الصور.
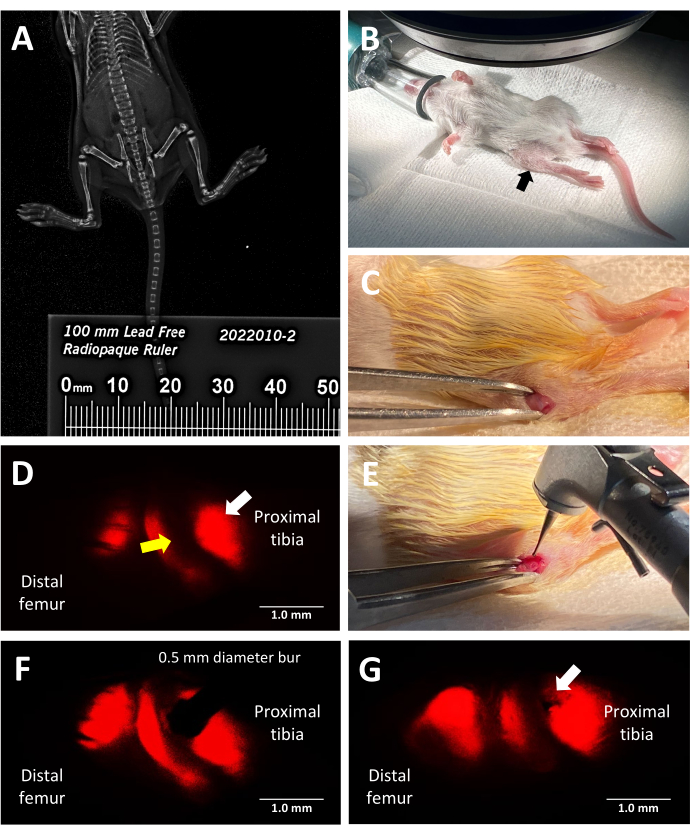
الشكل 2: الخطوات الرئيسية لإجراء إصابة صفيحة نمو الفئران المراسل الفلوري ثلاثي السلالات. أ: قياس طول الظنبوب عن طريق التصوير بالأشعة السينية بالفاكسيترون باستخدام مسطرة ظليلة للأشعة توضع بجانب الفئران في خزانة الأشعة السينية. (ب) الوضع المناسب للفأر المخدر لإجراء عملية جراحية تحت المجهر المجسم الفلوري. الساق القريبة المشار إليها بسهم أسود. ج: مثال على شق تم إجراؤه للوصول إلى صفيحة النمو. (د) مجهر ستيريو مضان يضيء المنطقة الضخامية للوحة النمو (سهم أبيض). يشار إلى المنطقة التكاثرية المجاورة بسهم أصفر. (ه) إضاءة الضوء الساطع للجراح وهو يضع بر الأسنان 0.5 مم على صفيحة النمو. (F) يتم توجيه الوضع الدقيق لبر الأسنان بواسطة المجهر الاستريو الفلوري في المنطقة الضخامية. (ز) مثال على عيب صفيحة النمو الشبيه بنوع سالتر هاريس من النوع الثاني (سهم أبيض). قضبان المقياس = 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إجراء إصابة صفيحة نمو الساق القريبة
- تخدير الفأر في غرفة التخدير isoflurane ، وضبط تركيز isoflurane إلى 2-3 ٪ ومعدل تدفق الأكسجين إلى 1 لتر / دقيقة. انتظر تحريض حالة مخدر عميق ، تم التحقق منها عن طريق اختبار قرصة إصبع القدم ومراقبة أنماط الجهاز التنفسي.
- تطبيق نصف الجرعة الموصوفة من البوبرينورفين تحت الجلد مباشرة بعد إزالة الفأر من الغرفة. جرعات البوبرينورفين وفقا لبروتوكول المعتمد.
- ضع مادة تشحيم العين لحماية عيون الفأر من الجفاف أثناء الجراحة ونقل الماوس في وضع ضعيف إلى مخروط أنف آلة الأيزوفلوران على مرحلة المجهر المجسم (الشكل 2 ب). اضبط تدفق التخدير عبر مخروط الأنف إلى 2٪ ومعدل تدفق الأكسجين إلى 1 لتر / دقيقة.
- تطهير الطرف الخلفي الأيمن ، ومنطقة الحوض ، والجانب الأمامي من الطرف الخلفي الأيسر ، والذيل بالتتابع مع البوفيدون اليود تليها 70 ٪ من الإيثانول.
- تحقق من استمرار عمق التخدير المستقر من خلال اختبار قرصة إصبع القدم الإضافي ومراقبة أنماط الجهاز التنفسي قبل بدء الجراحة.
- تحت إضاءة الضوء الساطع ، استخدم مشرطا # 15 لإنشاء شق في الجلد أسفل مفصل الركبة مباشرة بطول أولي يبلغ حوالي 5 مم ، للكشف عن الطرف القريب من الساق اليمنى (الشكل 2C). استخدم المقص لتمديد القطع إذا لزم الأمر. حافظ على الساق اليسرى المقابلة غير مصابة بحيث تكون بمثابة عنصر تحكم داخلي غير مصاب.
- قم بإجراء تشريح عمودي حاد من خلال العضلة العلوية عند الساق القريبة باستخدام الجانب الخلفي من مشرط # 15 ، وإزالة الأنسجة الرخوة للتعرض الواضح لصفيحة النمو.
- أطفئ أضواء غرفة العمليات وحدد قناة التألق الصحيحة لإضاءة المنطقة المرغوبة من لوحة النمو. مجموعات المرشحات المطلوبة لتصوير كل من الكولاجين الفلوري هي Col 2 Cyan: ET436 / 20x (إثارة) ، ET480 / 40 م (انبعاثات) ، عمود 10 mCherry: ET577 / 20x (إثارة) ، ET640 / 40 م (انبعاثات) ، Col 1 Topaz: ET500 / 20x (إثارة) ، ET535 / 30 م (انبعاثات). ضع الماوس لمراقبة صفيحة نمو الظنبوب القريبة (الشكل 2 د). اضبط فتحة الجلد القريبة قليلا ثم البعيدة للتأكد من أن صفيحة نمو الظنبوب في الرؤية وليس صفيحة نمو عظم الفخذ.
- قم بإنشاء آفة تشبه Salter-Harris من النوع الثاني أثناء النظر من خلال عدسة المجهر عن طريق وضع مثقاب الأسنان 0.5 مم بالتوازي مع المحور الظنبوبي في منتصف منطقة صفيحة النمو الضخامي ، باستخدام نهج جانبي (الشكل 2E ، F). لعمل عيب يحاكي آفة Salter-Harris من النوع الثاني بشكل متكرر ، حافظ على الطرف موازيا لسطح العمل حتى لا ينحني مسار دخول bur إلى المشاش. اضغط على دواسة الحفر لبدء دوران البر واضغط برفق على البر في لوحة النمو قبل أن يصبح العيب أعمق من قطر البر (الشكل 2G).
ملاحظة: زوج ثان من الأيدي يساعد في تثبيت طرف الماوس مفيد. - قم بري موقع الآفة بقطرة من برنامج تلفزيوني معقم لإزالة أي حطام.
- تأكد من عمق العيب عند 0.5 مم باستخدام مسبار اللثة.
4. إجراءات ما بعد الإصابة والإغلاق
- لوقت توصيف العيوب الصفرية ، قم بحصاد الطرف الخلفي المصاب والطرف المتحكم فيه قبل إغلاق الأنسجة. اتبع حصاد الأنسجة والتحضير للتصوير المقطعي المحوسب الدقيق اللاحق (microCT) وتصوير الأنسجة بالتبريد في القسم 6.
ملاحظة: بالنسبة للتجارب التي تنطوي على زرع مادة علاجية في عيب صفيحة النمو ، يمكن للعيب نفسه أن يستوعب فقط قطعة من المادة الحيوية تكون كروية تقريبا وقطرها 0.5 مم أو 0.082 مم3 (0.082 ميكرولتر) في الحجم. - استخدم الملقط تحت التصور المجهري لإدخال المادة الحيوية أو حقن علاج سائل في العيب داخل صفيحة النمو. استخدام كمية أكبر من المواد الحيوية أو المادة المحقونة إذا كان تصميم الدراسة لا يتطلب أن يقتصر العلاج على العيب فقط.
- أعد محاذاة حواف الجلد بعناية ، مع ضمان بقاء المادة المزروعة ، إن وجدت ، بشكل آمن داخل موقع العيب.
- استخدم تقنيات الخياطة المتقطعة مع 5-0 خيوط حمض البولي جليكوليك لإغلاق شق الجلد بشكل فعال.
- قم بتنظيف المناطق خارج المنطقة الجراحية تماما من بقايا البوفيدون واليود باستخدام مسحات بالماء المعقم ، مع توخي الحذر لتجنب ملامسة الجرح والمناطق المحيطة به عن كثب.
- قم بإزالة الماوس من مخروط أنف الأيزوفلوران على مرحلة المجهر إلى قفص الاسترداد ، وضعه بشكل جانبي على فراش جديد فوق وسادة تدفئة.
- راقب عن كثب معدل تنفس الفأر لمدة 5 دقائق تقريبا ، مع إعطاء جرعة البوبرينورفين المتبقية للتسكين تماما كما تتضاءل تأثيرات التخدير الأيزوفلوران ، والتي تشير إلى زيادة معدل التنفس ، ولكن قبل بدء الحركة. الحفاظ على الفأر في قفص استرداد معزول حتى يظهر قدرات متنقلة كاملة ، وبعد ذلك ، لم شمله مع والدته وإخوته.
- إجراء عمليات تفتيش يومية للعملية الأولية بعد 48 ساعة ، تليها تقييمات أسبوعية حتى نقطة القتل الرحيم. ركز على علامات العدوى وفعالية الحركة وإمكانية الوصول إلى الطعام وسلامة الغرز.
- فطم الفئران في الوقت القياسي (أي 3 أسابيع من العمر).
5. قياسات طول الأطراف
- بناء على النقاط الزمنية التي تحددها الفرضية التجريبية والتصميم ، قم بتخدير الفئران بالإيزوفلوران وإجراء تصوير بالأشعة السينية بالطول الكامل لكل من الساق المصابة وغير المصابة كما هو موضح في الشكل 2 أ والموصوف في القسم 1.4. تشمل المعالم المناسبة لإجراء قياسات متسقة لطول الأطراف الجزء العلوي من المشاش الظنبوبي والنهاية البعيدة للساق عند المفصل الظنبوبي كما هو موضح في الشكل 3.
ملاحظة: يستخدم التصوير لتقييم طول الأطراف وتناقضات طول الأطراف بسبب الإصابة ، وكذلك تطور الجسر العظمي داخل أنسجة صفيحة النمو على فترات محددة بعد الجراحة.
6. تشريح الأنسجة والتثبيت والتصوير بالأشعة المقطعية الدقيقة والتضمين
- القتل الرحيم للفأر عن طريق الاختناقCO 2 ويفضل استخدام نظام تحريض CO2 الآلي مع تأكيد الوفاة بطريقة بديلة مثل خلع عنق الرحم.
- عزل كل من الأطراف الخلفية السليمة وإزالة الجلد والعضلات من منطقة كبسولة العظام والركبة استعدادا للتحليل النسيجي والتصوير المقطعي الدقيق.
- قبل وضع الأطراف الخلفية في المثبت ، قم باستئصال الرضفة بعناية عن طريق قطعها باستخدام مقص تشريح دقيق لتسهيل اختراق التثبيت في تجويف الركبة. استخدم حقنة أنسولين 29 جم لتوزيع الفورمالين البارد المخزن بنسبة 10٪ بدقة في جميع مناطق تجويف الركبة. شديدة في منطقة الحجاب الحاجز في عظم الفخذ والساق لتحسين الوصول المثبت إلى مساحة النخاع. حافظ على أنسجة المفصل في وضع ممتد بالكامل داخل المثبت لمدة 24-36 ساعة عند 4 درجات مئوية عن طريق ربطه بشاش إلى وتد رفيع.
تنبيه: الفورمالين سام ويجب التعامل معه في غطاء دخان أثناء ارتداء معدات الحماية الشخصية المناسبة.
- قبل وضع الأطراف الخلفية في المثبت ، قم باستئصال الرضفة بعناية عن طريق قطعها باستخدام مقص تشريح دقيق لتسهيل اختراق التثبيت في تجويف الركبة. استخدم حقنة أنسولين 29 جم لتوزيع الفورمالين البارد المخزن بنسبة 10٪ بدقة في جميع مناطق تجويف الركبة. شديدة في منطقة الحجاب الحاجز في عظم الفخذ والساق لتحسين الوصول المثبت إلى مساحة النخاع. حافظ على أنسجة المفصل في وضع ممتد بالكامل داخل المثبت لمدة 24-36 ساعة عند 4 درجات مئوية عن طريق ربطه بشاش إلى وتد رفيع.
- بعد 24-48 ساعة من تثبيت الفورمالين عند 4 درجات مئوية ، قم بإجراء التصوير المقطعي المحوسب عالي الدقة بالأشعة السينية للعينات المقابلة والمصابة بواسطة التصوير المقطعي المحوسب بعد نقل العينات إلى برنامج تلفزيوني ، لتقييم تطور الجسر العظمي. استخدم حجم فوكسل 6.0 ميكرومتر ، وأوقات عينات تبلغ 330,000 مللي ثانية ، وإعدادات طاقة تبلغ 55,000 فولت بكثافة 145 ميكرو أمبير.
- بعد التصوير المقطعي المحوسب و 24 ساعة إضافية من تثبيت الفورمالين عند 4 درجات مئوية ، اشطف العينات في 1X PBS لمدة 3 × 5 دقائق ، ثم اغمر العينات في 10٪ سكروز في 1X PBS لمدة 1 ساعة ، 20٪ سكروز في 1X PBS لمدة 1 ساعة ، و 30٪ سكروز في 1X PBS بين عشية وضحاها. استخدم حقنة أنسولين 29 جم مملوءة بمحلول السكروز لضمان تغلغل محلول السكروز في جميع مناطق تجويف الركبة. انقله إلى مجمد بدرجة حرارة -80 درجة مئوية إذا لم يتم تضمينه بعد غمر السكروز طوال الليل لضمان الاحتفاظ بمراسل GFP والنشاط الأنزيمي للأنسجة.
- قم بإزالة أي أنسجة عضلية متبقية من منطقة المفصل قبل التضمين. قم بموازنة العينة بوسط تضمين بالتبريد طوال الليل ، مما يسهل الاختراق المتوسط في تجويف الركبة.
- اعرض صور التصوير المقطعي المحوسب لتحديد مكان العيب والجسر العظمي قبل التضمين. ضع طبقة رقيقة من وسط التضمين بالتبريد في cryomold وضع الساق / عظم الفخذ / المفصل الذي تم تشريحه والذي لا يزال متصلا بحيث تواجه المنطقة محل الاهتمام 90 درجة على سطح وسط التضمين.
ملاحظة: يسمح هذا الاتجاه للقسم بالتقاط العرض الجانبي للعيب الذي تم إنشاؤه جانبيا. إذا كان الجسر العظمي بالقرب من حافة العيب ، فإن هذا الاتجاه سيتجنب أيضا إمكانية فقدان منطقة الاهتمام خلال الأجزاء السميكة الأولى التي يتم التقاطها عبر الأنسجة. - ضع cryomold على الثلج الجاف حتى يتجمد وسط التضمين بالتبريد ، مما يؤدي إلى تأمين العينة. استمر في ملء cryomold بالوسط مع إبقائه على الثلج الجاف.
- بعد تأمين العينة ، اغمر cryomold في 2-methyl-butane المبرد بالثلج الجاف حتى يتجمد تماما. بعد التجميد ، قم بإزالة 2-methyl-butane الزائد ، ولف قوالب التبريد في السيلوفان ، واحفظه في -20 درجة مئوية أو -80 درجة مئوية.
ملاحظة: للتخزين المطول لأكثر من 1-2 أشهر في وسط التضمين بالتبريد ، يوصى باستخدام -80 درجة مئوية لمنع الجفاف. تم وصف التقسيم بالتبريد بمساعدة الشريط والتصاق الأقسام بالشرائح الزجاجية سابقا23.
7. التصوير المتسلسل ، تلطيخ ، وإعادة التصوير
- تنفيذ إجراء متسلسل للتصوير والتلوين وإعادة التصوير لتسهيل الكشف عن الإشارات البيولوجية المتعددة وانتشارها داخل نفس قسم الأنسجة كما هو موضح سابقا23. على وجه التحديد بالنسبة لأقسام صفيحة النمو من الفئران مراسل الكولاجين ثلاثية الألوان ، يوصى بالخطوات التالية. يضمن هذا النهج المنظم تصورا شاملا لكل من الإشارات الجزيئية والتفاصيل الهيكلية.
- في البداية ، التقط إشارات الفلورسنت الداخلية للكولاجين الثلاثة في الجولة الأولى من التصوير.
- ضع تلطيخ الكالسيين الأزرق والصورة للأنسجة المعدنية23 ، متبوعا بتلطيخ النشاط الأنزيمي للفوسفاتيز الحمضي المقاوم للطرطرات (TRAP) والتصوير23.
ملاحظة: على الرغم من عدم عرض نتائج تلطيخ النشاط الأنزيمي TRAP هنا ، يتم تنفيذ خطوة التلوين هذه لأنها ضرورية لإزالة المعادن قبل نتائج تلطيخ Safranin O / Fast Green المعروضة في قسم النتائج التمثيلية. - قم بإجراء تلطيخ نووي 4 '، 6-diamidino-2-phenylindole (DAPI) كما هو موضح أدناه ثم الصورة.
- ضع الشرائح التي خضعت لتصوير مسبق في جرة كوبلين تحتوي على 1x PBS. اتركها مغمورة حتى تنفصل أغطية الغطاء عن الشرائح. بمجرد فصلها ، قم بإزالة أغطية الغطاء وتجفيفها تماما.
- قم بتطبيق محلول التلوين المضاد DAPI على أغطية الغطاء ، باستخدام تخفيف 1: 1,000 من DAPI في خليط من 50٪ جلسرين و 1x PBS. تابع عملية التصوير بعد التطبيق.
- اختتم بتطبيق صبغة Safranin O / Fast Green لإبراز بنية الأنسجة ثم الصورة.
ملاحظة: قم بإجراء ذلك كخطوة ختامية لربط الصور الكروموجينية بإشارات الفلورسنت.- تحضير محاليل الهيماتوكسيلين الحديدية من Weigert. تحضير المحلول (أ) عن طريق إذابة 1 g من الهيماتوكسيلين في 100 mL من الإيثانول بنسبة 95٪ والمحلول B عن طريق الجمع بين 4 mL من محلول كلوريد الحديديك بنسبة 29٪ ، و 95 mL من الماء منزوع الأيونات ، و 1 mL من HCl المركز. امزج أجزاء متساوية من المحلول A و B لإنشاء محلول الهيماتوكسيلين العامل من Weigert ، وهو مستقر لمدة 4 أسابيع تقريبا.
- اغمر الشرائح في ماء منزوع الأيونات لمدة 2 × 2 دقيقة لترطيبها.
- ضع محلول الهيماتوكسيلين العامل من Weigert لمدة 5 دقائق.
- اغسل الشرائح في ماء الصنبور لمدة 5 دقائق ، ثم لفترة وجيزة في ماء منزوع الأيونات لمدة 1 دقيقة.
- صبغ بمحلول أخضر سريع 0.2٪ (0.2 جم من Fast Green FCF في 100 مل من الماء منزوع الأيونات) لمدة دقيقتين.
- شطف لفترة وجيزة في 1 ٪ حمض الخليك لمدة 1 دقيقة.
- صبغ بمحلول Safranin O بنسبة 0.1٪ (0.1 جم من Safranin O في 100 مل من الماء منزوع الأيونات) لمدة دقيقة واحدة.
- شطف في الماء منزوع الأيونات حتى الحصول على لون متوازن بصريا ، حوالي 5 دقائق.
- قم بتركيب الشرائح في 30٪ من الجلسرين في الماء منزوع الأيونات (تجنب برنامج تلفزيوني) وانتقل إلى التصوير على الفور لمنع انتشار اللون من الأنسجة. لإبراز خلايا منطقة الراحة في لوحة النمو ، قم بإجراء الصورة باستخدام مرشح Cy5: ET640 / 30x (EX) ، ET690 / 50 m (EM).
النتائج
يستخدم هذا البروتوكول الفئران المراسل الفلورية ثلاثية النسب للحث على عيب صفيحة النمو الجانبي في الساق القريبة بدقة من خلال الاستفادة من التألق الأحمر المتأصل المنبعث من الكولاجين من النوع X للتوجيه الجراحي. يظهر في الشكل 2 د منظر الجراح أثناء النظر من خلال عدسة المجهر المجسم باستخدام مجموعة مرشح mCherry . يسمح مضان النوع X الأصلي للجراح بوضع البر في المنطقة الضخامية وخلق إصابة تحاكي نوعا شائعا من إصابة صفيحة النمو التي تؤدي إلى جسر عظمي (الشكل 2F). التألق تحت القناة الحمراء هو ألمع ، وبالتالي ، يوصى باستخدامه أثناء وضع البر. بدلا من ذلك ، يمكن توجيه إنشاء العيوب باستخدام ألوان أخرى من التألق الأصلي للفئران المحورة وراثيا الثلاثية إذا كان الهدف من التجربة هو دراسة الإصابات في مناطق أخرى من صفيحة النمو غير المنطقة الضخامية والمنطقة المتكلسة المجاورة.
تم التحقق من صحة إنشاء عيب يشبه Salter-Harris من النوع الثاني في المنطقة الضخامية لصفيحة النمو والأنسجة العظمية السفلية المجاورة ، باستخدام بر أسنان قطره 0.5 مم ، من خلال التصوير المقطعي المحوسب والتصوير النسيجي بالتبريد للقصبة القريبة المصابة (الوقت 0) مقارنة بالضوابط الجانبية غير المصابة في N = 3 فئران (الشكل 4). كان من الصعب رؤية العيوب في صور microCT ثلاثية الأبعاد ولكن كان من الممكن اكتشافها في المقاطع العرضية 2-D (الشكل 3A و B و E و F). يعرض الشكل 3G توزيع الخلايا العظمية المنتجة للكولاجين من النوع الأول (التألق الأخضر) ، والخلايا الغضروفية التكاثرية المنتجة للكولاجين من النوع الثاني (التألق السماوي) ، والخلايا الغضروفية الضخامية المنتجة للكولاجين من النوع X. في صورة الفأر المصاب (الشكل 4G) ، هناك اضطراب في المنطقة الضخامية ، والطبقة المتكلسة مؤقتا ، وبعض أحدث العظام المشكلة بالنسبة للتحكم مع المنطقة التكاثرية باضطراب طفيف فقط. يوضح تلطيخ Safranin O / Fast Green (الشكل 4H) بشكل أفضل موقع العيب داخل صفيحة النمو المصابة لأن جميع الخلايا مرئية بوضوح.
يوفر تحليل الأشعة السينية بعض الأفكار حول الفئران الحية فيما يتعلق بتأثير هذا النوع من إصابة صفيحة النمو على طول الساق وتشكيل الجسر العظمي بمرور الوقت (الشكل 3). يكشف التصوير المقارن بين الساق غير المصابة (الشكل 3 أ) والمصابة (الشكل 3 ب) ، التي تم التقاطها قبل الجراحة وبعد 3 أسابيع من الجراحة ، عن كمية كبيرة من نمو الأطراف ، وترقق صفائح النمو ، ومنطقة معتمة مميزة تطورت في منطقة صفيحة النمو المصابة في 3 أسابيع. هذه العتامة داخل صفيحة النمو غير موجودة في النظير غير المصاب ولا الفئران قبل الجراحة. وبالتالي فإن الفاكسيترون هو إحدى طرق مراقبة التغيرات المرضية الناجمة عن الإصابة في الفئران الحية ، مثل تكوين جسر عظمي والتغيرات في طول الأطراف.
يقدم التصوير المقطعي المحوسب للعظام المشرحة تصورا مفصلا لتشكيل الجسر العظمي داخل صفائح النمو المصابة بعد ثلاثة أسابيع من الجراحة (الشكل 5). كما هو موضح في الصور من ستة فئران مصابة مختلفة موضحة في الشكل 5 ، هناك نمو ثابت للجسر العظمي في جميع الفئران. باستخدام برنامج سكانكو ميديكال ، تم حساب حجم الجسر العظمي من خلال مراجعة كل قسم من صفيحة نمو الظنبوب القريبة ، وتحديد منطقة الجسر العظمي (الشكل 5 ب) باستخدام أداة التحديد ، ثم دمج كل منطقة قسم في جميع أنحاء حجم لوحة النمو بالكامل للحصول على الحجم الكلي24. كان حجم الجسر العظمي المحسوب بهذه الطريقة 0.0761 مم3 ± 0.0246 (متوسط الانحراف المعياري ± ، N = 6). تتشكل غالبية الجسور العظمية بالقرب من منتصف صفيحة النمو على الرغم من النهج الجانبي ، مما يؤدي إلى إصابة الحافة الخارجية وكذلك مركز صفيحة النمو. يمكن أن تعزى هذه الظاهرة إلى حقيقة أن الخلايا الجذعية الوسيطة (MSCs) من نخاع العظم ، بدلا من perichondrium ، هي المسؤولة عن تكوين الجسر العظمي25.
في هذه الفئران المعدلة وراثيا ثلاثية الألوان ، يتم إثراء التحليل النسيجي بالتبريد لصفيحة النمو المصابة من خلال مضان الكولاجين الأصلي (الشكل 6). يكشف عن التفاعل المعقد بين خلايا العظام والخلايا الغضروفية في موقع الإصابة. تم توفير صور MicroCT الموضحة في الشكل 6J ، K لفني الأنسجة لتوجيه التضمين والتقسيم. تظهر الخلايا العظمية المنتجة للكولاجين من النوع الأول في الشكل 6L ، O ، P (مضان أخضر) ، بينما تظهر الخلايا الغضروفية التكاثرية المنتجة للكولاجين من النوع الثاني في الشكل 6L ، O ، Q (مضان سماوي). تظهر الخلايا الغضروفية الضخامية المنتجة للكولاجين من النوع X في الشكل 6L ، O ، R (مضان أحمر). يتيح هذا النهج الفلوري متعدد الألوان فحصا مفصلا لتمايز الخلايا الغضروفية بعد الجراحة داخل منطقة الجسر العظمي على خلفية الأنسجة المعدنية. تم استخدام تلطيخ DAPI لتأكيد توزيع جميع أنواع الخلايا داخل منطقة صفيحة النمو (الشكل 6M). يوضح تلطيخ Safranin O / Fast Green التنظيم المركب والهيكلي للغضروف والعظام داخل صفيحة النمو المصابة (الشكل 6N). يؤدي تصوير هذه الأجزاء الملطخة تحت مجموعة مرشح Cy5 إلى تفتيح خلايا منطقة الراحة بشكل ملحوظ عند الواجهة بين عظم المشاش والغضاريف.
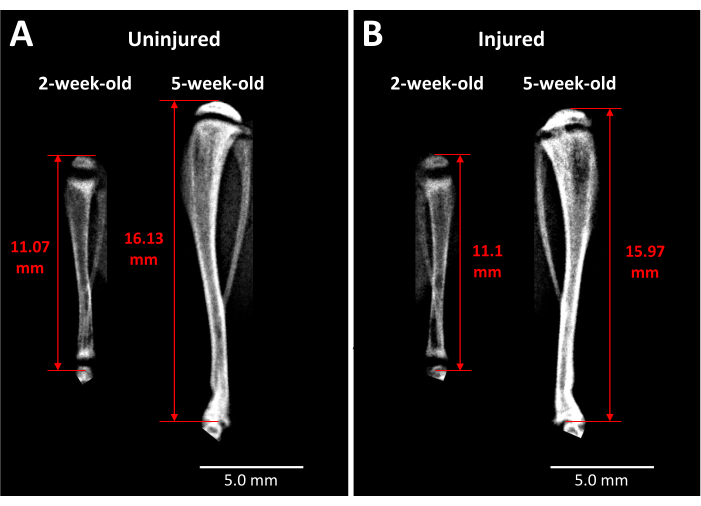
الشكل 3: صور الأشعة السينية للتحكم المقابل وعظمة الفأر المصابة. (أ) يتم التقاط صور الأشعة السينية لساق التحكم المقابل قبل الإصابة مباشرة عندما يكون عمر الفئران 2 أسابيع وفي 3 أسابيع بعد الجراحة عندما يكون عمر الفئران 5 أسابيع ، مما يدل على مدى النمو الذي يحدث خلال هذه الفترة. (ب) إصابة الساق من نفس الفأر في نفس النقاط الزمنية كما في (أ). المعالم المستخدمة لقياسات طول الساق هي قمة رأس الظنبوب القريب إلى نهاية الظنبوب عند مفصل الكاحل (أسهم حمراء برأسين). يظهر الجسر العظمي غير الشفاف في صفيحة نمو الساق القريبة المصابة في 5 أسابيع. قضبان المقياس = 5.00 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
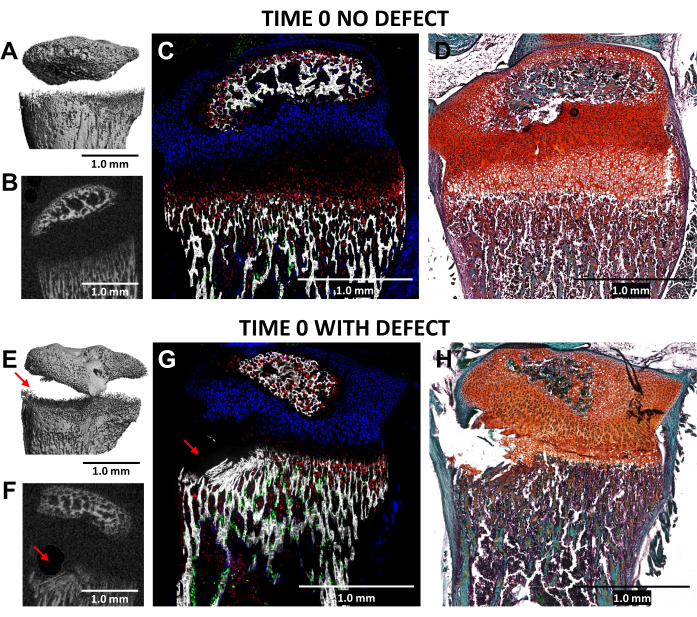
الشكل 4: التصوير المقطعي المحوسب والصور النسيجية للوقت صفر التحكم المقابل وإصابة الفأر الظنبوب القريب. (A ، E) و (B ، F) تصور مناظر 3D و 2D microCT المستعرضة ، مع الإشارة إلى العيب بواسطة الأسهم الحمراء في (E) و (F). (ج، ز) دمج الصور الترابية النسيجية المركبة التي تدمج ثلاث طبقات مضان فطرية مع طبقة نسيج معدنية. الخلايا الخضراء (Col3.6GFPtpz) هي خلايا العظام المنتجة للكولاجين من النوع الأول ، والخلايا ذات اللون الأزرق السماوي (Col2A1GFPcyan) هي الخلايا الغضروفية التكاثرية المنتجة للكولاجين من النوع الثاني ، والخلايا الحمراء (Col10A1RFPchry) هي خلايا غضروفية متضخمة من النوع X منتجة للكولاجين. (د، ح) Safranin O / تلطيخ أخضر سريع لنفس المنطقة مثل (C) و (G). قضبان المقياس = 1.0 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
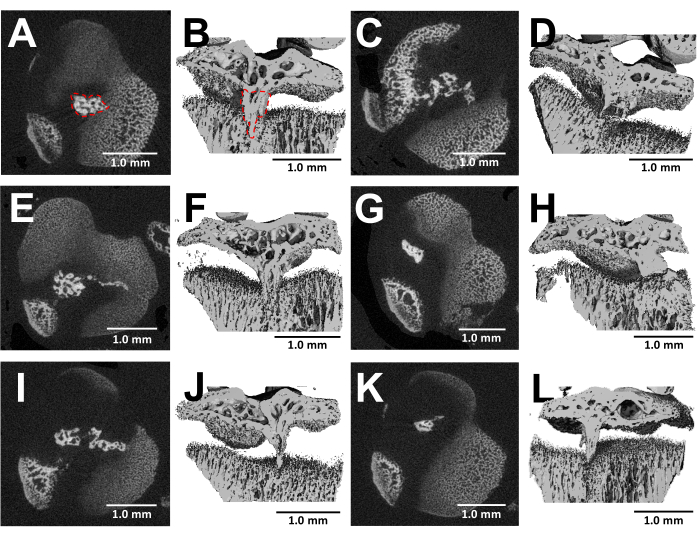
الشكل 5: صور التصوير المقطعي المحوسب الدقيق للجسور العظمية التي يشكلها هذا البروتوكول. (أ ، ج ، ه ، ز ، ط ، ك) المقاطع العرضية المستعرضة لصفيحة نمو الظنبوب القريبة لستة فئران مختلفة بعد 3 أسابيع من إنشاء عيب البر. جسر عظمي محدد بخط أحمر منقط في (أ). (B ، D ، F ، H ، J ، L) إعادة بناء 3D مع قطع طائرة طولية. جسر عظمي محدد بخط أحمر منقط في (ب). قضبان المقياس = 1.0 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
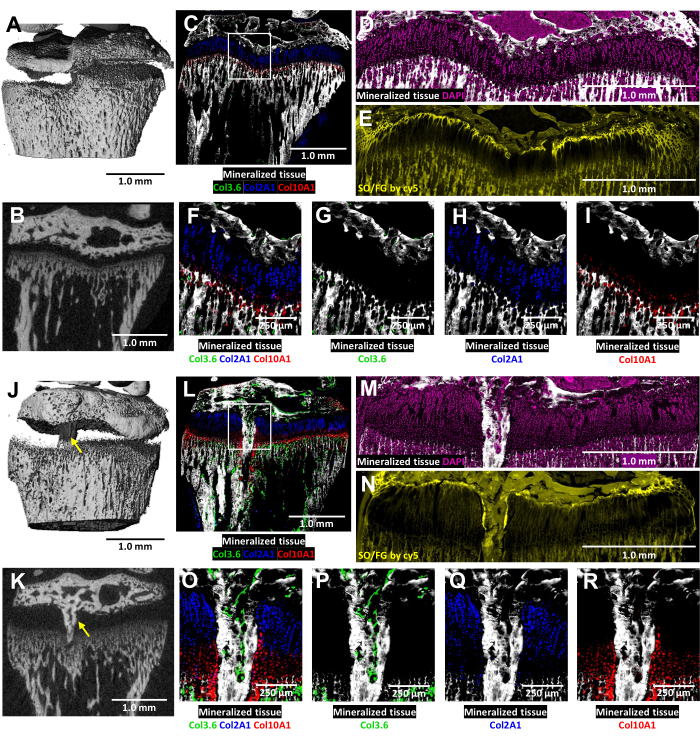
الشكل 6: التصوير المقطعي المحوسب والصور النسيجية للتحكم المقابل والساق القريبة للفأر المصاب مع تكوين جسر عظمي. (A ، J) و (B ، K) تصور مناظر 3D و 2D microCT المستعرضة ، مع الإشارة إلى الجسر العظمي بأسهم صفراء في (J) و (K). (ج، ل) دمج الصور الترابية النسيجية المركبة التي تدمج ثلاث طبقات مضان فطرية مع طبقة نسيج معدنية. الخلايا الخضراء (Col3.6GFPtpz) هي خلايا العظام المنتجة للكولاجين من النوع الأول ، والخلايا ذات اللون الأزرق السماوي (Col2A1GFPcyan) هي الخلايا الغضروفية التكاثرية المنتجة للكولاجين من النوع الثاني ، والخلايا الحمراء (Col10A1RFPchry) هي خلايا غضروفية متضخمة من النوع X منتجة للكولاجين. يشير المربع الأبيض إلى التكبير الأعلى الموضح في اللوحتين F و O. (د، م) الأنسجة المعدنية وتلطيخ DAPI في منطقة لوحة النمو من لوحات C و L. (ه، ن) Safranin O / تلطيخ أخضر سريع من نفس المنطقة مثل (D) و (M) الممسوحة ضوئيا باستخدام مضان cy5. (و ، س) تكبير أعلى لمنطقة صفيحة النمو في الصورة المدمجة للوحتين C و L. (G-I,P-R) تظهر القنوات الفردية للتألق الأصلي مع خلفية الأنسجة المعدنية. قضبان المقياس = 1.0 مم (A-E) و (J-N) ، = 250 ميكرومتر في (F-I) و (O-R). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتيح الاستخدام المبتكر للفئران مراسلة الكولاجين ثلاثية الألوان إنشاء عيوب صفيحة النمو بحجم وموقع محددين مسبقا ، مما يعزز بشكل كبير دقة النماذج التجريبية للفئران لإصابات صفيحة النمو. نظرا لصغر حجم الفئران البالغة من العمر أسبوعين ، فمن الأهمية بمكان استخدام بر صغير يبلغ 0.5 مم لإنشاء الإصابة لتجنب إضعاف الطرف والتسبب في كسر كامل السماكة. يجب على الجراح أيضا تطبيق ضغط كاف عند إنشاء العيب لتجنب الحفر بعمق في العظام لنفس السبب. يعد استخدام مسبار السمحاق أمرا بالغ الأهمية لتأكيد عمق الإصابة المتسق.
كما هو الحال مع أي عملية جراحية ، من المهم تأكيد عمق التخدير الكافي ، والذي يؤكده قرصة إصبع القدم العرضية ويتم الحفاظ على العقم طوال الوقت. نقطة جراحية أخرى ذات أهمية هي أنه تم وصف التشريح الحاد باستخدام النحات لأنه يتجنب إتلاف الأنسجة الرخوة ويساعد على ضمان قدرة الفئران على التنقل فور الشفاء من التخدير للوصول إلى الفأر الأم للتغذية والراحة. في تجربتنا ، ظلت الجروح المغلقة بالغرز مغلقة بنجاح ولا يلزم وجود مشابك الجرح. يوصى بإجراء عملية جراحية على الفئران في عمر 2 أسابيع لتقليد الطفل الصغير الذي يعاني من كسور صفيحة النمو. أحد الجوانب السلبية لهذا البروتوكول هو أنه نظرا لطبيعة الولادة غير المتوقعة ، فإن استخدام نموذج الفأر هذا يتطلب توافر الجراح في غضون مهلة قصيرة.
فيما يتعلق بوضع البر لإنشاء العيب ، يصف البروتوكول إنشاء الإصابة باستخدام مجموعة مرشح mCherry / Texas الحمراء التي تضيء المنطقة الضخامية داخل صفيحة النمو بسبب سطوع مضان الكولاجين X. لضمان حدوث الإصابة داخل صفيحة نمو الظنبوب ، من المفيد تحريك فتحة الأنسجة الرخوة قليلا إلى اليسار واليمين للتأكد من أن صفيحة نمو الظنبوب القريبة في الأفق ، وليس عظم الفخذ. يعد التبديل بين قنوات مجموعة المرشح لإلقاء الضوء على منطقة الخلايا الغضروفية التكاثرية أو أقسام العظام المجاورة مفيدا لتأكيد الوضع الدقيق بالنسبة لموقع المنطقة التكاثرية وأقسام العظام المجاورة.
في حين يمكن تمييز منطقة الخلايا الغضروفية التكاثرية وعظم المشاش والميتافيسيل تحت المجهر الفلوري في الفئران الحية ، فإن القيمة الحقيقية لمراسلي الكولاجين من النوع الثاني والنوع الأول تتحقق أثناء التحليل النسيجي لصفيحة النمو. نظرا للطبيعة المائية للعمليات النسيجية بالتبريد ، فإن بروتوكولات ترسيب الصبغة الكروموجينية التقليدية غير مناسبة بسبب الاختلال المحتمل للون مع التصوير الفلوري الناجم عن خطوات الجفاف. على الرغم من أن البروتوكول المائي ينتج عنه أنماط تلطيخ مماثلة لتلك الموجودة في أقسام البارافين ، إلا أن التصوير السريع بعد التلوين ضروري لمنع انتشار الصبغة من الأنسجة. يمكن أن يؤدي استخدام 30٪ من الجلسرين في الماء المقطر كوسيط تركيب إلى إبطاء هذا الانتشار ، مما يسمح بتلطيخ متعدد للكروموجينيك في نفس القسم ، بما في ذلك الغضروف باستخدام Safranin O / Fast Green.
يمكن رؤية عملية التعظم داخل الغضروف بوضوح مع الخلايا الغضروفية الحمراء التي تبطن الجسر العظمي المتطور (الشكل 6). يمكن أن يؤدي الاستخدام الإضافي لتقنيات الكيمياء الهيستولوجية المناعية ، التي يتوفر لها العديد من الأجسام المضادة للفئران ، إلى زيادة تعزيز الدراسات الميكانيكية التي أجريت في هذه الفئران المعدلة وراثيا. وإجمالا، فإن الجمع بين تقنيات الفاكسيترون والتصوير المقطعي المحوسب الدقيق والتصوير النسيجي بالتبريد في نموذج الفأر المعدل وراثيا هذا يوفر فهما شاملا للتغيرات العيانية والمجهرية التي تحدث استجابة لإصابات صفيحة النمو، مما يمهد الطريق للتدخلات العلاجية المستقبلية للتخفيف من هذه النتائج السلبية. يمكن إجراء المزيد من التلاعب الجيني لهذه الفئران المعدلة وراثيا للسماح لدراسات تتبع النسب بفهم أصل الخلايا التي تشارك زمانيا ومكانيا في الشفاء. سيسمح إجراء التجارب على الفئران مع تعديلات إضافية بدراسة أمراض الغضاريف مثل الورم العظمي الغضروفي - فرط نمو الغضروف والعظام بالقرب من صفيحة النمو.
يتضح اتساق نموذجنا من خلال التكوين القابل للتكرار للجسور العظمية في جميع الفئران دون الحاجة إلى التخلص من أي فئران من المجموعة بسبب إصابة الغضروف المفصلي. يعد هذا تحسنا مقارنة بالنماذج السابقة التي اقتربت من صفيحة النمو من نافذة قشرية أسفل صفيحة النمو ووجهت أداة حادة أو bur لأعلى نحو صفيحة النمو وأحيانا تتجاوز الغضروف المفصلي. إصابة إضافية في الغضروف المفصلي لا تحاكي إصابات صفيحة النمو الشائعة عند الأطفال. تقلل الإصابة الأكثر دقة لهذا النموذج الحيواني من عدد الفئران المطلوبة لكل تجربة وهذا تحسن آخر. يسمح استخدام الفئران المعدلة وراثيا للباحث بتركيز الإصابة على الأقسام الفرعية من صفيحة النمو ، مثل المنطقة الضخامية / المتكلسة مؤقتا أو منطقة المشاش / منطقة الراحة / منطقة التكاثر ، دون التأثير على الغضروف المفصلي. ومع ذلك ، فإن أحد قيود هذا النموذج هو التباين في حجم الجسر العظمي ، والذي يمكن أن يختلف بنسبة تصل إلى 30٪ بين المصابة. وبالتالي ، فإن اكتشاف تأثير مهم سريريا على تكوين الجسر العظمي لا يزال يتطلب عددا كبيرا من لتحقيق الأهمية الإحصائية.
تشمل الفوائد التي تعود على نموذج الفأر كما هو موضح هنا مقارنة بنماذج إصابة صفيحة نمو الفئران أو الأرانب المنشورة سابقا7،9،10،14 ، عددا أقل من المستخدمة ، وخفض التكلفة ، وحجم تكرار فعال بسبب تكوين قضيب عظمي قابل للتكرار ، وإطار زمني أقصر للدراسة ، ووضع إصابة أكثر دقة بسبب التصوير الحي للفئران المحورة وراثيا الثلاثية. على الرغم من عدم مناقشته بالتفصيل ، يمكن استخدام نموذج الماوس هذا لاختبار الغرسات المهندسة للأنسجة أو المواد الحيوية التي توفر عوامل النمو. من القيود الملحوظة على طريقة الفئران هذه أن حجم الغرسة المستخدمة لتوصيل الأدوية أو الخلايا العلاجية يقتصر على حجم العيب الذي يبلغ قطره 0.5 مم تقريبا. فقط النماذج الحيوانية الأكبر يمكن أن تستوعب حجم مواد الاختبار التي يمكن استخدامها في المرضى من البشر. عيب البر الذي تم إنشاؤه في هذا البروتوكول ليس هو نفس هندسة الكسر الرقيق وبالتالي يختلف عن الإصابات البشرية الفعلية. ومع ذلك ، فإن فوائد نموذج الفأر هذا كثيرة ، ويتجنب النهج الجانبي إتلاف الغضروف المفصلي الذي قد يحدث عند الاقتراب بشكل أعمى فوق أو أسفل صفيحة النمو بما يتماشى مع المحور الطويل الظنبوبي. تمثل هذه المنهجية قفزة كبيرة في أبحاث إصابة صفائح النمو ، مما يوفر طريقة مفصلة وقابلة للتكرار للتحقيق في علم الأمراض وتقييم الاستراتيجيات العلاجية الجديدة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل بمنحة من المعاهد الوطنية للصحة والمعهد الوطني لالتهاب المفاصل وأمراض الجهاز العضلي الهيكلي والجلد (NIAMS) 1R21AR079153 ومنحة برنامج تعزيز أبحاث جامعة كونيتيكت (REP). يود المؤلفون أن يشكروا على مساعدة ريناتا ريدزيك من مرفق التصوير المقطعي المحوسب الأساسي بجامعة كونيتيكت.
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
References
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved