Method Article
Tricolor-transgenes Mausmodell zur Untersuchung von Wachstumsfugenverletzungen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein verbessertes Mausmodell für Verletzungen der Knochenwachstumsfugen bei Jugendlichen. Unter Verwendung transgener Mäuse mit Fluoreszenzreportern der Tri-Linie für die Kollagentypen I, II und X, den primären Matrices, die mit drei verschiedenen Substraten der Wachstumsfuge assoziiert sind, wird die Platzierung von Verletzungen durch native Fluoreszenz unter dem Mikroskop gesteuert.
Zusammenfassung
Die Knorpelwachstumsfugen in den Knochen von Kindern ermöglichen die Verlängerung der Gliedmaßen, sind aber im Verhältnis zum Knochen schwach, was sie anfällig für Frakturen macht, wenn die Knochen überlastet werden. Bessere Behandlungen für stark frakturierte Wachstumsfugen sind erforderlich, da die Reaktion auf eine Verletzung eine knöcherne Brücke ist, die die Wachstumsfuge vorzeitig verschmilzt, was zu verkümmerten und/oder krummen Gliedmaßen führt. Mausmodelle der Wachstumsfugenverletzung sind vorteilhaft für mechanistische Studien, stellen aber eine Herausforderung dar, da es schwierig ist, die kleinen Wachstumsfugen bei jungen Mäusen sichtbar zu machen und präzise zu verletzen. Wir beschreiben hier ein verbessertes Wachstumsfugen-Verletzungsmodell unter Verwendung transgener Mäuse mit tri-lineage fluoreszierenden Reportern für die Kollagentypen I, II und X.
Diese Mäuse zeigen eine native Fluoreszenz, die mit den drei primären Substraten der Wachstumsfuge assoziiert ist. Eine Wachstumsfugenverletzung, die einer Salter-Harris-Typ-II-Verletzung ähnelt, wird reproduzierbar mit einem Bohrer erzeugt, wobei der hypertrophe Abschnitt der Wachstumsfuge als Referenz während der Live-Bildgebung unter Fluoreszenz-Stereomikroskopie-Führung verwendet wird. Die gefrorene histologische Analyse der nativen Fluoreszenz vereinfacht die Beurteilung der zellulären Reaktion auf Verletzungen. Diese Methodik stellt einen wesentlichen Sprung in der Erforschung von Wachstumsfugenverletzungen dar und bietet eine detaillierte und reproduzierbare Methode zur Untersuchung der Pathologie und zur Evaluierung neuer therapeutischer Strategien.
Einleitung
Knochenwachstumsfugen spielen eine zentrale Rolle beim Längswachstum langer Knochen im Kindes- und Jugendalter1. Die Wachstumsfuge befindet sich an den Enden langer Knochen und besteht aus mehreren Zonen, wobei Chondrozyten die wichtigsten zellulären Komponenten sind, die für die Produktion und Aufrechterhaltung dieses dynamischen Wachstumsbereichs verantwortlich sind. Die endochondrale Ossifikation der Wachstumsfuge tritt auf, um die Knochen durch eine sequentielle Progression der Chondrozytenproliferation, Hypertrophie, Apoptose, Invasion durch Blutgefäße, Rekrutierung von Osteoprogenitorzellen und schließlich Knochenbildung zu verlängern und zu erweitern2. Da die Wachstumsfuge relativ weicher ist als der Knochen, ist sie sehr anfällig für Frakturen, wenn die Knochen beim Sport oder anderen Aktivitäten überlastet werden. Die Salter-Harris-Klassifikation beschreibt fünf verschiedene Arten von Verletzungen der Wachstumsfugen3. Die Typ-II-Fraktur durch die hypertrophe Zone der Wachstumsfuge und des angrenzenden unteren Knochengewebes ist die häufigste4. Eine knöcherne Brücke bildet sich häufig als Reaktion auf Verletzungen der hypertrophen Zone oder des angrenzenden Knochens und führt zu einer vorzeitigen Versteifung der angrenzenden langen Knochenabschnitte5. Knöcherne Brücken behindern die normale Ausdehnung der Wachstumsfuge. Derzeit gibt es keine vorbeugenden Behandlungen für die Bildung der knöchernen Brücken, und einige bleiben unbehandelt, abhängig vom Alter des Patienten und der Größe und Lage der knöchernen Brücke6. Wenn die Fehlbildungen der Gliedmaßen schwerwiegend sind, umfassen die chirurgischen Optionen die Entfernung, gefolgt von der Implantation von Interpositionalmaterialien wie Fett oder Silikonkautschuk oder korrigierende Osteotomien und Knochenverlängerungsverfahren. Dennoch kann sich eine knöcherne Brücke immer noch neu bilden6. Weitere Forschung ist erforderlich, um die Bildung von Knochenbrücken zu verhindern und die Ergebnisse von Kindern mit Verletzungen der Knochenwachstumsfugen zu verbessern.
Es wurden mehrere Tiermodelle etabliert, um die zugrunde liegenden Mechanismen zu erforschen und neue Strategien zu entwickeln, um eine Beeinträchtigung der Knochenbrücken der Wachstumsfugen nach Verletzungenzu verhindern 7,8,9,10,11,12. Diese Tiermodelle konzentrieren sich häufig auf die proximale tibiale Wachstumsfuge und die distale Femurwachstumsfuge als primäre Verletzungsstelle, da dies typischerweise der Ort ist, an dem menschliche Verletzungen auftreten. Die tierischen Knochendefekte entstehen entweder durch einen lateralen Zugang, der einem tatsächlichen Frakturweg ähnelt, oder durch einen Zugang von oben oder unterhalb der Wachstumsfuge, der zu einer zentralen Bohrung in der Wachstumsfuge führt. In einem zuvor berichteten Rattenmodell wird ein Wachstumsplattendefekt erzeugt, indem ein Zahnbohrer durch ein kortikales Fenster im tibialen Mittelschaft eingeführt und durch das Knochenmark nach oben in Richtung des Kniegelenks gebohrt wird, um die Wachstumsfuge zentral zu verletzen 7,13. Alternativ verwendet ein rezentes Mausmodell einen lateralen Zugang mit einer Nadel mit kleiner Bohrung, um eine planare Nadelbahn durch die Wachstumsfuge8 zu erzeugen. In einem weit verbreiteten Rattenmodell wird der Defekt in der Wachstumsfuge des distalen Femurs erzeugt, indem der Gelenkknorpel zwischen den Kondylendurchbohrt wird 9,14. Bei größeren Tieren wie Kaninchen und Schafen wurden Wachstumsplattendefekte sowohl direkt in der proximalen Tibia als auch im distalen Femur durch Bohren oder Schneiden in die Wachstumsfuge oder durch Annäherung von unten und Schaffung eines zentralen Defekts induziert, wobei die Ränder der Wachstumsfuge unverändert blieben 10,11,12,15.
Mausmodelle für Verletzungen der Wachstumsfugen sind vorteilhaft für mechanistische Studien, die mit genetisch veränderten Mäusen durchgeführt werden können, wie z. B. Studien zur Rückverfolgung von Stammzelllinien8. Eine große Herausforderung in Maus- oder Rattentiermodellen besteht jedoch darin, eine konsistente und präzise Schädigung einer bestimmten Unterregion der Wachstumsfuge zu erreichen. Die Verletzung bestimmter Zonen der Wachstumsfuge und des angrenzenden Knochens ist erforderlich, um einen der klinisch relevanten Frakturpfade nachzuahmen, die durch die Salter-Harris-Klassifikationen beschrieben werden. Die bisherigen Herausforderungen in Nagetiermodellen sind vor allem auf das Fehlen eines visuellen Mittels zur Identifizierung des Substrats der Wachstumsfuge während der chirurgischen Entstehung der Verletzung zurückzuführen. Dieses Protokoll beschreibt eine verfeinerte Technik zur Erzeugung von Wachstumsplattendefekten in gezielten Substraten der murinen Wachstumsfuge unter Verwendung von dreifach transgenen Mäusen, die Kollagen I, II und X Fluoreszenzreporter exprimieren 16,17,18. Die verschiedenfarbige Fluoreszenz dieser Kollagene in jeder der primären Zonen der Wachstumsfuge ermöglicht die visuelle Unterscheidung der verschiedenen Abschnitte der Wachstumsfuge unter einem Fluoreszenz-Stereomikroskop während der chirurgischen Entstehung der Wachstumsfugenverletzung. Die Verwendung dieser transgenen Mäuse ermöglicht eine beispiellose Verletzungsgenauigkeit bei einer jungen Maus in einem vergleichbaren Entwicklungsstadium wie bei den verletzten Kindern.
Protokoll
Die Forschung wurde in Übereinstimmung mit den institutionellen Richtlinien durchgeführt. Alle tierexperimentellen Verfahren wurden vor Beginn der Arbeiten vom Institutional Animal Care and Use Committee (IACUC) des Gesundheitszentrums der University of Connecticut genehmigt. Ein Überblick über das Protokoll ist in Abbildung 1 dargestellt.

Abbildung 1: Gliederung des Protokolls zur Schädigung der Wachstumsfuge bei dreifarbigen Kollagen-Reportermäusen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Mauszucht und Vorbereitung auf die Operation
- Züchten Sie dreifarbige transgene Kollagen-Reportermäuse, die Col1a1-GFPTpz, Col2a1-CFP und Col10a1-mCherry 16,17,18,19,20,21 exprimieren, um Welpen für die Operation zu erhalten, die 2 Wochen alt sind (± 1 Tag). Verifizieren Sie die Expression des dreifachen Transgens durch Genotypisierung eines Fragments der Schwanzspitze unter einem Fluoreszenzmikroskop. Verwenden Sie nur die Mäuse, die für alle drei Farben positiv sind, um den Nutzen des Reportersystems bei der anschließenden histologischen Analyse zu maximieren.
HINWEIS: Dieses Alter von 2 Wochen (± 1 Tag) wird gewählt, da sich ihre Knochenwachstumsfugen in einem ähnlichen Entwicklungsstadium befinden wie bei einem menschlichen Jugendlichen22. Dieses Protokoll gilt für beide Geschlechter von Mäusen. - Identifizieren Sie am Tag der Operation oder einen Tag davor jede Maus, die für die Operation verwendet wird, mit einem Ohrstanzer, nachdem Sie das Ohr und den Ohrlocher mit alkoholischen Antiseptikum-Pads desinfiziert haben, wiegen Sie jede Maus und notieren Sie den Wert.
- Rasieren Sie die gesamte rechte Hintergliedmaße von der Hüfte bis zum Fuß mit einer elektrischen Haarschneidemaschine, während die Maus unter der Wirkung einer Isofluran-Anästhesie steht. Um eine Anästhesie bei Mäusen einzuleiten, verwenden Sie eine Mischung aus Isofluran (2-3%) und 100% Sauerstoff, die mit einer Flussrate von 1 l/min in einer 1-2 l Induktionskammer verabreicht wird. Entfernen Sie die Maus und vergewissern Sie sich, dass die Anästhesietiefe ausreichend ist, indem Sie die Zehen einklemmen, die nicht dazu führen sollten, dass sich die Maus bewegt.
HINWEIS: Diese Narkosetiefe hält ausreichend lange an, um die Rasur durchzuführen, ohne dass ein Anästhesie-Nasenkonus erforderlich ist. - Verwenden Sie Röntgenbildgebung mit einer Leistungseinstellung von 26 kV (800 mA), um Tibiabilder bei lebenden Mäusen unter Isofluran-induzierter Anästhesie aufzunehmen und die anfängliche Länge der Gliedmaßen aufzuzeichnen.
- Bevor Sie die Mäuse in den Röntgenschrank legen, induzieren Sie einen tiefgreifenden Anästhesiezustand mit einer Mischung aus Isofluran (2-3%) und 100% Sauerstoff, die mit einer Flussrate von 1 l/min in einer 1-2 l Induktionskammer verabreicht wird.
- Platzieren Sie jeweils drei anästhesierte Mäuse parallel auf dem Bauch in den Röntgenschrank in einer Regalhöhe, die es ermöglicht, ein Bild zu erhalten, das alle drei Mäuse umfasst. Spreizen Sie die Beine, damit die Schienbeinknochen nicht unter der Maus verdeckt werden. Um die Messgenauigkeit zu verbessern, positionieren Sie während der Bildgebung eine röntgendichte Skala in der Nähe der Maus (Abbildung 2A).
- Bringen Sie die vorbereiteten Mäuse in ihren Haltungskäfig mit der Muttermaus zurück, um auf nachfolgende chirurgische Eingriffe zu warten.
2. Vorbereitung von OP-Material und sterilem Arbeitsbereich
- Sterilisieren Sie die folgenden Gegenstände: 10-20 Mullpads, Applikatortupfer mit Wattespitze, Zahnbohrer (0,5 mm Durchmesser), Zahnstücke, Graefe-Pinzetten, gebogene hämostatische Mückenzangen, gebogene feine Scheren, Nadelhalter, Parodontalsonden und Zahnkleoid-Scheibenschnitzer.
- Sammeln Sie zusätzlich notwendige sterile Vorräte: eine injizierbare Suspension von Buprenorphin, 20 g Nadeln, 1 mL Spritzen, Handtuchabdeckungen, 5-0 ungefärbte, geflochtene, beschichtete Vicryl-Nähte, Povidon-Jod, phosphatgepufferte Kochsalzlösung, alkoholische antiseptische Pads, #15 Skalpelle, OP-Handschuhe, Umweltoberflächenbarriere-Tube Sox, Augenschmiermittel, 70% Ethanol-Spray. Schalten Sie einen Glasperlensterilisator für die zusätzliche Sterilisation von Gegenständen während der Operation und das elektrische Heizkissen unter einem sauberen Mauskäfig mit sterilisierter Einstreu ein.
- Reinigen und sterilisieren Sie den Fluoreszenz-Stereomikroskoptisch, die angrenzenden Oberflächen und das Ständer für chirurgische Instrumente mit 70 % Ethanol. Decken Sie diese Bereiche, die zum chirurgischen Arbeitsbereich werden, mit sterilen Handtuchabdeckungen ab.
- Montieren Sie das elektronische Hochgeschwindigkeits-Dentalbohrsystem. Verbinden Sie den elektronischen Fußschalter mit der Steuereinheit und decken Sie das Handstückkabel mit einem desinfizierten Oberflächensperrschlauch sox ab. Befestigen Sie den sterilen 0,5 mm runden Zahnbohrer. Schalten Sie den Controller ein und stellen Sie ihn auf ein Übersetzungsverhältnis von 1:1 und maximal 30.000 U/min ein.
- Befestigen Sie den flexiblen Isofluran-Maschinenschlauch, der mit dem Nasenkonus endet, der mit einem desinfizierten Oberflächenbarriererohr auf dem Fluoreszenz-Stereomikroskoptisch bedeckt ist, mit Klebeband.
- Schalten Sie das Fluoreszenzstereomikroskop und die Zusatzgeräte ein und öffnen Sie die Bilderfassungssoftware.
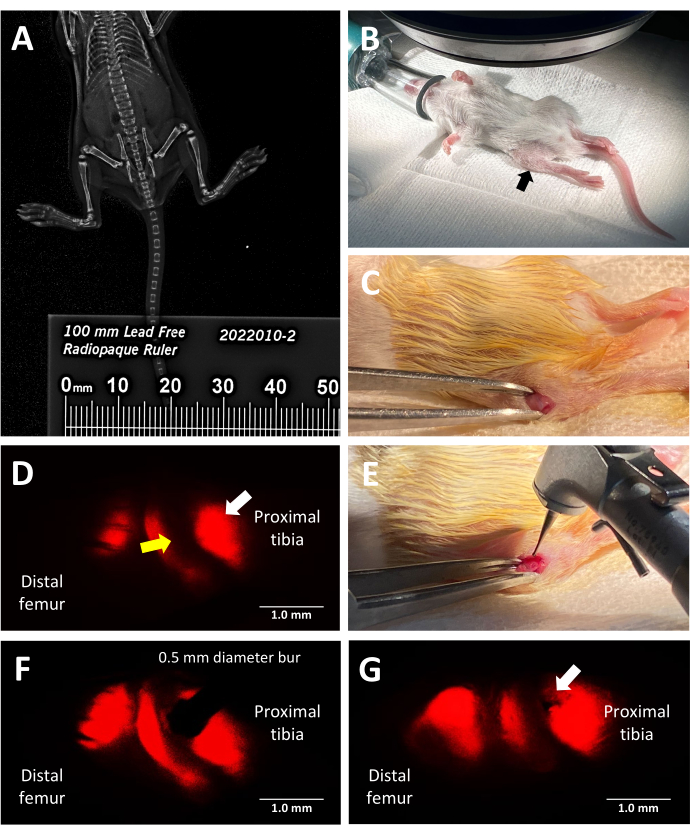
Abbildung 2: Wichtige Schritte des Verfahrens zur Verletzung der murinen Wachstumsfugen mit Trilinien-Fluoreszenz-Reportern. (A) Messung der Tibialänge mittels Faxitron-Röntgenbildgebung mit einem röntgendichten Lineal, das neben den Mäusen im Röntgenschrank platziert wurde. (B) Richtige Position einer anästhesierten Maus für die Operation unter einem Fluoreszenzstereomikroskop. Proximale Tibia, gekennzeichnet durch einen schwarzen Pfeil. (C) Ein Beispiel für einen Schnitt, der vorgenommen wurde, um Zugang zur Wachstumsfuge zu erhalten. (D) Fluoreszenz-Stereomikroskopie, die die hypertrophe Zone der Wachstumsfuge beleuchtet (weißer Pfeil). Die angrenzende proliferative Zone ist durch einen gelben Pfeil gekennzeichnet. (E) Helles Licht des Chirurgen, der den 0,5 mm Zahnbohrer gegen die Wachstumsfuge legt. (F) Die präzise Platzierung des Zahnbohrers wird durch Fluoreszenz-Stereomikroskopie in die hypertrophe Zone geführt. (G) Ein Beispiel für einen Salter-Harris-Typ-II-ähnlichen Wachstumsfugendefekt (weißer Pfeil). Maßstabsleisten = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Verfahren zur Verletzung der proximalen Tibia-Wachstumsfuge
- Betäuben Sie die Maus in der Isofluran-Anästhesiekammer, indem Sie die Isoflurankonzentration auf 2-3% und die Sauerstoffflussrate auf 1 l/min einstellen. Warten Sie auf die Induktion eines tiefgreifenden Narkosezustands, der durch einen Zehenkneiftest und die Beobachtung von Atemmustern überprüft wird.
- Verabreichen Sie die Hälfte der verschriebenen Dosis Buprenorphin subkutan unmittelbar nach der Entnahme der Maus aus der Kammer. Die Dosierung von Buprenorphin erfolgt gemäß dem genehmigten Tierprotokoll.
- Tragen Sie Augenschmiermittel auf, um die Augen der Maus während der Operation vor dem Austrocknen zu schützen, und übertragen Sie die Maus in Rückenlage auf den Nasenkegel der Isofluranmaschine auf dem Stereomikroskoptisch (Abbildung 2B). Stellen Sie den Anästhesiefluss durch den Nasenkonus auf 2% und den Sauerstofffluss auf 1 l/min ein.
- Desinfizieren Sie die rechte Hintergliedmaße, die Beckenregion, den vorderen Aspekt der linken Hintergliedmaße und den Schwanz nacheinander mit Povidon-Jod, gefolgt von 70% Ethanol.
- Überprüfen Sie eine anhaltend stabile Anästhesietiefe durch einen zusätzlichen Zehenquetschtest und die Beobachtung von Atemmustern vor Beginn der Operation.
- Bei hellem Licht wird mit einem Skalpell #15 ein Hautschnitt direkt unterhalb des Kniegelenks mit einer Anfangslänge von ca. 5 mm erstellt, um das proximale Ende der rechten Tibia freizulegen (Abbildung 2C). Verwenden Sie bei Bedarf eine Schere, um den Schnitt zu verlängern. Halten Sie das linke kontralaterale Schienbein unverletzt, so dass es als innere unverletzte Kontrolle dient.
- Führen Sie eine vertikale stumpfe Dissektion durch den darüber liegenden Muskel an der proximalen Tibia mit der Rückseite des Skalpells #15 durch und entfernen Sie das Weichgewebe, um die Wachstumsfuge frei zu sehen.
- Schalten Sie die Beleuchtung im Operationssaal aus und wählen Sie den richtigen Fluoreszenzkanal aus, um den gewünschten Bereich der Wachstumsfuge zu beleuchten. Für die Abbildung des fluoreszierenden Kollagens werden folgende Filtersets benötigt: Col 2 Cyan: ET436/20x (Anregung), ET480/40 m (Emission), Col 10 mCherry: ET577/20x (Anregung), ET640/40 m (Emission), Col 1 Topas: ET500/20x (Anregung), ET535/30 m (Emission). Positionieren Sie die Maus so, dass sie die proximale tibiale Wachstumsfuge beobachtet (Abbildung 2D). Stellen Sie die Hautöffnung etwas proximal und dann distal ein, um sicherzustellen, dass die Tibia-Wachstumsfuge und nicht die Femur-Wachstumsfuge sichtbar ist.
- Erzeugen Sie eine Salter-Harris-Typ-II-ähnliche Läsion, während Sie durch das Mikroskopokular schauen, indem Sie den 0,5-mm-Dentalbohrer parallel zur Tibiaachse in der Mitte der hypertrophen Wachstumsfugenzone positionieren und dabei einen lateralen Zugang verwenden (Abbildung 2E, F). Um einen Defekt reproduzierbar zu machen, der eine Salter-Harris-Typ-II-Läsion nachahmt, halten Sie die Extremität parallel zur Arbeitsfläche, damit der Bohrereintrittsweg nicht in die Epiphyse einbiegt. Üben Sie Druck auf das Bohrpedal aus, um die Bohrerdrehung einzuleiten, und drücken Sie den Bohrer vorsichtig in die Wachstumsfuge ein, bis er stoppt, bevor der Defekt tiefer als der Bohrerdurchmesser vordringt (Abbildung 2G).
HINWEIS: Ein zweites Paar Hände, das bei der Stabilisierung des Mausgliedes hilft, ist hilfreich. - Spülen Sie die Läsionsstelle mit einem Tropfen sterilem PBS, um alle Ablagerungen zu entfernen.
- Bestätigen Sie die Tiefe des Defekts bei 0,5 mm mit einer Parodontalsonde.
4. Verfahren nach der Verletzung und Schließung
- Für eine Time-Zero-Defect-Charakterisierung entnehmen Sie die verletzte Hintergliedmaße und kontrollieren Sie die Extremität vor dem Gewebeverschluss. Verfolgen Sie die Gewebeentnahme und die Vorbereitung für die anschließende Mikrocomputertomographie (microCT) und die kryohistologische Bildgebung in Abschnitt 6.
HINWEIS: Bei Experimenten, bei denen eine therapeutische Substanz in den Defekt der Wachstumsfuge implantiert wird, kann der Defekt selbst nur ein Stück Biomaterial aufnehmen, das ungefähr kugelförmig ist und einen Durchmesser von 0,5 mm oder ein Volumen von 0,082 mm3 (0,082 μL) hat. - Verwenden Sie eine Pinzette unter mikroskopischer Visualisierung, um das Biomaterial einzuführen, oder injizieren Sie ein flüssiges Therapeutikum in den Defekt innerhalb der Wachstumsfuge. Verwenden Sie ein größeres Volumen an Biomaterial oder injizierter Substanz, wenn das Studiendesign nicht erfordert, dass das Therapeutikum nur auf den Defekt beschränkt wird.
- Richten Sie die Hautränder vorsichtig neu aus und stellen Sie sicher, dass das implantierte Material, falls vorhanden, sicher an der Defektstelle verbleibt.
- Verwenden Sie unterbrochene Nahttechniken mit 5-0-Polyglykolsäurenähten, um den Hautschnitt effektiv zu versiegeln.
- Reinigen Sie die Bereiche außerhalb des chirurgischen Bereichs gründlich von Povidon-Jod-Rückständen mit Tupfern mit sterilem Wasser und achten Sie darauf, den Kontakt mit der Wunde und den eng umliegenden Bereichen zu vermeiden.
- Nehmen Sie die Maus aus dem Isofluran-Nasenkegel auf dem Mikroskoptisch in einen Auffangkäfig und positionieren Sie sie seitlich auf frischer Einstreu über einem Heizkissen.
- Beobachten Sie die Atemfrequenz der Maus etwa 5 Minuten lang genau und verabreichen Sie die verbleibende Buprenorphin-Dosis zur Analgesie, genau dann, wenn die Wirkung der Isofluran-Anästhesie nachlässt, was durch eine Erhöhung der Atemfrequenz angezeigt wird, jedoch vor dem Einsetzen der Mobilität. Halten Sie die Maus in einem isolierten Auffangkäfig, bis sie ihre vollen Gehfähigkeiten unter Beweis stellt, und vereinen Sie sie danach wieder mit ihrer Mutter und ihren Geschwistern.
- Führen Sie in den ersten 48 Stunden nach der Operation tägliche Inspektionen durch, gefolgt von wöchentlichen Beurteilungen bis zur Euthanasie. Konzentrieren Sie sich auf Anzeichen von Infektionen, die Wirksamkeit der Fortbewegung, den Zugang zu Lebensmitteln und die Integrität der Nähte.
- Entwöhnen Sie die Mäuse zur Standardzeit (d. h. im Alter von 3 Wochen).
5. Messungen der Gliedmaßenlänge
- Basierend auf den durch die experimentelle Hypothese und das Versuchsdesign bestimmten Zeitpunkten wird die Maus mit Isofluran anästhesiert und eine Röntgenbildgebung der gesamten Länge der verletzten und unverletzten Tibien durchgeführt, wie in Abbildung 2A gezeigt und in Abschnitt 1.4 beschrieben. Geeignete Orientierungspunkte für konsistente Messungen der Gliedmaßenlänge sind die Oberseite der Tibiaepiphyse und das distale Ende der Tibia am Tibiotalargelenk, wie in Abbildung 3 gezeigt.
HINWEIS: Die Bildgebung wird verwendet, um die Diskrepanzen zwischen der Gliedmaßenlänge und der Gliedmaßenlänge aufgrund der Verletzung sowie die Entwicklung der knöchernen Brücke innerhalb des Wachstumsfugengewebes in bestimmten postoperativen Intervallen zu beurteilen.
6. Gewebedissektion, Fixierung, Mikro-CT-Bildgebung und Einbettung
- Euthanasieren Sie die Maus durch CO2 -Erstickung, vorzugsweise unter Verwendung eines automatisierten CO2 - Induktionssystems mit einer Bestätigung des Todes durch eine alternative Methode, wie z. B. eine Zervixluxation.
- Isolieren Sie beide intakten Hintergliedmaßen und entfernen Sie Haut und Muskeln aus dem Knochen- und Kniekapselbereich zur Vorbereitung auf die histologische und mikroCT-Analyse.
- Bevor Sie die hinteren Gliedmaßen in das Fixiermittel stecken, entfernen Sie die Patella vorsichtig, indem Sie sie mit einer Mikropräparierschere abschneiden, um das Eindringen des Fixiermittels in die Kniehöhle zu erleichtern. Verwenden Sie eine 29-G-Insulinspritze, um kaltes 10% gepuffertes Formalin gründlich in allen Bereichen der Kniehöhle zu verteilen. Verstärken Sie die diaphysäre Region des Femurs und der Tibia, um den fixativen Zugang zum Knochenmarkraum zu verbessern. Halten Sie das Gelenkgewebe für 24-36 h bei 4 °C in einer vollständig ausgestreckten Position im Fixiermittel, indem Sie es mit Gaze an einen dünnen Dübel binden.
ACHTUNG: Formalin ist giftig und sollte in einem Abzug mit geeigneter persönlicher Schutzausrüstung gehandhabt werden.
- Bevor Sie die hinteren Gliedmaßen in das Fixiermittel stecken, entfernen Sie die Patella vorsichtig, indem Sie sie mit einer Mikropräparierschere abschneiden, um das Eindringen des Fixiermittels in die Kniehöhle zu erleichtern. Verwenden Sie eine 29-G-Insulinspritze, um kaltes 10% gepuffertes Formalin gründlich in allen Bereichen der Kniehöhle zu verteilen. Verstärken Sie die diaphysäre Region des Femurs und der Tibia, um den fixativen Zugang zum Knochenmarkraum zu verbessern. Halten Sie das Gelenkgewebe für 24-36 h bei 4 °C in einer vollständig ausgestreckten Position im Fixiermittel, indem Sie es mit Gaze an einen dünnen Dübel binden.
- Nach 24-48 Stunden Formalinfixierung bei 4 °C ist eine hochauflösende Röntgen-Mikro-CT von kontralateralen und verletzten Proben mittels Mikro-CT-Bildgebung durchzuführen, nachdem die Proben an PBS übertragen wurden, um die Entwicklung der knöchernen Brücke zu beurteilen. Verwenden Sie eine Voxelgröße von 6,0 μm, Abtastzeiten von 330.000 ms und Energieeinstellungen von 55.000 V bei einer Intensität von 145 μA.
- Nach der mikroCT-Bildgebung und weiteren 24 Stunden Formalinfixierung bei 4 °C spülen Sie die Proben 3 x 5 Minuten lang in 1x PBS und tauchen Sie die Proben dann 1 h lang in 10 % Saccharose in 1x PBS, 1 h lang 20 % Saccharose in 1x PBS und über Nacht 30 % Saccharose in 1 x PBS. Verwenden Sie eine mit Saccharoselösung gefüllte 29-G-Insulinspritze, um sicherzustellen, dass die Saccharoselösung alle Regionen der Kniehöhle durchdringt. In einen -80 °C-Gefrierschrank umfüllen, wenn nach dem Eintauchen der Saccharose über Nacht keine Einbettung erfolgt, um die Beibehaltung des GFP-Reporters und der enzymatischen Aktivität des Gewebes zu gewährleisten.
- Entfernen Sie vor dem Einbetten jegliches restliches Muskelgewebe aus der Gelenkregion. Äquilibrieren Sie die Probe über Nacht mit einem Kryo-Einbettungsmedium, um das Eindringen des Mediums in die Kniehöhle zu erleichtern.
- Sehen Sie sich die microCT-Bilder an, um vor der Einbettung zu bestimmen, wo sich der Defekt und die knöcherne Brücke befinden. Tragen Sie eine dünne Schicht des Kryo-Einbettungsmediums in ein Kryomold auf und platzieren Sie das präparierte und noch verbundene Schienbein/Oberschenkel/Gelenk so, dass der interessierende Bereich 90° zur Oberfläche des Einbettungsmediums zeigt.
HINWEIS: Diese Ausrichtung ermöglicht es dem Schnitt, die Queransicht des seitlich erzeugten Defekts zu erfassen. Wenn sich die knöcherne Brücke in der Nähe des Randes des Defekts befindet, wird durch diese Ausrichtung auch die Möglichkeit vermieden, dass der interessierende Bereich bei den ersten dickeren Schnitten durch das Gewebe übersehen wird. - Positionieren Sie die Kryoform auf Trockeneis, bis das Kryo-Einbettungsmedium erstarrt ist und die Probe gesichert ist. Füllen Sie die Kryoform weiter mit dem Medium, während Sie sie auf Trockeneis halten.
- Nachdem Sie die Probe gesichert haben, tauchen Sie das Kryomold in 2-Methyl-Butan, das mit Trockeneis gekühlt wurde, bis es vollständig gefroren ist. Nach dem Einfrieren überschüssiges 2-Methyl-Butan entfernen, die Kryoformen in Zellophan einwickeln und bei -20 °C oder -80 °C lagern.
HINWEIS: Für eine längere Lagerung von mehr als 1-2 Monaten in einem Kryo-Einbettungsmedium wird eine Temperatur von -80 °C empfohlen, um ein Austrocknen zu verhindern. Die bandgestützte Kryosektion und die Verklebung der Schnitte auf den Objektträgern sind zuvor beschrieben23.
7. Sequentielle Bildgebung, Färbung und Reimaging
- Implementierung eines sequentiellen Verfahrens der Bildgebung, Färbung und erneuten Bildgebung, um die Erkennung und Kolokalisierung mehrerer biologischer Signale innerhalb desselben Gewebeschnitts zu erleichtern, wie zuvor beschrieben23. Speziell für die Wachstumsfugenschnitte der dreifarbigen Kollagen-Reportermäuse werden die folgenden Schritte empfohlen. Dieser geordnete Ansatz gewährleistet eine umfassende Visualisierung sowohl molekularer Signale als auch struktureller Details.
- Erfassen Sie zunächst endogene Fluoreszenzsignale für die drei Kollagene in der ersten Bildgebungsrunde.
- Wenden Sie eine Calceinblau-Färbung und ein Bild für mineralisiertes Gewebe23 an, gefolgt von der Färbung und Bildgebung der enzymatischen Aktivität der tartratresistenten sauren Phosphatase (TRAP) (TRAP)23.
HINWEIS: Obwohl die Färbeergebnisse der enzymatischen Aktivität von TRAP hier nicht angezeigt werden, wird dieser Färbeschritt durchgeführt, da er für die Entfernung von Mineralien vor den im Abschnitt "Repräsentative Ergebnisse" dargestellten Färbeergebnissen von Safranin O/Fast Green unerlässlich ist. - Führen Sie eine 4',6-Diamidino-2-phenylindol (DAPI)-Kernfärbung wie unten beschrieben durch und dann ein Bild.
- Legen Sie Objektträger, die zuvor fotografiert wurden, in ein Coplin-Glas mit 1x PBS. Lassen Sie sie untergetaucht, bis sich die Deckgläser von den Objektträgern lösen. Nach dem Lösen die Deckgläser entfernen und gründlich trocknen.
- Tragen Sie DAPI Gegenfärbelösung auf die Deckgläser auf, wobei Sie eine 1:1.000-Verdünnung von DAPI in einer Mischung aus 50 % Glycerin und 1x PBS verwenden. Fahren Sie nach der Anwendung mit dem Imaging-Prozess fort.
- Zum Schluss tragen Sie Safranin O/Fast Green Färbung auf, um die Gewebearchitektur zu betonen und dann das Bild zu gestalten.
HINWEIS: Führen Sie diesen Schritt als letzten Schritt aus, um chromogene Bilder mit Fluoreszenzsignalen zu korrelieren.- Bereiten Sie Weigert's Eisen-Hämatoxylin-Lösungen vor. Bereiten Sie Lösung A vor, indem Sie 1 g Hämatoxylin in 100 ml 95%igem Ethanol auflösen, und Lösung B durch Kombinieren von 4 ml 29%iger Eisenchloridlösung, 95 ml deionisiertem Wasser und 1 ml konzentriertem HCl. Mischen Sie gleiche Teile von Lösung A und B, um die Weigert'sche Arbeitshämatoxylinlösung herzustellen, die etwa 4 Wochen lang stabil ist.
- Tauchen Sie die Objektträger 2 x 2 Minuten lang in entionisiertes Wasser, um sie zu hydratisieren.
- Tragen Sie die Hämatoxylin-Arbeitslösung von Weigert 5 Minuten lang auf.
- Objektträger 5 min in Leitungswasser waschen, danach 1 min kurz in entionisiertem Wasser.
- Mit 0,2 % Fast Green Lösung (0,2 g Fast Green FCF in 100 mL entionisiertem Wasser) für 2 min färben.
- 1 min kurz in 1%iger Essigsäure spülen.
- Mit 0,1 % Safranin O-Lösung (0,1 g Safranin O in 100 mL entionisiertem Wasser) 1 min lang färben.
- In entionisiertem Wasser spülen, bis eine visuell ausgewogene Farbe erreicht ist, ca. 5 Minuten.
- Montieren Sie Objektträger in 30 % Glycerin in entionisiertem Wasser (vermeiden Sie PBS) und fahren Sie sofort mit der Bildgebung fort, um eine Farbdiffusion aus dem Gewebe zu verhindern. Zur Akzentuierung der Ruhezonenzellen der Wachstumsfuge führen Sie das Bild mit einem Cy5-Filter durch: ET640/30x (EX), ET690/50 m (EM).
Ergebnisse
Dieses Protokoll verwendet fluoreszierende Reportermäuse mit Trilineage, um einen Defekt der lateralen Wachstumsfuge in der proximalen Tibia präzise zu induzieren, indem die inhärente rote Fluoreszenz, die von Typ-X-Kollagen emittiert wird, für die chirurgische Führung genutzt wird. Die Sicht, die der Chirurg hat, wenn er mit dem mCherry-Filterset durch das Stereomikroskop-Okular schaut, ist in Abbildung 2D dargestellt. Die native Typ-X-Fluoreszenz ermöglicht es dem Chirurgen, den Bohrer in der hypertrophen Zone zu platzieren und eine Verletzung zu erzeugen, die eine häufige Art von Wachstumsfugenverletzung nachahmt, die zu einer knöchernen Brücke führt (Abbildung 2F). Die Fluoreszenz unter dem roten Kanal ist am hellsten und wird daher für die Verwendung während der Bohrerplatzierung empfohlen. Alternativ könnte die Defektentstehung durch die Verwendung anderer Farben der nativen Fluoreszenz der dreifach transgenen Mäuse gesteuert werden, wenn das Ziel des Experiments darin besteht, Verletzungen in anderen Zonen der Wachstumsfuge als der hypertrophen Zone und der angrenzenden verkalkten Region zu untersuchen.
Die Bildung eines Salter-Harris-Typ-II-ähnlichen Defekts in der hypertrophen Zone der Wachstumsfuge und des angrenzenden unteren Knochengewebes unter Verwendung eines Zahnbohrers mit einem Durchmesser von 0,5 mm wurde durch MikroCT und kryohistologische Bildgebung der verletzten (Zeit 0) proximalen Tibias im Vergleich zu den unverletzten lateralen Kontrollen bei N = 3 Mäusen validiert (Abbildung 4). Die Defekte waren in den 3D-MikroCT-Bildern schwer zu erkennen, waren aber in den 2D-Querschnitten erkennbar (Abbildung 3A,B,E,F). Abbildung 3G zeigt die Verteilung von kollagenproduzierenden Knochenzellen vom Typ I (grüne Fluoreszenz), kollagenproduzierenden proliferativen Chondrozyten vom Typ II (Cyan-Fluoreszenz) und kollagenproduzierenden hypertrophen Chondrozyten vom Typ X. Auf dem Bild der verletzten Maus (Abbildung 4G) ist eine Störung der hypertrophen Zone, der provisorisch verkalkten Schicht und eines Teils des neu gebildeten Knochens relativ zur Kontrolle zu sehen, wobei die proliferative Zone nur leicht gestört ist. Die Safranin O/Fast Green-Färbung (Abbildung 4H) veranschaulicht am besten die Position des Defekts innerhalb der verletzten Wachstumsfuge, da alle Zellen deutlich sichtbar sind.
Die Röntgenanalyse gibt an lebenden Mäusen Aufschluss über die Auswirkungen dieser Art von Wachstumsfugenverletzung auf die Tibialänge und die Knochenbrückenbildung im Laufe der Zeit (Abbildung 3). Die vergleichende Bildgebung zwischen unverletzten (Abbildung 3A) und verletzten (Abbildung 3B) Tibien, die vor der Operation und 3 Wochen nach der Operation aufgenommen wurde, zeigt eine große Menge an Gliedmaßenwachstum, eine Ausdünnung der Wachstumsfugen und eine ausgeprägte undurchsichtige Region, die sich nach 3 Wochen im Bereich der verletzten Wachstumsfuge entwickelt hat. Diese Trübung innerhalb der Wachstumsfuge ist weder beim unverletzten Gegenstück noch bei den Mäusen vor der Operation vorhanden. Faxitron ist somit eine Möglichkeit, pathologische Veränderungen zu beobachten, die durch die Verletzung bei lebenden Mäusen hervorgerufen werden, wie z. B. die Bildung einer knöchernen Brücke und Veränderungen der Gliedmaßenlänge.
Die MikroCT-Bildgebung von präparierten Knochen bietet eine detaillierte Visualisierung der Knochenbrückenbildung innerhalb der verletzten Wachstumsfugen drei Wochen nach der Operation (Abbildung 5). Wie auf den Bildern von sechs verschiedenen verletzten Mäusen zu sehen ist, die in Abbildung 5 gezeigt sind, gibt es bei allen Mäusen eine konsistente Entwicklung der knöchernen Brücken. Unter Verwendung der Scanco Medical Software wurde das Volumen der knöchernen Brücke berechnet, indem jeder Abschnitt der proximalen tibialen Wachstumsfuge überprüft, der Bereich der knöchernen Brücke (Abbildung 5B) mit dem Auswahlwerkzeug abgegrenzt und dann jeder Schnittbereich über das gesamte Volumen der Wachstumsfuge integriert wurde, um das Gesamtvolumen24 zu erhalten. Das auf diese Weise berechnete knöcherne Brückenvolumen betrug 0,0761 mm3 ± 0,0246 (mittlere ± Standardabweichung, N = 6). Der Großteil der knöchernen Brücken bildet sich trotz des lateralen Zugangs nahe der Mitte der Wachstumsfuge aus, wodurch sowohl der äußere Rand als auch die Mitte der Wachstumsfuge verletzt werden. Dieses Phänomen ist darauf zurückzuführen, dass mesenchymale Stammzellen (MSCs) aus dem Knochenmark und nicht aus dem Perichondrium für die Bildung von Knochenbrücken verantwortlich sind25.
Bei diesen dreifarbigen transgenen Mäusen wird die kryohistologische Analyse der verletzten Wachstumsfuge durch die native Kollagenfluoreszenz angereichert (Abbildung 6). Sie zeigt das komplexe Zusammenspiel von Knochenzellen und Chondrozyten an der Verletzungsstelle. Die in Abbildung 6J,K gezeigten MicroCT-Bilder wurden dem Histologietechniker zur Verfügung gestellt, um die Einbettung und Schnittbestimmung zu leiten. Die kollagenproduzierenden Knochenzellen vom Typ I sind in Abbildung 6L,O,P (grüne Fluoreszenz) zu sehen, während die kollagenproduzierenden proliferativen Chondrozyten vom Typ II in Abbildung 6L,O,Q (cyanfarbene Fluoreszenz) zu sehen sind. Kollagen-produzierende hypertrophe Chondrozyten vom Typ X sind in Abbildung 6L,O,R (rote Fluoreszenz) zu sehen. Dieser mehrfarbige Fluoreszenzansatz ermöglicht eine detaillierte Untersuchung der postoperativen Chondrozytendifferenzierung im Bereich der knöchernen Brücke vor dem Hintergrund von mineralisiertem Gewebe. Die DAPI-Färbung wurde verwendet, um die Verteilung aller Zelltypen innerhalb des Wachstumsplattenbereichs zu bestätigen (Abbildung 6M). Die Safranin O/Fast Green-Färbung zeigt die kompositorische und strukturelle Organisation von Knorpel und Knochen innerhalb der verletzten Wachstumsfuge (Abbildung 6N). Die Bildgebung dieser gefärbten Schnitte unter einem Cy5-Filterset hellt die Ruhezonenzellen an der Grenzfläche zwischen Epiphysenknochen und Knorpel deutlich auf.
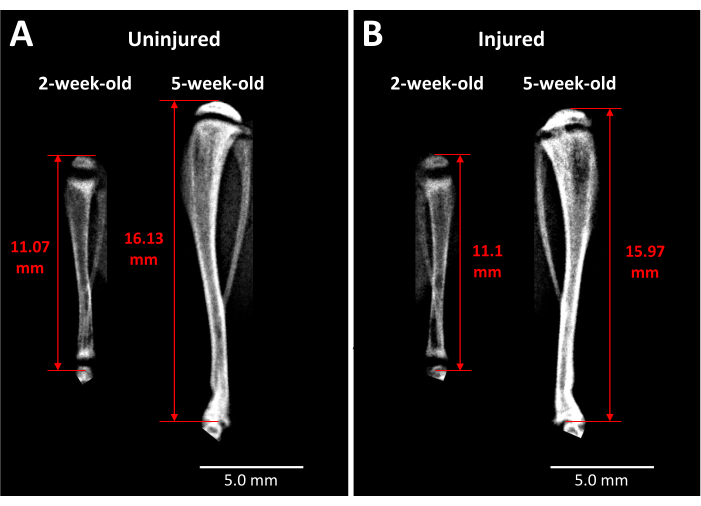
Abbildung 3: Röntgenbilder der kontralateralen Kontrolle und der verletzten Tibien der Maus. (A) Röntgenbilder der kontralateralen Kontrolltibia werden kurz vor der Verletzung aufgenommen, wenn die Mäuse 2 Wochen alt sind, und 3 Wochen nach der Operation, wenn die Mäuse 5 Wochen alt sind, um das Ausmaß des Wachstums zu zeigen, das in diesem Zeitraum stattfindet. (B) Verletzte Tibia von derselben Maus zu gleichen Zeitpunkten wie in (A). Die für die Messung der Tibialänge verwendeten Orientierungspunkte sind die Spitze des proximalen Tibiakopfes bis zum Ende der Tibia am Sprunggelenk (rote Doppelpfeile). Die undurchsichtige knöcherne Brücke ist nach 5 Wochen in der verletzten proximalen Tibia-Wachstumsfuge sichtbar. Maßstabsstäbe = 5,00 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
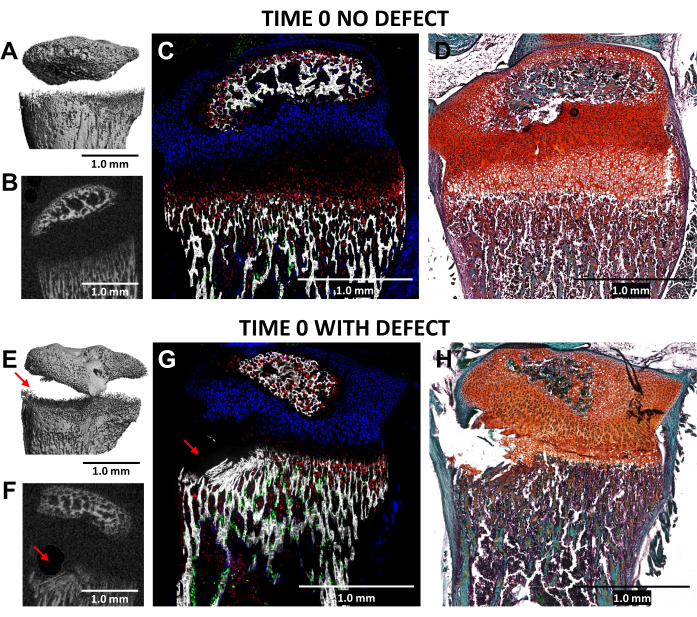
Abbildung 4: MicroCT und histologische Bilder der kontralateralen Kontrolle zum Zeitpunkt Null und der verletzten proximalen Tibiae der Maus. (A,E) und (B,F) zeigen 3D- und transversale 2D-MikroCT-Ansichten, wobei der Defekt durch rote Pfeile in (E) und (F) gekennzeichnet ist. (C,G) Komposit-zusammengeführte kryohistologische Bilder, die drei angeborene Fluoreszenzschichten mit einer mineralisierten Gewebeschicht verschmelzen. Grüne Blutkörperchen (Col3.6GFPtpz) sind die kollagenproduzierenden Knochenzellen vom Typ I, cyanblau gefärbte Zellen (Col2A1GFPcyan) sind kollagenproduzierende proliferative Chondrozyten vom Typ II und rote Blutkörperchen (Col10A1RFPchry) sind kollagenproduzierende hypertrophe Chondrozyten vom Typ X. (D,H) Safranin O/Fast Green-Färbung aus der gleichen Region wie (C) und (G). Maßstabsstäbe = 1,0 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
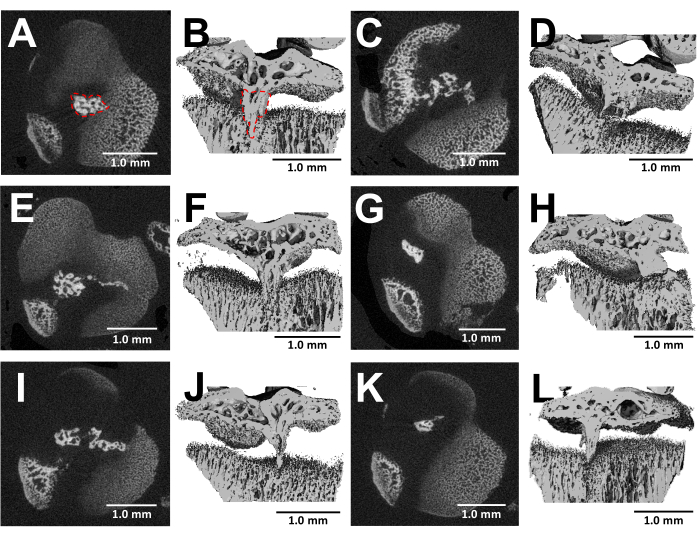
Abbildung 5: MicroCT-Bilder von knöchernen Brücken, die nach diesem Protokoll gebildet wurden. (A,C,E,G,I,K) Querschnitte der proximalen tibialen Wachstumsfuge von sechs verschiedenen Mäusen 3 Wochen nach der Entstehung des Bohrerdefekts. Knöcherne Brücke, die durch eine rot gestrichelte Linie in (A) umrandet ist. (B,D,F,H,J,L) 3D-Rekonstruktionen mit weggeschnittener Längsebene. Knöcherne Brücke, die in (B) durch eine rot gestrichelte Linie umrandet ist. Maßstabsstäbe = 1,0 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
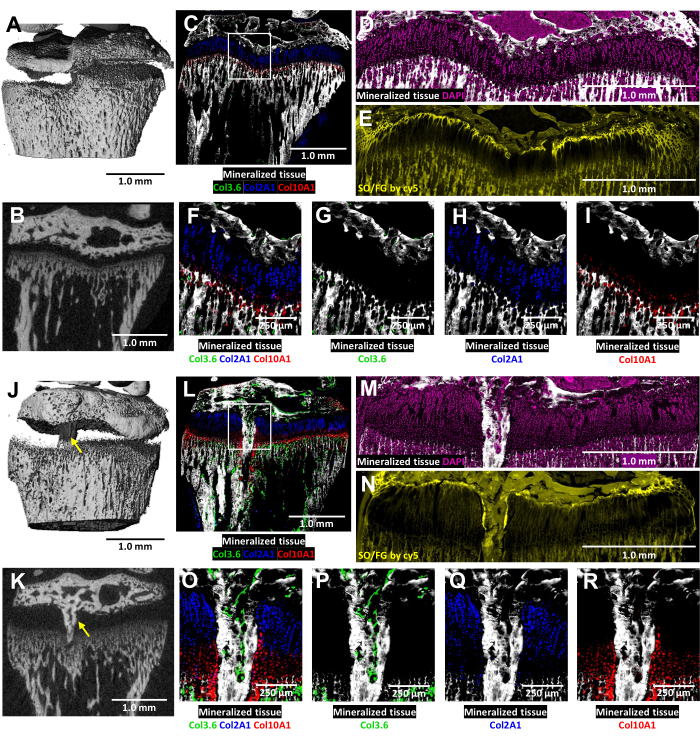
Abbildung 6: MikroCT und histologische Bilder der kontralateralen Kontrolle und der verletzten proximalen Tibia der Maus mit Knochenbrückenbildung. (A,J) und (B,K) zeigen 3D- und transversale 2D-MikroCT-Ansichten, wobei die knöcherne Brücke durch gelbe Pfeile in (J) und (K) gekennzeichnet ist. (C,L) Komposit-zusammengeführte kryohistologische Bilder, die drei angeborene Fluoreszenzschichten mit einer mineralisierten Gewebeschicht verschmelzen. Grüne Blutkörperchen (Col3.6GFPtpz) sind die kollagenproduzierenden Knochenzellen vom Typ I, cyanblau gefärbte Zellen (Col2A1GFPcyan) sind kollagenproduzierende proliferative Chondrozyten vom Typ II und rote Blutkörperchen (Col10A1RFPchry) sind kollagenproduzierende hypertrophe Chondrozyten vom Typ X. Das weiße Feld zeigt die höhere Vergrößerung an, die in den Feldern F und O angezeigt wird. (D,M) Das mineralisierte Gewebe und die DAPI-Färbung im Bereich der Wachstumsfuge der Panels C und L. (E,N) Safranin O/Fast Green-Färbung der gleichen Region wie (D) und (M), gescannt mit cy5-Fluoreszenz. (F,O) Eine höhere Vergrößerung des Bereichs der Wachstumsfuge im zusammengeführten Bild der Tafeln C und L. (G-I,P-R) Einzelne Kanäle der nativen Fluoreszenz sind mit einem mineralisierten Gewebehintergrund dargestellt. Maßstabsleisten = 1,0 mm (A-E) und (J-N), = 250 μm in (F-I) und (O-R). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der innovative Einsatz von dreifarbigen Kollagen-Reportermäusen ermöglicht die Erzeugung von Wachstumsplattendefekten mit einer vorgegebenen Größe und Lokalisation, wodurch die Genauigkeit von experimentellen Mausmodellen für Wachstumsplattenverletzungen erheblich verbessert wird. Angesichts der geringen Größe der 2 Wochen alten Mäuse ist es wichtig, einen kleinen 0,5-mm-Bohrer zu verwenden, um die Verletzung zu erzeugen, um eine Schwächung der Extremität und eine Fraktur in voller Dicke zu vermeiden. Der Chirurg muss auch bei der Erstellung des Defekts gerade genug Druck ausüben, um zu vermeiden, dass sich aus dem gleichen Grund zu tief in den Knochen bohrt. Die Verwendung der Perioprobe ist entscheidend für die Bestätigung einer konstanten Verletzungstiefe.
Wie bei jeder Operation ist es wichtig, eine ausreichende Narkosetiefe zu bestätigen, die durch ein gelegentliches Einklemmen der Zehen bestätigt wird, und die Sterilität bleibt durchgehend erhalten. Ein weiterer chirurgischer Punkt von Bedeutung ist, dass die stumpfe Dissektion mit einem Schnitzer beschrieben wurde, da sie eine Beschädigung des Weichgewebes vermeidet und dazu beiträgt, dass die Mäuse sofort nach der Genesung aus der Narkose gehfähig sind, um die Muttermaus für Ernährung und Komfort zu erreichen. Nach unserer Erfahrung sind die mit Nähten verschlossenen Wunden erfolgreich verschlossen geblieben und Wundclips sind nicht erforderlich. Eine Operation an Mäusen im Alter von 2 Wochen wird empfohlen, um das kleine Kind, bei dem Wachstumsfugenfrakturen auftreten, am besten nachzuahmen. Ein Nachteil dieses Protokolls besteht darin, dass die Verwendung dieses Mausmodells angesichts der Unvorhersehbarkeit der Geburt die kurzfristige Verfügbarkeit des Chirurgen erfordert.
In Bezug auf die Positionierung des Bohrers zur Erzeugung des Defekts beschreibt das Protokoll die Erzeugung der Verletzung unter Verwendung eines mCherry/Texas-Rotfiltersets, das die hypertrophe Zone innerhalb der Wachstumsfuge aufgrund der Helligkeit der Kollagen-X-Fluoreszenz beleuchtet. Um sicherzustellen, dass die Verletzung innerhalb der Tibia-Wachstumsfuge entsteht, ist es von Vorteil, die Weichteilöffnung leicht nach links und rechts zu bewegen, um zu bestätigen, dass die proximale Tibia-Wachstumsfuge und nicht der Femur sichtbar ist. Das Umschalten zwischen den Filtersetkanälen zur Beleuchtung der proliferativen Chondrozytenzone oder der angrenzenden Knochenabschnitte ist nützlich, um die genaue Platzierung relativ zur Position der proliferativen Zone und der angrenzenden Knochenabschnitte zu bestätigen.
Während bei den lebenden Mäusen die proliferative Chondrozytenzone sowie der epiphysäre und metaphysäre Knochen unter Fluoreszenzmikroskopie unterschieden werden können, wird der reale Wert der Kollagenreporter Typ II und Typ I bei der histologischen Analyse der Wachstumsfuge erkannt. Angesichts der wässrigen Natur kryohistologischer Prozesse sind herkömmliche chromogene Farbstofffällungsprotokolle ungeeignet, da die Farbe mit der Fluoreszenzbildgebung möglicherweise durch Dehydratisierungsschritte fehlausgerichtet wird. Obwohl das wässrige Protokoll Färbemuster liefert, die denen in Paraffinschnitten ähneln, ist eine schnelle Bildgebung nach der Färbung unerlässlich, um eine Farbstoffdiffusion aus dem Gewebe zu verhindern. Die Verwendung von 30 % Glycerin in destilliertem Wasser als Einbettmedium kann diese Diffusion verlangsamen und ermöglicht eine mehrfache chromogene Färbung auf demselben Abschnitt, einschließlich Knorpel mit Safranin O/Fast Green.
Der endochondrale Ossifikationsprozess ist deutlich sichtbar, wobei rote Chondrozyten die sich entwickelnde knöcherne Brücke auskleiden (Abbildung 6). Der zusätzliche Einsatz immunhistochemischer Techniken, für die viele murine Antikörper zur Verfügung stehen, könnte die mechanistischen Studien, die an diesen transgenen Mäusen durchgeführt werden, weiter verbessern. Insgesamt bietet die Kombination von Faxitron-, MikroCT- und kryo-histologischen Bildgebungsverfahren in diesem transgenen Mausmodell ein umfassendes Verständnis der makroskopischen und mikroskopischen Veränderungen, die als Reaktion auf Wachstumsfugenverletzungen auftreten, und ebnet den Weg für zukünftige therapeutische Interventionen zur Milderung solcher unerwünschten Ergebnisse. Weitere genetische Manipulationen an diesen transgenen Mäusen könnten durchgeführt werden, um die Herkunft der Zellen zu verstehen, die zeitlich und räumlich an der Heilung beteiligt sind. Experimente an Mäusen mit zusätzlichen Modifikationen würden die Untersuchung von Knorpelerkrankungen wie dem Osteochondrom ermöglichen - einer Überwucherung von Knorpel und Knochen in der Nähe der Wachstumsfuge.
Die Konsistenz unseres Modells zeigt sich in der reproduzierbaren Bildung von knöchernen Brücken bei allen Mäusen, ohne dass Mäuse aus der Gruppe aufgrund einer Gelenkknorpelverletzung verworfen werden mussten. Dies ist eine Verbesserung gegenüber früheren Modellen, die sich der Wachstumsfuge von einem kortikalen Fenster unterhalb der Wachstumsfuge näherten und ein scharfes Werkzeug oder einen Bohrer nach oben in Richtung der Wachstumsfuge abwinkelten und gelegentlich in den Gelenkknorpel hineinragten. Eine zusätzliche Verletzung des Gelenkknorpels ahmt die bei Kindern häufig auftretenden Verletzungen der Wachstumsfuge nicht nach. Die präzisere Schädigung dieses Tiermodells reduziert die Anzahl der pro Versuch benötigten Mäuse, was eine weitere Verbesserung darstellt. Die Verwendung transgener Mäuse ermöglicht es dem Forscher, die Verletzung auf Teilabschnitte der Wachstumsfuge zu fokussieren, wie z. B. den hypertrophen/provisorisch verkalkten Bereich oder den Bereich der Epiphyse/Ruhezone/proliferativen Zone, ohne den Gelenkknorpel zu beeinträchtigen. Eine Einschränkung dieses Modells ist jedoch die Variabilität des Knochenbrückenvolumens, die sich bei verletzten Tieren um bis zu 30% unterscheiden kann. Um einen klinisch signifikanten Effekt auf die Knochenbrückenbildung nachweisen zu können, ist daher immer noch eine große Anzahl von Tieren erforderlich, um eine statistische Relevanz zu erreichen.
Zu den Vorteilen eines Mausmodells, wie es hier beschrieben wird, im Vergleich zu zuvor veröffentlichten Ratten- oder Kaninchen-Wachstumsfugen-Verletzungsmodellen 7,9,10,14 gehören eine geringere Anzahl verwendeter Tiere, Kostenreduzierung, eine effiziente Replikatgröße aufgrund reproduzierbarer Knochenbalkenbildung, ein kürzerer Studienzeitraum und eine präzisere Verletzungsplatzierung aufgrund der Live-Bildgebung der dreifach transgenen Mäuse. Obwohl nicht im Detail diskutiert, kann dieses Mausmodell verwendet werden, um Tissue-Engineering-Implantate oder Biomaterialien zu testen, die Wachstumsfaktoren liefern. Eine bemerkenswerte Einschränkung dieser murinen Methode besteht darin, dass die Größe eines Implantats, das zur Verabreichung von therapeutischen Medikamenten oder Zellen verwendet wird, auf das Defektvolumen von etwa einer Kugel mit einem Durchmesser von 0,5 mm begrenzt ist. Nur größere Tiermodelle können das Volumen an Testmaterial aufnehmen, das bei menschlichen Patienten verwendet würde. Der Bohrerdefekt, der in diesem Protokoll erzeugt wird, hat nicht die gleiche Geometrie wie eine dünne Fraktur und unterscheidet sich daher von tatsächlichen menschlichen Verletzungen. Nichtsdestotrotz sind die Vorteile dieses Mausmodells vielfältig, und der laterale Zugang vermeidet eine Beschädigung des Gelenkknorpels, die auftreten würde, wenn man sich blind über oder unter der Wachstumsfuge in einer Linie mit der Tibia-Längsachse nähert. Diese Methodik stellt einen wesentlichen Sprung in der Erforschung von Wachstumsfugenverletzungen dar und bietet eine detaillierte und reproduzierbare Methode zur Untersuchung der Pathologie und zur Evaluierung neuer therapeutischer Strategien.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss der National Institutes of Health, des National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) 1R21AR079153 und einen Zuschuss des University of Connecticut Research Enhancement Program (REP) unterstützt. Die Autoren danken Renata Rydzik von der MicroCT Imaging Core Facility der University of Connecticut für die Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
Referenzen
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten