Method Article
用于研究生长板损伤的 Tricolor 转基因小鼠模型
摘要
该协议描述了一种改进的青少年骨骼生长板损伤小鼠模型。使用具有 I、II 和 X 型胶原(与生长板的三个不同基质相关的初级基质)的三系荧光报告基因的转基因小鼠,损伤放置由显微镜下的天然荧光引导。
摘要
儿童骨骼中的软骨生长板可以延长肢体,但相对于骨骼来说很脆弱,当骨骼超负荷时,他们很容易骨折。需要对严重骨折的生长板进行更好的治疗,因为对损伤的反应是骨桥过早地融合生长板,导致发育迟缓和/或弯曲的四肢。生长板损伤的小鼠模型有利于机制研究,但具有挑战性,因为很难可视化和精确损伤年轻小鼠的小生长板。我们在这里描述了一种改进的生长板损伤模型,该模型使用具有针对 I、II 和 X 型胶原的三系荧光报告基因的转基因小鼠。
这些小鼠显示出与生长板的三个初级基质相关的天然荧光。在荧光立体显微镜引导下,在实时成像过程中,使用生长板的肥大部分作为参考,使用车针可重复地产生类似于 Salter-Harris II 型损伤的生长板损伤。天然荧光的冰冻组织学分析简化了细胞对损伤反应的评估。该方法代表了生长板损伤研究的重大飞跃,为研究病理学和评估新的治疗策略提供了一种详细且可重复的方法。
引言
骨生长板在儿童和青少年时期长骨的纵向生长中起着关键作用1。生长板位于长骨的末端,由多个区域组成,其中软骨细胞是负责产生和维持这个动态生长区域的关键细胞成分。生长板的软骨内骨化通过软骨细胞增殖、肥大、细胞凋亡、血管侵袭、骨祖细胞募集以及最后的骨形成2 的连续进展来延长和扩大骨骼。由于生长板比骨骼相对较软,因此在运动或其他活动中骨骼超负荷时,它极易发生骨折。Salter-Harris 分类概述了五种不同类型的生长板损伤3.通过生长板的肥大区和邻近的下骨组织的 II 型骨折是最普遍的4。骨桥通常是由于肥厚区或相邻骨骼的损伤而形成的,并导致相邻长骨部分过早融合5。骨桥阻碍了生长板的正常扩张。目前,没有可用于骨桥形成的预防性治疗方法,有些治疗方法未经治疗,具体取决于患者的年龄和骨桥的大小和位置6。当肢体畸形严重时,手术选择包括切除,然后植入脂肪或硅橡胶等插入材料或矫正截骨术和骨延长手术;然而,一座骨桥仍可能改革6.需要更多的研究来防止骨桥形成并改善骨生长板损伤儿童的预后。
已经建立了几种动物模型来探索潜在机制并开发新策略来防止受伤后生长板的骨桥损伤 7,8,9,10,11,12。这些动物模型通常将胫骨近端生长板和股骨远端生长板作为主要损伤部位,因为这通常是发生人类损伤的地方。动物骨骼缺损是通过类似于实际骨折途径的横向入路或从生长板上方或下方进入导致生长板中中央钻孔的。在先前报道的大鼠模型中,通过胫骨中轴的皮质窗口插入牙刺并向上穿过骨髓朝膝关节方向钻孔以集中损伤生长板来产生生长板缺损 7,13。或者,最近的小鼠模型使用带有小口径针头的横向方法在生长板8 中创建平面针迹。在广泛使用的大鼠模型中,缺损是通过钻穿髁突之间的关节软骨在股骨远端的生长板中产生的 9,14。在兔子和绵羊等大型动物中,生长板缺损是通过钻孔或切开生长板或从下方接近并产生中央缺损而使生长板的边缘保持不变,直接在胫骨近端和股骨远端横向诱导的 10,11,12,15。
生长板损伤的小鼠模型有利于可以用转基因小鼠完成的机制研究,例如干细胞谱系追踪研究8。然而,小鼠或大鼠动物模型的一个重大挑战是对生长板的特定亚区域实现一致和精确的损伤。生长板和相邻骨骼的特定区域的损伤需要模拟 Salter-Harris 分类描述的临床相关骨折路径之一。迄今为止,啮齿动物模型面临的挑战主要是由于在手术造成损伤期间缺乏识别生长板基质的视觉手段。该方案描述了一种精细的技术,通过利用表达胶原蛋白 I、II 和 X 荧光报告基因的三重转基因小鼠,在小鼠生长板的目标基质中产生生长板缺陷 16,17,18。这些胶原蛋白在生长板的每个初级区域中的不同颜色的荧光允许在手术创建生长板损伤期间在荧光立体显微镜下对生长板的各个部分进行视觉区分。使用这些转基因小鼠可以在与受伤儿童相当的发育阶段的年轻小鼠中实现前所未有的损伤准确性。
研究方案
该研究是按照机构指南进行的。在开始工作之前,所有动物程序均已获得康涅狄格大学健康中心机构动物护理和使用委员会 (IACUC) 的批准。 图 1 示意图中描述了该协议的概述。

图 1:三色胶原报告小鼠生长板损伤方案概述。请单击此处查看此图的较大版本。
1. 小鼠饲养和手术准备
- 按照标准育种程序培育表达 Col1a1-GFPTpz、Col2a1-CFP 和 Col10a1-mCherry16、17、18、19、20、21 的三色转基因胶原报告小鼠,以获得 2 周龄(± 1 天)的手术幼仔。通过在荧光显微镜下对尾尖片段进行基因分型来验证三重转基因表达。仅使用对所有三种颜色均呈阳性的小鼠,以在随后的组织学分析中最大限度地发挥报告基因系统的优势。
注意:选择这个 2 周大(± 1 天)的年龄是因为他们的骨骼生长板处于与人类青少年22 相似的发育阶段。该协议适用于小鼠的两性。 - 在手术当天或前一天,用酒精消毒垫对耳朵和耳打孔器进行消毒后,用打耳器唯一识别用于手术的每只小鼠,称量每只鼠标,并记录该值。
- 当鼠标处于异氟醚麻醉作用下时,用电剪刀从臀部到脚部剃掉整个右后肢。为了在小鼠中诱导麻醉,使用异氟醚 (2-3%) 和 100% 氧气的混合物,在 1-2 L 诱导室内以 1 L/min 的流速给药。取下鼠标并确认麻醉深度足够,捏住脚趾,不应导致鼠标移动。
注意:这种麻醉深度将持续足够长的时间,以便在不需要麻醉鼻锥的情况下进行剃须。 - 采用功率设置为 26 kV (800 mA) 的 X 射线成像,在异氟醚诱导的麻醉下捕获活小鼠的胫骨图像,以记录初始肢体长度。
- 在将小鼠放入 X 射线柜之前,使用异氟醚 (2-3%) 和 100% 氧气的混合物诱导深度麻醉状态,在 1-2 L 诱导室内以 1 L/min 的流速施用。
- 一次将三只麻醉的小鼠平行放在 X 射线柜中的腹部,以架子的高度获得一张图像,其中包括所有三只小鼠。张开腿部,使胫骨不会在鼠标下被遮挡。为了提高测量精度,在成像过程中将不透射线的刻度放在鼠标附近(图 2A)。
- 将准备好的小鼠与母鼠一起放回它们的笼子中,以等待后续的外科手术。
2. 准备手术用品和无菌工作区
- 对以下物品进行消毒:10-20 个纱布垫、棉签、牙针(直径 0.5 毫米)、牙科手机、Graefe 镊子、弯曲的蚊子止血钳、弯曲的细剪刀、针架、牙周探针和牙科 cleoid discoid 雕刻机。
- 收集额外的必要无菌用品:丁丙诺啡注射混悬液、20 G 针头、1 mL 注射器、毛巾布、5-0 未染色、编织、涂层、vicryl 缝合线、聚维酮碘、磷酸盐缓冲盐水、酒精消毒垫、#15 手术刀、手术手套、环境表面屏障管 Sox、眼润滑剂、70% 乙醇喷雾剂。打开玻璃珠消毒器,在手术期间对物品进行额外消毒,并在带有消毒床上用品的干净鼠标笼下打开电加热垫。
- 使用 70% 乙醇清洁和消毒荧光立体显微镜载物台、相邻表面和手术器械支架。用无菌毛巾覆盖这些将成为手术工作空间的区域。
- 组装电子高速牙科钻孔系统。将电子脚踏控制器连接到控制单元,并用消毒过的表面阻隔管覆盖手机线。安装无菌 0.5 mm 圆形牙科车针。打开控制器并将其设置为1:1的驱动比和最大30,000 rpm。
- 用胶带固定柔性异氟醚机软管,该软管的末端是荧光立体显微镜载物台上用消毒过的表面屏障管覆盖的鼻锥。
- 打开荧光立体显微镜和辅助设备,打开图像采集软件。
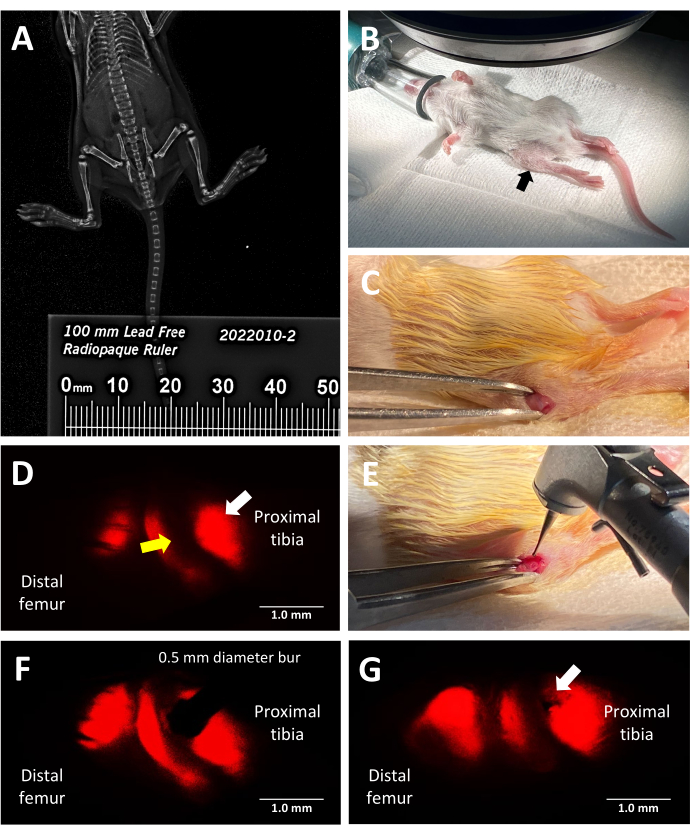
图 2:三系荧光报告小鼠生长板损伤程序的关键步骤。 (A) 使用放置在 X 射线柜中小鼠旁边的不透射线尺,通过传真机 X 射线成像测量胫骨长度。(B) 在荧光立体显微镜下进行手术的麻醉小鼠的正确位置。胫骨近端由黑色箭头指示。(C) 为进入生长板而制作的切口示例。(D) 荧光立体显微镜照亮生长板的肥大区(白色箭头)。相邻的增殖区由黄色箭头表示。(E) 外科医生将 0.5 毫米牙科车针靠在生长板上的强光照明。(F) 通过荧光立体显微镜将牙车针精确放置在肥大区。(G) Salter-Harris II 型样生长板缺损的示例(白色箭头)。比例尺 = 1 毫米。 请单击此处查看此图的较大版本。
3. 胫骨近端生长板损伤手术
- 在异氟醚麻醉室中麻醉小鼠,将异氟醚浓度调节至 2-3%,氧流速至 1 L/min。等待深度麻醉状态的诱导,通过脚趾捏试验和呼吸模式观察来验证。
- 将小鼠从腔室中取出后立即皮下注射规定剂量的一半丁丙诺啡。丁丙诺啡的剂量符合批准的动物方案。
- 涂抹眼部润滑剂以保护小鼠的眼睛在手术过程中不会干燥,并将仰卧位的小鼠转移到立体显微镜载物台上的异氟醚机器鼻锥上(图 2B)。将流经鼻锥的麻醉流量调节至 2%,将氧气流速调节至 1 L/min。
- 依次用聚维酮碘和 70% 乙醇对右后肢、骨盆区域、左后肢前部和尾部进行消毒。
- 在手术开始前通过额外的脚趾捏试验和观察呼吸模式来验证持续稳定的麻醉深度。
- 在强光照射下,使用 #15 手术刀在膝关节正下方的皮肤上切开一个初始长度约为 5 毫米的切口,露出右胫骨的近端(图 2C)。如有必要,使用剪刀延长切口。保持左侧对侧胫骨未受伤,使其作为内部未受伤的对照。
- 使用 #15 手术刀的背面对胫骨近端的上覆肌肉进行垂直钝解剖,去除软组织以清晰地暴露生长板。
- 关闭手术室的灯并选择正确的荧光通道以照亮生长板的所需区域。对每种荧光胶原进行成像所需的滤光片组为 Col 2 青色:ET436/20x(激发)、ET480/40 m(发射)、Col 10 mCherry:ET577/20x(激发)、ET640/40 m(发射)、Col 1 黄玉:ET500/20x(激发)、ET535/30 m(发射)。放置鼠标以观察胫骨近端生长板(图 2D)。稍微调整近端的皮肤开口,然后调整远端,以确保可以看到胫骨生长板而不是股骨生长板。
- 通过将 0.5 毫米牙钻车针平行于肥大生长板区中间的胫骨轴定位,在通过显微镜目镜观察时创建一个 Salter-Harris II 型样病变,采用横向方法(图 2E,F)。为了可重复地制造类似于 Salter-Harris II 型病变的缺损,请保持肢体与工作表面平行,以便车刺入口通路不会倾斜到骨骺中。在钻头踏板上施加压力以启动车针旋转,然后轻轻地将车针压入生长板,在缺陷超过车针直径之前停止(图 2G)。
注意:第二双手协助稳定鼠标肢体是有帮助的。 - 用一滴无菌 PBS 冲洗病变部位以去除任何碎屑。
- 使用牙周探针确认 0.5 毫米处的缺损深度。
4. 伤后程序和闭合
- 对于时间零缺陷表征,在组织闭合之前收获受伤的后肢和对照肢。遵循第 6 节的组织收获和后续显微计算机断层扫描 (microCT) 和冷冻组织学成像的准备工作。
注:对于涉及在生长板缺损中植入治疗物质的实验,缺损本身只能容纳一块大致呈球形且直径为 0.5 mm 或 0.082 mm3 (0.082 μL) 体积的生物材料。 - 在显微镜下利用镊子插入生物材料或将液体治疗剂注射到生长板内的缺损处。如果研究设计不要求将治疗仅限于缺陷,则使用更大体积的生物材料或注射物质。
- 小心地重新对齐皮肤边缘,确保植入的材料(如果有)安全地保持在缺损部位内。
- 采用 5-0 聚乙醇酸缝合线的间断缝合技术,有效密封皮肤切口。
- 使用蘸有无菌水的棉签彻底清洁手术区域以外的聚维酮碘残留物,小心避免接触伤口和周围区域。
- 将鼠标从显微镜载物台上的异氟醚鼻锥中取出到恢复笼中,将其横向放置在加热垫上的新鲜床上用品上。
- 密切观察小鼠的呼吸频率约 5 分钟,在异氟醚麻醉作用减弱时施用剩余的丁丙诺啡剂量进行镇痛,表现为呼吸频率增加,但在活动开始之前。将鼠标放在隔离的恢复笼中,直到它表现出完整的行走能力,然后与它的母亲和兄弟姐妹团聚。
- 对手术后最初的 48 小时进行每日检查,然后每周进行评估,直到安乐死。关注感染迹象、运动效率、食物的可及性和缝合线的完整性。
- 在标准时间(即 3 周龄)给小鼠断奶。
5. 肢体长度测量
- 根据实验假设和设计确定的时间点,用异氟醚麻醉小鼠,并对受伤和未受伤的胫骨的全长进行 X 射线成像,如图 2A 所示,并在第 1.4 节中描述。进行一致肢体长度测量的合适标志包括胫骨骨骺的顶部和胫距关节处的胫骨远端,如图 3 所示。
注意:成像用于评估由于受伤引起的肢体长度和肢体长度差异,以及在特定的术后间隔内生长板组织内骨桥的发育。
6. 组织解剖、固定、microCT 成像和包埋
- 通过 CO2 窒息对小鼠实施安乐死,最好使用自动 CO2 诱导系统,并通过替代方法(如颈椎脱位)确认死亡。
- 分离两个完整的后肢,并从骨骼和膝关节囊区域去除皮肤和肌肉,为组织学和 microCT 分析做准备。
- 在将后肢放入固定剂之前,使用显微解剖剪刀小心地切除髌骨,以促进固定剂渗透到膝腔中。使用 29 G 胰岛素注射器将 10% 缓冲的冷福尔马林彻底分布在膝腔的所有区域内。严重处理股骨和胫骨的骨干区域,以改善对骨髓间隙的固定通路。用纱布将关节组织在固定剂内在固定剂内完全伸展的位置保持24-36小时,方法是用纱布将其绑在薄销钉上。
注意:福尔马林有毒,应在通风橱中处理,同时穿戴适当的个人防护设备。
- 在将后肢放入固定剂之前,使用显微解剖剪刀小心地切除髌骨,以促进固定剂渗透到膝腔中。使用 29 G 胰岛素注射器将 10% 缓冲的冷福尔马林彻底分布在膝腔的所有区域内。严重处理股骨和胫骨的骨干区域,以改善对骨髓间隙的固定通路。用纱布将关节组织在固定剂内在固定剂内完全伸展的位置保持24-36小时,方法是用纱布将其绑在薄销钉上。
- 在 4 °C 下福尔马林固定 24-48 小时后,将样本转移到 PBS 后,通过 microCT 成像对对侧和受伤样本进行高分辨率 X 射线 microCT,以评估骨桥发育。使用 6.0 μm 的体素大小、330,000 ms 的采样时间和 55,000 V 的能量设置,强度为 145 μA。
- 在 microCT 成像并在 4 °C 下再固定福尔马林 24 小时后,将样品用 1X PBS 冲洗 3 x 5 分钟,然后将样品浸入 10% 蔗糖的 1X PBS 溶液中 1 小时,将 20% 蔗糖的 1X PBS 溶液浸入 1 小时,并将 30% 蔗糖的 1X PBS 溶液浸入过夜。使用装满蔗糖溶液的 29 G 胰岛素注射器,确保蔗糖溶液渗透到所有膝关节腔区域。如果在蔗糖浸泡过夜后未包埋,则转移到 -80 °C 冰箱中,以确保保留 GFP 报告基因和组织酶活性。
- 嵌入前从关节区域去除任何残留的肌肉组织。用冷冻包埋介质平衡样品过夜,促进培养基渗透到膝关节腔中。
- 查看 microCT 图像以确定嵌入前缺损和骨桥的位置。将一层薄薄的冷冻包埋培养基涂入冷冻模具中,并放置解剖且仍然连接的胫骨/股骨/关节,使感兴趣区域与包埋介质表面成 90° 角。
注意:此方向允许切片捕获横向创建的缺陷的横向视图。如果骨桥靠近缺损的边缘,那么这个方向也将避免在穿过组织的第一个较厚切片期间错过感兴趣区域的可能性。 - 将冷冻模具放在干冰上,直到冷冻包埋介质凝固,从而固定样品。继续用培养基填充低温模具,同时将其保存在干冰上。
- 固定样品后,将低温模具浸入用干冰冷却的 2-甲基丁烷中,直至完全冻结。冷冻后,去除多余的 2-甲基丁烷,用玻璃纸包裹冷冻模具,并储存在 -20 °C 或 -80 °C。
注:如果在冷冻包埋介质中长时间储存超过 1-2 个月,建议在 -80 °C 下防止干燥。胶带辅助冷冻切片和切片与载玻片的粘附如前所述23。
7. 序贯成像、染色和重成像
- 实施成像、染色和重新成像的顺序程序,以促进同一组织切片内多个生物信号的检测和共定位,如前所述23。特别是对于三色胶原报告小鼠的生长板切片,建议执行以下步骤。这种有序的方法确保了分子信号和结构细节的全面可视化。
- 最初,在第一轮成像中捕获三种胶原蛋白的内源性荧光信号。
- 对矿化组织23 进行钙黄绿素蓝染色和成像,然后进行抗酒石酸盐酸性磷酸酶 (TRAP) 酶活性染色和成像23。
注:虽然此处未显示 TRAP 酶活性染色结果,但执行此染色步骤,因为在代表性结果部分显示番红 O/Fast Green 染色结果之前,对于去除矿物质至关重要。 - 如下所述进行 4',6-二脒基-2-苯基吲哚 (DAPI) 核染色,然后成像。
- 将经过先前成像的载玻片放入含有 1x PBS 的 Coplin 罐中。将它们浸没在水中,直到盖玻片从载玻片上脱落。拆下后,取出并彻底干燥盖玻片。
- 将 DAPI 复染溶液涂在盖玻片上,在 50% 甘油和 1x PBS 的混合物中利用 1:1,000 稀释的 DAPI。申请后继续进行成像过程。
- 最后应用番红 O/Fast Green 染色剂来强调组织结构,然后成像。
注:将此作为结束步骤执行,以将显色图像与荧光信号相关联。- 制备 Weigert 苏木精铁溶液。通过将 1 g 苏木精溶解在 100 mL 95% 乙醇中来制备溶液 A,通过混合 4 mL 29% 氯化铁溶液、95 mL 去离子水和 1 mL 浓 HCl 来制备溶液 B。混合等量的溶液 A 和 B 以制备 Weigert 苏木精工作溶液,可稳定约 4 周。
- 将玻片浸入去离子水中 2 x 2 分钟以水合。
- 应用 Weigert 的工作苏木精溶液 5 分钟。
- 在自来水中洗涤玻片 5 分钟,然后在去离子水中短暂洗涤 1 分钟。
- 用 0.2% 固绿溶液(0.2 g 固绿 FCF 溶于 100 mL 去离子水)染色 2 分钟。
- 在 1% 乙酸中短暂冲洗 1 分钟。
- 用 0.1% Safranin O 溶液(0.1 g Safranin O 溶于 100 mL 去离子水)染色 1 分钟。
- 用去离子水冲洗,直到获得视觉上平衡的颜色,大约需要 5 分钟。
- 将载玻片安装在去离子水(避免 PBS)中的 30% 甘油中,并立即进行成像以防止颜色从组织中扩散。为了突出生长板的静止区细胞,使用 Cy5 滤镜进行成像:ET640/30x (EX)、ET690/50 m (EM)。
结果
该方案利用三系荧光报告小鼠通过利用 X 型胶原蛋白发出的固有红色荧光进行手术引导,精确诱导胫骨近端的外侧生长板缺损。外科医生在通过带有 mCherry 滤光片组的立体显微镜目镜观察时看到的视图如图 2D 所示。天然 X 型荧光允许外科医生将车针放置在肥大区,并产生类似于导致骨桥的常见生长板损伤类型的损伤 (图 2F)。红色通道下的荧光是最亮的,因此建议在车针放置期间使用。或者,如果实验的目标是研究生长板除肥大区和相邻钙化区域以外的其他区域的损伤,则可以通过使用三重转基因小鼠天然荧光的其他颜色来指导缺陷的产生。
使用 0.5 毫米直径的牙科车针在生长板的肥大区和相邻的下骨组织形成 Salter-Harris II 型缺损,通过与受伤(时间 0)近端胫骨的显微 CT 和冷冻组织学成像验证,与 N = 3 小鼠中未受伤的外侧对照相比(图 4)。这些缺陷在 3D microCT 图像中很难看到,但在 2-D 横截面中可以检测到(图 3A、B、E、F)。 图 3G 显示了 I 型产生胶原蛋白的骨细胞(绿色荧光)、II 型产生胶原蛋白的增殖性软骨细胞(青色荧光)和 X 型产生胶原蛋白的肥厚性软骨细胞的分布。在受伤小鼠的图像中(图 4G),相对于对照组,肥大区、暂时钙化层和一些最新形成的骨骼受到破坏,增殖区仅受到轻微干扰。Safranin O / Fast Green 染色(图 4H)最好地说明了受伤生长板内缺陷的位置,因为所有细胞都清晰可见。
X 射线分析提供了对活小鼠的一些见解,即这种类型的生长板损伤随着时间的推移对胫骨长度和骨桥形成的影响 (图 3)。手术前和手术后 3 周拍摄的未受伤 (图 3A) 和受伤 (图 3B) 胫骨之间的比较成像显示,肢体大量生长,生长板变薄,并且在 3 周时在受伤的生长板区域发展了明显的不透明区域。生长板内的这种混浊在未受伤的对应物中不存在,也不存在于手术前的小鼠中。因此,Faxitron 是观察活体小鼠损伤引起的病理变化的一种方法,例如骨桥的形成和肢体长度的变化。
解剖骨的 MicroCT 成像提供了手术后 3 周受伤生长板内骨桥形成的详细可视化 (图 5)。 如图 5 所示的 6 只不同受伤小鼠的图像所示,所有小鼠的骨桥发育一致。利用 Scanco Medical 软件,通过查看胫骨近端生长板的每个截面,用选择工具描绘骨桥的区域 (图 5B), 然后,整合整个生长板体积中的每个截面区域来计算骨桥体积得到总体积24。以这种方式计算的骨桥体积为 0.0761 mm3 ± 0.0246 (平均值±标准差,N = 6)。尽管采用外侧入路,但大多数骨桥在生长板的中间附近形成,这会损伤生长板的外缘和中心。这种现象可归因于以下事实:来自骨髓的间充质干细胞 (MSCs) 而不是软骨膜细胞负责骨桥的形成25。
在这些三色转基因小鼠中,天然胶原荧光丰富了受伤生长板的冷冻组织学分析 (图 6)。它揭示了损伤部位骨细胞和软骨细胞的复杂相互作用。将 图 6J、K 所示的 MicroCT 图像提供给组织学技术人员,以指导包埋和切片。I 型产生胶原蛋白的骨细胞如图 6L、O、P (绿色荧光)所示,而 II 型产生胶原蛋白的增殖性软骨细胞如图 6L、O、Q (青色荧光)所示。产生 X 型胶原蛋白的增生性软骨细胞见 图 6L、O、R (红色荧光)。这种多色荧光方法能够在矿化组织的背景下详细检查骨桥区域内的术后软骨细胞分化。DAPI 染色用于确认生长板区域内所有细胞类型的分布 (图 6M)。Safranin O / Fast Green 染色显示了受伤生长板内软骨和骨骼的复合和结构组织 (图 6N)。在 Cy5 滤光片组下对这些染色切片进行成像可显着增亮骨骺和软骨之间界面处的静息区细胞。
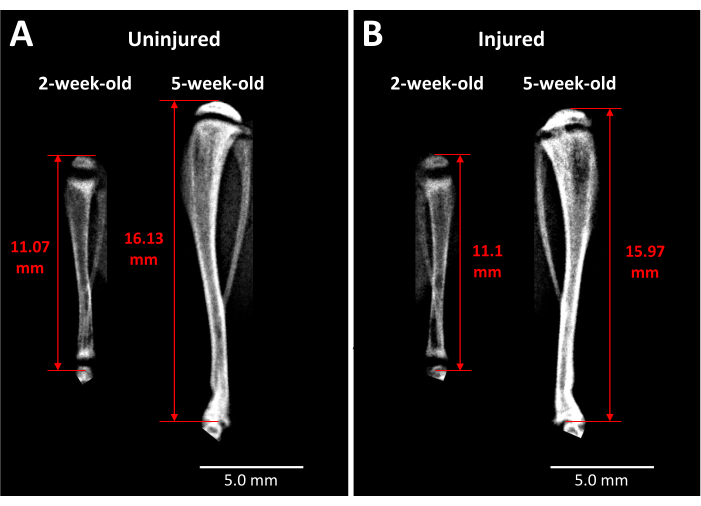
图 3:对侧对照和受伤小鼠胫骨的 X 射线图像。 (A) 当小鼠 2 周龄时,在受伤前拍摄对侧对照胫骨的 X 射线图像,当小鼠 5 周龄时,在手术后 3 周拍摄,展示了在此期间发生的生长程度。(B) 在与 (A) 相同的时间点由同一只小鼠受伤的胫骨。用于胫骨长度测量的标志是胫骨近端头的顶点到踝关节处的胫骨末端(红色双头箭头)。5 周时,在受伤的胫骨近端生长板中可以看到不透明的骨桥。比例尺 = 5.00 毫米。 请点击此处查看此图的较大版本。
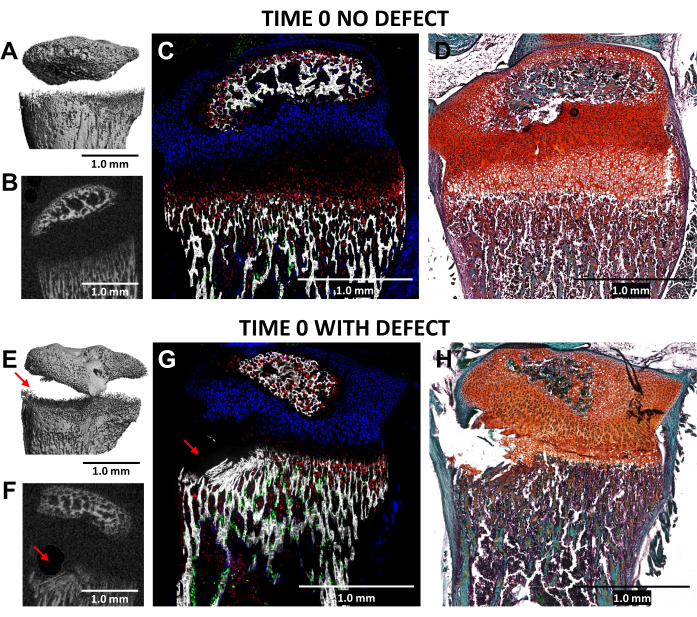
图 4:时间零对侧对照和受伤小鼠胫骨近端的 microCT 和组织学图像。 (A,E) 和 (B,F) 描绘了 3D 和横向 2D microCT 视图,缺陷由 (E) 和 (F) 中的红色箭头表示。(C,G)复合合并的冷冻组织学图像将三个先天荧光层与一个矿化组织层合并。绿细胞 (Col3.6GFPtpz) 是 I 型产生胶原蛋白的骨细胞,青蓝色细胞 (Col2A1GFPcyan) 是 II 型产生胶原蛋白的增殖性软骨细胞,红细胞 (Col10A1RFPchry) 是 X 型产生胶原蛋白的肥厚性软骨细胞。(D,H)与 (C) 和 (G) 相同区域的番红 O/固绿染色。比例尺 = 1.0 毫米。 请点击此处查看此图的较大版本。
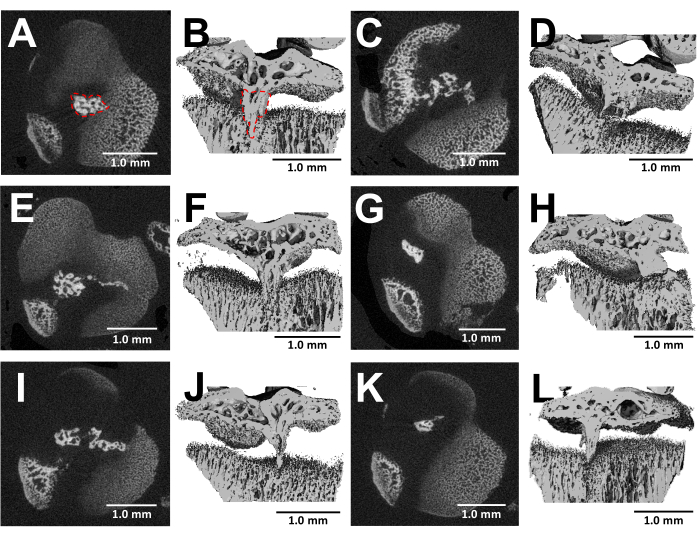
图 5:通过该协议形成的骨桥的 MicroCT 图像。 (A,C,E,G,I,K) BUR 缺损产生后 3 周,六只不同小鼠的胫骨近端生长板的横向横截面。骨桥由 (A) 中的红色虚线勾勒出来。(B,D,F,H,J,L) 切掉纵向平面的 3D 重建。骨桥在 (B) 中由红色虚线勾勒出来。比例尺 = 1.0 毫米。 请点击此处查看此图的较大版本。
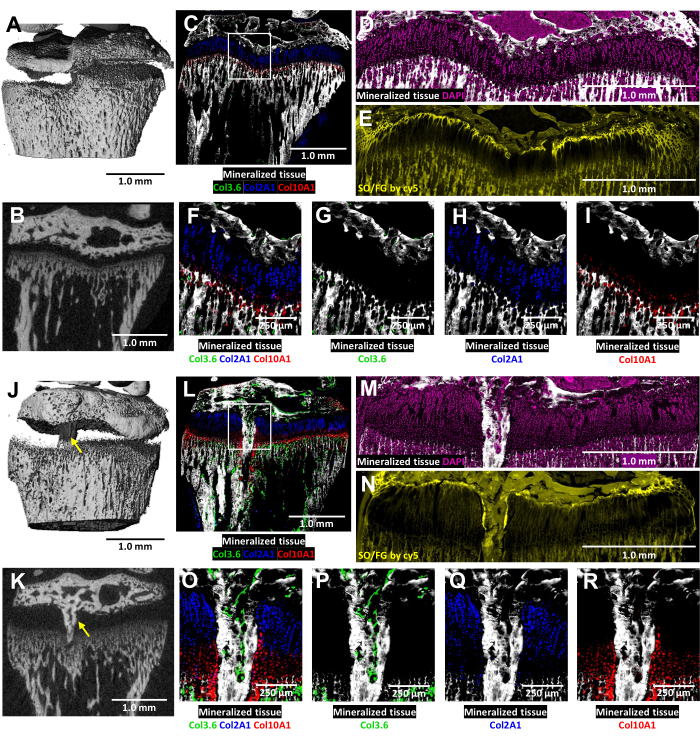
图 6:对侧对照和受伤小鼠胫骨近端伴骨桥形成的 microCT 和组织学图像。 (A,J) 和 (B,K) 描绘了 3D 和横向 2D microCT 视图,骨桥由 (J) 和 (K) 中的黄色箭头表示。(C,L)复合合并的冷冻组织学图像将三个先天荧光层与一个矿化组织层合并。绿细胞 (Col3.6GFPtpz) 是 I 型产生胶原蛋白的骨细胞,青蓝色细胞 (Col2A1GFPcyan) 是 II 型产生胶原蛋白的增殖性软骨细胞,红细胞 (Col10A1RFPchry) 是 X 型产生胶原蛋白的肥厚性软骨细胞。白色框表示面板 F 和 O 中显示的较高放大倍率。(D,M)图 C 和 L 生长板区域中的矿化组织和 DAPI 染色。(东,北)与 (D) 和 (M) 相同的区域用 cy5 荧光扫描的番红 O/固绿染色。(F,O)图 C 和 L 的合并图像中生长板区域的放大倍数更高。(G-I,P-R)天然荧光的单个通道以矿化组织为背景显示。比例尺 = 1.0 毫米 (AE) 和 (JN),= 250 μm 英寸 (FI) 和 (OR)。 请单击此处查看此图的较大版本。
讨论
三色胶原报告小鼠的创新使用能够产生具有预定大小和位置的生长板缺陷,显著提高了生长板损伤小鼠实验模型的准确性。鉴于 2 周龄小鼠的体型较小,使用 0.5 毫米的小车针造成损伤以避免肢体变弱并导致全层骨折至关重要。外科医生在产生缺损时还必须施加足够的压力,以避免出于同样的原因在骨骼中钻得太深。使用perioprobe对于确认一致的损伤深度至关重要。
与任何手术一样,确认足够的麻醉深度很重要,通过偶尔的脚趾捏和整个过程中保持无菌来确认。另一个重要的手术点是已经描述了用雕刻机进行钝性解剖,因为它避免了损伤软组织,并有助于确保小鼠在从麻醉中恢复后立即走动,以到达母鼠那里获得营养和舒适。根据我们的经验,用缝合线闭合的伤口仍然成功闭合,不需要伤口夹。建议在 2 周龄时对小鼠进行手术,以最好地模拟经历生长板骨折的幼儿。该协议的一个缺点是,鉴于分娩的不可预测性,使用这种小鼠模型需要外科医生在短时间内可用。
关于车针的定位以产生缺陷,该协议描述了使用 mCherry/Texas 红色滤光片组产生损伤,由于胶原蛋白 X 荧光的亮度,该滤光片组照亮生长板内的肥大区。为了确保损伤发生在胫骨生长板内,将软组织开口稍微向左和向右移动是有益的,以确认可以看到胫骨近端生长板,而不是股骨。在滤光片设置通道之间切换以照亮增殖软骨细胞区或相邻骨切片,有助于确认相对于增殖区和相邻骨切片位置的准确位置。
虽然在荧光显微镜下可以在活体小鼠中区分增殖性软骨细胞区以及骨骺端和干骺端骨,但在生长板的组织学分析过程中,可以实现 II 型和 I 型胶原报告基因的真正价值。鉴于冷冻组织学过程的水质,传统的显色染料沉淀方案不适用,因为脱水步骤可能导致颜色与荧光成像错位。尽管水性方案产生的染色模式与石蜡切片中的染色模式相似,但快速染色后成像对于防止染料从组织中扩散至关重要。使用蒸馏水中的 30% 甘油作为封片剂可以减慢这种扩散,允许在同一切片上进行多次显色染色,包括用 Safranin O/Fast Green 对软骨进行染色。
软骨内骨化过程清晰可见,红色软骨细胞排列在进化的骨桥 上(图 6)。免疫组织化学技术的额外使用,有许多可用的小鼠抗体,可以进一步加强在这些转基因小鼠中进行的机制研究。总之,这种转基因小鼠模型中传真管、microCT 和冷冻组织学成像技术的结合提供了对生长板损伤所发生的宏观和微观变化的全面理解,为未来的治疗干预铺平了道路,以减轻此类不良后果。可以对这些转基因小鼠进行进一步的基因操作,以允许谱系追踪研究了解在时间和空间上参与愈合的细胞的起源。在小鼠身上进行额外修饰的实验将允许研究软骨疾病,例如骨软骨瘤 - 生长板附近的软骨和骨骼过度生长。
我们模型的一致性通过在所有小鼠中可重复地形成骨桥来证明,而无需由于关节软骨损伤而丢弃组中的任何小鼠。这是对以前模型的改进,以前的模型从生长板下方的皮质窗口接近生长板,并将锋利的工具或毛刺向上倾斜到生长板,偶尔会越冲到关节软骨中。关节软骨的额外损伤与儿童常见的生长板损伤不同。这种动物模型的更精确的损伤减少了每次实验所需的小鼠数量,这是另一个改进。使用转基因小鼠使研究人员能够将损伤集中在生长板的子部分,例如肥大/暂时钙化区域或骨骺/休息区/增殖区区域,而不会影响关节软骨。然而,该模型的局限性是骨桥体积的可变性,受伤动物之间的差异可能高达 30%。因此,检测对骨桥形成的临床显着影响仍然需要大量动物才能实现统计相关性。
与先前发表的大鼠或兔生长板损伤模型 7,9,10,14 相比,此处描述的小鼠模型的好处包括使用的动物数量更少、成本降低、由于可重复的骨棒形成而有效的复制大小、更短的研究时间框架以及由于三重转基因小鼠的实时成像而更精确的损伤放置。虽然没有详细讨论,但这种小鼠模型可用于测试组织工程植入物或递送生长因子的生物材料。这种小鼠方法的一个显着局限性是,用于输送治疗药物或细胞的植入物的大小仅限于大约 0.5 毫米直径球体的缺损体积。只有较大的动物模型才能容纳用于人类患者的测试材料量。本协议中创建的车针缺陷与薄骨折的几何形状不同,因此与实际的人为伤害不同。尽管如此,这种小鼠模型的优点很多,并且外侧入路避免了在沿胫骨长轴垂直地盲目接近生长板上方或下方时会发生的关节软骨损伤。该方法代表了生长板损伤研究的重大飞跃,为研究病理学和评估新的治疗策略提供了一种详细且可重复的方法。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了美国国立卫生研究院、美国国家关节炎、肌肉骨骼和皮肤病研究所 (NIAMS) 1R21AR079153 和康涅狄格大学研究增强计划 (REP) 的资助。作者要感谢康涅狄格大学 MicroCT 成像核心设施的 Renata Rydzik 的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
参考文献
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。