Method Article
成長板損傷を研究するためのトリコロールトランスジェニックマウスモデル
要約
このプロトコルは、青年期の骨成長板損傷のための改良されたマウスモデルを記述します。成長プレートの3つの異なる基層に関連する一次マトリックスであるI型、II型、およびX型のコラーゲンの三系統蛍光レポーターを備えたトランスジェニックマウスを使用して、損傷の配置は顕微鏡下でのネイティブ蛍光によってガイドされます。
要約
子供の骨にある軟骨成長板は、手足を伸ばすことができますが、骨に対して弱いため、骨が過負荷になると骨折しやすくなります。損傷に対する反応は、成長板を早期に融合させる骨の橋であり、手足の発育不全および/または曲がった状態につながるため、重度の成長板の骨折に対するより良い治療が必要です。成長板損傷のマウスモデルは、機構研究には有利ですが、若いマウスの小さな成長板を視覚化して正確に損傷させることが難しいため、困難です。ここでは、I型、II.型、およびX型コラーゲンの三系統蛍光レポーターを用いたトランスジェニックマウスを用いた改良型成長板損傷モデルについて述べる。
これらのマウスは、成長プレートの3つの主要な基質に関連する天然の蛍光を示します。Salter-Harris Type II損傷と同様の成長板損傷は、蛍光実体顕微鏡ガイダンス下でのライブイメージング中に、成長板の肥大部を基準として使用してバーで再現可能に作成されます。天然蛍光の凍結組織学解析により、損傷に対する細胞応答の評価が容易になります。この方法論は、成長板損傷研究における大きな飛躍を表しており、病理学を調査し、新しい治療戦略を評価するための詳細で再現性のある方法を提供します。
概要
骨成長板は、小児期および青年期の長骨の縦方向の成長において極めて重要な役割を果たします1。長骨の末端に位置する成長板は複数のゾーンで構成されており、軟骨細胞はこのダイナミックな成長領域の生成と維持に関与する主要な細胞成分です。成長板の軟骨内骨化は、軟骨細胞の増殖、肥大、アポトーシス、血管による浸潤、骨前駆細胞の動員、そして最後に骨形成の連続的な進行を通じて、骨を伸ばし拡大するために起こります2。成長板は骨よりも比較的柔らかいため、スポーツやその他の活動中に骨が過負荷になると骨折しやすくなります。Salter-Harris分類は、成長板損傷の5つの異なるタイプを概説しています3。成長板の肥大領域と隣接する下部骨組織を通るII型骨折が最も一般的です4。骨ブリッジは、肥厚帯または隣接する骨の損傷に反応して形成されることが多く、隣接する長骨切片の早期融合につながる5。骨の橋は、成長板の正常な拡張を妨げます。現在、骨橋の形成には予防的治療法はなく、患者の年齢や骨橋の大きさや位置によっては、未治療のまま放置されているものもあります6。四肢の奇形がひどい場合、外科的選択肢には、除去とそれに続く脂肪やシリコーンゴムなどの配置間材料の埋め込み、または矯正骨切り術と骨延長手順が含まれます。しかし、骨ばった橋はまだ改革するかもしれません6。骨ブリッジの形成を防ぎ、骨成長板損傷の子供の転帰を改善するためには、さらなる研究が必要である。
いくつかの動物モデルが確立されており、根本的なメカニズムを探求し、損傷後の成長板の骨橋障害を防ぐための新しい戦略を開発しています7,8,9,10,11,12。これらの動物モデルは、通常、人間の損傷が発生する場所であることを考えると、近位脛骨成長板と遠位大腿骨成長板を主要な損傷部位として頻繁に焦点を当てています。動物の骨の欠損は、実際の骨折経路と同様の横方向のアプローチ、または成長プレートの中央のドリル穴につながる成長プレートの上または下からのアプローチによって作成されます。以前に報告されたラットモデルでは、成長板の欠損は、脛骨中軸の皮質窓を通して歯科用バーを挿入し、骨髄を膝関節に向かって上方に穿孔することによって作成され、成長板7,13を中央に損傷させる。あるいは、最近のマウスモデルは、小口径針を用いた横方向のアプローチを使用して、成長プレート8を通る平面針トラックを作成する。広く使用されているラットモデルでは、瑕疵は、顆の間の関節軟骨を穿孔することにより、遠位大腿骨の成長板に生じる9,14。ウサギやヒツジのような大型動物では、成長板の欠損は、成長板に穴を開けるか切り込むか、または下から接近して成長板の縁をそのまま残す中心欠陥を作成することにより、近位脛骨と遠位大腿骨に直接横方向に誘発されている10,11,12,15。
成長板損傷のマウスモデルは、幹細胞系譜追跡研究8など、遺伝子改変マウスで達成できる機構研究に有利である。しかし、マウスまたはラットの動物モデルにおける重要な課題は、成長板の特定のサブ領域に対して一貫した正確な損傷を達成することです。成長板と隣接する骨の特定の領域の損傷は、Salter-Harris分類によって説明される臨床的に関連する骨折経路の1つを模倣する必要があります。げっ歯類モデルにおけるこれまでの課題は、主に、損傷の外科的作成中に成長板の基層を識別する視覚的手段の欠如によるものです。このプロトコールは、コラーゲンI、II、およびX蛍光レポーター16、17、18を発現するトリプルトランスジェニックマウスを利用して、マウス成長プレートの標的基層に成長プレート欠陥を生じさせるための洗練された技術を記載している。成長プレートの主要なゾーンのそれぞれにおけるこれらのコラーゲンの異なる色の蛍光は、成長プレート損傷の外科的作成中に蛍光実体顕微鏡下で成長プレートの様々なセクションを視覚的に識別することを可能にする。これらのトランスジェニックマウスを用いることで、若いマウスにおいて、負傷した子供と同等の発達段階において、前例のない傷害精度を実現することができます。
プロトコル
この研究は、機関のガイドラインに準拠して実施されました。すべての動物用手順は、作業を開始する前に、コネチカット大学ヘルスセンターの施設内動物管理および使用委員会(IACUC)によって承認されました。プロトコルの概要を 図1 の回路図に示します。

図1:トリコロールコラーゲンレポーターマウスにおける成長板損傷プロトコルの概要。この図の拡大版を表示するには、ここをクリックしてください。
1. マウスの育種と手術の準備
- Col1a1-GFPTpz、Col2a1-CFP、およびCol10a1-mCherry 16,17,18,19,20,21を標準的な繁殖手順に従って発現するトリコロールトランスジェニックコラーゲンレポーターマウスを繁殖させ、生後2週間(±1日)の手術用子犬を取得します。蛍光顕微鏡で尾端フラグメントのジェノタイピングを行うことにより、トリプル導入遺伝子の発現を確認します。3色すべてに陽性のマウスのみを使用して、その後の組織学的解析時にレポーターシステムの利点を最大化します。
注:この生後2週間齢(±1日)は、骨成長板が人間の青年期と同様の発達段階にあるため、選択されます22。このプロトコルは、マウスの雌雄両方に適用されます。 - 手術当日または手術前日に、アルコール消毒パッドで耳とイヤーパンチを消毒した後、イヤーパンチを使用して手術に使用した各マウスを一意に識別し、各マウスの体重を量り、値を記録します。
- マウスがイソフルラン麻酔の効果下にある間に、電動クリッパーで股関節から足までの右後肢全体を剃ります。マウスに麻酔を誘発するには、イソフルラン(2〜3%)と100%酸素の混合物を使用し、1〜2Lの誘導チャンバー内で1L / minの流量で投与します。マウスを取り外し、マウスが動かないようにつま先をつまんで、麻酔の深さが十分であることを確認します。
注:この麻酔の深さは、麻酔鼻円錐を必要とせずにシェービングを行うのに十分な長さ続きます。 - 26 kV(800 mA)の電力設定でX線イメージングを採用し、イソフルラン誘発麻酔下で生きたマウスの脛骨画像をキャプチャし、初期肢の長さを記録します。
- マウスをX線キャビネットに入れる前に、イソフルラン(2〜3%)と100%酸素の混合物を使用して、1〜2Lの誘導チャンバー内で1L /分の流量で投与して、深い麻酔状態を誘発します。
- 麻酔をかけたマウス3匹を、X線キャビネットの腹に一度に平行に置き、3匹のマウスすべてを含む1枚の画像を取得できる棚の高さに置きます。脛骨がマウスの下に隠れないように、脚を広げます。測定精度を向上させるには、イメージング中にマウスの近くにX線不透過性スケールを配置します(図2A)。
- 準備したマウスを母マウスと一緒にハウジングケージに戻し、その後の外科的処置を待ちます。
2.手術用品と滅菌作業エリアの準備
- 次のアイテムを滅菌します:10〜20ガーゼパッド、綿先端アプリケーター綿棒、歯科用バー(直径0.5 mm)、歯科用ハンドピース、Graefe鉗子、湾曲した蚊止血鉗子、湾曲した細いはさみ、ニードルホルダー、歯周プローブ、および歯科用cleoid discoid carver。
- ブプレノルフィンの注射可能な懸濁液、20 G針、1 mLシリンジ、タオルカーテン、5-0未染色、編組、コーティング、ビクリル縫合糸、ポビドンヨード、リン酸緩衝生理食塩水、アルコール消毒パッド、#15メス、手術用手袋、環境表面バリアチューブソックス、眼用潤滑剤、70%エタノールスプレー。手術中のアイテムの追加滅菌のためにガラスビーズ滅菌器の電源を入れ、滅菌された寝具を備えた清潔なマウスケージの下の電気加熱パッドの電源を入れます。
- 蛍光実体顕微鏡ステージ、隣接する表面、および手術器具スタンドを70%エタノールを使用して洗浄および滅菌します。手術用ワークスペースとなるこれらの領域を滅菌タオルカーテンで覆います。
- 電子高速歯科用ドリルシステムを組み立てます。電子フットコントローラーをコントロールユニットに接続し、ハンドピースコードを消毒された表面バリアチューブソックスで覆います。滅菌済みの0.5mm丸型デンタルバーを取り付けます。コントローラーの電源を入れ、駆動比を1:1、最大30,000rpmに設定します。
- 蛍光実体顕微鏡ステージ上の消毒された表面バリアチューブソックスで覆われたノーズコーンで終端する柔軟なイソフルランマシンホースをテープで固定します。
- 蛍光実体顕微鏡と補助装置の電源を入れ、画像取得ソフトウェアを開きます。
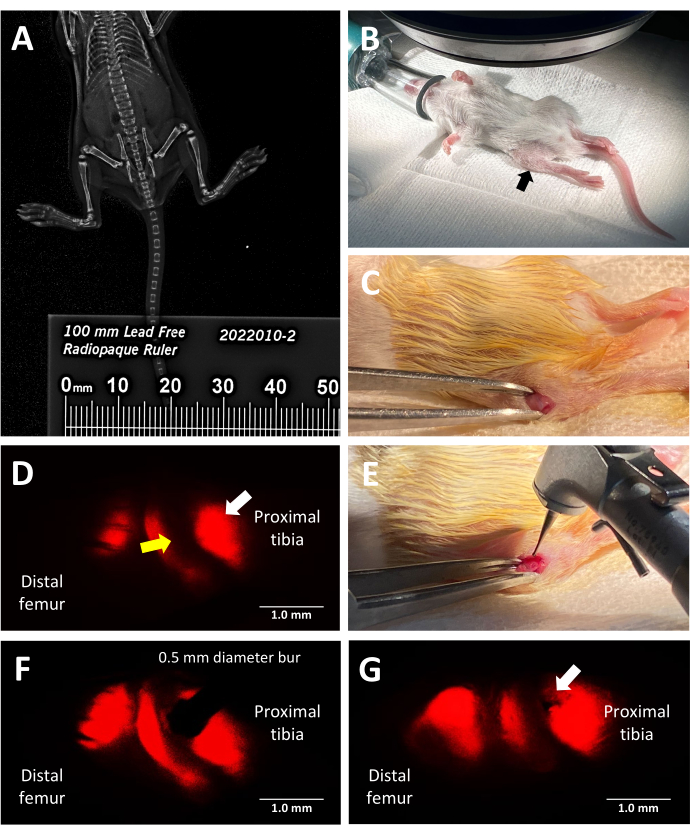
図2:三系統蛍光レポーターマウス成長板損傷手順の主要なステップ(A)X線キャビネット内のマウスの横に配置された放射線不透過性定規を使用したファキシトロンX線イメージングによる脛骨の長さの測定。(B)蛍光実体顕微鏡下での手術のための麻酔マウスの適切な位置。近位脛骨は黒い矢印で示されています。(C)成長板にアクセスするために行われた切開の例。(D)成長板の肥大領域を照らす蛍光実体顕微鏡(白矢印)。隣接する増殖ゾーンは黄色の矢印で示されます。(E)0.5mmのデンタルバーを成長プレートに当てる外科医の明るい光の照明。(F) デンタルバーの正確な配置は、蛍光立体顕微鏡によって肥厚領域にガイドされます。(G)Salter-Harris II型様成長板欠損の一例(白矢印)。スケールバー = 1 mm. この図の拡大版を表示するには、ここをクリックしてください。
3.近位脛骨成長板損傷の手順
- イソフルラン麻酔室でマウスに麻酔をかけ、イソフルラン濃度を2〜3%に、酸素流量を1L / minに調整します。つま先をつま先つまむテストと呼吸パターンの観察によって確認された深い麻酔状態の誘導を待ちます。
- マウスをチャンバーから取り出した直後に、処方された用量のブプレノルフィンの半分を皮下投与します。.ブプレノルフィンの投与量は、承認された動物プロトコルに従っています。
- 手術中にマウスの眼が乾燥するのを防ぐために眼用潤滑剤を塗布し、仰臥位のマウスを実体顕微鏡ステージ上のイソフルランマシンノーズコーンに移します(図2B)。ノーズコーンを通る麻酔の流れを2%に、酸素の流量を1L / minに調整します。
- 右後肢、骨盤領域、左後肢の前面、尾をポビドンヨードと70%エタノールで順次消毒します。
- 手術開始前に、追加のつま先つま先つまみテストと呼吸パターンの観察を通じて、麻酔の深さが安定し続けていることを確認します。
- 明るい光の照明の下で、#15メスを使用して、膝関節のすぐ下の皮膚に初期の長さ約5 mmの切開を作成し、右脛骨の近位端を明らかにします(図2C)。必要に応じてハサミを使ってカットを伸ばします。左の反対側の脛骨を損傷しないようにして、内部の無傷のコントロールとして機能するようにします。
- #15メスの裏側を使用して、近位脛骨の上にある筋肉を通して垂直鈍的解剖を行い、軟部組織を除去して成長板をはっきりと露出させます。
- 手術室の照明を消し、成長プレートの目的の領域を照らすための正しい蛍光チャネルを選択します。各蛍光コラーゲンのイメージングに必要なフィルターセットは、Col 2 Cyan:ET436/20x(励起)、ET480/40 m(発光)、Col 10 mCherry:ET577/20x(励起)、ET640/40 m(発光)、Col 1 Topaz:ET500/20x(励起)、ET535/30 m(発光)です。マウスを配置して、近位脛骨成長板を観察します(図2D)。皮膚の開口部を少し近位に調整し、次に遠位に調整して、脛骨成長板が大腿骨成長板ではなく視界に入ることを確認します。
- 顕微鏡の接眼レンズを覗きながら、0.5 mmの歯科用ドリルバーを肥厚性成長板ゾーンの中央の脛骨軸に平行に配置し、横方向のアプローチを使用して、Salter-Harris II型のような病変を作成します(図2E、F)。Salter-Harris II型病変を模倣した欠損を再現性よく作るには、バーエントリ経路が骨端に角度をつけないように、四肢を作業面と平行に保ちます。ドリルペダルに圧力をかけてバーの回転を開始し、欠陥がバーの直径よりも深くなる前に停止して、バーを成長プレートにゆっくりと押し込みます(図2G)。
注:マウスの手足を安定させるのを助ける2番目の手が役立ちます。 - 病変部位を滅菌PBSの滴で洗浄し、破片を取り除きます。
- 歯周プローブを使用して、0.5mmの欠陥の深さを確認します。
4. 怪我後の手続きと閉鎖
- タイムゼロ欠陥の特性評価のためには、組織閉鎖前に負傷した後肢と制御肢を採取します。セクション6では、組織採取とその後のマイクロコンピューター断層撮影(microCT)および凍結組織学イメージングの準備に従ってください。
注:成長板欠損部に治療物質を移植する実験では、欠損自体は、ほぼ球形で直径0.5mmまたは体積0.082mm3(0.082μL)の生体材料片のみに対応できます。 - 顕微鏡で可視化された鉗子を使用して、生体材料を挿入したり、成長プレート内の欠陥に液体治療薬を注入したりします。研究デザインが治療を欠陥のみに制限する必要がない場合は、大量の生体材料または注入された物質を使用してください。
- 皮膚の縁を慎重に再調整し、埋め込まれた材料がある場合は、欠陥部位内にしっかりと留まるようにします。
- 5-0ポリグリコール酸縫合糸による中断縫合技術を採用し、皮膚の切開部を効果的にシールします。
- 滅菌水を入れた綿棒を使用して、ポビドンヨード残留物の手術領域を超えた領域を徹底的に洗浄し、創傷や密接な周辺領域との接触を避けるように注意を払います。.
- マウスを顕微鏡ステージ上のイソフルランノーズコーンからリカバリーケージに移し、加熱パッドの上の新鮮な寝具の上に横方向に配置します。
- マウスの呼吸数を約5分間注意深く観察し、イソフルラン麻酔の効果が減少するのと同じように、鎮痛のための残りのブプレノルフィン用量を投与します。これは、呼吸数の増加によって示されますが、可動性が始まる前に。.マウスを隔離された回復ケージに保持し、完全な歩行能力を発揮するまで、その後、マウスを母親や兄弟と再会させます。
- 手術後48時間の最初の検査を毎日実施し、その後、安楽死の時点まで毎週評価を行います。感染の兆候、移動の有効性、食物へのアクセスのしやすさ、縫合糸の完全性に焦点を当てます。
- 標準的な時期(すなわち、生後3週間)でマウスを離乳させる。
5.四肢の長さの測定
- 実験仮説と設計によって決定された時点に基づいて、マウスにイソフルランを麻酔し、 図 2A で示され、セクション 1.4 で説明されているように、損傷した脛骨と負傷していない脛骨の両方の全長の X 線イメージングを行います。一貫した四肢の長さの測定を行うための適切なランドマークには、 図 3 に示すように、脛骨骨端の上部と脛骨距関節の脛骨の遠位端が含まれます。
注: イメージングは、損傷による四肢の長さと四肢の長さの不一致、および特定の術後間隔での成長板組織内の骨橋の発達を評価するために使用されます。
6. 組織解剖、固定、マイクロCTイメージング、埋埋入
- CO2窒息によりマウスを安楽死させ、好ましくは、子宮頸部脱臼などの代替方法による死亡確認を伴う自動CO2誘導システムを使用する。
- 無傷の後肢を分離し、組織学的およびマイクロCT分析の準備として、骨と膝の被膜領域から皮膚と筋肉を切除します。
- 後肢を固定液に入れる前に、膝蓋骨をマイクロ解剖ハサミで切り取り、膝蓋骨を慎重に切除し、膝腔への固定剤の浸透を促進します。29 Gインスリン注射器を使用して、膝腔のすべての領域に冷たい10%緩衝ホルマリンを完全に分配します。大腿骨と脛骨の骨幹領域を重症化して、骨髄腔への固定アクセスを改善します。関節組織を固定剤内で完全に伸ばした位置に保持し、ガーゼで細いダボに結び付けて、4°Cで24〜36時間保持します。
注意:ホルマリンは有毒であるため、適切な個人用保護具を着用しながらドラフトで取り扱ってください。
- 後肢を固定液に入れる前に、膝蓋骨をマイクロ解剖ハサミで切り取り、膝蓋骨を慎重に切除し、膝腔への固定剤の浸透を促進します。29 Gインスリン注射器を使用して、膝腔のすべての領域に冷たい10%緩衝ホルマリンを完全に分配します。大腿骨と脛骨の骨幹領域を重症化して、骨髄腔への固定アクセスを改善します。関節組織を固定剤内で完全に伸ばした位置に保持し、ガーゼで細いダボに結び付けて、4°Cで24〜36時間保持します。
- 4°Cでホルマリン固定の24-48時間後、骨ブリッジの発達を評価するために、サンプルをPBSに移した後、マイクロCTイメージングにより反対側および負傷したサンプルの高解像度X線マイクロCTを実施します。ボクセルサイズ6.0μm、サンプル時間330,000ms、エネルギー設定55,000V、強度145μAを使用します。
- マイクロCTイメージングと4°Cでのホルマリン固定をさらに24時間行った後、サンプルを1X PBSで3×5分間すすぎ、次にサンプルを1X PBSの10%スクロースに1時間、1X PBSに20%スクロースを1時間、1X PBSに30%スクロースを一晩浸します。スクロース溶液で満たされた29Gインスリンシリンジを使用して、スクロース溶液がすべての膝腔領域に浸透するようにします。.一晩ショ糖に浸漬した後に包埋しない場合は、-80°Cの冷凍庫に移し、GFPレポーターと組織酵素活性の保持を確保します。
- 埋め込む前に、関節領域から残っている筋肉組織をすべて取り除きます。クライオ包埋培地でサンプルを一晩平衡化し、培地が膝腔に浸透するのを促進します。
- マイクロCT画像を表示して、埋め込み前に欠損部と骨ブリッジがどこにあるかを判断します。クライオ埋め込み培地の薄層をクライオモールドに塗布し、解剖され、まだ接続されている脛骨/大腿骨/関節を、関心領域が埋め込み培地の表面に対して90°を向くように配置します。
注:この向きにより、切片化は横方向に作成された欠陥の側面図をキャプチャできます。骨ブリッジが欠損部の端に近い場合、この向きにより、組織を通過する最初の厚い部分で関心領域が失われる可能性も回避されます。 - クライオエンベッド培地が固化するまでクライオモールドをドライアイス上に配置し、試料を固定します。クライオモールドをドライアイスの上に置いたまま、培地を充填し続けます。
- 試料を固定した後、ドライアイスで冷やした2-メチルブタンにクライオモールドを浸漬し、完全に凍結させます。凍結後、余分な2-メチルブタンを取り除き、クライオモールドをセロハンで包み、-20°Cまたは-80°Cで保存します。
注:クライオ包埋培地で1〜2か月を超えて長期間保存する場合は、乾燥を防ぐために-80°Cをお勧めします。テープ支援クライオセクショニングおよび切片のスライドガラスへの接着は、前述した23。
7. シーケンシャルイメージング、染色、再イメージング
- イメージング、染色、および再イメージングの連続的な手順を実施して、前述の23と同様に、同じ組織切片内の複数の生物学的シグナルの検出および共局在を容易にする。特にトリコロールコラーゲンレポーターマウスの成長プレート切片には、次の手順が推奨されます。この順序付けられたアプローチにより、分子シグナルと構造の詳細の両方を包括的に視覚化できます。
- 最初に、イメージングの最初のラウンドで3つのコラーゲンの内因性蛍光シグナルを捕捉します。
- 石灰化組織23にカルセインブルー染色と画像を適用し、続いて酒石酸耐性酸性ホスファターゼ(TRAP)酵素活性染色とイメージング23を適用します。
注:TRAP酵素活性染色の結果はここには表示されませんが、この染色ステップは、代表的な結果セクションに示されているSafranin O/Fast Green染色結果の前にミネラルを除去するために不可欠であるため、実行されます。 - 以下に説明するように4',6-ジアミジノ-2-フェニルインドール(DAPI)核染色を行い、次に画像化します。
- 以前にイメージングを受けたスライドを、1x PBSを含むCoplinジャーに入れます。カバーガラスがスライドから剥がれるまで、それらを水に浸しておきます。取り外したら、カバースリップを取り外して完全に乾かします。
- 50%グリセロールと1x PBSの混合物に1:1,000で希釈したDAPIを利用して、DAPI対比染色液をカバーガラスに塗布します。アプリケーション後にイメージングプロセスに進みます。
- 最後に、Safranin O/Fast Green染色剤を塗布して組織構造を強調し、次に画像化します。
注:これを最終ステップとして実行し、発色画像を蛍光シグナルと相関させます。- ヴァイゲルトの鉄ヘマトキシリン溶液を調製します。1 gのヘマトキシリンを100 mLの95%エタノールに溶解して溶液Aを調製し、4 mLの29%塩化第二鉄溶液、95 mLの脱イオン水、および1 mLの濃縮HClを組み合わせて溶液Bを調製します。溶液AとBを等量混合して、約4週間安定なWeigertの作業用ヘマトキシリン溶液を作成します。
- スライドを脱イオン水に2 x 2分間浸して水和させます。
- ヴァイゲルトの作業用ヘマトキシリン溶液を5分間塗布します。
- スライドを水道水で5分間洗浄し、次に脱イオン水で1分間短時間洗浄します。
- 0.2% Fast Green 溶液 (0.2 g の Fast Green FCF を 100 mL の脱イオン水に含ませたもの) で 2 分間染色します。
- 1%酢酸で1分間短時間すすぎます。
- 0.1%サフラニンO溶液(100 mLの脱イオン水に0.1 gのサフラニンO)で1分間染色します。
- 脱イオン水ですすいで、視覚的にバランスの取れた色になるまで、約5分間します。
- スライドを脱イオン水に30%グリセロールにセットし(PBSは避けてください)、すぐにイメージングに進み、組織からの色の拡散を防ぎます。成長プレートの静止領域細胞を強調するために、Cy5フィルターで画像を実行します:ET640/30x(EX)、ET690/50m(EM)。
結果
このプロトコルは、三系統蛍光レポーターマウスを利用して、X型コラーゲンが発する固有の赤色蛍光を外科的指導に活用することにより、近位脛骨の側方成長板欠損を正確に誘導します。mCherryフィルターをセットした実体顕微鏡の接眼レンズを覗き込んだときの外科医の眺めを 図2Dに示します。ネイティブのタイプX蛍光により、外科医はバーを肥厚ゾーンに配置し、骨ブリッジにつながる一般的なタイプの成長板損傷を模倣した損傷を作り出すことができます (図2F)。赤チャンネルの下の蛍光は最も明るいため、バー留置中の使用をお勧めします。あるいは、実験の目標が肥厚性ゾーンおよび隣接する石灰化領域よりも成長プレートの他のゾーンへの損傷を研究することである場合、トリプルトランスジェニックマウスの天然蛍光の他の色を使用することによって欠陥作成を導くことができる。
直径0.5mmのデンタルバーを使用して、成長板の肥大領域と隣接する下部骨組織にSalter-HarrisII型のような欠損を作成することを、N = 3マウスの損傷していない側方コントロールと比較して、損傷した(時間0)近位脛骨のマイクロCTおよび凍結組織学イメージングを通じて検証しました(図4)。欠陥は3DマイクロCT画像では確認しにくかったが、2次元断面では検出可能だった(図3A、B、E、F)。 図3G は、I型コラーゲン産生骨細胞(緑色蛍光)、II型コラーゲン産生増殖性軟骨細胞(シアン蛍光)、およびX型コラーゲン産生肥大軟骨細胞の分布を示しています。負傷したマウス(図4G)の画像では、肥大領域、暫定的に石灰化した層、および増殖領域がわずかに乱れただけのコントロールと比較して最も新しく形成された骨の一部が破壊されています。サフラニンO/Fast Green染色(図4H)は、すべての細胞がはっきりと見えるため、損傷した成長プレート内の欠陥の位置を最もよく示しています。
X線分析は、このタイプの成長板損傷が脛骨の長さと骨橋形成に経時的に与える影響について、生きたマウスにいくつかの洞察を提供します (図3)。手術前と手術後3週間で撮影された無傷の脛骨 (図3A) と負傷した 脛骨(図3B) の比較画像では、大量の四肢の成長、成長板の菲薄化、および3週間で損傷した成長板領域に発生した明確な不透明な領域が明らかになります。成長板内のこの不透明度は、無傷のマウスや手術前のマウスには存在しません。したがって、Faxitronは、骨梁の形成や四肢の長さの変化など、生きたマウスの損傷によって引き起こされる病理学的変化を観察する1つの方法です。
解剖された骨のMicroCTイメージングは、手術の3週間後に損傷した成長板内の骨ブリッジ形成を詳細に視覚化します(図5)。図5に示す6つの異なる負傷マウスの画像に見られるように、すべてのマウスで一貫した骨ブリッジの発達が見られます。Scanco Medicalソフトウェアを使用して、近位脛骨成長板の各セクションを確認し、選択ツールで骨ブリッジの領域を描写し(図5B)、次に成長プレートの体積全体で各セクション領域を統合して総体積24を得ることにより、骨ブリッジの体積を計算しました。この方法で計算された骨橋の体積は 0.0761 mm3 ± 0.0246 (平均±標準偏差、N = 6) でした。骨の橋の大部分は、横方向のアプローチにもかかわらず、成長プレートの中央近くに形成され、成長プレートの外縁と中心を傷つけます。この現象は、軟骨周囲ではなく骨髄由来の間葉系幹細胞(MSC)が骨ブリッジ形成に関与しているという事実に起因する可能性がある25。
これらのトリコロールトランスジェニックマウスでは、損傷した成長板の凍結組織学的分析は、天然のコラーゲン蛍光によって強化されています(図6)。これは、損傷部位における骨細胞と軟骨細胞の複雑な相互作用を明らかにします。図6J、Kに示すMicroCT画像は、包埋と切片化をガイドするために組織学技術者に提供されました。I型コラーゲン産生骨細胞は図6L,O,P(緑色蛍光)に、II型コラーゲン産生増殖性軟骨細胞は図6L,O,Q(シアン蛍光)に見られます。X型コラーゲン産生肥大軟骨細胞は、図6L、O、R(赤色蛍光)に見られます。このマルチカラー蛍光アプローチにより、石灰化組織を背景にした骨橋領域内の術後軟骨細胞の分化を詳細に調べることができます。DAPI染色を使用して、成長プレート領域内のすべての細胞タイプの分布を確認しました(図6M)。Safranin O/Fast Green染色は、損傷した成長板内の軟骨と骨の複合的および構造的組織を示しています(図6N)。これらの染色切片をCy5フィルターセットでイメージングすると、骨端骨と軟骨の間の界面にある静止領域の細胞が著しく明るくなります。
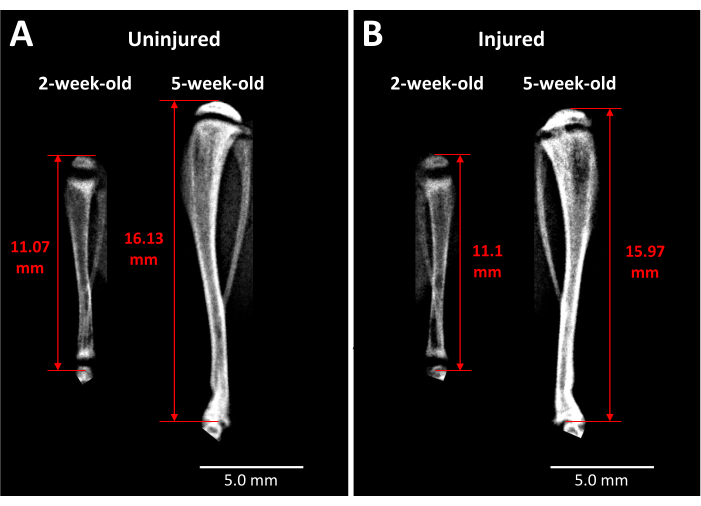
図3:対側コントロールと負傷したマウスの脛骨のX線画像 (A) 対側コントロール脛骨のX線画像は、マウスが生後2週間のときは損傷の直前に、マウスが生後5週間のときには手術後3週間で撮影されており、この期間中に起こる成長の程度を示しています。(B)(A)と同じ時点で同じマウスから負傷した脛骨。脛骨の長さの測定に使用されるランドマークは、近位脛骨頭の頂点から足首関節の脛骨の端までです(赤い両方向の矢印)。不透明な骨の橋は、5 週間で損傷した近位脛骨成長板に見えます。スケールバー = 5.00 mm。 この図の拡大版を表示するには、ここをクリックしてください。
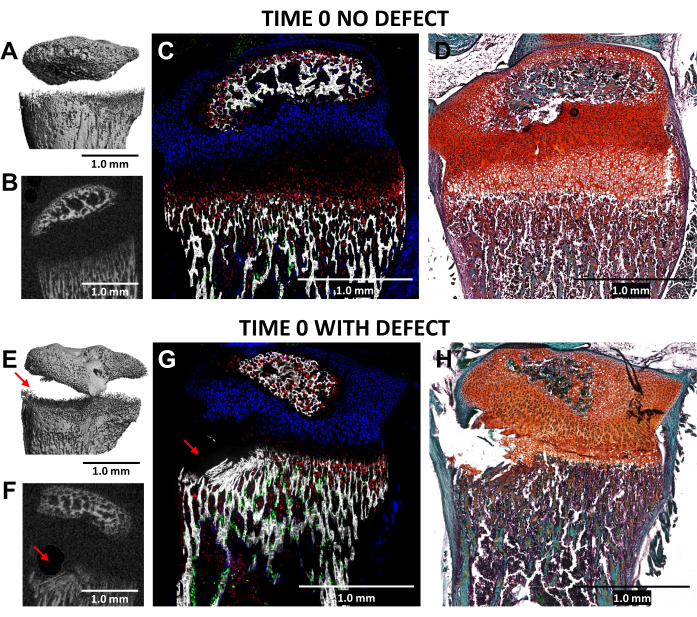
図4:タイムゼロ対側コントロールと損傷したマウス近位脛骨のマイクロCTおよび組織学的画像(A,E)および(B,F)は、3Dおよび横方向の2DマイクロCTビューを示しており、(E)および(F)の赤い矢印で欠陥が示されています。(C,G)3つの自然蛍光層と石灰化組織層を融合させた凍結組織学的画像を合成した。緑色細胞(Col3.6GFPtpz)はI型コラーゲン産生骨細胞、シアンブルーの細胞(Col2A1GFPcyan)はII型コラーゲン産生増殖性軟骨細胞、赤色細胞(Col10A1RFPchry)はX型コラーゲン産生肥厚性軟骨細胞です。(D,H)(C)および(G)と同じ領域のSafranin O/Fast Green染色。スケールバー= 1.0 mm。この図の拡大版を表示するには、ここをクリックしてください。
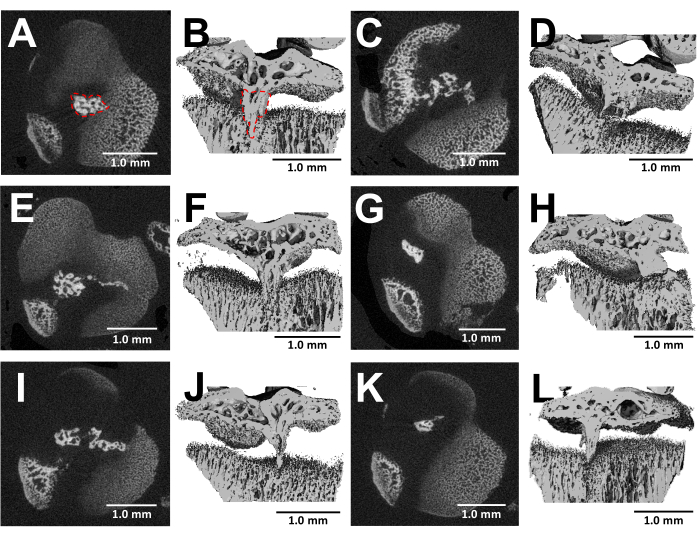
図5:このプロトコルによって形成された骨ブリッジのMicroCT画像(A、C、E、G、I、K)バー欠損作成後3週間の6つの異なるマウスの近位脛骨成長板の横断面。(A)の赤い点線で囲まれた骨の橋。(B,D,F,H,J,L) 縦方向の平面を切り取った3D再構成。(B)の赤い点線で囲まれた骨の橋。スケールバー= 1.0 mm。この図の拡大版を表示するには、ここをクリックしてください。
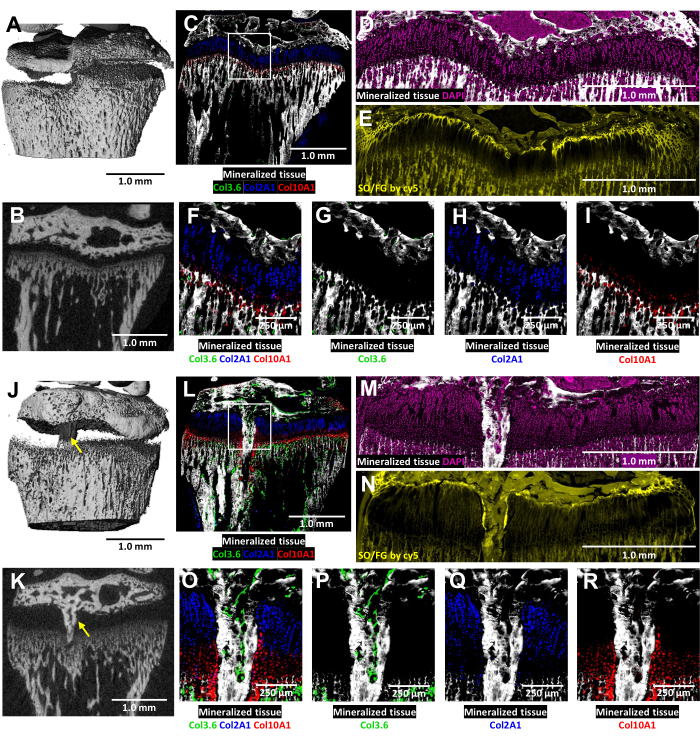
図6:骨ブリッジ形成を伴う対側コントロールおよび損傷したマウス近位脛骨のMicroCTおよび組織学的画像。 (A,J)および(B,K)は、3Dおよび横方向の2DマイクロCTビューを示しており、(J)および(K)は骨ブリッジを黄色の矢印で示しています。(C,L)3つの自然蛍光層と石灰化組織層を融合させた凍結組織学的画像を合成した。緑色細胞(Col3.6GFPtpz)はI型コラーゲン産生骨細胞、シアンブルーの細胞(Col2A1GFPcyan)はII型コラーゲン産生増殖性軟骨細胞、赤色細胞(Col10A1RFPchry)はX型コラーゲン産生肥厚性軟骨細胞です。白いボックスは、 パネルF と Oで示されている高倍率を示しています。(D,M)パネル C および Lの成長板領域における石灰化組織およびDAPI染色。(E,N)(D)および(M)と同じ領域のSafranin O/Fast Green染色をcy5蛍光でスキャンしました。(F,O)パネル C と Lの合体画像における成長板面積の高倍率。(G-I,P-R)天然蛍光の個々のチャネルを、石灰化した組織の背景で示しています。スケールバー = 1.0 mm (A-E) と (J-N)、= 250 μm in (F-I) と (O-R)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
トリコロールコラーゲンレポーターマウスの革新的な使用により、所定のサイズと位置で成長板欠損を作成することができ、成長板損傷のマウス実験モデルの精度が大幅に向上します。生後2週間齢のマウスのサイズが小さいことを考えると、手足が弱くなり、全層骨折を引き起こすのを避けるために、小さな0.5mmのバーを使用して損傷を引き起こすことが重要です。また、外科医は、同じ理由で骨に深く穴を開けすぎないように、欠損を作成する際に十分な圧力をかける必要があります。ペリオプローブの使用は、一貫した損傷の深さを確認するために重要です。
他の手術と同様に、適切な麻酔の深さを確認することが重要であり、時折つま先をつまむことで確認され、全体を通して無菌性が維持されます。また、カーバーによる鈍解剖は、軟部組織の損傷を防ぎ、麻酔からの回復後すぐにマウスが母マウスに到達して栄養と快適さを得ることができるため、カーバーによる鈍的解剖が説明されていることです。私たちの経験では、縫合糸で閉じられた傷は正常に閉じられたままであり、創傷クリップは必要ありません。成長板骨折を経験する幼児を最もよく模倣するために、2週齢のマウスの手術が推奨されます。このプロトコルの欠点の1つは、出産の予測不可能な性質を考えると、このマウスモデルの使用には、急な通知で外科医が利用できる必要があることです。
欠陥を作成するためのバーの位置に関して、プロトコルは、コラーゲンX蛍光の明るさのために成長プレート内の肥厚ゾーンを照らすmCherry/Texas赤色フィルターセットを使用して損傷を作成することを説明しています。損傷が脛骨成長板内に生じるようにするには、軟部組織の開口部を左右にわずかに動かして、近位脛骨成長板が大腿骨ではなく視界内にあることを確認することが有益です。増殖性軟骨細胞ゾーンまたは隣接する骨切片を照らすためにフィルターセットチャンネルを切り替えることは、増殖性ゾーンと隣接する骨切片の位置に対する正確な配置を確認するのに役立ちます。
増殖性軟骨細胞ゾーンと骨端骨および骨端骨は、生きたマウスの蛍光顕微鏡法で区別できますが、II型およびI型コラーゲンレポーターの真の価値は、成長板の組織学的分析中に実現されます。クライオ組織学的プロセスの水性の性質を考えると、脱水ステップによって引き起こされる蛍光イメージングと色の不一致が生じる可能性があるため、従来の発色色素沈殿プロトコルは不適切です。水性プロトコールでは、パラフィン切片と同様の染色パターンが得られますが、組織からの色素拡散を防ぐためには、染色後の迅速なイメージングが不可欠です。封入剤として蒸留水中の30%グリセロールを利用すると、この拡散を減速させることができ、サフラニンO/Fast Greenによる軟骨を含む、同じ切片での複数の発色染色が可能になります。
軟骨内骨化プロセスは、進化する骨橋を覆う赤い軟骨細胞ではっきりと見えます (図6)。多くのマウス抗体が利用可能な免疫組織化学技術の追加使用は、これらのトランスジェニックマウスで実施されたメカニズム研究をさらに強化する可能性があります。全体として、このトランスジェニックマウスモデルにおけるファキシトロン、マイクロCT、およびクライオ組織学的イメージング技術の組み合わせは、成長板の損傷に応答して発生する巨視的および微視的変化の包括的な理解を提供し、そのような有害な結果を軽減するための将来の治療介入への道を開きます。これらのトランスジェニックマウスのさらなる遺伝子操作を行うことで、系統追跡研究が治癒に時間的および空間的に関与する細胞の起源を理解することを可能にすることができる。追加の変更を加えたマウスでの実験により、骨軟骨腫(成長板近くの軟骨と骨の過成長)などの軟骨疾患の研究が可能になります。
私たちのモデルの一貫性は、関節軟骨損傷のためにグループからマウスを捨てる必要なしに、すべてのマウスで骨ブリッジの再現可能な形成によって実証されています。これは、成長板の下の皮質窓から成長板にアプローチし、鋭利な工具またはバールを成長板に向かって上向きに角度をつけ、時折関節軟骨にオーバーシュートする従来のモデルよりも改善されています。関節軟骨の追加の損傷は、子供に一般的に発生する成長板の損傷を模倣するものではありません。この動物モデルのより正確な損傷は、実験ごとに必要なマウスの数を減らし、それは別の改善です。トランスジェニックマウスを使用すると、研究者は、関節軟骨に影響を与えることなく、肥大性/暫定的に石灰化した領域や骨端/安静時帯/増殖性領域などの成長板のサブセクションに損傷を集中させることができます。ただし、このモデルの制限は、骨ブリッジの体積のばらつきであり、負傷した動物間で最大30%異なる可能性があります。したがって、骨ブリッジ形成に対する臨床的に有意な影響を検出するには、統計的な関連性を達成するためには、依然として多数の動物が必要です。
以前に発表されたラットまたはウサギの成長板損傷モデルと比較して、ここで説明したマウスモデルの利点7,9,10,14には、使用される動物数が少ないこと、コスト削減、再現性のある骨棒形成による効率的な複製サイズ、研究時間枠の短縮、およびトリプルトランスジェニックマウスのライブイメージングによるより正確な損傷配置が含まれます。詳細は説明されていませんが、このマウスモデルは、成長因子を送達する組織工学インプラントや生体材料の試験に使用できます。このマウス法の顕著な制限は、治療薬または細胞を送達するために使用されるインプラントのサイズが、直径約0.5mmの球の欠陥体積に制限されることである。より大きな動物モデルのみが、人間の患者に使用される試験材料の量に対応できます。このプロトコルで作成されるburの欠陥は薄いひび割れと同じ幾何学的ではない、従って実際の人間の傷害と異なって。それにもかかわらず、このマウスモデルの利点は多く、横方向のアプローチは、脛骨の長軸に沿って成長板の上または下に盲目的に近づくときに発生する関節軟骨の損傷を回避します。この方法論は、成長板損傷研究における大きな飛躍を表しており、病理学を調査し、新しい治療戦略を評価するための詳細で再現性のある方法を提供します。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、国立衛生研究所、国立関節炎・筋骨格・皮膚疾患研究所(NIAMS)1R21AR079153、およびコネチカット大学研究強化プログラム(REP)からの助成金によって支援されました。著者らは、コネチカット大学MicroCTイメージングコア施設のRenata Rydzik氏の協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
参考文献
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515(2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474(2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved