Method Article
Modello murino transgenico tricolore per lo studio delle lesioni della cartilagine di crescita
In questo articolo
Riepilogo
Questo protocollo descrive un modello murino migliorato per le lesioni della cartilagine di crescita ossea degli adolescenti. Utilizzando topi transgenici con reporter fluorescenti tri-lineage per collagene di tipo I, II e X, le matrici primarie associate a tre diversi substrati della placca di crescita, il posizionamento delle lesioni è guidato dalla fluorescenza nativa al microscopio.
Abstract
Le placche di crescita della cartilagine nelle ossa dei bambini consentono l'allungamento degli arti, ma sono deboli rispetto all'osso, rendendole inclini alla frattura quando le ossa sono sovraccaricate. Sono necessari trattamenti migliori per le placche di crescita gravemente fratturate perché la risposta alla lesione è un ponte osseo che fonde prematuramente la cartilagine di crescita, portando a arti rachitici e/o storti. I modelli murini di lesione della cartilagine di accrescimento sono vantaggiosi per gli studi meccanicistici, ma sono impegnativi perché è difficile visualizzare e danneggiare con precisione le piccole cartilagini di accrescimento nei topi giovani. Descriviamo qui un modello di lesione della cartilagine di crescita migliorata utilizzando topi transgenici con reporter fluorescenti tri-lineage per collagene di tipo I, II e X.
Questi topi mostrano una fluorescenza nativa associata ai tre substrati primari della cartilagine di crescita. Una lesione della cartilagine di accrescimento simile a una lesione di Salter-Harris di tipo II viene creata in modo riproducibile con una fresa utilizzando la sezione ipertrofica della cartilagine di accrescimento come riferimento durante l'imaging dal vivo sotto guida di stereoscopia a fluorescenza. L'analisi istologica congelata della fluorescenza nativa semplifica la valutazione della risposta cellulare alla lesione. Questa metodologia rappresenta un salto sostanziale nella ricerca sulle lesioni della cartilagine di crescita, fornendo un metodo dettagliato e riproducibile per indagare la patologia e valutare nuove strategie terapeutiche.
Introduzione
Le placche di crescita ossea svolgono un ruolo fondamentale nella crescita longitudinale delle ossa lunghe durante l'infanzia e l'adolescenza1. Situata alle estremità delle ossa lunghe, la placca di crescita comprende più zone, con i condrociti che sono i componenti cellulari chiave responsabili della produzione e del mantenimento di questa area di crescita dinamica. L'ossificazione endocondrale della cartilagine di crescita si verifica per allungare ed espandere le ossa attraverso una progressione sequenziale di proliferazione dei condrociti, ipertrofia, apoptosi, invasione da parte dei vasi sanguigni, reclutamento di cellule osteoprogenitrici e, infine, formazione ossea2. Poiché la cartilagine di accrescimento è relativamente più morbida dell'osso, è altamente suscettibile alla frattura quando le ossa sono sovraccaricate durante lo sport o altre attività. La classificazione di Salter-Harris delinea cinque tipi distinti di lesioni da cartilagine di accrescimento3. La frattura di tipo II attraverso la zona ipertrofica della cartilagine di accrescimento e il tessuto osseo inferiore adiacente è la più prevalente4. Un ponte osseo si forma spesso in risposta a lesioni della zona ipertrofica o dell'osso adiacente e porta alla fusione prematura delle sezioni ossee lunghe adiacenti5. I ponti ossei impediscono la normale espansione della cartilagine di crescita. Attualmente, non sono disponibili trattamenti preventivi per la formazione del ponte osseo e alcuni non vengono trattati a seconda dell'età del paziente e delle dimensioni e della posizione del ponte osseo6. Quando la malformazione degli arti è grave, le opzioni chirurgiche includono la rimozione seguita dall'impianto di materiali interposizionali come grasso o gomma siliconica o procedure correttive di osteotomia e allungamento osseo; Eppure un ponte osseo può ancora riformarsi6. Sono necessarie ulteriori ricerche per prevenire la formazione di ponti ossei e per migliorare gli esiti dei bambini con lesioni della cartilagine di crescita ossea.
Sono stati stabiliti diversi modelli animali per esplorare i meccanismi sottostanti e sviluppare nuove strategie per prevenire la compromissione del ponte osseo delle placche di crescita dopo la lesione 7,8,9,10,11,12. Questi modelli animali si concentrano spesso sulla placca di accrescimento tibiale prossimale e sulla cartilagine di accrescimento del femore distale come sito di lesione primaria, dato che questo è tipicamente il luogo in cui si verificano lesioni umane. I difetti ossei degli animali sono creati da un approccio laterale simile a un vero e proprio percorso di frattura o da un approccio dall'alto o dal basso della cartilagine di accrescimento che porta a un foro centrale nella cartilagine di accrescimento. In un modello di ratto precedentemente riportato, un difetto della cartilagine di accrescimento viene creato inserendo una fresa dentale attraverso una finestra corticale nell'asta mediana tibiale e perforando verso l'alto attraverso il midollo verso l'articolazione del ginocchio per ferire centralmente la cartilaginedi accrescimento 7,13. In alternativa, un recente modello murino utilizza un approccio laterale con un ago di piccolo diametro per creare una traccia planare dell'ago attraverso la placca di crescita8. In un modello di ratto ampiamente utilizzato, il difetto viene creato nella cartilagine di crescita del femore distale perforando la cartilagine articolare tra i condili 9,14. Negli animali più grandi come conigli e pecore, i difetti della cartilagine di accrescimento sono stati indotti lateralmente direttamente nella tibia prossimale e nel femore distale perforando o tagliando la cartilagine di accrescimento o avvicinandosi dal basso e creando un difetto centrale lasciando inalterati i bordi della cartilagine di accrescimento 10,11,12,15.
I modelli murini per le lesioni della cartilagine di crescita sono vantaggiosi per gli studi meccanicistici che possono essere realizzati con topi geneticamente modificati, come gli studi di tracciamento del lignaggio delle cellule staminali8. Tuttavia, una sfida significativa nei modelli animali murini o di ratto è ottenere lesioni coerenti e precise in una particolare sottoregione della cartilagine di crescita. La lesione di particolari zone della cartilagine di accrescimento e dell'osso adiacente è necessaria per imitare uno dei percorsi di frattura clinicamente rilevanti descritti dalle classificazioni di Salter-Harris. Le sfide fino ad oggi nei modelli di roditori sono principalmente dovute alla mancanza di mezzi visivi per identificare i substrati della cartilagine di crescita durante la creazione chirurgica della lesione. Questo protocollo descrive una tecnica raffinata per creare difetti della cartilagine di accrescimento in substrati mirati della cartilagine murina utilizzando topi transgenici tripli che esprimono reporter fluorescenti di collagene I, II e X 16,17,18. La fluorescenza di colore diverso di questi collageni in ciascuna delle zone primarie della cartilagine di accrescimento consente la discriminazione visiva delle varie sezioni della cartilagine di accrescimento sotto uno stereomicroscopio a fluorescenza durante la creazione chirurgica della lesione della cartilagine di accrescimento. L'uso di questi topi transgenici consente una precisione delle lesioni senza precedenti in un topo giovane in una fase di sviluppo paragonabile a quella dei bambini feriti.
Protocollo
La ricerca è stata condotta nel rispetto delle linee guida istituzionali. Tutte le procedure per gli animali sono state approvate dal Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC) dell'Università del Connecticut prima di iniziare il lavoro. Uno schema del protocollo è descritto nello schema della Figura 1 .

Figura 1: Schema del protocollo di lesione della cartilagine di crescita nei topi reporter con collagene tricolore. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Allevamento di topi e preparazione per l'intervento chirurgico
- Alleva topi reporter di collagene transgenico tricolore che esprimono Col1a1-GFPTpz, Col2a1-CFP e Col10a1-mCherry 16,17,18,19,20,21 secondo le procedure di allevamento standard per ottenere cuccioli per intervento chirurgico di 2 settimane (± 1 giorno). Verificare l'espressione del triplo transgene genotipizzando un frammento della punta della coda al microscopio a fluorescenza. Utilizzare solo i topi positivi per tutti e tre i colori per massimizzare il beneficio del sistema reporter durante la successiva analisi istologica.
NOTA: Questa età di 2 settimane (± 1 giorno) è selezionata perché le loro placche di crescita ossea sono in uno stadio di sviluppo simile a quello dell'adolescente umanodi 22 anni. Questo protocollo si applica a entrambi i sessi di topi. - Il giorno dell'intervento o un giorno prima, identificare in modo univoco ogni topo utilizzato per l'intervento chirurgico utilizzando un punzone per le orecchie dopo aver disinfettato l'orecchio e il punzone per le orecchie con tamponi antisettici imbevuti di alcol, pesare ciascun topo e registrare il valore.
- Radere l'intero arto posteriore destro dall'anca al piede con un tagliacapelli elettrico mentre il topo è sotto l'effetto dell'anestesia con isoflurano. Per indurre l'anestesia nei topi, utilizzare una miscela di isoflurano (2-3%) e ossigeno al 100%, somministrata a una velocità di flusso di 1 L/min all'interno di una camera di induzione da 1-2 L. Rimuovere il mouse e verificare che la profondità dell'anestesia sia sufficiente con un pizzico di dita che non dovrebbe causare il movimento del mouse.
NOTA: Questa profondità di anestesia durerà sufficientemente a lungo per condurre la rasatura senza richiedere un cono per l'anestesia. - Utilizzare l'imaging a raggi X con un'impostazione di potenza di 26 kV (800 mA) per acquisire immagini tibiali in topi vivi in anestesia indotta da isoflurano per registrare la lunghezza iniziale dell'arto.
- Prima di posizionare i topi nella cabina radiografica, indurre un profondo stato di anestesia utilizzando una miscela di isoflurano (2-3%) e ossigeno al 100%, somministrata a una velocità di flusso di 1 L/min all'interno di una camera di induzione da 1-2 L.
- Posizionare tre topi anestetizzati alla volta in parallelo sullo stomaco nella cabina radiografica a un'altezza dello scaffale che consenta di ottenere un'immagine che includa tutti e tre i topi. Allarga le gambe in modo che le ossa tibiali non siano oscurate sotto il topo. Per una maggiore precisione di misurazione, posizionare una scala radiopaca vicino al mouse durante l'imaging (Figura 2A).
- Rimetti i topi preparati nella loro gabbia di alloggiamento con il topo madre in attesa delle successive procedure chirurgiche.
2. Preparazione di forniture chirurgiche e area di lavoro sterile
- Sterilizzare i seguenti elementi: 10-20 garze, tamponi applicatori con punta di cotone, frese dentali (diametro 0,5 mm), manipoli dentali, pinze Graefe, pinze emostatiche per zanzare curve, forbici fini curve, portaaghi, sonde parodontali e intagliatori discoidi cleoidi dentali.
- Raccogliere ulteriori forniture sterili necessarie: una sospensione iniettabile di buprenorfina, aghi da 20 G, siringhe da 1 ml, teli per asciugamani, suture 5-0 non colorate, intrecciate, rivestite, in vicryl, iodio povidone, soluzione salina tamponata con fosfato, tamponi antisettici imbevuti di alcol, bisturi #15, guanti chirurgici, sox per tubi barriera ambientale per superfici, lubrificante per gli occhi, spray all'etanolo al 70%. Accendi uno sterilizzatore a perle di vetro per un'ulteriore sterilizzazione degli oggetti durante l'intervento chirurgico e il termoforo elettrico sotto una gabbia per mouse pulita con lettiera sterilizzata.
- Pulire e sterilizzare il tavolino dello stereomicroscopio a fluorescenza, le superfici adiacenti e il supporto dello strumento chirurgico utilizzando il 70% di etanolo. Copri queste aree che diventeranno l'area di lavoro chirurgica con teli sterili.
- Assemblare il sistema elettronico di perforazione dentale ad alta velocità. Collegare il pedale reostato elettronico all'unità di controllo e coprire il cavo del manipolo con un tubo barriera per superfici disinfettato sox. Applicare la fresa dentale rotonda sterile da 0,5 mm. Accendere il controller e impostarlo su un rapporto di trasmissione di 1:1 e un massimo di 30.000 giri/min.
- Fissare, con del nastro adesivo, il tubo flessibile della macchina all'isoflurano che termina con il cono del naso coperto da un tubo barriera superficiale disinfettato sox sullo stadio dello stereomicroscopio a fluorescenza.
- Accendere lo stereomicroscopio a fluorescenza e l'apparecchiatura ausiliaria e aprire il software di acquisizione delle immagini.
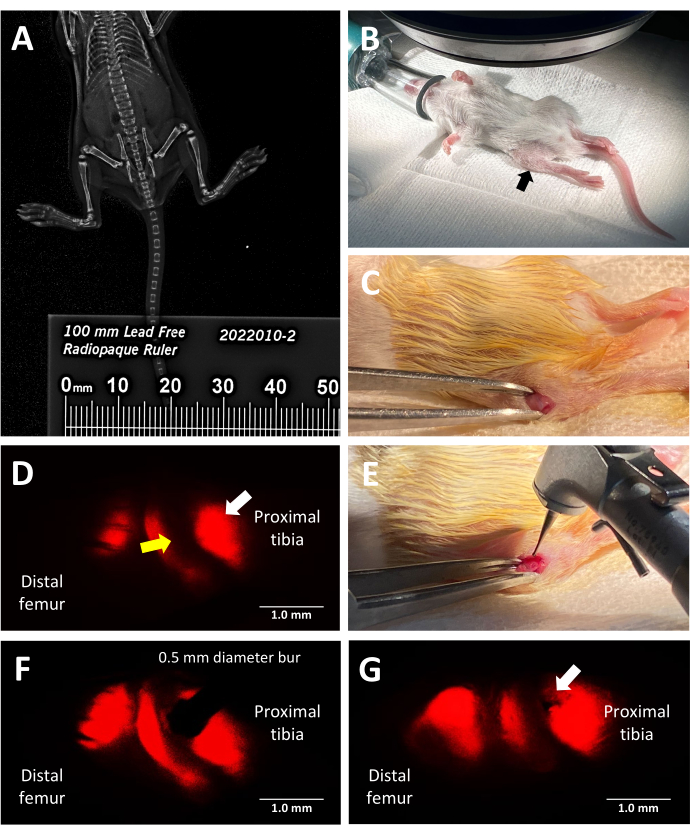
Figura 2: Passaggi chiave della procedura di lesione della cartilagine murina reporter fluorescente a trilinea. (A) Misurazione della lunghezza tibiale mediante imaging a raggi X con faxitrone utilizzando un righello radiopaco posizionato accanto ai topi nella cabina radiografica. (B) Posizione corretta di un topo anestetizzato per la chirurgia sotto uno stereomicroscopio a fluorescenza. Tibia prossimale indicata da una freccia nera. (C) Un esempio di incisione praticata per accedere alla cartilagine di accrescimento. (D) Microscopia stereoscopica a fluorescenza che illumina la zona ipertrofica della cartilagine di crescita (freccia bianca). La zona proliferativa adiacente è indicata da una freccia gialla. (E) Illuminazione a luce intensa del chirurgo che posiziona la fresa dentale da 0,5 mm contro la placca di accrescimento. (F) Il posizionamento preciso della fresa dentale è guidato dalla stereoscopia a fluorescenza nella zona ipertrofica. (G) Un esempio di difetto della placca di crescita simile a Salter-Harris di tipo II (freccia bianca). Barre della scala = 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.
3. Procedura di lesione della cartilagine di accrescimento prossimale della tibia
- Anestetizzare il topo nella camera di anestesia dell'isoflurano, regolando la concentrazione di isoflurano al 2-3% e la portata di ossigeno a 1 L/min. Attendere l'induzione di uno stato anestetico profondo, verificato da un test di pizzicamento delle dita dei piedi e dall'osservazione dei modelli respiratori.
- Somministrare metà della dose prescritta di buprenorfina per via sottocutanea immediatamente dopo la rimozione del topo dalla camera. Il dosaggio della buprenorfina è conforme al protocollo animale approvato.
- Applicare lubrificante oculare per proteggere gli occhi del topo dalla secchezza durante l'intervento chirurgico e trasferire il topo in posizione supina sul cono del naso della macchina per isoflurano sul tavolino dello stereomicroscopio (Figura 2B). Regolare il flusso di anestesia attraverso il cono nasale al 2% e la portata di ossigeno a 1 L/min.
- Disinfettare l'arto posteriore destro, la regione pelvica, l'aspetto anteriore dell'arto posteriore sinistro e la coda in sequenza con iodio povidone seguito da etanolo al 70%.
- Verificare una profondità stabile e continua dell'anestesia attraverso un ulteriore test di pizzicamento delle dita dei piedi e l'osservazione dei modelli respiratori prima dell'inizio dell'intervento chirurgico.
- In condizioni di luce intensa, utilizzare un bisturi #15 per creare un'incisione nella pelle appena sotto l'articolazione del ginocchio con una lunghezza iniziale di circa 5 mm, per rivelare l'estremità prossimale della tibia destra (Figura 2C). Usa le forbici per estendere il taglio, se necessario. Mantenere illesa la tibia controlaterale sinistra in modo che funga da controllo interno illeso.
- Eseguire una dissezione smussata verticale attraverso il muscolo sovrastante della tibia prossimale utilizzando il lato posteriore del bisturi #15, rimuovendo il tessuto molle per una chiara esposizione della cartilagine di crescita.
- Spegnere le luci della sala operatoria e selezionare il canale di fluorescenza corretto per illuminare la regione desiderata della piastra di crescita. I set di filtri necessari per l'imaging di ciascuno dei collageni fluorescenti sono Col 2 Ciano: ET436/20x (eccitazione), ET480/40 m (emissione), Col 10 mCherry: ET577/20x (eccitazione), ET640/40 m (emissione), Col 1 Topazio: ET500/20x (eccitazione), ET535/30 m (emissione). Posizionare il mouse per osservare la cartilagine di accrescimento tibiale prossimale (Figura 2D). Regolare l'apertura della pelle leggermente più prossimale e poi distale per assicurarsi che la cartilagine di accrescimento tibiale sia in vista e non la cartilagine di accrescimento del femore.
- Creare una lesione simile a quella di Salter-Harris di tipo II mentre si guarda attraverso l'oculare del microscopio posizionando la fresa dentale da 0,5 mm parallela all'asse tibiale al centro della zona della cartilagine di crescita ipertrofica, utilizzando un approccio laterale (Figura 2E, F). Per creare in modo riproducibile un difetto che imita una lesione di Salter-Harris di tipo II, mantenere l'arto parallelo alla superficie di lavoro in modo che la via di ingresso della fresa non si inclini nell'epifisi. Applicare pressione sul pedale del trapano per avviare la rotazione della fresa e premere delicatamente la fresa nella piastra di crescita, fermandosi prima che il difetto vada oltre il diametro della fresa (Figura 2G).
NOTA: Un secondo paio di mani che aiutano a stabilizzare l'arto del mouse è utile. - Irrigare il sito della lesione con una goccia di PBS sterile per rimuovere eventuali detriti.
- Confermare la profondità del difetto a 0,5 mm utilizzando una sonda parodontale.
4. Procedure post infortunio e chiusura
- Per la caratterizzazione del difetto a tempo zero, prelevare l'arto posteriore ferito e controllare l'arto prima della chiusura del tessuto. Seguire il prelievo dei tessuti e la preparazione per la successiva tomografia microcomputerizzata (microCT) e l'imaging crio-istologico nella sezione 6.
NOTA: Per gli esperimenti che prevedono l'impianto di una sostanza terapeutica nel difetto della cartilagine di crescita, il difetto stesso può ospitare solo un pezzo di biomateriale approssimativamente sferico e di 0,5 mm di diametro o 0,082 mm3 (0,082 μL) di volume. - Utilizzare una pinza sotto visualizzazione microscopica per inserire il biomateriale o iniettare un terapeutico liquido nel difetto all'interno della piastra di crescita. Utilizzare un volume maggiore di biomateriale o sostanza iniettata se il disegno dello studio non richiede che la terapia sia limitata al solo difetto.
- Riallineare con cura i bordi della pelle, assicurandosi che il materiale impiantato, se presente, rimanga saldamente all'interno del sito del difetto.
- Utilizzare tecniche di sutura interrotta con suture di acido poliglicolico 5-0 per sigillare efficacemente l'incisione cutanea.
- Detergere accuratamente le aree oltre la regione chirurgica dai residui di iodio povidone utilizzando tamponi con acqua sterile, facendo attenzione a evitare il contatto con la ferita e le aree circostanti.
- Rimuovere il mouse dal cono del naso dell'isoflurano sul tavolino del microscopio in una gabbia di recupero, posizionandolo lateralmente su una lettiera fresca sopra un termoforo.
- Osservare attentamente la frequenza respiratoria del topo per circa 5 minuti, somministrando la dose rimanente di buprenorfina per l'analgesia proprio quando gli effetti dell'anestesia con isoflurano diminuiscono, indicati da un aumento della frequenza respiratoria, ma prima dell'inizio della mobilità. Tenere il topo in una gabbia di recupero isolata fino a quando non dimostra le piene capacità deambulatorie, dopodiché, ricongiungendolo con la madre e i fratelli.
- Condurre ispezioni giornaliere per le prime 48 ore dopo l'operazione, seguite da valutazioni settimanali fino al punto di eutanasia. Concentrati sui segni di infezione, sull'efficacia della locomozione, sull'accessibilità al cibo e sull'integrità delle suture.
- Svezzare i topi all'ora standard (cioè 3 settimane di età).
5. Misure della lunghezza degli arti
- Sulla base dei punti temporali determinati dall'ipotesi sperimentale e dal disegno, anestetizzare i topi con isoflurano e condurre l'imaging a raggi X dell'intera lunghezza delle tibie lese e non danneggiate come mostrato nella Figura 2A e descritto nella sezione 1.4. I punti di riferimento adatti per effettuare misurazioni coerenti della lunghezza degli arti includono la parte superiore dell'epifisi tibiale e l'estremità distale della tibia all'articolazione tibioastragalica, come mostrato nella Figura 3.
NOTA: L'imaging viene utilizzato per valutare la lunghezza degli arti e le discrepanze nella lunghezza degli arti dovute alla lesione, nonché lo sviluppo del ponte osseo all'interno dei tessuti della cartilagine di crescita a specifici intervalli post-operatori.
6. Dissezione tissutale, fissazione, imaging microCT e inclusione
- Eutanasia del topo tramite asfissia da CO2 , preferibilmente utilizzando un sistema automatizzato di induzione di CO2 con una conferma di morte con un metodo alternativo come la lussazione cervicale.
- Isolare entrambi gli arti posteriori intatti e rimuovere la pelle e il muscolo dall'osso e dall'area capsulare del ginocchio in preparazione per l'analisi istologica e microCT.
- Prima di inserire gli arti posteriori nel fissativo, asportare accuratamente la rotula tagliandola con le forbici da micro-dissezione per facilitare la penetrazione del fissativo nella cavità del ginocchio. Utilizzare una siringa da insulina da 29 G per distribuire accuratamente la formalina tamponata fredda al 10% in tutte le aree della cavità del ginocchio. Grave la regione diafisaria del femore e della tibia per migliorare l'accesso fissativo allo spazio midollare. Mantenere il tessuto articolare in posizione completamente estesa all'interno del fissativo per 24-36 ore a 4 °C legandolo con una garza a un tassello sottile.
ATTENZIONE: La formalina è tossica e deve essere maneggiata in una cappa aspirante indossando adeguati dispositivi di protezione individuale.
- Prima di inserire gli arti posteriori nel fissativo, asportare accuratamente la rotula tagliandola con le forbici da micro-dissezione per facilitare la penetrazione del fissativo nella cavità del ginocchio. Utilizzare una siringa da insulina da 29 G per distribuire accuratamente la formalina tamponata fredda al 10% in tutte le aree della cavità del ginocchio. Grave la regione diafisaria del femore e della tibia per migliorare l'accesso fissativo allo spazio midollare. Mantenere il tessuto articolare in posizione completamente estesa all'interno del fissativo per 24-36 ore a 4 °C legandolo con una garza a un tassello sottile.
- Dopo 24-48 ore di fissazione in formalina a 4 °C, eseguire una microCT a raggi X ad alta risoluzione di campioni controlaterali e danneggiati mediante imaging microCT dopo aver trasferito i campioni al PBS, per la valutazione dello sviluppo del ponte osseo. Utilizza una dimensione del voxel di 6,0 μm, tempi di campionamento di 330.000 ms e impostazioni di energia di 55.000 V con un'intensità di 145 μA.
- Dopo l'imaging microCT e altre 24 ore di fissazione in formalina a 4 °C, sciacquare i campioni in 1X PBS per 3 x 5 minuti e quindi immergere i campioni in 10% di saccarosio in 1X PBS per 1 ora, 20% di saccarosio in 1X PBS per 1 ora e 30% di saccarosio in 1X PBS durante la notte. Utilizzare una siringa da insulina da 29 G riempita con soluzione di saccarosio per assicurarsi che la soluzione di saccarosio permei tutte le regioni della cavità del ginocchio. Trasferire in un congelatore a -80 °C se non incorporato dopo l'immersione notturna nel saccarosio per garantire il mantenimento del reporter GFP e dell'attività enzimatica tissutale.
- Rimuovere il tessuto muscolare residuo dalla regione articolare prima dell'incorporamento. Equilibrare il campione con un mezzo di crioinclusione durante la notte, facilitando la penetrazione del mezzo nella cavità del ginocchio.
- Visualizzate le immagini della microCT per determinare dove si trovano il difetto e il ponte osseo prima dell'incorporazione. Applicare uno strato sottile del mezzo di crioinclusione in un criomold e posizionare la tibia/femore/articolazione sezionata e ancora collegata in modo tale che la regione di interesse sia rivolta a 90° rispetto alla superficie del mezzo di inclusione.
NOTA: Questo orientamento consente al sezionamento di catturare la vista laterale del difetto creato lateralmente. Se il ponte osseo si trova vicino al bordo del difetto, questo orientamento eviterà anche la possibilità di perdere la regione di interesse durante le prime sezioni più spesse prelevate attraverso il tessuto. - Posizionare il criopoldo su ghiaccio secco fino a quando il mezzo di crioinclusione non si solidifica, fissando il campione. Continua a riempire il criopoldo con il mezzo mantenendolo su ghiaccio secco.
- Dopo aver fissato il campione, immergere il criomold in 2-metil-butano raffreddato con ghiaccio secco fino a completo congelamento. Dopo il congelamento, rimuovere l'eccesso di 2-metilbutano, avvolgere i criostampi nel cellophane e conservarli a -20 °C o -80 °C.
NOTA: Per una conservazione prolungata oltre 1-2 mesi in un mezzo di crioinclusione, si consiglia una temperatura di -80 °C per evitare l'essiccazione. La criosezione assistita da nastro e l'adesione delle sezioni ai vetrini sono descritte in precedenza23.
7. Imaging sequenziale, colorazione e reimaging
- Implementare una procedura sequenziale di imaging, colorazione e reimaging per facilitare il rilevamento e la colocalizzazione di più segnali biologici all'interno della stessa sezione di tessuto come descritto in precedenza23. In particolare per le sezioni della cartilagine di crescita dei topi reporter con collagene tricolore, si raccomandano i seguenti passaggi. Questo approccio ordinato garantisce una visualizzazione completa sia dei segnali molecolari che dei dettagli strutturali.
- Inizialmente, catturare segnali fluorescenti endogeni per i tre collageni nel primo ciclo di imaging.
- Applicare la colorazione blu di calceina e l'immagine per il tessuto mineralizzato23, seguita dalla colorazione dell'attività enzimatica della fosfatasi acida resistente ai tartrati (TRAP) e dall'imaging23.
NOTA: Sebbene i risultati della colorazione dell'attività enzimatica TRAP non siano visualizzati qui, questa fase di colorazione viene eseguita in quanto è essenziale per la rimozione del minerale prima dei risultati della colorazione Safranin O/Fast Green presentati nella sezione dei risultati rappresentativi. - Condurre la colorazione nucleare 4',6-diamidino-2-fenilindolo (DAPI) come descritto di seguito e quindi l'immagine.
- Posizionare i vetrini che sono stati sottoposti a imaging precedente in un barattolo Coplin contenente 1x PBS. Lasciarli immersi fino a quando i vetrini coprioggetti non si staccano dai vetrini. Una volta staccati, rimuovere e asciugare accuratamente i vetrini.
- Applicare la soluzione controcolorante DAPI sui vetrini, utilizzando una diluizione 1:1.000 di DAPI in una miscela di glicerolo al 50% e 1x PBS. Procedere con il processo di imaging dopo l'applicazione.
- Concludere con l'applicazione del colorante Safranin O/Fast Green per accentuare l'architettura dei tessuti e quindi l'immagine.
NOTA: Eseguire questa operazione come passaggio conclusivo per correlare le immagini cromogeniche con i segnali fluorescenti.- Preparare le soluzioni di ferro ematossilina di Weigert. Preparare la soluzione A sciogliendo 1 g di ematossilina in 100 mL di etanolo al 95% e la Soluzione B combinando 4 mL di soluzione di cloruro ferrico al 29%, 95 mL di acqua deionizzata e 1 mL di HCl concentrato. Mescolare parti uguali della soluzione A e B per creare la soluzione di ematossilina funzionante di Weigert, stabile per circa 4 settimane.
- Immergere gli scivoli in acqua deionizzata per 2 x 2 minuti per idratarli.
- Applicare la soluzione di ematossilina di Weigert per 5 minuti.
- Lavare gli scivoli in acqua di rubinetto per 5 minuti, quindi brevemente in acqua deionizzata per 1 minuto.
- Colorare con soluzione Fast Green allo 0,2% (0,2 g di Fast Green FCF in 100 mL di acqua deionizzata) per 2 min.
- Sciacquare brevemente con acido acetico all'1% per 1 minuto.
- Colorare con soluzione di Safranina O allo 0,1% (0,1 g di Safranina O in 100 mL di acqua deionizzata) per 1 min.
- Sciacquare in acqua deionizzata fino a ottenere un colore visivamente equilibrato, circa 5 minuti.
- Montare i vetrini in glicerolo al 30% in acqua deionizzata (evitare la PBS) e procedere immediatamente all'imaging per prevenire la diffusione del colore dal tessuto. Per accentuare le celle della zona di riposo della cartilagine di accrescimento, condurre l'immagine con un filtro Cy5: ET640/30x (EX), ET690/50 m (EM).
Risultati
Questo protocollo utilizza topi reporter fluorescenti trilineari per indurre con precisione un difetto della placca di crescita laterale nella tibia prossimale, sfruttando la fluorescenza rossa intrinseca emessa dal collagene di tipo X per la guida chirurgica. La vista che il chirurgo ha mentre guarda attraverso l'oculare dello stereomicroscopio con il set di filtri mCherry è mostrata nella Figura 2D. La fluorescenza nativa di tipo X consente al chirurgo di posizionare la fresa nella zona ipertrofica e creare una lesione che imita un tipo comune di lesione della cartilagine di accrescimento che porta a un ponte osseo (Figura 2F). La fluorescenza sotto il canale rosso è la più brillante e, quindi, consigliata per l'uso durante il posizionamento della fresa. In alternativa, la creazione di difetti potrebbe essere guidata utilizzando altri colori della fluorescenza nativa dei topi tripli transgenici se l'obiettivo dell'esperimento è studiare lesioni in altre zone della cartilagine di crescita rispetto alla zona ipertrofica e alla regione calcificata adiacente.
La creazione di un difetto simile a Salter-Harris di tipo II nella zona ipertrofica della cartilagine di accrescimento e del tessuto osseo inferiore adiacente, utilizzando una fresa dentale di 0,5 mm di diametro, è stata convalidata attraverso microCT e crio-istologia delle tibie prossimali danneggiate (tempo 0) rispetto ai controlli laterali illesi in N = 3 topi (Figura 4). I difetti erano difficili da vedere nelle immagini microCT 3D, ma erano rilevabili nelle sezioni trasversali 2D (Figura 3A, B, E, F). La Figura 3G mostra la distribuzione delle cellule ossee produttrici di collagene di tipo I (fluorescenza verde), dei condrociti proliferativi produttori di collagene di tipo II (fluorescenza ciano) e dei condrociti ipertrofici produttori di collagene di tipo X. Nell'immagine del topo ferito (Figura 4G), c'è una rottura della zona ipertrofica, dello strato provvisoriamente calcificato e di parte dell'osso di nuova formazione rispetto al controllo con la zona proliferativa solo leggermente disturbata. La colorazione Safranin O/Fast Green (Figura 4H) illustra al meglio la posizione del difetto all'interno della cartilagine di crescita danneggiata poiché tutte le cellule sono chiaramente visibili.
L'analisi a raggi X fornisce alcune informazioni sui topi vivi per quanto riguarda l'impatto di questo tipo di lesione della cartilagine di crescita sulla lunghezza della tibia e sulla formazione del ponte osseo nel tempo (Figura 3). L'imaging comparativo tra tibie illese (Figura 3A) e ferite (Figura 3B), prelevato prima dell'intervento chirurgico e 3 settimane dopo l'intervento, rivela una grande quantità di crescita degli arti, assottigliamento delle placche di crescita e una distinta regione opaca che si è sviluppata nell'area della cartilagine di crescita lesa a 3 settimane. Questa opacità all'interno della cartilagine di crescita non è presente nella controparte illesa né nei topi prima dell'intervento chirurgico. Il faxitron è quindi un modo per osservare i cambiamenti patologici indotti dalla lesione nei topi vivi, come la formazione di un ponte osseo e i cambiamenti nella lunghezza degli arti.
L'imaging MicroCT delle ossa sezionate offre una visualizzazione dettagliata della formazione del ponte osseo all'interno delle placche di crescita danneggiate tre settimane dopo l'intervento chirurgico (Figura 5). Come si vede nelle immagini di sei diversi topi feriti mostrati nella Figura 5, c'è uno sviluppo costante del ponte osseo in tutti i topi. Utilizzando il software Scanco Medical, il volume del ponte osseo è stato calcolato esaminando ciascuna sezione della placca di crescita tibiale prossimale, delineando l'area del ponte osseo (Figura 5B) con lo strumento di selezione e quindi integrando ciascuna area della sezione nell'intero volume della placca di crescita per ottenere il volume totale24. Il volume del ponte osseo calcolato in questo modo era 0,0761 mm3 ± 0,0246 (media ± deviazione standard, N = 6). La maggior parte dei ponti ossei si forma vicino al centro della cartilagine di accrescimento nonostante l'approccio laterale, che ferisce il bordo esterno e il centro della cartilagine di accrescimento. Questo fenomeno può essere attribuito al fatto che le cellule staminali mesenchimali (MSC) del midollo osseo, piuttosto che del pericondrio, sono responsabili della formazione del ponte osseo25.
In questi topi transgenici tricolori, l'analisi crio-istologica della cartilagine di crescita danneggiata è arricchita dalla fluorescenza del collagene nativo (Figura 6). Rivela la complessa interazione tra cellule ossee e condrociti nel sito della lesione. Le immagini MicroCT mostrate nella Figura 6J,K sono state fornite al tecnico istologo per guidare l'inclusione e il sezionamento. Le cellule ossee produttrici di collagene di tipo I sono visibili nella Figura 6L, O, P (fluorescenza verde), mentre i condrociti proliferativi produttori di collagene di tipo II sono visibili nella Figura 6L, O, Q (fluorescenza ciano). I condrociti ipertrofici che producono collagene di tipo X sono visibili nella Figura 6L,O,R (fluorescenza rossa). Questo approccio a fluorescenza multicolore consente un esame dettagliato della differenziazione dei condrociti post-operatoria all'interno dell'area del ponte osseo su uno sfondo di tessuto mineralizzato. La colorazione DAPI è stata utilizzata per confermare la distribuzione di tutti i tipi di cellule all'interno dell'area della cartilagine di crescita (Figura 6M). La colorazione Safranin O/Fast Green dimostra l'organizzazione composita e strutturale della cartilagine e dell'osso all'interno della cartilagine di crescita lesionata (Figura 6N). L'imaging di queste sezioni colorate con un set di filtri Cy5 illumina notevolmente le cellule della zona di riposo all'interfaccia tra l'osso epifisario e la cartilagine.
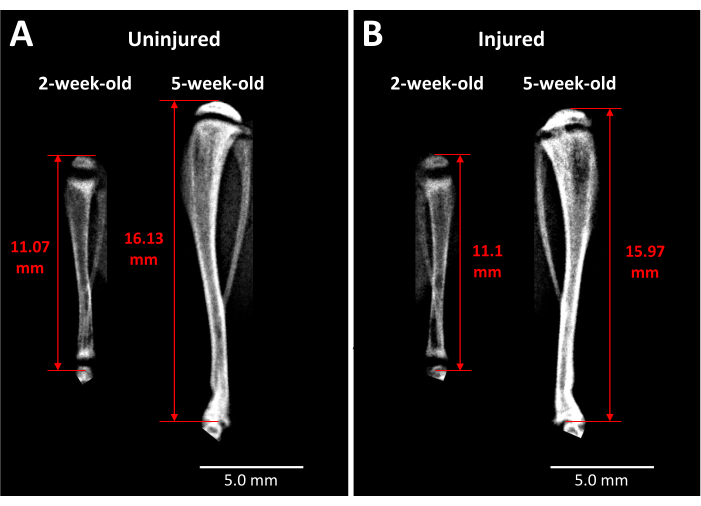
Figura 3: Immagini radiografiche del controllo controlaterale e delle tibie di topo ferite. (A) Le immagini a raggi X della tibia di controllo controlaterale vengono scattate appena prima della lesione quando i topi hanno 2 settimane e a 3 settimane dopo l'intervento chirurgico quando i topi hanno 5 settimane, dimostrando l'entità della crescita che si verifica durante questo periodo. (B) Tibia ferita dallo stesso topo negli stessi punti temporali di cui al punto (A). I punti di riferimento utilizzati per le misurazioni della lunghezza della tibia sono l'apice della testa della tibia prossimale fino all'estremità della tibia all'altezza dell'articolazione della caviglia (frecce rosse a due punte). Il ponte osseo opaco è visibile nella cartilagine di crescita della tibia prossimale lesionata a 5 settimane. Barre della scala = 5,00 mm. Clicca qui per visualizzare una versione più grande di questa figura.
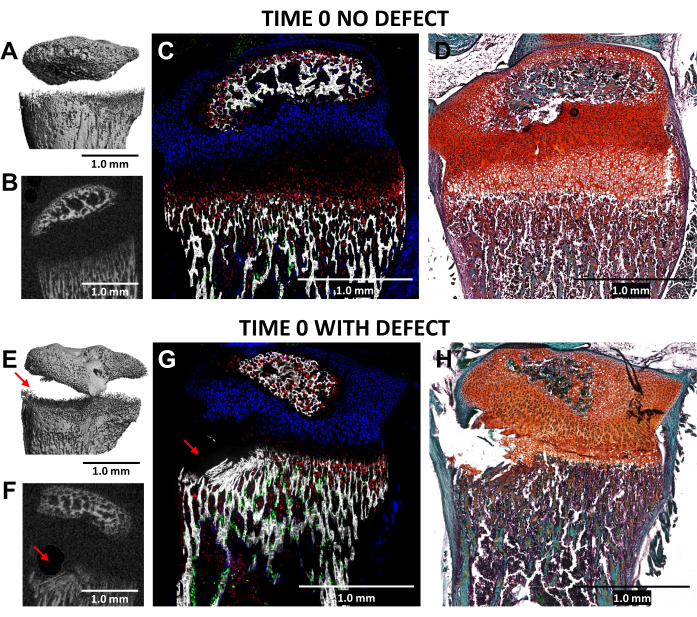
Figura 4: MicroCT e immagini istologiche del controllo controlaterale a tempo zero e tibie prossimali di topo ferite. (A,E) e (B,F) raffigurano viste microCT 3D e 2D trasversali, con il difetto indicato da frecce rosse in (E) e (F). (C,G) Immagini crio-istologiche combinate in composito che fondono tre strati di fluorescenza innata con uno strato di tessuto mineralizzato. Le cellule verdi (Col3.6GFPtpz) sono le cellule ossee produttrici di collagene di tipo I, le cellule di colore blu ciano (Col2A1GFPcyan) sono condrociti proliferativi produttori di collagene di tipo II e i globuli rossi (Col10A1RFPchry) sono condrociti ipertrofici che producono collagene di tipo X. (D,H) Safranina O/Colorazione Fast Green della stessa regione di (C) e (G). Barre della scala = 1,0 mm. Clicca qui per visualizzare una versione più grande di questa figura.
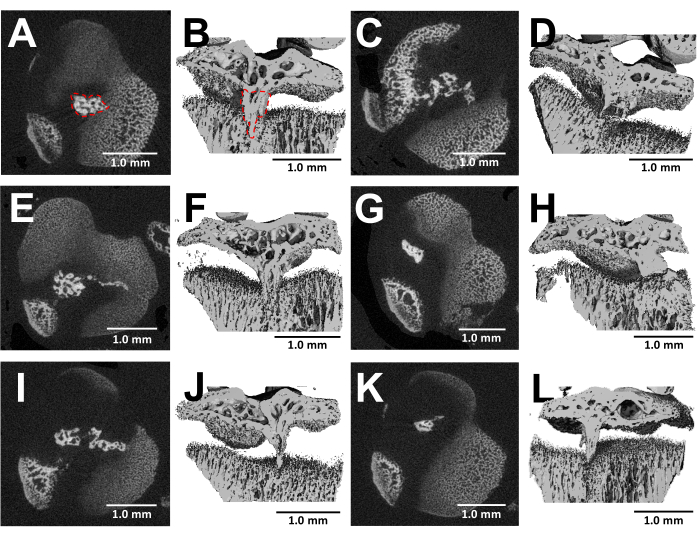
Figura 5: Immagini MicroCT dei ponti ossei formati da questo protocollo. (A,C,E,G,I,K) Sezioni trasversali della placca di crescita tibiale prossimale di sei diversi topi a 3 settimane dalla creazione del difetto della fresa. Ponte osseo delineato da una linea tratteggiata rossa in (A). (B,D,F,H,J,L) Ricostruzioni 3D con un piano longitudinale tagliato. Ponte osseo delineato da una linea tratteggiata rossa in (B). Barre della scala = 1,0 mm. Clicca qui per visualizzare una versione più grande di questa figura.
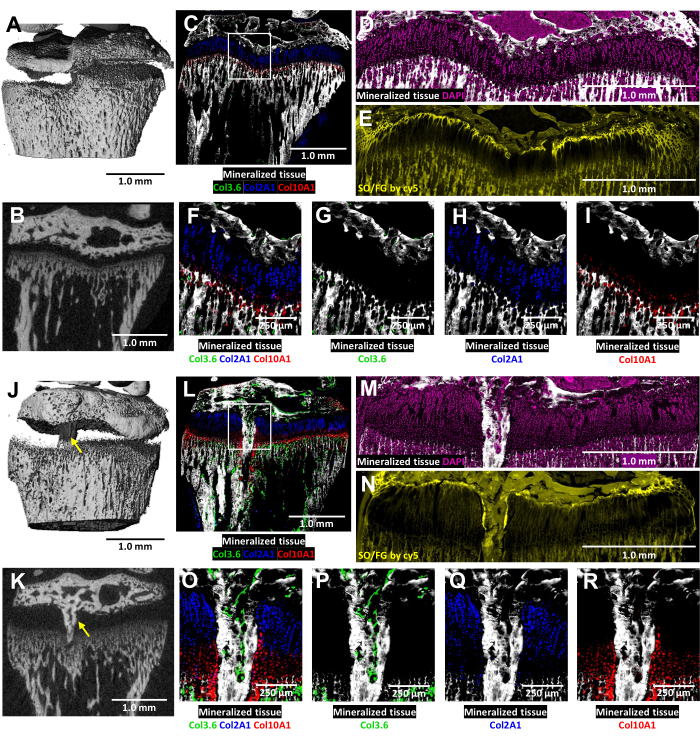
Figura 6: MicroTC e immagini istologiche del controllo controlaterale e della tibia prossimale di topo lesionata con formazione di ponti ossei. (A,J) e (B,K) raffigurano viste microCT 3D e 2D trasversali, con il ponte osseo indicato da frecce gialle in (J) e (K). (C,L) Immagini crio-istologiche combinate in composito che fondono tre strati di fluorescenza innata con uno strato di tessuto mineralizzato. Le cellule verdi (Col3.6GFPtpz) sono le cellule ossee produttrici di collagene di tipo I, le cellule di colore blu ciano (Col2A1GFPcyan) sono condrociti proliferativi produttori di collagene di tipo II e i globuli rossi (Col10A1RFPchry) sono condrociti ipertrofici che producono collagene di tipo X. La casella bianca indica l'ingrandimento maggiore mostrato nei pannelli F e O. (D,M) Il tessuto mineralizzato e la colorazione DAPI nell'area della placca di crescita dei pannelli C e L. (E,N) Colorazione Safranin O/Fast Green della stessa regione di (D) e (M) scansionata con fluorescenza cy5. (F,O) Un ingrandimento maggiore dell'area della piastra di crescita nell'immagine unita dei pannelli C e L. (G-I,P-R) Singoli canali della fluorescenza nativa mostrati con uno sfondo tissutale mineralizzato. Barre della scala = 1,0 mm (A-E) e (J-N), = 250 μm in (F-I) e (O-R). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'uso innovativo di topi reporter in collagene tricolore consente la creazione di difetti della cartilagine di crescita con una dimensione e una posizione predeterminate, migliorando significativamente l'accuratezza dei modelli sperimentali murini per le lesioni della cartilagine di crescita. Date le piccole dimensioni dei topi di 2 settimane, è fondamentale utilizzare una piccola fresa da 0,5 mm per creare la lesione per evitare di indebolire l'arto e causare una frattura a tutto spessore. Il chirurgo deve anche applicare una pressione sufficiente quando crea il difetto per evitare di perforare troppo in profondità l'osso per lo stesso motivo. L'uso della periosonda è fondamentale per confermare una profondità costante della lesione.
Come per qualsiasi intervento chirurgico, è importante confermare un'adeguata profondità di anestesia, confermata da un pizzico occasionale del dito del piede e la sterilità viene mantenuta per tutto il tempo. Un altro punto chirurgico importante è che la dissezione smussata con un intagliatore è stata descritta perché evita di danneggiare i tessuti molli e aiuta a garantire che i topi siano in grado di deambulare immediatamente dopo il recupero dall'anestesia per raggiungere la madre topo per nutrimento e comfort. Nella nostra esperienza, le ferite chiuse con punti di sutura sono rimaste chiuse con successo e non sono necessarie clip per le ferite. Si raccomanda un intervento chirurgico sui topi a 2 settimane di età per imitare al meglio il bambino che subisce fratture della cartilagine di crescita. Uno svantaggio di questo protocollo è che, data la natura imprevedibile del parto, l'uso di questo modello murino richiede la disponibilità del chirurgo con breve preavviso.
Per quanto riguarda il posizionamento della fresa per creare il difetto, il protocollo descrive la creazione della lesione utilizzando un set di filtri rossi mCherry/Texas che illumina la zona ipertrofica all'interno della placca di crescita a causa della luminosità della fluorescenza del collagene X. Per garantire che la lesione si crei all'interno della cartilagine di accrescimento tibiale, è utile spostare leggermente l'apertura dei tessuti molli a sinistra e a destra per confermare che la cartilagine di accrescimento tibiale prossimale sia in vista e non il femore. Il passaggio tra i canali del set di filtri per illuminare la zona proliferativa dei condrociti o le sezioni ossee adiacenti è utile per confermare un posizionamento accurato rispetto alla posizione della zona proliferativa e delle sezioni ossee adiacenti.
Mentre la zona dei condrociti proliferativi e l'osso epifisario e metafisario possono essere distinti al microscopio a fluorescenza nei topi vivi, il valore reale dei reporter di collagene di tipo II e di tipo I si realizza durante l'analisi istologica della cartilagine di crescita. Data la natura acquosa dei processi crio-istologici, i tradizionali protocolli di precipitazione del colorante cromogenico non sono adatti a causa del potenziale disallineamento del colore con l'imaging fluorescente causato dalle fasi di disidratazione. Sebbene il protocollo acquoso produca modelli di colorazione simili a quelli delle sezioni di paraffina, l'imaging rapido post-colorazione è essenziale per prevenire la diffusione del colorante dal tessuto. L'utilizzo del 30% di glicerolo in acqua distillata come mezzo di montaggio può rallentare questa diffusione, consentendo la colorazione cromogenica multipla sulla stessa sezione, compresa la cartilagine con Safranin O/Fast Green.
Il processo di ossificazione endocondrale è chiaramente visibile con condrociti rossi che rivestono il ponte osseo in evoluzione (Figura 6). L'uso aggiuntivo di tecniche di immunoistochimica, per le quali sono disponibili molti anticorpi murini, potrebbe migliorare ulteriormente gli studi meccanicistici condotti in questi topi transgenici. Nel complesso, la combinazione di faxitroni, microCT e tecniche di imaging crio-istologico in questo modello murino transgenico offre una comprensione completa dei cambiamenti macroscopici e microscopici che si verificano in risposta alle lesioni della cartilagine di crescita, aprendo la strada a futuri interventi terapeutici per mitigare tali esiti avversi. Ulteriori manipolazioni genetiche di questi topi transgenici potrebbero essere fatte per consentire studi di tracciamento del lignaggio per comprendere l'origine delle cellule che sono temporalmente e spazialmente coinvolte nella guarigione. La sperimentazione sui topi con ulteriori modifiche consentirebbe lo studio delle malattie della cartilagine come l'osteocondroma, una crescita eccessiva di cartilagine e osso vicino alla cartilagine di crescita.
La coerenza del nostro modello è dimostrata dalla formazione riproducibile di ponti ossei in tutti i topi senza la necessità di scartare alcun topo dal gruppo a causa di lesioni della cartilagine articolare. Questo è un miglioramento rispetto ai modelli precedenti che si avvicinavano alla cartilagine di crescita da una finestra corticale sotto la cartilagine di crescita e inclinavano uno strumento affilato o una fresa verso l'alto verso la cartilagine di crescita e occasionalmente superavano la cartilagine articolare. Un'ulteriore lesione della cartilagine articolare non imita le lesioni della cartilagine di accrescimento che si verificano comunemente nei bambini. La lesione più precisa di questo modello animale riduce il numero di topi necessari per esperimento e questo è un altro miglioramento. L'uso di topi transgenici consente al ricercatore di concentrare la lesione su sottosezioni della cartilagine di crescita, come l'area ipertrofica/provvisoriamente calcificata o l'area epifisi/zona di riposo/zona proliferativa, senza intaccare la cartilagine articolare. Tuttavia, un limite di questo modello è la variabilità del volume del ponte osseo, che può differire fino al 30% tra gli animali feriti. Di conseguenza, rilevare un effetto clinicamente significativo sulla formazione del ponte osseo richiede ancora un gran numero di animali per raggiungere la rilevanza statistica.
I vantaggi di un modello murino come descritto qui rispetto ai modelli di lesioni della cartilagine di crescita di ratto o coniglio precedentemente pubblicati 7,9,10,14, includono un numero inferiore di animali utilizzati, riduzione dei costi, una dimensione di replica efficiente grazie alla formazione riproducibile della barra ossea, un intervallo di tempo di studio più breve e un posizionamento più preciso della lesione grazie all'imaging dal vivo dei topi transgenici tripli. Sebbene non sia discusso in dettaglio, questo modello murino può essere utilizzato per testare impianti di ingegneria tissutale o biomateriali che forniscono fattori di crescita. Una notevole limitazione di questo metodo murino è che la dimensione di un impianto utilizzato per somministrare farmaci terapeutici o cellule è limitata al volume del difetto di circa una sfera di 0,5 mm di diametro. Solo i modelli animali più grandi possono ospitare il volume di materiale di prova che verrebbe utilizzato nei pazienti umani. Il difetto della fresa creato in questo protocollo non ha la stessa geometria di una frattura sottile e quindi differisce dalle lesioni umane reali. Ciononostante, i vantaggi di questo modello murino sono molteplici, e l'approccio laterale evita di danneggiare la cartilagine articolare che si verificherebbe quando ci si avvicina alla cieca sopra o sotto la placca di accrescimento in linea con l'asse lungo tibiale. Questa metodologia rappresenta un salto sostanziale nella ricerca sulle lesioni della cartilagine di crescita, fornendo un metodo dettagliato e riproducibile per indagare la patologia e valutare nuove strategie terapeutiche.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da una sovvenzione del National Institutes of Health, del National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) 1R21AR079153 e da una sovvenzione del programma di miglioramento della ricerca (REP) dell'Università del Connecticut. Gli autori desiderano ringraziare l'assistenza di Renata Rydzik della struttura MicroCT Imaging Core dell'Università del Connecticut.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
Riferimenti
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon