Method Article
Modèle murin transgénique tricolore pour l’étude des lésions de la plaque de croissance
Dans cet article
Résumé
Ce protocole décrit un modèle murin amélioré pour les lésions des plaques de croissance osseuse chez les adolescents. En utilisant des souris transgéniques avec des rapporteurs fluorescents tri-lignées pour les types de collagène I, II et X, les matrices primaires associées à trois substrats différents de la plaque de croissance, le placement des lésions est guidé par la fluorescence native au microscope.
Résumé
Les plaques de croissance du cartilage dans les os des enfants permettent l’allongement des membres mais sont faibles par rapport à l’os, ce qui les rend sujets à la fracture lorsque les os sont surchargés. De meilleurs traitements pour les plaques de croissance gravement fracturées sont nécessaires, car la réponse à la blessure est un pont osseux qui fusionne prématurément la plaque de croissance, entraînant un retard de croissance et/ou des membres tordus. Les modèles murins de lésions des plaques de croissance sont avantageux pour les études mécanistes, mais sont difficiles car il est difficile de visualiser et de blesser avec précision les petites plaques de croissance chez les jeunes souris. Nous décrivons ici un modèle amélioré de lésions de la plaque de croissance utilisant des souris transgéniques avec des rapporteurs fluorescents à trois lignées pour les types de collagène I, II et X.
Ces souris présentent une fluorescence native associée aux trois substrats primaires de la plaque de croissance. Une lésion de la plaque de croissance similaire à une blessure de type II de Salter-Harris est créée de manière reproductible avec une fraise en utilisant la section hypertrophique de la plaque de croissance comme référence lors de l’imagerie en direct sous guidage par stéréo-microscopie à fluorescence. L’analyse histologique figée de la fluorescence native simplifie l’évaluation de la réponse cellulaire à la lésion. Cette méthodologie représente un bond substantiel dans la recherche sur les lésions des plaques de croissance, fournissant une méthode détaillée et reproductible pour l’étude de la pathologie et l’évaluation de nouvelles stratégies thérapeutiques.
Introduction
Les plaques de croissance osseuse jouent un rôle central dans la croissance longitudinale des os longs pendant l’enfance et l’adolescence1. Située aux extrémités des os longs, la plaque de croissance comprend plusieurs zones, les chondrocytes étant les principaux composants cellulaires responsables de la production et du maintien de cette zone de croissance dynamique. L’ossification endochondrale de la plaque de croissance se produit pour allonger et dilater les os par une progression séquentielle de la prolifération des chondrocytes, de l’hypertrophie, de l’apoptose, de l’invasion des vaisseaux sanguins, du recrutement de cellules ostéoprogénitrices et, enfin, de la formation osseuse2. Étant donné que la plaque de croissance est relativement plus molle que l’os, elle est très sensible à la fracture lorsque les os sont surchargés pendant les sports ou d’autres activités. La classification de Salter-Harris décrit cinq types distincts de lésions de la plaque de croissance3. La fracture de type II à travers la zone hypertrophique de la plaque de croissance et le tissu osseux inférieur adjacent est la plus répandue4. Un pont osseux se forme souvent en réponse à des lésions de la zone hypertrophique ou de l’os adjacent et conduit à une fusion prématurée des sections d’os longs adjacentes5. Les ponts osseux empêchent l’expansion normale de la plaque de croissance. À l’heure actuelle, aucun traitement préventif n’est disponible pour la formation du pont osseux, et certains ne sont pas traités en fonction de l’âge du patient et de la taille et de l’emplacement du pont osseux6. Lorsque la malformation d’un membre est grave, les options chirurgicales comprennent l’ablation suivie de l’implantation de matériaux interpositionnels comme la graisse ou le caoutchouc de silicone ou des procédures d’ostéotomie corrective et d’allongement osseux ; Pourtant, un pont osseux peut encore se reformer6. Des recherches supplémentaires sont nécessaires pour prévenir la formation de ponts osseux et pour améliorer les résultats des enfants atteints de lésions de la plaque de croissance osseuse.
Plusieurs modèles animaux ont été établis pour explorer les mécanismes sous-jacents et développer de nouvelles stratégies pour prévenir l’altération du pont osseux des plaques de croissance après une blessure 7,8,9,10,11,12. Ces modèles animaux se concentrent souvent sur la plaque de croissance tibiale proximale et la plaque de croissance distale du fémur comme principal site de blessure, étant donné que c’est généralement là que les blessures humaines se produisent. Les défauts osseux de l’animal sont créés soit par une approche latérale semblable à une voie de fracture réelle, soit par une approche par le haut ou au-dessous de la plaque de croissance menant à un trou de forage central dans la plaque de croissance. Dans un modèle de rat précédemment rapporté, un défaut de plaque de croissance est créé en insérant une fraise dentaire à travers une fenêtre corticale dans la tige médiane du tibia et en perçant vers le haut à travers la moelle vers l’articulation du genou pour blesser centralement la plaque de croissance 7,13. Alternativement, un modèle de souris récent utilise une approche latérale avec une aiguille de petit calibre pour créer une piste d’aiguille plane à travers la plaque de croissance8. Dans un modèle de rat largement utilisé, le défaut est créé dans la plaque de croissance du fémur distal en perçant le cartilage articulaire entre les condyles 9,14. Chez les animaux plus grands comme les lapins et les moutons, les défauts de la plaque de croissance ont été induits latéralement directement dans le tibia proximal et le fémur distal en perçant ou en coupant dans la plaque de croissance ou en s’approchant par le bas et en créant un défaut central laissant les bords de la plaque de croissance inaltérés 10,11,12,15.
Les modèles murins pour les lésions de la plaque de croissance sont avantageux pour les études mécanistes qui peuvent être réalisées avec des souris génétiquement modifiées, telles que les études de traçage de la lignée des cellules souches8. Cependant, un défi important dans les modèles animaux murins ou rats est d’obtenir des lésions cohérentes et précises à une sous-région particulière de la plaque de croissance. Il est nécessaire de lécher des zones particulières de la plaque de croissance et de l’os adjacent pour imiter l’une des voies de fracture cliniquement pertinentes décrites par les classifications de Salter-Harris. Les défis rencontrés jusqu’à présent dans les modèles de rongeurs sont principalement dus à l’absence d’un moyen visuel d’identifier les substrats de la plaque de croissance lors de la création chirurgicale de la blessure. Ce protocole décrit une technique raffinée pour créer des défauts de plaque de croissance dans des substrats ciblés de la plaque de croissance murine en utilisant des souris transgéniques triples qui expriment des rapporteurs fluorescents de collagène I, II et X 16,17,18. La fluorescence de couleur différente de ces collagènes dans chacune des zones primaires de la plaque de croissance permet une discrimination visuelle des différentes sections de la plaque de croissance sous un stéréomicroscope à fluorescence lors de la création chirurgicale de la lésion de la plaque de croissance. L’utilisation de ces souris transgéniques permet une précision sans précédent des blessures chez une jeune souris à un stade de développement comparable à celui des enfants blessés.
Protocole
La recherche a été réalisée dans le respect des directives institutionnelles. Toutes les procédures animales ont été approuvées par le comité institutionnel de soin et d’utilisation des animaux (IACUC) du centre de santé de l’Université du Connecticut avant le début des travaux. Un aperçu du protocole est décrit dans le schéma de la figure 1 .

Figure 1 : Aperçu du protocole de lésion de la plaque de croissance chez les souris rapporteures de collagène tricolore. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Reproduction de souris et préparation à la chirurgie
- Élevez des souris rapporteures de collagène transgéniques tricolores qui expriment Col1a1-GFPTpz, Col2a1-CFP et Col10a1-mCherry 16,17,18,19,20,21 selon les procédures d’élevage standard pour obtenir des chiots pour la chirurgie âgés de 2 semaines (± 1 jour). Vérifiez l’expression du triple transgène en génotypage d’un fragment de l’extrémité de la queue au microscope à fluorescence. N’utilisez que les souris qui sont positives pour les trois couleurs afin de maximiser les avantages du système rapporteur lors de l’analyse histologique ultérieure.
REMARQUE : Cet âge de 2 semaines (± 1 jour) est choisi parce que leurs plaques de croissance osseuse sont à un stade de développement similaire à celui de l’adolescent humain22. Ce protocole s’applique aux deux sexes de souris. - Le jour de l’intervention chirurgicale ou la veille, identifiez de manière unique chaque souris utilisée pour l’opération à l’aide d’un poinçon d’oreille après avoir désinfecté l’oreille et le poinçon d’oreille avec des tampons antiseptiques à base d’alcool, pesez chaque souris et notez la valeur.
- Rasez tout le postérieur droit de la hanche au pied à l’aide d’une tondeuse électrique pendant que la souris est sous l’effet de l’anesthésie à l’isoflurane. Pour induire l’anesthésie chez la souris, utilisez un mélange d’isoflurane (2-3%) et d’oxygène à 100%, administré à un débit de 1 L/min dans une chambre d’induction de 1-2 L. Retirez la souris et vérifiez que la profondeur de l’anesthésie est suffisante avec un pincement des orteils qui ne doit pas faire bouger la souris.
REMARQUE : Cette profondeur d’anesthésie durera suffisamment longtemps pour effectuer le rasage sans nécessiter de cône nasal d’anesthésie. - Utilisez l’imagerie par rayons X avec un réglage de puissance de 26 kV (800 mA) pour capturer des images tibiales chez des souris vivantes sous anesthésie induite par l’isoflurane afin d’enregistrer la longueur initiale des membres.
- Avant de placer les souris dans l’armoire à rayons X, induire un état d’anesthésie profond à l’aide d’un mélange d’isoflurane (2-3%) et d’oxygène à 100%, administré à un débit de 1 L/min dans une chambre d’induction de 1-2 L.
- Placez trois souris anesthésiées à la fois en parallèle sur leur estomac dans l’armoire de radiologie à une hauteur d’étagère qui permet d’obtenir une image incluant les trois souris. Écartez les pattes pour que les os tibiaux ne soient pas obscurcis sous la souris. Pour une meilleure précision de mesure, placez une échelle radio-opaque près de la souris pendant l’imagerie (Figure 2A).
- Remettez les souris préparées dans leur cage d’hébergement avec la souris mère pour attendre les interventions chirurgicales ultérieures.
2. Préparation du matériel chirurgical et zone de travail stérile
- Stérilisez les articles suivants : 10 à 20 compresses de gaze, tampons applicateurs à bout de coton, fraises dentaires (0,5 mm de diamètre), pièces à main dentaires, pinces Graefe, pinces hémostatiques incurvées pour moustiques, ciseaux fins incurvés, porte-aiguilles, sondes parodontales et sculpteurs discoïdes dentaires cléoïdes.
- Rassemblez les fournitures stériles supplémentaires nécessaires : une suspension injectable de buprénorphine, des aiguilles de 20 g, des seringues de 1 ml, des draps de serviette, des sutures 5-0 non teintes, tressées, enduites, vicryl, de la povidone iodée, du sérum physiologique tamponné au phosphate, des tampons antiseptiques à l’alcool, des scalpels #15, des gants chirurgicaux, un tube de barrière de surface environnementale sox, un lubrifiant pour les yeux, un spray d’éthanol à 70 %. Mettez sous tension un stérilisateur à billes de verre pour une stérilisation supplémentaire des articles pendant l’opération et le coussin chauffant électrique sous une cage à souris propre avec une litière stérilisée.
- Nettoyez et stérilisez la platine du stéréomicroscope à fluorescence, les surfaces adjacentes et le support de l’instrument chirurgical avec de l’éthanol à 70 %. Couvrez ces zones qui deviendront l’espace de travail chirurgical avec des champs de serviette stériles.
- Assemblez le système de forage dentaire électronique à grande vitesse. Connectez la pédale électronique à l’unité de commande et couvrez le cordon de la pièce à main avec un tube de barrière de surface désinfecté sox. Fixez la fraise dentaire ronde stérile de 0,5 mm. Allumez la manette et réglez-la sur un rapport d’entraînement de 1:1 et un maximum de 30 000 tr/min.
- Fixez, à l’aide de ruban adhésif, le tuyau flexible de la machine à isoflurane qui se termine par le cône nasal recouvert d’un tube barrière de surface désinfecté sox sur la platine du stéréomicroscope à fluorescence.
- Mettez sous tension le stéréomicroscope à fluorescence et l’équipement auxiliaire, puis ouvrez le logiciel d’acquisition d’images.
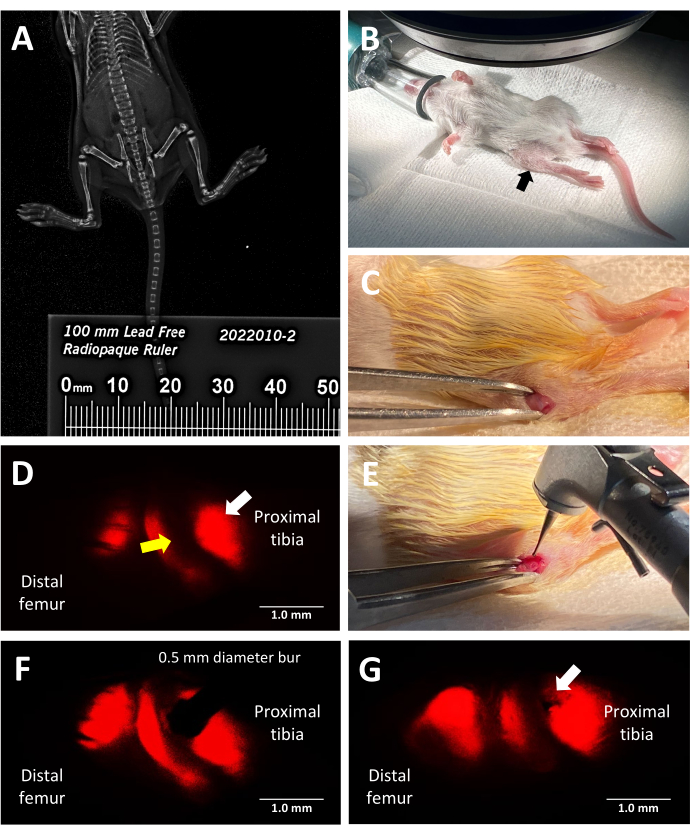
Figure 2 : Étapes clés de la procédure de lésion de la plaque de croissance murine rapporteure fluorescente trilineage. (A) Mesure de la longueur tibiale par imagerie par rayons X par faxitron à l’aide d’une règle radio-opaque placée le long des souris dans la cabine de radiographie. (B) Position correcte d’une souris anesthésiée pour la chirurgie sous un stéréomicroscope à fluorescence. Tibia proximal indiqué par une flèche noire. (C) Un exemple d’incision pratiquée pour accéder à la plaque de croissance. (D) Stéréomicroscopie à fluorescence éclairant la zone hypertrophique de la plaque de croissance (flèche blanche). La zone proliférative adjacente est indiquée par une flèche jaune. (E) Éclairage à la lumière vive du chirurgien plaçant la fraise dentaire de 0,5 mm contre la plaque de croissance. (F) Le placement précis de la fraise dentaire est guidé par stéréomicroscopie à fluorescence dans la zone hypertrophique. (G) Un exemple d’un défaut de plaque de croissance de type Salter-Harris de type II (flèche blanche). Barres d’échelle = 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
3. Procédure de lésion de la plaque de croissance du tibia proximal
- Anesthésie la souris dans la chambre d’anesthésie à l’isoflurane, en ajustant la concentration d’isoflurane à 2-3 % et le débit d’oxygène à 1 L/min. Attendez l’induction d’un état anesthésique profond, vérifié par un test de pincement des orteils et l’observation des schémas respiratoires.
- Administrer la moitié de la dose prescrite de buprénorphine par voie sous-cutanée immédiatement après le retrait de la souris de la chambre. La posologie de la buprénorphine est conforme au protocole animal approuvé.
- Appliquez un lubrifiant oculaire pour protéger les yeux de la souris contre le dessèchement pendant l’intervention chirurgicale et transférez la souris en position couchée sur le cône nasal de la machine à isoflurane sur la platine du stéréomicroscope (Figure 2B). Ajustez le débit d’anesthésie à travers le cône nasal à 2 % et le débit d’oxygène à 1 L/min.
- Désinfectez le membre postérieur droit, la région pelvienne, la face antérieure du membre postérieur gauche et la queue séquentiellement avec de la povidone iodée suivie de 70 % d’éthanol.
- Vérifiez la stabilité et la profondeur de l’anesthésie au moyen d’un test supplémentaire de pincement des orteils et de l’observation des schémas respiratoires avant le début de la chirurgie.
- Sous un éclairage lumineux, utilisez un scalpel #15 pour créer une incision dans la peau juste en dessous de l’articulation du genou d’une longueur initiale d’environ 5 mm, afin de révéler l’extrémité proximale du tibia droit (Figure 2C). Utilisez des ciseaux pour allonger la coupe si nécessaire. Gardez le tibia controlatéral gauche non blessé afin qu’il serve de contrôle interne non blessé.
- Effectuez une dissection contondante verticale à travers le muscle sus-jacent au niveau du tibia proximal à l’aide de la face arrière du scalpel #15, en retirant les tissus mous pour une exposition claire de la plaque de croissance.
- Éteignez les lumières de la salle d’opération et sélectionnez le bon canal de fluorescence pour éclairer la région souhaitée de la plaque de croissance. Les ensembles de filtres nécessaires pour imager chacun des collagènes fluorescents sont Col 2 Cyan : ET436/20x (excitation), ET480/40 m (émission), Col 10 mCherry : ET577/20x (excitation), ET640/40 m (émission), Col 1 Topaz : ET500/20x (excitation), ET535/30 m (émission). Positionnez la souris de manière à ce qu’elle observe la plaque de croissance tibiale proximale (Figure 2D). Ajustez l’ouverture de la peau légèrement plus proximale, puis distale pour vous assurer que la plaque de croissance tibiale est visible et non la plaque de croissance du fémur.
- Créez une lésion de type Salter-Harris de type II tout en regardant à travers l’oculaire du microscope en positionnant la fraise de foret dentaire de 0,5 mm parallèlement à l’axe tibial au milieu de la zone de la plaque de croissance hypertrophique, en utilisant une approche latérale (Figure 2E,F). Pour obtenir de manière reproductible un défaut qui imite une lésion de Salter-Harris de type II, gardez le membre parallèle à la surface de travail afin que la voie d’entrée de la fraise ne s’incline pas dans l’épiphyse. Appliquez une pression sur la pédale de perceuse pour amorcer la rotation de la fraise et enfoncez doucement la fraise dans la plaque de croissance, en arrêtant avant que le défaut ne s’enfonce plus profondément que le diamètre de la fraise (Figure 2G).
REMARQUE : Une deuxième paire de mains aidant à stabiliser le membre de la souris est utile. - Irriguez le site de la lésion avec une goutte de PBS stérile pour éliminer tous les débris.
- Confirmez la profondeur du défaut à 0,5 mm à l’aide d’une sonde parodontale.
4. Procédures post-blessure et fermeture
- Pour la caractérisation du défaut au temps zéro, prélever le membre postérieur blessé et le membre témoin avant la fermeture du tissu. Suivez le prélèvement de tissus et la préparation pour la microtomodensitométrie ultérieure (microTDM) et l’imagerie cryo-histologique dans la section 6.
REMARQUE : Dans le cas d’expériences impliquant l’implantation d’une substance thérapeutique dans le défaut de la plaque de croissance, le défaut lui-même ne peut accueillir qu’un morceau de biomatériau à peu près sphérique et de 0,5 mm de diamètre ou de 0,082 mm3 (0,082 μL) de volume. - Utilisez des pinces sous visualisation microscopique pour insérer le biomatériau ou injectez un produit thérapeutique liquide dans le défaut de la plaque de croissance. Utiliser un plus grand volume de biomatériau ou de substance injectée si la conception de l’étude n’exige pas que le traitement soit limité au seul défaut.
- Réalignez soigneusement les bords de la peau, en vous assurant que le matériau implanté, le cas échéant, reste solidement à l’intérieur du site du défaut.
- Utilisez des techniques de suture interrompue avec des sutures à l’acide polyglycolique 5-0 pour sceller efficacement l’incision cutanée.
- Nettoyez soigneusement les zones au-delà de la région chirurgicale des résidus de povidone iodée à l’aide d’écouvillons avec de l’eau stérile, en prenant soin d’éviter tout contact avec la plaie et les zones environnantes proches.
- Retirez la souris du cône nasal de l’isoflurane sur la platine du microscope jusqu’à une cage de récupération, en la positionnant latéralement sur une litière fraîche au-dessus d’un coussin chauffant.
- Observez de près la fréquence respiratoire de la souris pendant environ 5 minutes, en administrant la dose restante de buprénorphine pour l’analgésie au moment où les effets de l’anesthésie à l’isoflurane diminuent, indiqués par une augmentation de la fréquence respiratoire, mais avant le début de la mobilité. Maintenez la souris dans une cage de récupération isolée jusqu’à ce qu’elle démontre toutes ses capacités ambulatoires, puis réunissez-la avec sa mère et ses frères et sœurs.
- Effectuer des inspections quotidiennes pendant les 48 heures suivant l’opération, suivies d’évaluations hebdomadaires jusqu’au moment de l’euthanasie. Concentrez-vous sur les signes d’infection, l’efficacité de la locomotion, l’accessibilité à la nourriture et l’intégrité des sutures.
- Sevrez les souris à l’heure normale (c’est-à-dire à l’âge de 3 semaines).
5. Mesure de la longueur des membres
- Sur la base des points temporels déterminés par l’hypothèse et la conception expérimentales, anesthésier les souris avec de l’isoflurane et effectuer une imagerie par rayons X de toute la longueur des tibias blessés et non blessés, comme le montre la figure 2A et décrit dans la section 1.4. Les points de repère appropriés pour effectuer des mesures cohérentes de la longueur des membres comprennent le haut de l’épiphyse tibiale et l’extrémité distale du tibia au niveau de l’articulation tibio-talienne, comme le montre la figure 3.
REMARQUE : L’imagerie est utilisée pour évaluer les écarts de longueur et de longueur des membres dus à la blessure, ainsi que le développement du pont osseux dans les tissus de la plaque de croissance à des intervalles postopératoires spécifiques.
6. Dissection tissulaire, fixation, imagerie microCT et intégration
- Euthanasier la souris par asphyxie au CO2 , de préférence à l’aide d’un système automatisé d’induction de CO2 avec confirmation de la mort par une autre méthode telle que la luxation cervicale.
- Isolez les deux membres postérieurs intacts et retirez la peau et les muscles de l’os et de la région capsulaire du genou en préparation de l’analyse histologique et de la microtomodensitométrie.
- Avant de mettre les membres postérieurs dans le fixateur, excisez soigneusement la rotule en la coupant à l’aide de micro-ciseaux de dissection pour faciliter la pénétration du fixateur dans la cavité du genou. Utilisez une seringue à insuline de 29 g pour bien répartir le formol tamponné à 10 % dans toutes les zones de la cavité du genou. Sévère la région diaphysaire du fémur et du tibia pour améliorer l’accès fixateur à l’espace de la moelle. Maintenez le tissu articulaire en position complètement déployée à l’intérieur du fixateur pendant 24 à 36 h à 4 °C en l’attachant avec de la gaze à une cheville mince.
ATTENTION : Le formol est toxique et doit être manipulé dans une hotte tout en portant un équipement de protection individuelle approprié.
- Avant de mettre les membres postérieurs dans le fixateur, excisez soigneusement la rotule en la coupant à l’aide de micro-ciseaux de dissection pour faciliter la pénétration du fixateur dans la cavité du genou. Utilisez une seringue à insuline de 29 g pour bien répartir le formol tamponné à 10 % dans toutes les zones de la cavité du genou. Sévère la région diaphysaire du fémur et du tibia pour améliorer l’accès fixateur à l’espace de la moelle. Maintenez le tissu articulaire en position complètement déployée à l’intérieur du fixateur pendant 24 à 36 h à 4 °C en l’attachant avec de la gaze à une cheville mince.
- Après 24 à 48 h de fixation au formol à 4 °C, effectuer une microtomodensitométrie à rayons X à haute résolution des échantillons controlatéraux et blessés par imagerie microCT après transfert des échantillons au PBS, pour l’évaluation du développement du pont osseux. Utilisez une taille de voxel de 6,0 μm, des temps d’échantillonnage de 330 000 ms et des réglages d’énergie de 55 000 V avec une intensité de 145 μA.
- Après l’imagerie microCT et 24 h supplémentaires de fixation au formol à 4 °C, rincez les échantillons dans 1X PBS pendant 3 x 5 minutes, puis immergez les échantillons dans 10 % de saccharose dans 1X PBS pendant 1 h, 20 % de saccharose dans 1X PBS pendant 1 h et 30 % de saccharose dans 1X PBS pendant la nuit. Utilisez une seringue d’insuline de 29 g remplie de solution de saccharose pour vous assurer que la solution de saccharose pénètre dans toutes les régions de la cavité du genou. Transférer dans un congélateur à -80 °C si ce n’est pas le cas, après l’immersion nocturne dans le saccharose, afin d’assurer la rétention du rapporteur GFP et de l’activité enzymatique tissulaire.
- Retirez tout tissu musculaire résiduel de la région articulaire avant de l’encastrer. Équilibrez l’échantillon avec un milieu cryo-enrobé pendant la nuit, facilitant la pénétration du fluide dans la cavité du genou.
- Visualisez les images microCT pour déterminer où se trouvent le défaut et le pont osseux avant l’encastrement. Appliquez une fine couche du milieu de cryo-enrobage dans un cryomoule et placez le tibia/fémur/articulation disséqué et toujours connecté de manière à ce que la région d’intérêt soit orientée à 90° par rapport à la surface du milieu d’enrobage.
REMARQUE : Cette orientation permet à la coupe de capturer la vue latérale du défaut créé latéralement. Si le pont osseux est près du bord du défaut, cette orientation évitera également la possibilité de manquer la région d’intérêt lors des premières sections plus épaisses prélevées à travers le tissu. - Placez le cryomoule sur de la glace carbonique jusqu’à ce que le milieu de cryo-enrobage se solidifie, fixant ainsi l’échantillon. Continuez à remplir le cryomoule avec le fluide tout en le maintenant sur de la glace sèche.
- Après avoir fixé l’échantillon, immergez le cryomoule dans du 2-méthyl-butane refroidi avec de la glace sèche jusqu’à ce qu’il soit complètement congelé. Après la congélation, retirez l’excès de 2-méthyl-butane, enveloppez les cryomoules dans du cellophane et conservez-les à -20 °C ou -80 °C.
REMARQUE : Pour un stockage prolongé au-delà de 1 à 2 mois dans un milieu cryo-enrobé, -80 °C est recommandé pour éviter le dessèchement. La cryosectionnement assistée par bande et l’adhérence des sections sur les lames de verre sont décrits précédemment23.
7. Imagerie séquentielle, coloration et réimagerie
- Mettre en œuvre une procédure séquentielle d’imagerie, de coloration et de réimagerie pour faciliter la détection et la colocalisation de plusieurs signaux biologiques dans la même section de tissu, comme décrit précédemment23. En particulier pour les sections de plaque de croissance des souris rapporteures de collagène tricolore, les étapes suivantes sont recommandées. Cette approche ordonnée garantit une visualisation complète des signaux moléculaires et des détails structurels.
- Dans un premier temps, capturez des signaux fluorescents endogènes pour les trois collagènes lors de la première série d’imagerie.
- Appliquer la coloration au bleu de calcéine et l’image pour les tissus minéralisés23, suivie de la coloration et de l’imagerie de l’activité enzymatique de la phosphatase acide résistante au tartrate (TRAP)23.
REMARQUE : Bien que les résultats de coloration de l’activité enzymatique TRAP ne soient pas affichés ici, cette étape de coloration est effectuée car elle est essentielle pour l’élimination du minéral avant les résultats de coloration Safranin O/Fast Green présentés dans la section des résultats représentatifs. - Effectuez la coloration nucléaire du 4',6-diamidino-2-phénylindole (DAPI) comme décrit ci-dessous, puis imagez.
- Placez les lames qui ont fait l’objet d’une imagerie préalable dans un bocal Coplin contenant 1x PBS. Laissez-les immergés jusqu’à ce que les lamelles se détachent des glissières. Une fois détachés, retirez et séchez soigneusement les lamelles.
- Appliquez une solution de contre-coloration DAPI sur les lamelles, en utilisant une dilution de 1:1 000 de DAPI dans un mélange de 50 % de glycérol et de 1x PBS. Poursuivez le processus d’imagerie après l’application.
- Terminez par l’application de la coloration Safranin O/Fast Green pour accentuer l’architecture tissulaire, puis l’image.
REMARQUE : Effectuez cette étape comme étape finale pour corréler les images chromogènes avec les signaux fluorescents.- Préparez les solutions d’hématoxyline de fer de Weigert. Préparez la solution A en dissolvant 1 g d’hématoxyline dans 100 ml d’éthanol à 95 % et la solution B en combinant 4 ml de solution de chlorure ferrique à 29 %, 95 ml d’eau désionisée et 1 ml de HCl concentré. Mélangez à parts égales les solutions A et B pour créer la solution d’hématoxyline fonctionnelle de Weigert, stable pendant environ 4 semaines.
- Immerger les lames dans de l’eau déminéralisée pendant 2 x 2 min pour s’hydrater.
- Appliquez la solution d’hématoxyline de Weigert pendant 5 min.
- Lavez les lames à l’eau du robinet pendant 5 min, puis brièvement à l’eau déminéralisée pendant 1 min.
- Colorer avec une solution Fast Green à 0,2 % (0,2 g de Fast Green FCF dans 100 mL d’eau déminéralisée) pendant 2 min.
- Rincer brièvement avec de l’acide acétique à 1 % pendant 1 min.
- Colorer avec une solution de Safranine O à 0,1 % (0,1 g de Safranine O dans 100 mL d’eau déminéralisée) pendant 1 min.
- Rincer à l’eau déminéralisée jusqu’à l’obtention d’une couleur visuellement équilibrée, environ 5 min.
- Montez les lames dans du glycérol à 30 % dans de l’eau désionisée (évitez le PBS) et passez immédiatement à l’imagerie pour éviter la diffusion de la couleur du tissu. Pour accentuer les cellules de la zone de repos de la plaque de croissance, on conduit l’image avec un filtre Cy5 : ET640/30x (EX), ET690/50 m (EM).
Résultats
Ce protocole utilise des souris rapporteures fluorescentes trilinéaires pour induire un défaut de la plaque de croissance latérale dans le tibia proximal avec précision en exploitant la fluorescence rouge inhérente émise par le collagène de type X pour le guidage chirurgical. La figure 2D montre la vue du chirurgien lorsqu’il regarde à travers l’oculaire du stéréomicroscope avec le jeu de filtres mCherry. La fluorescence native de type X permet au chirurgien de placer la fraise dans la zone hypertrophique et de créer une lésion qui imite un type courant de lésion de la plaque de croissance conduisant à un pont osseux (Figure 2F). La fluorescence sous le canal rouge est la plus brillante et, par conséquent, recommandée pour la mise en place de la fraise. Alternativement, la création de défauts pourrait être guidée par l’utilisation d’autres couleurs de la fluorescence native des souris transgéniques triples si le but de l’expérience est d’étudier les lésions à d’autres zones de la plaque de croissance que la zone hypertrophique et la région calcifiée adjacente.
La création d’un défaut de type Salter-Harris de type II dans la zone hypertrophique de la plaque de croissance et du tissu osseux inférieur adjacent, à l’aide d’une fraise dentaire de 0,5 mm de diamètre, a été validée par microtomodensitométrie et imagerie cryohistologique des tibias proximaux blessés (temps 0) par rapport aux témoins latéraux non blessés chez N = 3 souris (figure 4). Les défauts étaient difficiles à voir sur les images microCT 3D, mais étaient détectables dans les coupes efficaces 2D (figures 3A, B, E, F). La figure 3G montre la distribution des cellules osseuses productrices de collagène de type I (fluorescence verte), des chondrocytes prolifératifs producteurs de collagène de type II (fluorescence cyan) et des chondrocytes hypertrophiques producteurs de collagène de type X. Sur l’image de la souris blessée (Figure 4G), il y a une perturbation de la zone hypertrophique, de la couche provisoirement calcifiée et d’une partie de l’os le plus récent par rapport au contrôle, la zone proliférative n’étant que légèrement perturbée. La coloration Safranin O/Fast Green (Figure 4H) illustre le mieux l’emplacement du défaut dans la plaque de croissance blessée puisque toutes les cellules sont clairement visibles.
L’analyse aux rayons X donne un aperçu de l’impact de ce type de blessure à la plaque de croissance sur la longueur du tibia et la formation du pont osseux au fil du temps (figure 3). L’imagerie comparative entre les tibias non blessés (Figure 3A) et blessés (Figure 3B), prise avant la chirurgie et 3 semaines après la chirurgie, révèle une grande quantité de croissance des membres, un amincissement des plaques de croissance et une région opaque distincte qui s’est développée dans la zone de la plaque de croissance blessée à 3 semaines. Cette opacité à l’intérieur de la plaque de croissance n’est pas présente chez l’homologue non blessé ni chez les souris avant la chirurgie. Faxitron est donc un moyen d’observer les changements pathologiques induits par la lésion chez les souris vivantes, tels que la formation d’un pont osseux et les modifications de la longueur des membres.
L’imagerie MicroCT des os disséqués offre une visualisation détaillée de la formation des ponts osseux dans les plaques de croissance blessées trois semaines après la chirurgie (Figure 5). Comme le montrent les images de six souris blessées différentes montrées à la figure 5, il y a un développement cohérent du pont osseux chez toutes les souris. À l’aide du logiciel Scanco Medical, le volume du pont osseux a été calculé en examinant chaque section de la plaque de croissance tibiale proximale, en délimitant la zone du pont osseux (Figure 5B) à l’aide de l’outil de sélection, puis en intégrant chaque section dans tout le volume de la plaque de croissance pour obtenir le volume totalde 24. Le volume osseux du pont calculé de cette manière était de 0,0761 mm3 ± 0,0246 (moyenne ±écart-type, N = 6). La majorité des ponts osseux se forment près du milieu de la plaque de croissance malgré l’approche latérale, ce qui blesse le bord externe ainsi que le centre de la plaque de croissance. Ce phénomène peut être attribué au fait que les cellules souches mésenchymateuses (CSM) de la moelle osseuse, plutôt que du périchondre, sont responsables de la formation des ponts osseux25.
Chez ces souris transgéniques tricolores, l’analyse cryo-histologique de la plaque de croissance lésée est enrichie par la fluorescence du collagène natif (Figure 6). Il révèle l’interaction complexe des cellules osseuses et des chondrocytes sur le site de la lésion. Les images MicroCT illustrées à la figure 6J,K ont été fournies au technicien en histologie pour guider l’enrobage et la section. Les cellules osseuses productrices de collagène de type I sont observées sur la figure 6L, O, P (fluorescence verte), tandis que les chondrocytes prolifératifs producteurs de collagène de type II sont visibles sur la figure 6L, O, Q (fluorescence cyan). Les chondrocytes hypertrophiques producteurs de collagène de type X sont observés sur la figure 6L, O, R (fluorescence rouge). Cette approche de fluorescence multicolore permet un examen détaillé de la différenciation postopératoire des chondrocytes dans la zone du pont osseux sur fond de tissu minéralisé. La coloration DAPI a été utilisée pour confirmer la distribution de tous les types de cellules dans la zone de la plaque de croissance (Figure 6M). La coloration Safranin O/Fast Green démontre l’organisation composite et structurelle du cartilage et de l’os à l’intérieur de la plaque de croissance lésée (Figure 6N). L’imagerie de ces coupes colorées sous un ensemble de filtres Cy5 permet d’éclaircir notamment les cellules de la zone de repos à l’interface entre l’os épiphysaire et le cartilage.
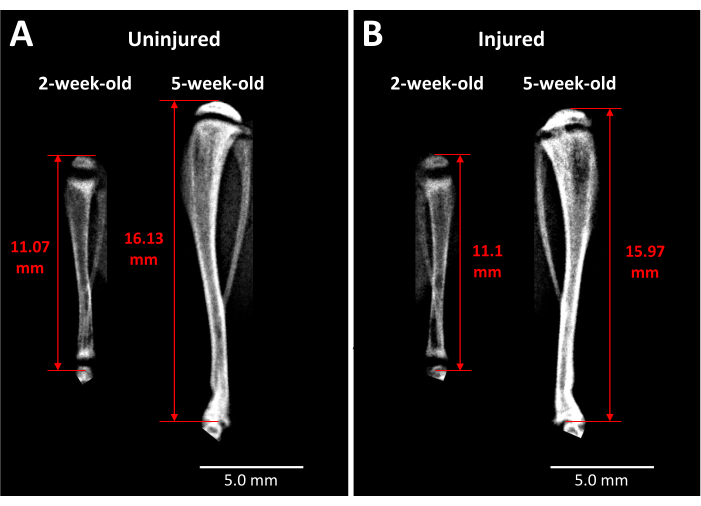
Figure 3 : Radiographies du tibia de contrôle controlatéral et des tibias de souris lésés. (A) Les images radiographiques du tibia de contrôle controlatéral sont prises juste avant la blessure lorsque les souris ont 2 semaines et à 3 semaines après la chirurgie lorsque les souris ont 5 semaines, démontrant l’étendue de la croissance qui se produit pendant cette période. (B) Tibia blessé par la même souris aux mêmes moments qu’en (A). Les points de repère utilisés pour les mesures de la longueur du tibia sont l’apex de la tête du tibia proximal jusqu’à l’extrémité du tibia au niveau de l’articulation de la cheville (flèches rouges à deux pointes). Le pont osseux opaque est visible dans la plaque de croissance du tibia proximal blessé à 5 semaines. Barres d’échelle = 5,00 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
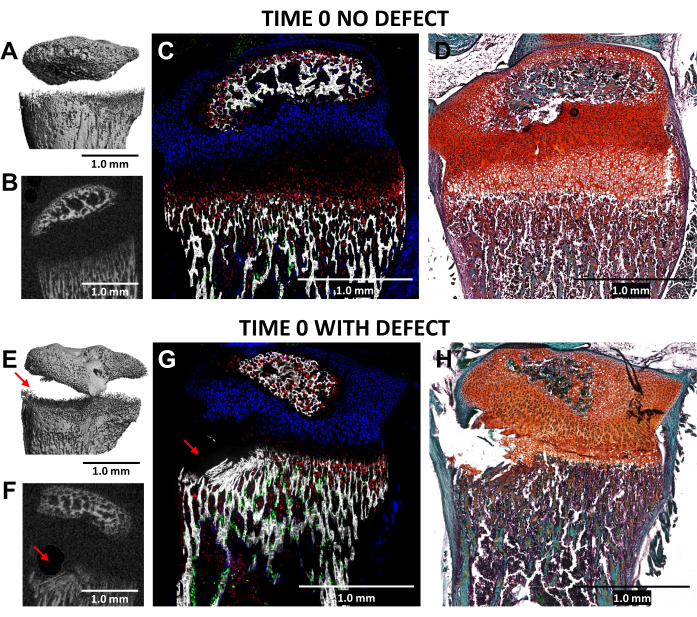
Figure 4 : MicroCT et images histologiques du contrôle controlatéral de temps zéro et des tibias proximaux de souris blessés. (A, E) et (B, F) représentent des vues microCT 3D et transversales 2D, le défaut étant indiqué par des flèches rouges en (E) et (F). (C, G) Images cryo-histologiques composites fusionnées fusionnant trois couches de fluorescence innée avec une couche de tissu minéralisé. Les cellules vertes (Col3.6GFPtpz) sont les cellules osseuses productrices de collagène de type I, les cellules de couleur bleu cyan (Col2A1GFPcyan) sont des chondrocytes prolifératifs producteurs de collagène de type II, et les globules rouges (Col10A1RFPchry) sont des chondrocytes hypertrophiques producteurs de collagène de type X. (D,H) Coloration Safranine O/Fast Green de la même région que (C) et (G). Barres d’échelle = 1,0 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
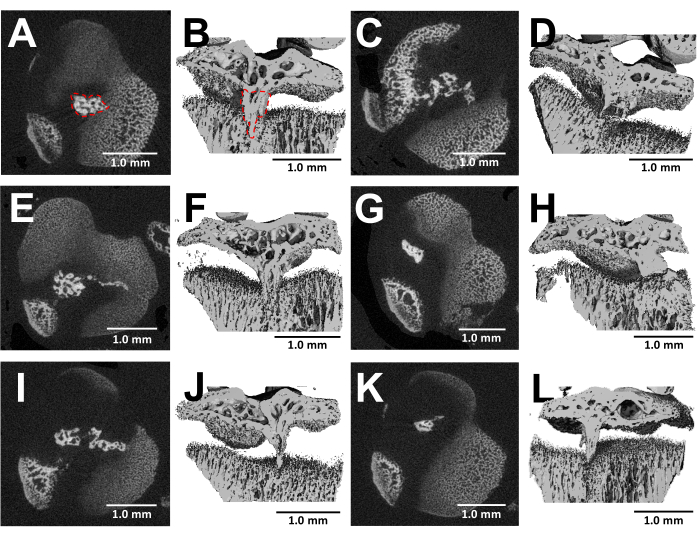
Figure 5 : Images MicroCT des ponts osseux formés par ce protocole. (A, C, E, G, I, K) Coupes transversales transversales de la plaque de croissance tibiale proximale de six souris différentes 3 semaines après la création du défaut de fraise. Pont osseux délimité par une ligne pointillée rouge en (A). (B,D,F,H,J,L) Reconstruction 3D avec un plan longitudinal découpé. Pont osseux délimité par une ligne pointillée rouge en (B). Barres d’échelle = 1,0 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
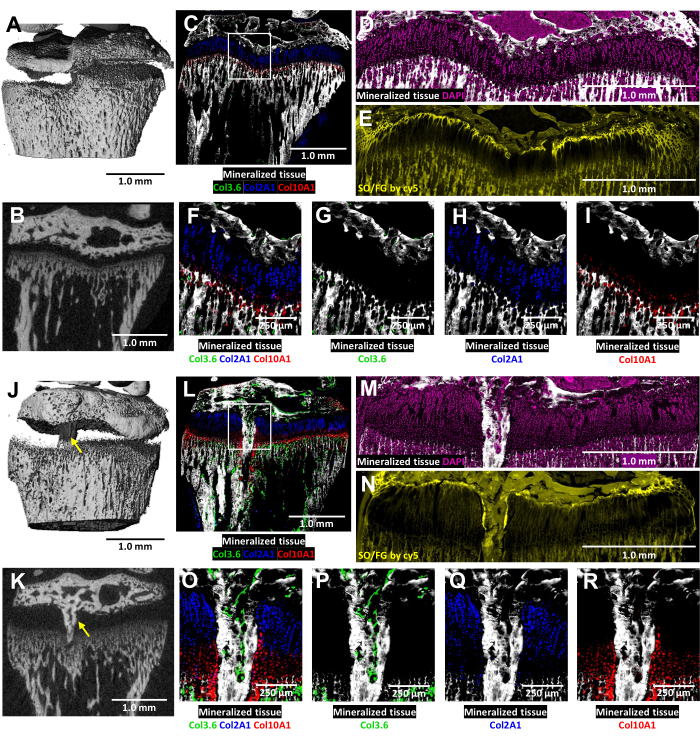
Figure 6 : MicroCT et images histologiques du contrôle controlatéral et du tibia proximal de souris blessé avec formation de pont osseux. (A, J) et (B, K) représentent des vues microCT 3D et transversales 2D, le pont osseux étant indiqué par des flèches jaunes en (J) et (K). (C,L) Images cryo-histologiques composites fusionnées fusionnant trois couches de fluorescence innée avec une couche de tissu minéralisé. Les cellules vertes (Col3.6GFPtpz) sont les cellules osseuses productrices de collagène de type I, les cellules de couleur bleu cyan (Col2A1GFPcyan) sont des chondrocytes prolifératifs producteurs de collagène de type II, et les globules rouges (Col10A1RFPchry) sont des chondrocytes hypertrophiques producteurs de collagène de type X. La boîte blanche indique le grossissement plus élevé indiqué dans les panneaux F et O. (D,M) Le tissu minéralisé et la coloration DAPI dans la zone de la plaque de croissance des panneaux C et L. (E,N) Coloration Safranin O/Fast Green de la même région que (D) et (M) balayée avec fluorescence cy5. (F,O) Un grossissement plus élevé de la surface de la plaque de croissance dans l’image fusionnée des panneaux C et L. (G-I,P-R) Canaux individuels de la fluorescence native représentés avec un fond de tissu minéralisé. Barres d’échelle = 1,0 mm (A-E) et (J-N), = 250 μm in (F-I) et (O-R). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’utilisation innovante de souris rapporteures de collagène tricolore permet de créer des défauts de plaque de croissance avec une taille et un emplacement prédéterminés, améliorant considérablement la précision des modèles expérimentaux murins pour les lésions de la plaque de croissance. Étant donné la petite taille des souris âgées de 2 semaines, il est essentiel d’utiliser une petite fraise de 0,5 mm pour créer la blessure afin d’éviter d’affaiblir le membre et de provoquer une fracture de pleine épaisseur. Le chirurgien doit également appliquer juste assez de pression lors de la création du défaut pour éviter de percer trop profondément dans l’os pour la même raison. L’utilisation du périopobre est essentielle pour confirmer une profondeur de blessure constante.
Comme pour toute intervention chirurgicale, il est important de confirmer une profondeur d’anesthésie adéquate, confirmée par un pincement occasionnel de l’orteil et la stérilité est maintenue tout au long de l’opération. Un autre point chirurgical important est que la dissection contondante avec un sculpteur a été décrite car elle évite d’endommager les tissus mous et aide à garantir que les souris sont capables de se déplacer immédiatement après la récupération de l’anesthésie pour atteindre la souris mère pour se nourrir et se réconforter. D’après notre expérience, les plaies fermées avec des sutures sont restées fermées avec succès et les clips de plaie ne sont pas nécessaires. La chirurgie sur les souris à l’âge de 2 semaines est recommandée pour imiter au mieux le jeune enfant qui subit des fractures de la plaque de croissance. L’un des inconvénients de ce protocole est que, compte tenu de la nature imprévisible de l’accouchement, l’utilisation de ce modèle de souris nécessite la disponibilité du chirurgien à court terme.
En ce qui concerne le positionnement de la fraise pour créer le défaut, le protocole décrit la création de la blessure à l’aide d’un ensemble de filtres rouges mCherry/Texas qui illumine la zone hypertrophique à l’intérieur de la plaque de croissance en raison de la luminosité de la fluorescence du collagène X. Pour s’assurer que la blessure est créée à l’intérieur de la plaque de croissance tibiale, il est avantageux de déplacer légèrement l’ouverture des tissus mous vers la gauche et la droite pour confirmer que la plaque de croissance tibiale proximale est en vue, et non le fémur. Le basculement entre les canaux de filtre pour éclairer la zone chondrocytaire proliférative ou les sections osseuses adjacentes est utile pour confirmer un placement précis par rapport à l’emplacement de la zone proliférative et des sections osseuses adjacentes.
Alors que la zone chondrocytaire proliférative et l’os épiphysaire et métaphysaire peuvent être distingués en microscopie à fluorescence chez les souris vivantes, la valeur réelle des rapporteurs de collagène de type II et de type I est réalisée lors de l’analyse histologique de la plaque de croissance. Compte tenu de la nature aqueuse des processus cryo-histologiques, les protocoles traditionnels de précipitation des colorants chromogènes ne conviennent pas en raison du désalignement potentiel de la couleur avec l’imagerie fluorescente causé par les étapes de déshydratation. Bien que le protocole aqueux produise des motifs de coloration similaires à ceux des coupes de paraffine, l’imagerie post-coloration rapide est essentielle pour empêcher la diffusion du colorant du tissu. L’utilisation de 30 % de glycérol dans de l’eau distillée comme milieu de montage peut ralentir cette diffusion, ce qui permet plusieurs colorations chromogènes sur la même section, y compris le cartilage avec Safranin O/Fast Green.
Le processus d’ossification endochondrale est clairement visible avec des chondrocytes rouges tapissant le pont osseux en évolution (Figure 6). L’utilisation supplémentaire de techniques d’immunohistochimie, pour lesquelles il existe de nombreux anticorps murins, pourrait améliorer davantage les études mécanistes menées chez ces souris transgéniques. Dans l’ensemble, la combinaison de techniques de faxitron, de microCT et d’imagerie cryo-histologique dans ce modèle de souris transgénique offre une compréhension complète des changements macroscopiques et microscopiques qui se produisent en réponse aux lésions de la plaque de croissance, ouvrant la voie à de futures interventions thérapeutiques pour atténuer ces résultats indésirables. D’autres manipulations génétiques de ces souris transgéniques pourraient être effectuées pour permettre des études de traçage de la lignée afin de comprendre l’origine des cellules qui sont impliquées dans le temps et l’espace dans la guérison. L’expérimentation sur des souris avec des modifications supplémentaires permettrait d’étudier les maladies du cartilage telles que l’ostéochondrome - une prolifération de cartilage et d’os près de la plaque de croissance.
La cohérence de notre modèle est démontrée par la formation reproductible de ponts osseux chez toutes les souris sans qu’il soit nécessaire d’écarter les souris du groupe en raison d’une lésion du cartilage articulaire. Il s’agit d’une amélioration par rapport aux modèles précédents qui s’approchaient de la plaque de croissance à partir d’une fenêtre corticale sous la plaque de croissance et inclinaient un outil pointu ou une fraise vers le haut vers la plaque de croissance et dépassaient parfois le cartilage articulaire. Une blessure supplémentaire du cartilage articulaire n’imite pas les blessures courantes de la plaque de croissance chez les enfants. La blessure plus précise de ce modèle animal réduit le nombre de souris nécessaires par expérience, ce qui constitue une autre amélioration. L’utilisation de souris transgéniques permet au chercheur de concentrer la lésion sur des sous-sections de la plaque de croissance, telles que la zone hypertrophique/provisoirement calcifiée ou la zone d’épiphyse/zone de repos/zone proliférative, sans affecter le cartilage articulaire. Cependant, l’une des limites de ce modèle est la variabilité du volume du pont osseux, qui peut différer jusqu’à 30 % entre les animaux blessés. Par conséquent, la détection d’un effet cliniquement significatif sur la formation de ponts osseux nécessite encore un grand nombre d’animaux pour obtenir une pertinence statistique.
Les avantages d’un modèle de souris tel que décrit ici par rapport aux modèles de lésions de la plaque de croissance du rat ou du lapinprécédemment publiés 7,9,10,14 comprennent un nombre inférieur d’animaux utilisés, une réduction des coûts, une taille de réplique efficace grâce à la formation reproductible de barres osseuses, une période d’étude plus courte et un placement plus précis des lésions grâce à l’imagerie en direct des souris transgéniques triples. Bien qu’il ne soit pas discuté en détail, ce modèle de souris peut être utilisé pour tester des implants issus de l’ingénierie tissulaire ou des biomatériaux délivrant des facteurs de croissance. Une limitation notable de cette méthode murine est que la taille d’un implant utilisé pour administrer des médicaments ou des cellules thérapeutiques est limitée au volume du défaut d’une sphère d’environ 0,5 mm de diamètre. Seuls les modèles animaux plus grands peuvent s’adapter au volume de matériel de test qui serait utilisé chez les patients humains. Le défaut de fraise créé dans ce protocole n’a pas la même géométrie qu’une fracture mince et diffère donc des blessures humaines réelles. Néanmoins, les avantages de ce modèle de souris sont nombreux, et l’approche latérale évite d’endommager le cartilage articulaire qui se produirait lors d’une approche aveugle au-dessus ou en dessous de la plaque de croissance dans l’alignement du grand axe tibial. Cette méthodologie représente un bond substantiel dans la recherche sur les lésions des plaques de croissance, fournissant une méthode détaillée et reproductible pour l’étude de la pathologie et l’évaluation de nouvelles stratégies thérapeutiques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par une subvention des National Institutes of Health, du National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) 1R21AR079153 et d’une subvention du programme d’amélioration de la recherche (REP) de l’Université du Connecticut. Les auteurs tiennent à remercier Renata Rydzik de l’installation MicroCT Imaging Core de l’Université du Connecticut.
matériels
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
Références
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon