Method Article
Büyüme Plakası Yaralanmasını İncelemek için Üç Renkli Transgenik Murin Modeli
Bu Makalede
Özet
Bu protokol, ergen kemik büyüme plakası yaralanmaları için geliştirilmiş bir fare modelini tanımlar. Büyüme plakasının üç farklı substratı ile ilişkili birincil matrisler olan kollajen tip I, II ve X için üç soylu floresan raportörlere sahip transgenik fareler kullanılarak, yaralanma yerleşimi mikroskop altında doğal floresan tarafından yönlendirilir.
Özet
Çocukların kemiklerindeki kıkırdak büyüme plakaları, uzuv uzamasını mümkün kılar ancak kemiğe göre zayıftır, bu da kemikler aşırı yüklendiğinde kırılmaya eğilimli hale getirir. Ciddi şekilde kırılmış büyüme plakaları için daha iyi tedavilere ihtiyaç vardır, çünkü yaralanmaya verilen yanıt, büyüme plakasını erken kaynaştıran ve bodur ve / veya çarpık uzuvlara yol açan kemikli bir köprüdür. Büyüme plakası yaralanmasının murin modelleri, mekanik çalışmalar için avantajlıdır, ancak genç farelerde küçük büyüme plakalarını görselleştirmek ve hassas bir şekilde yaralamak zor olduğu için zordur. Burada, kollajen tip I, II ve X için üç soylu floresan raportörlere sahip transgenik fareler kullanan gelişmiş bir büyüme plakası yaralanma modelini açıklıyoruz.
Bu fareler, büyüme plakasının üç ana substratı ile ilişkili doğal floresan gösterir. Salter-Harris Tip II yaralanmasına benzer bir büyüme plakası yaralanması, floresan stereo mikroskopi rehberliğinde canlı görüntüleme sırasında büyüme plakasının hipertrofik bölümünü referans olarak kullanan bir frez ile tekrarlanabilir şekilde oluşturulur. Doğal floresanın donmuş histolojik analizi, yaralanmaya hücresel yanıtın değerlendirilmesini basitleştirir. Bu metodoloji, patolojiyi araştırmak ve yeni terapötik stratejileri değerlendirmek için ayrıntılı ve tekrarlanabilir bir yöntem sağlayarak, büyüme plakası yaralanması araştırmalarında önemli bir sıçramayı temsil eder.
Giriş
Kemik büyüme plakaları, çocukluk ve ergenlik döneminde uzun kemiklerin uzunlamasına büyümesinde çok önemli bir rol oynar1. Uzun kemiklerin uçlarında yer alan büyüme plakası, bu dinamik büyüme alanını üretmekten ve sürdürmekten sorumlu anahtar hücresel bileşenler olan kondrositler ile birden fazla bölgeden oluşur. Büyüme plakasının endokondral ossifikasyonu, kondrosit proliferasyonu, hipertrofi, apoptoz, kan damarları tarafından istila, osteoprogenitör hücrelerin toplanması ve son olarak kemik oluşumunun sıralı bir şekilde ilerlemesi yoluyla kemikleri uzatmak ve genişletmek için meydana gelir2. Büyüme plakası kemikten nispeten daha yumuşak olduğundan, spor veya diğer aktiviteler sırasında kemikler aşırı yüklendiğinde kırılmaya karşı oldukça hassastır. Salter-Harris sınıflandırması, büyüme plakası yaralanmalarının beş farklı türünü ana hatlarıyla belirtir3. Büyüme plağının hipertrofik bölgesi ve bitişik alt kemik dokusu boyunca Tip II kırık en yaygın olanıdır4. Kemikli bir köprü genellikle hipertrofik bölgenin veya bitişik kemiğin yaralanmalarına yanıt olarak oluşur ve bitişik uzun kemik bölümlerinin erken füzyonuna yol açar5. Kemikli köprüler, büyüme plakasının normal genişlemesini engeller. Şu anda, kemikli köprü oluşumu için herhangi bir önleyici tedavi mevcut değildir ve bazıları hastanın yaşına ve kemikli köprünün boyutuna ve konumuna bağlı olarak tedavi edilmeden bırakılmaktadır6. Ekstremite malformasyonu şiddetli olduğunda, cerrahi seçenekler arasında çıkarılması ve ardından yağ veya silikon kauçuk gibi interpozisyonel materyallerin implante edilmesi veya düzeltici osteotomi ve kemik uzatma prosedürleri; Yine de kemikli bir köprü yine dereform yapabilir 6. Kemik köprüsü oluşumunu önlemek ve kemik büyüme plakası yaralanması olan çocukların sonuçlarını iyileştirmek için daha fazla araştırmaya ihtiyaç vardır.
Yaralanma sonrası büyüme plakalarının kemik köprüsü bozulmasını önlemek için altta yatan mekanizmaları araştırmak ve yeni stratejiler geliştirmek için çeşitli hayvan modelleri oluşturulmuştur7,8,9,10,11,12. Bu hayvan modelleri sıklıkla birincil yaralanma bölgesi olarak proksimal tibial büyüme plakasına ve distal femur büyüme plakasına odaklanır, çünkü burası tipik olarak insan yaralanmalarının meydana geldiği yerdir. Hayvan kemik kusurları, ya gerçek bir kırık yoluna benzer bir yanal yaklaşımla ya da büyüme plakasının üstünden veya altından bir yaklaşımla oluşturulur ve bu da büyüme plakasında merkezi bir matkap deliğine yol açar. Daha önce bildirilen bir sıçan modelinde, tibial orta şafttaki kortikal bir pencereden bir diş frezi sokularak ve büyüme plakasını merkezi olarak yaralamak için ilikten diz eklemine doğru yukarı doğru delinerek bir büyüme plakası defekti oluşturulur 7,13. Alternatif olarak, yeni bir fare modeli, büyüme plakası8 boyunca düzlemsel bir iğne yolu oluşturmak için küçük delikli bir iğne ile yanal bir yaklaşım kullanır. Yaygın olarak kullanılan bir sıçan modelinde, defekt, kondiller 9,14 arasındaki eklem kıkırdağının delinmesiyle distal uyluk kemiğinin büyüme plakasında oluşturulur. Tavşanlar ve koyunlar gibi daha büyük hayvanlarda, büyüme plakası defektleri, büyüme plağını delerek veya keserek veya aşağıdan yaklaşarak ve büyüme plağının kenarlarını değiştirmeden bırakarak merkezi bir defekt oluşturarak doğrudan proksimal tibiada ve distal femurda lateral olarak indüklenmiştir 10,11,12,15.
Büyüme plakası yaralanmaları için murin modelleri, kök hücre soy izleme çalışmaları gibi genetik olarak değiştirilmiş farelerle gerçekleştirilebilecek mekanik çalışmalar için avantajlıdır8. Bununla birlikte, murin veya sıçan hayvan modellerinde önemli bir zorluk, büyüme plakasının belirli bir alt bölgesinde tutarlı ve kesin bir yaralanma elde etmektir. Büyüme plakasının ve bitişik kemiğin belirli bölgelerinin yaralanması, Salter-Harris sınıflandırmaları tarafından tanımlanan klinik olarak ilgili kırık yollarından birini taklit etmek için gereklidir. Kemirgen modellerinde bugüne kadar olan zorluklar, esas olarak, yaralanmanın cerrahi olarak oluşturulması sırasında büyüme plakasının substratını tanımlamak için görsel bir aracın olmamasından kaynaklanmaktadır. Bu protokol, kollajen I, II ve X floresan raportörlerini 16,17,18 eksprese eden üçlü transgenik fareler kullanılarak murin büyüme plakasının hedeflenen substratında büyüme plakası kusurları oluşturmak için rafine bir tekniği tanımlar. Büyüme plağının birincil bölgelerinin her birindeki bu kollajenlerin farklı renkli floresansı, büyüme plağı yaralanmasının cerrahi olarak oluşturulması sırasında bir floresan stereo mikroskobu altında büyüme plağının çeşitli bölümlerinin görsel olarak ayırt edilmesine izin verir. Bu transgenik farelerin kullanımı, yaralanan çocuklarla karşılaştırılabilir bir gelişim aşamasında genç bir farede benzeri görülmemiş bir yaralanma doğruluğuna izin verir.
Protokol
Araştırma, kurumsal yönergelere uygun olarak gerçekleştirilmiştir. Tüm hayvan prosedürleri, çalışmaya başlamadan önce Connecticut Üniversitesi Sağlık Merkezi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır. Protokolün bir taslağı Şekil 1 şemasında açıklanmıştır.

Şekil 1: Üç renkli kollajen raportör farelerde büyüme plakası yaralanma protokolünün ana hatları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Fare yetiştiriciliği ve ameliyata hazırlık
- 2 haftalık (± 1 gün) ameliyat için yavrular elde etmek için standart yetiştirme prosedürlerine göre Col1a1-GFPTpz, Col2a1-CFP ve Col10a1-mCherry 16,17,18,19,20,21 eksprese eden üç renkli transgenik kollajen raportör fareler yetiştirin. Bir floresan mikroskobu altında bir kuyruk ucu parçasını genotipleyerek üçlü transgen ekspresyonunu doğrulayın. Sonraki histolojik analiz sırasında raportör sisteminin faydasını en üst düzeye çıkarmak için yalnızca üç renk için de pozitif olan fareleri kullanın.
NOT: Bu 2 haftalık yaş (± 1 gün), kemik büyüme plakaları insan ergen22 ile benzer bir gelişim aşamasında olduğu için seçilmiştir. Bu protokol farelerin her iki cinsiyeti için de geçerlidir. - Ameliyat günü veya bir gün önce, kulağı ve kulak yumruğunu alkollü antiseptik pedlerle dezenfekte ettikten sonra bir kulak yumruğu kullanarak ameliyat için kullanılan her fareyi benzersiz bir şekilde tanımlayın, her fareyi tartın ve değeri kaydedin.
- Fare izofluran anestezisinin etkisi altındayken sağ arka bacak kalçadan ayağa kadar tüm sağ bacak tıraş edin. Farelerde anesteziyi indüklemek için, 1-2 L'lik bir indüksiyon odası içinde 1 L / dak'lık bir akış hızında uygulanan izofluran (% 2-3) ve% 100 oksijen karışımı kullanın. Fareyi çıkarın ve farenin hareket etmesine neden olmaması gereken bir ayak parmağı tutamıyla anestezi derinliğinin yeterli olduğunu onaylayın.
NOT: Bu anestezi derinliği, anestezi burun konisi gerektirmeden tıraşı gerçekleştirmek için yeterince uzun sürecektir. - İlk uzuv uzunluğunu kaydetmek için izofluran kaynaklı anestezi altında canlı farelerde tibial görüntüleri yakalamak için 26 kV (800 mA) güç ayarlı X-ışını görüntülemesi kullanın.
- Fareleri X-ışını kabinine yerleştirmeden önce, 1-2 L'lik bir indüksiyon odası içinde 1 L / dk'lık bir akış hızında uygulanan izofluran (% 2-3) ve% 100 oksijen karışımı kullanarak derin bir anestezi durumu indükleyin.
- Anestezi uygulanmış üç fareyi, üç fareyi de içeren bir görüntünün elde edilmesini sağlayan bir raf yüksekliğinde, X-ışını kabinine mideleri üzerine paralel olarak yerleştirin. Bacakları yayın, böylece tibial kemikler farenin altında gizlenmez. Gelişmiş ölçüm doğruluğu için, görüntüleme sırasında farenin yanına bir radyoopak ölçek yerleştirin (Şekil 2A).
- Hazırlanan fareleri, sonraki cerrahi prosedürleri beklemek için anne fare ile birlikte yuva kafeslerine geri koyun.
2. Cerrahi malzemelerin ve steril çalışma alanının hazırlanması
- Aşağıdaki öğeleri sterilize edin: 10-20 gazlı bez, pamuk uçlu aplikatör çubukları, diş frezleri (0,5 mm çap), diş başlıkları, Graefe forsepsleri, kavisli sivrisinek hemostatik forsepsleri, kavisli ince makaslar, iğne tutucular, periodontal problar ve diş cleoid diskoid oymacıları.
- Gerekli ek steril malzemeleri toplayın: enjekte edilebilir bir buprenorfin süspansiyonu, 20 G iğneler, 1 mL şırıngalar, havlu örtüleri, 5-0 boyasız, örgülü, kaplamalı, vicryl sütürler, povidon-iyot, fosfat tamponlu salin, alkol antiseptik pedler, # 15 neşter, cerrahi eldivenler, çevresel yüzey bariyer tüpü sox, göz kayganlaştırıcı,% 70 etanol sprey. Ameliyat sırasında öğelerin ek sterilizasyonu için bir cam boncuk sterilizatörünü ve sterilize yataklı temiz bir fare kafesinin altında elektrikli ısıtma yastığını açın.
- Floresan stereomikroskop aşamasını, bitişik yüzeyleri ve cerrahi alet standını %70 etanol kullanarak temizleyin ve sterilize edin. Ameliyat çalışma alanı haline gelecek olan bu bölgelerin üzerini steril havlu örtüler ile örtün.
- Elektronik yüksek hızlı diş delme sistemini monte edin. Elektronik ayak kumandasını kontrol ünitesine bağlayın ve başlık kablosunu dezenfekte edilmiş bir yüzey bariyer tüpü sox ile kapatın. Steril 0,5 mm yuvarlak diş frezini takın. Denetleyiciyi açın ve 1:1 sürücü oranına ve maksimum 30.000 rpm'ye ayarlayın.
- Floresan stereomikroskop aşamasında dezenfekte edilmiş bir yüzey bariyer tüpü sox ile kaplanmış burun konisi ile sonlanan esnek izofluran makine hortumunu bantla sabitleyin.
- Floresan stereomikroskobu ve yardımcı ekipmanı açın ve görüntü alma yazılımını açın.
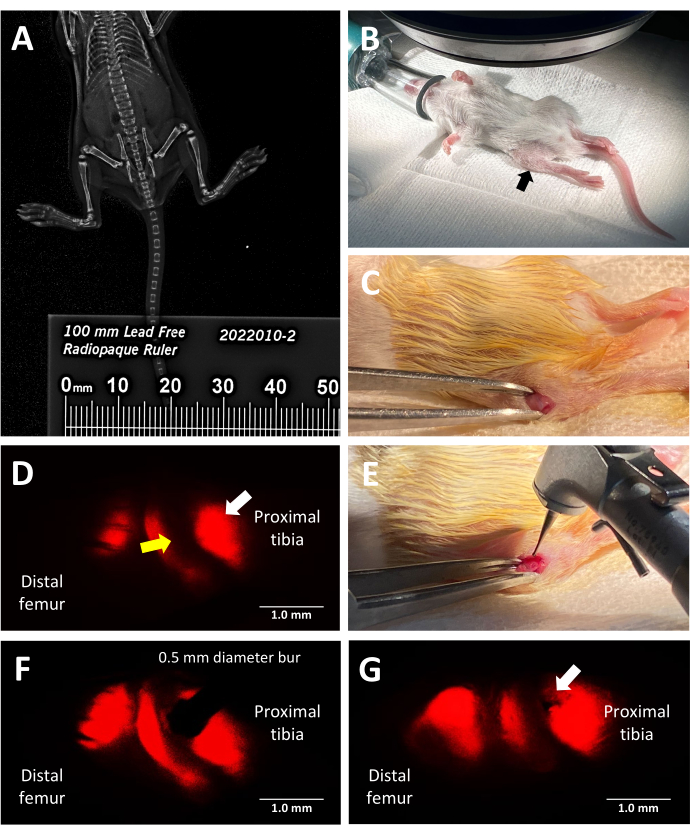
Şekil 2: Trilineage floresan raportör murin büyüme plakası yaralanma prosedürünün temel adımları. (A) X-ışını kabininde farelerin yanına yerleştirilmiş bir radyoopak cetvel kullanılarak faksitron X-ışını görüntüleme ile tibial uzunluğun ölçülmesi. (B) Floresan stereomikroskop altında ameliyat için anestezi uygulanmış bir farenin uygun pozisyonu. Proksimal tibia siyah bir okla gösterilir. (C) Büyüme plakasına erişmek için yapılan bir kesi örneği. (D) Büyüme plakasının hipertrofik bölgesini aydınlatan floresan stereo mikroskobu (beyaz ok). Bitişik proliferatif bölge sarı bir okla gösterilir. (E) 0,5 mm'lik diş frezini büyüme plakasına yerleştiren cerrahın parlak ışık aydınlatması. (F) Dental frezin hassas yerleştirilmesi, floresan stereo mikroskobu ile hipertrofik bölgeye yönlendirilir. (G) Salter-Harris Tip II benzeri büyüme plakası defekti örneği (beyaz ok). Ölçek çubukları = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Proksimal tibia büyüme plakası yaralanma prosedürü
- Fareyi izofluran anestezi odasında uyuşturun, izofluran konsantrasyonunu% 2-3'e ve oksijen akış hızını 1 L / dk'ya ayarlayın. Ayak parmağı sıkışma testi ve solunum paternlerinin gözlemlenmesi ile doğrulanan derin bir anestezik durumun indüksiyonunu bekleyin.
- Farenin hazneden çıkarılmasından hemen sonra reçete edilen buprenorfin dozunun yarısını deri altına uygulayın. Buprenorfin dozu, onaylanmış hayvan protokolüne göre yapılır.
- Ameliyat sırasında farenin gözlerinin kurumasını önlemek için oküler kayganlaştırıcı uygulayın ve fareyi sırtüstü pozisyonda stereomikroskop aşamasındaki izofluran makinesi burun konisine aktarın (Şekil 2B). Burun konisinden geçen anestezi akışını %2'ye ve oksijen akış hızını 1 L/dk'ya ayarlayın.
- Sağ arka bacak, pelvik bölge, sol arka bacak ön yüzü ve kuyruğu sırayla povidon-iyot ve ardından% 70 etanol ile dezenfekte edin.
- Ameliyata başlamadan önce ek bir ayak parmağı sıkıştırma testi ve solunum paternlerinin gözlemlenmesi yoluyla devam eden stabil bir anestezi derinliğini doğrulayın.
- Parlak ışık aydınlatması altında, sağ tibianın proksimal ucunu ortaya çıkarmak için diz ekleminin hemen altındaki deride başlangıç uzunluğu yaklaşık 5 mm olan bir kesi oluşturmak için #15 neşter kullanın (Şekil 2C). Gerekirse kesimi uzatmak için makas kullanın. Sol kontralateral tibiayı yaralanmamış halde tutun, böylece iç yaralanmamış kontrol görevi görür.
- # 15 neşterinin arka tarafını kullanarak proksimal tibiadaki üstteki kas boyunca dikey bir künt diseksiyon yapın ve büyüme plakasının net bir şekilde ortaya çıkması için yumuşak dokuyu çıkarın.
- Ameliyathane ışıklarını kapatın ve büyüme plakasının istenen bölgesini aydınlatmak için doğru floresan kanalını seçin. Floresan kollajenlerin her birini görüntülemek için gereken filtre setleri Col 2 Cyan: ET436 / 20x (uyarma), ET480 / 40 m (emisyon), Col 10 mCherry: ET577 / 20x (uyarma), ET640 / 40 m (emisyon), Col 1 Topaz: ET500 / 20x (uyarma), ET535 / 30 m (emisyon). Proksimal tibial büyüme plakasını gözlemlemek için fareyi konumlandırın (Şekil 2D). Femur büyüme plağının değil, tibial büyüme plağının göründüğünden emin olmak için cilt açıklığını biraz daha proksimal ve ardından distal olarak ayarlayın.
- Mikroskop göz merceğinden bakarken, 0.5 mm'lik dental matkap frezini hipertrofik büyüme plakası bölgesinin ortasında tibial eksene paralel olarak konumlandırarak lateral bir yaklaşım kullanarak Salter-Harris Tip II benzeri bir lezyon oluşturun (Şekil 2E,F). Salter-Harris Tip II lezyonunu taklit eden bir kusuru tekrarlanabilir bir şekilde yapmak için, uzuvu çalışma yüzeyine paralel tutun, böylece frez giriş yolu epifize açı yapmaz. Frez dönüşünü başlatmak için matkap pedalına baskı uygulayın ve kusur frez çapından daha derine inmeden önce frezi büyüme plakasına hafifçe bastırın (Şekil 2G).
NOT: Fare uzuvunu stabilize etmeye yardımcı olan ikinci bir çift el yardımcı olur. - Herhangi bir kalıntıyı temizlemek için lezyon bölgesini bir damla steril PBS ile sulayın.
- Bir periodontal prob kullanarak kusurun derinliğini 0,5 mm'de onaylayın.
4. Yaralanma sonrası prosedürler ve kapatma
- Sıfır zaman kusur karakterizasyonu için, doku kapanmadan önce yaralı arka uzuv ve kontrol uzuvunu hasat edin. Bölüm 6'da doku toplamayı ve sonraki mikrobilgisayarlı tomografi (mikroBT) ve kriyo-histoloji görüntülemesi için hazırlığı takip edin.
NOT: Büyüme plakası defektine terapötik bir maddenin implantasyonunu içeren deneyler için, defektin kendisi yalnızca kabaca küresel ve 0,5 mm çapında veya 0,082 mm3 (0,082 μL) hacminde bir biyomateryal parçasını barındırabilir. - Biyomateryali yerleştirmek veya büyüme plakası içindeki kusura sıvı bir terapötik enjekte etmek için mikroskobik görselleştirme altında forseps kullanın. Çalışma tasarımı, terapötiğin sadece kusurla sınırlı olmasını gerektirmiyorsa, daha büyük miktarda biyomateryal veya enjekte edilen madde kullanın.
- Cilt kenarlarını dikkatlice yeniden hizalayın, eğer varsa, implante edilen materyalin kusur bölgesi içinde güvenli bir şekilde kalmasını sağlayın.
- Cilt kesisini etkili bir şekilde kapatmak için 5-0 poliglikolik asit sütürlerle kesintili dikiş teknikleri kullanın.
- Steril su ile bezler kullanarak povidon-iyot kalıntısının cerrahi bölgesinin dışındaki alanları iyice temizleyin, yara ve yakın çevredeki alanlarla temastan kaçınmaya özen gösterin.
- Fareyi mikroskop tablasındaki izofluran burun konisinden bir kurtarma kafesine çıkarın ve bir ısıtma yastığı üzerinde taze yatak örtüsü üzerine yanal olarak yerleştirin.
- Farenin solunum hızını yaklaşık 5 dakika boyunca yakından gözlemleyin, izofluran anestezisinin etkileri azaldığında, solunum hızında bir artışla gösterilirken, ancak hareketliliğin başlamasından önce analjezi için kalan buprenorfin dozunu uygulayın. Fareyi, tam yürüme yeteneklerini gösterene kadar izole bir kurtarma kafesinde tutun, daha sonra annesi ve kardeşleriyle yeniden bir araya getirin.
- Ameliyattan sonraki ilk 48 saat için günlük denetimler yapın, ardından ötenazi noktasına kadar haftalık değerlendirmeler yapın. Enfeksiyon belirtilerine, hareket etkinliğine, yiyeceğe erişilebilirliğe ve dikişlerin bütünlüğüne odaklanın.
- Fareleri standart zamanda (yani 3 haftalıkken) sütten kesin.
5. Uzuv uzunluğu ölçümleri
- Deneysel hipotez ve tasarım tarafından belirlenen zaman noktalarına dayanarak, fareleri izofluran ile uyuşturun ve Şekil 2A'da gösterildiği ve bölüm 1.4'te açıklandığı gibi hem yaralı hem de yaralanmamış tibiaların tam uzunluğunun X-ışını görüntülemesini yapın. Tutarlı uzuv uzunluğu ölçümleri yapmak için uygun yer işaretleri, Şekil 3'te gösterildiği gibi tibial epifizin üst kısmını ve tibiotalar eklemdeki tibianın distal ucunu içerir.
NOT: Görüntüleme, yaralanmaya bağlı uzuv uzunluğu ve uzuv uzunluğu farklılıklarının yanı sıra belirli postoperatif aralıklarla büyüme plakası dokuları içindeki kemikli köprünün gelişimini değerlendirmek için kullanılır.
6. Doku diseksiyonu, fiksasyon, mikroCT görüntüleme ve gömme
- Fareyi CO2 boğulması yoluyla, tercihen servikal çıkık gibi alternatif bir yöntemle ölüm onayı ile otomatik bir CO2 indüksiyon sistemi kullanarak ötenazi yapın.
- Histolojik ve mikroCT analizine hazırlanırken her iki sağlam arka uzuvları izole edin ve kemik ve diz kapsüler bölgesinden deri ve kasları çıkarın.
- Arka bacakları fiksatife koymadan önce, diz boşluğuna fiksatif penetrasyonu kolaylaştırmak için mikro diseksiyon makası kullanarak patellayı dikkatlice keserek çıkarın. Soğuk% 10 tamponlu formalini diz boşluğunun tüm bölgelerine iyice dağıtmak için 29 G'lık bir insülin şırıngası kullanın. İlik boşluğuna fikratif erişimi iyileştirmek için femur ve tibianın diyafiz bölgesini şiddetlendirin. Eklem dokusunu fiksatif içinde 4 ° C'de 24-36 saat boyunca ince bir dübelin üzerine gazlı bezle bağlayarak tamamen uzatılmış bir konumda tutun.
DİKKAT: Formalin toksiktir ve uygun kişisel koruyucu ekipman giyilirken çeker ocak içinde kullanılmalıdır.
- Arka bacakları fiksatife koymadan önce, diz boşluğuna fiksatif penetrasyonu kolaylaştırmak için mikro diseksiyon makası kullanarak patellayı dikkatlice keserek çıkarın. Soğuk% 10 tamponlu formalini diz boşluğunun tüm bölgelerine iyice dağıtmak için 29 G'lık bir insülin şırıngası kullanın. İlik boşluğuna fikratif erişimi iyileştirmek için femur ve tibianın diyafiz bölgesini şiddetlendirin. Eklem dokusunu fiksatif içinde 4 ° C'de 24-36 saat boyunca ince bir dübelin üzerine gazlı bezle bağlayarak tamamen uzatılmış bir konumda tutun.
- 4 ° C'de 24-48 saat formalin fiksasyonundan sonra, kemik köprüsü gelişiminin değerlendirilmesi için numuneleri PBS'ye aktardıktan sonra mikroCT görüntüleme ile kontralateral ve yaralı numunelerin yüksek çözünürlüklü X-ışını mikroBT'sini gerçekleştirin. 6,0 μm'lik bir voksel boyutu, 330.000 ms'lik örnekleme süreleri ve 145 μA yoğunlukta 55.000 V'luk enerji ayarları kullanın.
- MikroCT görüntülemeden ve 4 ° C'de 24 saatlik ek bir formalin fiksasyonundan sonra, numuneleri 1X PBS'de 3 x 5 dakika durulayın ve ardından numuneleri 1 saat boyunca 1X PBS'de %10 sükroza, 1X PBS'de %20 sükroz içine daldırın 1 saat ve gece boyunca 1X PBS'de% 30 sükroz. Sükroz solüsyonunun tüm diz boşluğu bölgelerine nüfuz etmesini sağlamak için sükroz solüsyonu ile doldurulmuş 29 G'lik bir insülin şırıngası kullanın. GFP raportörünün ve doku enzimatik aktivitesinin korunmasını sağlamak için gece boyunca sükroz daldırıldıktan sonra gömülmeyecekse -80 °C'lik bir dondurucuya aktarın.
- Gömmeden önce eklem bölgesinde kalan kas dokusunu çıkarın. Numuneyi gece boyunca kriyo gömülü bir ortamla dengeleyin ve ortamın diz boşluğuna nüfuz etmesini kolaylaştırın.
- Gömmeden önce defektin ve kemik köprüsünün nerede olduğunu belirlemek için mikroCT görüntülerini görüntüleyin. Kriyo gömme ortamının ince bir tabakasını bir kriyokalıba uygulayın ve disseke edilmiş ve hala bağlı olan tibia/femur/eklemi, ilgilenilen bölge gömme ortamının yüzeyine 90° bakacak şekilde yerleştirin.
NOT: Bu yönlendirme, kesitlemenin yanal olarak oluşturulan kusurun yanal görünümünü yakalamasına izin verir. Kemikli köprü defektin kenarına yakınsa, bu oryantasyon aynı zamanda dokudan alınan ilk daha kalın bölümler sırasında ilgilenilen bölgeyi kaçırma olasılığını da ortadan kaldıracaktır. - Kriyo kalıbı, kriyo gömme ortamı katılaşana kadar kuru buz üzerine yerleştirin ve numuneyi sabitleyin. Kriyokalıbı kuru buz üzerinde tutarken ortamla doldurmaya devam edin.
- Numuneyi sabitledikten sonra, kriyokalıbı tamamen donana kadar kuru buzla soğutulmuş 2-metil-bütan içine daldırın. Dondurma sonrası, fazla 2-metil-bütanı çıkarın, kriyokalıpları selofan içine sarın ve -20 °C veya -80 °C'de saklayın.
NOT: Kriyo gömülü bir ortamda 1-2 aydan daha uzun süreli saklama için, kurumayı önlemek için -80 °C önerilir. Bant destekli kriyoseksiyon ve bölümlerin cam slaytlara yapıştırılması daha önce açıklanmıştır23.
7. Sıralı görüntüleme, boyama ve yeniden görüntüleme
- Daha önce tarif edildiği gibi aynı doku kesiti içinde birden fazla biyolojik sinyalin tespit edilmesini ve kolokalizasyonunu kolaylaştırmak için sıralı bir görüntüleme, boyama ve yeniden görüntüleme prosedürü uygulayın23. Özellikle üç renkli kollajen raportör farelerden alınan büyüme plakası bölümleri için aşağıdaki adımlar önerilir. Bu sıralı yaklaşım, hem moleküler sinyallerin hem de yapısal detayların kapsamlı bir şekilde görselleştirilmesini sağlar.
- Başlangıçta, ilk görüntüleme turunda üç kollajen için endojen floresan sinyalleri yakalayın.
- Mineralize doku23 için kalsein mavisi boyama ve görüntü uygulayın, ardından tartarat dirençli asit fosfataz (TRAP) enzimatik aktivite boyama ve görüntüleme23 uygulayın.
NOT: TRAP enzimatik aktivite boyama sonuçları burada gösterilmezken, bu boyama adımı, temsili sonuçlar bölümünde sunulan Safranin O / Fast Green boyama sonuçlarından önce mineralin uzaklaştırılması için gerekli olduğu için gerçekleştirilir. - Aşağıda anlatıldığı gibi 4',6-diamidino-2-fenilindol (DAPI) nükleer boyama yapın ve ardından görüntü oluşturun.
- Önceden görüntülemeden geçmiş slaytları 1x PBS içeren bir Coplin kavanozuna yerleştirin. Lameller slaytlardan ayrılana kadar su altında bırakın. Ayrıldıktan sonra lamelleri çıkarın ve iyice kurulayın.
- % 50 gliserol ve 1x PBS karışımı içinde 1: 1.000 oranında DAPI seyreltmesi kullanarak lamellere DAPI karşı boyama solüsyonu uygulayın. Uygulama sonrası görüntüleme işlemine devam edin.
- Doku mimarisini ve ardından görüntüyü vurgulamak için Safranin O / Fast Green boyasının uygulanmasıyla sonlandırın.
NOT: Bunu, kromojenik görüntüleri floresan sinyallerle ilişkilendirmek için son adım olarak gerçekleştirin.- Weigert'in Demir Hematoksilen çözeltilerini hazırlayın. 1 g hematoksilini 100 mL% 95 etanol içinde çözerek Çözelti A'yı ve 4 mL% 29 Ferrik klorür çözeltisi, 95 mL deiyonize su ve 1 mL konsantre HCl'yi birleştirerek Çözelti B'yi hazırlayın. Weigert'in yaklaşık 4 hafta boyunca stabil olan çalışan hematoksilen çözeltisini oluşturmak için Çözelti A ve B'nin eşit parçalarını karıştırın.
- Nemlendirmek için slaytları 2 x 2 dakika deiyonize suya batırın.
- Weigert'in çalışan hematoksilen solüsyonunu 5 dakika boyunca uygulayın.
- Slaytları musluk suyunda 5 dakika, ardından kısa bir süre deiyonize suda 1 dakika yıkayın.
- % 0.2 Fast Green solüsyonu (100 mL deiyonize suda 0.2 g Fast Green FCF (100 mL deiyonize su) ile 2 dakika boyunca boyayın.
- % 1 asetik asit içinde 1 dakika boyunca kısaca durulayın.
- % 0.1 Safranin O çözeltisi (100 mL deiyonize su içinde 0.1 g Safranin O) ile 1 dakika boyunca boyayın.
- Görsel olarak dengeli bir renk elde edene kadar yaklaşık 5 dakika deiyonize suda durulayın.
- Slaytları deiyonize suya% 30 gliserol içinde monte edin (PBS'den kaçının) ve dokudan renk yayılımını önlemek için hemen görüntülemeye devam edin. Büyüme plakasının dinlenme bölgesi hücrelerini vurgulamak için görüntüyü bir Cy5 filtresi ile iletin: ET640/30x (EX), ET690/50 m (EM).
Sonuçlar
Bu protokol, cerrahi rehberlik için tip X kollajen tarafından yayılan doğal kırmızı floresanstan yararlanarak proksimal tibiada bir lateral büyüme plakası defektini hassas bir şekilde indüklemek için üç soylu floresan raportör fareleri kullanır. Cerrahın mCherry filtre seti ile stereomikroskop göz merceğinden bakarken sahip olduğu görüntü Şekil 2D'de gösterilmiştir. Doğal Tip X floresan, cerrahın frezi hipertrofik bölgeye yerleştirmesine ve kemikli bir köprüye yol açan yaygın bir büyüme plakası yaralanmasını taklit eden bir yaralanma oluşturmasına izin verir (Şekil 2F). Kırmızı kanalın altındaki floresan en parlak olanıdır ve bu nedenle frez yerleştirme sırasında kullanılması önerilir. Alternatif olarak, deneyin amacı, hipertrofik bölge ve bitişik kalsifiye bölge dışında büyüme plakasının diğer bölgelerindeki yaralanmaları incelemekse, üçlü transgenik farelerin doğal floresansının diğer renkleri kullanılarak kusur oluşturma yönlendirilebilir.
Büyüme plakasının hipertrofik bölgesinde ve bitişik alt kemik dokusunda 0.5 mm çapında bir diş frezi kullanılarak Salter-Harris Tip II benzeri bir defektin oluşturulması, N = 3 faredeki yaralanmamış lateral kontrollere kıyasla yaralı (zaman 0) proksimal tibiaların mikroBT ve kriyo-histoloji görüntülemesi ile doğrulandı (Şekil 4). Kusurların 3D mikroBT görüntülerinde görülmesi zordu, ancak 2 boyutlu kesitlerde tespit edilebilirdi (Şekil 3A, B, E, F). Şekil 3G , tip I kollajen üreten kemik hücrelerinin (yeşil floresan), tip II kollajen üreten proliferatif kondrositlerin (camgöbeği floresan) ve tip X kollajen üreten hipertrofik kondrositlerin dağılımını göstermektedir. Yaralı farenin görüntüsünde (Şekil 4G), hipertrofik bölgede, geçici olarak kalsifiye olmuş tabakada ve proliferatif bölge sadece hafifçe bozulmuş olarak kontrole göre en yeni oluşan kemiğin bir kısmında bir bozulma vardır. Safranin O / Hızlı Yeşil boyama (Şekil 4H), tüm hücreler açıkça görülebildiğinden, yaralı büyüme plakası içindeki kusurun yerini en iyi şekilde gösterir.
X-ışını analizi, bu tip büyüme plakası yaralanmasının zaman içinde tibia uzunluğu ve kemik köprüsü oluşumu üzerindeki etkisi konusunda canlı fareler hakkında bazı bilgiler sağlar (Şekil 3). Ameliyattan önce ve ameliyattan 3 hafta sonra çekilen, yaralanmamış (Şekil 3A) ve yaralı (Şekil 3B) tibialar arasındaki karşılaştırmalı görüntüleme, büyük miktarda uzuv büyümesi, büyüme plakalarının incelmesi ve 3 haftada yaralı büyüme plakası alanında gelişen belirgin bir opak bölge ortaya koymaktadır. Büyüme plakası içindeki bu opaklık, yaralanmamış muadillerinde veya ameliyattan önce farelerde mevcut değildir. Bu nedenle Faxitron, canlı farelerde yaralanmanın neden olduğu, kemikli bir köprü oluşumu ve uzuv uzunluğundaki değişiklikler gibi patolojik değişiklikleri gözlemlemenin bir yoludur.
Diseke kemiklerin mikroBT görüntülemesi, ameliyattan üç hafta sonra yaralı büyüme plakaları içinde kemik köprüsü oluşumunun ayrıntılı bir görselleştirmesini sunar (Şekil 5). Şekil 5'te gösterilen altı farklı yaralı fareden alınan görüntülerde görüldüğü gibi, tüm farelerde tutarlı bir kemik köprüsü gelişimi vardır. Scanco Medical yazılımı kullanılarak, kemikli köprü hacmi, proksimal tibial büyüme plakasının her bir bölümü gözden geçirilerek, kemikli köprünün alanını seçme aracıyla tanımlayarak (Şekil 5B) ve ardından toplam hacmi elde etmek için tüm büyüme plakası hacmi boyunca her bir bölüm alanını entegre ederekhesaplandı 24. Bu şekilde hesaplanan kemikli köprü hacmi 0.0761 mm3 ± 0.0246 idi (ortalama ± standart sapma, N = 6). Kemikli köprülerin çoğu, büyüme plakasının merkezinin yanı sıra dış kenarı da yaralayan yanal yaklaşıma rağmen, büyüme plakasının ortasına yakın bir yerde oluşur. Bu fenomen, kemik köprüsü oluşumundan perikondriyum yerine kemik iliğinden elde edilen mezenkimal kök hücrelerin (MSC'ler) sorumlu olduğu gerçeğine bağlanabilir25.
Bu üç renkli transgenik farelerde, yaralı büyüme plakasının kriyo-histolojik analizi, doğal kollajen floresansı ile zenginleştirilir (Şekil 6). Yaralanma bölgesindeki kemik hücrelerinin ve kondrositlerin karmaşık etkileşimini ortaya çıkarır. Şekil 6J,K'da gösterilen mikroBT görüntüleri, gömme ve kesit alma işlemlerine rehberlik etmesi için histoloji teknisyenine sağlandı. Tip I kollajen üreten kemik hücreleri Şekil 6L,O,P'de (yeşil floresan), tip II kollajen üreten proliferatif kondrositler ise Şekil 6L,O,Q'da (camgöbeği floresan) görülmektedir. Tip X kollajen üreten hipertrofik kondrositler Şekil 6L,O,R'de (kırmızı floresan) görülmektedir. Bu çok renkli floresan yaklaşımı, mineralize doku zemininde kemik köprü alanı içindeki ameliyat sonrası kondrosit farklılaşmasının ayrıntılı bir şekilde incelenmesini sağlar. Büyüme plakası alanı içindeki tüm hücre tiplerinin dağılımını doğrulamak için DAPI boyaması kullanıldı (Şekil 6M). Safranin O / Fast Green boyaması, yaralı büyüme plakası içindeki kıkırdak ve kemiğin kompozit ve yapısal organizasyonunu gösterir (Şekil 6N). Bu lekeli bölümlerin bir Cy5 filtre seti altında görüntülenmesi, epifiz kemiği ve kıkırdak arasındaki arayüzdeki dinlenme bölgesi hücrelerini önemli ölçüde aydınlatır.
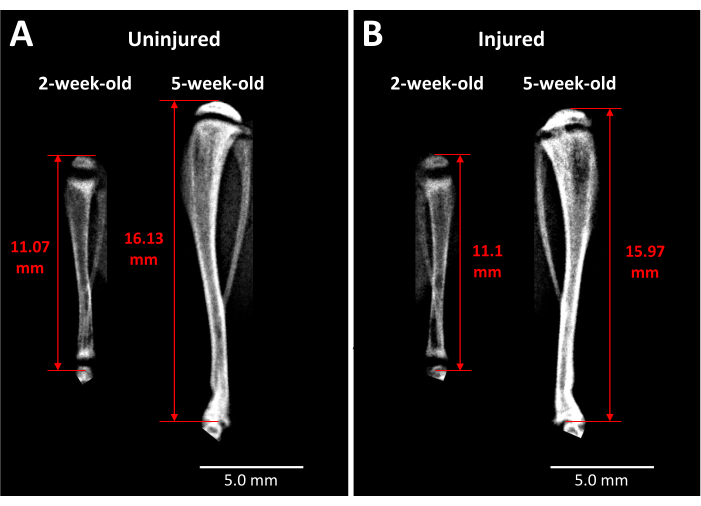
Şekil 3: Kontralateral kontrol ve yaralı fare tibialarının röntgen görüntüleri. (A) Kontralateral kontrol tibiasının röntgen görüntüleri, fareler 2 haftalıkken yaralanmadan hemen önce ve fareler 5 haftalıkken ameliyattan 3 hafta sonra çekilir ve bu süre zarfında meydana gelen büyümenin derecesini gösterir. (B) (A)'daki ile aynı zaman noktalarında aynı fareden yaralanmış tibia. Tibia uzunluğu ölçümleri için kullanılan yer işaretleri, proksimal tibia başının tepesinden ayak bileği eklemindeki tibianın sonuna kadardır (kırmızı çift başlı oklar). Opak kemikli köprü, 5 haftada yaralı proksimal tibia büyüme plakasında görülebilir. Ölçek çubukları = 5,00 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
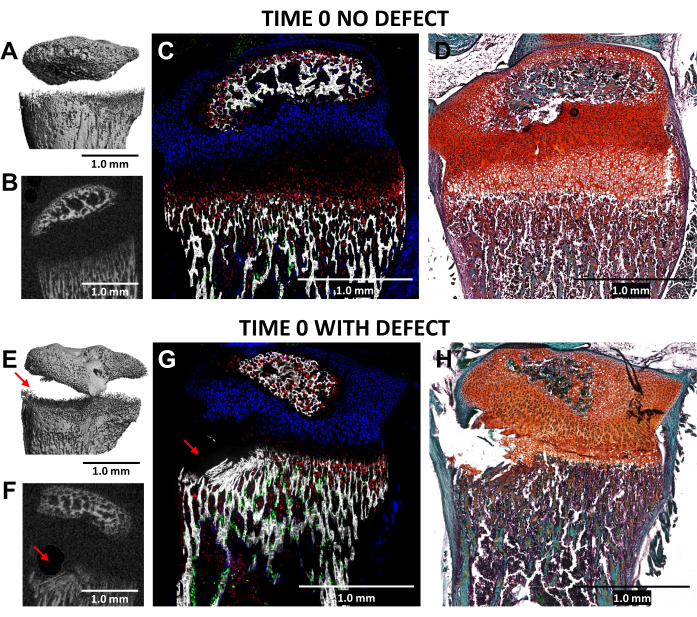
Şekil 4: MikroBT ve histolojik görüntüler, zaman sıfır kontralateral kontrol ve yaralı fare proksimal tibiaları. (A, E) ve (B, F), 3D ve enine 2D mikroBT görünümlerini gösterir ve kusur (E) ve (F) 'de kırmızı oklarla gösterilir. (C,G) Kompozit, doğuştan gelen üç floresan tabakasını mineralize bir doku tabakası ile birleştiren birleştirilmiş kriyo-histolojik görüntüler. Yeşil hücreler (Col3.6GFPtpz) tip I kollajen üreten kemik hücreleridir, camgöbeği mavi renkli hücreler (Col2A1GFPcyan) tip II kollajen üreten proliferatif kondrositlerdir ve kırmızı hücreler (Col10A1RFPchry) tip X kollajen üreten hipertrofik kondrositlerdir. (D,H) (C) ve (G) ile aynı bölgenin Safranin O / Hızlı Yeşil boyanması. Ölçek çubukları = 1,0 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
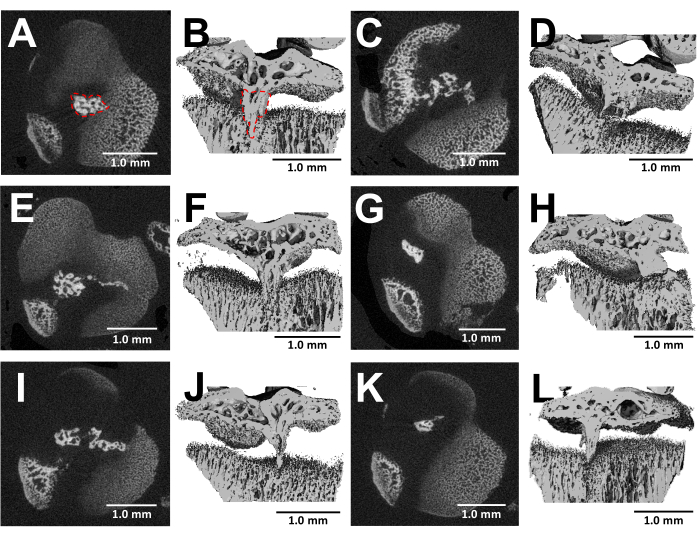
Şekil 5: Bu protokol ile oluşturulan kemik köprülerin mikroBT görüntüleri. (A,C,E,G,I,K) Bur defekti oluşturulduktan 3 hafta sonra altı farklı farenin proksimal tibial büyüme plakasının enine kesitleri. (A)'da kırmızı noktalı bir çizgi ile özetlenen kemikli köprü. (B,D,F,H,J,L) Uzunlamasına bir düzlem ile kesilmiş 3D rekonstrüksiyonlar. (B)'de kırmızı noktalı bir çizgi ile çevrelenen kemikli köprü. Ölçek çubukları = 1,0 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
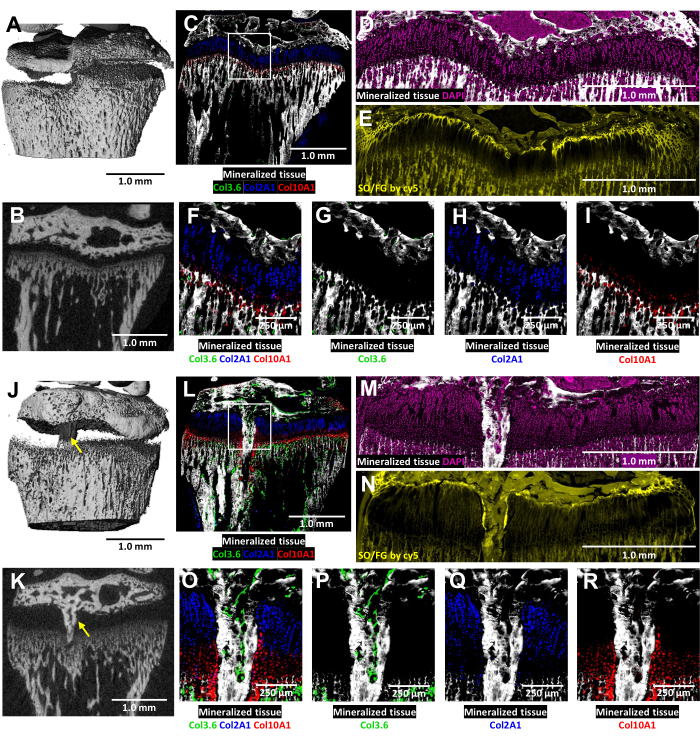
Şekil 6: Kontralateral kontrol ve kemikli köprü oluşumu olan yaralı fare proksimal tibiasının mikroBT ve histolojik görüntüleri. (A, J) ve (B, K) 3D ve enine 2D mikroCT görünümlerini gösterir ve kemikli köprü (J) ve (K) 'de sarı oklarla gösterilir. (C,L) Kompozit, doğuştan gelen üç floresan tabakasını mineralize bir doku tabakası ile birleştiren birleştirilmiş kriyo-histolojik görüntüler. Yeşil hücreler (Col3.6GFPtpz) tip I kollajen üreten kemik hücreleridir, camgöbeği mavi renkli hücreler (Col2A1GFPcyan) tip II kollajen üreten proliferatif kondrositlerdir ve kırmızı hücreler (Col10A1RFPchry) tip X kollajen üreten hipertrofik kondrositlerdir. Beyaz kutu, F ve O panellerinde gösterilen daha yüksek büyütmeyi gösterir. (D,M) C ve L panellerinin büyüme plakası alanındaki mineralize doku ve DAPI boyaması. (E,H) (D) ve (M) ile aynı bölgenin Safranin O / Hızlı Yeşil boyaması cy5 floresan ile taranır. (F,O) C ve L panellerinin birleştirilmiş görüntüsünde büyüme plakası alanının daha yüksek bir büyütmesi. (G-I,P-R) Mineralize bir doku zemini ile gösterilen doğal floresanın bireysel kanalları. Ölçek çubukları = 1.0 mm (AE) ve (JN), = 250 μm (FI) ve (ER). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Üç renkli kollajen raportör farelerin yenilikçi kullanımı, önceden belirlenmiş bir boyut ve konuma sahip büyüme plakası kusurlarının oluşturulmasını sağlayarak, büyüme plakası yaralanmaları için murin deneysel modellerinin doğruluğunu önemli ölçüde artırır. 2 haftalık farelerin küçük boyutu göz önüne alındığında, uzvun zayıflamasını ve tam kalınlıkta bir kırığa neden olmasını önlemek için yaralanmayı oluşturmak için 0,5 mm'lik küçük bir frez kullanmak çok önemlidir. Cerrah ayrıca, aynı nedenle kemiğe çok derinden delmekten kaçınmak için kusuru oluştururken yeterli basınç uygulamalıdır. Periyoprobun kullanımı, tutarlı bir yaralanma derinliğini doğrulamak için kritik öneme sahiptir.
Herhangi bir ameliyatta olduğu gibi, ara sıra bir ayak parmağı sıkışması ile onaylanan yeterli bir anestezi derinliğini doğrulamak önemlidir ve sterilite boyunca korunur. Bir başka cerrahi önemli nokta, yumuşak dokuya zarar vermekten kaçındığı ve farelerin anesteziden iyileştikten hemen sonra beslenme ve rahatlık için anne fareye ulaşmak için yürüyebilmelerini sağlamaya yardımcı olduğu için bir oymacı ile künt diseksiyonun tarif edilmiş olmasıdır. Deneyimlerimize göre, dikişlerle kapatılan yaralar başarılı bir şekilde kapanmıştır ve yara klipslerine gerek yoktur. Büyüme plakası kırıkları yaşayan küçük çocuğu en iyi şekilde taklit etmek için 2 haftalıkken fareler üzerinde ameliyat yapılması önerilir. Bu protokolün bir dezavantajı, doğumun öngörülemeyen doğası göz önüne alındığında, bu fare modelinin kullanılmasının cerrahın kısa sürede hazır bulunmasını gerektirmesidir.
Defekti oluşturmak için frezin konumlandırılması ile ilgili olarak, protokol, kollajen X floresansının parlaklığı nedeniyle büyüme plakası içindeki hipertrofik bölgeyi aydınlatan bir mCherry / Texas kırmızı filtre seti kullanılarak yaralanmanın oluşturulmasını açıklar. Yaralanmanın tibial büyüme plakası içinde oluşturulduğundan emin olmak için, femur değil proksimal tibial büyüme plakasının göründüğünü doğrulamak için yumuşak doku açıklığını hafifçe sola ve sağa hareket ettirmek faydalıdır. Proliferatif kondrosit bölgesini veya bitişik kemik bölümlerini aydınlatmak için filtre ayar kanalları arasında geçiş yapmak, proliferatif bölgenin ve bitişik kemik bölümlerinin konumuna göre doğru yerleşimi doğrulamak için yararlıdır.
Canlı farelerde floresan mikroskobu altında proliferatif kondrosit zonu ile epifiz ve metafiz kemiği ayırt edilebilirken, Tip II ve Tip I kollajen raportörlerinin gerçek değeri, büyüme plağının histolojik analizi sırasında fark edilir. Kriyo-histolojik işlemlerin sulu doğası göz önüne alındığında, dehidrasyon adımlarının neden olduğu floresan görüntüleme ile rengin potansiyel yanlış hizalanması nedeniyle geleneksel kromojenik boya çökeltme protokolleri uygun değildir. Sulu protokol, parafin bölümlerindekine benzer boyama desenleri vermesine rağmen, dokudan boya difüzyonunu önlemek için hızlı boyama sonrası görüntüleme gereklidir. Montaj ortamı olarak damıtılmış suda% 30 gliserol kullanmak bu difüzyonu yavaşlatabilir ve Safranin O / Fast Green ile kıkırdak da dahil olmak üzere aynı bölümde çoklu kromojenik boyamaya izin verebilir.
Endokondral ossifikasyon süreci, gelişen kemikli köprüyü kaplayan kırmızı kondrositler ile açıkça görülebilir (Şekil 6). Birçok murin antikorunun mevcut olduğu immünohistokimya tekniklerinin ek kullanımı, bu transgenik farelerde yürütülen mekanik çalışmaları daha da geliştirebilir. Toplamda, bu transgenik fare modelinde faksitron, mikroBT ve kriyo-histolojik görüntüleme tekniklerinin kombinasyonu, büyüme plakası yaralanmalarına yanıt olarak meydana gelen makroskopik ve mikroskobik değişikliklerin kapsamlı bir şekilde anlaşılmasını sağlayarak, bu tür olumsuz sonuçları hafifletmek için gelecekteki terapötik müdahalelerin önünü açar. Bu transgenik farelerin daha fazla genetik manipülasyonu, iyileşmeye zamansal ve mekansal olarak dahil olan hücrelerin kökenini anlamak için soy izleme çalışmalarına izin vermek için yapılabilir. Ek modifikasyonlara sahip fareler üzerinde deney yapılması, osteokondrom gibi kıkırdak hastalıklarının incelenmesine izin verecektir - büyüme plakasının yakınında kıkırdak ve kemiğin aşırı büyümesi.
Modelimizin tutarlılığı, eklem kıkırdak yaralanması nedeniyle gruptan herhangi bir fareyi atmaya gerek kalmadan tüm farelerde tekrarlanabilir kemik köprüleri oluşumu ile gösterilmiştir. Bu, büyüme plakasının altındaki kortikal bir pencereden büyüme plakasına yaklaşan ve keskin bir alet veya frezi büyüme plakasına doğru yukarı doğru açılı hale getiren ve bazen eklem kıkırdağına doğru aşacak olan önceki modellere göre bir gelişmedir. Eklem kıkırdağının ek bir yaralanması, çocuklarda yaygın olarak görülen büyüme plakası yaralanmalarını taklit etmez. Bu hayvan modelinin daha hassas bir şekilde yaralanması, deney başına gereken fare sayısını azaltır ve bu da başka bir gelişmedir. Transgenik farelerin kullanılması, araştırmacının yaralanmayı, eklem kıkırdağını etkilemeden hipertrofik/geçici olarak kalsifiye alan veya epifiz/dinlenme bölgesi/proliferatif bölge alanı gibi büyüme plakasının alt bölümlerine odaklamasına izin verir. Bununla birlikte, bu modelin bir sınırlaması, yaralı hayvanlar arasında% 30'a kadar farklılık gösterebilen kemikli köprü hacmindeki değişkenliktir. Sonuç olarak, kemikli köprü oluşumu üzerinde klinik olarak anlamlı bir etkinin tespit edilmesi, istatistiksel alakalılık elde etmek için hala çok sayıda hayvanı gerektirir.
Daha önceyayınlanan sıçan veya tavşan büyüme plakası yaralanma modellerine kıyasla burada açıklandığı gibi bir fare modelinin faydaları 7,9,10,14, daha az sayıda hayvan kullanımı, maliyet azaltma, tekrarlanabilir kemik çubuğu oluşumu nedeniyle verimli bir çoğaltma boyutu, daha kısa bir çalışma süresi çerçevesi ve üçlü transgenik farelerin canlı görüntülenmesi nedeniyle daha hassas yaralanma yerleşimi. Ayrıntılı olarak tartışılmasa da, bu fare modeli, doku mühendisliği implantlarını veya büyüme faktörleri sağlayan biyomalzemeleri test etmek için kullanılabilir. Bu murin yönteminin dikkate değer bir sınırlaması, terapötik ilaçlar veya hücreler vermek için kullanılan bir implantın boyutunun, kabaca 0,5 mm çapında bir kürenin kusur hacmi ile sınırlı olmasıdır. Sadece daha büyük hayvan modelleri, insan hastalarda kullanılacak test materyalinin hacmini barındırabilir. Bu protokolde oluşturulan frez defekti, ince bir kırık ile aynı geometriye sahip değildir ve bu nedenle gerçek insan yaralanmalarından farklıdır. Bununla birlikte, bu fare modelinin faydaları çoktur ve yanal yaklaşım, tibial uzun eksen doğrultusunda büyüme plakasının üstüne veya altına körü körüne yaklaşırken ortaya çıkacak eklem kıkırdağına zarar vermekten kaçınır. Bu metodoloji, patolojiyi araştırmak ve yeni terapötik stratejileri değerlendirmek için ayrıntılı ve tekrarlanabilir bir yöntem sağlayarak, büyüme plakası yaralanması araştırmalarında önemli bir sıçramayı temsil eder.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri, Ulusal Artrit ve Kas-İskelet ve Deri Hastalıkları Enstitüsü (NIAMS) 1R21AR079153 ve Connecticut Üniversitesi Araştırma Geliştirme Programı (REP) hibesi ile desteklenmiştir. Yazarlar, Connecticut Üniversitesi MicroCT Görüntüleme Çekirdeği tesisinden Renata Rydzik'in yardımına teşekkür etmek isterler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
Referanslar
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır