Method Article
مراقبة نشاط التكرار الغني بالليوسين الذي يحتوي على 8 قنوات (LRRC8/VRAC) باستخدام نقل طاقة الرنين Förster بالانبعاث المحسس (SE-FRET)
In This Article
Summary
الفيزيولوجيا الكهربية هي المعيار الذهبي للتحقيق في نشاط القناة الأيونية. ومع ذلك ، هناك الكثير من الأساليب البديلة ، بما في ذلك الطرق البصرية. هنا ، نصف طريقة لمراقبة نشاط التكرار الغني بالليوسين الذي يحتوي على قنوات أنيون مكونة من 8 قنوات (LRRC8) باستخدام طريقة قائمة على نقل طاقة رنين فورستر بين الوحدات الفرعية (FRET).
Abstract
يشكل أعضاء عائلة البروتين LRRC8 قنوات أيون غير متجانسة وأوسموليت لها أدوار في العديد من العمليات الفسيولوجية. كقنوات أنيون منظمة الحجم (VRACs) / قنوات تصحيح خارجية حساسة للحجم (VSORs) ، يتم تنشيطها عند تورم الخلايا التناضحية وتتوسط في بثق الكلوريد والأوسموليتات العضوية ، مما يؤدي إلى تدفق الماء وبالتالي انكماش الخلية. بالإضافة إلى دورها في تنظيم الحجم التناضحي ، فقد تورطت VRACs في العمليات الخلوية مثل التمايز والهجرة وموت الخلايا المبرمج. من خلال تأثيرها على إمكانات الغشاء ونقلها لجزيئات الإشارات المختلفة ، يلعب التكرار الغني بالليوسين الذي يحتوي على 8 قنوات (LRRC8) أدوارا في التواصل بين الخلايا العصبية الدبقية ، وإفراز الأنسولين ، والاستجابة المناعية. ظلت آلية التنشيط بعيدة المنال. عادة ما تتم دراسة قنوات LRRC8 ، مثل القنوات الأيونية الأخرى ، باستخدام طرق الفيزيولوجيا الكهربية. هنا ، نصف طريقة للكشف عن تنشيط قناة LRRC8 عن طريق قياس نقل طاقة رنين فورستر بالانبعاث المحسس داخل المعقد (SE-FRET) بين البروتينات الفلورية المدمجة في مجالات التكرار الغنية بالليوسين الطرفية C للوحدات الفرعية LRRC8. توفر هذه الطريقة إمكانية دراسة تنشيط القناة في الموقع دون تبادل البيئة العصارة الخلوية وأثناء عمليات مثل تمايز الخلايا وموت الخلايا المبرمج.
Introduction
تم العثور على القنوات الأيونية المكونة من غيري التكرار الغني بالليوسين الذي يحتوي على 8 (LRRC8) بروتينات عائلية في جميع أنحاء خلايا الفقاريات ، وتشارك في مجموعة واسعة من الوظائف الفسيولوجية1،2. تلعب قنوات LRRC8 هذه ، التي تم تحديدها لأول مرة على أنها قنوات أنيون منظمة لحجم الصوت (VRACs) أو قنوات تصحيح ظاهرية حساسة لمستوى الصوت (VSOR) ، دورا مهما في انخفاض الحجم التنظيمي الخلوي 3,4. إنها تسهل طرد أيونات الكلوريد والأوسموليتات العضوية ، والتي يتبعها تدفق المياه استجابة للتورم التناضحي. بالإضافة إلى دورها في الاستجابة للإجهاد التناضحي ، فقد تم ربط دورها في تنظيم الحجم الخلوي بتكاثر الخلايا وهجرتها ، وموت الخلايا المبرمج ، وتكوين المنوية ، والسلامة الظهارية5،6،7. ثبت أن تغيير إمكانات الغشاء عند تنشيط LRRC8 / VRAC يساهم في تمايز الأنبوبالعضلي 8 وإفراز الأنسولين بواسطة خلايا β البنكرياس9،10،11. علاوة على ذلك ، تجري قنوات LRRC8 مجموعة متنوعة من الأسموليتات العضوية مثل جزيئات الإشارات البيورينرجية ATP و cGAMP أو غلوتامات الحمض الأميني المثير ، مما يضع هذه القنوات في اتصال الخلية الخلوية في الجهاز المناعي أو التفاعل بين الخلايا الدبقيةوالخلايا العصبية 12،13،14،15،16،17،18،19،20 ،21،22. حتى الكائنات الغريبة الحيوية ، مثل صبغة الفلورسين ، أو المضاد الحيوي بلاستيسيدين S أو عقار سيسبلاتين المضاد للسرطان ، يتم إجراؤها بواسطة قنوات LRRC823،24،25.
هناك العديد من التقارير حول نقل الإشارة المؤدي إلى تنشيط LRRC8 / VRAC26 ، 27 ، 28. ومع ذلك ، لا تزال الآلية غير واضحة ، وتقدم الأدبيات مجموعة واسعة من الآليات المحتملة التي يمكن أن تعتمد على العملية الفسيولوجية المحددة. وتشمل هذه التغييرات في قوة أيون العصارة الخلوية ، والتفاعل مع الهيكل الخلوي ، وتكوين الغشاء ، وبروتينات G ، وحالة الأكسدة والاختزال ، وشلالات الفسفرة2،27،29،30،31.
تحتوي قنوات LRRC8 / VRAC على LRRC8A كوحدة فرعية أساسية3،4 يجب أن تتغير مع واحدة على الأقل من paralogues LRRC8B-E لتشكيل قنوات وظيفية من الناحيةالفسيولوجية 4،14،32. يحدد تكوين الوحدة الفرعية الخصائص الفيزيائية الحيوية للقناة ، مثل التصحيح والتعطيل المعتمد على إزالة الاستقطاب4،29،32،33،34 ، وخصوصية الركيزة15،17،20،21،24،35 ، وبعض مساراتالتنشيط 36،37. تظهر هياكل المجهر الإلكتروني بالتبريد (cryo-EM) أن متجانسات LRRC8A ، وكذلك غيرية المعايرة ، تتجمع على شكل سداسي38،39،40 ، في حين أن كيميرات LRRC8A / LRRC8C التي تشكل قنوات وظيفية هي سباعي41. يتكون الجزء الطرفي N من جميع بروتينات LRRC8 من أربعة حلزونات عبر الغشاء ، ويحتوي الجزء الطرفي C على مجال به تكرارات غنية بالليوسين (LRRD). توفر الهياكل المعقدة LRRC8 المتاحة دليلا على أن LRRDs ، التي تمتد إلى العصارة الخلوية3،4،23 ، قد تخضع لإعادة ترتيب توافقية أثناء بوابة القناة34،42،43. يتم تأكيد هذه الفكرة من خلال اكتشاف أن الاندماج الطرفي C للبروتينات الفلورية يؤدي إلى نشاط القناة القاعدية14 وأن ارتباط الأجسام النانوية بالمجالات يمكن أن يعدل نشاطالقناة 44. علاوة على ذلك ، تم عرض التعديلات التوافقية في C-termini من خلال نقل طاقة رنين Förster داخل المركب (FRET) 45.
الطريقة الأكثر شيوعا لدراسة نشاط القناة الأيونية هي القياسات الفيزيولوجية الكهربية46 ، والتي تم تطبيقها على نطاق واسع في التحقيق في VRACs قبل تحديدها الجزيئي47. ومع ذلك ، هناك العديد من الطرق الإضافية لمراقبة نشاط VRAC بشكل غير مباشر ، بما في ذلك قياس ركائزها التي يتم إجراؤها - أيونات الهاليد أو الأسموليتات العضوية - أو تأثيرها على حجم الخلية48. في الواقع ، اعتمد تحديد بروتينات LRRC8 على أنها VRAC على اختبار يعتمد على تبريد بروتين الفلورسنت الحساسللهاليد 49 عن طريق دخول اليوديد إلى الخلية من خلال VRACsالمنشطة 3،4. هناك طريقة أخرى لمراقبة نشاط قناة LRRC8 / VRAC تستفيد من حركة مجالات العصارة الخلوية التي يمكن ملاحظتها ، كما هو الحال في القنوات الأيونيةالأخرى 50،51،52،53 ، من خلال التغييرات في FRET45. تحقيقا لهذه الغاية ، تم دمج البروتينات الفلورية التي تعمل كأزواج FRET ، مثل بروتين الفلورسنت السماوي (CFP) / mCerulean3 كمانح والبروتين الفلوري الأصفر (YFP) / mVenus كمتقبل ، في C-termini لبروتينات LRRC8 (الشكل 1). تم عرض FRET داخل المعقد بين الوحدات الفرعية LRRC8 من خلال تجارب التبييض الضوئي المتقبل45. لتجنب طريقة التبييض الضوئي المدمرة ، تمت مراقبة تغيرات FRET بمرور الوقت بواسطة FRET بالانبعاث المحسس (SE-FRET) ، حيث يتم قياس الانبعاث المحس للمستقبل عند إثارة المتبرع بسبب تداخل طيف الانبعاث للمانح مع طيف الإثارة للمستقبل. أدى تطبيق نقص التوتر خارج الخلية ، وهو حافز لتنشيط LRRC8 / VRAC ، إلى انخفاض قابل للعكس في شدة SE-FRET45. الأهم من ذلك ، أن القياسات المتزامنة لتثبيت مشبك الخلية الكاملة ومراقبة FRET أثناء العلاج بنقص التوتر أظهرت أن هذا الانخفاض في FRET يعكس بالفعل تنشيط LRRC8 / VRAC45. توفر هذه الطريقة، التي تتجنب تعطيل غشاء البلازما أو تغيير البيئة داخل الخلايا بواسطة محلول الماصة، بديلا لمراقبة نشاط LRRC8/VRAC. إنه مفيد بشكل خاص في الإعدادات الفسيولوجية حيث يكون الحفاظ على العصارة الخلوية الأصلية أمرا بالغ الأهمية ، أو يكون الدقة تحت الخلوية ضروريا ، أو يلزم مراقبة نشاط القناة لفترات طويلة.
هنا ، نقدم بروتوكولا لدراسة LRRC8 / VRAC مع مثل هذه القراءة المستندة إلى FRET. يصور البروتوكول كيفية التعامل مع الخلايا ونقلها ، والحصول على عينات وصور التحكم ، وتحليل البيانات ، وحساب قيم FRET (SE-FRET) للانبعاث المحسوس.
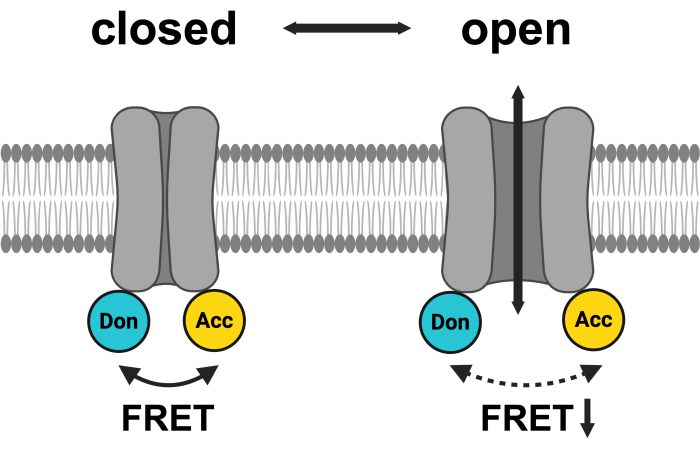
الشكل 1: تخطيطي لنظام زوج LRRC8 FRET. يظهر mCerulean3 باللون السماوي ، ويظهر mVenus باللون الأصفر. بعد فتح VRAC ، تتغير المسافة (و / أو الاتجاه المكاني) بين الفلوروفورات ، مما يؤدي إلى انخفاض نقل الطاقة بين المتبرع (Don) والمتلقي (Acc) ، وبالتالي خفض FRET المرصود. تم إنشاؤه باستخدام BioRender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. تحضير العازلة والكواشف
- قم بإعداد مخازن متوسطة وميساوية التوتر ، وتحت التوتر ، ومفرطة التوتر وقياس الأسمولية للمخازن المؤقتة باستخدام مقياس التناضح للتأكد من أن الأسمولية (Osm) في النطاق المتوقع مع انحراف مقبول فقط.
- وسائط زراعة الخلايا: قم بإعداد وسط النسر المعدل (DMEM) من Dulbecco المكمل بمصل الأبقار الجنيني بنسبة 10٪ و 1٪ بنسلين / ستربتومايسين
- المخزن المؤقت للتصوير متساوي التوتر (~ 340 مللي أسم): قم بإعداد المخزن المؤقت للتصوير متساوي التوتر عن طريق خلط 150 ملي كلوريد الصوديوم ، 6 ملي كلوريد كلوريد ، 1 ملي مللي كلوريد2 ، 1.5 ملي كلوريدالكالسيوم 2 ، 10 ملي مولار د (+) - الجلوكوز و 10 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبيرازين إيثان حمض السلفونيك (HEPES).
- المخزن المؤقت للتصوير الناقص التوتر (~ 250 مللي أسم): قم بإعداد المخزن المؤقت للتصوير المنخفض التوتر عن طريق خلط 105 ملي كلوريد الصوديوم ، و 6 ملي كلوريد كلوريد الصوديوم ، و 1 ملي مولار كلوريدالملزوم 2 ، و 1.5 ملي كلوريد الكالسيوم2 ، و 10 ملي مولار د (+) - الجلوكوز و 10 ملي مولار HEPES.
- المخزن المؤقت للتصوير مفرط التوتر (~ 500 مللي أسم): قم بإعداد المخزن المؤقت للتصوير عالي التوتر عن طريق خلط 160 ملي مولار D (-) -Mannitol و 150 ملي كلوريد الصوديوم و 6 ملي كلوريد الصوديوم و 1 ملي مللي كلوريد2 و 1.5 ملي كلوريدالملن 2 و 10 ملي مولار د (+) -جلوكوز و 10 ملي هيبس.
ملاحظة: يمكن استكمال المخازن المؤقتة بأدوية معينة اعتمادا على ما سيتم فحصه.
2. نمو الخلايا الملتصقة على أطباق القاع الزجاجي
- قم بإعداد طبق واحد على الأقل للتعداء فقط مع البروتين محل الاهتمام (POI) المدمجة إما مع المتبرع أو المتقبل الفلوروفور وطبق واحد على الأقل للتعداء مع زوج المتبرع والمتقبل (الجدول 1 والشكل 2). استخدم أطباق ذات قاع زجاجي للسماح بالفحص المجهري الفلوري. اعتمادا على نوع الخلية ، قم بمعالجة السطح مسبقا عن طريق التنظيف الخاص أو طلاءه بالبولي ليسين.
ملاحظة: هنا ، يتم استخدام متبرع FRET mCerulean3 (mCer) 54 ومتقبل FRET mVenus (mVen) 55 كزوج FRET ، ولكن مجموعات أخرى من الفلوروفورات قابلة للتطبيق أيضا. تستخدم عينة تعبر عن نقطة الاهتمام المدمجة مع المتبرع أو المتقبل وحده لتحديد عوامل التصحيح β و γ (الجدول 1) اللازمة لتصحيح نزيف المتبرع في قناة المستقبل والإثارة المتقاطعة للمتقبل بواسطة الطول الموجي للإثارة المانحة (الشكل 2Ac ، Bf). - في اليوم السابق للتعداء ، قم بزرع 1 × 105 خلايا HeLa في 2 مل من وسائط زراعة الخلايا على أطباق 35 مم ذات قاع زجاجي مناسب للفحص المجهري الفلوري. زراعة الخلايا بين عشية وضحاها عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 في حاضنة زراعة الخلايا.
ملاحظة: يمكن تكييف أحجام الكواشف مع مساحة سطح أطباق / قارورة زراعة الخلايا الأخرى بحجم مختلف. يمكن تكييف رقم الخلية مع كثافة مناسبة لخطوط الخلايا المختلفة والأساليب التجريبية.- استنشق المادة الطافية لزراعة الخلايا من الطبقة الأحادية للخلايا الملتصقة المزروعة على قوارير زراعة الخلايا T75 باستخدام مضخة تفريغ.
- اغسل الخلايا عن طريق إضافة 10 مل من محلول ملحي ذو فوسفات مخزن (DPBS) من Dulbecco إلى قارورة زراعة الخلية وشفط المحلول بعد ذلك باستخدام مضخة تفريغ.
- قم بتغطية الخلايا بالكامل ب 1 مل من 0,05٪ Trypsin-EDTA واحتضان الخلايا لمدة دقيقتين عند 37 درجة مئوية و 5٪ من الغلاف الجويCO2 في حاضنة زراعة الخلايا.
- أضف 9 مل من وسائط زراعة الخلايا الخلايا عن طريق سحب العينات.
- انقل تعليق الخلية إلى أنبوب سعة 15 مل وجهاز طرد مركزي عند 700 × جم لمدة 3 دقائق في درجة حرارة الغرفة (RT).
- قم بشفط المادة الطافية بمضخة تفريغ وأعد تعليق حبيبات الخلية في 10 مل من وسائط زراعة الخلايا.
- امزج كميات متساوية من تعليق الخلية و 0.4٪ تريبان بلو في أنبوب وأضف 10 ميكرولتر إلى شريحة العد. ضع الشريحة في عداد الخلايا الآلي وابدأ العد باستخدام البرنامج المناسب لعد الخلايا.
- لحساب حجم تعليق الخلية المطلوب لكل طبق ، اقسم رقم الخلية المطلوب لكل طبق (1 × 105) على رقم الخلية لكل مليلتر تم الحصول عليه من عداد الخلية.
- قم بإعداد معلق خلية في أنبوب مناسب يحتوي على عدد الخلايا المطلوبة لكل طبق بالحجم المطلوب لكل طبق (2 مل) بالإضافة إلى الكمية لطبق واحد إضافي.
- امزج تعليق الخلية 20 مرة على الأقل عن طريق قلب الأنبوب والماصة 2 مل من تعليق الخلية في كل طبق.
- لضمان توزيع أكثر توازنا للخلايا ، اترك الأطباق لمدة 30 دقيقة في RT قبل وضعها في حاضنة زراعة الخلايا.
3. تعداء الخلية
ملاحظة: هنا ، تم استخدام FuGENE ككاشف تعداد. الكواشف والطرق الأخرى للتعداء قابلة للتطبيق أيضا. يجب تقييم النسب المثلى للحمض النووي البلازميد (pDNA) إلى كواشف التعدي والوقت للتعبير الأمثل لكل نقطة إنتاج ونموذج خلية تجريبيا. هنا ، تم استخدام 2 ميكروغرام من إجمالي pDNA لكل طبق 35 مم. تم استخدام تركيبات المتبرع والمستقبل FRET بنسبة 1: 1 ، وكانت نسبة كاشف pDNA إلى التعدي 1: 4 (الجدول 1).
- قبل التعداء ، استبدل المادة الطافية لزراعة الخلايا ب 2 مل من الوسائط الدافئة مسبقا.
- تمييع pDNA في Opti-Minimal Essential Medium (MEM) بحجم نهائي يبلغ 100 ميكرولتر (= محلول pDNA).
- قم بتخفيف كاشف التعدي في Opti-MEM بحجم نهائي يبلغ 100 ميكرولتر (= محلول الكاشف).
ملاحظة: للحصول على تعداء أكثر اتساقا ، قم بإعداد مزيج رئيسي لمحلول pDNA والكاشف. - امزج pDNA ومحلول الكاشف جيدا.
- أضف محلول pDNA إلى محلول الكاشف (= محلول التعداد).
- اخلطي محلول التعداء جيدا.
- احتضان محلول التعداء لمدة 15 دقيقة في RT.
- أضف محلول التعدي بالتنقيط بحركة حلزونية إلى الطبق.
- امزج عن طريق تحريك الطبق 5 مرات أفقيا وعموديا على سطح المقعد.
- زراعة الخلايا بين عشية وضحاها عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 في حاضنة زراعة الخلايا.
| شرط | البناء (البناء) | عينة | تستخدم ل |
| 1 | LRRC8A-mCerulean | بناء المانحين فقط | تحديد عامل التصحيح β |
| 2 | LRRC8E-mVenus | بناء المتقبل فقط | تحديد عامل التصحيح γ |
| 3 | LRRC8A-mCerulean و LRRC8E-mVenus | زوج فريت | القياس الكمي SE-FRET |
الجدول 1: مثال على الشروط اللازمة لتجربة SE-FRET نموذجية لقياس نشاط LRRC8 / VRAC لقناة مكونة من الوحدة الفرعية LRRC8A المدمجة في المانح (mCerulean3) والوحدة الفرعية LRRC8E المدمجة في فلوروفور المستقبل (mVenus).
4. الحصول على الصورة لتحديد عامل التصحيح
ملاحظة: هناك نزيف من خلال انبعاث المتبرع في الانبعاث المكتشف للمستقبل أثناء FRET. علاوة على ذلك ، هناك إثارة متبادلة للفلوروفور المتقبل بواسطة الطول الموجي للإثارة المانحة. يجب تعويض هذه العمليات أثناء حساب SE-FRET. تحقيقا لهذه الغاية ، يتم تحديد عوامل التصحيح في الخلايا التي تعبر عن المتبرع أو المتقبل فقط بعد 24 ساعة من التعدي. هنا ، تم إجراء التصوير على Leica Thunder Imager المجهز بمصباح Leica LED8 ، ومكعب المرشح CYR71010 ، وهدف الزيت HC PL APO 63x / 1.40 ، ومرشح التمرير الطويل ل 460/80 و 553/70 وكاميرا Leica DFC9000GTC. أجريت التجارب دون رقابة بيئية ولكن في وجود HEPES في مخازن التصوير لتثبيت الرقم الهيدروجيني. للمراقبة / القياسات طويلة الأجل ، ينصح باستخدام نظام التحكم البيئي. للتحليل ، يتم حساب SE-FRET من الصور الأولية الملتقطة. يمكن القيام بذلك في وقت واحد أثناء الاستحواذ أو بعد ذلك. هنا ، تم استخدام برنامج Leica LAS X مع المكون الإضافي SE-FRET لتبسيط الإجراء التجريبي فيما يتعلق بحساب عوامل التصحيح وتصور تغيرات قيمة SE-FRET في الوقت الفعلي أثناء الحصول على الصور. وفيما يتعلق بمرحلة ما بعد الاستحواذ، يمكن تحديد عوامل التصحيح ونظام السوابق المعتمدة من الانبعاثات باستخدام مجموعات برمجيات أخرى (مثل فيجي) بعد الحصول على البيانات الأولية وفقا للبروتوكول الوارد أدناه.
- قبل الحصول على صورة للخلايا المنقولة المفردة لحساب عوامل التصحيح ، استخدم عينة واحدة تعبر عن زوج FRET لإعداد إعداد الفحص المجهري لجميع القنوات (الإثارة المانحة / انبعاث المتبرع DD ، DA للمانح / المستقبل ، والمستقبل / المستقبل AA ؛ انظر الجدول 1 والشكل 2 ج والشكل 3 أ).
ملاحظة: بالنسبة لقياسات SE-FRET مع وحدات فرعية VRAC ذات علامات mCerulean3 و mVenus المنقولة كما هو موضح أعلاه ، تم استخدام المعلمات التالية: تجميع 8 × 8 بكسل ، ووقت تعريض 100 مللي ثانية ، وكثافة مصباح LED بنسبة 10٪. - خذ العينة التي تعبر عن بنية المتبرع فقط (الشكل 2 أ) ، واستنشق وسائط زراعة الخلايا ، واغسل الخلايا ثلاث مرات باستخدام 2 مل من المخزن المؤقت متساوي التوتر.
- أضف 3 مل من المخزن المؤقت متساوي التوتر وضع العينة على مرحلة المجهر.
- ابحث عن مجال رؤية (FOV) به خلية واحدة على الأقل تعبر عن بنية المتبرع.
- صور جميع القنوات (DD و DA و AA انظر الجدول 2 والشكل 2 أ).
- ارسم منطقة اهتمام (ROI) حول الخلية / الخلايا وقم بقياس متوسط شدة DA (= IDA ؛ الشكل 2 أك) و DD (= IDD ؛ الشكل 2Aa).
- لطرح الخلفية ، ارسم عائد استثمار في قنوات DA و DD حيث توجد إشارة الخلفية فقط وقم بقياس متوسط الشدة (IBDA و IBDD).
- اطرح متوسط شدة عائد الاستثمار في الخلفية من متوسط الشدة المقاسة في عائد الاستثمار للخلية للقناة المقابلة (
 و
و 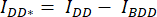 ).
). - كرر الخطوات 4.2 - 4.5 مع العينة التي تعبر عن بنية المستقبل فقط (الشكل 2 ب).
- ارسم عائد استثمار حول الخلية (الخلايا) وقم بقياس متوسط شدة DA (= IDA ؛ الشكل 2Bf) و AA (= IAA ؛ الشكل 2 يكون).
- لطرح الخلفية ، ارسم عائد استثمار في قنوات DA و AA حيث توجد إشارة الخلفية فقط وقم بقياس متوسط الشدة (IBDA و IBAA).
- اطرح متوسط شدة عائد الاستثمار في الخلفية من متوسط الشدة المقاسة في عائد الاستثمار للخلية للقناة المقابلة (
 و
و 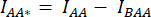 ).
). - استخدم القيم المحددة ل IDA* و IDD* و IAA* لحساب عوامل
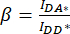 التصحيح و
التصحيح و 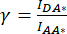 ،
،
حيث يتم استخدام عامل التصحيح β للتعويض عن نزيف انبعاث المتبرع في قناة DA. يستخدم عامل التصحيح γ للتعويض عن الإثارة المتبادلة للفلوروفور المستقبل بواسطة الطول الموجي للإثارة المانحة في قناة DA.
| إثارة | انبعاث | اسم القناة | خط LED | مكعب التصفية | مرشح التمرير الطويل |
| المتبرع | المتبرع | دد | 440 نانومتر | CYR71010 | 460/80 نانومتر |
| المتبرع | المتقبل | دا | 440 نانومتر | CYR71010 | 535/70 نانومتر |
| المتقبل | المتقبل | أ أ | 510 نانومتر | CYR71010 | 535/70 نانومتر |
الجدول 2: ملخص القنوات المطلوبة لتجارب SE-FRET.
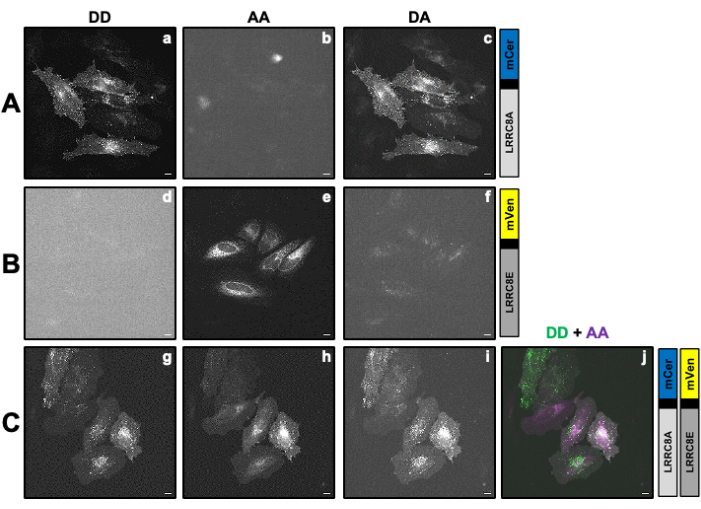
الشكل 2: صور مضان تمثيلية للعينات المستخدمة لحساب عوامل التصحيح β و γ اللازمة لتحديد نشاط VRAC لقناة مكونة من وحدة فرعية LRRC8A مدمجة في الوحدة الفرعية mCerulean3 المانحة (mCer) و LRRC8E المدمجة في فلوروفور المتقبل mVenus (mVen) بواسطة قياسات SE-FRET. (أ ، ب) الكشف عن المتبرع / المتبرع DD ، والمتقبل / المستقبل AA ، وقناة DA المانحة / المستقبلة في خلايا HeLa التي تعبر فقط عن المتبرع (A) LRRC8A-mCer أو المستقبل (B) LRRC8E-mVen. (ج) الكشف عن قنوات DD و AA و DA في خلايا HeLa التي تم نقلها بالاشتراك مع زوج المتبرع والمستقبل LRRC8A-mCer و LRRC8E-mVen. وتظهر اللوحات أ إلى 1 صورا تم التقاطها في قناة الكشف عن المتبرع (إثارة المتبرع والكشف عن إشارة المتبرع؛ وإثارة المتبرع بالإشارة المانحة؛ والكشف عن الإشارة المانحة؛ والكشف عن الإشارة المانحة؛ والكشف عن الإشارة المانحة؛ والإشارة إلى الجهة المانحة؛ وكشف الإشارة المانحة؛ والكشف عن الإشارة المانحة؛ و دد; (أ) و(د) و(ز)، قناة كشف المستقبل (إثارة المتقبل وكشف إشارة المستقبل؛ أ. (ب) و(ه) وقناة كشف إشارة FRET (إثارة المانح وكشف إشارة المستقبل)؛ دا; ج ، و و ، و i). اللوحة j هي تراكب اللوحين g و h. تظهر قناة DD باللون الأخضر وقناة AA باللون الأرجواني. شريط المقياس = 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
5. التصوير بفاصل زمني لقياس SE-FRET
- خذ العينة التي تعبر عن بناء المتبرع والمتلقي (الجدول 1 ، الشكل 2 ج والشكل 3 أ) ، واستنشق وسائط زراعة الخلايا ، واغسل الخلايا ثلاث مرات باستخدام 2 مل من المخزن المؤقت متساوي التوتر بعد 24 ساعة من التعدين.
- أضف 3 مل من المخزن المؤقت متساوي التوتر وضع العينة على مرحلة الفحص المجهري.
- لشفط المخزن المؤقت متساوي التوتر لاحقا ، قم بتثبيت وضبط قنية الخرطوم بحيث يصل طرف القنية إلى قاع الطبق.
- لإضافة المخازن المؤقتة ، قم بتثبيت الأنابيب وضبطها بحيث يمكن أن يسقط المخزن المؤقت المدفوع بتدفق الجاذبية في الطبق.
ملاحظة: هنا ، تم استخدام نظام نضح الجاذبية الذي يتم التحكم فيه بالصمام مع أربعة صمامات مغناطيسية للتحكم في التدفق العازل ، ولكن هناك طرق أخرى قابلة للتطبيق أيضا. - ابحث عن مجال رؤية مع خلية واحدة على الأقل تعبر عن بناء المتبرع والمتقبل في وقت واحد.
- قم بإعداد تجربة بفاصل زمني للقنوات DD و DA و AA بفاصل زمني قدره 10 ثوان ومدة لتغطية جميع شروط تسلسل التحفيز ، على سبيل المثال ، 12 دورة من خط الأساس متبوعة ب 15 دورة لكل شرط (الشكل 3).
ملاحظة: يمكن اعتماد الفاصل الزمني وعدد الدورات وفقا للاحتياجات التجريبية ولكن يجب أن يتضمن دائما قياسا أساسيا للتطبيع من أجل تصور البيانات ومقارنتها بشكل أفضل. - بعد القياس الأساسي ، اغسل العينة في المخزن المؤقت للحالة الأولى.
- استنشق المخزن المؤقت متساوي التوتر عبر قنية الخرطوم ، مع تطبيق فراغ مع حقنة.
- أضف 3 مل من المخزن المؤقت للحالة التالية عن طريق تدفق الجاذبية.
- استنشق المخزن المؤقت وأضف مرة أخرى 3 مل من نفس المخزن المؤقت.
- كرر الخطوة 5.7.3 مرة أخرى.
- بعد قياس الحالة الأولى ، اغسل العينة في المخزن المؤقت للحالة التالية (الخطوات 5.7.1-5.7.4).
- كرر الخطوات 5.5-5.8 حتى يتم التقاط جميع الشروط.
- لقياس SE-FRET الكمي ، ارسم عائد استثمار حول الخلية / الخلايا وقم بقياس متوسط الشدة في قناة DD = (IDD) و DA (IDA) و AA (IAA) لجميع الصور (النقاط الزمنية) في السلسلة الزمنية (الشكل 3 أ ، ب).
- لطرح الخلفية لإشارة FRET ، ارسم عائد استثمار في قناة DA حيث توجد إشارة الخلفية فقط وقم بقياس متوسط الشدة (IBDA).
- اطرح متوسط شدة عائد الاستثمار في الخلفية من متوسط الشدة المقاسة في عائد الاستثمار للخلية لقناة DA (
 ).
). - استخدم القيم المحددة لحساب متوسط قيم SE-FRET لكل عائد استثمار وجميع النقاط
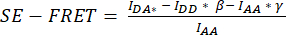 الزمنية.
الزمنية. - لتحسين قابلية المقارنة بين الظروف المختلفة وتصور قيم SE-FRET ، استخدم متوسط قيم خط الأساس لكل عائد استثمار لتطبيع جميع النقاط الزمنية لعائد الاستثمار المقابل.
- ارسم قيم SE-FRET الطبيعية بمرور الوقت (الشكل 3 ب).
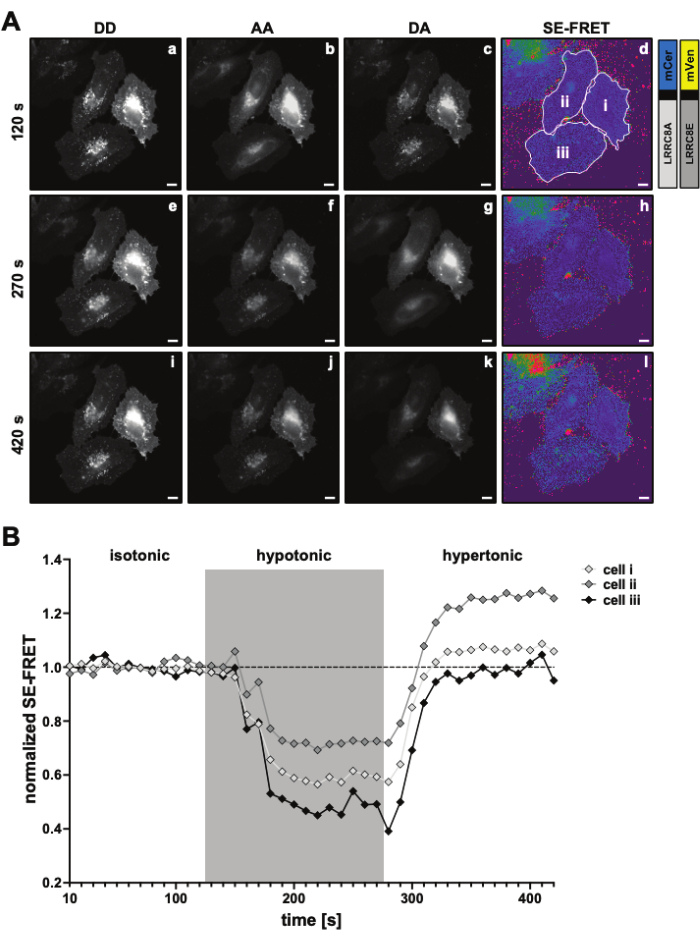
الشكل 3: صور التألق التمثيلية والقياس الكمي SE-FRET. (أ) صور التألق التمثيلية و SE-FRET الظاهرة للنقطة الزمنية الأولى لتجربة اللفات الزمنية لقياس نشاط VRAC بواسطة SE-FRET لقناة مكونة من وحدات فرعية LRRC8A و LRRC8E اعتمادا على التوتر. شريط المقياس = 10 ميكرومتر. تظهر نفس الخلايا في الشكل 2C. تظهر اللوحات a-i الكشف عن قنوات DD وAA وDA وSE-FRET الظاهري المحسوب. تمثل الخطوط العريضة البيضاء عائد الاستثمار (الخلايا من الأول إلى الثالث في اللوحة d) المستخدمة لقياس متوسط شدة الإشارة في DD و AA و DA وصورة SE-FRET الظاهرة. (ب) التقدير الكمي لقيم SE-FRET بمرور الوقت. كان تسلسل الظروف 12 دورة من المخزن المؤقت للتصوير متساوي التوتر (خط الأساس) متبوعا ب 15 دورة من المخزن المؤقت للتصوير مفرط التوتر. تم تطبيع متوسط قيمة SE-FRET الخام لكل عائد استثمار (الخلايا من الأول إلى الثالث) والنقطة الزمنية إلى متوسط قيمة خط الأساس (متساوي التوتر) لعائد الاستثمار المقابل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باستخدام هذه الطريقة القائمة على FRET ، يمكن مراقبة نشاط LRRC8 / VRAC أثناء التحفيز التناضحي ، ويرتبط الانخفاض في SE-FRET بدرجة نقص التوتر خارج الخلية45. تظهر هنا أيضا النتائج التمثيلية لتنشيط القناة الناجم عن نقص التوتر (الشكل 3 والشكل 4). بالإضافة إلى ذلك ، يمكن ملاحظة تنشيط LRRC8 / VRAC بواسطة محفزات متساوية مختلفة ، مثل التلاعب بإشارات diacylglycerol45 أو أثناء تنشيط الخلايا العضلية56.
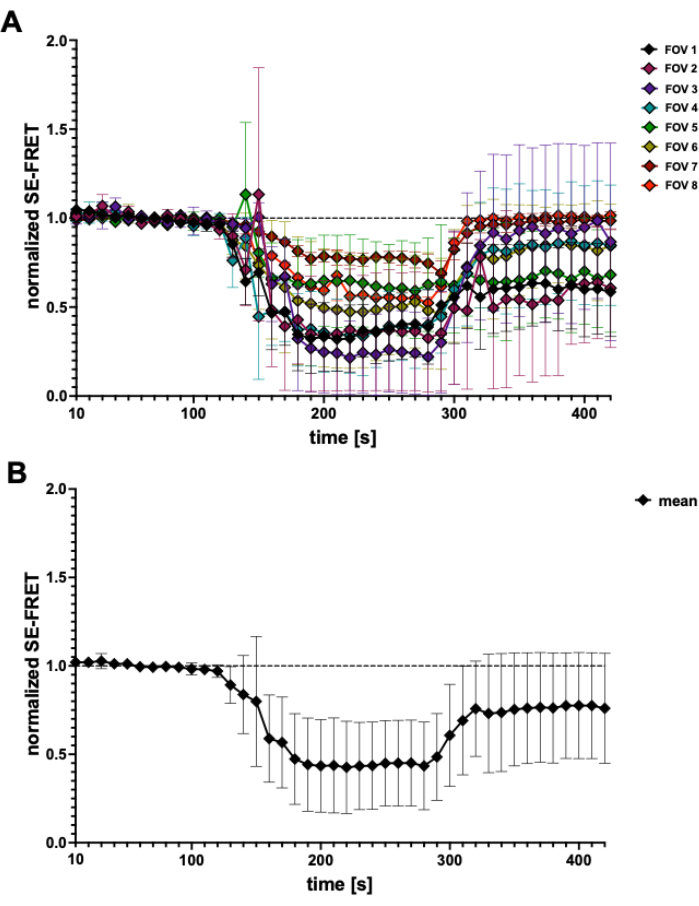
الشكل 4: آثار SE-FRET. (أ) آثار SE-FRET الظاهرة من 5 تجارب مستقلة. تمثل البيانات متوسط ± SD من N = 2 إلى N = 7 خلايا لكل مجال رؤية (FOV). (ب) متوسط ± SD لجميع الخلايا (N = 31 خلية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظرا لأن قنوات LRRC8 / VRAC متورطة أيضا في انخفاض حجم موت الخلايا المبرمجبمقدار 24،57 ، فإن مراقبة نشاط القناة عند تحريض موت الخلايا المبرمج سيكون تطبيقا آخر للطريقة الموضحة هنا. وفقا لذلك ، تم تنفيذ بروتوكول مراقبة SE-FRET في خلايا HeLa التي تعبر عن LRRC8A-mCerulean3 و LRRC8E-mVenus أثناء تطبيق الأدوية المحفزة لموت الخلايا المبرمج بوساطة مستقبلات الموت. تبين سابقا أن عامل نخر الورم (TNF) -α وسيكلوهيكسيميد (CHX) يستحضران تيارات VRAC في غضون بضع دقائق58. بعد إضافة 2 نانوغرام / مل TNF-α و 1 ميكروغرام / مل CHX في المخزن المؤقت متساوي التوتر ، كان هناك انخفاض قوي في SE-FRET (الشكل 5). استبدال المخزن المؤقت بوسط مفرط التوتر ، على الرغم من احتوائه على TNF-α و CHX ، تعافت قيم SE-FRET بالقرب من خط الأساس (الشكل 5 أ) ، المقابلة لتناقص تيارات VRAC في محلول حمام مفرط التوتر أثناء العلاج باستخدام ترابط Fas الذي يحفز موت الخلايا المبرمج58. لم تؤد معالجة الخلايا ب DMSO ، مذيب TNF-α و CHX ، إلى تقليل SE-FRET. لم يؤثر TNF-α + CHX على SE-FRET ل CFP-18aa-YFP ، وهو بناء ترادفي ل EYFP و ECFP كتحكمFRET 59 ، مما يدل على خصوصية LRRC8 / VRAC (الشكل 5 ب).
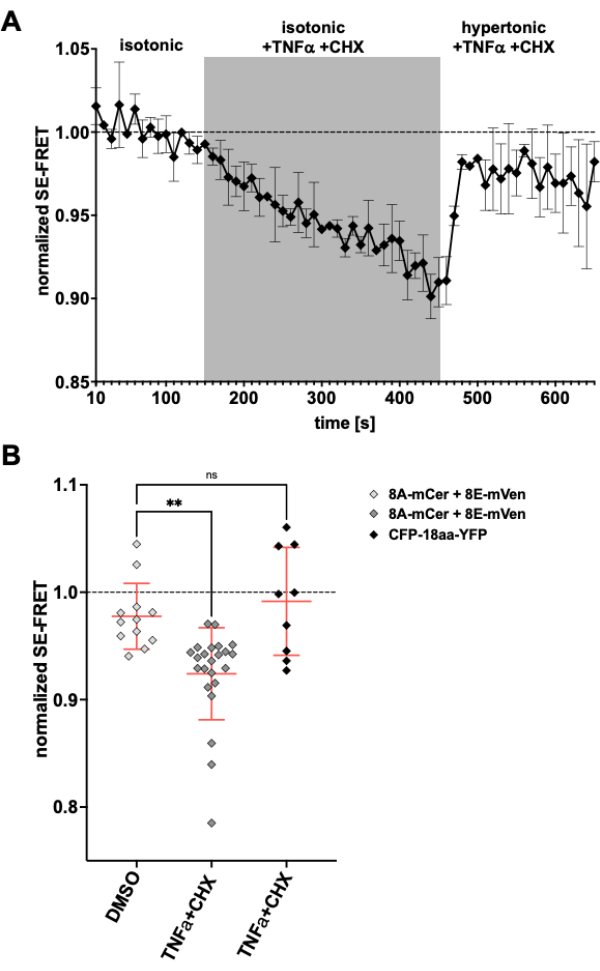
الشكل 5: تنشيط VRAC متساوي التنايح عن طريق موت الخلايا المبرمج بوساطة مستقبلات الموت. (أ) قيم SE-FRET الطبيعية من خلايا HeLa التي تعبر عن LRRC8A-mCer / LRRC8E-mVen (ن = 8 أطباق ، 23 خلية) بمرور الوقت. بعد 15 دورة في المخزن المؤقت للتصوير متساوي التوتر (خط الأساس) ، تم استبدال محلول الحمام بمخزن مؤقت متساوي التوتر مكمل ب 2 نانوغرام / مل من TNF-α و 1 ميكروغرام / مل سيكلوهيكسيميد (CHX) لمدة 30 دورة متبوعة بمخزن مؤقت للتصوير مفرط التوتر مع TNF-α و CHX. تم تطبيع متوسط قيمة SE-FRET الأولية لكل عائد استثمار ونقطة زمنية إلى متوسط قيمة خط الأساس (متساوي التوتر) لعائد الاستثمار المعني. (ب) التقدير الكمي لقيم SE-FRET الطبيعية لخلايا HeLa التي تعبر عن LRRC8A / E كما هو الحال في A مع محلول متساوي التوتر يحتوي على DMSO كتحكم في السيارة ل CHX (ن = 5 أطباق ، 12 خلية) أو مخزن مؤقت متساوي التوتر يحتوي على محفزات موت الخلايا المبرمج كما في A (ن = 8 أطباق ، 23 خلية) ، أو خلايا HeLa التي تعبر عن CFP-18aa-YFP مع محفزات موت الخلايا المبرمج (ن = 3 أطباق ، 9 خلايا). تمثل البيانات متوسط آخر 10 نقاط زمنية في المخزن المؤقت الخاص بالخلايا الفردية (الرموز) ومتوسط جميع الخلايا ± SD. ** ص < 0.01 ANOVA عادي أحادي الاتجاه متبوعا باختبار Tukey للمقارنة المتعددة اللاحقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الفحص المجهري FRET هو تقنية راسخة ومستخدمة على نطاق واسع لدراسة التفاعل بين البروتينات. وبالتالي ، يمكن تطبيق الأساليب القائمة على FRET في العديد من المختبرات ذات الخبرة المتغيرة. تم رصد إعادة الترتيب التوافقي أثناء البوابات لمجموعة واسعة من القنوات الأيونية باستخدام المقايسات القائمة على FRET (على سبيل المثال ، انظر المراجع34 ، 50 ، 51 ، 52 ، 53 ، 60 ، 61 ، 62 ، 63 ، 64 ، 65 ، 66 ، 67) ، في بعض الحالات جنبا إلى جنب مع الفيزيولوجيا الكهربية في القياس الفلوري المشبك68،69،70،71. يمكن استخدام FRET لدراسة علاقات البنية والوظيفة لهذه القنوات الأيونية أو لمراقبة نشاطها بشكل مستقل عن نقل الأيونات. يمكن أن يكون للطريقة المعروضة هنا مزايا واضحة على الفيزيولوجيا الكهربية لأنها تسمح بمراقبة نشاط قنوات LRRC8 / VRAC في الموقع.
تشمل الخطوات الحاسمة في البروتوكول طلاء الخلايا للوصول إلى التقاء مثالي للتعداء والتصوير ، مما يسهل بشكل مثالي تمييز الخلايا بسهولة لتحليلها لاحقا. يعد التعداء المشترك الفعال للوحدات الفرعية المختلفة أمرا بالغ الأهمية للتوطين الصحيح تحت الخلية. على سبيل المثال ، سيؤدي وجود فائض من الوحدة الفرعية غير LRRC8A إلى توطين الشبكة الإندوبلازمية (ER)المحسن 4. لذلك ، قد تحتاج إلى تعديل نسب البلازميد. اعتمادا على النظام ، يجب التحقق من أزواج FRET التي تم إنشاؤها حديثا ، على سبيل المثال ، عن طريق تبييض المتقبل. يجب موازنة وقت التجميع والتعرض مع بعضهما البعض لتمكين الدقة الزمنية والمكانية المثلى لسؤال البحث. يتيح Binning أوقات تعرض أقصر وبالتالي يقلل من التبييض المحتمل لمستشعر FRET مع تقليل الدقة المكانية. لذلك ، إذا تطلب الإعداد التجريبي ، على سبيل المثال ، التمييز تحت الخلوي لنشاط LRRC8 / VRAC ، فيجب تجنب binning. يحدد سؤال البحث بالتساوي عدد الدورات والفاصل الزمني في سلسلة الفاصل الزمني. لا يكون الفاصل الزمني مناسبا إلا إذا كانت حركية تغييرات FRET (وبالتالي تنشيط/تعطيل LRRC8 / VRAC) مطلوبة. خلاف ذلك ، يمكن أيضا إجراء تسجيلات بسيطة "قبل وبعد". يعتمد طول التجربة على العملية الفسيولوجية. من الناحية المثالية ، يجب مراقبة نشاط LRRC8 / VRAC عند المحفزات حتى يستقر SE-FRET. يمكن تحديد هذه العوامل في التجارب التجريبية. يجب تحديد عوامل التصحيح لحساب إشارة SE-FRET الحقيقية لجميع الظروف. قد تؤدي عوامل التصحيح المحددة بشكل غير صحيح إلى المبالغة أو التقليل من شدة SE-FRET. أخيرا ، بعد إنشاء خط أساس مستقر ، يجب أن يكون الفاصل الزمني بين الصور قصيرا بما يكفي لالتقاط العملية الفسيولوجية ذات الأهمية.
هذه الطريقة تحمل بعض القيود. أحدها هو أن التغييرات في شدة FRET بين LRRC8 أثناء عكس حركات LRRDs ، لا تتوافق بالضرورة مع انتقال الأيونات أو الأسموليت عبر المسام. يتضح هذا من تغييرات FRET التي لوحظت مع متجانسات LRRC8A45 على الرغم من تياراتها الدنيا4،32،72. قد لا تؤثر حاصرات المسام لقنوات LRRC8/VRAC على إشارة FRET ، مما يجعل هذه الطريقة غير مناسبة للبحث عن معدلات قنوات معينة. علاوة على ذلك ، يمكن أن تؤثر مستويات التعبير عن بروتينات LRRC8 المعبر عنها بشكل مفرط على العمليات الفسيولوجية التي يتم ملاحظتها ، خاصة وأن بروتينات LRRC8 ذات العلامات الطرفية C تعرض نشاطا أساسيا14.
أحد الجوانب التي يمكن اعتبارها قيدا أو ميزة اعتمادا على سؤال البحث المعين هو أنه في هذه الطريقة ، يتم قياس الوحدات الفرعية LRRC8 المعبر عنها خارج الرحم فقط بشكل انتقائي. لذلك ، فإن مستويات الخلفية للبروتينات الداخلية بالكاد تتداخل مع القياسات. من ناحية أخرى ، قد لا تتصرف البروتينات التي يتم التعبير عنها بشكل مفرط مثل قنوات LRRC8 الداخلية مع تكوين الوحدة الفرعية وقياس القياس المتكافئ المختلف. على سبيل المثال ، قد يكون للمنبهات المختلفة مثل الأكسدة تأثيرات تعديلية متعارضة على قنوات LRRC8 ذات تكوين مختلف36. من خلال تغيير النسب بين الوحدات الفرعية المعبر عنها ، يمكن تعديل القياس المتكافئ والتوصيل الأيوني الكلي14،73 ، لكن تكوينها الأصلي ، مع احتمال أن يكون أكثر من معلمين في كثير من الأحيان داخل مركبواحد 21 ، غير واضح وقد يختلف بين أنواع الخلايا74،75،76. علاوة على ذلك ، تبين أن اندماج البروتينات الفلورية في العصارة الخلوية C-termini لبروتينات LRRC8 يزيد من نشاط قناة LRRC8 / VRAC القاعدية في بويضات Xenopus 14 ، على الأرجح لأن العلامات الكبيرة تعدل تشكل LRRDs ، والتي قد تحكم فتحالقناة 14،44،45. لذلك ، فإن حجم البروتينات الفلورية والرابط واتجاهها قد لا يؤثر فقط على كفاءة FRET ولكن أيضا على نشاط القناة. ومع ذلك ، الأهم من ذلك ، أن قنوات VRAC لبروتينات LRRC8 المدمجة مع بروتينات الفلورسنت ظلت مستجيبة للتحفيز المنخفض التوتر14 ، مما يتيح استخدامها كمستشعرات FRET45.
تشمل مزايا هذه الطريقة غير الغازية لمراقبة نشاط قناة LRRC8 / VRAC عن طريق الفحص المجهري الضوئي مقارنة بالطرق الأخرى ما يلي: (ط) يسمح بمراقبة LRRC8 / VRAC داخل الخلايا أو المقصورات التي يتعذر الوصول إليها عادة للفيزيولوجيا الكهربية. وهذا يشمل العضيات داخل الخلايا التي يمكن العثور على مجمعات LRRC8 عليها أو استهدافهاإلى 45،77،78. (ii) يظل التركيب العصاري الخلوي دون تغيير بالطريقة ، بينما أثناء قياسات مشبك التصحيح للخلية بأكملها ، يتم استبدال العصارة الخلوية إلى حد كبير بمحلول الماصة ، والذي قد يؤثر على مسارات الإشارات كما لوحظ مع تنشيط LRRC8 / VRAC الناجم عن phorbol-12-myristate-13-acetate (PMA) 45. (iii) يوفر إمكانية مراقبة تنشيط LRRC8 / VRAC بدقة تحت الخلوية ، مثل تمييز النشاط عند الحواف الأمامية والخلفية أثناء هجرة الخلايا ، حيث - يقتصر على الأماكن الضيقة - تم تورط VRAC79،80. (iv) يتيح المراقبة المستمرة لنشاط LRRC8 / VRAC أثناء العمليات الفسيولوجية الممتدة مثل تمايز الخلايا العضلية56.
في حين أن هناك قيودا وتحديات في هذه الطريقة ، إلا أنها تبشر بمزيد من الاستكشاف ، بما في ذلك التطبيقات المحتملة في النماذج الحيوانية. بالاقتران مع طرق أخرى لدراسة عائلة قنوات الأيونات والأوسموليت ، قد يساهم هذا الاختبار القائم على FRET بشكل كبير في كشف آليات التنشيط واستكشاف الوظائف الفسيولوجية المتنوعة لقنوات LRRC8 في بيئاتها الأصلية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر C.F. Kaminski على الهدية الكريمة للبلازميد الذي يشفر بناء CFP-18aa-YFP ، و A. Klemmer للمساعدة الفنية ، وجميع الأعضاء الحاليين والسابقين في مختبر Stauber الذين ساهموا في تطوير هذه الطريقة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
References
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367(2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974(2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885(2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461(2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431(2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382(2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532(2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435(2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421(2019).
- Hille, B. Ion Channels of Excitable Membranes. 3rd edn. , Sinauer. Sunderland, Massachusetts. (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896(2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, Suppl 1 S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215(2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118(2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093(2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755(2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108(2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7(2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940(2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879(2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663(2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved