Method Article
ניטור פעילות חוזרת עשירה בלאוצין המכילה 8 ערוצים (LRRC8/VRAC) באמצעות העברת אנרגיית תהודה של Förster עם פליטה רגישה (SE-FRET)
In This Article
Summary
אלקטרופיזיולוגיה היא תקן הזהב לחקר פעילות תעלות היונים. עם זאת, ישנן גישות חלופיות רבות, כולל שיטות אופטיות. במאמר זה אנו מתארים שיטה לניטור הפעילות של תעלות אניון עשירות בלאוצין המכילות 8 ערוצי אניון (LRRC8) באמצעות שיטה מבוססת העברת אנרגיית תהודה בין תת-יחידות Förster (FRET).
Abstract
חברי משפחת החלבונים LRRC8 יוצרים תעלות יון ואוסמוליטים הטרומריות בעלות תפקידים בתהליכים פיזיולוגיים רבים. כתעלות אניון מווסתות נפח (VRACs) / תעלות תיקון חיצוניות רגישות לנפח (VSORs), הן מופעלות על התנפחות תאים אוסמוטית ומתווכות את האקסטרוזיה של כלוריד ואוסמוליטים אורגניים, מה שמוביל לזרם המים ומכאן להתכווצות התא. מעבר לתפקידם בוויסות נפח אוסמוטי, VRACs היו מעורבים בתהליכים תאיים כגון התמיינות, הגירה ואפופטוזיס. באמצעות השפעתן על פוטנציאל הממברנה והעברתן של מולקולות איתות שונות, תעלות חוזרות עשירות בלאוצין המכילות 8 (LRRC8) ממלאות תפקידים בתקשורת נוירון-גליה, הפרשת אינסולין ותגובה חיסונית. מנגנון ההפעלה נותר חמקמק. תעלות LRRC8, כמו תעלות יונים אחרות, נחקרות בדרך כלל בשיטות אלקטרופיזיולוגיות. במאמר זה אנו מתארים שיטה לזיהוי שפעול ערוץ LRRC8 על ידי מדידת העברת אנרגיית תהודה של Förster (SE-FRET) בין חלבונים פלואורסצנטיים המאוחים לתחומים חוזרים עשירים בלאוצין במסוף C של תת-יחידות LRRC8. שיטה זו מציעה את האפשרות לחקור הפעלת ערוץ באתרו ללא חילופי הסביבה הציטוסולית ובמהלך תהליכים כגון התמיינות תאים ואפופטוזיס.
Introduction
תעלות יונים המורכבות מהטרומרים של חלבונים חוזרים עשירים בלאוצין המכילים 8 (LRRC8) חלבונים ממשפחת בעלי החוליות נמצאות בכל תאי חולייתנים, ומשתתפות במגוון רחב של תפקודים פיזיולוגיים 1,2. ערוצי LRRC8 אלה, שזוהו לראשונה כערוצי אניון מווסתים עוצמת קול (VRACs) או ערוצי תיקון חיצוניים רגישים לעוצמת הקול (VSOR), ממלאים תפקיד מכריע בהפחתת נפח הבקרה התאית 3,4. הם מאפשרים גירוש של יוני כלוריד ואוסמוליטים אורגניים, אשר ואחריו זרם מים בתגובה לנפיחות אוסמוטית. מעבר לתפקידם בתגובת עקה אוסמוטית, תפקידם בוויסות נפח התא נקשר להתרבות ונדידת תאים, אפופטוזיס, ספרמיוגנזה ושלמות אפיתל 5,6,7. שינוי פוטנציאל הממברנה בעת הפעלת LRRC8/VRAC הוכח כתורם להתמיינות מיוצינור8 ולהפרשת אינסולין על ידי תאי β הלבלב 9,10,11. יתר על כן, תעלות LRRC8 מוליכות מגוון אוסמוליטים אורגניים כגון מולקולות איתות פורינרגיות ATP ו-cGAMP או חומצת האמינו המעוררת גלוטמט, וממקמות תעלות אלה בתקשורת תא-תא במערכת החיסון או באינטראקציה גליה-נוירון 12,13,14,15,16,17,18,19,20,21,22. אפילו קסנוביוטים, כגון הצבע פלואורסצאין, האנטיביוטיקה בלסטיצידין S או התרופה האנטי-סרטנית ציספלטין, מבוצעים על ידי תעלות LRRC8 23,24,25.
ישנם דיווחים רבים על העברת האות המוביל להפעלת LRRC8/VRAC 26,27,28. עם זאת, המנגנון עדיין אינו ברור, והספרות מציגה מגוון רחב של מנגנונים אפשריים שעשויים להיות תלויים בתהליך הפיזיולוגי הספציפי. אלה כוללים שינויים בחוזק היונים הציטוסוליים, אינטראקציה עם השלד הציטוסולי, הרכב הממברנה, חלבוני G, מצב החיזור ומפל הזרחן 2,27,29,30,31.
ערוצי LRRC8/VRAC מכילים את LRRC8A כתת-יחידה חיונית 3,4 שחייבת להתמזג עם לפחות אחד מהפרלוגים שלה, LRRC8B-E, כדי ליצור ערוצים פונקציונליים פיזיולוגית 4,14,32. הרכב תת-היחידות קובע תכונות ביופיזיקליות של התעלה, כגון אי-הפעלה תלוית תיקון ודפולריזציה 4,29,32,33,34, ספציפיות המצע 15,17,20,21,24,35, וכמה מסלולי הפעלה36,37. מבני מיקרוסקופ קריו-אלקטרונים (cryo-EM) מראים כי הומומרים LRRC8A, כמו גם הטרומרים, מתאספים כהקסמרים38,39,40, בעוד שכימרות LRRC8A/LRRC8C היוצרות תעלות פונקציונליות הן הפטמרים41. החלק N-terminal של כל חלבוני LRRC8 מורכב מארבעה סלילים טרנסממברנליים, והחלק C-terminal מכיל תחום עם חזרות עשירות בלאוצין (LRRD). המבנים המורכבים הזמינים של LRRC8 מספקים ראיות לכך שה-LRRDs, המשתרעים לתוך הציטוזול 3,4,23, עשויים לעבור סידורים מחדש קונפורמטיביים במהלך תעלות 34,42,43. רעיון זה מאושש על ידי הממצא כי היתוך C-terminal של חלבונים פלואורסצנטיים גורם לפעילות תעלת הבסיס14 וכי קשירה של ננו-גופים לתחומים יכולה לווסת את פעילות הערוץ44. יתר על כן, שינויים קונפורמטיביים של C-termini הודגמו על ידי העברת אנרגיית תהודה תוך מורכבת של Förster (FRET)45.
השיטה הנפוצה ביותר לחקר פעילות תעלות היונים היא מדידות אלקטרופיזיולוגיות46, אשר יושמו בהרחבה בחקר VRACs לפני זיהויים המולקולרי47. עם זאת, ישנן דרכים שונות נוספות לנטר את פעילות VRAC באופן עקיף, כולל מדידת המצע המוליך שלו - יוני הליד או אוסמוליטים אורגניים - או השפעתו על נפח התא48. למעשה, הזיהוי של חלבוני LRRC8 כ-VRAC הסתמך על בדיקה המבוססת על מרווה של חלבון פלואורסצנטי רגיש להליד49 על ידי כניסת יודיד לתא דרך VRACsמופעלים 3,4. שיטה נוספת לניטור פעילות ערוץ LRRC8/VRAC עושה שימוש בתנועה של התחומים הציטוסוליים שניתן לראות, כמו בתעלות יונים אחרות 50,51,52,53, על ידי שינויים ב-FRET 45. לשם כך, חלבונים פלואורסצנטיים המשמשים כזוגות FET, כגון חלבון ציאן-פלואורסצנטי (CFP)/mCerulean3 כתורם וחלבון צהוב-פלואורסצנטי (YFP)/mVenus כמקבל, אוחדו ל-C-termini של חלבוני LRRC8 (איור 1). FRET תוך-מורכב בין תת-יחידות LRRC8 הוכח בניסויי פוטו-הלבנה45. הימנעות משיטת ההלבנה ההרסנית, שינויי FRET לאורך זמן נוטרו על ידי FRET (SE-FRET), כאשר בעצם נמדדת הפליטה הרגישה של המקבל בעת עירור התורם עקב חפיפה של ספקטרום הפליטה של התורם עם ספקטרום העירור של המקבל. יישום היפוטוניות חוץ-תאית, גירוי להפעלת LRRC8/VRAC, הביא לירידה הפיכה בעוצמת SE-FRET45. חשוב לציין, מדידות סימולטניות של מהדק טלאי על תאים שלמים וניטור FRET במהלך טיפול היפוטוני הראו כי ירידה זו ב- FRET אכן שיקפה את הפעלת LRRC8/VRAC45. שיטה זו, המונעת שיבוש קרום הפלזמה או שינוי הסביבה התוך-תאית על ידי תמיסת פיפטה, מציעה חלופה לניטור פעילות LRRC8/VRAC. הוא שימושי במיוחד בסביבות פיזיולוגיות שבהן שמירה על הציטוזול המקומי היא חיונית, יש צורך ברזולוציה תת-תאית, או נדרשת תצפית ממושכת על פעילות הערוץ.
כאן, אנו מציגים פרוטוקול לחקר LRRC8/VRAC עם קריאה מבוססת FRET. הפרוטוקול מתאר כיצד לטפל ולהדביק תאים, לרכוש תמונות דגימה ובקרה, לנתח את הנתונים ולחשב ערכי FRET (SE-FRET) של פליטה רגישה.
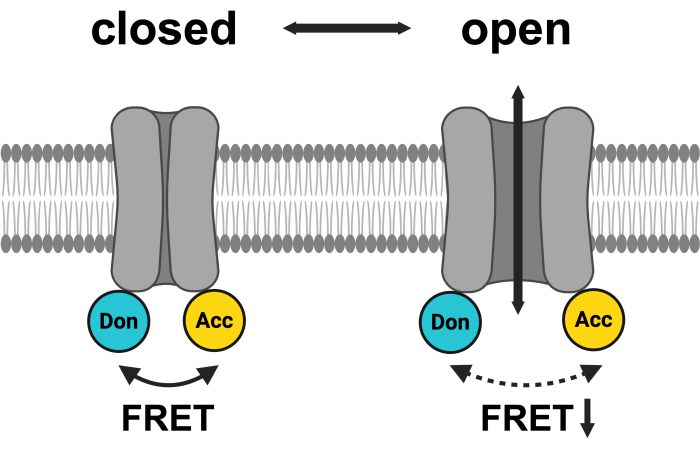
איור 1: סכמה של מערכת הזוג LRRC8 FET. mCerulean3 מוצג בציאן, ו-mVenus מוצג בצהוב. לאחר פתיחת VRAC, המרחק (ו / או הכיוון המרחבי) בין הפלואורופורים משתנה, וכתוצאה מכך העברת אנרגיה מופחתת בין תורם (דון) ומקבל (Acc), ובתורו, מורידה את FRET שנצפה. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
1. הכנת חיץ וריאגנטים
- הכינו מאגרים בינוניים ואיזוטוניים, היפוטוניים והיפרטוניים ומדדו את האוסמולריות של המאגרים בעזרת אוסמומטר כדי להבטיח שהאוסמולריות (Osm) נמצאת בטווח הצפוי עם סטייה מקובלת בלבד.
- מדיה לתרביות תאים: הכינו את מדיום הנשר המעובד (DMEM) של Dulbecco בתוספת 10% סרום בקר עוברי (FBS) ו-1% פניצילין/סטרפטומיצין
- מאגר הדמיה איזוטוני (~ 340 mOsm): הכן את מאגר ההדמיה האיזוטוני על ידי ערבוב 150 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D(+)-גלוקוז ו- 10 mM 4-(2-Hydroxy Ethyl)-1-Piperazine Ethane Sulfonic acid (HEPES).
- מאגר הדמיה היפוטוני (~ 250 mOsm): הכן את מאגר ההדמיה ההיפוטוני על ידי ערבוב 105 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D(+)-גלוקוז ו- 10 mM HEPES.
- מאגר הדמיה היפרטוני (~ 500 mOsm): הכן את מאגר ההדמיה ההיפרטונית על ידי ערבוב 160 mM D(-)-Mannitol, 150 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D(+)-גלוקוז ו- 10 mM HEPES.
הערה: ניתן להוסיף למאגרים תרופות ספציפיות בהתאם למה שייחקר.
2. צמיחה של תאים דבקים על צלחות תחתית זכוכית
- הכינו לפחות מנה אחת להעברה רק עם חלבון העניין (POI) המאוחה לתורם או לפלואורופור המקבל ולפחות מנה אחת להעברה עם זוג התורם והמקבל (טבלה 1 ואיור 2). השתמשו בכלים עם תחתית זכוכית כדי לאפשר מיקרוסקופ פלואורסצנטי. בהתאם לסוג התא, לטפל פני השטח על ידי ניקוי מיוחד או ציפוי אותו עם פוליליזין.
הערה: כאן, תורם FRET mCerulean3 (mCer)54 ומקבל FRET mVenus (mVen)55 משמשים כזוג FET, אך שילובים אחרים של פלואורופורים ישימים גם כן. דגימות המבטאות את נקודת העניין המאוחה לתורם או למקבל בלבד משמשות לקביעת גורמי התיקון β ו-γ (טבלה 1) הדרושים לתיקון דימום של תורם בערוץ המקבל ועירור צולב של המקבל על ידי אורך גל העירור של התורם (איור 2Ac, Bf). - יום לפני ההדבקה, זרע 1 x 105 תאי HeLa ב 2 מ"ל של מדיה תרבית תאים על צלחות 35 מ"מ עם תחתית זכוכית המתאימה למיקרוסקופ פלואורסצנטי. תאי תרבית לילה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 באטמוספירה באינקובטור של תרביות תאים.
הערה: ניתן להתאים נפחים של ריאגנטים לשטח הפנים של צלחות/בקבוקים אחרים של תרביות תאים בגודל שונה. ניתן להתאים את מספר התא לצפיפות המתאימה לקווי תאים שונים ולגישות ניסיוניות.- שאפו את תרבית התא משכבה חד-שכבתית של תאים דבקים שגודלו בתרבית על צלוחיות תרבית תאי T75 באמצעות משאבת ואקום.
- שטפו את התאים על ידי הוספת 10 מ"ל של מלח חוצץ פוספט של דולבקו (DPBS) לבקבוק תרבית התאים ושאיפה של התמיסה לאחר מכן עם משאבת ואקום.
- כסו את התאים לחלוטין ב-1 מ"ל של 0,05% טריפסין-EDTA ודגרו על התאים במשך 2 דקות ב-37°C ו-5%CO2 אטמוספירה באינקובטור תרביות תאים.
- הוסף 9 מ"ל של מדיה תרבית תאים להשעות את התאים על ידי pipetting.
- העבר את מתלה התא לתוך צינור 15 מ"ל וצנטריפוגה ב 700 x גרם במשך 3 דקות בטמפרטורת החדר (RT).
- שאפו את הסופרנאטנט עם משאבת ואקום והשהו מחדש את גלולת התא ב -10 מ"ל של מדיה של תרבית תאים.
- ערבבו נפחים שווים של תרחיף תאים ו-0.4% טריפאן כחול בצינור והוסיפו 10 μL לשקופית ספירה. מקם את השקופית במונה התאים האוטומטי והתחל לספור באמצעות התוכנית המתאימה לספירת תאים.
- כדי לחשב את נפח תרחיף התאים הדרוש לכל מנה, חלק את מספר התא הדרוש לכל צלחת (1 x 105) במספר התא למיליליטר המתקבל ממונה התא.
- הכינו תרחיף תאים בצינור מתאים המכיל את מספר התאים הדרוש לכל צלחת בנפח הדרוש לכל מנה (2 מ"ל) בתוספת כמות למנה אחת.
- מערבבים את תרחיף התא לפחות 20 פעמים על ידי היפוך הצינור והפיפטה 2 מ"ל של תרחיף התא בכל צלחת.
- כדי להבטיח פיזור תאים אחיד יותר, השאירו את הכלים למשך 30 דקות ב- RT לפני הצבתם באינקובטור תרביות התא.
3. טרנספקציה של תאים
הערה: כאן, FuGENE שימש כמגיב טרנספקציה. ריאגנטים ושיטות טרנספקציה אחרות ישימות גם כן. יש להעריך אמפירית את היחסים האופטימליים בין דנ"א פלסמיד (pDNA) לריאגנטים טרנספקציוניים וזמן לביטוי אופטימלי עבור כל נקודת עניין ומודל תא. כאן, 2 מיקרוגרם של pDNA הכולל לכל צלחת 35 מ"מ שימש. מבנים של תורם FRET ומקבל שימשו ביחס של 1:1, ויחס מגיב pDNA לטרנספקציה היה 1:4 (טבלה 1).
- לפני הטרנספקציה, להחליף את supernatant תרבית התא עם טרי 2 מ"ל של מדיה שחוממה מראש.
- לדלל pDNA בתווך אופטי-מינימלי חיוני (MEM) עם נפח סופי של 100 μL (=תמיסת pDNA).
- לדלל את מגיב הטרנספקציה ב- Opti-MEM עם נפח סופי של 100 μL (=תמיסת מגיב).
הערה: לקבלת טרנספקציה אחידה יותר, הכינו תערובת אב לתמיסת pDNA ומגיב. - מערבבים היטב pDNA ותמיסת מגיב.
- הוסף את תמיסת ה- pDNA לתמיסת המגיב (=תמיסת טרנספקציה).
- מערבבים היטב את תמיסת הטרנספקציה.
- לדגור על תמיסת הטרנספקציה למשך 15 דקות ב- RT.
- מוסיפים את תמיסת הטרנספקציה בתנועה ספירלית לצלחת.
- מערבבים על ידי הזזת המנה 5 פעמים אופקית ואנכית על פני הספסל.
- תאי תרבית לילה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 באטמוספירה באינקובטור של תרביות תאים.
| תנאי | מבנה (ים) | לדוגמה | משמש עבור |
| 1 | LRRC8A-mCerulean | מבנה התורם בלבד | קביעת גורם תיקון β |
| 2 | LRRC8E-mVenus | קונסטרוקציית קבלה בלבד | קביעת גורם תיקון γ |
| 3 | LRRC8A-mCerulean ו-LRRC8E-mVenus | זוג FRET | כימות SE-FRET |
טבלה 1: דוגמה לתנאים הדרושים לניסוי SE-FRET טיפוסי למדידת פעילות LRRC8/VRAC של תעלה המורכבת מתת-יחידה LRRC8A המאוחה לתורם (mCerulean3) ותת-יחידה LRRC8E המאוחה לפלואורופור המקבל (mVenus).
4. רכישת תמונה לקביעת גורם תיקון
הערה: יש דימום של פליטת התורם לתוך הפליטה שזוהתה של המקבל במהלך FRET. יתר על כן, יש עירור צולב של פלואורופור המקבל על ידי אורך גל עירור התורם. תהליכים אלה חייבים להיות פיצוי במהלך החישוב של SE-FRET. לשם כך, גורמי תיקון נקבעים בתאים המבטאים רק את תורם FRET או מקבל 24 שעות לאחר הטרנספקציה. כאן, ההדמיה בוצעה על גבי Leica THUNDER Imager המצויד במנורת Leica LED8, CYR71010 קוביית המסנן, HC PL APO 63x/1.40 OIL objective, מסנן מעבר ארוך עבור 460/80 ו- 553/70 ומצלמת DFC9000GTC של Leica. הניסויים בוצעו ללא בקרה סביבתית אלא בנוכחות HEPES במאגרי ההדמיה כדי לייצב את ה- pH. לתצפית/מדידות ארוכות טווח, מומלץ להשתמש במערכת בקרה סביבתית. לצורך ניתוח, SE-FRET מחושב מהתמונות הגולמיות שצולמו. זה יכול להיעשות בו זמנית במהלך הרכישה או לאחר מכן. כאן, תוכנת Leica LAS X עם תוסף SE-FRET שימשה כדי לפשט את ההליך הניסיוני לגבי חישוב גורמי התיקון והדמיית שינויי הערך SE-FRET בזמן אמת במהלך רכישת תמונה. עבור לאחר הרכישה, ניתן לקבוע גורמי תיקון ו- SE-FRET עם חבילות תוכנה אחרות (למשל, FIJI) לאחר רכישת נתונים גולמיים בהתאם לפרוטוקול המסופק להלן.
- לפני רכישת תמונה של תאים בודדים שעברו טרנספקציה כדי לחשב את גורמי התיקון, השתמש בדגימה אחת המבטאת את זוג FRET כדי להגדיר את הגדרת המיקרוסקופ עבור כל הערוצים (עירור תורם/פליטת תורם DD, DA תורם/מקבל ומקבל AA; ראו טבלה 1 ואיור 2C ואיור 3A).
הערה: עבור מדידות SE-FRET עם תת-יחידות VRAC המתויגות mCerulean3 ו-mVenus כמתואר לעיל, נעשה שימוש בפרמטרים הבאים: שילוב של 8x8 פיקסלים, זמן חשיפה של 100ms ועוצמת מנורת LED של 10%. - קחו את הדגימה המבטאת את מבנה התורם בלבד (איור 2A), שאפו את מדיית תרבית התא, ושטפו את התאים שלוש פעמים עם 2 מ"ל של חיץ איזוטוני.
- מוסיפים 3 מ"ל של חיץ איזוטוני ומניחים את הדגימה על במת המיקרוסקופ.
- מצא שדה ראייה (FOV) עם תא אחד לפחות המבטא את מבנה התורם.
- דמיינו את כל הערוצים (DD, DA ו-AA ראו טבלה 2 ואיור 2A).
- צייר אזור עניין (ROI) סביב התא/תאים ומדוד את העוצמה הממוצעת של DA (= IDA; איור 2Ac) ו-DD (= IDD; איור 2Aa).
- לחיסור רקע, צייר החזר השקעה בערוצי DA ו- DD שבהם נמצא רק אות הרקע ומדוד את העוצמה הממוצעת (IBDA ו- IBDD).
- הפחתת העוצמה הממוצעת של החזר ההשקעה ברקע מהעוצמה הממוצעת הנמדדת בהחזר ההשקעה של התא של הערוץ המתאים (
 ו
ו 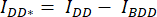 - ).
- ). - חזור על שלבים 4.2-4.5 כאשר המדגם מבטא רק את מבנה המקבל (איור 2B).
- צייר החזר השקעה סביב התא(ים) ומדוד את העוצמה הממוצעת של DA (= IDA; איור 2Bf) ו-AA (= IAA; איור 2Be).
- לחיסור רקע, צייר החזר השקעה בערוצי DA ו- AA שבהם נמצא רק אות הרקע ומדוד את העוצמות הממוצעות (IBDA ו- IBAA).
- הפחתת העוצמה הממוצעת של החזר ההשקעה ברקע מהעוצמה הממוצעת הנמדדת בהחזר ההשקעה של התא של הערוץ המתאים (
 ו
ו 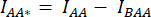 - ).
- ). - השתמש בערכים שנקבעו עבור IDA*, IDD* ו- IAA* כדי לחשב את גורמי
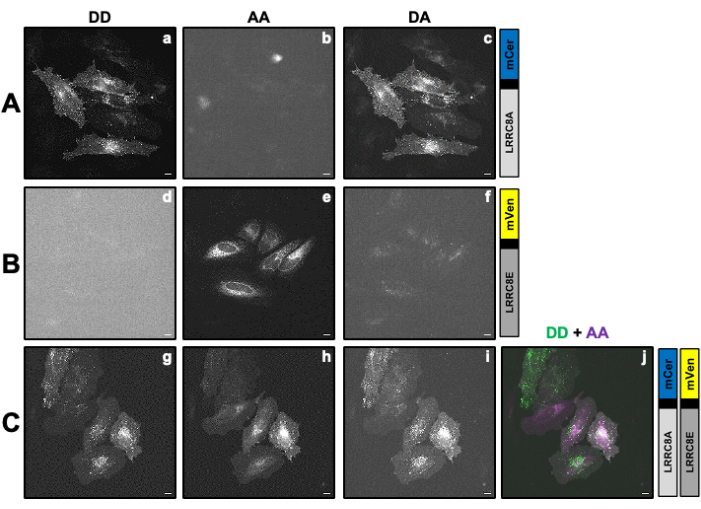
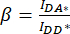 התיקון ו
התיקון ו 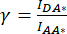 - ,
- ,
כאשר גורם התיקון β משמש כדי לפצות על הדימום של פליטת התורם לתוך ערוץ DA. גורם התיקון γ משמש כדי לפצות על עירור צולב של פלואורופור המקבל על ידי אורך גל עירור התורם בערוץ DA.
| עירור של | פליטה של | שם ערוץ | קו LED | קוביית סינון | מסנן מעבר ארוך |
| תורם | תורם | DD | 440 נאנומטר | CYR71010 | 460/80 ניוטון מטר |
| תורם | מקבל | דא | 440 נאנומטר | CYR71010 | 535/70 ניוטון מטר |
| מקבל | מקבל | א.א. | 510 ניוטון מטר | CYR71010 | 535/70 ניוטון מטר |
טבלה 2: סיכום הערוצים הדרושים לניסויי SE-FRET.
איור 2: תמונות פלואורסצנטיות מייצגות של דגימות המשמשות לחישוב גורמי התיקון β ו-γ הדרושים כדי לקבוע את פעילות VRAC של תעלה המורכבת מתת-יחידה LRRC8A המאוחה לתת-יחידה mCerulean3 (mCer) של התורם המאוחה לפלואורופור mVenus (mVen) המקבל באמצעות מדידות SE-FRET. (א,ב) איתור DD של התורם/תורם, AA מקבל/מקבל וערוץ DA של התורם/מקבל בתאי HeLa המבטאים רק את התורם (A) LRRC8A-mCer או את המקבל (B) LRRC8E-mVen. (C) זיהוי תעלות DD, AA ו-DA בתאי HeLa שהודבקו יחד עם זוג התורמים והמקבלים LRRC8A-mCer ו-LRRC8E-mVen. לוחות a-i מציגים תמונות שצולמו בערוץ איתור התורם (עירור התורם וזיהוי אות התורם; ד.ד.; a, d ו- g), ערוץ זיהוי המקבל (עירור המקבל וזיהוי אות המקבל; א.א.; b, e ו- h ) וערוץ זיהוי אות FRET (עירור התורם ואיתור האות המקבל; דא; ג, ו וט). לוח j הוא שכבת העל של הלוחות g ו- h. ערוץ DD מוצג בירוק וערוץ AA במגנטה. סרגל קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הדמיה בהילוך מהיר לכימות SE-FRET
- קחו את הדגימה המבטאת את מבנה התורם והמקבל (טבלה 1, איור 2C ואיור 3A), שאפו מדיה של תרבית תאים, ושטפו את התאים שלוש פעמים עם 2 מ"ל של חיץ איזוטוני 24 שעות לאחר הטרנספקציה.
- מוסיפים 3 מ"ל של חיץ איזוטוני ומניחים את הדגימה על שלב המיקרוסקופ.
- לשאיפה מאוחרת יותר של החיץ האיזוטוני, מקבעים ומתאימים צינורית צינורית כך שקצה הצינורית יגיע לתחתית המנה.
- להוספת חוצצים, יש לקבע ולהתאים את הצינורות כך שהחיץ המונע על ידי זרימת כוח הכבידה יוכל לרדת לתוך המנה.
הערה: כאן, נעשה שימוש במערכת זילוח כבידה מבוקרת שסתום עם ארבעה שסתומים מגנטיים כדי לשלוט בזרימת החיץ, אך שיטות אחרות ישימות גם כן. - מצא FOV עם לפחות תא אחד המבטא את מבנה התורם והמקבל בו זמנית.
- הגדר ניסוי קיטועי זמן עבור הערוצים DD, DA ו- AA עם מרווח של 10 שניות ומשך זמן כדי לכסות את כל התנאים של רצף הגירוי, לדוגמה, 12 מחזורים של קו בסיס ואחריו 15 מחזורים לכל מצב (איור 3).
הערה: ניתן לאמץ את המרווח ואת מספר המחזורים בהתאם לצרכי הניסוי, אך תמיד צריך לכלול מדידה בסיסית לנורמליזציה לתצוגה חזותית טובה יותר והשוואה של הנתונים. - לאחר מדידת קו הבסיס, שטפו את הדגימה במאגר עבור התנאי הראשון.
- שואפים את החיץ האיזוטוני דרך צינורית הצינור, תוך הפעלת ואקום עם מזרק.
- הוסף 3 מ"ל של החיץ של המצב הבא על ידי זרימת הכבידה.
- שאפו את המאגר והוסיפו שוב 3 מ"ל של אותו חיץ.
- חזור על שלב 5.7.3 פעם נוספת.
- לאחר מדידת התנאי הראשון, שטפו את הדגימה במאגר עבור התנאי הבא (שלבים 5.7.1-5.7.4).
- חזור על שלבים 5.5-5.8 עד שכל התנאים יילכדו.
- לכימות SE-FRET, ציירו החזר השקעה סביב התא/תאים ומדדו את העוצמה הממוצעת בערוץ DD = (IDD), DA (IDA) ו-AA (IAA) עבור כל התמונות (נקודות זמן) בסדרת הזמן (איור 3A, B).
- לחיסור רקע עבור אות FRET, צייר החזר השקעה בערוץ DA שבו נמצא רק אות הרקע ומדוד את העוצמה הממוצעת (IBDA).
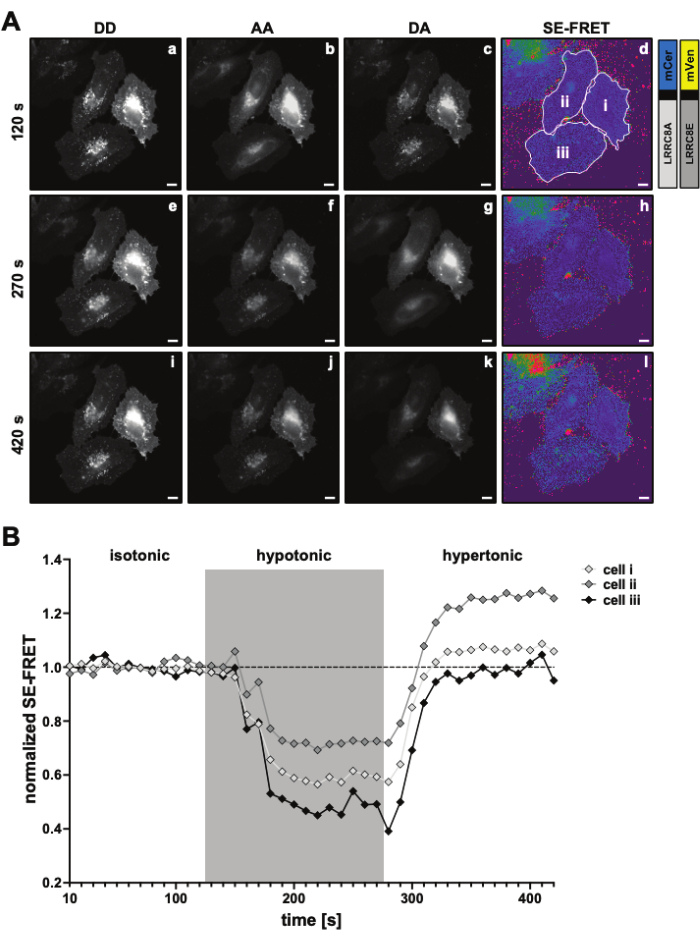
- הפחתת העוצמה הממוצעת של החזר ההשקעה ברקע מהעוצמה הממוצעת הנמדדת בהחזר ההשקעה על התא של ערוץ DA (
 ).
). - השתמש בערכים שנקבעו כדי לחשב את ערכי SE-FRET הממוצעים עבור כל החזר השקעה וכל נקודות
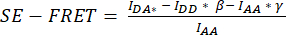 הזמן .
הזמן . - לקבלת יכולת השוואה טובה יותר של תנאים שונים ותצוגה חזותית של ערכי SE-FRET, השתמש בממוצע של ערכי הבסיס של כל החזר השקעה כדי לנרמל את כל נקודות הזמן של החזר ההשקעה המתאים.
- התווה את ערכי SE-FRET המנורמלים לאורך זמן (איור 3B).
איור 3: תמונות פלואורסצנטיות מייצגות וכימות SE-FET. (A) תמונות פלואורסצנטיות מייצגות ו-SE-FRET לכאורה של נקודת הזמן הראשונה של ניסוי הקפות זמן כדי למדוד את פעילות VRAC על ידי SE-FRET של תעלה המורכבת מתתי-יחידות LRRC8A ו-LRRC8E בהתאם לטוניות. סרגל קנה מידה = 10 מיקרומטר. אותם תאים מוצגים באיור 2C. לוחות a-i מציגים את הזיהוי של ערוצי DD, AA ו- DA ואת SE-FRET המחושב לכאורה. קווי מתאר לבנים מייצגים את החזר ההשקעה (תאים i-iii בלוח d) המשמשים למדידת עוצמות האות הממוצעות ב- DD, AA ו- DA ואת תמונת SE-FRET הנראית לעין. (B) כימות ערכי SE-FRET לאורך זמן. רצף התנאים היה 12 מחזורים של חיץ הדמיה איזוטוני (קו בסיס) ואחריו 15 מחזורים של חיץ הדמיה היפוטוני ו-15 מחזורים של חיץ הדמיה היפרטוני. ערך SE-FRET הממוצע הגולמי של כל החזר השקעה (תאים i-iii) ונקודת הזמן נורמל לממוצע של הערך הבסיסי (איזוטוני) עבור החזר ההשקעה המתאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
בשיטה מבוססת FRET זו, ניתן לנטר את פעילות LRRC8/VRAC במהלך גירוי אוסמוטי, והירידה ב- SE-FRET מתואמת עם מידת ההיפוטוניות החוץ תאית45. תוצאות מייצגות של הפעלת ערוצים הנגרמת על ידי היפוטוניות מוצגות גם כאן (איור 3 ואיור 4). בנוסף, ניתן לצפות בהפעלת LRRC8/VRAC על ידי גירויים איזוסמוטיים שונים, כגון מניפולציה של איתות דיאצילגליצרול45 או במהלך הפעלת מיוציטים56.
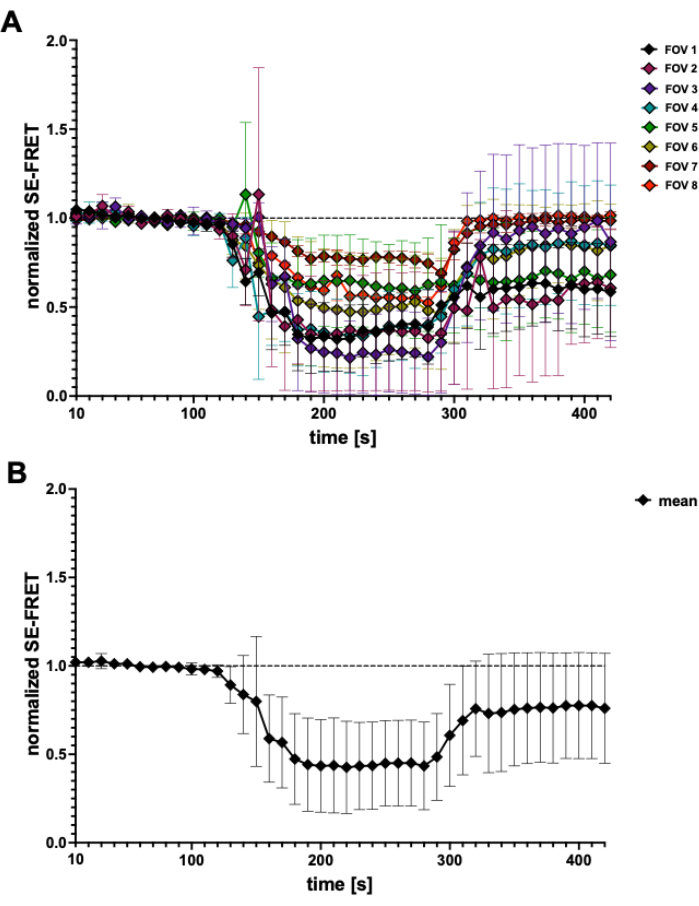
איור 4: עקבות SE-FRET. (A) עקבות SE-FRET לכאורה מ-5 ניסויים בלתי תלויים. הנתונים מייצגים ממוצע ± SD של N = 2 עד N = 7 תאים לכל שדה ראייה (FOV). (B) ממוצע ± SD של כל התאים (N = 31 תאים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מכיוון שתעלות LRRC8/VRAC מעורבות גם בהפחתת נפח אפופטוטי24,57, צפייה בפעילות הערוץ עם השראת אפופטוזיס תהיה יישום נוסף לשיטה המתוארת כאן. בהתאם לכך, פרוטוקול ניטור SE-FRET בתאי HeLa המבטאים LRRC8A-mCerulean3 ו-LRRC8E-mVenus בוצע תוך יישום תרופות הגורמות לאפופטוזיס בתיווך קולטן מוות. גורם נמק הגידול (TNF)-α וציקלוהקסמיד (CHX) הוכחו בעבר כמעוררים זרמי VRAC תוך מספר דקות58. לאחר תוספת של 2 ננוגרם/מ"ל TNF-α ו-1 מיקרוגרם/מ"ל CHX במאגר איזוטוני, חלה ירידה חזקה ב-SE-FRET (איור 5). החלפת החיץ בתווך היפרטוני, אף על פי שהכיל TNF-α ו-CHX, ערכי SE-FRET התאוששו קרוב לקו הבסיס (איור 5A), בהתאמה להפחתת זרמי VRAC בתמיסת אמבטיה היפרטונית במהלך הטיפול בליגנד Fas58 הגורם לאפופטוזיס. הטיפול בתאים עם DMSO, הממס עבור TNF-α ו- CHX, לא הביא להפחתת SE-FRET. TNF-α + CHX לא השפיעו על SE-FRET של CFP-18aa-YFP, מבנה טנדם של EYFP ו-ECFP כבקרת FRET59, מה שמדגים את הספציפיות של LRRC8/VRAC (איור 5B).
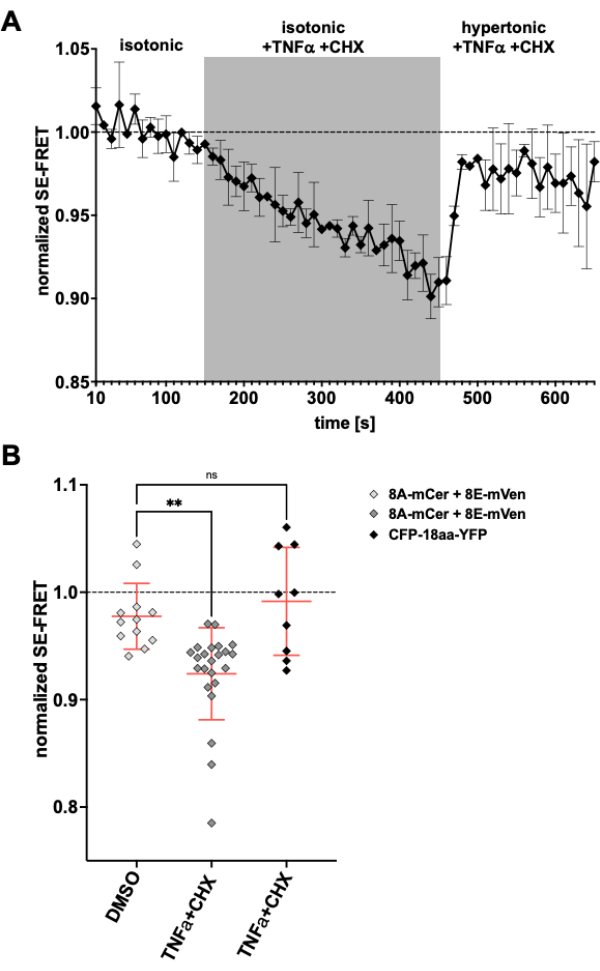
איור 5: הפעלת VRAC איזוסמוטית על-ידי אפופטוזיס בתיווך קולטן מוות. (A) ערכי SE-FRET מנורמלים מתאי HeLa המבטאים LRRC8A-mCer/LRRC8E-mVen (n = 8 מנות, 23 תאים) לאורך זמן. לאחר 15 מחזורים במאגר הדמיה איזוטוני (קו בסיס), פתרון האמבטיה הוחלף בחיץ איזוטוני בתוספת 2 ng/mL TNF-α ו-1 μg/mL cycloheximide (CHX) למשך 30 מחזורים ולאחר מכן 20 מחזורים חיץ הדמיה היפרטוני עם TNF-α ו-CHX. ערך SE-FRET הממוצע הגולמי של כל החזר השקעה ונקודת זמן נורמל לממוצע של הערך הבסיסי (איזוטוני) עבור החזר ההשקעה המתאים. (B) כימות ערכי SE-FRET מנורמלים של תאי HeLa המבטאים LRRC8A/E כמו ב-A עם תמיסה איזוטונית המכילה DMSO כבקרת רכב עבור CHX (n = 5 כלים, 12 תאים) או חיץ איזוטוני המכיל השראות אפופטוזיס כמו ב-A (n = 8 כלים, 23 תאים), או של תאי HeLa המבטאים CFP-18aa-YFP עם השראות אפופטוזיס (n = 3 כלים, 9 תאים). הנתונים מייצגים את הממוצע של 10 נקודות הזמן האחרונות במאגר המתאים של תאים בודדים (סמלים) ואת הממוצע של כל התאים ± SD; ** p < 0.01 ANOVA חד-כיווני רגיל ואחריו מבחן ההשוואה המרובים של Tukey לאחר הוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מיקרוסקופ FRET הוא טכניקה מבוססת ובשימוש נרחב לחקר האינטראקציה בין חלבונים. לפיכך, שיטות מבוססות FRET ניתן ליישם במעבדות רבות של מומחיות משתנה. סידורים קונפורמטיביים במהלך gating נוטרו עבור מגוון רחב של תעלות יונים באמצעות בדיקות מבוססות FRET (לדוגמה, ראה הפניות 34,50,51,52,53,60,61,62,63,64,65,66,67), במקרים מסוימים בשילוב עם אלקטרופיזיולוגיה בפלאורומטריה מהדק טלאי 68,69,70,71. ניתן להשתמש ב-FRET כדי לחקור את יחסי מבנה-פונקציה של תעלות יונים אלה או כדי לפקח על פעילותן ללא תלות בהעברת יונים. לשיטה המוצגת כאן יכולים להיות יתרונות ברורים על פני אלקטרופיזיולוגיה מכיוון שהיא מאפשרת ניטור הפעילות של תעלות LRRC8/VRAC באתרן.
שלבים קריטיים בפרוטוקול כוללים ציפוי התאים כדי להגיע למפגש אופטימלי עבור טרנספקציה והדמיה, אשר באופן אידיאלי מאפשר הבחנה קלה בין תאים לניתוח מאוחר יותר. העברה משותפת יעילה של תת-היחידות השונות חיונית ללוקליזציה תת-תאית נכונה; לדוגמה, עודף של תת-היחידה שאינה LRRC8A יוביל ללוקליזציה משופרת של הרשתית האנדופלסמית (ER)4. לכן, ייתכן שיהיה צורך להתאים את יחסי הפלסמיד. בהתאם למערכת, זוגות FRET חדשים שנוצרו צריכים להיות מאומתים, למשל, על ידי הלבנה מקבלת. יש לאזן את זמן החיבור וזמן החשיפה זה כנגד זה כדי לאפשר פתרון זמני ומרחבי אופטימלי לשאלת המחקר. בינינג מאפשר זמני חשיפה קצרים יותר ובכך מפחית את פוטנציאל ההלבנה של חיישן FRET תוך הפחתת הרזולוציה המרחבית. לכן, אם מערך הניסוי דורש, למשל, אפליה תת-תאית של פעילות LRRC8/VRAC, יש להימנע מקשירה. שאלת המחקר קובעת באופן שווה את מספר ומרווח המחזורים בסדרת קיטועי זמן. מרווח הזמן רלוונטי רק אם הקינטיקה של שינויי FRET (ולכן הפעלה/הפעלה של LRRC8/VRAC) נדרשת; אחרת, ניתן לבצע גם הקלטות פשוטות של "לפני ואחרי". אורך הניסוי תלוי בתהליך הפיזיולוגי. באופן אידיאלי, יש לעקוב אחר פעילות LRRC8/VRAC בגירויים עד לייצוב SE-FRET. גורמים אלה יכולים להיקבע בניסויי פיילוט. יש לקבוע גורמי תיקון לחישוב אות SE-FRET האמיתי עבור כל התנאים. גורמי תיקון שנקבעו באופן שגוי עלולים להוביל להערכת יתר או חסר של עוצמות SE-FRET. לבסוף, לאחר קביעת קו בסיס יציב, מרווח הזמן בין התמונות צריך להיות קצר מספיק כדי ללכוד את התהליך הפיזיולוגי של עניין.
השיטה נושאת כמה מגבלות. אחת מהן היא ששינויים בעוצמות ה-FRET הבין-LRRC8 תוך שיקוף תנועות ה-LRRDs, אינם בהכרח תואמים להעברת יונים או אוסמוליטים דרך הנקבוביות. זה ברור מהשינויים ב-FRET שנצפו עם LRRC8A homomers45 למרות הזרמים המינימליים שלהם 4,32,72. ייתכן שחוסמי נקבוביות של ערוצי LRRC8/VRAC לא ישפיעו על אות ה-FET, ולכן שיטה זו אינה מתאימה לחיפוש אחר אפנן ערוצים ספציפי. יתר על כן, רמות הביטוי של חלבוני LRRC8 המבוטאים יתר על המידה עשויות להשפיע על התהליכים הפיזיולוגיים הנצפים, במיוחד כאשר חלבוני LRRC8 המתויגים C סופניים מציגים פעילות בסיסית14.
היבט שיכול להיחשב כמגבלה או יתרון בהתאם לשאלת המחקר הספציפית הוא שבשיטה זו, רק תת-היחידות LRRC8 המבוטאות באופן אקטופי נמדדות באופן סלקטיבי. לכן, רמות רקע של חלבונים אנדוגניים כמעט ולא מפריעות למדידות. מצד שני, החלבונים המבוטאים יתר על המידה עשויים שלא להתנהג כמו תעלות LRRC8 אנדוגניות עם הרכב תת-יחידות וסטויכיומטריה שונים פוטנציאלית. לדוגמה, גירויים שונים כגון חמצון עשויים להיות בעלי השפעות מודולטוריות מנוגדות על תעלות LRRC836 המורכבות באופן שונה. על ידי שינוי היחסים בין תת-יחידות המבוטאות במשותף, ניתן לכוונן את הסטויכיומטריה שלהן ואת מוליכות היונים הכוללת14,73, אך ההרכב המקורי שלהן, עם ככל הנראה לעתים קרובות יותר משני פרלוגים בתוךקומפלקס אחד 21, אינו ברור ועשוי להשתנות בין סוגי תאים 74,75,76. יתר על כן, היתוך של חלבונים פלואורסצנטיים ל-C-termini הציטוסולי של חלבוני LRRC8 הוכח כמגביר את פעילות תעלת LRRC8/VRAC הבסיסית בביציות Xenopus 14, ככל הנראה משום שהתגים הגדולים מווסתים את הקונפורמציה של ה-LRRDs, אשר עשויים לשלוט בפתיחת התעלה 14,44,45 . לכן, גודלם של החלבונים הפלואורסצנטיים, המקשר והכיוון שלהם עשויים להשפיע לא רק על יעילות FRET אלא גם על פעילות התעלה. עם זאת, חשוב לציין, תעלות VRAC של חלבוני LRRC8 שהתמזגו עם חלבונים פלואורסצנטיים נותרו מגיבות לגירוי היפוטוני14, מה שאיפשר את השימוש בהם כחיישני FRET45.
היתרונות של שיטה לא פולשנית זו לניטור פעילות ערוץ LRRC8/VRAC במיקרוסקופ אור בהשוואה לשיטות אחרות כוללים: (i) היא מאפשרת צפייה ב-LRRC8/VRAC בתוך תאים או תאים שבדרך כלל אינם נגישים לאלקטרופיזיולוגיה. זה כולל אברונים תוך תאיים שעליהם ניתן למצוא קומפלקסים של LRRC8 או לכוון אותם ל-45,77,78. (ii) ההרכב הציטוסולי נותר ללא שינוי בשיטה, בעוד שבמהלך מדידות מהדק טלאי של כל התא, הציטוזול מוחלף במידה רבה בתמיסת פיפטה, אשר עשויה להשפיע על מסלולי איתות כפי שנצפו עם הפעלת LRRC8/VRAC45 הנגרמת על ידי phorbol-12-myristate-13-acetate (PMA). (iii) הוא מציע את האפשרות לצפות בהפעלת LRRC8/VRAC ברזולוציה תת-תאית, כגון הבחנה בין פעילות בקצוות המובילים והנגררים במהלך נדידת תאים, כאשר -מוגבל לחללים סגורים - VRAC מעורב79,80. (iv) הוא מאפשר ניטור רציף של פעילות LRRC8/VRAC במהלך תהליכים פיזיולוגיים מורחבים כגון התמיינות מיוציטים56.
אמנם יש מגבלות ואתגרים בשיטה זו, אך היא טומנת בחובה הבטחה לחקירה נוספת, כולל יישומים פוטנציאליים במודלים של בעלי חיים. בשילוב עם שיטות אחרות לחקר משפחת תעלות היונים והאוסמוליטים, בדיקה מבוססת FRET זו עשויה לתרום באופן משמעותי לפענוח מנגנוני ההפעלה ולחקור את הפונקציות הפיזיולוגיות המגוונות של ערוצי LRRC8 בסביבתם הטבעית.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים ל- C.F. Kaminski על תרומתו האדיבה של הפלסמיד המקודד את מבנה CFP-18aa-YFP, ל- A. Klemmer על הסיוע הטכני, ולכל חברי מעבדת שטאובר בהווה ובעבר שתרמו לפיתוח שיטה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
References
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367(2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974(2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885(2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461(2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431(2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382(2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532(2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435(2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421(2019).
- Hille, B. Ion Channels of Excitable Membranes. 3rd edn. , Sinauer. Sunderland, Massachusetts. (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896(2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, Suppl 1 S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215(2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118(2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093(2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755(2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108(2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7(2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940(2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879(2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663(2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved