Method Article
使用敏化发射 Förster 共振能量转移 (SE-FRET) 监测含有 8 通道亮氨酸的富含亮氨酸重复序列 (LRRC8/VRAC) 活性
摘要
电生理学是研究离子通道活性的金标准。但是,有很多替代方法,包括光学方法。在这里,我们描述了一种使用基于亚基间 Förster 共振能量转移 (FRET) 的方法监测包含 8 个通道 (LRRC8) 形成的阴离子通道的富含亮氨酸重复序列的活性的方法。
摘要
LRRC8 蛋白家族的成员形成异聚离子和渗透离子通道,在许多生理过程中发挥作用。作为体积调节阴离子通道 (VRACs)/体积敏感的外向整流通道 (VSORs),它们在渗透细胞膨胀时被激活并介导氯离子和有机渗透液的挤出,导致水外流,从而导致细胞收缩。除了在渗透压调节中的作用外,VRAC 还与分化、迁移和细胞凋亡等细胞过程有关。通过它们对膜电位及其各种信号分子转运的影响,包含 8 个富含亮氨酸的重复序列 (LRRC8) 通道在神经元-胶质细胞通讯、胰岛素分泌和免疫反应中发挥作用。激活机制仍然难以捉摸。与其他离子通道一样,LRRC8 通道通常使用电生理学方法进行研究。在这里,我们描述了一种通过测量与 LRRC8 亚基的 C 末端富含亮氨酸重复结构域融合的荧光蛋白之间的复合物内敏化发射 Förster 共振能量转移 (SE-FRET) 来检测 LRRC8 通道激活的方法。这种方法提供了在没有交换胞质环境的情况下以及在细胞分化和细胞凋亡等过程中原位研究通道激活的可能性。
引言
由含有 8 种富含亮氨酸重复序列的异聚体组成的离子通道 8 (LRRC8) 家族蛋白遍布整个脊椎动物细胞,参与广泛的生理功能 1,2。这些 LRRC8 通道最初被确定为容量调节阴离子通道 (VRAC) 或容量敏感的向外整流通道 (VSOR),在细胞调节体积减少中起着至关重要的作用 3,4。它们促进氯离子和有机渗透物的排出,然后随着渗透膨胀而出现水外排。除了在渗透应激反应中的作用外,它们在细胞体积调节中的作用还与细胞增殖和迁移、细胞凋亡、精子发生和上皮完整性有关 5,6,7。LRRC8/VRAC 激活后膜电位的改变已被证明有助于肌管分化8 和胰腺β细胞分泌胰岛素 9,10,11。此外,LRRC8 通道传导多种有机渗透物,例如嘌呤能信号分子 ATP 和 cGAMP 或兴奋性氨基酸谷氨酸,将这些通道置于免疫系统的细胞间通讯或神经胶质细胞-神经元相互作用中 12,13,14,15,16,17,18,19,20,21,22.甚至外源性物质,如染料荧光素、抗生素杀稻瘟菌素 S 或抗癌药物顺铂,也是由 LRRC8 通道传导的 23,24,25。
关于导致 LRRC8/VRAC 激活的信号转导,有许多报道 26,27,28。然而,其机制仍不清楚,文献提出了可能取决于特定生理过程的广泛潜在机制。这些包括胞质离子强度的变化、与细胞骨架的相互作用、膜组成、G 蛋白、氧化还原状态和磷酸化级联反应 2,27,29,30,31。
LRRC8/VRAC 通道包含 LRRC8A 作为必需亚基 3,4,它必须与至少一个旁系同源物 LRRC8B-E 异聚化以形成生理功能通道 4,14,32。亚基组成决定了通道的生物物理特性,例如整流和去极化依赖性失活 4,29,32,33,34,底物特异性 15,17,20,21,24,35 和一些激活途径 36,37.冷冻电子显微镜 (cryo-EM) 结构显示,LRRC8A 同源体以及异聚体组装为六聚体 38,39,40,而形成功能通道的 LRRC8A/LRRC8C 嵌合体是七聚体 41。所有 LRRC8 蛋白的 N 端部分由四个跨膜螺旋组成,C 端部分包含一个富含亮氨酸重复序列 (LRRD) 的结构域。可用的 LRRC8 复合物结构提供了证据,证明延伸到胞质溶胶 3,4,23 的 LRRD 可能在通道门控期间发生构象重排 34,42,43。荧光蛋白的 C 端融合导致基底通道活性14,并且纳米抗体与结构域的结合可以调节通道活性44,这一发现证实了这一概念。此外,复合体内 Förster 共振能量转移 (FRET) 显示 C 末端的构象改变45。
研究离子通道活性的最常用方法是电生理学测量46,在分子鉴定之前,它被广泛应用于 VRAC 的研究47。然而,还有各种其他方法可以间接监测 VRAC 活性,包括测量其传导底物 - 卤化物离子或有机渗透剂 - 或其对细胞体积的影响48。事实上,LRRC8 蛋白是否为 VRAC 依赖于基于碘化物通过活化的 VRAC 进入细胞来淬灭卤化物敏感荧光蛋白49 的测定 3,4。另一种监测 LRRC8/VRAC 通道活性的方法是利用胞质结构域的运动,这可以通过 FRET45 的变化观察到,就像在其他离子通道 50,51,52,53 中一样。为此,将用作 FRET 对的荧光蛋白,例如作为供体的青色荧光蛋白 (CFP)/mCerulean3 和作为受体的黄色荧光蛋白 (YFP)/mVenus,与 LRRC8 蛋白的 C 末端融合(图 1)。受体光漂白实验显示了 LRRC8 亚基之间的复合物内FRET45。避免了破坏性光漂白方法,通过敏化发射 FRET (SE-FRET) 监测 FRET 随时间的变化,其中基本上由于供体的发射光谱与受体的激发光谱重叠,测量了受体在供体激发时的敏化发射。应用细胞外低渗性,刺激 LRRC8/VRAC 激活,导致 SE-FRET 强度可逆降低45。重要的是,在低渗治疗期间同时进行的全细胞膜片钳测量和 FRET 监测表明,FRET 的这种降低确实反映了 LRRC8/VRAC 激活45。这种方法避免了通过移液器溶液破坏质膜或改变细胞内环境,为监测 LRRC8/VRAC 活性提供了一种替代方案。它在维持天然胞质溶胶至关重要、需要亚细胞分辨率或需要长时间观察通道活动的生理环境中特别有用。
在这里,我们提出了一种使用这种基于 FRET 的读数来研究 LRRC8/VRAC 的方案。该方案描述了如何处理和转染细胞、采集样品和控制图像、分析数据以及计算敏化发射 FRET (SE-FRET) 值。
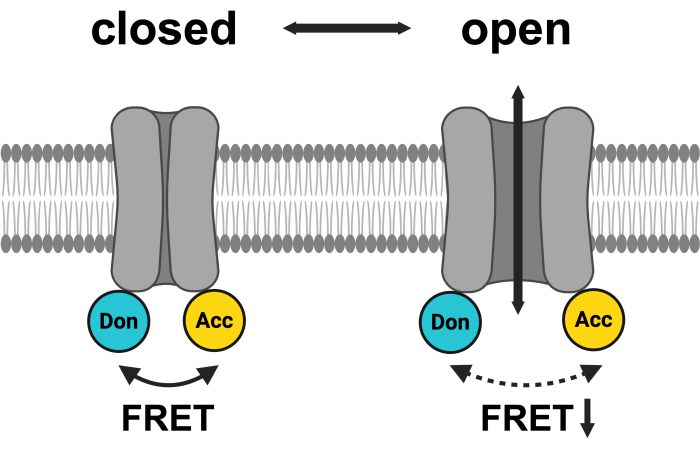
图 1:LRRC8 FRET 对系统示意图。 mCerulean3 以青色显示,mVenus 以黄色显示。VRAC 打开后,荧光团之间的距离(和/或空间方向)发生变化,导致供体 (Don) 和受体 (Acc) 之间的能量传递减少,进而降低观察到的 FRET。使用 BioRender.com 创建。请单击此处查看此图的较大版本。
研究方案
1. 缓冲液和试剂的制备
- 准备中等和等渗、低渗和高渗缓冲液,并用渗透压计测量缓冲液的渗透压,以确保渗透压 (Osm) 在预期范围内,只有可接受的偏差。
- 细胞培养基:制备补充有 10% 胎牛血清 (FBS) 和 1% 青霉素/链霉素的 Dulbecco 改良 Eagle 培养基 (DMEM)
- 等渗成像缓冲液 (~340 mOsm):通过混合 150 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-葡萄糖和 10 mM 4-(2-羟基乙基)-1-哌嗪乙烷磺酸 (HEPES) 来制备等渗成像缓冲液。
- 低渗成像缓冲液 (~250 mOsm):通过混合 105 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-葡萄糖和 10 mM HEPES 来制备低渗成像缓冲液。
- 高渗成像缓冲液 (~500 mOsm):通过混合 160 mM D(-)-甘露醇、150 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-葡萄糖和 10 mM HEPES 来制备高渗成像缓冲液。
注:缓冲液可能补充特定药物,具体取决于将要研究的内容。
2. 贴壁细胞在玻璃底培养皿上的生长
- 准备至少一个培养皿,仅使用与供体或受体荧光团融合的目标蛋白 (POI) 进行转染,至少准备一个培养皿,用于与供体和受体对进行转染(表 1 和 图 2)。使用玻璃底培养皿进行荧光显微镜检查。根据细胞类型,通过特殊清洁或涂覆聚赖氨酸对表面进行预处理。
注:在这里,FRET 供体 mCerulean3 (mCer)54 和 FRET 受体 mVenus (mVen)55 用作 FRET 对,但荧光团的其他组合也适用。表达与供体或受体单独融合的 POI 的样品用于确定校正受体通道中供体渗出和供体激发波长对受体交叉激发所需的校正因子 β 和 γ(表 1)(图 2Ac,Bf)。 - 转染前一天,将 1 x 10个 5 HeLa 细胞接种在 2 mL 细胞培养基中,置于 35 mm 培养皿上,玻璃底适合荧光显微镜检查。在细胞培养箱中,在 37 °C 和 5% CO2 气氛下培养细胞过夜。
注:试剂的体积可以适应其他不同尺寸的细胞培养皿/培养瓶的表面积。细胞数量可以适应适合不同细胞系和实验方法的密度。- 使用真空泵从在 T75 细胞培养瓶上培养的单层贴壁细胞中吸出细胞培养上清液。
- 向细胞培养瓶中加入 10 mL Dulbecco 磷酸盐缓冲盐水 (DPBS) 洗涤细胞,然后用真空泵吸出溶液。
- 用 1mL 的 0.05% 胰蛋白酶-EDTA 完全覆盖细胞,并在细胞培养箱中将细胞在 37 °C 和 5% CO2 气氛中孵育 2 分钟。
- 加入 9 mL 细胞培养基,通过移液悬浮细胞。
- 将细胞悬液转移至 15 mL 试管中,并在室温 (RT) 下以 700 x g 离心 3 分钟。
- 用真空泵吸出上清液,并将细胞沉淀重悬于 10 mL 细胞培养基中。
- 在试管中混合等体积的细胞悬液和 0.4% 台盼蓝,并向计数玻片中加入 10 μL。将玻片放入自动细胞计数仪中,并使用适当的细胞计数程序开始计数。
- 要计算每个培养皿所需的细胞悬液体积,请将每个培养皿所需的细胞数 (1 x 105) 除以从细胞计数仪获得的每毫升细胞数。
- 在合适的试管中制备细胞悬液,其中包含每个培养皿所需的细胞数、每个培养皿所需的体积 (2 mL) 加上一个培养皿的额外量。
- 通过倒置试管并在每个培养皿中吸取 2 mL 细胞悬液,混合细胞悬液至少 20 次。
- 为确保细胞分布更均匀,请将培养皿在 RT 下放置 30 分钟,然后再将其放入细胞培养箱中。
3. 细胞转染
注:此处使用 FuGENE 作为转染试剂。其他转染试剂和方法也适用。需要根据经验评估质粒 DNA (pDNA) 与转染试剂的最佳比例以及每种 POI 和细胞模型的最佳表达时间。在这里,每 35 mm 培养皿使用 2 μg 总 pDNA。FRET 供体和受体构建体以 1:1 的比例使用,pDNA 与转染试剂的比例为 1:4(表 1)。
- 转染前,用新鲜的 2 mL 预热培养基替换细胞培养上清液。
- 在最终体积为 100 μL(=pDNA 溶液)的 Opti-Minimal 必需培养基 (MEM) 中稀释 pDNA。
- 在 Opti-MEM 中稀释转染试剂,最终体积为 100 μL(=试剂溶液)。
注:为了获得更均匀的转染,请制备 pDNA 和试剂溶液的预混液。 - 将 pDNA 和试剂溶液充分混合。
- 将 pDNA 溶液添加到试剂溶液(=转染溶液)中。
- 充分混合转染溶液。
- 将转染溶液在 RT 下孵育 15 分钟。
- 以螺旋运动方式将转染溶液逐滴加入培养皿中。
- 将培养皿在工作台面上水平和垂直移动 5 次,混合。
- 在细胞培养箱中,在 37 °C 和 5% CO2 气氛下培养细胞过夜。
| 条件 | 构造体 (s) | 样本 | 用于 |
| 1 | LRRC8A-m蔚蓝 | 仅供体构建体 | 确定校正因子 β |
| 2 | LRRC8E-mVenus | 仅受体结构 | 确定校正因子 γ |
| 3 | LRRC8A-mCerulean 和 LRRC8E-mVenus | 品丝对 | SE-FRET 定量 |
表 1:典型 SE-FRET 实验所需的条件示例,以测量由与供体融合的 LRRC8A 亚基 (mCerulean3) 和与受体融合的 LRRC8E 亚基 (mVenus) 荧光团组成的通道的 LRRC8/VRAC 活性。
4. 用于校正因子确定的图像采集
注意:在 FRET 期间,供体发射会渗入检测到的受体发射中。此外,受体荧光团通过供体激发波长进行交叉激发。在计算 SE-FRET 期间,必须对这些过程进行补偿。为此,在转染后 24 小时,在仅表达 FRET 供体或受体的细胞中测定校正因子。在这里,成像是在配备 Leica LED8 灯、滤光片立方体CYR71010、HC PL APO 63x/1.40 OIL 物镜、460/80 和 553/70 长通滤光片以及 Leica DFC9000GTC 相机的 Leica THUNDER 成像仪上进行的。实验在没有环境控制的情况下进行,但在成像缓冲液中存在 HEPES 的情况下进行,以稳定 pH 值。对于长期观察/测量,建议使用环境控制系统。为了进行分析,SE-FRET 是根据捕获的原始图像计算的。这可以在采集期间或采集后同时进行。在这里,带有 SE-FRET 插件的 Leica LAS X 软件用于简化有关校正因子计算和在图像采集过程中实时可视化 SE-FRET 值变化的实验程序。对于采集后,可以根据下面提供的协议在原始数据采集后使用其他软件包(例如,FIJI)确定校正因子和 SE-FRETs。
- 在对单个转染细胞进行图像采集以计算校正因子之前,使用一个表达 FRET 对的样品来设置所有通道(供体激发/供体发射 DD、供体/受体 DA 和受体/受体 AA;参见 表 1 和 图 2C 和 图 3A)。
注:对于如上所述转染 mCerulean3 和 mVenus 标记的 VRAC 亚基的 SE-FRET 测量,使用以下参数:8x8 像素合并、100ms 曝光时间和 10% LED 灯强度。 - 取仅表达供体构建体的样品(图 2A),吸出细胞培养基,并用 2 mL 等渗缓冲液洗涤细胞 3 次。
- 加入 3 mL 等渗缓冲液,将样品放在显微镜载物台上。
- 找到至少有一个细胞表达供体构建体的视野 (FOV)。
- 对所有通道进行成像(DD、DA 和 AA 参见 表 2 和 图 2A)。
- 在细胞/细胞周围绘制感兴趣区域 (ROI) 并测量 DA 的平均强度 (= IDA;图 2Ac)和 DD (= IDD;图 2Aa)。
- 对于背景减法,在仅找到背景信号的 DA 和 DD 通道中绘制 ROI 并测量平均强度(IBDA 和 IBDD)。
- 从相应通道 ( 和
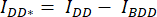 )
) 的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。
的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。 - 重复步骤 4.2-4.5,样品仅表达受体构建体(图 2B)。
- 在细胞周围绘制 ROI 并测量 DA 的平均强度 (= IDA; 图 2Bf)和 AA (= IAA; 图 2Be)。
- 对于背景扣除,在仅找到背景信号的 DA 和 AA 通道中绘制 ROI 并测量平均强度(IBDA 和 IBAA)。
- 从相应通道 ( 和
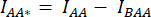 )
) 的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。
的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。 - 使用为 IDA*、I DD* 和 IAA* 确定的值来计算校正因子
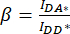 和
和 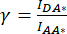 ,
,
其中校正因子 β 用于补偿供体发射到 DA 通道的泄漏。校正因子 γ 用于补偿 DA 通道中供体激发波长对受体荧光团的交叉激发。
| 激发 | 发射 | 频道名称 | LED 线 | Filter cube(过滤立方体) | 长通滤波器 |
| 施主 | 施主 | DD 系列 | 440 纳米 | CYR71010 | 460/80 纳米 |
| 施主 | 受主 | 大 | 440 纳米 | CYR71010 | 535/70 纳米 |
| 受主 | 受主 | 机 管 局 | 510 纳米 | CYR71010 | 535/70 纳米 |
表 2:SE-FRET 实验所需的通道总结。
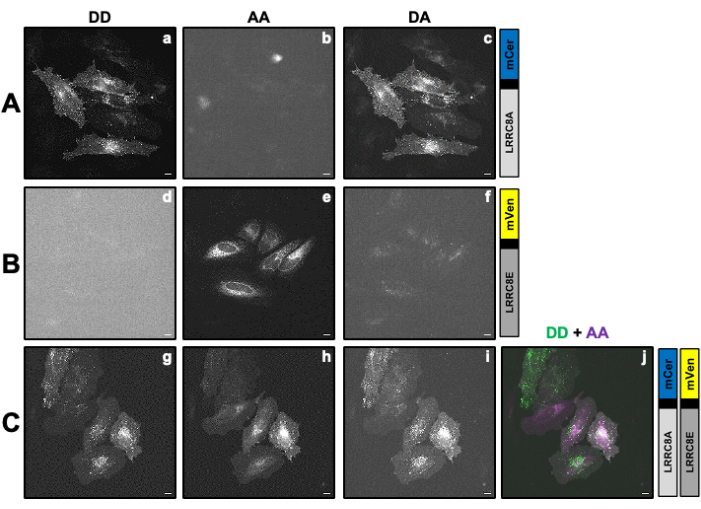
图 2:样品的代表性荧光图像,用于计算校正因子 β 和 γ 确定由与供体 mCerulean3 (mCer) 融合的 LRRC8A 亚基和通过 SE-FRET 测量与受体 mVenus (mVen) 荧光团融合的 LRRC8E 亚基组成的通道的 VRAC 活性。 (A,B)在仅表达供体 (A) LRRC8A-mCer 或受体 (B) LRRC8E-mVen 的 HeLa 细胞中检测供体/供体 DD、受体/受体 AA 和供体/受体 DA 通道。(C) 在共转染供体和受体对 LRRC8A-mCer 和 LRRC8E-mVen 的 HeLa 细胞中检测 DD、AA 和 DA 通道。面板 a-i 显示在供体检测通道中拍摄的图像(供体的激发和供体信号的检测;DD;a、d 和 g)、受体检测通道(受体的激励和受体信号的检测;机 管 局;b、e 和 h)和 FRET 信号检测通道(激发供体和检测受体信号;大;c、f 和 i)。面板 j 是面板 g 和 h 的叠加层,DD 通道以绿色显示,AA 通道以洋红色显示。比例尺 = 10 μm。请点击此处查看此图的较大版本。
5. 用于 SE-FRET 定量的延时成像
- 取表达供体和受体构建体的样品(表 1、 图 2C 和 图 3A),吸出细胞培养基,并在转染后 24 小时用 2 mL 等渗缓冲液洗涤细胞 3 次。
- 加入 3 mL 等渗缓冲液,将样品放在显微镜载物台上。
- 为了稍后吸入等渗缓冲液,固定并调整软管套管,使套管尖端到达培养皿的底部。
- 对于添加缓冲液,固定并调整管道,以便由重力流驱动的缓冲液可以落入培养皿中。
注:这里使用了带有四个电磁阀的阀控重力灌注系统来控制缓冲液流量,但其他方法也适用。 - 找到至少一个细胞同时表达供体和受体构建体的 FOV。
- 为通道 DD、DA 和 AA 设置一个延时实验,间隔为 10 秒,持续时间涵盖刺激序列的所有条件,例如,基线 12 个周期,每个条件 15 个周期(图 3)。
注意:间隔和循环数可以根据实验需要采用,但应始终包括用于标准化的基线测量,以便更好地可视化和比较数据。 - 基线测量后,在缓冲液中洗涤样品以达到第一种条件。
- 通过软管套管吸出等渗缓冲液,用注射器施加真空。
- 通过重力流加入 3 mL 下一个条件的缓冲液。
- 吸出缓冲液并再次加入 3 mL 相同的缓冲液。
- 再次重复步骤 5.7.3。
- 测量第一个条件后,在缓冲液中洗涤样品以用于下一个条件(步骤 5.7.1-5.7.4)。
- 重复步骤 5.5-5.8,直到捕获所有条件。
- 对于 SE-FRET 定量,在细胞/细胞周围绘制 ROI,并测量时间序列中所有图像(时间点)的 DD = (IDD)、DA (IDA) 和 AA (IAA) 通道中的平均强度(图 3A、B)。
- 对于 FRET 信号的背景扣除,在仅找到背景信号的 DA 通道中绘制 ROI 并测量平均强度 (IBDA)。
- 从 DA 通道 ()
 的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。
的细胞 ROI 中测量的平均强度中减去背景 ROI 的平均强度。 - 使用确定的值计算每个 ROI 和所有时间点
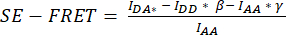 的平均 SE-FRET 值。
的平均 SE-FRET 值。 - 为了更好地比较不同条件和 SE-FRET 值的可视化,请使用每个 ROI 的基线值的平均值来标准化相应 ROI 的所有时间点。
- 绘制随时间变化的标准化 SE-FRET 值(图 3B)。
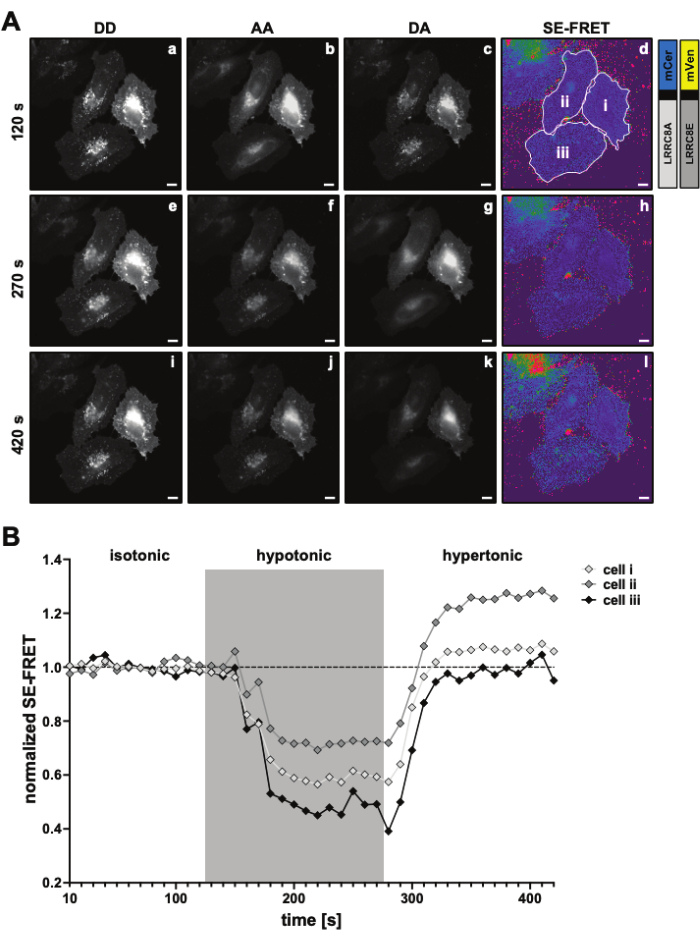
图 3:代表性荧光图像和 SE-FRET 定量。(A) 代表性荧光图像和时间循环实验第一个时间点的表观 SE-FRET图像,用于测量由 LRRC8A 和 LRRC8E 亚基组成的通道的 VRAC 活性,具体取决于张力。比例尺 = 10 μm。相同的单元格如图 2C 所示。图 a-i 显示了 DD、AA 和 DA 通道的检测以及计算的表观 SE-FRET。白色轮廓表示用于测量 DD、AA 和 DA 中平均信号强度以及表观 SE-FRET 图像的 ROI(图 d 中的单元格 i-iii)。(B) SE-FRET 值随时间变化的定量。条件顺序是 12 个周期的等渗成像缓冲液 (基线),然后是 15 个周期的低渗和 15 个周期的高渗成像缓冲液。将每个 ROI (单元格 i-iii) 和时间点的原始平均 SE-FRET 值标准化为相应 ROI 的基线 (等渗) 值的平均值。请单击此处查看此图的较大版本。
结果
使用这种基于 FRET 的方法,可以在渗透刺激期间监测 LRRC8/VRAC 活性,并且 SE-FRET 的降低与细胞外低渗程度相关45。此处还显示了低渗诱导的通道激活的代表性结果(图 3 和 图 4)。此外,可以观察到不同等渗刺激的 LRRC8/VRAC 激活,例如纵甘油二酯信号传导45 或心肌细胞激活期间 56。
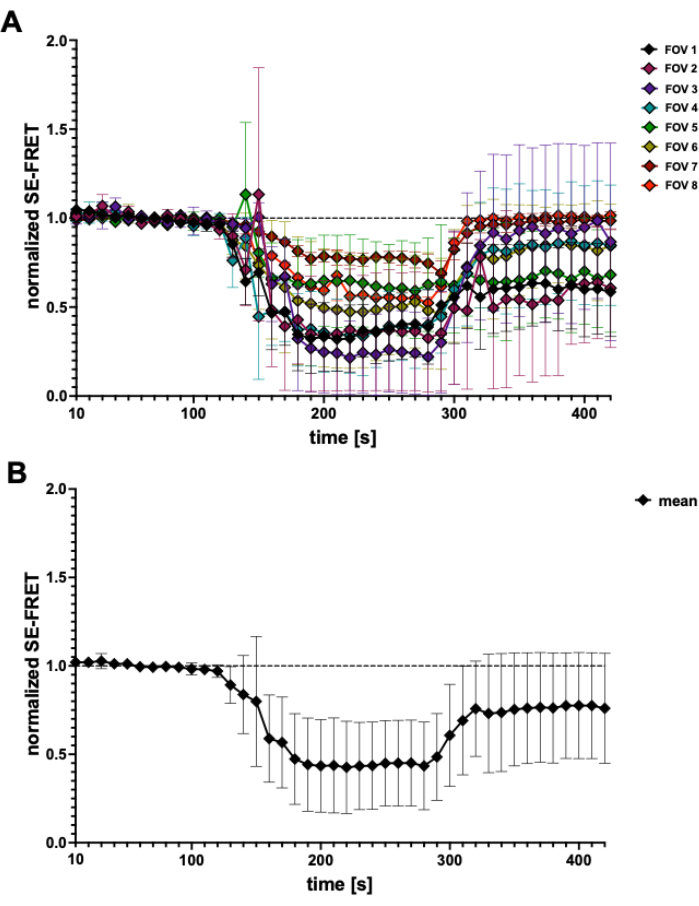
图 4:SE-FRET 轨迹。 (A) 来自 5 个独立实验的表观 SE-FRET 轨迹。数据表示每个视野 (FOV) N = 2 至 N = 7 个细胞的平均 ± SD。(B) 所有细胞的平均 ± SD (N = 31 个细胞)。 请单击此处查看此图的较大版本。
由于 LRRC8/VRAC 通道也参与凋亡体积减少24,57,因此在诱导细胞凋亡时观察通道活动将是此处描述的方法的另一个应用。因此,在应用死亡受体介导的细胞凋亡诱导药物的同时,在表达 LRRC8A-mCerulean3 和 LRRC8E-mVenus 的 HeLa 细胞中监测 SE-FRET 的方案。肿瘤坏死因子 (TNF)-α 和放线菌酮 (CHX) 先前显示可在几分钟内诱发 VRAC 电流58。在等渗缓冲液中加入 2 ng/mL TNF-α 和 1 μg/mL CHX 后,SE-FRET 明显降低(图 5)。用高渗培养基代替缓冲液,即使含有 TNF-α 和 CHX,SE-FRET 值也恢复到接近基线(图 5A),对应于在用诱导细胞凋亡的 Fas 配体58 处理期间高渗浴溶液中 VRAC 电流的减少。用 DMSO(TNF-α 和 CHX 的溶剂)处理细胞不会导致 SE-FRET 降低。TNF-α + CHX 不影响 CFP-18aa-YFP 的 SE-FRETs,CFP-18aa-YFP 是一种 EYFP 和 ECFP 串联构建体作为 FRET 对照59,证明了对 LRRC8/VRAC 的特异性(图 5B)。
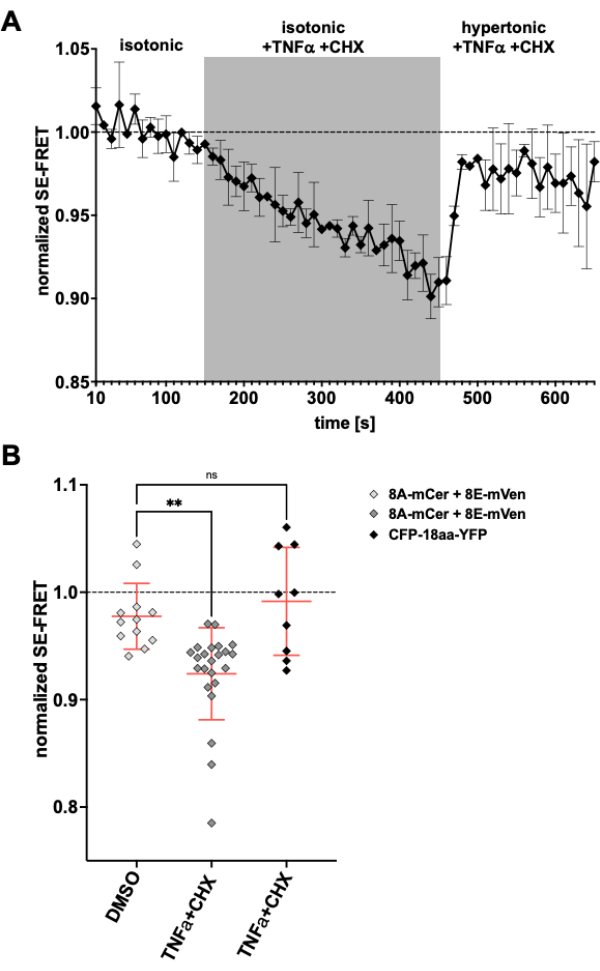
图 5:死亡受体介导的细胞凋亡引起的等渗 VRAC 激活。 (A) 表达 LRRC8A-mCer/LRRC8E-mVen 的 HeLa 细胞 (n = 8 个培养皿,23 个细胞) 随时间推移的标准化 SE-FRET 值。在等渗成像缓冲液 (基线) 中循环 15 次后,将浴液替换为补充有 2 ng/mL TNF-α 和 1 μg/mL 放线菌酮 (CHX) 的等渗缓冲液 30 个循环,然后用 TNF-α 和 CHX 进行 20 次循环的高渗成像缓冲液。将每个 ROI 和时间点的原始平均 SE-FRET 值标准化为相应 ROI 的基线(等渗)值的平均值。(B) 用含有 DMSO 的等渗溶液作为 CHX 的载体对照(n = 5 个培养皿,12 个细胞)或含有细胞凋亡诱导剂的等渗缓冲液(如 A 中,n = 8 个培养皿,23 个细胞)或表达 CFP-18aa-YFP 的 HeLa 细胞(n = 3 个培养皿,9 个细胞)定量标准化 SE-FRET 值。数据表示单个单元格(符号)的相应缓冲区中最后 10 个时间点的平均值和所有单元格的平均值± SD;** p < 0.01 普通单向方差分析,然后是 Tukey 的多重比较事后检验。 请单击此处查看此图的较大版本。
讨论
FRET 显微镜是一种成熟且广泛使用的技术,用于研究蛋白质之间的相互作用。因此,基于 FRET 的方法可以应用于许多具有不同专业知识的实验室。使用基于 FRET 的分析法,已经对广泛的离子通道监测了门控过程中的构象重排(例如,参见参考文献 34,50,51,52,53,60,61,62,63,64,65,66,67),在某些情况下与膜片钳荧光法中的电生理学相结合 68,69,70,71。FRET可用于研究这些离子通道的结构-功能关系,或独立于离子传输监测它们的活性。与电生理学相比,这里介绍的方法具有明显的优势,因为它允许原位监测 LRRC8/VRAC 通道的活性。
该方案中的关键步骤包括对细胞进行铺板,以达到转染和成像的最佳汇合度,这理想地有助于轻松区分细胞以供以后分析。不同亚基的有效共转染对于正确的亚细胞定位至关重要;例如,非 LRRC8A 亚基的过量将导致内质网 (ER) 定位增强4。因此,可能需要调整质粒比例。根据系统的不同,应验证新生成的 FRET 对,例如,通过受体漂白。像素合并和曝光时间必须相互平衡,以便为研究问题实现最佳的时间和空间分辨率。像素合并可以缩短曝光时间,从而减少 FRET 传感器的潜在漂白,同时降低空间分辨率。因此,如果实验设置需要,例如,LRRC8/VRAC 活性的亚细胞区分,则应避免分箱。研究问题同样决定了延时序列中周期的数量和间隔。仅当需要 FRET 的动力学变化(以及 LRRC8/VRAC 激活/失活)时,该间隔才相关;否则,也可以执行简单的 "before-and-after" 录音。实验的长短取决于生理过程。理想情况下,应监测刺激时的 LRRC8/VRAC 活性,直到 SE-FRET 稳定。这些因素可以在试点实验中确定。必须确定所有条件下计算实际 SE-FRET 信号的校正因子。错误确定的校正因子可能导致高估或低估 SE-FRET 强度。最后,在建立稳定的基线后,图像之间的时间间隔必须足够短,以捕捉感兴趣的生理过程。
该方法有一些限制。其中之一是 LRRC8 间 FRET 强度的变化虽然反映了 LRRD 的运动,但不一定对应于离子或渗透液通过孔的传输。这从用 LRRC8A 同源体45 观察到的 FRET 变化中可以清楚地看出,尽管它们的电流最小 4,32,72。LRRC8/VRAC 通道的孔阻塞剂可能不会影响 FRET 信号,因此该方法不适合寻找特定通道调制剂。此外,过表达 LRRC8 蛋白的表达水平会影响观察到的生理过程,尤其是当 C 端标记的 LRRC8 蛋白显示基础活性时14。
根据特定的研究问题,可以被认为是限制或优势的一个方面是,在这种方法中,只有异位表达的 LRRC8 亚基被选择性地测量。因此,内源性蛋白质的背景水平几乎不会干扰测量。另一方面,过表达的蛋白质可能不像内源性 LRRC8 通道那样表现,具有可能不同的亚基组成和化学计量学。例如,氧化等各种刺激可能对不同组成的 LRRC8 通道产生相反的调节作用36。通过改变共表达亚基之间的比率,可以调整它们的化学计量和整体离子电导14,73,但它们的天然组成(一个复合物中可能通常有两个以上的旁系同源物21)尚不清楚,并且可能因细胞类型而异 74,75,76.此外,荧光蛋白与 LRRC8 蛋白的胞质 C 末端融合显示会增加非洲爪蟾卵母细胞中的基础 LRRC8/VRAC 通道活性14,这可能是因为大标签调节 LRRD 的构象,这可能控制通道开放 14,44,45.因此,荧光蛋白的大小、接头及其方向可能不仅影响 FRET 效率,还可能影响通道活性。然而,重要的是,与荧光蛋白融合的 LRRC8 蛋白的 VRAC 通道对低渗刺激保持反应14,使其能够用作 FRET 传感器45。
与其他方法相比,这种非侵入性方法通过光学显微镜监测 LRRC8/VRAC 通道活动的优势包括:(i) 它允许在通常无法进行电生理学的细胞或隔室内观察 LRRC8/VRAC。这包括可以找到或靶向 LRRC8 复合物 45,77,78 的细胞器内细胞器。(ii) 该方法保持胞质溶质组成不变,而在全细胞膜片钳测量期间,胞质溶胶在很大程度上被移液管溶液取代,这可能会影响佛波醇-12-肉豆蔻酸酯-13-乙酸酯 (PMA) 诱导的 LRRC8/VRAC 激活所观察到的信号通路45。(iii) 它提供了以亚细胞分辨率观察 LRRC8/VRAC 激活的可能性,例如区分细胞迁移过程中前缘和后缘的活动,其中 - 仅限于狭窄空间 - VRAC 已涉及79,80。(iv) 它能够在心肌细胞分化等扩展生理过程中连续监测 LRRC8/VRAC 活性56。
虽然这种方法存在局限性和挑战,但它有望进一步探索,包括在动物模型中的潜在应用。结合其他方法来研究该离子和渗透通道家族,这种基于 FRET 的测定可能有助于解开激活机制和探索 LRRC8 通道在其天然环境中的不同生理功能。
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢 C.F. Kaminski 的慷慨馈赠,即编码 CFP-18aa-YFP 构建体的质粒,感谢 A. Klemmer 的技术援助,以及为该方法的开发做出贡献的 Stauber 实验室的所有现任和前任成员。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
参考文献
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。