Method Article
感作蛍光フェルスター共鳴エネルギー移動(SE-FRET)を使用したロイシンリッチリピート含有8チャネル(LRRC8/VRAC)活性のモニタリング
要約
電気生理学は、イオンチャネル活性を調査するためのゴールドスタンダードです。ただし、光学的方法など、多くの代替アプローチがあります。ここでは、8チャネル(LRRC8)形成陰イオンチャネルを含むロイシンリッチリピートの活性を、サブユニット間フェルスター共鳴エネルギー移動(FRET)ベースの方法を用いてモニターする方法について述べる。
要約
LRRC8タンパク質ファミリーのメンバーは、ヘテロメアイオンチャネルと浸透圧チャネルを形成し、多数の生理学的プロセスで役割を果たしています。体積調節陰イオンチャネル(VRAC)/体積感受性外向き整流チャネル(VSOR)として、浸透圧細胞の膨潤時に活性化され、塩化物および有機浸透圧の押し出しを媒介し、水の流出、ひいては細胞の収縮につながります。VRACは、浸透圧容量調節における役割を超えて、分化、移動、アポトーシスなどの細胞プロセスに関与しています。ロイシンリッチリピートを含む8(LRRC8)チャネルは、膜電位への影響とさまざまなシグナル伝達分子の輸送を通じて、ニューロン-グリア間コミュニケーション、インスリン分泌、および免疫応答に役割を果たします。活性化メカニズムは、いまだに解明されていません。LRRC8チャネルは、他のイオンチャネルと同様に、通常、電気生理学的方法を使用して研究されます。ここでは、LRRC8サブユニットのC末端ロイシンリッチリピートドメインに融合した蛍光タンパク質間の複合体内増感発光フェルスター共鳴エネルギー移動(SE-FRET)を測定することにより、LRRC8チャネルの活性化を検出する方法について説明します。この方法は、細胞質環境を交換することなく、細胞分化やアポトーシスなどのプロセス中に、その場でチャネル活性化を研究する可能性を提供します。
概要
ロイシンリッチリピート含有8(LRRC8)ファミリータンパク質のヘテロマーからなるイオンチャネルは、脊椎動物細胞全体に見られ、幅広い生理機能に関与しています1,2。これらのLRRC8チャネルは、最初に体積調節陰イオンチャネル(VRAC)または体積感受性外向き整流チャネル(VSOR)として識別され、細胞の体積減少に重要な役割を果たします3,4。それらは塩化物イオンと有機浸透圧の排出を促進し、その後、浸透圧の膨潤に応答して水が流出します。浸透圧ストレス応答におけるそれらの役割を超えて、細胞体積調節におけるそれらの役割は、細胞の増殖と移動、アポトーシス、精子形成、および上皮の完全性に関連しています5,6,7。LRRC8/VRAC活性化による膜電位の変化は、筋管の分化8および膵臓β細胞9,10,11によるインスリン分泌に寄与することが示されている。さらに、LRRC8チャネルは、プリン作動性シグナル伝達分子ATPおよびcGAMPまたは興奮性アミノ酸グルタミン酸などの種々の有機浸透圧を伝導し、これらのチャネルを免疫系またはグリアニューロン相互作用における細胞間コミュニケーションに配置する12,13,14,15,16,17,18,19,20、21,22.染料フルオレセイン、抗生物質ブラストシジンS、または抗がん剤シスプラチンなどの生体異物でさえ、LRRC8チャネル23,24,25によって行われます。
LRRC8/VRACの活性化につながるシグナル伝達については、多数の報告があります26,27,28。しかし、そのメカニズムは依然として不明であり、文献では、特定の生理学的プロセスに依存する可能性のある幅広い潜在的なメカニズムが示されています。これらには、細胞質イオン強度、細胞骨格との相互作用、膜組成、Gタンパク質、酸化還元状態、およびリン酸化カスケード2,27,29,30,31の変化が含まれます。
LRRC8/VRACチャネルは、LRRC8Aを必須サブユニット3,4として含み、生理学的に機能的なチャネル4,14,32を形成するためには、そのパラローグLRRC8B-Eの少なくとも1つとヘテロマー化しなければならない。サブユニット組成は、整流および脱分極依存性の不活性化4,29,32,33,34、基質特異性15,17,20,21,24,35、およびいくつかの活性化経路36,37などのチャネルの生物物理学的特性を決定する.クライオ電子顕微鏡(クライオ電子顕微鏡)の構造は、LRRC8Aホモマーおよびヘテロマーがヘキサマーとして集合することを示している38,39,40、一方、機能チャネルを形成するLRRC8A/LRRC8Cキメラはヘプタマー41である。すべてのLRRC8タンパク質のN末端部分は4つの膜貫通ヘリックスを含み、C末端部分はロイシンリッチリピート(LRRD)を持つドメインを含んでいます。利用可能なLRRC8複合体構造は、細胞質3,4,23に伸びるLRRDが、チャネルゲーティング34,42,43の間にコンフォメーション再配列を受ける可能性があるという証拠を提供します。この考えは、蛍光タンパク質のC末端融合が基礎チャネル活性をもたらすという知見14、およびドメインへのナノボディの結合がチャネル活性を調節できるという知見によって裏付けられている44。さらに、C末端の立体配座変化は、複合体内フェルスター共鳴エネルギー移動(FRET)45によって示された。
イオンチャネル活性を研究する最も一般的な方法は、電気生理学的測定46であり、これは分子同定47の前にVRACの研究に広く適用された。ただし、VRACの活動を間接的に監視するには、伝導性基質(ハロゲン化物イオンまたは有機浸透圧)の測定や細胞体積への影響の測定など、さまざまな追加の方法があります48。実際、LRRC8タンパク質のVRACとしての同定は、活性化されたVRAC3,4を介して細胞に侵入するヨウ化物によるハロゲン化物感受性蛍光タンパク質49の消光に基づくアッセイに依存していた。LRRC8/VRACチャネル活性をモニターする別の方法は、他のイオンチャネル50,51,52,53と同様に、FRET45の変化によって観察できる細胞質ドメインの動きを利用する。そのために、ドナーとしてシアン蛍光タンパク質(CFP)/mCerulean3、受容体として黄色蛍光タンパク質(YFP)/mVenusなど、FRETペアとして機能する蛍光タンパク質をLRRC8タンパク質のC末端に融合させました(図1)。LRRC8サブユニット間の複合体内FRETは、アクセプター光退色実験45によって示された。破壊的な光退色法を避けて、FRETの経時変化を感作発光FRET(SE-FRET)によって監視し、基本的にはドナーの発光スペクトルとアクセプターの励起スペクトルとの重なりによるドナーの励起時のアクセプターの増感放出を測定しました。LRRC8/VRAC 活性化の刺激である細胞外低張性の適用により、SE-FRET強度が可逆的に減少した45。重要なことに、低張治療中の全細胞パッチクランプ測定とFRETモニタリングの同時実施により、FRETのこの減少は実際にLRRC8/VRAC活性化を反映していることが示された45。この方法は、ピペット溶液による原形質膜の破壊や細胞内環境の変化を回避し、LRRC8/VRAC活性をモニタリングするための代替手段を提供します。これは、天然のサイトゾルを維持することが重要である、細胞内分解能が必要な場合、またはチャネル活性の長期観察が必要な生理学的環境で特に有用です。
ここでは、このようなFRETベースの読み出しを使用してLRRC8 / VRACを研究するためのプロトコルを紹介します。このプロトコルは、細胞の取り扱いとトランスフェクション、サンプル画像と制御画像の取得、データの分析、および感作蛍光FRET(SE-FRET)値の計算方法を示しています。
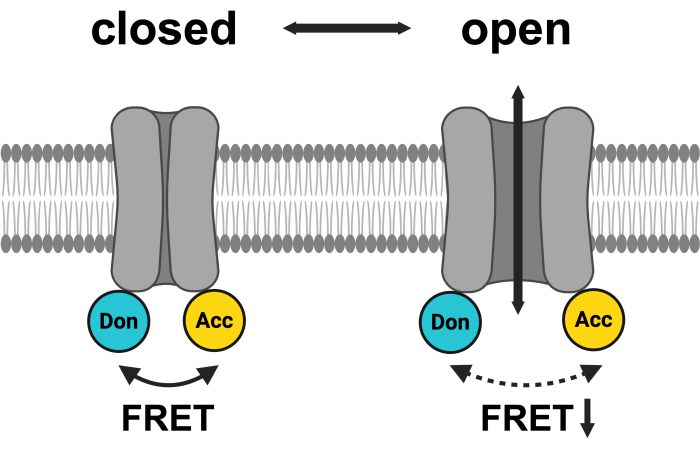
図1:LRRC8 FRETペアシステムの概略図。 mCerulean3はシアン、mVenusは黄色で示されています。VRACが開くと、蛍光色素間の距離(および/または空間的配向)が変化し、ドナー(Don)とアクセプター(Acc)の間のエネルギー伝達が減少し、その結果、観察されたFRETが低下します。BioRender.com で作成。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. バッファーと試薬の調製
- 中程度、等張性、低張性、および高張性のバッファーを準備し、浸透圧計でバッファーの浸透圧を測定して、浸透圧(Osm)が許容可能な偏差のみで予想される範囲内にあることを確認します。
- 細胞培養培地:10%ウシ胎児血清(FBS)と1%ペニシリン/ストレプトマイシンを添加したダルベッコ改変イーグル培地(DMEM)を調製します。
- アイソトニックイメージングバッファー (~340 mOsm): 150 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-グルコース、10 mM 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸 (HEPES) を混合して、アイソトニックイメージングバッファーを調製します。
- 低張イメージングバッファー(~250 mOsm):105 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-グルコース、および10 mM HEPESを混合して、低張イメージングバッファーを調製します。
- 高張イメージングバッファー (~500 mOsm): 160 mM D(-)-マンニトール、150 mM NaCl、6 mM KCl、1 mM MgCl2、1.5 mM CaCl2、10 mM D(+)-グルコース、10 mM HEPES を混合して、高張イメージングバッファーを調製します。
注:バッファーには、調査対象に応じて特定の薬物が補充される場合があります。
2. ガラス底皿上での接着細胞の増殖
- トランスフェクション用のディッシュを少なくとも 1 つ調製し、目的タンパク質(POI)をドナーまたはアクセプター蛍光色素のいずれかに融合させ、ドナーとアクセプターのペアによるトランスフェクション用のディッシュを少なくとも 1 つ用意します(表 1 および 図 2)。ガラス底の皿を使用して、蛍光顕微鏡法を可能にします。細胞の種類に応じて、表面を特別な洗浄またはポリリジンでコーティングして前処理します。
注:ここでは、FRETドナーmCerulean3(mCer)54 およびFRETアクセプターmVenus(mVen)55 がFRETペアとして使用されますが、他の蛍光色素の組み合わせも適用可能です。ドナーまたはアクセプターのみに融合したPOIを発現するサンプルを使用して、アクセプターチャネル内のドナーブリードスルーとドナー励起波長によるアクセプターの交差励起を補正するために必要なβおよびγ(表1)の補正係数を決定します(図2Ac、Bf)。 - トランスフェクションの前日に、1 x 105 HeLa細胞を2 mLの細胞培養培地に播種し、蛍光顕微鏡に適したガラス底の35 mm皿に載せます。細胞培養インキュベーター内で、37°Cおよび5%CO2 雰囲気で細胞を一晩培養します。
注:試薬の量は、異なるサイズの他の細胞培養皿/フラスコの表面積に適合させることができます。細胞数は、さまざまな細胞株や実験アプローチに適した密度に適合させることができます。- T75細胞培養フラスコで培養した接着細胞の単層から、真空ポンプを用いて細胞培養上清を吸引します。
- 細胞培養フラスコに10 mLのダルベッコリン酸緩衝生理食塩水(DPBS)を加え、その後、真空ポンプで溶液を吸引して細胞を洗浄します。
- 細胞を1mLの0.05%トリプシン-EDTAで完全に覆い、細胞培養インキュベーター内で37°Cおよび5%CO2 雰囲気で2分間細胞をインキュベートします。
- 9 mLの細胞培養培地を添加し、ピペッティングにより細胞を懸濁します。
- 細胞懸濁液を15 mLチューブに移し、700 x g で室温(RT)で3分間遠心分離します。
- 真空ポンプで上清を吸引し、細胞ペレットを10 mLの細胞培養培地に再懸濁します。
- 等量の細胞懸濁液と0.4%トリパンブルーをチューブ内で混合し、計数スライドに10 μLを加えます。スライドを自動セルカウンターにセットし、セルカウントに適したプログラムを使用してカウントを開始します。
- 各ディッシュに必要な細胞懸濁液の量を計算するには、ディッシュごとに必要なセル数(1 x 105)を、セルカウンターから得られたミリリットルあたりのセル数で割ります。
- 1皿あたり必要な細胞数(2mL)に1皿分の追加分を加えた量で、1皿あたり必要な細胞数を含む細胞懸濁液を適切なチューブに調製します。
- チューブを反転させ、各皿に細胞懸濁液2 mLをピペットで移して、細胞懸濁液を少なくとも20回混合します。
- より均一な細胞分布を確保するには、細胞培養インキュベーターにセットを室温で30分間置いておきます。
3. 細胞トランスフェクション
注:ここでは、トランスフェクション試薬としてFuGENEを使用しました。他のトランスフェクション試薬や方法も適用可能です。各POIおよび細胞モデルについて、プラスミドDNA(pDNA)とトランスフェクション試薬の最適な比率、および最適な発現までの時間を経験的に評価する必要があります。ここでは、35 mmディッシュあたり2 μgの総pDNAを使用しました。FRETドナーおよびアクセプターコンストラクトを1:1の比率で使用し、pDNAとトランスフェクション試薬の比率は1:4でした(表1)。
- トランスフェクションの前に、細胞培養上清を新鮮な2 mLの温めた培地と交換します。
- Opti-Minimal Essential Medium(MEM)でpDNAを最終容量100 μL(=pDNA溶液)で希釈します。
- トランスフェクション試薬をOpti-MEMで最終容量100 μL(=試薬溶液)で希釈します。
注:より均一なトランスフェクションを得るには、pDNAと試薬溶液のマスターミックスを調製します。 - pDNAと試薬溶液をよく混合します。
- 試薬溶液(=トランスフェクション溶液)にpDNA溶液を添加します。
- トランスフェクション溶液をよく混合します。
- トランスフェクション溶液をRTで15分間インキュベートします。
- トランスフェクション溶液をらせん状に滴下してディッシュに加えます。
- ベンチの表面で皿を水平と垂直に5回動かして混ぜます。
- 細胞培養インキュベーター内で、37°Cおよび5%CO2 雰囲気で細胞を一晩培養します。
| 条件 | コンストラクト (s) | 見本 | 用途 |
| 1 | LRRC8A-mセルリアン | ドナーコンストラクトのみ | 補正係数の決定 β |
| 2 | LRRC8E-mビーナス | アクセプターコンストラクトのみ | 補正係数の決定 γ |
| 3 | LRRC8A-mセルリアンとLRRC8E-mヴィーナス | FRETペア | SE-FRET定量化 |
表1:ドナーに融合したLRRC8Aサブユニット(mCerulean3)とアクセプター(mVenus)蛍光色素に融合したLRRC8Eサブユニットで構成されるチャネルのLRRC8/VRAC活性を測定するための一般的なSE-FRET実験に必要な条件の例。
4. 補正係数決定のための画像取得
注:FRET中に検出されたアクセプターの放出に、ドナー放出のブリードスルーがあります。また、ドナー励起波長によるアクセプター蛍光色素の交差励起がある。これらのプロセスは、SE-FRETの計算中に補正する必要があります。この目的のために、トランスフェクションの24時間後にFRETドナーまたはアクセプターのみを発現する細胞において、補正係数が決定される。ここでは、ライカLED8ランプ、フィルターキューブCYR71010、HC PL APO 63x/1.40 OIL対物レンズ、460/80および553/70用のロングパスフィルター、ライカDFC9000GTCカメラを搭載したライカサンダーイメージャーでイメージングを行いました。実験は環境制御なしで行いましたが、イメージングバッファーにHEPESが存在する状態で行い、pHを安定させました。長期の観察・測定には、環境制御システムの使用をお勧めします。解析では、キャプチャしたRAW画像からSE-FRETを算出します。これは、取得中または取得後に同時に行うことができます。ここでは、Leica LAS XソフトウェアとSE-FRETプラグインを使用して、補正係数の計算に関する実験手順を簡素化し、画像取得中のSE-FRET値の変化をリアルタイムで視覚化しました。取得後の場合、補正係数とSE-FRETは、以下に示すプロトコルに従って、生データ取得後に他のソフトウェアパッケージ(FIJIなど)で決定できます。
- 補正係数を計算するために単一のトランスフェクション細胞の画像取得を行う前に、FRETペアを発現する1つのサンプルを使用して、すべてのチャンネル(ドナー励起/ドナー発光DD、ドナー/アクセプターDA、アクセプター/アクセプターAA; 表1 、 図2C 、 図3Aを参照)の顕微鏡設定を設定します。
注:上記のようにトランスフェクトされたmCerulean3およびmVenusタグ付きVRACサブユニットを使用したSE-FRET測定では、8x8ピクセルビニング、100msの露光時間、および10%のLEDランプ強度のパラメータを使用しました。 - ドナーコンストラクトのみを発現するサンプル(図2A)を採取し、細胞培養培地を吸引し、2 mLの等張緩衝液で細胞を3回洗浄します。
- 3 mLの等張緩衝液を加え、サンプルを顕微鏡ステージに置きます。
- ドナーコンストラクトを発現する細胞が少なくとも1つある視野(FOV)を見つけます。
- すべてのチャネルをイメージ化します(DD、DA、およびAAは 表2 および 図2Aを参照)。
- 細胞の周囲に関心領域(ROI)を描き、DAの平均強度を測定します(= IDA;図2Ac)および DD (= IDD;図2Aa)。
- バックグラウンド減算の場合は、バックグラウンド信号のみが検出されるDAチャネルとDDチャネルでROIを描画し、平均強度(IBDA およびIBDD)を測定します。
- 対応するチャネル (
 と
と 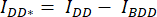 ) のセル ROI で測定された平均強度から、バックグラウンド ROI の平均強度を減算します。
) のセル ROI で測定された平均強度から、バックグラウンド ROI の平均強度を減算します。 - サンプルでアクセプターコンストラクトのみを表現するサンプルで、手順4.2〜4.5を繰り返します(図2B)。
- セルの周囲にROIを描画し、DAの平均強度(= IDA;図2Bf)および AA (= IAA;図 2Be)。
- バックグラウンド減算の場合は、バックグラウンド信号のみが検出されるDAチャネルとAAチャネルでROIを描画し、平均強度(IBDA および IBAA)を測定します。
- 対応するチャネル (
 と
と 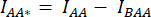 ) のセル ROI で測定された平均強度から、バックグラウンド ROI の平均強度を差し引きます。
) のセル ROI で測定された平均強度から、バックグラウンド ROI の平均強度を差し引きます。 - IDA*、IDD*、 IAA* で決定された値を使用して、補正係数
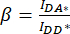 と
と 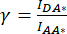 を計算します。
を計算します。
これにより、補正係数βを使用して、DAチャネルへのドナー放射のブリードスルーを補償します。補正係数γは、DAチャネルのドナー励起波長によるアクセプターフルオロフォアの交差励起を補償するために使用されます。
| の励起 | の排出 | チャンネル名 | LEDライン | フィルター キューブ | ロングパスフィルター |
| 寄贈者 | 寄贈者 | ディー | 440 nmの | CYR71010 | 460/80 nm |
| 寄贈者 | アクセプター | ダ | 440 nmの | CYR71010 | 535/70 nm |
| アクセプター | アクセプター | AAさん | 510 nmの | CYR71010 | 535/70 nm |
表2:SE-FRET実験に必要なチャンネルのまとめ。
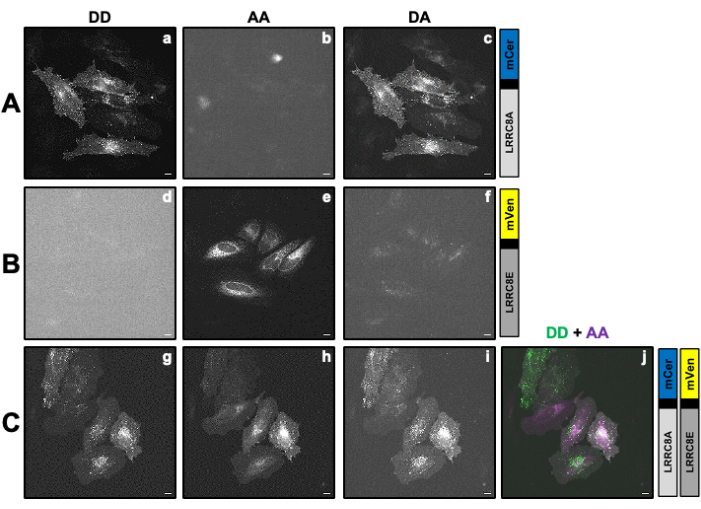
図2:SE-FRET測定により、ドナーmCerulean3(mCer)に融合したLRRC8AサブユニットとアクセプターmVenus(mVen)蛍光色素に融合したLRRC8Eサブユニットで構成されるチャネルのVRAC活性を決定するために必要な補正係数βとγを計算するために使用されたサンプルの代表的な蛍光画像。 (A,B)ドナー(A)LRRC8A-mCerまたはアクセプター(B)LRRC8E-mVenのみを発現するHeLa細胞におけるドナー/ドナーDD、アクセプター/アクセプターAA、およびドナー/アクセプターDAチャネルの検出。(C)ドナーとアクセプターのペアLRRC8A-mCerおよびLRRC8E-mVenと共トランスフェクションしたHeLa細胞中のDD、AA、およびDAチャネルの検出。パネルa〜iは、ドナー検出チャネルで撮影された画像を示しています(ドナーの励起およびドナー信号の検出;DDです。a、dおよびg)、アクセプター検出チャネル(アクセプターの励起およびアクセプター信号の検出;AAです。b、e、およびh)およびFRET信号検出チャネル(ドナーの励起およびアクセプター信号の検出;DAです。c、f、および i)。パネルjはパネルgとhのオーバーレイで、DDチャンネルは緑、AAチャンネルはマゼンタで示されています。スケールバー = 10 μm. この図の拡大版を見るには、ここをクリックしてください。
5. SE-FRET定量のためのタイムラプスイメージング
- ドナーおよびアクセプターコンストラクトを発現するサンプル(表1、 図2C および 図3A)を採取し、細胞培養培地を吸引し、トランスフェクションの24時間後に2mLの等張緩衝液で細胞を3回洗浄します。
- 3 mLの等張緩衝液を加え、サンプルを顕微鏡ステージに置きます。
- アイソトニックバッファーを後で吸引するには、カニューレの先端が皿の底に達するようにホースカニューレを固定して調整します。
- バッファーを追加するには、重力流によって駆動されるバッファーが皿に落ちるようにチューブを固定して調整します。
注:ここでは、バッファーフローを制御するために4つの磁気バルブを備えたバルブ制御重力灌流システムを使用しましたが、他の方法も適用可能です。 - ドナーとアクセプターコンストラクトを同時に発現する少なくとも1つの細胞を持つFOVを見つけます。
- チャネル DD、DA、AA のタイムラプス実験を 10 秒の間隔と、刺激シーケンスのすべての条件 (例: ベースラインの 12 サイクルと条件ごとに 15 サイクル) をカバーする持続時間を設定します (図 3)。
注:間隔とサイクル数は、実験のニーズに応じて採用できますが、データの視覚化と比較を改善するために、正規化のためのベースライン測定を常に含める必要があります。 - ベースライン測定後、最初の条件でサンプルをバッファーで洗浄します。
- ホースカニューレを介して等張バッファーを吸引し、シリンジで真空を適用します。
- 重力流により、次の条件の緩衝液を3mL加える。
- 緩衝液を吸引し、同じ緩衝液を3mL再度加えます。
- 手順 5.7.3 をもう一度繰り返します。
- 最初の条件を測定した後、次の条件(ステップ5.7.1-5.7.4)のためにサンプルをバッファーで洗浄します。
- すべての条件がキャプチャされるまで、手順 5.5 から 5.8 を繰り返します。
- SE-FRETの定量化では、細胞の周囲にROIを描画し、時系列のすべての画像(時点)のDD =(IDD)、DA(IDA)、およびAA(IAA)チャネルの平均強度を測定します(図3A、B)。
- FRET信号のバックグラウンド減算については、バックグラウンド信号のみが検出されるDAチャネルでROIを描画し、平均強度(IBDA)を測定します。
- DAチャネルのセルROIで測定された平均強度から、バックグラウンドROIの平均強度を差し引きます(
 )。
)。 - 決定された値を使用して、各 ROI と
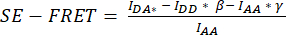 すべての時点の平均 SE-FRET値を計算します。
すべての時点の平均 SE-FRET値を計算します。 - さまざまな条件の比較可能性を高め、SE-FRET値を視覚化するには、各ROIのベースライン値の平均を使用して、対応するROIのすべての時点を正規化します。
- 正規化されたSE-FRET値を経時的にプロットします(図3B)。
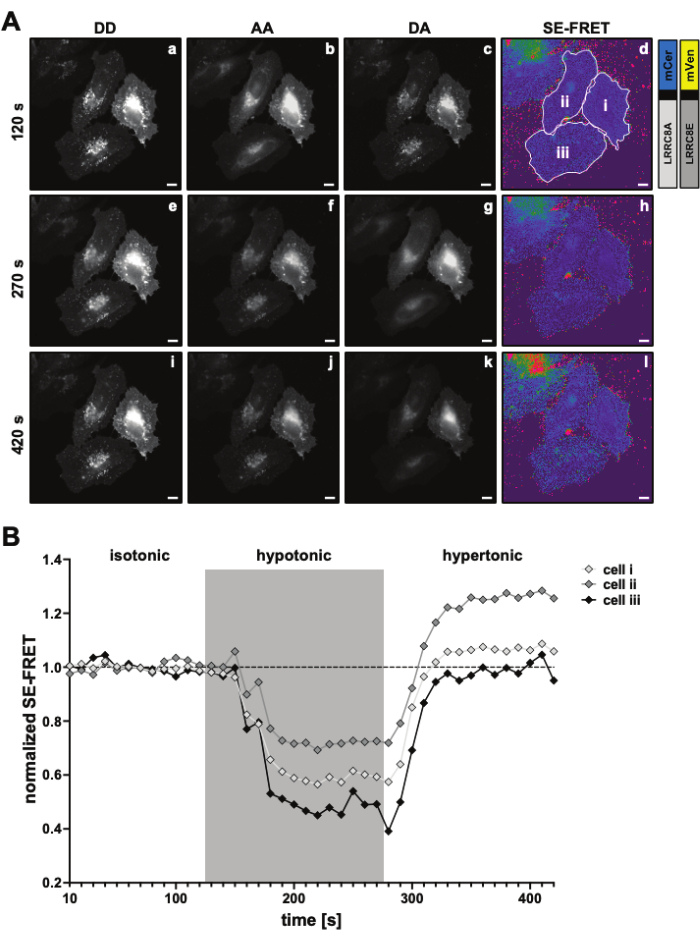
図3:代表的な蛍光画像とSE-FRETの定量 (A)張度に応じてLRRC8AとLRRC8Eサブユニットで構成されるチャネルのSE-FRETによるVRAC活性を測定するためのタイムラプス実験の最初の時点の代表的な蛍光画像と見かけのSE-FRET。スケールバー = 10 μm。同じセルを図 2C に示します。パネルa-iは、DD、AA、DAチャンネルの検出と、計算された見かけのSE-FRETを示しています。白いアウトラインは、DD、AA、DAの平均信号強度と見かけのSE-FRET画像を測定するために使用されるROI(パネルdのセルi-iii)を表しています。(B)SE-FRET値の経時的な定量化。条件のシーケンスは、12 サイクルの等張イメージング バッファー (ベースライン) と、それに続く 15 サイクルの低張イメージング バッファーと 15 サイクルの高張イメージング バッファーでした。各 ROI (セル i から iii) と時点の生の平均 SE-FRET値は、対応する ROI のベースライン (等張) 値の平均に正規化されました。この図の拡大版を表示するには、ここをクリックしてください。
結果
このFRETベースの方法では、浸透圧刺激中にLRRC8 / VRAC活性を監視でき、SE-FRETの減少は細胞外低張性の程度と相関しています45。低張性誘発性チャネル活性化の代表的な結果もここに示します(図3 および 図4)。さらに、ジアシルグリセロールシグナル伝達の操作45 や筋細胞活性化56などの異なるアイソスモティック刺激によるLRRC8/VRACの活性化が観察され得る。
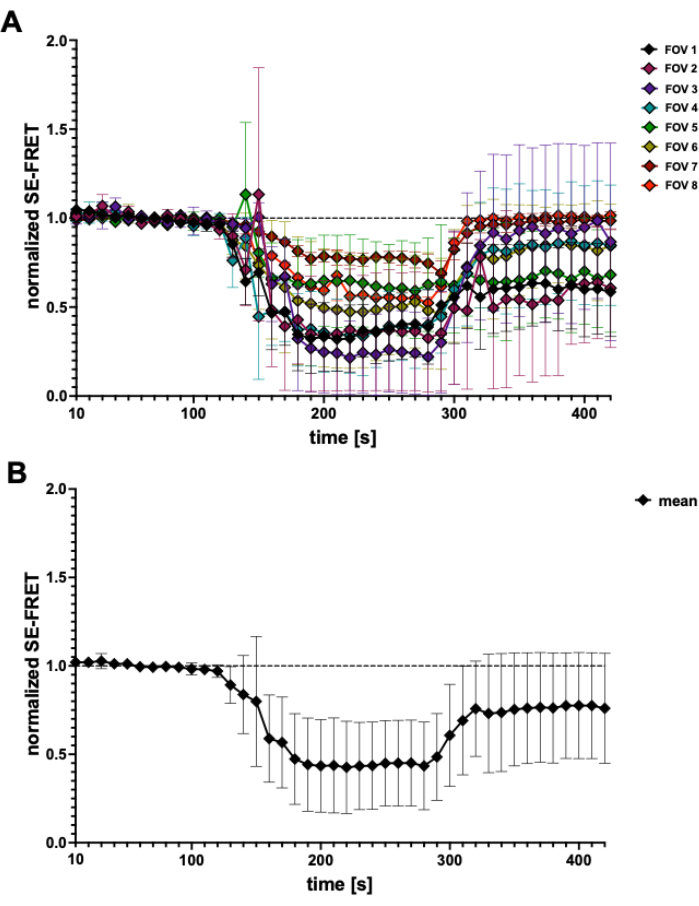
図4:SE-FRETトレース (A)5つの独立した実験からの見かけのSE-FRETトレース。データは、視野 (FOV) あたり N = 2 から N = 7 セルの平均 ± SD を表します。(B)全細胞の平均±SD値(N=31細胞)。 この図の拡大版を表示するには、ここをクリックしてください。
LRRC8/VRACチャネルはアポトーシス量の減少にも関与しているため24,57、アポトーシス誘導時のチャネル活性の観察は、ここで説明する方法の別のアプリケーションになります。そこで、LRRC8A-mCerulean3およびLRRC8E-mVenusを発現するHeLa細胞におけるSE-FRETのモニタリングプロトコールを、デスレセプター介在性アポトーシス誘導薬を適用しながら実施しました。腫瘍壊死因子(TNF)-αおよびシクロヘキシミド(CHX)は、数分以内にVRAC電流を誘発することが以前に示されていた58。2 ng/mL の TNF-α と 1 μg/mL の CHX を等張バッファーに添加すると、SE-FRETが強く減少しました(図 5)。TNF-αおよびCHXを含んでいるにもかかわらず、バッファーを高張媒体に置き換えると、SE-FRET値はベースライン近くに回復し(図5A)、アポトーシス誘導Fasリガンド58による治療中の高張性浴溶液中のVRAC電流の減少に対応する。TNF-αおよびCHXの溶媒であるDMSOで細胞を処理しても、SE-FRETの減少は得られませんでした。TNF-α + CHXは、FRET制御59としてEYFPとECFPのタンデム構造であるCFP-18aa-YFPのSE-FRETに影響を与えず、LRRC8 / VRACの特異性を示しています(図5B)。
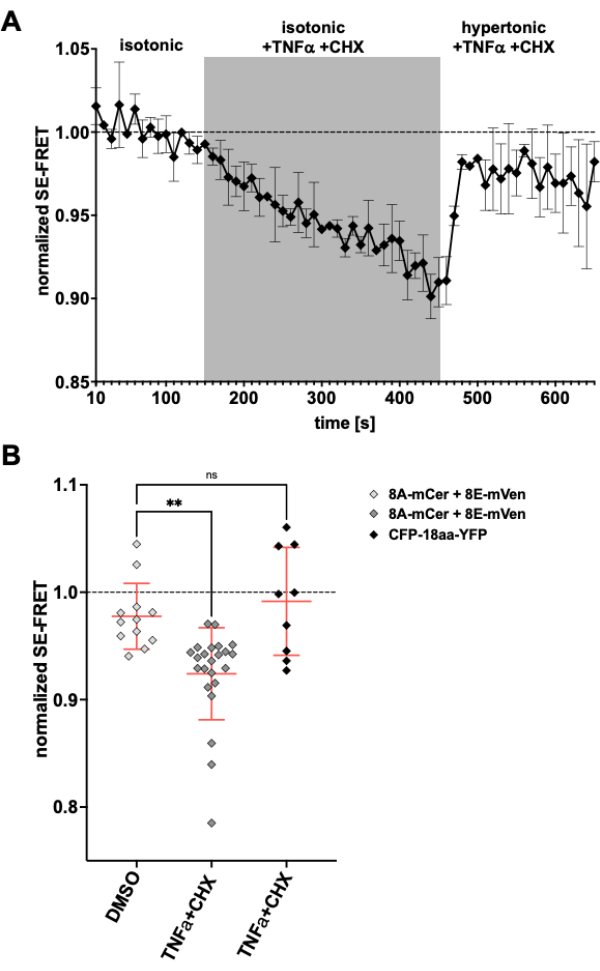
図5:死受容体媒介性アポトーシスによるアイソスモーティックVRAC活性化 (A)LRRC8A-mCer/LRRC8E-mVen発現HeLa細胞(n = 8皿、23細胞)の経時的な正規化されたSE-FRET値。等張イメージングバッファー(ベースライン)で15サイクル後、浴溶液を2 ng/mL TNF-αと1 μg/mLシクロヘキシミド(CHX)を30サイクル補給した等張バッファーに置き換え、続いてTNF-αとCHXを含む20サイクルの高張イメージングバッファーを補充しました。各 ROI と時点の生の平均 SE-FRET値は、それぞれの ROI のベースライン (等張) 値の平均に正規化されました。(B)LRRC8A/Eを発現するHeLa細胞をAのようにDMSOを含む等張液をCHXのビヒクル制御として使用した場合(n = 5皿、12細胞)、またはAのようにアポトーシス誘導剤を含む等張緩衝液(n = 8皿、23細胞)、またはアポトーシス誘導剤を使用してCFP-18aa-YFPを発現するHeLa細胞(n = 3皿、9細胞)の正規化SE-FRET値の定量化。データは、個々のセル(シンボル)のそれぞれのバッファ内の最後の10の時点の平均と、SD±すべてのセルの平均を表します。** p < 0.01 通常の一元配置分散分析とそれに続くテューキーの多重比較の事後検定。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
FRET顕微鏡は、タンパク質間の相互作用を研究するために広く使用され、確立されている技術です。したがって、FRETベースの方法は、さまざまな専門知識を持つ多くの研究室で適用できます。ゲーティング中のコンフォメーション再配列は、FRETベースのアッセイを用いて、広範囲のイオンチャネルについてモニターされています(例えば、参考文献34,50,51,52,53,60,61,62,63,64,65,66,67を参照のこと)。)、場合によっては、パッチクランプ蛍光測定68,69,70,71の電気生理学と組み合わされます。FRETは、これらのイオンチャネルの構造と機能の関係を研究したり、イオン輸送とは無関係にそれらの活性を監視するために使用できます。ここで紹介する方法は、LRRC8/VRACチャネルの活性をその場で監視できるため、電気生理学に比べて明らかな利点があります。
プロトコールの重要なステップには、トランスフェクションとイメージングに最適なコンフルエンシーに到達するための細胞のプレーティングが含まれ、これは理想的には後の分析のための容易な細胞識別を容易にします。異なるサブユニットの効果的な同時トランスフェクションは、正しい細胞内局在化にとって非常に重要です。例えば、非LRRC8Aサブユニットが過剰になると、小胞体(ER)の局在が亢進する4。したがって、プラスミド比を調整する必要がある場合があります。システムによっては、新しく生成されたFRETペアを、アクセプター漂白などによって検証する必要があります。ビニングと露光時間は、研究課題の最適な時間的および空間的解像度を実現するために、互いにバランスを取る必要があります。ビニングにより露光時間が短縮されるため、FRETセンサーの漂白の可能性が低減され、空間分解能が低下します。したがって、実験装置でLRRC8/VRAC活性の細胞内識別が必要な場合、ビニングは避けるべきです。研究課題は、タイムラプスシリーズのサイクルの数と間隔を等しく決定します。間隔は、FRETの変化(したがってLRRC8 / VRACの活性化/不活性化)の動力学が必要な場合にのみ関連します。それ以外の場合は、単純な「ビフォーアフター」録音も実行できます。実験の長さは、生理学的プロセスによって異なります。理想的には、刺激に対するLRRC8/VRACの活性は、SE-FRETが安定するまで監視する必要があります。これらの因子は、パイロット実験で決定できます。実際のSE-FRET信号を計算するための補正係数は、すべての条件で決定する必要があります。修正係数が正しく決定されていないと、SE-FRET強度が過大評価または過小評価される可能性があります。最後に、安定したベースラインを確立した後、画像間の時間間隔は、関心のある生理学的プロセスをキャプチャするのに十分短くする必要があります。
この方法にはいくつかの制限があります。その一つは、LRRDの動きを反映したLRRC8 FRET間の強度の変化が、必ずしもイオンや浸透圧の細孔輸送に対応するとは限らないことです。これは、LRRC8Aホモマー45で観察されたFRETの変化から明らかであるが、その最小電流4,32,72にも関わらずである。LRRC8/VRACチャンネルのポアブロッカーはFRET信号に影響を与えない場合があるため、この方法は特定のチャンネルモジュレーターの検索には適していません。さらに、過剰発現したLRRC8タンパク質の発現レベルは、特にC末端タグ付きLRRC8タンパク質が基礎活性を示すため、観察される生理学的プロセスに影響を与える可能性がある14。
特定の研究課題に応じて制限または利点と見なすことができる側面は、この方法では、異所的に発現したLRRC8サブユニットのみが選択的に測定されることです。そのため、内因性タンパク質のバックグラウンドレベルは測定にほとんど干渉しません。一方、過剰発現したタンパク質は、内因性LRRC8チャネルのように振る舞わない可能性があり、サブユニット組成や化学量論が異なる可能性があります。例えば、酸化のような種々の刺激は、異なる組成のLRRC8チャネル36に対して反対の調節効果を有することがある。共発現したサブユニット間の比率を変えることにより、それらの化学量論と全体的なイオンコンダクタンスを調整することができる14,73が、1つの複合体21内に2つ以上のパラログを持つ可能性が高いそれらのネイティブ組成は明確ではなく、細胞タイプ間で異なる可能性がある74,75,76.さらに、蛍光タンパク質とLRRC8タンパク質の細胞質C末端との融合は、Xenopus卵子におけるLRRC8/VRACチャネルの基礎活性を増加させることが示された14、これはおそらく、大きなタグがLRRDのコンフォメーションを調節し、チャネルの開口を支配している可能性があるからである14,44,45.したがって、蛍光タンパク質のサイズ、リンカー、およびそれらの配向は、FRET効率だけでなく、チャネル活性にも影響を与える可能性があります。しかし、重要なことに、蛍光タンパク質と融合したLRRC8タンパク質のVRACチャネルは、低張刺激14に対して応答性を維持し、FRETセンサー45としての使用を可能にした。
この非侵襲的な方法の利点は、光学顕微鏡法によってLRRC8/VRACチャネル活動を他の方法と比較して監視することです: (i)それは細胞またはコンパートメント内のLRRC8/VRACを観察することを可能にします これは、通常は電気生理学のためにアクセスできない。これには、LRRC8複合体が見出される、または45,77,78を標的とすることができる細胞内小器官が含まれる。(ii)サイトゾル組成は、この方法によって変更されないままであるが、全細胞パッチクランプ測定中、サイトゾルは大部分がピペット溶液に置き換えられ、ホルボール-12-ミリスチン酸-13-アセテート(PMA)誘導LRRC8/VRAC活性化45で観察されるシグナル伝達経路に影響を与える可能性がある。(iii)それは、細胞移動中の前縁と後縁での活性を区別するなど、細胞内分解能でLRRC8 / VRAC活性化を観察する可能性を提供します。これは、限られたスペースに限定されている79,80。(iv)筋細胞分化56などの広範な生理学的過程におけるLRRC8/VRAC活性の連続的なモニタリングを可能にする。
この方法には制限と課題がありますが、動物モデルへの応用の可能性を含め、さらなる探求が期待されています。このFRETベースのアッセイは、このイオンおよび浸透圧チャネルファミリーを研究する他の方法と組み合わせることで、活性化メカニズムの解明とLRRC8チャネルの天然環境における多様な生理学的機能の探索に大きく貢献する可能性があります。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
CFP-18aa-YFPコンストラクトをコードするプラスミドを寄贈してくださったC.F. Kaminski氏、技術支援を提供してくださったA. Klemmer氏、そしてこの方法の開発に貢献してくださったシュタウバー研究室の現役および元メンバー全員に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
参考文献
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367(2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974(2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885(2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461(2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431(2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382(2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532(2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435(2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421(2019).
- Hille, B. Ion Channels of Excitable Membranes. 3rd edn. , Sinauer. Sunderland, Massachusetts. (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896(2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, Suppl 1 S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215(2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118(2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093(2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755(2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108(2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7(2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940(2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879(2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663(2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128(2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved