Method Article
Hassaslaştırılmış Emisyonlu Förster Rezonans Enerji Transferi (SE-FRET) Kullanılarak 8 Kanal (LRRC8/VRAC) Aktivitesi İçeren Lösin Açısından Zengin Tekrarın İzlenmesi
Bu Makalede
Özet
Elektrofizyoloji, iyon kanalı aktivitesini araştırmak için altın standarttır. Bununla birlikte, optik yöntemler de dahil olmak üzere birçok alternatif yaklaşım vardır. Burada, alt birimler arası Förster rezonans enerji transferi (FRET) tabanlı bir yöntem kullanarak 8 kanal (LRRC8) ile oluşturulmuş anyon kanalı içeren lösin açısından zengin tekrarın aktivitesini izlemek için bir yöntem açıklıyoruz.
Özet
LRRC8 protein ailesinin üyeleri, çok sayıda fizyolojik süreçte rol oynayan heteromerik iyon ve ozmolit kanalları oluşturur. Hacim ayarlı anyon kanalları (VRAC'ler) / hacme duyarlı dışa doğru doğrultucu kanallar (VSOR'lar) olarak, ozmotik hücre şişmesi üzerine aktive olurlar ve klorür ve organik ozmolitlerin ekstrüzyonuna aracılık ederek su akışına ve dolayısıyla hücre büzülmesine yol açarlar. Ozmotik hacim regülasyonundaki rollerinin ötesinde, VRAC'ler farklılaşma, göç ve apoptoz gibi hücresel süreçlerde rol oynamıştır. Membran potansiyeli üzerindeki etkileri ve çeşitli sinyal moleküllerini taşımaları sayesinde, 8 (LRRC8) kanal içeren lösin açısından zengin tekrar, nöron-glia iletişiminde, insülin sekresyonunda ve immün yanıtta rol oynar. Aktivasyon mekanizması belirsiz kaldı. LRRC8 kanalları, diğer iyon kanalları gibi, tipik olarak elektrofizyolojik yöntemler kullanılarak incelenir. Burada, LRRC8 alt birimlerinin C-terminal lösin açısından zengin tekrar alanlarına kaynaşmış floresan proteinler arasındaki kompleks içi hassaslaştırılmış emisyonlu Förster rezonans enerji transferini (SE-FRET) ölçerek LRRC8 kanal aktivasyonunu tespit etmek için bir yöntem açıklıyoruz. Bu yöntem, sitozolik ortamın değişimi olmadan ve hücre farklılaşması ve apoptoz gibi süreçler sırasında kanal aktivasyonunu yerinde inceleme imkanı sunar.
Giriş
8 (LRRC8) ailesi proteini içeren lösin açısından zengin tekrar heteromerlerinden oluşan iyon kanalları, omurgalı hücreleri boyunca bulunur ve çok çeşitli fizyolojik işlevlere katılır 1,2. İlk olarak hacim regüle anyon kanalları (VRAC'ler) veya hacim duyarlı dışa doğru doğrultucu kanallar (VSOR) olarak tanımlanan bu LRRC8 kanalları, hücresel düzenleyici hacim azalmasında çok önemli bir rol oynar 3,4. Klorür iyonlarının ve organik ozmolitlerin atılmasını kolaylaştırırlar, bunu ozmotik şişmeye yanıt olarak su akışı izler. Ozmotik stres yanıtındaki rollerinin ötesinde, hücresel hacim regülasyonundaki rolleri hücre proliferasyonu ve göçü, apoptoz, spermiyogenez ve epitel bütünlüğü ile ilişkilendirilmiştir 5,6,7. LRRC8 / VRAC aktivasyonu üzerine membran potansiyelinin değişmesinin, miyotüp farklılaşmasına8 ve pankreas β hücreleri 9,10,11 tarafından insülin sekresyonuna katkıda bulunduğu gösterilmiştir. Ayrıca, LRRC8 kanalları, purinerjik sinyal molekülleri ATP ve cGAMP veya uyarıcı amino asit glutamat gibi çeşitli organik ozmolitleri iletir ve bu kanalları bağışıklık sisteminde hücre-hücre iletişimine veya glia-nöron etkileşimine yerleştirir 12,13,14,15,16,17,18,19,20,21,22. Floresein boyası, antibiyotik blasticidin S veya antikanser ilacı sisplatin gibi ksenobiyotikler bile LRRC8 kanalları 23,24,25 tarafından gerçekleştirilir.
LRRC8/VRAC aktivasyonuna yol açan sinyal iletimi hakkında çok sayıda rapor vardır 26,27,28. Bununla birlikte, mekanizma belirsizliğini korumaktadır ve literatür, spesifik fizyolojik sürece bağlı olabilecek çok çeşitli potansiyel mekanizmalar sunmaktadır. Bunlar, sitozolik iyon kuvvetindeki değişiklikleri, hücre iskeleti ile etkileşimi, zar bileşimini, G proteinlerini, redoks durumunu ve fosforilasyon kaskadlarını 2,27,29,30,31 içerir.
LRRC8/VRAC kanalları, fizyolojik olarak işlevsel kanallar 4,14,32 oluşturmak için LRRC8B-E paraloglarından en az biri LRRC8B E ile heteromerize olması gereken temel bir alt birim 3,4 olarak LRRC8A'yı içerir. Alt birim bileşimi, kanalın rektifikasyon ve depolarizasyona bağlı inaktivasyon 4,29,32,33,34, substrat özgüllüğü 15,17,20,21,24,35 ve bazı aktivasyon yolları 36,37 gibi biyofiziksel özelliklerini belirler. Kriyo-elektron mikroskobu (kriyo-EM) yapıları, LRRC8A homomerlerinin yanı sıra heteromerlerin heksamer38,39,40 olarak bir araya geldiğini, fonksiyonel kanalları oluşturan LRRC8A/LRRC8C kimeralarının ise heptamer41 olduğunu göstermektedir. Tüm LRRC8 proteinlerinin N-terminal kısmı, dört transmembran sarmal içerir ve C-terminal kısmı, lösin açısından zengin tekrarlara (LRRD) sahip bir alan içerir. Mevcut LRRC8 kompleks yapıları, sitozol 3,4,23'e uzanan LRRD'lerin, kanal geçitlemesi 34,42,43 sırasında konformasyonel yeniden düzenlemelere uğrayabileceğine dair kanıt sağlar. Bu fikir, floresan proteinlerin C-terminal füzyonunun bazal kanal aktivitesi14 ile sonuçlandığı ve nanocisimlerin alanlara bağlanmasının kanal aktivitesi44 ile modüle edebileceği bulgusu ile desteklenmektedir. Ayrıca, C-terminalinin konformasyonel değişiklikleri, kompleks içi Förster rezonans enerji transferi (FRET)45 ile gösterilmiştir.
İyon kanalı aktivitesini incelemek için en yaygın yöntem, moleküler tanımlamalarından47 önce VRAC'lerin araştırılmasında yaygın olarak uygulanan elektrofizyolojik ölçümlerdir46. Bununla birlikte, iletilen substratlarının (halojenür iyonları veya organik ozmolitler) ölçümü veya hücre hacmi48 üzerindeki etkisi de dahil olmak üzere, VRAC aktivitesini dolaylı olarak izlemenin çeşitli ek yolları vardır. Aslında, LRRC8 proteinlerinin VRAC olarak tanımlanması, halojenüre duyarlı bir floresan proteinin49 aktive edilmiş VRAC'ler 3,4 yoluyla hücreye giren iyodür ile söndürülmesine dayanan bir teste dayanıyordu. LRRC8/VRAC kanal aktivitesini izlemek için başka bir yöntem, diğer iyon kanallarında olduğu gibi 50,51,52,53 FRET 45'teki değişikliklerle gözlemlenebilen sitozolik alanların hareketini kullanır. Bu amaçla, donör olarak camgöbeği-floresan proteini (CFP)/mCerulean3 ve alıcı olarak sarı-floresan proteini (YFP)/mVenüs gibi FRET çiftleri olarak hizmet eden floresan proteinler, LRRC8 proteinlerinin C-terminaline kaynaştırıldı (Şekil 1). LRRC8 alt birimleri arasındaki kompleks içi FRET , alıcı fotoağartma deneyleri45 ile gösterilmiştir. Yıkıcı foto-ağartma yönteminden kaçınarak, zaman içindeki FRET değişiklikleri, temel olarak vericinin emisyon spektrumunun alıcının uyarma spektrumu ile örtüşmesi nedeniyle vericinin uyarılması üzerine alıcının duyarlı emisyonunun ölçüldüğü hassaslaştırılmış emisyon FRET (SE-FRET) ile izlendi. LRRC8 / VRAC aktivasyonu için bir uyaran olan hücre dışı hipotonisitenin uygulanması, SE-FRET yoğunluğunda45 geri dönüşümlü bir azalma ile sonuçlandı. Daha da önemlisi, hipotonik tedavi sırasında eşzamanlı tüm hücre yama kelepçesi ölçümleri ve FRET izlemesi, FRET'teki bu azalmanın gerçekten de LRRC8 / VRAC aktivasyonunuyansıttığını gösterdi 45. Pipet çözeltisi ile plazma zarının bozulmasını veya hücre içi ortamın değiştirilmesini önleyen bu yöntem, LRRC8/VRAC aktivitesinin izlenmesi için bir alternatif sunar. Doğal sitozolün korunmasının çok önemli olduğu, hücre altı çözünürlüğün gerekli olduğu veya kanal aktivitesinin uzun süreli gözleminin gerekli olduğu fizyolojik ortamlarda özellikle yararlıdır.
Burada, LRRC8/VRAC'ı böyle bir FRET tabanlı okuma ile incelemek için bir protokol sunuyoruz. Protokol, hücrelerin nasıl işleneceğini ve transfekte edileceğini, numune ve kontrol görüntülerinin nasıl elde edileceğini, verilerin nasıl analiz edileceğini ve hassaslaştırılmış emisyon FRET (SE-FRET) değerlerinin nasıl hesaplanacağını gösterir.
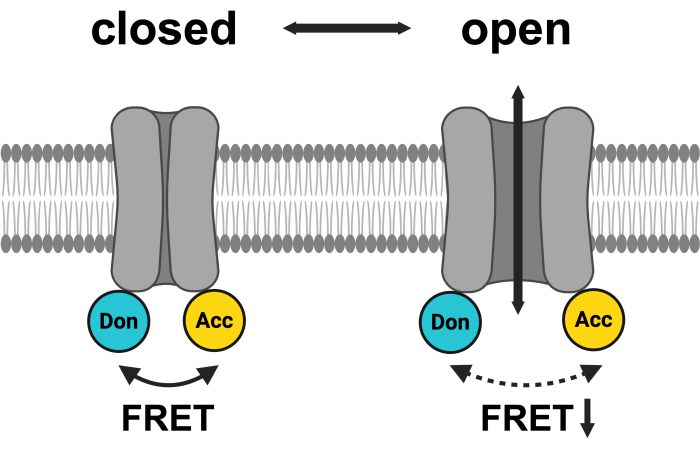
Şekil 1: LRRC8 FRET çift sisteminin şeması. mCerulean3 camgöbeği, mVenüs ise sarı renkle gösterilir. VRAC açılmasını takiben, floroforlar arasındaki mesafe (ve/veya uzamsal yönelim) değişir, bu da verici (Don) ve alıcı (Acc) arasında enerji transferinin azalmasına ve dolayısıyla gözlemlenen FRET'in düşmesine neden olur. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Tampon ve reaktiflerin hazırlanması
- Orta ve izotonik, hipotonik ve hipertonik tamponlar hazırlayın ve ozmolaritenin (Osm) yalnızca kabul edilebilir bir sapma ile beklenen aralıkta olduğundan emin olmak için tamponların ozmolaritesini bir ozmolametre ile ölçün.
- Hücre kültürü ortamı: %10 Fetal Sığır Serumu (FBS) ve %1 penisilin/streptomisin ile desteklenmiş Dulbecco'nun Modifiye Eagle Medium'unu (DMEM) hazırlayın
- İzotonik görüntüleme tamponu (~340 mOsm): 150 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D (+) - Glikoz ve 10 mM 4- (2-Hidroksi Etil) -1-Piperazin Etan Sülfonik asit (HEPES) karıştırarak izotonik görüntüleme tamponunu hazırlayın.
- Hipotonik görüntüleme tamponu (~250 mOsm): 105 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D (+) - Glikoz ve 10 mM HEPES'i karıştırarak hipotonik görüntüleme tamponunu hazırlayın.
- Hipertonik görüntüleme tamponu (~500 mOsm): 160 mM D(-)-Mannitol, 150 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1.5 mM CaCl2, 10 mM D (+) - Glikoz ve 10 mM HEPES'i karıştırarak hipertonik görüntüleme tamponunu hazırlayın.
NOT: Tamponlar, neyin araştırılacağına bağlı olarak spesifik ilaçlarla desteklenebilir.
2. Cam tabanlı tabaklarda yapışık hücrelerin büyümesi
- Transfeksiyon için en az bir tabak, sadece donör veya alıcı florofora kaynaşmış ilgilenilen protein (POI) ile ve donör ve alıcı çifti ile transfeksiyon için en az bir tabak hazırlayın (Tablo 1 ve Şekil 2). Floresan mikroskobuna izin vermek için cam tabanlı tabaklar kullanın. Hücre tipine bağlı olarak, yüzeyi özel olarak temizleyerek veya polilisin ile kaplayarak ön işleme tabi tutun.
NOT: Burada, FRET donörü mCerulean3 (mCer)54 ve FRET alıcısı mVenüs (mVen)55, FRET çifti olarak kullanılır, ancak diğer florofor kombinasyonları da uygulanabilir. Tek başına donöre veya alıcıya kaynaşmış POI'yi ifade eden numune, alıcı kanalında donör kanamasını ve alıcının donör uyarma dalga boyu tarafından çapraz uyarılmasını düzeltmek için gerekli olan β ve γ düzeltme faktörlerini belirlemek için kullanılır (Şekil 2Ac, Bf). - Transfeksiyondan bir gün önce, floresan mikroskobu için uygun cam tabanlı 35 mm'lik tabaklar üzerinde 2 mL hücre kültürü ortamında 1 x 105 HeLa hücresi tohumlayın. Hücreleri, bir hücre kültürü inkübatöründe 37 ° C'de ve% 5 CO2 atmosferinde gece boyunca kültürleyin.
NOT: Reaktif hacimleri, farklı boyuttaki diğer hücre kültürü kaplarının/şişesinin yüzey alanına uyarlanabilir. Hücre sayısı, farklı hücre dizileri ve deneysel yaklaşımlar için uygun bir yoğunluğa uyarlanabilir.- Bir vakum pompası kullanarak T75 hücre kültürü şişeleri üzerinde kültürlenen yapışık hücrelerin tek tabakasından hücre kültürü süpernatantını aspire edin.
- Hücre kültürü şişesine 10 mL Dulbecco'nun Fosfat Tamponlu Salin (DPBS) ekleyerek ve daha sonra çözeltiyi bir vakum pompası ile aspire ederek hücreleri yıkayın.
- Hücreleri 1 mL %0,05 Tripsin-EDTA ile tamamen örtün ve hücreleri bir hücre kültürü inkübatöründe 37 °C ve %5 CO2 atmosferinde 2 dakika inkübe edin.
- 9 mL hücre kültürü ortamı ekleyin ve hücreleri pipetleme ile askıya alın.
- Hücre süspansiyonunu 15 mL'lik bir tüpe aktarın ve oda sıcaklığında (RT) 3 dakika boyunca 700 x g'da santrifüjleyin.
- Süpernatanı bir vakum pompası ile aspire edin ve hücre peletini 10 mL hücre kültürü ortamında yeniden süspanse edin.
- Bir tüpte eşit hacimlerde hücre süspansiyonu ve% 0.4 tripan mavisi karıştırın ve bir sayma slaytına 10 μL ekleyin. Slaytı otomatik hücre sayacına yerleştirin ve hücre sayımı için uygun programı kullanarak saymaya başlayın.
- Her bir tabak için gereken hücre süspansiyonu hacmini hesaplamak için, tabak başına gereken hücre sayısını (1 x 105) hücre sayacından elde edilen mililitre başına hücre sayısına bölün.
- Uygun bir tüpte, tabak başına gereken hücre sayısını, tabak başına gereken hacimde (2 mL) ve fazladan bir tabak için miktarı içeren bir hücre süspansiyonu hazırlayın.
- Tüpü ters çevirerek hücre süspansiyonunu en az 20 kez karıştırın ve her tabakta 2 mL hücre süspansiyonunu pipetleyin.
- Daha eşit bir hücre dağılımı sağlamak için, bulaşıkları hücre kültürü inkübatörüne yerleştirmeden önce RT'de 30 dakika bekletin.
3. Hücre transfeksiyonu
NOT: Burada, FuGENE bir transfeksiyon reaktifi olarak kullanılmıştır. Diğer transfeksiyon reaktifleri ve yöntemleri de uygulanabilir. Plazmid DNA'nın (pDNA) transfeksiyon reaktiflerine optimal oranları ve her POI ve hücre modeli için optimal ekspresyon süresi ampirik olarak değerlendirilmelidir. Burada, 35 mm'lik çanak başına 2 μg toplam pDNA kullanıldı. FRET donör ve alıcı yapıları 1:1 oranında kullanıldı ve pDNA-transfeksiyon reaktif oranı 1:4 idi (Tablo 1).
- Transfeksiyondan önce, hücre kültürü süpernatantını taze 2 mL önceden ısıtılmış ortamla değiştirin.
- pDNA'yı Opti-Minimal Esansiyel Ortamda (MEM) 100 μL'lik bir son hacimle (=pDNA çözeltisi) seyreltin.
- Transfeksiyon reaktifini Opti-MEM'de 100 μL'lik bir son hacim (= reaktif çözeltisi) ile seyreltin.
NOT: Daha homojen bir transfeksiyon için, pDNA ve reaktif çözeltisi için bir ana karışım hazırlayın. - pDNA ve reaktif çözeltisini iyice karıştırın.
- pDNA çözeltisini reaktif çözeltisine (=transfeksiyon çözeltisi) ekleyin.
- Transfeksiyon çözeltisini iyice karıştırın.
- Transfeksiyon çözeltisini RT'de 15 dakika inkübe edin.
- Transfeksiyon solüsyonunu spiral hareketlerle damla damla tabağa ekleyin.
- Tabağı tezgah yüzeyinde yatay ve dikey olarak 5 kez hareket ettirerek karıştırın.
- Hücreleri, bir hücre kültürü inkübatöründe 37 ° C'de ve% 5 CO2 atmosferinde gece boyunca kültürleyin.
| Koşul | Yapı (lar) | Örnek | İçin kullanılır |
| 1 | LRRC8A-mGök Mavisi | Sadece donör yapısı | Düzeltme faktörü β belirleyin |
| 2 | LRRC8E-mVenüs | Yalnızca alıcı yapısı | Düzeltme faktörü γ belirleyin |
| 3 | LRRC8A-mCerulean ve LRRC8E-mVenüs | FRET çifti | SE-FRET miktar tayini |
Tablo 1: Vericiye kaynaşmış LRRC8A alt biriminden (mCerulean3) ve alıcıya kaynaşmış LRRC8E alt biriminden (mVenüs) oluşan bir kanalın LRRC8/VRAC aktivitesini ölçmek için tipik bir SE-FRET deneyi için gerekli koşulların örneği florofor.
4. Düzeltme faktörü belirleme için görüntü elde etme
NOT: FRET sırasında alıcının tespit edilen emisyonuna verici emisyonunda bir kanama vardır. Ayrıca, alıcı floroforun donör uyarma dalga boyu tarafından çapraz uyarımı vardır. SE-FRET'in hesaplanması sırasında bu işlemler telafi edilmelidir. Bu amaçla, transfeksiyondan 24 saat sonra sadece FRET donörünü veya alıcısını eksprese eden hücrelerde düzeltme faktörleri belirlenir. Burada görüntüleme, bir Leica LED8 lamba, filtre küpü CYR71010, bir HC PL APO 63x/1.40 OIL objektif, 460/80 ve 553/70 için uzun geçiren filtre ve bir Leica DFC9000GTC kamera ile donatılmış bir Leica THUNDER Görüntüleyici üzerinde gerçekleştirildi. Deneyler, çevresel kontrol olmadan, ancak pH'ı stabilize etmek için görüntüleme tamponlarında HEPES varlığında gerçekleştirildi. Uzun süreli gözlem/ölçümler için bir çevresel kontrol sistemi kullanılması tavsiye edilir. Analiz için SE-FRET, yakalanan ham görüntülerden hesaplanır. Bu, satın alma sırasında veya daha sonra aynı anda yapılabilir. Burada, görüntü elde etme sırasında düzeltme faktörlerinin hesaplanması ve SE-FRET değer değişikliklerinin gerçek zamanlı olarak görselleştirilmesi ile ilgili deneysel prosedürü basitleştirmek için SE-FRET eklentisine sahip Leica LAS X yazılımı kullanılmıştır. Edinme sonrası için, düzeltme faktörleri ve SE-FRET, aşağıda verilen protokole göre ham veri alımından sonra diğer yazılım paketleri (örneğin, FIJI) ile belirlenebilir.
- Düzeltme faktörlerini hesaplamak için tek transfekte edilmiş hücrelerin görüntü elde edilmesinden önce, tüm kanallar için mikroskopi ayarını ayarlamak için FRET çiftini ifade eden bir numune kullanın (donör uyarma/donör emisyonu DD, donör/alıcı DA ve alıcı/alıcı AA; bkz. Tablo 1 ve Şekil 2C ve Şekil 3A).
NOT: Yukarıda açıklandığı gibi transfekte edilmiş mCerulean3 ve mVenüs etiketli VRAC alt birimleri ile SE-FRET ölçümleri için aşağıdaki parametreler kullanılmıştır: 8x8 piksel gruplama, 100 ms pozlama süresi ve %10 LED lamba yoğunluğu. - Sadece donör yapısını ifade eden numuneyi alın (Şekil 2A), hücre kültürü ortamını aspire edin ve hücreleri 2 mL izotonik tampon ile üç kez yıkayın.
- 3 mL izotonik tampon ekleyin ve numuneyi mikroskop aşamasına yerleştirin.
- Verici yapısını ifade eden en az bir hücreye sahip bir görüş alanı (FOV) bulun.
- Tüm kanalları görüntüleyin (DD, DA ve AA, bkz. Tablo 2 ve Şekil 2A).
- Hücrenin/hücrelerin etrafına bir ilgi alanı (ROI) çizin veDA'nın ortalama yoğunluğunu ölçün (= I DA; Şekil 2Ac) ve DD (= IDD; Şekil 2Aa).
- Arka plan çıkarma işlemi için, yalnızca arka plan sinyalinin bulunduğu DA ve DD kanallarında bir ROI çizin ve ortalama yoğunluğu ölçün (IBDA ve IBDD).
- Arka plan ROI'sinin ortalama yoğunluğunu, karşılık gelen kanalın (
 ve
ve 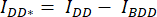 ) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın.
) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın. - 4.2- 4.5 adlarını, yalnızca alıcı yapıyı ifade eden numune ile tekrarlayın (Şekil 2B).
- Hücre(ler)in etrafına bir ROI çizin ve DA'nın ortalama yoğunluğunu ölçün (= I DA; Şekil 2Bf) ve AA (= IAA; Şekil 2Be).
- Arka plan çıkarma işlemi için, yalnızca arka plan sinyalinin bulunduğu DA ve AA kanallarında bir ROI çizin ve ortalama yoğunlukları ölçün (IBDA ve IBAA).
- Arka plan ROI'sinin ortalama yoğunluğunu, karşılık gelen kanalın (
 ve
ve 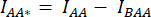 ) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın.
) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın. - Düzeltme faktörlerini
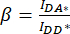 hesaplamak için IDA*, IDD* ve IAA* için belirlenen değerleri kullanın ve
hesaplamak için IDA*, IDD* ve IAA* için belirlenen değerleri kullanın ve 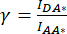 ,
,
Bu sayede, β düzeltme faktörü, verici emisyonunun DA kanalına sızmasını telafi etmek için kullanılır. Düzeltme faktörü γ, alıcı floroforun DA kanalındaki donör uyarma dalga boyu tarafından çapraz uyarılmasını telafi etmek için kullanılır.
| Uyarılması | Emisyonu | Kanal adı | LED hattı | Filtre küpü | Uzun geçiren filtre |
| Donör | Donör | DD | 440 deniz mili | CYR71010 | 460/80 deniz mili |
| Donör | Acceptor | DA | 440 deniz mili | CYR71010 | 535/70 deniz mili |
| Acceptor | Acceptor | ACAR | 510 deniz mili | CYR71010 | 535/70 deniz mili |
Tablo 2: SE-FRET deneyleri için gerekli kanalların özeti.
Şekil 2: Donör mCerulean3'e (mCer) kaynaşmış LRRC8A alt biriminden ve SE-FRET ölçümleri ile alıcı mVenüs (mVen) floroforuna kaynaşmış LRRC8E alt biriminden oluşan bir kanalın VRAC aktivitesini belirlemek için gerekli olan β ve γ düzeltme faktörlerini hesaplamak için kullanılan numunelerin temsili floresan görüntüleri. (A,B) HeLa hücrelerinde verici/verici DD, alıcı/alıcı AA ve verici/alıcı DA kanalının saptanması, yalnızca verici (A) LRRC8A-mCer veya alıcı (B) LRRC8E-mVen'i eksprese eder. (C) Donör ve alıcı çifti LRRC8A-mCer ve LRRC8E-mVen ile birlikte transfekte edilen HeLa hücrelerinde DD, AA ve DA kanallarının tespiti. Paneller a-i, donör tespit kanalında çekilen görüntüleri gösterir (donörün uyarılması ve donör sinyalinin tespiti; DD; a, d ve g), alıcı algılama kanalı (alıcının uyarılması ve alıcı sinyalinin algılanması; ACAR; b, e ve h ) ve FRET sinyal algılama kanalı (vericinin uyarılması ve alıcı sinyalinin algılanması; DA; c, f ve i). Panel j, g ve h panellerinin kaplamasıdır. DD kanalı yeşil ve AA kanalı macenta olarak gösterilir. Ölçek çubuğu = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. SE-FRET miktar tayini için hızlandırılmış görüntüleme
- Verici ve alıcı yapıyı ifade eden numuneyi alın (Tablo 1, Şekil 2C ve Şekil 3A), hücre kültürü ortamını aspire edin ve hücreleri transfeksiyondan 24 saat sonra 2 mL izotonik tampon ile üç kez yıkayın.
- 3 mL izotonik tampon ekleyin ve numuneyi mikroskopi aşamasına yerleştirin.
- İzotonik tamponun daha sonra aspirasyonu için, kanül ucu tabağın dibine ulaşacak şekilde bir hortum kanülünü sabitleyin ve ayarlayın.
- Tampon eklemek için, boruları yerçekimi akışıyla tahrik edilen tamponun tabağa düşebileceği şekilde sabitleyin ve ayarlayın.
NOT: Burada, tampon akışını kontrol etmek için dört manyetik valfli valf kontrollü bir yerçekimi perfüzyon sistemi kullanılmıştır, ancak başka yöntemler de uygulanabilir. - Verici ve alıcı yapısını aynı anda ifade eden en az bir hücreye sahip bir FOV bulun.
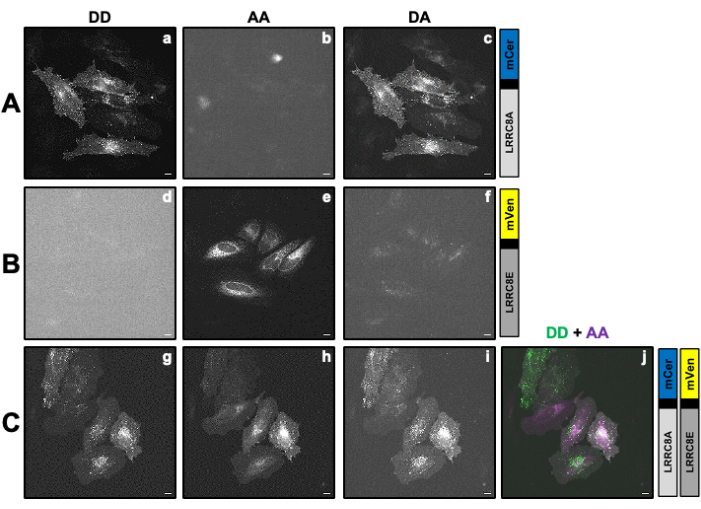
- DD, DA ve AA kanalları için 10 s'lik bir aralıkla ve stimülasyon dizisinin tüm koşullarını kapsayacak bir süreyle, örneğin 12 döngü taban çizgisi ve ardından koşul başına 15 döngü ile hızlandırılmış bir deney ayarlayın (Şekil 3).
NOT: Aralık ve döngü sayısı, deneysel ihtiyaçlara göre benimsenebilir, ancak verilerin daha iyi görselleştirilmesi ve karşılaştırılması için her zaman normalleştirme için bir temel ölçüm içermelidir. - Temel ölçümden sonra, ilk koşul için numuneyi tamponda yıkayın.
- İzotonik tamponu hortum kanülü aracılığıyla aspire edin ve bir şırınga ile vakum uygulayın.
- Yerçekimi akışı ile bir sonraki koşulun tamponundan 3 mL ekleyin.
- Tamponu aspire edin ve aynı tampondan 3 mL tekrar ekleyin.
- Adım 5.7.3'ü bir kez daha tekrarlayın.
- İlk koşulun ölçülmesinden sonra, bir sonraki koşul için numuneyi tamponda yıkayın (adım 5.7.1-5.7.4).
- Tüm koşullar yakalanana kadar 5.5-5.8 adımlarını tekrarlayın.
- SE-FRET nicelemesi için, hücrenin/hücrelerin etrafına bir ROI çizin ve zaman serisindeki tüm görüntüler (zaman noktaları) için DD = (IDD), DA (IDA) ve AA (IAA) kanalındaki ortalama yoğunluğu ölçün (Şekil 3A, B).
- FRET sinyali için arka plan çıkarma için, yalnızca arka plan sinyalinin bulunduğu DA kanalında bir ROI çizin ve ortalama yoğunluğu (IBDA) ölçün.
- Arka plan ROI'sinin ortalama yoğunluğunu, DA kanalının (
 ) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın.
) hücre ROI'sinde ölçülen ortalama yoğunluktan çıkarın. - Her bir ROI ve tüm zaman noktaları
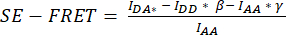 için ortalama SE-FRET değerlerini hesaplamak için belirlenen değerleri kullanın.
için ortalama SE-FRET değerlerini hesaplamak için belirlenen değerleri kullanın. - Farklı koşulların daha iyi karşılaştırılabilirliği ve SE-FRET değerlerinin görselleştirilmesi için, karşılık gelen ROI'nin tüm zaman noktalarını normalleştirmek için her ROI'nin temel değerlerinin ortalamasını kullanın.
- Zaman içinde normalleştirilmiş SE-FRET değerlerini çizin (Şekil 3B).
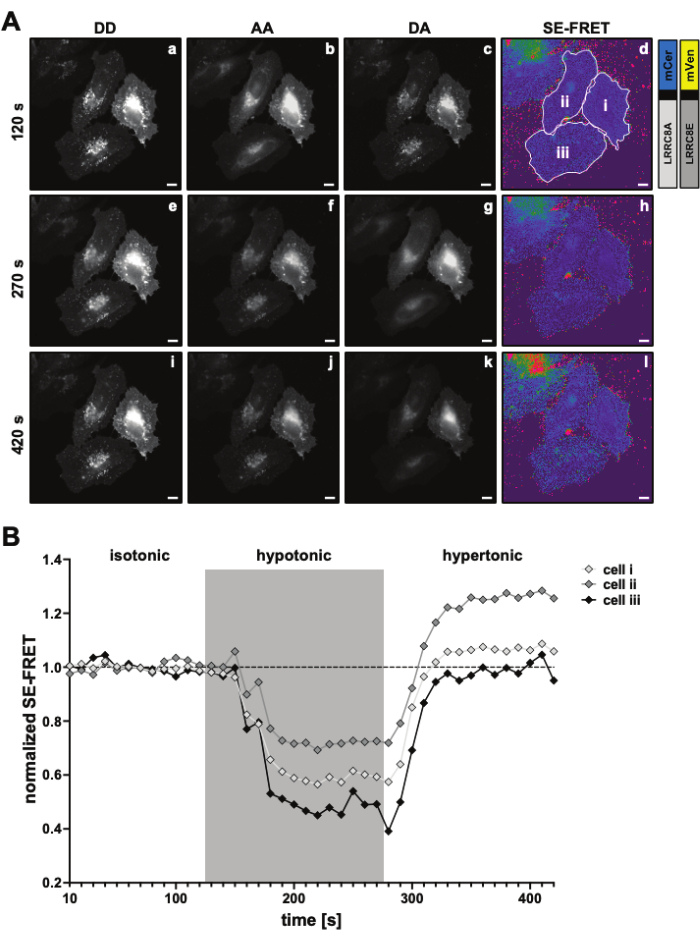
Şekil 3: Temsili floresan görüntüleri ve SE-FRET nicelemesi. (A) Tonisiteye bağlı olarak LRRC8A ve LRRC8E alt birimlerinden oluşan bir kanalın SE-FRET ile VRAC aktivitesini ölçmek için bir zaman turları deneyinin ilk zaman noktasının temsili floresan görüntüleri ve görünen SE-FRET'i. Ölçek çubuğu = 10 μm. Aynı hücreler Şekil 2C'de gösterilmiştir. Paneller a-i, DD, AA ve DA kanallarının algılanmasını ve hesaplanan görünür SE-FRET'i gösterir. Beyaz anahatlar, DD, AA ve DA'daki ortalama sinyal yoğunluklarını ve görünen SE-FRET görüntüsünü ölçmek için kullanılan ROI'leri (panel d'deki hücreler i-iii) temsil eder. (B) SE-FRET değerlerinin zaman içinde ölçülmesi. Koşulların sırası 12 döngü izotonik görüntüleme tamponu (başlangıç), ardından 15 döngü hipotonik ve 15 döngü hipertonik görüntüleme tamponu idi. Her bir ROI'nin (hücre i-iii) ve zaman noktasının ham ortalama SE-FRET değeri, karşılık gelen ROI için temel (izotonik) değerin ortalamasına normalleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bu FRET tabanlı yöntemle, ozmotik stimülasyon sırasında LRRC8 / VRAC aktivitesi izlenebilir ve SE-FRET'teki azalma, hücre dışı hipotonisitederecesi 45 ile ilişkilidir. Hipotonisite ile indüklenen kanal aktivasyonu için temsili sonuçlar da burada gösterilmektedir (Şekil 3 ve Şekil 4). Ek olarak, diasilgliserol sinyalinin45 manipülasyonu veya miyosit aktivasyonu56 sırasında farklı izozmotik uyaranlarla LRRC8/VRAC aktivasyonu gözlemlenebilir.
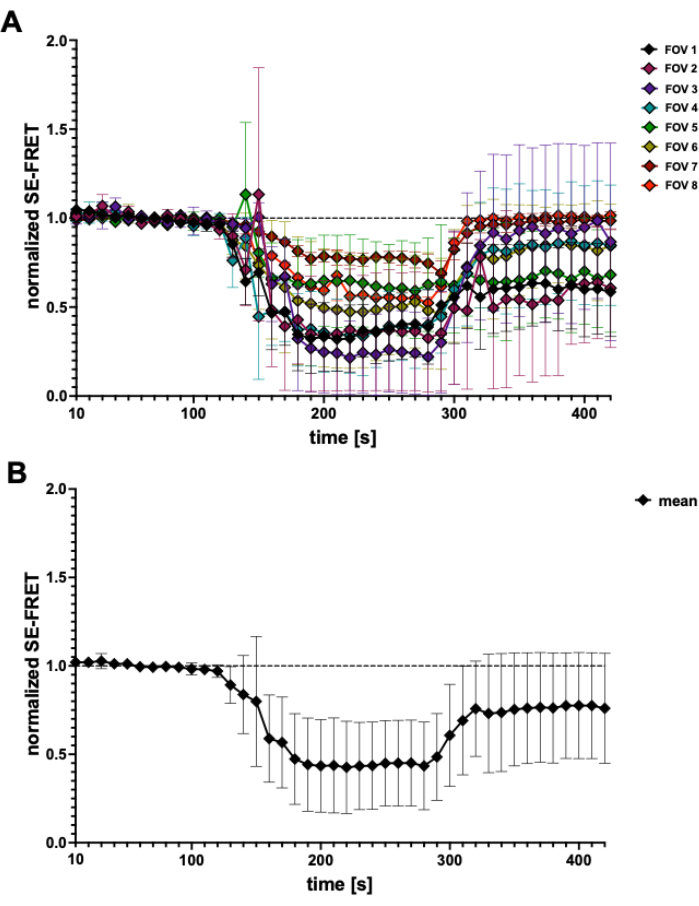
Şekil 4: SE-FRET izleri. (A) 5 bağımsız deneyden görünen SE-FRET izleri. Veriler, görüş alanı (FOV) başına N = 2 ila N = 7 hücrenin ortalama ± SD'sini temsil eder. (B) Tüm hücrelerin ortalama ± SD'si (N = 31 hücre). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
LRRC8/VRAC kanalları da apoptotik hacim azalmasında rol oynadığından24,57, apoptozun indüklenmesi üzerine kanal aktivitesini gözlemlemek burada açıklanan yöntem için başka bir uygulama olacaktır. Buna göre, LRRC8A-mCerulean3 ve LRRC8E-mVenüs eksprese eden HeLa hücrelerinde SE-FRET izleme protokolü, ölüm reseptörü aracılı apoptozu indükleyen ilaçlar uygulanırken gerçekleştirildi. Tümör nekroz faktörü (TNF)-α ve sikloheksimidin (CHX) daha önce birkaç dakika içinde VRAC akımlarını uyandırdığı gösterilmişti58. İzotonik tamponda 2 ng/mL TNF-α ve 1 μg/mL CHX ilavesinden sonra, SE-FRET'te sağlam bir azalma olmuştur (Şekil 5). TNF-α ve CHX içermesine rağmen tamponun hipertonik bir ortamla değiştirilmesi, SE-FRET değerleri taban çizgisine yakın bir yerde geri kazanıldı (Şekil 5A), apoptozu indükleyen Fas ligandı58 ile tedavi sırasında hipertonik banyo çözeltisindeki azalan VRAC akımlarına karşılık geldi. Hücrelerin TNF-α ve CHX için çözücü olan DMSO ile muamelesi, SE-FRET azalması ile sonuçlanmadı. TNF-α + CHX, FRET kontrolü59 olarak bir EYFP ve ECFP tandem yapısı olan CFP-18aa-YFP'nin SE-FRET'ini etkilemedi ve LRRC8 / VRAC için özgüllüğü gösterdi (Şekil 5B).
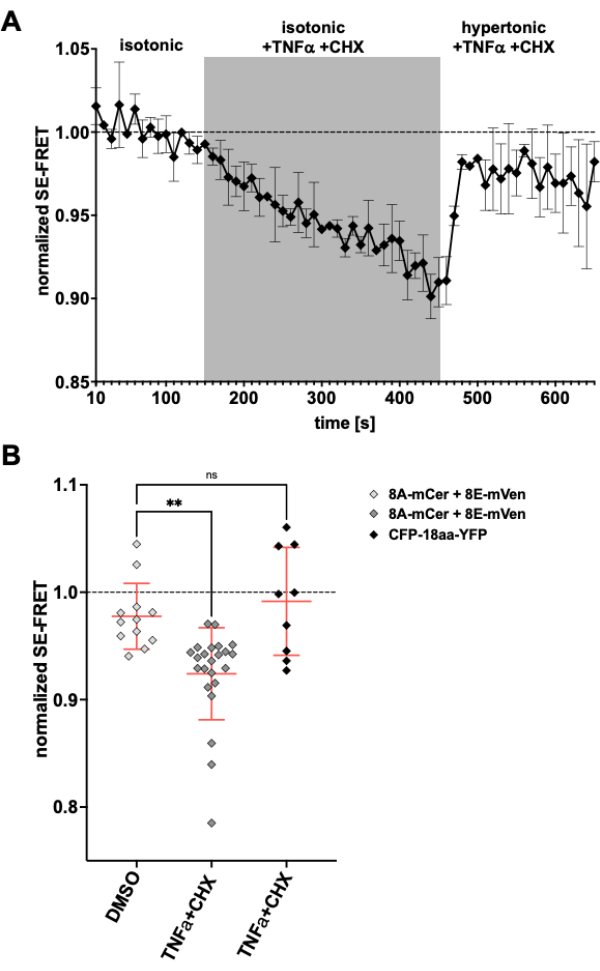
Şekil 5: Ölüm reseptörü aracılı apoptoz ile izomotik VRAC aktivasyonu. (A) Zaman içinde LRRC8A-mCer / LRRC8E-mVen eksprese eden HeLa hücrelerinden (n = 8 tabak, 23 hücre) normalleştirilmiş SE-FRET değerleri. İzotonik görüntüleme tamponunda (taban çizgisi) 15 döngüden sonra, banyo çözeltisi, 30 döngü için 2 ng / mL TNF-α ve 1 μg / mL sikloheksimid (CHX) ile takviye edilmiş izotonik tampon ile değiştirildi, ardından TNF-α ve CHX ile 20 döngü hipertonik görüntüleme tamponu izledi. Her bir ROI ve zaman noktasının ham ortalama SE-FRET değeri, ilgili ROI için temel (izotonik) değerin ortalamasına normalleştirildi. (B) CHX (n = 5 tabak, 12 hücre) veya A'daki gibi apoptoz indükleyicileri içeren izotonik tampon (n = 8 tabak, 23 hücre) için araç kontrolü olarak DMSO içeren izotonik çözelti ile A'daki gibi LRRC8A / E eksprese eden HeLa hücrelerinin normalleştirilmiş SE-FRET değerlerinin ölçülmesi veya apoptoz indükleyicileri ile CFP-18aa-YFP eksprese eden HeLa hücrelerinin (n = 3 tabak, 9 hücre). Veriler, tek tek hücrelerin (semboller) ilgili tamponundaki son 10 zaman noktasının ortalamasını ve SD'± tüm hücrelerin ortalamasını temsil eder; ** p < 0.01 sıradan tek yönlü ANOVA ve ardından Tukey'in çoklu karşılaştırma post-hoc testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
FRET mikroskobu, proteinler arasındaki etkileşimi incelemek için iyi bilinen, yaygın olarak kullanılan bir tekniktir. Bu nedenle, FRET tabanlı yöntemler, değişken uzmanlığa sahip birçok laboratuvarda uygulanabilir. Geçit oluşturma sırasındaki konformasyonel yeniden düzenlemeler, FRET tabanlı tahliller kullanılarak çok çeşitli iyon kanalları için izlenmiştir (örneğin, bkz. referanslar 34,50,51,52,53,60,61,62,63,64,65,66,67), bazı durumlarda yama kelepçeli florometride elektrofizyoloji ile birleştirilir 68,69,70,71. FRET, bu iyon kanallarının yapı-işlev ilişkilerini incelemek veya iyon taşınmasından bağımsız olarak aktivitelerini izlemek için kullanılabilir. Burada sunulan yöntem, LRRC8/VRAC kanallarının aktivitesinin yerinde izlenmesine izin verdiği için elektrofizyolojiye göre açık avantajlara sahip olabilir.
Protokoldeki kritik adımlar, transfeksiyon ve görüntüleme için en uygun birleşmeye ulaşmak için hücrelerin kaplanmasını içerir, bu da daha sonraki analizler için ideal olarak kolay hücre ayrımını kolaylaştırır. Farklı alt birimlerin etkili bir şekilde birlikte transfeksiyonu, doğru hücre altı lokalizasyonu için çok önemlidir; örneğin, LRRC8A olmayan alt birimin fazlalığı, gelişmiş endoplazmik retikulum (ER) lokalizasyonuna yol açacaktır4. Bu nedenle, plazmit oranlarının ayarlanması gerekebilir. Sisteme bağlı olarak, yeni oluşturulan FRET çiftleri, örneğin alıcı ağartma ile doğrulanmalıdır. Araştırma sorusu için en uygun zamansal ve uzamsal çözünürlüğü sağlamak için gruplama ve maruz kalma süresi birbirine karşı dengelenmelidir. Gruplama, daha kısa pozlama süreleri sağlar ve dolayısıyla uzamsal çözünürlüğü azaltırken FRET sensörünün potansiyel ağarmasını azaltır. Bu nedenle, deney düzeneği, örneğin LRRC8/VRAC aktivitesinin hücre altı ayrımını gerektiriyorsa, gruplamadan kaçınılmalıdır. Araştırma sorusu, hızlandırılmış bir serideki döngülerin sayısını ve aralığını eşit olarak belirler. Aralık, yalnızca FRET değişikliklerinin kinetiği (ve dolayısıyla LRRC8/VRAC etkinleştirme/inaktivasyonu) gerekliyse geçerlidir; Aksi takdirde, basit "öncesi ve sonrası" kayıtları da yapılabilir. Deneyin uzunluğu fizyolojik sürece bağlıdır. İdeal olarak, uyaranlar üzerindeki LRRC8/VRAC aktivitesi, SE-FRET stabilize olana kadar izlenmelidir. Bu faktörler pilot deneylerde belirlenebilir. Gerçek SE-FRET sinyalini hesaplamak için düzeltme faktörleri tüm koşullar için belirlenmelidir. Yanlış belirlenen düzeltme faktörleri, SE-FRET yoğunluklarının fazla veya eksik tahmin edilmesine neden olabilir. Son olarak, istikrarlı bir taban çizgisi oluşturduktan sonra, görüntüler arasındaki zaman aralığı, ilgilenilen fizyolojik süreci yakalamak için yeterince kısa olmalıdır.
Yöntem bazı sınırlamalar taşır. Bunlardan biri, LRRD'lerin hareketlerini yansıtırken LRRC8 FRET yoğunlukları arasındaki değişikliklerin, gözenek boyunca iyon veya ozmolit taşınmasına karşılık gelmesi gerekmemesidir. Bu, minimum akımlarına 4,32,72 rağmen LRRC8A homomerleri45 ile gözlemlenen FRET değişikliklerinden açıkça anlaşılmaktadır. LRRC8/VRAC kanallarının gözenek blokerleri FRET sinyalini etkilemeyebilir, bu da bu yöntemi belirli kanal modülatörlerinin aranması için uygun hale getirmez. Ayrıca, aşırı eksprese edilen LRRC8 proteinlerinin ekspresyon seviyeleri, özellikle C-terminal etiketli LRRC8 proteinleri bazal aktivite14 gösterdiğinden, gözlemlenen fizyolojik süreçleri etkileyebilir.
Belirli bir araştırma sorusuna bağlı olarak bir sınırlama veya avantaj olarak kabul edilebilecek bir husus, bu yöntemde yalnızca ektopik olarak ifade edilen LRRC8 alt birimlerinin seçici olarak ölçülmesidir. Bu nedenle, endojen proteinlerin arka plan seviyeleri ölçümlere neredeyse hiç müdahale etmez. Öte yandan, aşırı eksprese edilen proteinler, potansiyel olarak farklı alt birim bileşimi ve stokiyometrisi ile endojen LRRC8 kanalları gibi davranmayabilir. Örneğin, oksidasyon gibi çeşitli uyaranlar, farklı şekilde oluşturulmuş LRRC8 kanalları36 üzerinde zıt modülatör etkilere sahip olabilir. Birlikte ifade edilen alt birimler arasındaki oranları değiştirerek, stokiyometrileri ve genel iyon iletkenliği ayarlanabilir14,73, ancak bir kompleks21 içinde muhtemelen genellikle ikiden fazla paralog içeren doğal bileşimleri net değildir ve hücre tipleriarasında değişebilir 74,75,76. Ayrıca, floresan proteinlerin LRRC8 proteinlerinin sitozolik C-terminaline füzyonunun, Xenopus oositlerinde14 bazal LRRC8/VRAC kanal aktivitesini arttırdığı gösterilmiştir, çünkü büyük etiketler, kanal açılışını yönetebilen LRRD'lerin konformasyonunu modüle eder 14,44,45. Bu nedenle, floresan proteinlerin boyutu, bağlayıcı ve yönelimleri sadece FRET verimliliğini değil, aynı zamanda kanal aktivitesini de etkileyebilir. Bununla birlikte, daha da önemlisi, floresan proteinlerle kaynaşmış LRRC8 proteinlerinin VRAC kanalları, hipotonik stimülasyona14 yanıt vermeye devam etti ve bu da FRET sensörleri45 olarak kullanılmalarını sağladı.
LRRC8 / VRAC kanal aktivitesini ışık mikroskobu ile izlemek için bu non-invaziv yöntemin diğer yöntemlere kıyasla avantajları şunları içerir: (i) Elektrofizyoloji için tipik olarak erişilemeyen hücreler veya bölmeler içinde LRRC8 / VRAC'ın gözlemlenmesine izin verir. Bu, LRRC8 komplekslerinin bulunabileceği veya 45,77,78'e hedeflenebileceği hücre içi organelleri içerir. (ii) Sitozolik bileşim yöntem tarafından değiştirilmeden kalırken, tüm hücre yama-kelepçe ölçümleri sırasında, sitozol büyük ölçüde pipet çözeltisi ile değiştirilir, bu da forbol-12-miristat-13-asetat (PMA) ile gözlemlendiği gibi sinyal yollarını etkileyebilir LRRC8 / VRAC aktivasyonu45. (iii) Hücre göçü sırasında ön ve arka kenarlardaki aktiviteyi ayırt etmek gibi hücre altı çözünürlükle LRRC8/VRAC aktivasyonunu gözlemleme imkanı sunar, burada -kapalı alanlarla sınırlı- VRACdahil edilmiştir 79,80. (iv) Miyosit farklılaşması56 gibi genişletilmiş fizyolojik süreçler sırasında LRRC8/VRAC aktivitesinin sürekli izlenmesini sağlar.
Bu yöntemle ilgili sınırlamalar ve zorluklar olsa da, hayvan modellerindeki potansiyel uygulamalar da dahil olmak üzere daha fazla araştırma için umut vaat ediyor. Bu iyon ve ozmolit kanal ailesini incelemek için diğer yöntemlerle birlikte, bu FRET bazlı tahlil, aktivasyon mekanizmalarının çözülmesine ve LRRC8 kanallarının doğal ortamlarında çeşitli fizyolojik işlevlerinin araştırılmasına önemli ölçüde katkıda bulunabilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
CFP-18aa-YFP yapısını kodlayan plazmidin nazik hediyesi için C.F. Kaminski'ye, teknik yardım için A. Klemmer'e ve bu yöntemin geliştirilmesine katkıda bulunan Stauber laboratuvarının tüm mevcut ve eski üyelerine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
Referanslar
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır