Method Article
Monitoramento da atividade de 8 canais (LRRC8/VRAC) de repetição rica em leucina usando transferência de energia de ressonância de Förster de emissão sensibilizada (SE-FRET)
Neste Artigo
Resumo
A eletrofisiologia é o padrão-ouro para investigar a atividade do canal iônico. No entanto, existem muitas abordagens alternativas, incluindo métodos ópticos. Aqui, descrevemos um método para monitorar a atividade da repetição rica em leucina contendo canais de ânions formados por 8 canais (LRRC8) usando um método baseado em transferência de energia de ressonância de Förster (FRET) entre subunidades.
Resumo
Os membros da família de proteínas LRRC8 formam canais heteroméricos de íons e osmólitos com papéis em vários processos fisiológicos. Como canais de ânions regulados por volume (VRACs) / canais de retificação externa sensíveis ao volume (VSORs), eles são ativados após o inchaço das células osmóticas e medeiam a extrusão de cloreto e osmólitos orgânicos, levando ao efluxo de água e, portanto, ao encolhimento celular. Além de seu papel na regulação do volume osmótico, os VRACs têm sido implicados em processos celulares, como diferenciação, migração e apoptose. Por meio de seu efeito no potencial de membrana e no transporte de várias moléculas de sinalização, a repetição rica em leucina contendo 8 canais (LRRC8) desempenha papéis na comunicação neurônio-glia, secreção de insulina e resposta imune. O mecanismo de ativação permaneceu indescritível. Os canais LRRC8, como outros canais iônicos, são tipicamente estudados usando métodos eletrofisiológicos. Aqui, descrevemos um método para detectar a ativação do canal LRRC8 medindo a transferência de energia de ressonância de Förster de emissão sensibilizada intracomplexa (SE-FRET) entre proteínas fluorescentes fundidas aos domínios de repetição ricos em leucina C-terminal das subunidades LRRC8. Este método oferece a possibilidade de estudar a ativação do canal in situ sem troca do ambiente citosólico e durante processos como diferenciação celular e apoptose.
Introdução
Canais iônicos compostos por heterômeros de proteínas da família 8 (LRRC8) são encontrados em células de vertebrados, participando de uma ampla gama de funções fisiológicas 1,2. Esses canais LRRC8, identificados pela primeira vez como canais de ânions regulados por volume (VRACs) ou canais de retificação externa sensíveis ao volume (VSOR), desempenham um papel crucial na diminuição do volume regulatório celular 3,4. Eles facilitam a expulsão de íons cloreto e osmólitos orgânicos, que é seguida por efluxo de água em resposta ao inchaço osmótico. Além de seu papel na resposta ao estresse osmótico, seu papel na regulação do volume celular tem sido associado à proliferação e migração celular, apoptose, espermiogênese e integridade epitelial 5,6,7. A alteração do potencial de membrana após a ativação de LRRC8 / VRAC demonstrou contribuir para a diferenciação do miotubo8 e secreção de insulina pelas células β pancreáticas9 , 10 , 11 . Além disso, os canais LRRC8 conduzem uma variedade de osmólitos orgânicos, como as moléculas de sinalização purinérgica ATP e cGAMP ou o aminoácido excitatório glutamato, colocando esses canais na comunicação célula-célula no sistema imunológico ou interação glia-neurônio 12,13,14,15,16,17,18,19,20,21,22. Mesmo os xenobióticos, como o corante fluoresceína, o antibiótico blasticidina S ou a droga anticancerígena cisplatina, são conduzidos pelos canais LRRC8 23,24,25.
Existem inúmeros relatos sobre a transdução de sinal que leva à ativação do LRRC8 / VRAC26 , 27 , 28 . No entanto, o mecanismo permanece obscuro, e a literatura apresenta uma ampla gama de mecanismos potenciais que podem depender do processo fisiológico específico. Isso inclui alterações na força do íon citosólico, interação com o citoesqueleto, composição da membrana, proteínas G, estado redox e cascatas de fosforilação 2,27,29,30,31.
Os canais LRRC8 / VRAC contêm LRRC8A como uma subunidade essencial 3,4 que deve se heteromerizar com pelo menos um de seus parálogos LRRC8B-E para formar canais fisiologicamente funcionais 4,14,32. A composição da subunidade determina as propriedades biofísicas do canal, como retificação e inativação dependente de despolarização 4,29,32,33,34, especificidade do substrato 15,17,20,21,24,35 e algumas vias de ativação 36,37. As estruturas de microscopia crioeletrônica (cryo-EM) mostram que os homômeros LRRC8A, assim como os heterômeros, se reúnem como hexâmeros38,39,40, enquanto as quimeras LRRC8A / LRRC8C que formam canais funcionais são heptâmeros41. A parte N-terminal de todas as proteínas LRRC8 compreende quatro hélices transmembranares, e a parte C-terminal contém um domínio com repetições ricas em leucina (LRRD). As estruturas complexas LRRC8 disponíveis fornecem evidências de que os LRRDs, que se estendem para o citosol 3,4,23, podem sofrer rearranjos conformacionais durante o canal 34,42,43. Essa noção é corroborada pela descoberta de que a fusão C-terminal de proteínas fluorescentes resulta em atividade de canal basal14 e que a ligação de nanocorpos aos domínios pode modular a atividade do canal44. Além disso, alterações conformacionais dos terminais C foram mostradas pela transferência de energia de ressonância de Förster intra-complexo (FRET)45.
O método mais comum para estudar a atividade dos canais iônicos são as medidas eletrofisiológicas46, que foram amplamente aplicadas na investigação de VRACs antes de sua identificação molecular47. No entanto, existem várias maneiras adicionais de monitorar indiretamente a atividade do VRAC, incluindo a medição de seus substratos conduzidos - íons haleto ou osmólitos orgânicos - ou seu efeito no volume celular48. De fato, a identificação de proteínas LRRC8 como VRAC dependeu de um ensaio baseado na extinção de uma proteína fluorescente sensível ao halogeneto49 por iodeto que entra na célula através de VRACs ativados 3,4. Outro método para monitorar a atividade do canal LRRC8 / VRAC faz uso do movimento dos domínios citosólicos que podem ser observados, como em outros canais iônicos 50,51,52,53, por mudanças no FRET45. Para tanto, proteínas fluorescentes que servem como pares FRET, como proteína ciano-fluorescente (CFP)/mCerulean3 como doadora e proteína fluorescente amarela (YFP)/mVenus como aceptor, foram fundidas aos terminais C das proteínas LRRC8 (Figura 1). O FRET intracomplexo entre as subunidades LRRC8 foi demonstrado por experimentos de fotobranqueamento aceptor45. Evitando o método de fotobranqueamento destrutivo, as mudanças de FRET ao longo do tempo foram monitoradas por emissão sensibilizada FRET (SE-FRET), onde basicamente é medida a emissão sensibilizada do aceptor após a excitação do doador devido à sobreposição do espectro de emissão do doador com o espectro de excitação do aceptor. A aplicação de hipotonicidade extracelular, um estímulo para a ativação de LRRC8/VRAC, resultou em uma redução reversível na intensidade de SE-FRET45. É importante ressaltar que as medições simultâneas de patch-clamp de células inteiras e o monitoramento de FRET durante o tratamento hipotônico mostraram que essa redução no FRET de fato refletiu a ativação de LRRC8 / VRAC45. Este método, que evita a ruptura da membrana plasmática ou a alteração do ambiente intracelular pela solução de pipeta, oferece uma alternativa para monitorar a atividade do LRRC8/VRAC. É particularmente útil em ambientes fisiológicos onde a manutenção do citosol nativo é crucial, a resolução subcelular é necessária ou a observação prolongada da atividade do canal é necessária.
Aqui, apresentamos um protocolo para estudar LRRC8 / VRAC com essa leitura baseada em FRET. O protocolo descreve como manusear e transfectar células, adquirir amostras e imagens de controle, analisar os dados e calcular os valores de FRET (SE-FRET) de emissão sensibilizada.
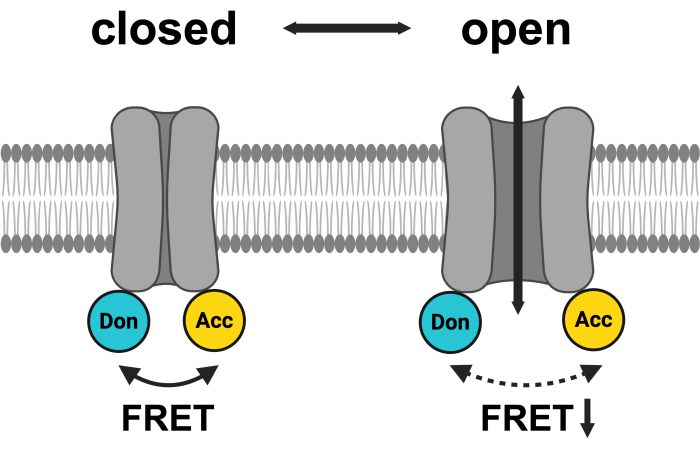
Figura 1: Esquema do sistema de pares LRRC8 FRET. mCerulean3 é mostrado em ciano, e mVenus é mostrado em amarelo. Após a abertura do VRAC, a distância (e/ou a orientação espacial) entre os fluoróforos muda, resultando em uma transferência de energia reduzida entre o doador (Don) e o aceitador (Acc) e, por sua vez, diminuindo o FRET observado. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparação de tampão e reagentes
- Prepare tampões médios e isotônicos, hipotônicos e hipertônicos e meça a osmolaridade dos tampões com um osmômetro para garantir que a osmolaridade (Osm) esteja na faixa esperada com apenas um desvio aceitável.
- Meios de cultura celular: Prepare o meio de águia modificado de Dulbecco (DMEM) suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina/estreptomicina
- Tampão de imagem isotônico (~ 340 mOsm): Prepare o tampão de imagem isotônico misturando 150 mM de NaCl, 6 mM KCl, 1 mM MgCl2, 1,5 mM CaCl2, 10 mM D(+)-glicose e 10 mM de ácido 4-(2-hidroxietil)-1-piperazina etano sulfônico (HEPES).
- Tampão de imagem hipotônico (~ 250 mOsm): Prepare o tampão de imagem hipotônico misturando 105 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1,5 mM CaCl2, 10 mM D(+)-Glicose e 10 mM HEPES.
- Tampão de imagem hipertônico (~ 500 mOsm): Prepare o tampão de imagem hipertônico misturando 160 mM D(-)-Manitol, 150 mM NaCl, 6 mM KCl, 1 mM MgCl2, 1,5 mM CaCl2, 10 mM D(+)-Glicose e 10 mM HEPES.
NOTA: Os tampões podem ser complementados com medicamentos específicos, dependendo do que será investigado.
2. Crescimento de células aderentes em placas com fundo de vidro
- Prepare pelo menos uma placa para transfecção apenas com a proteína de interesse (POI) fundida ao fluoróforo doador ou aceptor e pelo menos uma placa para transfecção com o par doador e aceitador (Tabela 1 e Figura 2). Use pratos com fundo de vidro para permitir a microscopia de fluorescência. Dependendo do tipo de célula, pré-trate a superfície com limpeza especial ou revestindo-a com polilisina.
NOTA: Aqui, o doador FRET mCerulean3 (mCer)54 e o aceptor FRET mVenus (mVen)55 são usados como par FRET, mas outras combinações de fluoróforos também são aplicáveis. A amostra que expressa o POI fundido ao doador ou aceitador sozinho é usada para determinar os fatores de correção β e γ (Tabela 1) necessários para corrigir o sangramento do doador no canal aceptor e a excitação cruzada do aceptor pelo comprimento de onda de excitação do doador (Figura 2Ac, Bf). - No dia anterior à transfecção, semear 1 x 105 células HeLa em 2 mL de meio de cultura celular em placas de 35 mm com fundo de vidro adequado para microscopia de fluorescência. Cultive células durante a noite a 37 °C e 5% de atmosfera de CO2 em uma incubadora de cultura de células.
NOTA: Os volumes de reagentes podem ser adaptados à área de superfície de outras placas/frascos de cultura de células com um tamanho diferente. O número de células pode ser adaptado a uma densidade adequada para diferentes linhagens celulares e abordagens experimentais.- Aspirar o sobrenadante da cultura de células da monocamada de células aderentes cultivadas em frascos de cultura de células T75 utilizando uma bomba de vácuo.
- Lave as células adicionando 10 mL de solução salina tamponada com fosfato de Dulbecco (DPBS) ao frasco de cultura de células e aspirando a solução posteriormente com uma bomba de vácuo.
- Cubra as células completamente com 1mL de tripsina-EDTA a 0,05% e incube as células por 2 min a 37 °C e atmosfera de CO2 a 5% em uma incubadora de cultura de células.
- Adicione 9 mL de meio de cultura celular e suspenda as células pipetando.
- Transfira a suspensão celular para um tubo de 15 mL e centrifugue a 700 x g por 3 min em temperatura ambiente (RT).
- Aspirar o sobrenadante com uma bomba de vácuo e ressuspender o sedimento celular em 10 ml de meio de cultura celular.
- Misture volumes iguais de suspensão celular e 0,4% de azul de tripano em um tubo e adicione 10 μL a uma lâmina de contagem. Coloque a corrediça no contador de células automatizado e comece a contar usando o programa apropriado para contagem de células.
- Para calcular o volume de suspensão celular necessário para cada prato, divida o número de células necessárias por prato (1 x 105) pelo número de células por mililitro obtido no contador de células.
- Preparar uma suspensão celular num tubo adequado contendo o número de células necessárias por placa no volume necessário por placa (2 ml) mais a quantidade para uma placa extra.
- Misturar a suspensão celular pelo menos 20 vezes invertendo o tubo e pipetar 2 ml da suspensão celular em cada prato.
- Para garantir uma distribuição celular mais uniforme, deixe as placas por 30 min em RT antes de colocá-las na incubadora de cultura de células.
3. Transfecção celular
NOTA: Aqui, FuGENE foi usado como reagente de transfecção. Outros reagentes e métodos de transfecção também são aplicáveis. As proporções ideais de DNA de plasmídeo (pDNA) para reagentes de transfecção e o tempo para expressão ideal para cada POI e modelo de célula precisam ser avaliados empiricamente. Aqui, 2 μg de pDNA total por placa de 35 mm foram usados. As construções doadoras e aceitadoras de FRET foram usadas na proporção de 1:1, e a proporção de pDNA-reagente para transfecção foi de 1:4 (Tabela 1).
- Antes da transfecção, substitua o sobrenadante da cultura de células por 2 mL frescos de meio pré-aquecido.
- Diluir o pDNA em Opti-Minimal Essential Medium (MEM) com um volume final de 100 μL (= solução de pDNA).
- Diluir o reagente de transfecção em Opti-MEM com um volume final de 100 μL (= solução reagente).
NOTA: Para uma transfecção mais uniforme, prepare uma mistura principal para o pDNA e a solução reagente. - Misture bem o pDNA e a solução reagente.
- Adicione a solução de pDNA à solução reagente (= solução de transfecção).
- Misture bem a solução de transfecção.
- Incubar a solução de transfecção por 15 min em RT.
- Adicione a solução de transfecção gota a gota em um movimento espiral ao prato.
- Misture movendo o prato 5 vezes horizontal e verticalmente na superfície da bancada.
- Cultive células durante a noite a 37 °C e 5% de atmosfera de CO2 em uma incubadora de cultura de células.
| Condição | Construto (s) | Amostra | Usado para |
| 1 | LRRC8A-mCerulean | Apenas construção doadora | determinar o fator de correção β |
| 2 | LRRC8E-mVênus | Somente construção do aceitador | determinar o fator de correção γ |
| 3 | LRRC8A-mCerulean e LRRC8E-mVenus | Par FRET | Quantificação SE-FRET |
Tabela 1: Exemplo de condições necessárias para um experimento SE-FRET típico para medir a atividade LRRC8 / VRAC de um canal composto pela subunidade LRRC8A fundida ao doador (mCerulean3) e subunidade LRRC8E fundida ao fluoróforo aceptor (mVenus).
4. Aquisição de imagens para determinação do fator de correção
NOTA: Há um sangramento da emissão do doador na emissão detectada do aceptor durante o FRET. Além disso, há excitação cruzada do fluoróforo aceitador pelo comprimento de onda de excitação do doador. Esses processos devem ser compensados durante o cálculo do SE-FRET. Para este fim, os fatores de correção são determinados em células que expressam apenas o doador ou aceptor de FRET 24 h após a transfecção. Aqui, a imagem foi realizada em um Leica THUNDER Imager equipado com uma lâmpada Leica LED8, o CYR71010 de cubo de filtro, uma objetiva HC PL APO 63x/1.40 OIL, filtro passa-longo para 460/80 e 553/70 e uma câmera Leica DFC9000GTC. Os experimentos foram realizados sem controle ambiental, mas na presença de HEPES nos tampões de imagem para estabilizar o pH. Para observação/medições de longo prazo, é aconselhável usar um sistema de controle ambiental. Para análise, o SE-FRET é calculado a partir das imagens brutas capturadas. Isso pode ser feito simultaneamente durante a aquisição ou depois. Aqui, o software Leica LAS X com o plug-in SE-FRET foi usado para simplificar o procedimento experimental em relação ao cálculo dos fatores de correção e visualizar as alterações do valor SE-FRET em tempo real durante a aquisição da imagem. Para pós-aquisição, os fatores de correção e SE-FRET podem ser determinados com outros pacotes de software (por exemplo, FIJI) após a aquisição de dados brutos de acordo com o protocolo fornecido abaixo.
- Antes da aquisição da imagem de células transfectadas individuais para calcular os fatores de correção, use uma amostra expressando o par FRET para definir a configuração de microscopia para todos os canais (excitação do doador / emissão do doador DD, doador / aceitador DA e aceptor / aceitador AA; consulte a Tabela 1 e a Figura 2C e a Figura 3A).
NOTA: Para medições SE-FRET com subunidades VRAC marcadas com mCerulean3 e mVenus transfectadas conforme descrito acima, os seguintes parâmetros foram usados: binning de pixel 8x8, tempo de exposição de 100ms e intensidade da lâmpada LED de 10%. - Pegue a amostra que expressa apenas a construção do doador (Figura 2A), aspire os meios de cultura celular e lave as células três vezes com 2 mL de tampão isotônico.
- Adicione 3 mL de tampão isotônico e coloque a amostra no microscópio stage.
- Encontre um campo de visão (FOV) com pelo menos uma célula expressando a construção do doador.
- Faça a imagem de todos os canais (DD, DA e AA, consulte a Tabela 2 e a Figura 2A).
- Desenhe uma região de interesse (ROI) ao redor da célula / células e meça a intensidade média de DA (= IDA; Figura 2Ac) e DD (= IDD; Figura 2Aa).
- Para subtração de fundo, desenhe um ROI nos canais DA e DD onde apenas o sinal de fundo é encontrado e meça a intensidade média (IBDA e IBDD).
- Subtraia a intensidade média da ROI de fundo da intensidade média medida na ROI da célula do canal correspondente (
 e
e 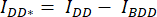 ).
). - Repita as etapas 4.2 a 4.5 com a amostra expressando apenas a construção do aceitador (Figura 2B).
- Desenhe um ROI ao redor da(s) célula(s) e meça a intensidade média de DA (= IDA; Figura 2Bf) e AA (= IAA; Figura 2Be).
- Para subtração de fundo, desenhe um ROI nos canais DA e AA onde apenas o sinal de fundo é encontrado e meça as intensidades médias (IBDA e IBAA).
- Subtraia a intensidade média da ROI de fundo da intensidade média medida na ROI da célula do canal correspondente (
 e
e 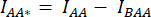 ).
). - Utilizar os valores determinados para IDA*, IDD* e IAA* para calcular os fatores
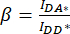 de correção e
de correção e 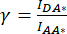 ,
,
Em que o fator de correção β é usado para compensar o sangramento da emissão do doador no canal DA. O fator de correção γ é usado para compensar a excitação cruzada do fluoróforo aceptor pelo comprimento de onda de excitação do doador no canal DA.
| Excitação de | Emissão de | Nome do canal | Linha LED | Cubo de filtro | Filtro passa-longo |
| Doador | Doador | DD | 440 nm | CYR71010 | 460/80 de nanômetro |
| Doador | Aceitador | DA | 440 nm | CYR71010 | 535/70 de nanômetro |
| Aceitador | Aceitador | AA | 510 nm | CYR71010 | 535/70 de nanômetro |
Tabela 2: Resumo dos canais necessários para experimentos SE-FRET.
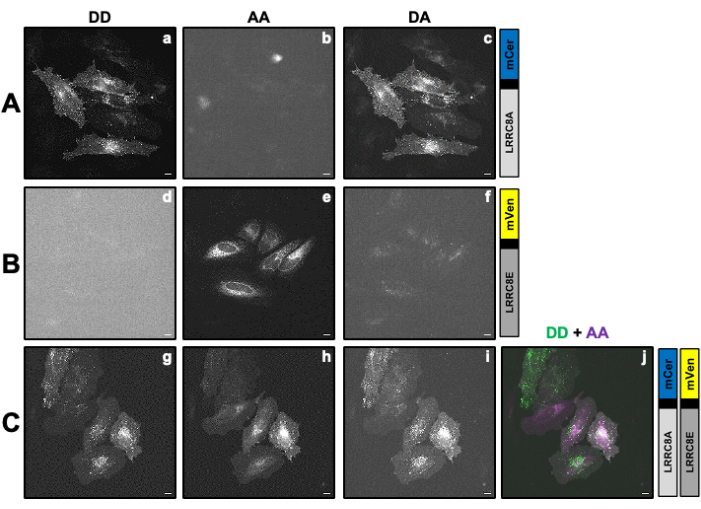
Figura 2: Imagens de fluorescência representativas de amostras usadas para calcular os fatores de correção β e γ necessários para determinar a atividade VRAC de um canal composto pela subunidade LRRC8A fundida ao doador mCerulean3 (mCer) e subunidade LRRC8E fundida ao fluoróforo aceptor mVenus (mVen) por medições SE-FRET. (A, B) Detecção do doador/doador DD, aceptor/aceitador AA e canal DA doador/aceitador em células HeLa expressando apenas o doador (A) LRRC8A-mCer ou o aceptor (B) LRRC8E-mVen. (C) Detecção de canais DD, AA e DA em células HeLa co-transfectadas com o par doador e aceitador LRRC8A-mCer e LRRC8E-mVen. Os painéis a-i mostram imagens tiradas no canal de detecção do doador (excitação do doador e detecção do sinal do doador; DD; a, d e g), o canal de detecção do receptor (excitação do receptor e detecção do sinal do receptor; AA; b, e e h ) e o canal de detecção do sinal FRET (excitação do doador e detecção do sinal receptor; DA; c, f e i). O painel j é a sobreposição dos painéis g e h. O canal DD é mostrado em verde e o canal AA em magenta. Barra de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
5. Imagem de lapso de tempo para quantificação SE-FRET
- Pegue a amostra que expressa a construção doadora e aceptora (Tabela 1, Figura 2C e Figura 3A), aspire os meios de cultura celular e lave as células três vezes com 2 mL de tampão isotônico 24 h após a transfecção.
- Adicionar 3 ml de tampão isotónico e colocar a amostra na fase de microscopia.
- Para posterior aspiração do tampão isotônico, fixe e ajuste uma cânula de mangueira de modo que a ponta da cânula atinja o fundo do prato.
- Para adicionar amortecedores, fixe e ajuste os tubos para que o amortecedor acionado pelo fluxo gravitacional possa cair no prato.
NOTA: Aqui, foi usado um sistema de perfusão por gravidade controlado por válvula com quatro válvulas magnéticas para controlar o fluxo do tampão, mas outros métodos também são aplicáveis. - Encontre um FOV com pelo menos uma célula expressando a construção do doador e do aceitador simultaneamente.
- Configure um experimento de lapso de tempo para os canais DD, DA e AA com um intervalo de 10 s e uma duração para cobrir todas as condições da sequência de estimulação, por exemplo, 12 ciclos de linha de base seguidos por 15 ciclos por condição (Figura 3).
NOTA: O intervalo e o número de ciclos podem ser adotados de acordo com as necessidades experimentais, mas devem sempre incluir uma medição de linha de base para normalização para melhor visualização e comparação dos dados. - Após a medição inicial, lave a amostra no tampão para a primeira condição.
- Aspirar o tampão isotónico através da cânula da mangueira, aplicando um vácuo com uma seringa.
- Adicione 3 mL do tampão da próxima condição por fluxo por gravidade.
- Aspire o tampão e adicione novamente 3 mL do mesmo tampão.
- Repita a etapa 5.7.3 mais uma vez.
- Após a medição da primeira condição, lave a amostra no tampão para a próxima condição (etapas 5.7.1-5.7.4).
- Repita as etapas 5.5 a 5.8 até que todas as condições sejam capturadas.
- Para quantificação SE-FRET, desenhe um ROI ao redor da célula / células e meça a intensidade média no canal DD = (IDD), DA (IDA) e AA (IAA) para todas as imagens (pontos de tempo) na série temporal (Figura 3A, B).
- Para subtração de fundo para o sinal FRET, desenhe um ROI no canal DA onde apenas o sinal de fundo é encontrado e meça a intensidade média (IBDA).
- Subtraia a intensidade média da ROI de fundo da intensidade média medida na ROI da célula do canal DA (
 ).
). - Use os valores determinados para calcular os valores médios de SE-FRET para cada ROI e todos os pontos
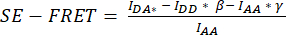 de tempo.
de tempo. - Para melhor comparabilidade de diferentes condições e visualização dos valores SE-FRET, use a média dos valores de linha de base de cada ROI para normalizar todos os pontos de tempo do ROI correspondente.
- Plote os valores SE-FRET normalizados ao longo do tempo (Figura 3B).
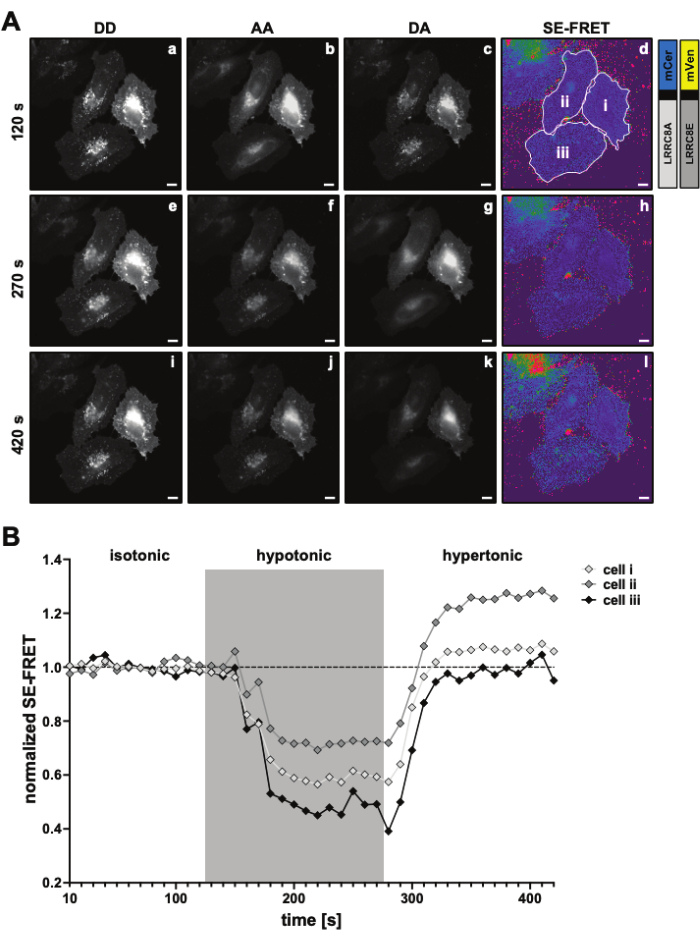
Figura 3: Imagens de fluorescência representativas e quantificação SE-FRET. (A) Imagens de fluorescência representativas e o SE-FRET aparente do primeiro ponto de tempo de um experimento de lapso de tempo para medir a atividade VRAC por SE-FRET de um canal composto pelas subunidades LRRC8A e LRRC8E, dependendo da tonicidade. Barra de escala = 10 μm. As mesmas células são mostradas na Figura 2C. Os painéis a-i mostram a detecção dos canais DD, AA e DA e o SE-FRET aparente calculado. Os contornos brancos representam as ROIs (células i-iii no painel d) usadas para medir as intensidades médias do sinal em DD, AA e DA e a imagem SE-FRET aparente. (B) Quantificação dos valores SE-FRET ao longo do tempo. A sequência de condições foi de 12 ciclos de tampão de imagem isotônico (linha de base) seguidos por 15 ciclos de tampão de imagem hipotônico e 15 ciclos de tampão de imagem hipertônico. O valor médio bruto de SE-FRET de cada ROI (células i-iii) e ponto de tempo foi normalizado para a média do valor da linha de base (isotônico) para o ROI correspondente. Clique aqui para ver uma versão maior desta figura.
Resultados
Com este método baseado em FRET, a atividade LRRC8 / VRAC pode ser monitorada durante a estimulação osmótica, e a redução no SE-FRET se correlaciona com o grau de hipotonicidade extracelular45. Resultados representativos para a ativação do canal induzida por hipotonicidade também são mostrados aqui (Figura 3 e Figura 4). Além disso, a ativação de LRRC8/VRAC por diferentes estímulos isosmóticos, como a manipulação da sinalização de diacilglicerol45 ou durante a ativação de miócitos56, pode ser observada.
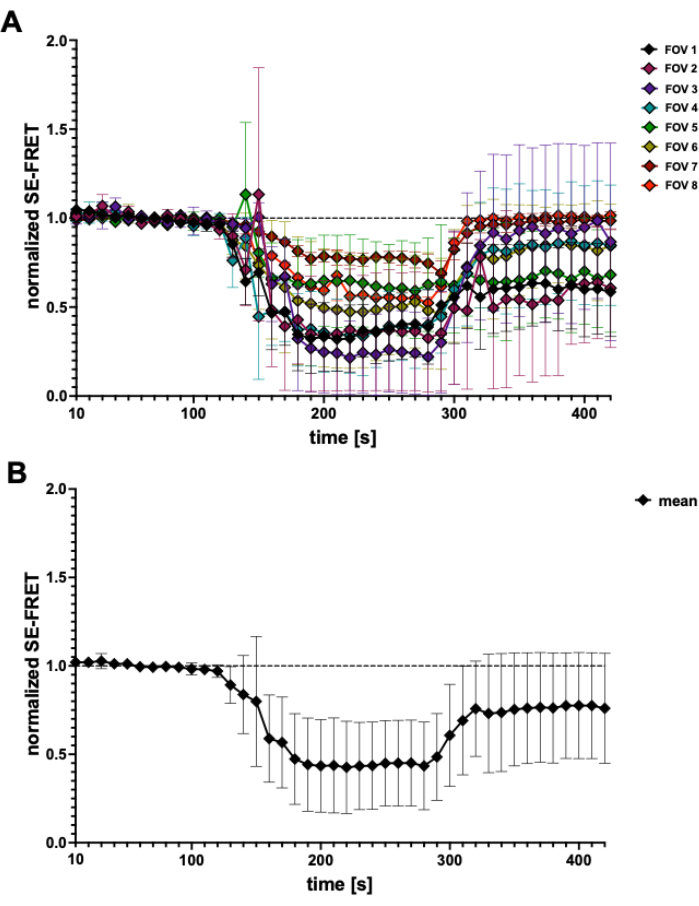
Figura 4: Traços SE-FRET. (A) Traços SE-FRET aparentes de 5 experimentos independentes. Os dados representam ± DP médio de N = 2 a N = 7 células por campo de visão (FOV). (B) DP médio ± de todas as células (N = 31 células). Clique aqui para ver uma versão maior desta figura.
Como os canais LRRC8 / VRAC também estão envolvidos na diminuição do volume apoptótico24,57, observar a atividade do canal na indução da apoptose seria outra aplicação para o método aqui descrito. Assim, o protocolo para monitorar SE-FRET em células HeLa que expressam LRRC8A-mCerulean3 e LRRC8E-mVenus foi realizado durante a aplicação de drogas indutoras de apoptose mediadas por receptor de morte. O fator de necrose tumoral (TNF)-α e a cicloheximida (CHX) demonstraram evocar correntes VRAC em poucos minutos58. Após a adição de 2 ng/mL de TNF-α e 1 μg/mL de CHX no tampão isotônico, houve uma diminuição robusta no SE-FRET (Figura 5). Substituindo o tampão por um meio hipertônico, embora contendo TNF-α e CHX, os valores de SE-FRET se recuperaram próximos da linha de base (Figura 5A), correspondendo à diminuição das correntes VRAC na solução de banho hipertônico durante o tratamento com ligante Fas indutor de apoptose58. O tratamento das células com DMSO, o solvente para TNF-α e CHX, não resultou em redução de SE-FRET. TNF-α + CHX não afetou SE-FRET de CFP-18aa-YFP, uma construção em tandem EYFP e ECFP como controle FRET59, demonstrando a especificidade para LRRC8 / VRAC ( Figura 5B ).
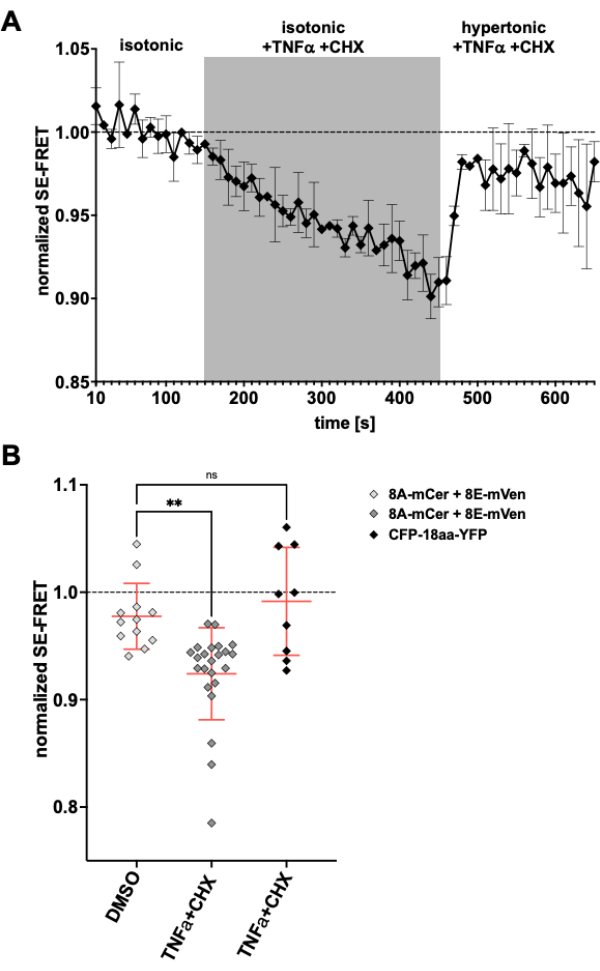
Figura 5: Ativação isosmótica de VRAC por apoptose mediada por receptor de morte. (A) Valores SE-FRET normalizados de células HeLa que expressam LRRC8A-mCer / LRRC8E-mVen (n = 8 pratos, 23 células) ao longo do tempo. Após 15 ciclos em tampão de imagem isotônico (linha de base), a solução de banho foi substituída por tampão isotônico suplementado com 2 ng/mL de TNF-α e 1 μg/mL de cicloheximida (CHX) por 30 ciclos, seguidos por 20 ciclos de tampão de imagem hipertônico com TNF-α e CHX. O valor médio bruto de SE-FRET de cada ROI e ponto de tempo foi normalizado para a média do valor basal (isotônico) para o respectivo ROI. (B) Quantificação de valores SE-FRET normalizados de células HeLa que expressam LRRC8A / E como em A com solução isotônica contendo DMSO como controle veicular para CHX (n = 5 pratos, 12 células) ou tampão isotônico contendo indutores de apoptose como em A (n = 8 pratos, 23 células), ou de células HeLa expressando CFP-18aa-YFP com indutores de apoptose (n = 3 pratos, 9 células). Os dados representam a média dos últimos 10 pontos no tempo no respetivo buffer de células individuais (símbolos) e a média de todas as células ± SD; ** p < 0,01 ANOVA ordinária de uma via seguida do teste post-hoc de comparação múltipla de Tukey. Clique aqui para ver uma versão maior desta figura.
Discussão
A microscopia FRET é uma técnica bem estabelecida e amplamente utilizada para estudar a interação entre proteínas. Portanto, os métodos baseados em FRET podem ser aplicados em muitos laboratórios de especialização variável. Os rearranjos conformacionais durante o gating foram monitorados para uma ampla gama de canais iônicos usando ensaios baseados em FRET (por exemplo, consulte as referências 34,50,51,52,53,60,61,62,63,64,65,66,67), em alguns casos associada à eletrofisiologia na fluorometria patch-clamp 68,69,70,71. O FRET pode ser usado para estudar as relações estrutura-função desses canais iônicos ou para monitorar sua atividade independentemente do transporte de íons. O método aqui apresentado pode ter vantagens claras sobre a eletrofisiologia, pois permite o monitoramento da atividade dos canais LRRC8 / VRAC in situ.
As etapas críticas do protocolo incluem o revestimento das células para alcançar a confluência ideal para transfecção e imagem, o que idealmente facilita a fácil distinção celular para análise posterior. A co-transfecção eficaz das diferentes subunidades é crucial para a correta localização subcelular; por exemplo, um excesso da subunidade não-LRRC8A levará a uma localização aprimorada do retículo endoplasmático (RE)4. Portanto, as proporções de plasmídeo podem precisar ser ajustadas. Dependendo do sistema, os pares FRET recém-gerados devem ser verificados, por exemplo, por branqueamento do aceitador. O binning e o tempo de exposição devem ser equilibrados entre si para permitir uma resolução temporal e espacial ideal para a questão de pesquisa. O binning permite tempos de exposição mais curtos e, portanto, reduz o branqueamento potencial do sensor FRET enquanto diminui a resolução espacial. Portanto, se a configuração experimental exigir, por exemplo, discriminação subcelular da atividade LRRC8 / VRAC, o binning deve ser evitado. A questão de pesquisa determina igualmente o número e o intervalo de ciclos em uma série de lapso de tempo. O intervalo só é relevante se a cinética das mudanças de FRET (e, portanto, a ativação/inativação de LRRC8/VRAC) for necessária; caso contrário, gravações simples de "antes e depois" também podem ser realizadas. A duração do experimento depende do processo fisiológico. Idealmente, a atividade LRRC8 / VRAC sobre estímulos deve ser monitorada até que SE-FRET tenha se estabilizado. Esses fatores podem ser determinados em experimentos piloto. Os fatores de correção para calcular o sinal SE-FRET real devem ser determinados para todas as condições. Fatores de correção determinados incorretamente podem levar a uma superestimação ou subestimação das intensidades SE-FRET. Por fim, depois de estabelecer uma linha de base estável, o intervalo de tempo entre as imagens deve ser curto o suficiente para capturar o processo fisiológico de interesse.
O método apresenta algumas limitações. Uma delas é que as mudanças nas intensidades de FRET inter-LRRC8, embora reflitam os movimentos dos LRRDs, não correspondem necessariamente ao transporte de íons ou osmólitos através do poro. Isso fica claro nas mudanças de FRET observadas com os homômeros LRRC8A45, apesar de suas correntes mínimas 4,32,72. Os bloqueadores de poros dos canais LRRC8/VRAC podem não afetar o sinal FRET, tornando este método inadequado para a busca de moduladores de canal específicos. Além disso, os níveis de expressão das proteínas LRRC8 superexpressas podem afetar os processos fisiológicos observados, especialmente porque as proteínas LRRC8 marcadas com C-terminal exibem atividade basal14.
Um aspecto que pode ser considerado uma limitação ou uma vantagem, dependendo da questão de pesquisa específica, é que, neste método, apenas as subunidades LRRC8 expressas ectopicamente são medidas seletivamente. Portanto, os níveis de fundo de proteínas endógenas dificilmente interferem nas medições. Por outro lado, as proteínas superexpressas podem não se comportar como os canais endógenos de LRRC8 com composição de subunidade e estequiometria potencialmente diferentes. Por exemplo, vários estímulos, como a oxidação, podem ter efeitos modulatórios opostos em canais LRRC8 compostos de forma diferente36. Ao alterar as proporções entre as subunidades co-expressas, sua estequiometria e condutância geral de íons podem ser ajustadas 14,73, mas sua composição nativa, com provavelmente mais de dois parálogos dentro de um complexo21, não é clara e pode variar entre os tipos de células 74,75,76. Além disso, a fusão de proteínas fluorescentes com os terminais C citosólicos das proteínas LRRC8 demonstrou aumentar a atividade do canal basal LRRC8 / VRAC em oócitos Xenopus 14, provavelmente porque as grandes marcas modulam a conformação dos LRRDs, o que pode governar a abertura do canal14 , 44 , 45. Portanto, o tamanho das proteínas fluorescentes, o ligante e sua orientação podem não apenas afetar a eficiência do FRET, mas também a atividade do canal. No entanto, é importante ressaltar que os canais VRAC das proteínas LRRC8 fundidas com proteínas fluorescentes permaneceram responsivos à estimulação hipotônica14, permitindo seu uso como sensores FRET45.
As vantagens deste método não invasivo para monitorar a atividade do canal LRRC8 / VRAC por microscopia de luz em comparação com outros métodos incluem: (i) Permite observar LRRC8 / VRAC dentro de células ou compartimentos normalmente inacessíveis para eletrofisiologia. Isso inclui organelas intracelulares nas quais os complexos LRRC8 podem ser encontrados ou direcionados para 45,77,78. (ii) A composição citosólica permanece inalterada pelo método, enquanto durante as medições de patch-clamp de células inteiras, o citosol é amplamente substituído por solução de pipeta, o que pode afetar as vias de sinalização, conforme observado com a ativação LRRC8 / VRAC induzida por forbol-12-miristato-13-acetato (PMA)45. (iii) Oferece a possibilidade de observar a ativação do LRRC8 / VRAC com resolução subcelular, como distinguir a atividade nas bordas de ataque e fuga durante a migração celular, onde - restrito a espaços confinados - o VRAC foi implicado79,80. (iv) Permite o monitoramento contínuo da atividade LRRC8 / VRAC durante processos fisiológicos prolongados, como a diferenciação de miócitos56.
Embora existam limitações e desafios com esse método, ele promete uma exploração mais aprofundada, incluindo aplicações potenciais em modelos animais. Em combinação com outros métodos para estudar esta família de canais de íons e osmólitos, este ensaio baseado em FRET pode contribuir significativamente para desvendar os mecanismos de ativação e explorar as diversas funções fisiológicas dos canais LRRC8 em seus ambientes nativos.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos a C.F. Kaminski pelo gentil presente do plasmídeo que codifica a construção CFP-18aa-YFP, a A. Klemmer pela assistência técnica e a todos os membros atuais e antigos do laboratório Stauber que contribuíram para o desenvolvimento deste método.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
Referências
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367(2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974(2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885(2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461(2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431(2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382(2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532(2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435(2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421(2019).
- Hille, B. Ion Channels of Excitable Membranes. 3rd edn. , Sinauer. Sunderland, Massachusetts. (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896(2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, Suppl 1 S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215(2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118(2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093(2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755(2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108(2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7(2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940(2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879(2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663(2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128(2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados