A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد فرز ناجح لعزل الحويصلة خارج الخلية
In This Article
Summary
يوفر هذا البروتوكول وصفا تفصيليا لفرز الحويصلات خارج الخلية (EVs) التي تطلقها الخلايا اللحمية الوسيطة. على وجه الخصوص ، يركز على إعداد الأداة وتحسين ظروف الفرز. الهدف هو فرز الحويصلات خارج الخلية مع الحفاظ على خصائصها.
Abstract
تحتوي الحويصلات خارج الخلية (EVs) التي تطلقها الخلايا اللحمية المتوسطة (MSCs) على مجموعة من الحمض النووي الريبي الصغير ذات الأدوار التجديدية والمضادة للالتهابات. لذلك ، يتم تصور MSC-EVs المنقاة كخيار علاجي من الجيل التالي لمجموعة واسعة من الأمراض. في هذا البروتوكول ، نبلغ عن استراتيجية الفرز الناجح للمركبات الكهربائية من الطاف للخلايا الجذعية الجذعية المشتقة من الدهون (ASCs) ، والتي غالبا ما تستخدم في تطبيقات الطب التجديدي لجراحة العظام.
أولا ، وصفنا تحضير العينة ، مع التركيز على خطوات عزل EV ووضع العلامات باستخدام إستر الكربوكسي فلوريسين السكسينيميديل (CFSE) للكشف عن التألق. بعد ذلك ، قمنا بتفصيل عملية الفرز ، والتي تشكل الجزء الرئيسي من البروتوكول.
بالإضافة إلى القواعد المحددة في إرشادات MISEV 2023 و MIFlowCyt EV ، قمنا بتطبيق شروط تجريبية محددة فيما يتعلق بحجم الفوهة وترددها وضغط الغمد. يتم إنشاء المعلمات المورفولوجية باستخدام حبات من الأقطار المختارة لتغطية النطاق النظري لحجم EV. بعد فرز ASC-EVs ، أجرينا فحصا للنقاء للجزء الذي تم فرزه عن طريق إعادة تحليله باستخدام الفرز والتحقق من توزيع حجم EV باستخدام تقنية تحليل تتبع الجسيمات النانوية.
نظرا للأهمية المتزايدة للمركبات الكهربائية ، أصبح وجود سكان نقيين للدراسة والتوصيف أمرا بالغ الأهمية. هنا ، نعرض استراتيجية الفائز لإعداد الفرز لتحقيق هذا الهدف.
Introduction
الحويصلات خارج الخلية (EVs) هي مجموعة غير متجانسة من الحويصلات ذات البنية الغشائية التي تطلقها جميع الخلايا تقريبا ، محددة بطبقة ثنائية الدهون ، غير قادرة على التكاثر من تلقاءنفسها 1. يمكن العثور عليها في العديد من السوائل الحيوية مثل بلازما الدم ، والمصل ، واللعاب ، وحليب الثدي ، والبول ، وغسل الشعب الهوائية ، والسائل الأمنيوسي ، والسائل النخاعي ، والاستسقاء الخبيث2. تتمثل إحدى الوظائف الرئيسية للمركبات الكهربائية في نقل الجزيئات المختلفة ، بما في ذلك الأحماض النووية والبروتينات والدهون والكربوهيدرات ، بين الخلية المانحة والخلية المتلقية. يمكن أن يحدث هذا من خلال آليات مختلفة ، مثل الاندماج الغشائي المباشر ، وتفاعل المستقبلات والترابط ، والالتقام الخلوي ، والبلعمة3،4. لهذا السبب ، ثبت أنها تلعب دورا مهما في الكثير من العمليات الفسيولوجية والمرضية ، وتظهر وعدا كبيرا كمؤشرات حيوية جديدة للمرض ، وكوسائل توصيل الأدوية ، وكعوامل علاجية5،6.
الخلايا اللحمية الوسيطة (MSCs) هي خلايا متعددة القدرات يمكن عزلها عن العديد من الأنسجة ، بما في ذلك الأنسجة الدهنية ، ولب الأسنان ، ودم الحبل السري ، والمشيمة ، والسائل الأمنيوسي ، وهلام وارتون ، وحتى الدماغ والرئة والغدة الصعترية والبنكرياس والطحال والكبد والكلى. في السنوات الأخيرة ، اجتذبوا اهتماما كبيرا بالطبالتجديدي 7. يمكن حصاد الخلايا الجذعية الوسيطة المشتقة من الدهون (ASCs) من الأنسجة الدهنية من خلال إجراء أقل توغلا مقارنة بالمصادر الأخرى مثل نخاع العظام ، مما يؤدي إلى تقليل مخاطر المضاعفات الشديدة وتجنب المشكلاتالأخلاقية 8.
بالإضافة إلى ذلك ، تحتوي الأنسجة الدهنية على تركيز أعلى بكثير من الخلايا الجذعية الجذعية مقارنة بنخاع العظم (1٪ مقابل >0.01٪) ومصادر أخرى مثل الأدمة ولب الأسنان والحبل السري والمشيمة. تعتبر الخلايا الجذعية الجذعية ضرورية في تجديد الأنسجة والخلايا المصابة بسبب قدرتها على التمايز وإفرازها لذخيرة واسعة من عوامل النمو والكيموكينات والسيتوكينات. تعزى هذه الفوائد العلاجية إلى قدرتها على التمايز ولكن أيضا إلى حقيقة أنها تفرز ذخيرة واسعة من عوامل النمو والكيموكينات والسيتوكينات. يتم إعطاء مثال صارخ من خلال الإمكانات العلاجية ل MSCs لحالات العظام ، مع مصطلح "أمراض الجهاز العضلي الهيكلي" الذي يحتوي على أكبر عدد من الدراسات السريرية المسجلة في clinicaltrials.gov (تم الوصول إليه في 13مايو 2024).
علاوة على ذلك ، يمكن للخلايا الجذعية الجذعية أيضا إفراز المركبات الكهربائية التي تشارك في تجديد الأنسجة عن طريق نقل المعلومات إلى الخلايا أو الأنسجة التالفة وممارسة نشاط بيولوجي مشابه للخلايا الأم9،10. لهذا السبب ، قد تكون MSC-EVs بديلا قيما للعلاج الخلوي لتحقيق نهج خال من الخلايا11 ، مع دراستين سريريتين تتضمنان MSC-EVs لحالات العظام (NCT05261360 و NCT04998058). ومع ذلك ، لا تزال هناك العديد من التحديات للتطبيقات السريرية للمركبات الكهربائية. على سبيل المثال ، هناك بعض المخاوف بشأن تقنيات عزل المركبات الكهربائية: معظمها لا يضمن نقاء الحويصلة أو سلامتها. علاوة على ذلك ، فإن بعض تقنيات العزل معقدة وتستغرق وقتا طويلا وذات قابلية تكرار منخفضة ، مما يجعلها غير مناسبة للاستخدام السريري12.
من ناحية أخرى ، يعد فرز الخلايا طريقة شائعة الاستخدام تسمح بعزل الخلايا المفردة عن معلقات الخلايا غير المتجانسة باستخدام علامات فلورية محددة13. يمكن استخدامه للعديد من التطبيقات وتكييفه مع أنواع العينات المختلفة. ومع ذلك ، على الرغم من أن فرز الخلايا هو تقنية راسخة ومستخدمة على نطاق واسع ، إلا أن فرز المركبات الكهربائية لا يزال يمثل تحديا كبيرا لأن معظم المركبات الكهربائية أقل من الحد الأدنى من عتبة الكشف حتى لمقاييس التدفق الخلوي الأكثر حساسية. هناك بعض الميزات التي تجعل الفرز أكثر ملاءمة لهذا الغرض. بادئ ذي بدء ، باستخدام نظام Jet-in-air حيث يتم استجواب التيار المعلق للجسيمات بواسطة الليزر في الهواء ، بدلا من خلية التدفق. يحافظ هذا النظام على العينة عن طريق تقليل الضغط الذي تتعرض له. النقطة الثانية المهمة هي وجود شريط "التعتيب" بين الدفق وعدسة التجميع التي تقلل من الضوضاء البصرية في الخلفية للأداة. على الرغم من أنها منخفضة ، إلا أن ضوضاء الخلفية لا يتم التخلص منها تماما وتشكل مرجعا يوفر نافذة جزئية للأحداث التي تقع تحت العتبة: من المهم جدا تحليل الأحداث القريبة من "حد الكشف" للأداة14. أخيرا ، يتميز الفرز ب Scatter الأمامي ثنائي المسار (FSC) مع قناعين مختلفين يسمحان بتحسين التمييز بين الجسيمات الصغيرة والكبيرة في العينة.
بناء على ذلك ، قمنا بتطوير بروتوكول يهدف إلى فصل كربوكسي فلوريسين إستر السكسينيميديل (CFSE) المسمى MSC-EVs باستخدام فارز خلايا عالي الحساسية. لتقليل التلاعب بالمركبات الكهربائية والحفاظ على سلامتها وكميتها، تجنبنا خطوات الطرد المركزي الفائق أثناء تحضير العينة. علاوة على ذلك ، تم تعديل ظروف الفرز لتقليل الضغط على الحويصلات ، بما في ذلك التحسين الإضافي لأداتنا عن طريق تقليل ضغط الفرز المرتبط بحجم الفوهة (فوهة 70 ميكرومتر لضغط 35 رطل لكل بوصة مربعة).
Access restricted. Please log in or start a trial to view this content.
Protocol
يتكون البروتوكول هنا من أربعة أجزاء: (1) تحضير العينة ، (2) توصيف ASC-EVs ، (3) فرز ASC-EVs ، و (4) تحليل ما بعد الفرز. يظهر مخطط يمثل سير العمل في الشكل 1.
الشكل 1: مخطط تدفق البروتوكول. يوضح المخطط الانسيابي الخطوات المتضمنة في البروتوكول. (1) تحضير العينة ، (2) توصيف الحويصلات قبل الفرز ، (3) الفرز ، و (4) تحليل الحويصلات بعد الفرز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تحضير العينة
- مجموعة الحويصلات خارج الخلية (EV) الطافية الغنية
- قم بإذابة أو جمع الخلايا الجذعية الدهنية (ASCs) التي تم زراعتها في الممر قبل جمع المركبات الكهربائية (عادة ما يكون المرور من 1 إلى 5) والبذور لكل ASC تعزل كمية متطابقة من الخلايا (على سبيل المثال ، 1 مليون خلية لكل 175 سم2 من سطح القارورة تؤدي إلى ما يقرب من 60٪ -70٪ من التقاء).
- قم بزراعة ASCs في وسط الاستزراع المناسب (DMEM-F12 لهذا البروتوكول) مع مصل بقري الجنين الخالي من EV (FBS) أو محللة الصفائح الدموية البشرية (hPL) ، وفقا للبروتوكول المطلوب ، لمدة 48-72 ساعة.
- للحصول على FBS أو hPL خال من EV ، جهاز الطرد المركزي الفائق عند 120,000 × جم طوال الليل عند 4 درجات مئوية واستخدم المادة الطافية.
ملاحظة: من هذه النقطة فصاعدا ، يقصد دائما أن تكون قوة الطرد المركزي المشار إليها متوسطة للأداة والدوار والأنابيب المستخدمة. ضع في اعتبارك أن الدوارات أو الأنابيب المختلفة قد يكون لها قوة g متغيرة لكل دورة في الدقيقة وعامل k. للحصول على طريقة سهلة لمقارنة الدوارات وضبط قوة الجاذبية والسرعة ، راجع أحد جداول التحويل المتاحة https://www.beckman.it/centrifuges/rotors/calculator.
- للحصول على FBS أو hPL خال من EV ، جهاز الطرد المركزي الفائق عند 120,000 × جم طوال الليل عند 4 درجات مئوية واستخدم المادة الطافية.
- عند التقاء الخلايا بنسبة 90٪ ، افصل عد ASCs وعلقها في حجم مناسب من الوسط الخالي من المصل ، من الناحية المثالية 1 مل لكل 1 × 106 ASCs. بذور ASCs معلقة في ألواح 24 بئرا مع 1 مل لكل بئر. بدون مصل ، ستبقى الخلايا معلقة وتشكل كرويا. بعد 96 ساعة ، اجمع المادة الطافية.
- قم بإزالة الخلايا العائمة والحطام عن طريق الطرد المركزي التسلسلي عند 4 درجات مئوية: 400 × جم لمدة 10 دقائق ، و 1,000 × جم لمدة 10 دقائق ، و 2,000 × جم لمدة 10 دقائق ، ومرتين 4,000 × جم لمدة 10 دقائق.
- قم بتصفية المادة الطافية من خلال مرشح 0.22 ميكرومتر لإزالة الجسيمات المتبقية التي يزيد حجمها عن 220 نانومتر.
ملاحظة: استخدم على الفور للتطبيقات النهائية ، أو قم بتخزينها لمدة ليلة واحدة كحد أقصى عند 4 درجات مئوية أو قم بالتجميد عند -80 درجة مئوية إذا لم يتم تنفيذ المزيد من الخطوات في غضون 24 ساعة.
- تلطيخ المركبات الكهربائية للفرز
- تحضير محلول 5 ملي مولار من 5 (6) -كربوكسي فلوريسين ثنائي الأسيتات N-succinimidyl ester (CFSE). استخدمه طازجا أو جمد عند -20 درجة مئوية محمي من الضوء.
- انتقل مباشرة من الخطوة 1.1.1-1.5 (في غضون 24 ساعة) أو ذوبان الجليد -80 درجة مئوية المخزنة المحتوية على المركبات الكهربائية عند 4 درجات مئوية.
- قبل التلوين ، قم بتسخين المواد الطافية عند 37 درجة مئوية وإضافة CFSE للحصول على تركيز نهائي يبلغ 10 ميكرومتر (تخفيف 500 ضعف). احتضن لمدة 1 ساعة عند 37 درجة مئوية في الظلام.
- أثناء الحضانة ، أضف 2 مل من PBS إلى مكثف الطرد المركزي (غشاء السليلوز المتجدد ، MWCO 100 كيلو دالتون) ، والغطاء ، وجهاز الطرد المركزي عند 4,000 × جم لمدة 10 دقائق في دوار دلو متأرجح. قم بإزالة PBS غير المصفى من أسفل جهاز المرشح وشفط المرشح من أنبوب التجميع.
ملاحظة: يعتمد بروتوكول الترشيح الفائق بالطرد المركزي الموضح على معالجة ما يصل إلى 15 مل من العينة (الحد الأقصى للحجم). - أضف ما يصل إلى 15 مل عينة إلى مكثف الطرد المركزي وقم بتغطية الجهاز. جهاز طرد مركزي عند 4,000 × جم لمدة تصل إلى 30 دقيقة.
ملاحظة: سينتج عن ذلك عينة نهائية من 500 ميكرولتر في المتوسط. ومع ذلك ، اعتمادا على عوامل مثل طبيعة العينة ومعدل التدفق ، يمكن أن يختلف وقت الطرد المركزي المطلوب لتحقيق التركيز المطلوب. - قم بإزالة الجهاز من جهاز الطرد المركزي وإفراغ أنبوب التجميع. أضف 14 مل من PBS إلى جهاز التصفية. جهاز طرد مركزي عند 4,000 × جم لمدة تصل إلى 30 دقيقة.
- كرر الخطوة 1.2.6.
- استرجع عينة المركبات الكهربائية المركزة الملطخة ب CFSE من جهاز المرشح ، حوالي 500 ميكرولتر ، وقم بتخزين 100 ميكرولتر عند 4 درجات مئوية في الظلام أثناء متابعة فرز العينة المتبقية.
2. توصيف ASC-EVs
- تحليل اللطخة الغربية لعلامات المركبات الكهربائية
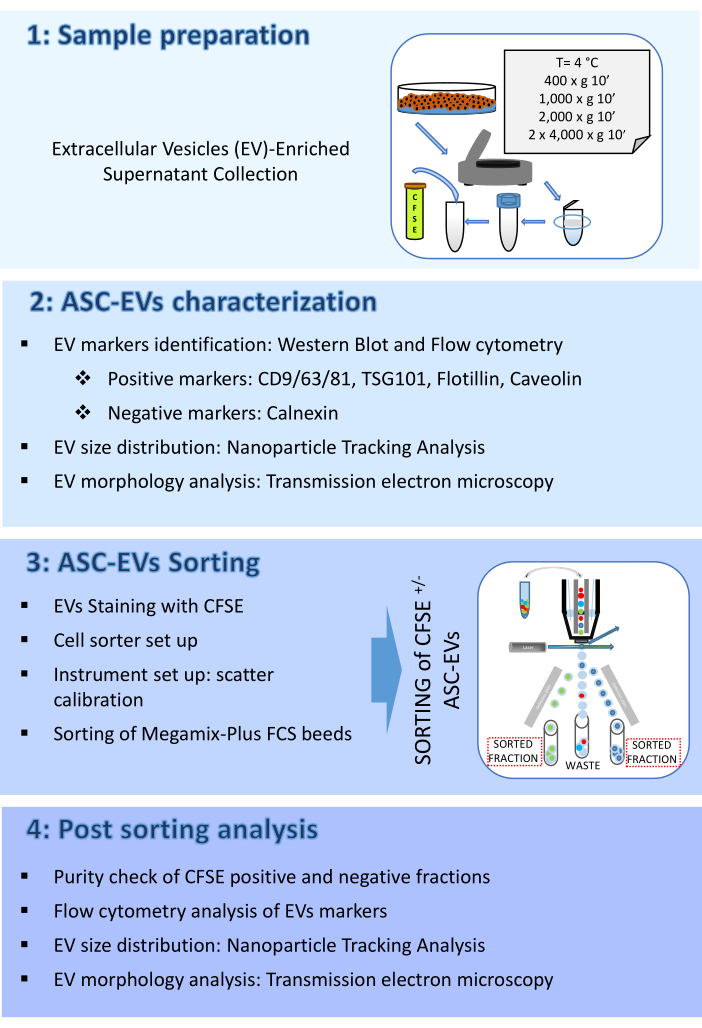
- حبيبات ASCs (1 × 106) عند 376 × جم عند RT لمدة 5 دقائق وتعليقها في مخزن مؤقت مناسب للتحلل مكمل بمثبطات البروتياز. قم بإجراء القياس الكمي للبروتين باستخدام الفحص المفضل.
ملاحظة: كما هو موضح في هذه الدراسة ، يتم الحصول على أفضل نتائج القياس الكمي باستخدام تقنية فحص حمض البيسنشونينيك. - قم بتحديد المادة الطافية المركزة ب ASCs المكافئة ل 1 × 106 ASCs بتقنية برادفورد أو بيليه EVs المقابلة ل 1 × 106 ASCs عند 100,000 × جم عند 4 درجات مئوية لمدة ساعة واحدة وتعليقها في محلول التحلل المناسب المكمل بمثبطات البروتياز. قم بإجراء القياس الكمي للبروتين باستخدام الفحص المفضل.
ملاحظة: كما هو موضح في هذه الدراسة ، يتم الحصول على أفضل نتائج القياس الكمي لحبيبات EV باستخدام تقنية فحص حمض البيسنشونيك. - إذا تم استخدام مادة طافية مركزة بدلا من المركبات الكهربائية المنقاة ، فقم بتحليل العينات في 5٪ 2-Mercaptoethanol و 2x Laemmli.
ملاحظة: كما هو موضح في هذه الدراسة ، فإن كل من المركبات الطافية المركزة والنقية تعطي نتائج قابلة للمقارنة لعلامات المركبات الكهربائية الإيجابية والسلبية. - قم بتحميل وفصل العينات (1-10 ميكروغرام) في هلام بولي أكريلاميد بنسبة 10٪ عند 110 فولت لمدة 90 دقيقة.
- انقله إلى غشاء النيتروسليلوز عند 250 مللي أمبير لمدة 120 دقيقة.
- غشاء البقع مع Ponceau S لتصور العينات ونقل السلم. قم بإزالة Ponceau S مع PBS تحت الاهتزاز اللطيف.
- كتلة الأغشية مع 5٪ حليب مجفف خالي الدسم و 0.1٪ توين في PBS لمدة 60 دقيقة.
- أغشية التحقيق مع الأجسام المضادة المناسبة في التخفيفات العاملة ، بما في ذلك علامات EV الإيجابية (على سبيل المثال ، في هذا العمل CD9 و CD81 و TSG101 و Flotillin) والسلبية (على سبيل المثال ، في هذا العمل Calnexin) EV ، عند 4 درجات مئوية بين عشية وضحاها.
- يغسل مع 0.1٪ Tween في PBS ويحتضن بالأجسام المضادة الثانوية المناسبة المترافقة مع البيروكسيديز لمدة 45 دقيقة في RT قبل أن يكشف النطاق مع نظام ECL المفضل. احصل على الصور باستخدام نظام التصوير المتاح (الشكل 2 أ).
- حبيبات ASCs (1 × 106) عند 376 × جم عند RT لمدة 5 دقائق وتعليقها في مخزن مؤقت مناسب للتحلل مكمل بمثبطات البروتياز. قم بإجراء القياس الكمي للبروتين باستخدام الفحص المفضل.
- تحليل قياس التدفق الخلوي لعلامات EV: تلطيخ السطح
- قبل الاستخدام ، قم بالطرد المركزي لكل جسم مضاد أحادي النسيلة (mAb) عند 15,000-17,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية للتخلص من الركام ، مما قد يسبب إشارات إيجابية خاطئة. علاوة على ذلك ، قم بتصفية mAbs إلى أنابيب مرشح طرد مركزي منفصلة 0.22 ميكرومتر عند 1,000 × جم عند 4 درجات مئوية حتى يمر كل الخليط عبر المرشح ولا يبقى أي سائل للجسم المضاد على سطح المرشح. قم بتخزين mAbs في درجة حرارة 4 درجات مئوية.
- قم بإعداد تخفيف 1:10 من المركبات الكهربائية الملطخة ب CFSE (انظر الخطوة 1.2.1-1.2.8) في PBS مرشح 0.22 ميكرومتر.
- احتضان 100 ميكرولتر من العينات، أو PBS مفلتر بمقدار 0.22 ميكرومتر، مع أو بدون mAbs الخاصة ب EV (مضاد ل CD9/63/81) أو mAbs الخاص ب MSC (مضاد ل CD44)، تم معايرة حجمه مسبقا. قم بإجراء الحضانة عند 4 درجات مئوية في الظلام لمدة 30 دقيقة.
ملاحظة: يمكن توسيع هذا البروتوكول ، الذي تم تطويره للكشف عن المركبات الكهربائية النموذجية وعلامات سلالة MSC ، إلى جميع علامات السطح الخاصة بالنوع الفرعي من سلالات الخلايا أو المركبات الكهربائية الأخرى. لا تستخدم الفلوروكرومات التي تقع في قناة إيزوثيوسيانات الفلوريسئين (FITC) لتجنب التداخل مع تلطيخ CFSE للمركبات الكهربائية. قم بإجراء تلطيخ واحد باستخدام كل مللي أمبير مترافق مع فلوروكروم واحد ، على سبيل المثال ، ألوفيكوسياانين (APC). من الممكن تلطيخ متعدد الألوان ، ولكن يجب تضمين عناصر التحكم لمعالجة مشكلات العوائق الفراغية المحتملة للأجسام المضادة. من الضروري اختبار الأجسام المضادة الفردية بمفردها أو داخل مزيج والتأكد من أن الإشارة قابلة للمقارنة. بالإضافة إلى ذلك ، يجب تضمين FMOs ضمن الضوابط. - قم بإعداد معايرة التبعثر كما هو موضح في الخطوة 3.2.
- قم بإنشاء مخطط نقطي لمقياس سجل التشتت الجانبي (SSC) مقابل مقياس سجل FITC وقم بتشغيل أنبوب من 0.22 ميكرومتر مفلتر إما PBS أو EVs غير ملطخة ؛ قم بتعيين الحد على قناة FITC وضبطه على أعلى القيم التي تستبعد غالبية ضوضاء الخلفية. ارسم منطقة تحدد الأحداث الإيجابية للجنة الأمن الغذائي العالمي.
- قم بإنشاء مخطط رسم بياني APC مسور على منطقة الأحداث الإيجابية CFSE وقم بتشغيل أنبوب من 0.22 ميكرومتر مفلتر إما PBS أو EVs غير ملطخة.
ملاحظة: لكسب APC ، استخدم الكسب الذي تم إنشاؤه باستخدام مراقبة الجودة للأداة ، على الرغم من أنه يوصى بإجراء كسب معين من أجل تحسين أداء الأداة. - أضف 200 ميكرولتر من PBS مفلتر 0.22 ميكرومتر إلى العينات الملطخة واحصل عليها. استخدم معدل تدفق منخفض (10 ميكرولتر في الدقيقة) للاستحواذ والتسجيل. إذا أمكن ، قم بتسجيل ما لا يقل عن 5,000 حدث في البوابة الإيجابية ل FITC.
- استخدم عنصر تحكم PBS الملون ب mAb للكشف عن الإشارات غير المحددة المحتملة ل mAbs. اقرأ جميع أنابيب العينة بنفس معدل التدفق لضمان الاتساق بين عمليات التشغيل.
- لتجنب التلوث المتبادل للعينة ، قم بتشغيل منظف لمدة 10 ثوان بين كل أنبوب تم تحليله ، متبوعا ب 10 ثوان بالماء منزوع الأيونات (DI) (الشكل 2 ب).
ملاحظة: لتجنب أي عدم استقرار لأداة السوائل ، احصل على العينة لمدة 10 ثوان ، ثم ابدأ التسجيل.
- تحليل قياس التدفق الخلوي لعلامة EV: تلطيخ داخل الخلايا
ملاحظة: للتلوين داخل الخلايا ، استخدم مجموعة محددة تحتوي على كواشف التثبيت والنفاذ. يتم اقتران Anti-Caveolin mAb مع Alexa 488. تم إجراء تلطيخ IC في غياب CFSE.- قبل الاستخدام ، قم بالطرد المركزي mAb كما هو موضح سابقا (الخطوة 2.2.1).
- للتلوين داخل الخلايا ، اتبع تعليمات الشركة المصنعة (الشكل 2 ج).
- توصيف تركيز وحجم EV عن طريق تحليل تتبع الجسيمات النانوية (NTA)
- قم بإجراء تخفيفات مناسبة للعينات للحصول على 20-120 حدثا في إطار عرض شاشة عدادات NTA.
- حقن العينات في غرفة عينة جهاز NTA باستخدام حقنة أنسولين سعة 1 مل.
- اضبط برنامج NTA للتسجيل على النحو التالي: 5 قياسات قياسية ، 60 ثانية لكل منها ، ومضخة تدفق مضبوطة على 30.
- اضبط شدة الضوء على قيمة مناسبة تسمح بتمييز الجسيمات بوضوح عن الخلفية وتشغيل البرنامج النصي للالتقاط على برنامج NTA.
ملاحظة: قد يؤثر إعداد مستوى الكاميرا على اكتشاف الجسيمات. إذا كانت القيمة عالية جدا ، تظهر خلفية حليبية وتشتت قوي لضوء الجسيمات ، يغطي معظم إشارات الجسيمات. إذا كانت القيمة منخفضة جدا ، على الرغم من الحصول على خلفية أغمق ، فمن الممكن أن يتم تفويت معظم الأحداث الأقل سطوعا. يجب مراقبة كل عينة من أجل الإعداد الأمثل. - اضبط عامل التخفيف إذا كانت الجسيمات لكل إطار أقل من 20 أو أكثر من 80.
- اضبط العتبة على 4 لتحليل متوسط الحجم المشروط وتركيز الجسيمات للطاف. ضع في اعتبارك عوامل التخفيف الأولية.
- قم بتنظيف حجرة الأداة بالماء منزوع الأيونات بعد كل عينة لتجنب التلوث المتبادل.
- افتح برنامج تحليل NTA وقم بإجراء تحليل على العينات المكتسبة ، مع مراعاة عامل التخفيف (الشكل 2 د).
- توصيف مورفولوجيا EV عن طريق المجهر الإلكتروني للإرسال (TEM)
- اجمع المواد الطافية المركزة ب ASCs أو عزل المركبات الكهربائية عن طريق الطرد المركزي الفائق (100,000 × جم عند 4 درجات مئوية لمدة 1 ساعة) متبوعا بتعليق الحبيبات في نفس حجم PBS.
- اسمح بامتصاص 5 ميكرولتر من المادة الطافية المركزة أو المركبات الكهربائية على شبكات مطلية بالكربون لمدة 10 دقائق. امسح قطرات السائل الزائدة بورق الترشيح.
- قم بإجراء صبغة سلبية باستخدام أسيتات اليورانيل 2٪ في معلق مائي لمدة 10 دقائق باستخدام حجم متطابق من قطرة العينة (5 ميكرولتر). قم بإزالة أسيتات اليورانيل الزائدة عن طريق لمس الشبكة بورق الترشيح.
- جفف الشبكة في درجة حرارة الغرفة (RT) وفحصها بمجهر إلكتروني ناقل عند 120 كيلو فولت (الشكل 2E).
الشكل 2: توصيف ASC-EVs. (أ) لطخة غربية تمثيلية للمركبات الكهربائية الإيجابية (CD9 و CD81 و TSG101 و Flotillin) والسلبية (Calnexin). تم الإبلاغ عن الأوزان الجزيئية المقابلة ، وتم استخدام محللات ASCs كمراقبة. (ب) تحليل قياس التدفق الخلوي لعلامات المركبات الكهربائية. تم تحليل التعبير عن العلامات التالية: CD9 و CD63 و CD81 و CD44. تم تحليل ASC-EVs إيجابية CFSE فقط للتعبير عن العلامات. تمثل الرسوم البيانية ASC-EVs غير الملوثة (الرسوم البيانية الحمراء) والملطخة (الرسوم البيانية الزرقاء). (ج) قياس التدفق الخلوي ، التحليل داخل الخلايا لعلامة EVs Caveolin. تمثل الرسوم البيانية ASC-EVs غير الملوثة (الرسم البياني الرمادي) والملطخة (الرسوم البيانية الزرقاء). (د) توصيف ASC-EVs بواسطة NTA. تمثل الرسوم البيانية تركيز (الجسيمات / مل) / الحجم (نانومتر) للعينة. (ه) تصور ASC-EVs بواسطة TEM. أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. فرز ASC-EVs
- إعداد فارز الخلايا
ملاحظة: فارز الخلايا هو مقياس التدفق الخلوي الذي يتيح عزل مجموعة نقية من عينة البداية غير المتجانسة. يفصل فارز الخلايا الجسيمات المستهدفة عن طريق تذبذب التيار بكهرضغطية بتردد عال لتوليد قطرات تحتوي على حدث. يتم شحن القطرات التي تحتوي على الجسيمات ذات الأهمية ، مثل الخلايا أو الحويصلات ، وانحرافها من خلال ألواح الانحراف المعدنية. يستخدم الكسر الذي تم فرزه لإجراء تحليل المصب.- افتح خط الضغط والمكنسة الكهربائية.
ملاحظة: تحتوي بعض أجهزة الفرز على بدء تشغيل تلقائي ، بينما يحتوي البعض الآخر على بدء تشغيل يدوي. يفضل استخدام فارز مع بدء تشغيل يدوي ، لأنه يسمح بتحسين بعض الميزات التقنية مثل التردد والضغط واختيار طرف الفوهة. على وجه الخصوص ، يوصى بالعمل بتردد 66,000 هرتز ، وضغط 35 رطل لكل بوصة مربعة ، وفوهة 70 ميكرومتر. - قم بتشغيل الجهاز ، وافتح خزانة السلامة الحيوية ، وقم بتشغيل برنامج الفرز.
- اضغط على السوائل ثم قم بتشغيل نظام الموائع.
- قم بتنشيط Drop Drive ، البلورة الكهروإجهادية في الفوهة التي تهتز لتحتوي على قطرات.
- قم بإجراء إزالة الفقاعات للتخلص من وجود الفقاعات في النظام ثم قم بتشغيل أنبوب 5 مل من محلول التنظيف لمدة 5 دقائق عند ضغط تفاضلي عال وأنبوب 5 مل من ماء DI لمدة 5 دقائق.
- قم بتنفيذ إجراء بدء التشغيل اليدوي.
- في علامة التبويب التحكم بالليزر، اضغط على زر تشغيل الليزر لتشغيل طاقة الليزر.
ملاحظة: كرر هذا الإجراء لجميع أنواع الليزر: أزرق 488 نانومتر ، أصفر أخضر 561 نانومتر ، بنفسجي 405 نانومتر ، أحمر 640 نانومتر. - افحص المحاذاة الرأسية للدفق.
ملاحظة: في حالة الحاجة ، حرك مرحلة تجميع الفوهة ، على وجه الخصوص ، الميكرومتر الأمامي والخلفي ، والميكرومتر الأيمن والأيسر ، والمحور لضبط المحاذاة الرأسية والتحقق من التيار الرأسي باستخدام ميكرومتر لأعلى ولأسفل ؛ للحصول على أفضل محاذاة ، يجب أن يكون التيار رأسيا على كل ليزر. إذا كانت هذه هي المرة الأولى التي يستخدم فيها المرء فوهة معينة ، فيجب إجراء تأخير الليزر . على لوحة الشاشة التي تعمل باللمس، في علامة التبويب اعتراض الليزر والتيار ، حدد حجم الفوهة الصحيح، واضغط على زر تأخير الليزر ، واتبع تعليمات تأخير الليزر لتنفيذ إجراء تأخير الليزر. بشكل عام ، عند تغيير ضغط الغمد ، وبالتالي طرف الفوهة ، يتم تنفيذ تحديد تأخير الليزر قبل العثور على المحاذاة. في نهاية إجراء تأخير الليزر ، يقترح إجراء طرح صورة الخلفية باتباع التعليمات التي تظهر على الشاشة من أجل تقليل إشارة الخلفية. - قم بإجراء تحديد بقعة الليزر بالضغط على علامة التبويب Laser Stream Intercept ، وزر السهم الأخضر ، واتباع التعليمات الموجودة على شاشة اللمس.
- في علامة التبويب التحكم بالليزر، اضغط على زر تشغيل الليزر لتشغيل طاقة الليزر.
- تهيئة Intellisort. قم بتعيين تردد محرك الإسقاط وقيمة السعة الافتراضية ، مما يؤدي إلى تكوين الدفق قطرة.
- بمجرد تنفيذ هذه الخطوة، قم بتحميل تكوين محفوظ. لتحميل تكوين إعداد محفوظ، حدد إعداد فرز التحميل على شريط أدوات برنامج الفرز. بعد التحقق من الترددات والسعة المختلفة ، اختر الأفضل الذي يضمن أفضل استقرار للسقوط. العمل بتردد 66,000 هرتز وسعة حوالي 40-45 فولت.
- إجراء إجراء محاذاة الليزر الدقيقة .
- قم بتحميل أنبوب 5 مل في جهاز أخذ العينات من حبات محاذاة مراقبة الجودة وتشغيله ؛ حدد في علامة التبويب محاذاة دقيقة المعلمة المطلوبة على المحورين X و Y من أجل تصور الخرزات مضغوطة وموازنة بشكل جيد. في منطقة عرض البيانات، حدد أولا 488 - 513/26-H لمعلمة المحور Y و 488-FSC1-H لمعلمة المحور X. بعد ذلك ، لضبط جميع أشعة الليزر ، حدد 405-488 / 59-H لمعلمة المحور Y و 640-795 / 70-H لمعلمة المحور X.
ملاحظة: تعتمد المعلمات المحددة على تكوين الليزر لفارز. اقتراح يدوي الأداة هو اختيار أشعة الليزر التي تحتوي على أكبر فصل مكاني على شريط الثقب. لهذا الغرض ، استخدم ليزر بنفسجي (405 نانومتر) وليزر أحمر (640 نانومتر). - بمجرد فحص المحاذاة اليدوية من قبل أخصائي الفرز ، قم بإجراء مراقبة الجودة التلقائية. حدد قطر حبات مراقبة الجودة: قطر 3 ميكرومتر.
ملاحظة: في نهاية هذا الإجراء ، يمكن أن تكون النتيجة عدم اجتياز مراقبة الجودة أو اجتياز مراقبة الجودة. في حالة فشل مراقبة الجودة ، من الضروري تحسين المحاذاة يدويا. - احفظ اكتساب مراقبة الجودة على بروتوكول محاذاة البرنامج.
- قم بتحميل أنبوب 5 مل في جهاز أخذ العينات من حبات محاذاة مراقبة الجودة وتشغيله ؛ حدد في علامة التبويب محاذاة دقيقة المعلمة المطلوبة على المحورين X و Y من أجل تصور الخرزات مضغوطة وموازنة بشكل جيد. في منطقة عرض البيانات، حدد أولا 488 - 513/26-H لمعلمة المحور Y و 488-FSC1-H لمعلمة المحور X. بعد ذلك ، لضبط جميع أشعة الليزر ، حدد 405-488 / 59-H لمعلمة المحور Y و 640-795 / 70-H لمعلمة المحور X.
- إنهاء إجراء Intellisort
- حدد موقع لوحات الانحراف في الموضع الصحيح في فارز وقم بتشغيل الجهد (يوصى بشحن 3,000 فولت على لوحات الانحراف).
- اختر إخراج فرز 6 Tube Holder ، وقم بتمكين التدفقات التي تحدد لها على مؤشر الدفق ، وقم بإجراء دفق الاختبار.
ملاحظة: إذا لم يتم فصل التدفقات وتحديدها بوضوح ، فقم بضبط مرحلة الشحن أو إلغاء الإلغاء أو تعديل المعلمات الأخرى من أجل الحصول على تيار محدد بوضوح وغير متذبذب. - قم بتمكين زر تحديد تأخير الإسقاط التلقائي Intellisort (تحديد تأخير الإسقاط التلقائي ). تسمح هذه الخطوة بتعيين تأخير السقوط الصحيح. بعد هذه الخطوة، تحقق من التدفقات مرة أخرى.
- قم بتنشيط وضع صيانة Intellisort (وضع الصيانة). تحقق من تأخير الإسقاط يدويا.
- قم بتحميل بروتوكول تأخير الإسقاط اليدوي على برنامج الفرز. الحصول على حبات التحكم في الفلورسنت.
- أدخل حامل الشريحة الصحيح. في برنامج الفرز، حدد Sort > Drop Delay Wizard. حدد منطق الفرز.
- تحقق باستخدام المجهر الفلوري من وجود 97٪ من حبات الفلورسنت على البركة الخامسة.
- افتح خط الضغط والمكنسة الكهربائية.
- إعداد الأداة: معايرة المبعثر
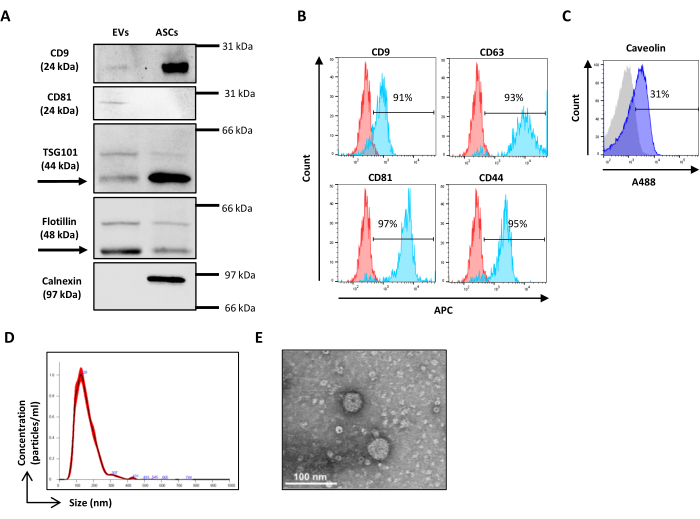
ملاحظة: يتم إجراء معايرة المبعثر باستخدام حبات Verity Shells (يشار إليها من الآن فصاعدا باسم حبات السيليكا العضوية المجوفة). تتميز حبات السيليكا العضوية هذه بتوزيع معامل الانكسار وخصائص تشتت الضوء الأقرب إلى المركبات الكهربائية من حبات البوليسترين ، مما يسمح بإعداد جهد SSC و FSC للتمييز بشكل أفضل بين الأحداث الشبيهة بالمركبات الكهربائية والضوضاء الإلكترونية. تتكون حبات السيليكا العضوية من قارورتين مع مخاليط من الخرز ، VER01A (حبات 189 نانومتر) و VER01B (حبات 374 نانومتر). تحتوي كل قارورة على خليط من حبات السيليكا العضوية المجوفة وخرز الفلورسنت الأخضر 380 نانومتر ، يشار إليها باسم الخرز المرجعي. تركيز حبات السيليكا العضوية المجوفة هو 1 × 108 حبات / مل.- قم بإعداد عينة من حبيبات VER01A و VER01B عن طريق تخفيف قطرة واحدة (50 ميكرولتر) من كل منها في 1 مل من PBS مفلتر 0.22 ميكرومتر بتركيز نهائي قدره 5,000 حبة / ميكرولتر.
ملاحظة: دوامة الخرز لمدة 5 ثوان قبل الاستخدام. - قم بإنشاء مخطط نقطي لمقياس سجل SSC مقابل مقياس سجل FITC.
- احصل على حبات VER01B واضبط الجهد لتمييز الخرز المرجعي جيدا في الجزء الأيمن العلوي من مخطط SSC / FITC النقطي (الشكل 3 أ).
- ضع منطقة حول هذه المجموعة من الخرز.
- قم بإنشاء مخطط نقطي لمقياس سجل SSC مقابل مقياس سجل FSC. حدد الخرزات المرجعية ومجموعة حبات VER01B. قم بتعيين منطقة حول مجموعة حبات VER01B (الشكل 3 ب).
- احصل على حبات VER01A وقم بإنشاء منطقة حول مجموعة الخرز هذه (الشكل 3 ج).
ملاحظة: تتداخل هذه المجموعة من الخرز جزئيا مع ضوضاء خلفية الجهاز. - احصل على PBS مفلتر 0.22 ميكرومتر واضبط العتبة لتقليل ضوضاء خلفية الأداة دون فقدان تصور أصغر الخرز.
ملاحظة: يمكن إجراء معايرة المبعثر باستخدام حبات FSC Megamix (يشار إليها من الآن فصاعدا باسم حبات البوليسترين FSC) ، وهي مزيج من حبات الفلورسنت بأقطار التالية: 100 نانومتر ، 300 نانومتر ، 500 نانومتر ، و 900 نانومتر. يجب تفضيل استخدام حبات السيليكا العضوية المجوفة على حبات البوليسترين FSC لأنها تتمتع بتوزيع معامل الانكسار وخصائص تشتت الضوء المشابهة للمركبات الكهربائية. يتداخل عدد حبات البوليسترين FSC 300 نانومتر مع مرجع حبات السيليكا العضوية المجوفة. لذلك ، تختار البوابة القائمة على حبات السيليكا العضوية المجوفة مركبات كهربائية متشابهة الحجم على مقياس التدفق الخلوي.
- قم بإعداد عينة من حبيبات VER01A و VER01B عن طريق تخفيف قطرة واحدة (50 ميكرولتر) من كل منها في 1 مل من PBS مفلتر 0.22 ميكرومتر بتركيز نهائي قدره 5,000 حبة / ميكرولتر.
- الحصول على عينة
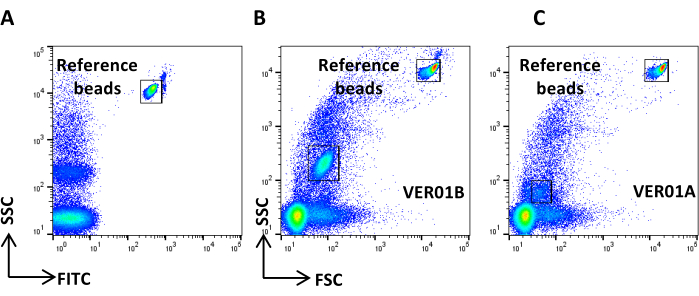
- قم بإنشاء مخطط نقطي لمقياس سجل SSC مقابل مقياس سجل FITC ، واحصل على PBS مفلتر 0.22 ميكرومتر ، وحدد ضوضاء الخلفية المرجعية (الشكل 4 أ).
ملاحظة: اضبط معدل تدفق مقياس الخلايا على منخفض وتحكم في معدل التدفق. يجب ألا يزيد عدد الأحداث عن 2,000 حدث. معدل التدفق المنخفض يعني عند الضغط التفاضلي المنخفض. - احصل على عينة التحكم (المركبات الكهربائية غير الملوثة) وتحقق من معدل التدفق. تأكد من أن عدد الأحداث / الأحداث حوالي 5,000 حدث.
ملاحظة: إذا تجاوز عدد الأحداث المقترحة، فقم بتخفيف العينة. - احصل على PBS ملطخ ومعالج كعينة CFSE وتحقق من عدم وجود أحداث إيجابية مرئية (الشكل 4 ب).
- الحصول على عينة ملطخة CFSE. تخفيفه بناء على معدل التدفق. ارسم منطقة تحدد الأحداث الإيجابية للجنة الأمن الغذائي العالمي للأوراق المالية وأخرى تحدد الأحداث السلبية للجنة الأمن الغذائي العالمي. استخدم عينة غير ملوثة كعنصر تحكم (الشكل 5 أ ، ب). هذه هي مناطق الفرز.
- قم بإنشاء مخطط نقطي لمقياس سجل SSC مقابل مقياس سجل FITC ، واحصل على PBS مفلتر 0.22 ميكرومتر ، وحدد ضوضاء الخلفية المرجعية (الشكل 4 أ).
- فرز العينات
- في برنامج الفرز، افتح بروتوكولا جديدا (على شريط الأدوات، حدد بروتوكول > الملف > جديد).
- في برنامج الفرز، انقر فوق إعداد الحصول على البيانات. في نافذة معلمة الاكتساب ، حدد قنوات الاهتمام وقم بتعطيل الآخرين. بالنسبة لهذه اللوحة المحددة ، فإن الإشارة الممكنة هي: 488-FSC1 و 488-FSC2 و 488-SSC و 488-513 / 26 (لإشارة CFSE).
- حدد موقع أنبوب العينة سعة 5 مل على جهاز أخذ العينة. على شاشة اللمس، انقر فوق الزر تحميل ، وعلى شريط أدوات برنامج الفرز، حدد اكتساب > البدء (أو اضغط على الزر F2 ). ستظهر نافذة من خصائص العينة. أدخل اسم العينة وانقر فوق موافق.
- قم بإنشاء اللوحة ، مع مؤامرة الاهتمام وإنشاء استراتيجية البوابات.
- في شريط أدوات برنامج الفرز، حدد الرسم البياني > إنشاء مدرج تكراري.
- في مساحة العمل ، قم بإنشاء ثلاث مخططات نقطية ، الأولى مع معلمة سجل الارتفاع للمحور x 488-FSC1 والمحور y 488-SSC Height-Log ، والثانية مع معلمة سجل الارتفاع على المحور x 488-FSC2 والمحور y 488-SSC Height-Log ، والثالثة مع معلمة سجل الارتفاع CFSE على المحور x 488-513 / 26 والمحور y 488-SSC Height-Log.
- في علامة التبويب فرز، حدد المنطقة / المناطق المراد فرزها. في برنامج الفرز، انقر فوق إعداد الفرز. في النافذة منطق الفرز والإحصاء ، حدد المنطقة المراد فرزها في منشئ المنطق.
ملاحظة: لاتخاذ قرار الفرز ، هناك إعدادات مختلفة يجب أخذها في الاعتبار: منطق الفرز ، ووضع الفرز ، وإسقاط المغلف. يشير منطق الفرز إلى استراتيجية البوابات. لا يتم فرز الأحداث الموجودة خارج البوابة المحددة. يرتبط وضع الفرز بالإخراج النهائي. اعمل في وضع التنقية ، وبهذه الطريقة ، تحتوي جميع القطرات التي تم فرزها على الأحداث الإيجابية المطلوبة فقط. يحدد مغلف الإسقاط عدد عمليات الإسقاط التي سيتم شحنها وفرزها فيما يتعلق بالموقع في إسقاط الحدث الإيجابي: اختر 1-2 قطرات للتأكد من فرز جميع الأحداث الإيجابية. - عندما يكون معدل التدفق مستقرا، أوقف الاكتساب (على شريط أدوات برنامج الفرز، حدد اكتساب > إيقاف أو اضغط على الزر F2 مرة أخرى). ابدأ الفرز (في شريط أدوات برنامج الفرز، حدد فرز > ابدأ أو اضغط على الزر F4 ).
ملاحظة: قبل البدء في الفرز ، تحقق من دفق الاختبار. تحقق من أن الكسر الذي تم فرزه يقع بشكل صحيح في أنبوب التجميع. - احفظ إعداد الفرز. في شريط أدوات برنامج الفرز، حدد فرز > حفظ إعدادات الفرز.
- فحص نقاء السكان المصنفين
- اغسل الجهاز عن طريق الحصول على أنبوب 5 مل من محلول التنظيف لمدة 10 دقائق عند ضغط تفاضلي عال وأنبوب 5 مل من ماء DI لمدة 10 دقائق.
- احصل على برنامج تلفزيوني مفلتر 0.22 ميكرومتر وتحقق من عدم وجود أحداث إيجابية CFSE.
- قم بتخفيف 5 ميكرولتر من العينة المصنفة في 100 ميكرولتر من 0.22 ميكرومتر من PBS مفلتر بمقدار 0.22 ميكرومتر.
- الحصول على جميع أحجام العينات وتسجيلها (الشكل 5 ج ، د).
ملاحظة: تم الإبلاغ عن إعادة تحليل كل من المركبات الكهربائية المصنفة الإيجابية والسالبة CFSE.
الشكل 3: إعداد المعلمة الفيزيائية بخرز السيليكا العضوية المجوفة. (أ) مخطط SSC / FITC النقطي: تم استخدام الخرز الفلوري الأخضر المرجعي لتعيين معلمة SSC. مخطط SSC / FSC النقطي للخرز (B) VER01B و (C) VER01A. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
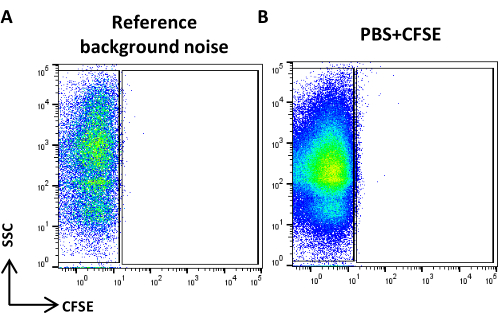
الشكل 4: ضوضاء الخلفية المرجعية. (أ) مخطط نقطة SSC / CFSE لعينة PBS. (ب) مخطط نقطة SSC / CFSE لعينة PBS + CFSE. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
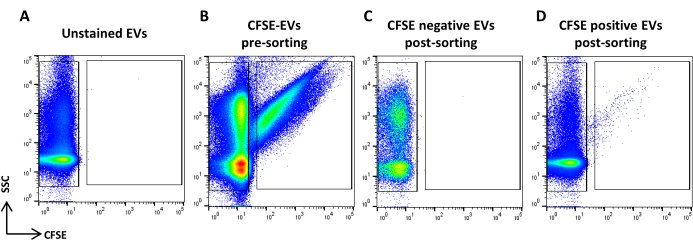
الشكل 5: فرز ASC-EVs الملطخة ب CFSE. (أ) مخطط نقطة SSC / CFSE للمركبات الكهربائية غير الملوثة ، (ب) المركبات الكهربائية الملطخة ب CFSE ، (ج) المركبات الكهربائية السالبة CFSE بعد الفرز ، و (د) المركبات الكهربائية الإيجابية CFSE بعد الفرز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحليلات الفرز اللاحقة
ملاحظة: نظرا لمحدودية كمية المواد بعد الفرز ، قد لا يكون من الممكن إجراء جميع التحليلات. مع المبلغ الذي تم الحصول عليه ، يتم تنفيذ ما يلي.
- توصيف EV عن طريق قياس التدفق الخلوي: تلطيخ السطح (انظر الخطوة 2.2)
ملاحظة: كما هو موضح سابقا لعينات الفرز المسبق باستثناء إعداد العينة. يمكن استخدام العينات بعد الفرز غير مخففة.- استخدم عينات مصنفة غير مخففة وتابع وفقا للخطوة 2.2.3. (الشكل 6 أ)
- توصيف تركيز المركبات الكهربائية وحجمها بواسطة NTA (انظر الخطوة 2.4)
ملاحظة: كما هو موضح سابقا لعينات الفرز المسبق باستثناء إعداد العينة. يمكن استخدام العينات بعد الفرز غير مخففة.- استخدم عينات مصنفة غير مخففة وتابع وفقا للخطوة 2.4.2. (الشكل 6 ب)
- توصيف مورفولوجيا EV بواسطة TEM (انظر الخطوة 2.5)
ملاحظة: كما هو موضح سابقا لعينات الفرز المسبق باستثناء إعداد العينة.- أضف 2 مل من PBS إلى مكثف الطرد المركزي (غشاء السليلوز المتجدد ، MWCO 100 كيلو دالتون) ، والغطاء ، وجهاز الطرد المركزي عند 4,000 × جم لمدة 10 دقائق في دوار دلو متأرجح. قم بإزالة PBS غير المصفى من الجزء السفلي من جهاز التصفية.
- شفط الترشيح من أنبوب التجميع. يعتمد بروتوكول الترشيح الفائق بالطرد المركزي الموضح على معالجة عينات تصل إلى 15 مل (الحد الأقصى للحجم).
- أضف ما يصل إلى 15 مل عينة إلى مرشح AU-15 وقم بتغطية الجهاز. جهاز طرد مركزي عند 4,000 × جم لمدة تصل إلى 30 دقيقة. ركز حتى الحد الأدنى من الحجم الذي يسمح به الجهاز ، حوالي 100-150 ميكرولتر.
- استرجع عينة EV المركزة التي تم فرزها من جهاز المرشح وتابع كما هو موضح سابقا لعينات الفرز المسبق TEM (الخطوة 2.5.2) ( الشكل 6C).
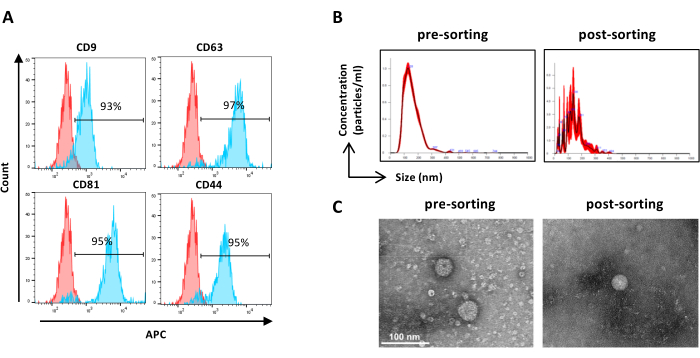
الشكل 6: توصيف ASC-EVs التي تم فرزها. تحليل قياس التدفق الخلوي لعلامات EV. تم تحليل التعبير عن العلامات التالية: CD9 و CD63 و CD81 و CD44. تم تحليل ASC-EVs إيجابية CFSE فقط للتعبير عن العلامات. (أ) تمثل الرسوم البيانية غير ملوثة (الرسوم البيانية الحمراء) والملطخة (الرسوم البيانية الزرقاء) ASC-EVs. (ب) توصيف ASC-EVs بواسطة NTA. تمثل الرسوم البيانية تركيز (الجسيمات / مل) / الحجم (نانومتر) لعينات الفرز المسبق (اليسار) وما بعد الفرز (اليمنى). (ج) تصور ASC-EVs بواسطة TEM للفرز المسبق (على اليسار) وما بعد الفرز (اليمين). أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم فرز حبات البوليسترين FSC للتحقق من صحة إعداد الجهاز وشروط الفرز. حبات البوليسترين FSC عبارة عن مزيج من حبات الفلورسنت التي تتراوح من 100 نانومتر و 300 نانومتر و 500 نانومتر و 900 نانومتر ويمكن رؤيتها على قناة FITC. يوضح الشكل 7 أ مقياس سجل SSC مقابل مخطط نقطة مقياس س?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعد تحليل وفرز المركبات الكهربائية أمرا صعبا نظرا لصغر حجمها وحقيقة أنها قريبة من حد الكشف لمعظم مقاييس التدفق الخلوي. كان هدفنا هو تطوير بروتوكول لعزل المركبات الكهربائية المشتقة من AMSCs المسماة ب CFSE. تم اختيار CFSE كطريقة تلطيخ نظرا لكفاءة وضع العلامات العالية على المركب...
Access restricted. Please log in or start a trial to view this content.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر إيمانويل كانونيكو على الدعم الفني. تم تنفيذ جزء من هذا العمل في ALEMBIC ، وهو مختبر مجهري متقدم أنشأته IRCCS Ospedale San Raffaele وجامعة Vita-Salute San Raffaele. تم دعم عمل إنريكو راجني ولورا دي جيرولامو من قبل وزارة الصحة الإيطالية ، "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
References
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved