Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre dışı vezikül izolasyonu için başarılı bir sıralama ayarlama
Bu Makalede
Özet
Bu protokol, mezenkimal stromal hücreler tarafından salınan hücre dışı veziküllerin (EV'ler) sıralanmasının ayrıntılı bir tanımını sağlar. Özellikle, cihaz ayarına ve sıralama koşullarının optimizasyonuna odaklanır. Amaç, özelliklerini koruyarak hücre dışı vezikülleri sıralamaktır.
Özet
Mezenkimal stromal hücreler (MSC'ler) tarafından salınan hücre dışı veziküller (EV'ler), rejeneratif ve antienflamatuar rollere sahip bir dizi mikroRNA içerir. Bu nedenle, saflaştırılmış MSC-EV'ler, çok çeşitli hastalıklar için yeni nesil bir terapötik seçenek olarak öngörülmektedir. Bu protokolde, genellikle ortopedik rejeneratif tıp uygulamalarında kullanılan adipoz türevli MSC'lerin (ASC'ler) süpernatantından EV'leri başarılı bir şekilde ayırma stratejisini rapor ediyoruz.
İlk olarak, floresan tespiti için karboksifloresein süksinimidil ester (CFSE) ile EV izolasyonu ve etiketleme adımlarına odaklanarak numune hazırlamayı tanımladık; Akabinde protokolün ana kısmını oluşturan tasnif sürecini detaylı bir şekilde gerçekleştirdik.
MISEV 2023 ve MIFlowCyt EV kılavuzlarında tanımlanan kurallara ek olarak, nozul boyutu, frekansı ve kılıf basıncı ile ilgili özel deneysel koşullar uyguladık. Morfolojik parametreler, EV boyutunun teorik aralığını kapsayacak şekilde seçilen çap boncukları kullanılarak oluşturulur. ASC-EV'lerin tasnifinden sonra, tasnif edilen fraksiyonun sorter ile yeniden analiz edilerek ve nanopartikül izleme analiz tekniği ile EV boyut dağılımını doğrulayarak saflık kontrolü gerçekleştirdik.
EV'lerin artan önemi nedeniyle, incelemek ve karakterize etmek için saf bir nüfusa sahip olmak çok önemli hale geliyor. Burada, bu hedefe ulaşmak için sıralamayı ayarlamak için bir kazanan stratejisi gösteriyoruz.
Giriş
Hücre Dışı Veziküller (EV'ler), hemen hemen tüm hücreler tarafından salınan, bir lipid çift tabakası ile sınırlandırılmış, kendi başlarına çoğalamayan heterojen bir zar yapılı vezikül grubudur1. Kan plazması, serum, tükürük, anne sütü, idrar, bronş lavaj sıvısı, amniyotik sıvı, beyin omurilik sıvısı ve malign asit gibi çeşitli biyosıvılarda bulunabilirler2. EV'lerin ana işlevlerinden biri, nükleik asitler, proteinler, lipitler ve karbonhidratlar dahil olmak üzere çeşitli molekülleri bir verici ve bir alıcı hücre arasında taşımaktır. Bu, doğrudan membran füzyonu, reseptör-ligand etkileşimi, endositoz ve fagositoz gibi çeşitli mekanizmalar yoluyla ortaya çıkabilir 3,4. Bu nedenle, birçok fizyolojik ve patolojik süreçte önemli bir rol oynadıkları gösterilmiştir ve hastalığın yeni biyobelirteçleri, ilaç dağıtım araçları ve terapötik ajanlar olarak önemli umut vaat etmektedirler 5,6.
Mezenkimal stromal hücreler (MSC'ler), yağ dokusu, diş pulpası, göbek kordonu kanı, plasenta, amniyotik sıvı, Wharton jölesi ve hatta beyin, akciğer, timus, pankreas, dalak, karaciğer ve böbrek dahil olmak üzere birçok dokudan izole edilebilen multipotent hücrelerdir. Son yıllarda rejeneratif tıbba büyük ilgi görmüşlerdir7. Adipoz kaynaklı mezenkimal kök hücreler (ASC'ler), kemik iliği gibi diğer kaynaklara kıyasla daha az invaziv bir prosedürle yağ dokusundan toplanabilir, bu da ciddi komplikasyon risklerini azaltır ve etik sorunlardan kaçınır8.
Ek olarak, yağ dokusu, kemik iliğinden (%1'e karşı %>0.01) ve dermis, diş pulpası, göbek kordonu ve plasenta gibi diğer kaynaklardan önemli ölçüde daha yüksek konsantrasyonda MSC içerir. MSC'ler, farklılaşma yetenekleri ve geniş bir büyüme faktörleri, kemokinler ve sitokinler repertuarını salgılamaları nedeniyle yaralı doku ve hücrelerin yenilenmesinde çok önemlidir; Bu terapötik faydalar, farklılaşma yeteneklerine ve aynı zamanda geniş bir büyüme faktörleri, kemokinler ve sitokinler repertuarı salgılamalarına bağlanabilir. Çarpıcı bir örnek, MSC'lerin ortopedik durumlar için terapötik potansiyeli ile verilmektedir ve "Kas-İskelet Sistemi Hastalıkları" terimi, clinicaltrials.gov kapsamında daha fazla sayıda kayıtlı klinik çalışmaya sahiptir (erişim tarihi: 13Mayıs 2024).
Ayrıca, MSC'ler, hasarlı hücrelere veya dokuya bilgi aktararak doku rejenerasyonunda rol alan ve ana hücrelere benzer biyolojik aktivite gösteren EV'leri de salgılayabilir 9,10. Bu nedenle, MSC-EV'ler, ortopedik durumlar için MSC-EV'leri içeren iki klinik çalışma (NCT05261360 ve NCT04998058) ile hücresiz bir yaklaşım11 elde etmek için hücre tedavisinin değerli bir ikamesi olabilir. Bununla birlikte, EV'lerin klinik uygulamaları için hala çeşitli zorluklar mevcuttur. Örneğin, EV izolasyon teknikleriyle ilgili bazı endişeler vardır: bunların çoğu vezikül saflığını veya bütünlüğünü garanti etmez. Ayrıca, bazı izolasyon teknikleri karmaşık, zaman alıcı ve düşük tekrarlanabilirliğe sahiptir, bu da onları klinik kullanım için uygun hale getirmez12.
Hücre sıralama ise spesifik floresan markörler13 kullanarak tek hücrelerin heterojen hücre süspansiyonlarından izolasyonuna izin veren yaygın olarak kullanılan bir yöntemdir. Birçok uygulama için kullanılabilir ve farklı numune türlerine uyarlanabilir. Bununla birlikte, hücre sıralama iyi bilinen ve yaygın olarak kullanılan bir teknoloji olmasına rağmen, EV sıralama hala çok zordur çünkü çoğu EV, en hassas akış sitometreleri için bile minimum algılama eşiğinin altındadır. Bir sıralayıcıyı bu amaç için daha uygun hale getiren bazı özellikler vardır. Her şeyden önce, parçacıkları askıya alan akışın bir akış hücresi içinde değil, havadaki lazerler tarafından sorgulandığı bir Jet-in-air sistemi kullanarak; Bu sistem, maruz kaldığı stresi azaltarak numuneyi korur. İkinci önemli nokta, akış ile toplama merceği arasında, cihazın arka plan optik gürültüsünü azaltan bir "karartma" çubuğunun varlığıdır. Düşük olmasına rağmen, arka plan gürültüsü tamamen ortadan kaldırılmaz ve eşiğin altına düşen olaylara kısmi bir pencere sağlayan bir referans oluşturur: cihazın14 "algılama sınırına" yakın olan olayların analizi için çok önemlidir. Son olarak, sıralayıcı, numunedeki küçük ve büyük parçacıklar arasında daha iyi ayrım yapılmasına izin veren iki farklı maskeye sahip çift bir İleri Saçılma (FSC) özelliğine sahiptir.
Buna dayanarak, yüksek hassasiyetli bir hücre sıralayıcı kullanarak karboksifloresein süksinimidil ester (CFSE) etiketli MSC-EV'leri ayırmayı amaçlayan bir protokol geliştirdik. EV'lerin manipülasyonunu en aza indirmek ve bütünlüklerini ve miktarlarını korumak için, numune hazırlama sırasında ultrasantrifüj adımlarından kaçındık. Ayrıca, ayırma koşulları, meme boyutuyla ilişkili ayırma basıncını azaltarak (35 psi'lik bir basınç için 70 μm meme) cihazımızın daha fazla optimizasyonu da dahil olmak üzere, veziküller üzerindeki stresi en aza indirecek şekilde ayarlandı.
Protokol
Buradaki protokol dört bölümden oluşmaktadır: (1) Numune hazırlama, (2) ASC-EV'lerin karakterizasyonu, (3) ASC-EV'lerin sınıflandırılması ve (4) Sıralama sonrası analiz. İş akışını temsil eden bir şema Şekil 1'de gösterilmiştir.
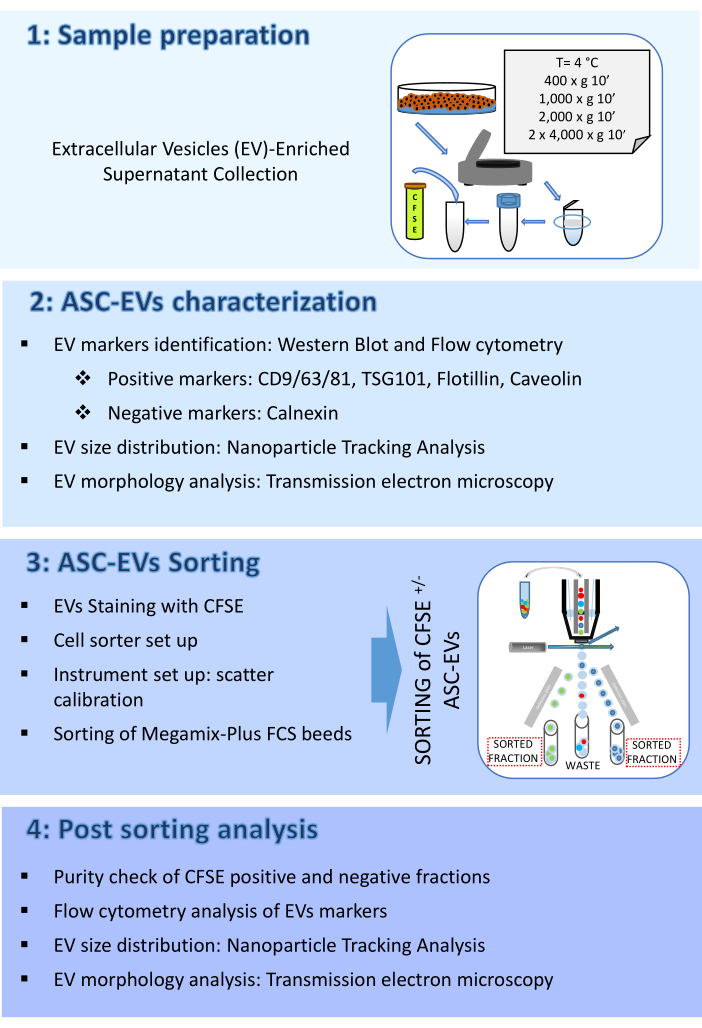
Şekil 1: Protokol Akış şeması. Akış şeması, protokolde yer alan adımları gösterir. (1) numune hazırlama, (2) tasnif öncesi veziküllerin karakterizasyonu, (3) tasnif ve (4) tasnif sonrası veziküllerin analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Numune hazırlama
- Hücre dışı veziküller (EV) ile zenginleştirilmiş süpernatan koleksiyonu
- EV'lerin toplanmasından önce (genellikle 1'den 5'e kadar olan geçiş) pasajı kültürleyen adipoz-MSC'leri (ASC'ler) çözün veya toplayın ve her ASC başına tohum, aynı miktarda hücreyi izole edin (ör., 175cm2 başına 1 milyon hücre şişe yüzeyi yaklaşık% 60 -% 70 birleşme ile sonuçlanır).
- ASC'leri, istenen protokole göre EV içermeyen fetal sığır serumu (FBS) veya insan trombosit lizatı (hPL) ile desteklenmiş uygun kültür ortamında (bu protokol için DMEM-F12) 48-72 saat büyütün.
- EV içermeyen FBS veya hPL elde etmek için, gece boyunca 4 ° C'de 120.000 x g'da ultrasantrifüj yapın ve süpernatanı kullanın.
NOT: Bu noktadan itibaren, belirtilen merkezkaç kuvveti, kullanılan alet, rotor ve borular için her zaman ortalama anlamına gelir. Farklı rotorların veya tüplerin rpm başına değişken g-kuvvetine ve k faktörüne sahip olabileceğini unutmayın. Rotorları karşılaştırmanın ve g-kuvveti ile hızı ayarlamanın kolay bir yolu için, https://www.beckman.it/centrifuges/rotors/calculator mevcut dönüştürme tablolarından birine bakın.
- EV içermeyen FBS veya hPL elde etmek için, gece boyunca 4 ° C'de 120.000 x g'da ultrasantrifüj yapın ve süpernatanı kullanın.
- % 90 hücre birleşmesinde, ASC'leri ayırın ve sayın ve uygun bir hacimde serum içermeyen ortamda, ideal olarak 1 x 106 ASC başına 1 mL'de askıya alın. Tohum ASC'leri, kuyucuk başına 1 mL olan 24 oyuklu plakalarda süspansiyon halindedir. Serum olmadan, hücreler süspansiyon halinde kalacak ve bir küre oluşturacaktır. 96 saat sonra, süpernatanı toplayın.
- 4 ° C'de seri santrifüjleme ile yüzen hücreleri ve kalıntıları çıkarın: 10 dakika boyunca 400 x g , 10 dakika boyunca 1.000 x g , 10 dakika boyunca 2.000 x g ve 10 dakika boyunca iki kez 4.000 x g .
- 220 nm'den daha büyük kalan parçacıkları çıkarmak için süpernatanı 0,22 μm'lik bir filtreden süzün.
NOT: Aşağı akış uygulamaları için hemen kullanın veya 4 °C'de en fazla bir gece saklayın veya 80 saat içinde başka adımlar atılmazsa -24 °C'de dondurun.
- Sıralama için EV'ler boyama
- 5 mM'lik bir 5(6)-Karboksifloresein diasetat N-süksinimidil ester (CFSE) çözeltisi hazırlayın. Taze hazırlanmış olarak kullanın veya -20 °C'de ışıktan koruyarak dondurun.
- Doğrudan adım 1.1.1-1.1.5'ten (24 saat içinde) ilerleyin veya -80 °C'de depolanmış EV içeren süpernatanları 4 °C'de çözün.
- Boyamadan önce, süpernatanları 37 °C'de ısıtın ve 10 μM'lik (500 kat seyreltme) son konsantrasyon için CFSE ekleyin. Karanlıkta 37 °C'de 1 saat inkübe edin.
- İnkübasyon sırasında, bir santrifüj yoğunlaştırıcıya (rejenere selüloz membran, MWCO 100 kDa), kapağa 2 mL PBS ekleyin ve sallanan bir kova rotorunda 10 dakika boyunca 4.000 x g'da santrifüjleyin. Filtrelenmemiş PBS'yi filtre cihazının altından çıkarın ve süzüntüyü toplama tüpünden aspire edin.
NOT: Ana hatlarıyla belirtilen santrifüjlü ultrafiltrasyon protokolü, numunenin 15 mL'ye kadar (maksimum hacim) işlenmesine dayanmaktadır. - Santrifüj yoğunlaştırıcıya 15 mL'ye kadar numune ekleyin ve cihazı kapatın. 4.000 x g'da 30 dakikaya kadar santrifüjleyin.
NOT: Bu, ortalama olarak 500 μL'lik bir nihai numune verecektir. Bununla birlikte, numunenin doğası ve akış hızı gibi faktörlere bağlı olarak, istenen konsantrasyonu elde etmek için gereken santrifüjleme süresi değişebilir. - Cihazı santrifüjden çıkarın ve toplama tüpünü boşaltın. Filtre cihazına 14 mL PBS ekleyin. 4.000 x g'da 30 dakikaya kadar santrifüjleyin.
- Adım 1.2.6'yı tekrarlayın.
- Konsantre CFSE lekeli EV numunesini filtre cihazından yaklaşık 500 μL'lik bir şekilde geri kazanın ve kalan numunenin sınıflandırılmasına devam ederken karanlıkta 4 °C'de 100 μL saklayın.
2. ASC-EV'lerin karakterizasyonu
- EV belirteçlerinin Western blot analizi
- Pelet ASC'leri (1 x 10,6) RT'de 376 x g'da 5 dakika süreyle askıya alın ve proteaz inhibitörleri ile desteklenmiş uygun lizis tamponunda askıya alın. Tercih edilen tahlil ile protein miktar tayini gerçekleştirin.
NOT: Bu çalışmada deneyimlendiği gibi, en iyi miktar tayini sonuçları Biskinkoninik asit tahlil tekniği ile elde edilmiştir. - Bradford tekniği ile 1 x 106 ASC'ye eşdeğer ASC konsantre süpernatanı veya 1 saat boyunca 4 ° C'de 100.000 x g'de 1 x10 6 ASC'ye karşılık gelen pelet EV'leri ölçün ve proteaz inhibitörleri ile desteklenmiş uygun lizis tamponunda askıya alın. Tercih edilen tahlil ile protein miktar tayini gerçekleştirin.
NOT: Bu çalışmada deneyimlendiği gibi, EV peletleri için en iyi miktar tayini sonuçları Biskinkoninik asit tahlil tekniği ile elde edilmiştir. - Saflaştırılmış EV'ler yerine konsantre süpernatan kullanılıyorsa, numuneleri %5 2-Merkaptoetanol ve 2x Laemmli tamponunda parçalayın.
NOT: Bu çalışmada deneyimlendiği gibi, hem konsantre süpernatan hem de saflaştırılmış EV'ler, pozitif ve negatif EV belirteçleri için karşılaştırılabilir sonuçlar verir. - Numuneleri (1-10 μg) %10'luk bir poliakrilamid jel içinde 110 V'ta 90 dakika boyunca yükleyin ve ayırın.
- 120 dakika boyunca 250 mA'da bir nitroselüloz membrana aktarın.
- Numuneleri görselleştirmek ve merdiven transferini sağlamak için Ponceau S ile membranı lekeleyin. PBS'li Ponceau S'yi hafifçe sallayarak çıkarın.
- PBS'de %5 yağsız kurutulmuş süt ve %0.1 Tween ile membranları 60 dakika boyunca bloke edin.
- Gece boyunca 4 ° C'de pozitif (örneğin, bu çalışmada CD9, CD81, TSG101 ve Flotillin) ve negatif (örneğin, bu çalışmada Calnexin) EV belirteçleri dahil olmak üzere çalışma seyreltmelerinde uygun antikorlara sahip prob membranları.
- PBS'de% 0.1 Tween ile yıkayın ve tercih edilen ECL sistemi ile bant ortaya çıkmadan önce RT'de 45 dakika boyunca uygun peroksidaz konjuge ikincil antikorlarla inkübe edin. Mevcut bir görüntüleme sistemi ile görüntüler elde edin (Şekil 2A).
- Pelet ASC'leri (1 x 10,6) RT'de 376 x g'da 5 dakika süreyle askıya alın ve proteaz inhibitörleri ile desteklenmiş uygun lizis tamponunda askıya alın. Tercih edilen tahlil ile protein miktar tayini gerçekleştirin.
- EV belirteçlerinin akış sitometrisi analizi: yüzey boyama
- Kullanmadan önce, yanlış pozitif sinyallere neden olabilecek agregaları ortadan kaldırmak için her bir monoklonal antikoru (mAb) 15.000-17.000 x g'da 4 ° C'de 30 dakika santrifüjleyin. Ayrıca, mAb'leri, tüm karışım filtreden geçene ve filtrenin yüzeyinde hiçbir antikor sıvısı kalmayana kadar 4 ° C'de 1.000 x g'de ayrı 0,22 μm santrifüj filtre tüplerine filtreleyin. mAb'leri 4 °C'de saklayın.
- 0,22 μm filtreli PBS'de CFSE lekeli EV'lerin 1:10 oranında seyreltilmesini hazırlayın (bkz. adım 1.2.1-1.2.8).
- Daha önce titre edilmiş EV'ye özgü mAbs (anti-CD9/63/81) veya MSC'ye özgü mAbs (anti-CD44) ile veya bunlar olmadan 100 μL numune veya 0,22 μm filtrelenmiş PBS'yi inkübe edin. Karanlıkta 4 ° C'de 30 dakika inkübasyon yapın.
NOT: Tipik EV'leri ve MSC soy belirteçlerini tespit etmek için geliştirilen bu protokol, diğer tüm hücre soylarını veya EV'lerin alt tipine özgü yüzey belirteçlerini kapsayacak şekilde genişletilebilir. EV'lerin CFSE boyaması ile örtüşmeyi önlemek için floresein izotiyosiyanat (FITC) kanalına düşen florokromları kullanmayın. Bir florokrom, örneğin allofikosiyanin (APC) ile konjuge edilmiş her mAb'yi kullanarak tek bir boyama gerçekleştirin. Çok renkli boyama mümkündür, ancak potansiyel antikor sterik engelleme sorunlarını ele almak için kontroller dahil edilmelidir. Tek tek antikorları tek başına veya bir karışım içinde test etmek ve sinyalin karşılaştırılabilir olduğundan emin olmak gerekir. Ek olarak, FMO'ların kontroller arasına dahil edilmesi gerekir. - Dağılım kalibrasyonunu adım 3.2'de açıklandığı gibi ayarlayın.
- FITC günlük ölçeğine karşı yan saçılma (SSC) günlük ölçeğinin bir nokta grafiğini oluşturun ve 0,22 μm filtrelenmiş PBS veya boyanmamış EV'lerden oluşan bir tüp çalıştırın; FITC kanalındaki eşiği ayarlayın ve arka plan gürültüsünün çoğunu hariç tutan en yüksek değerlere ayarlayın. CFSE pozitif olaylarını tanımlayan bir bölge çizin.
- CFSE pozitif olaylar bölgesinde kapılı bir APC histogram grafiği oluşturun ve 0,22 μm filtreli PBS veya boyanmamış EV'lerden oluşan bir tüp çalıştırın.
NOT: APC kazancı için, cihaz performanslarını optimize etmek için belirli bir kazanç gerçekleştirmeniz tavsiye edilse de, cihaz QC ile belirlenen kazancı kullanın. - Lekeli numunelere 200 μL 0.22 μm filtrelenmiş PBS ekleyin ve elde edin. Çekim ve kayıt için düşük bir akış hızı (dakikada 10 μL) kullanın. Mümkünse, FITC pozitif kapısında en az 5.000 olay kaydedin.
- mAbs'nin olası aspesifik sinyallerini tespit etmek için mAb lekeli PBS kontrolünü kullanın. Çalışmalar arasında tutarlılığı sağlamak için tüm numune tüplerini aynı akış hızında okuyun.
- Numune çapraz kontaminasyonunu önlemek için, analiz edilen her tüp arasında 10 saniye boyunca bir deterjan çalıştırın, ardından deiyonize (DI) su ile 10 saniye boyunca çalıştırın (Şekil 2B).
NOT: Herhangi bir akışkan cihaz kararsızlığını önlemek için, s'yi alınamp10 sn ve ardından kayda başlayın.
- EV markörünün akış sitometrisi analizi: Hücre içi boyama
NOT: Hücre içi boyama için, fiksasyon ve geçirgenlik reaktifleri içeren özel bir kit kullanın. Anti-Caveolin mAb, Alexa 488 ile konjuge edilmiştir. IC boyaması CFSE yokluğunda gerçekleştirilmiştir.- Kullanmadan önce, mAb'yi daha önce açıklandığı gibi santrifüjleyin (adım 2.2.1).
- Hücre içi boyama için üreticinin talimatlarına uyun (Şekil 2C).
- Nanopartikül izleme analizi (NTA) ile EV konsantrasyonunun ve boyutunun karakterizasyonu
- NTA cihaz ekranının görüntüleme çerçevesinde 20-120 olay elde etmek için numunelerin uygun seyreltmelerini yapın.
- Numuneleri 1 mL'lik bir insülin şırıngası kullanarak NTA cihazı numune odasına enjekte edin.
- Kayıt için NTA yazılımını aşağıdaki gibi ayarlayın: Her biri 60 sn olan 5 standart ölçüm ve 30'a ayarlanmış bir akış pompası.
- Işık yoğunluğunu, parçacıkları arka plandan net bir şekilde ayırt etmeye izin veren uygun bir değere ayarlayın ve yakalama komut dosyasını NTA yazılımında çalıştırın.
NOT: Kamera seviyesi ayarı partikül algılamayı etkileyebilir. Değer çok yüksekse, parçacık sinyallerinin çoğunu kaplayan sütlü bir arka plan ve güçlü parçacık ışığı saçılımı ortaya çıkar. Değer çok düşükse, daha koyu bir arka plan elde edilmesine rağmen, daha az parlak olayların çoğunun gözden kaçması mümkündür. Optimum ayar için her numune izlenmelidir. - Çerçeve başına parçacıklar 20'den düşük veya 80'den fazlaysa seyreltme faktörünü ayarlayın.
- Süpernatantın ortalama modal boyutunu ve parçacık konsantrasyonunu analiz etmek için eşiği 4'e ayarlayın. İlk seyreltme faktörlerini hesaba katın.
- Çapraz kontaminasyonu önlemek için alet odasını her numuneden sonra deiyonize su ile temizleyin.
- NTA analiz yazılımını açın ve seyreltme faktörünü dikkate alarak elde edilen numuneler üzerinde analiz yapın (Şekil 2D).
- Transmisyon elektron mikroskobu (TEM) ile EV morfolojisinin karakterizasyonu
- ASC konsantre süpernatanı toplayın veya EV'leri ultrasantrifüjleme (1 saat boyunca 4 ° C'de 100.000 x g ) ve ardından aynı hacimde PBS'de pelet süspansiyonu ile izole edin.
- 5 μL konsantre süpernatan veya EV'lerin karbon kaplı ızgaralarda 10 dakika boyunca emilmesine izin verin. Fazla sıvı damlasını filtre kağıdı ile kurulayın.
- Aynı hacimde numune damlası (5 μL) kullanarak sulu süspansiyon içinde 10 dakika boyunca% 2 uranil asetat ile negatif boyama yapın. Izgaraya filtre kağıdı ile dokunarak fazla uranil asetatı çıkarın.
- Izgarayı oda sıcaklığında (RT) kurutun ve 120 kV'da bir transmisyon elektron mikroskobu ile inceleyin (Şekil 2E).
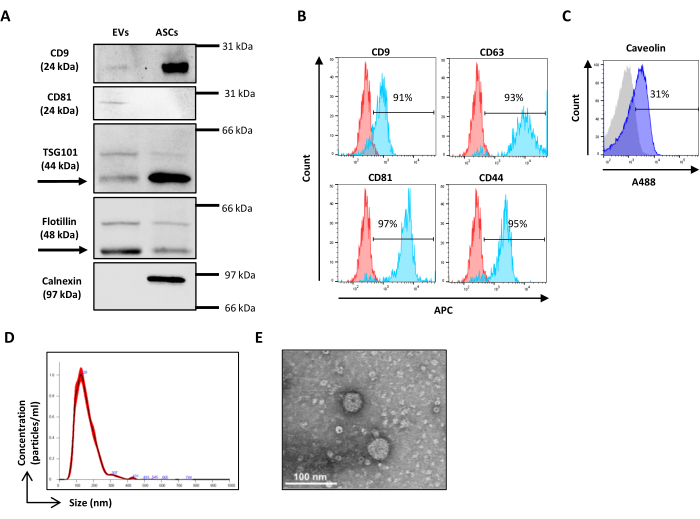
Şekil 2: ASC-EV karakterizasyonu. (A) EV'lerin pozitif (CD9, CD81, TSG101 ve Flotillin) ve negatif (Calnexin) belirteçlerinin temsili Western blot'u. Karşılık gelen moleküler ağırlıklar rapor edilmiştir ve ASC lizatları kontrol olarak kullanılmıştır. (B) EV belirteçlerinin akış sitometrisi analizi. Aşağıdaki belirteçlerin ekspresyonu analiz edildi: CD9, CD63, CD81 ve CD44. Belirteç ekspresyonu için sadece CFSE pozitif ASC-EV'ler analiz edildi. Histogramlar, boyanmamış (kırmızı histogramlar) ve lekeli (mavi histogramlar) ASC-EV'leri temsil eder. (C) EV markörü Caveolin'in akış sitometrisi hücre içi analizi. Histogramlar, lekelenmemiş (gri histogram) ve lekeli (mavi histogramlar) ASC-EV'leri temsil eder. (d) ASC-EV'lerin NTA tarafından karakterizasyonu. Histogramlar, numunenin konsantrasyonunu (partiküller/mL)/boyutunu (nm) temsil eder. (E) ASC-EV'lerin TEM ile görselleştirilmesi. Ölçek çubukları = 100 nm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. ASC-EV'lerin sınıflandırılması
- Hücre sıralayıcı kurulumu
NOT: Hücre sıralayıcı, heterojen bir başlangıç numunesinden saf bir popülasyonun izolasyonunu sağlayan bir akış sitometresidir. Hücre sıralayıcı, bir olay içeren damlalar oluşturmak için akışı yüksek frekansta bir piezoelektrik ile salarak hedef parçacıkları ayırır. Hücreler veya veziküller gibi ilgilenilen parçacıkları içeren damlalar, metal saptırma plakaları aracılığıyla yüklenir ve saptırılır. Sıralanan fraksiyon, aşağı akış analizi yapmak için kullanılır.- Basınç hattını açın ve vakumlayın.
NOT: Bazı sıralayıcılar otomatik başlatmaya sahipken, diğerleri manuel başlatmaya sahiptir. Frekans, basınç ve nozul ucu seçimi gibi bazı teknik özelliklerin optimizasyonuna izin verdiği için manuel başlatmalı bir sıralayıcı tercih edilir. Özellikle 66.000 Hz frekans, 35 psi basınç ve 70 μm nozul ile çalışılması tavsiye edilir. - Cihazı açın, biyogüvenlik kabinini açın ve ayırıcı yazılımını başlatın.
- Akışkanlara basınç uygulayın ve ardından akışkan sistemini açın.
- Nozuldaki piezoelektrik kristal olan ve damlacıklara sahip olacak şekilde titreşen Drop Drive'ı etkinleştirin.
- Sistemdeki kabarcıkların varlığını ortadan kaldırmak için Kabarcık Giderme prosedürünü uygulayın ve ardından 5 mL'lik bir temizleme solüsyonu tüpünü yüksek diferansiyel basınçta 5 dakika ve 5 mL'lik DI tüpünü 5 dakika boyunca çalıştırın.
- Manuel Başlatma prosedürünü gerçekleştirin.
- Lazer Kontrol Sekmesinde, lazer gücünü açmak için Lazer Gücü düğmesine basın.
NOT: Tüm lazerler için bu prosedürü tekrarlayın: Mavi 488 nm, Sarı-Yeşil 561 nm, Mor 405 nm ve Kırmızı 640 nm. - Akışın dikey hizalamasını inceleyin.
NOT: İhtiyaç durumunda, dikey hizalamayı ayarlamak ve dikey akışı yukarı ve aşağı mikrometre ile doğrulamak için nozul montaj aşamasını, özellikle ön ve arka mikrometreyi, sol ve sağ mikrometreyi ve gimbal'ı hareket ettirin; En iyi hizalama için, akış her lazerde dikey olmalıdır. Belirli bir nozul ilk kez kullanılıyorsa, bir Lazer Gecikmesi yapılması gerekir. Dokunmatik ekran panelinde, Lazer ve Akış Kesişimi sekmesinde, doğru nozul boyutunu seçin, Lazer Gecikme düğmesine basın ve lazer gecikme prosedürünü gerçekleştirmek için lazer gecikme talimatlarını izleyin. Genel olarak, kılıf basıncını ve dolayısıyla nozul ucunu değiştirirken, hizalama bulunmadan önce Lazer Gecikme Belirleme işlemi gerçekleştirilir. Lazer Gecikme prosedürünün sonunda, arka plan sinyalini en aza indirmek için ekrandaki talimatlara göre Arka Plan Görüntüsü Çıkarma Prosedürünün gerçekleştirilmesi önerilir. - Lazer Akışı Kesişim Noktası sekmesine, Yeşil Ok düğmesine basarak ve dokunmatik ekran monitöründeki talimatları izleyerek Lazer Noktası Belirleme işlemini gerçekleştirin.
- Lazer Kontrol Sekmesinde, lazer gücünü açmak için Lazer Gücü düğmesine basın.
- Intellisort'u başlatın. Bırakma sürücüsü frekansını ve akışın bir damlacık oluşturmasına neden olan varsayılan genlik değerini ayarlayın.
- Bu adım gerçekleştirildikten sonra, kaydedilmiş bir yapılandırmayı yükleyin. Kaydedilmiş bir ayar yapılandırmasını yüklemek için, sıralayıcı yazılımı araç çubuğunda Sıralama Ayarını Yükle'yi seçin. Farklı frekansları ve genlikleri kontrol ettikten sonra, en iyi düşme kararlılığını sağlayan en iyisini seçin. 66.000 Hz frekansında ve yaklaşık 40-45 V genlikte çalışın.
- İnce Lazer Hizalama prosedürünü gerçekleştirin.
- Örnekleyiciye 5 mL'lik bir tüp QC hizalama boncukları yükleyin ve çalıştırın; İnce Hizalama sekmesinde, iyi sıkıştırılmış ve harmanlanmış boncukları görselleştirmek için X ve Y ekseninde istenen parametreyi seçin. Veri Görüntüleme Alanında, öncelikle Y ekseni parametresi için 488 - 513/26-H'yi ve X ekseni parametresi için 488-FSC1-H'yi seçin. Ardından, tüm lazerlerde ince ayar yapmak için Y ekseni parametresi için 405-488/59-H'yi ve X ekseni parametresi için 640-795/70-H'yi seçin.
NOT: Seçilen parametreler, sıralayıcının lazer konfigürasyonuna bağlıdır. Cihaz kılavuzu önerisi, iğne deliği şeridi üzerinde en büyük uzamsal ayrıma sahip lazerlerin seçimidir. Bunun için Mor lazer (405 nm) ve Kırmızı lazer (640 nm) kullanın. - Manuel hizalama, sıralayıcı uzmanı tarafından kontrol edildikten sonra, Otomatik QC'yi gerçekleştirin. QC boncuklarının çapını seçin: 3 μm çap.
NOT: Bu prosedürün sonunda, sonuç QC geçmedi veya QC geçti olabilir. QC'nin başarısız olması durumunda, hizalamayı manuel olarak optimize etmek gerekir. - QC alımını yazılım Hizalama protokolüne kaydedin.
- Örnekleyiciye 5 mL'lik bir tüp QC hizalama boncukları yükleyin ve çalıştırın; İnce Hizalama sekmesinde, iyi sıkıştırılmış ve harmanlanmış boncukları görselleştirmek için X ve Y ekseninde istenen parametreyi seçin. Veri Görüntüleme Alanında, öncelikle Y ekseni parametresi için 488 - 513/26-H'yi ve X ekseni parametresi için 488-FSC1-H'yi seçin. Ardından, tüm lazerlerde ince ayar yapmak için Y ekseni parametresi için 405-488/59-H'yi ve X ekseni parametresi için 640-795/70-H'yi seçin.
- Intellisort prosedürünü sonlandırma
- Saptırma plakalarını sıralayıcıda doğru konuma yerleştirin ve voltajı açın (saptırma plakalarında 3.000 V şarj önerilir).
- 6 Tüp Tutucu sıralama çıkışını seçin, Akış Göstergesinde bunları seçerek akışları etkinleştirin ve Test Akışını gerçekleştirin.
NOT: Akışlar net bir şekilde ayrılmamış ve tanımlanmamışsa, açıkça tanımlanmış ve salınım yapmayan bir akış elde etmek için şarj fazını, fanı gidermeyi ayarlayın veya diğer parametreleri değiştirin. - Intellisort Otomatik Bırakma Gecikmesi Belirleme düğmesini etkinleştirin. Bu adım, doğru düşme gecikmesinin ayarlanmasını sağlar. Bu adımdan sonra akışları yeniden doğrulayın.
- Intellisort Bakım Modu'nu etkinleştirin. Düşme Gecikmesini manuel olarak doğrulayın.
- Manuel Drop Delay protokolünü sıralayıcı yazılımına yükleyin. Floresan kontrol boncukları edinin.
- Doğru kaydırma tutucusunu takın. Sıralayıcı yazılımında, Bırakma Gecikmesi Sihirbazı'nı > Sırala'yı seçin. Sıralama Mantığı'nı seçin.
- Floresan mikroskobu ile beşinci su birikintisinde floresan boncukların %97'sinin varlığını doğrulayın.
- Basınç hattını açın ve vakumlayın.
- Cihaz kurulumu: Dağılım kalibrasyonu
NOT: Saçılma kalibrasyonu, Verity Shells boncukları (bundan böyle içi boş organo silika boncuklar olarak anılacaktır) kullanılarak gerçekleştirilir. Bu organo silika boncuklar, EV'lere polistiren boncuklardan daha yakın bir kırılma indisi dağılımı ve ışık saçılma özellikleri ile karakterize edilir, böylece SSC ve FSC voltajının kurulumunun EV benzeri olaylar ile elektronik gürültü arasında daha iyi ayrım yapmasına izin verir. Organo silika boncuklar, VER01A (189 nm boncuklar) ve VER01B (374 nm boncuklar) olmak üzere boncuk karışımları içeren iki şişeden oluşur. Her şişe, içi boş organo silika boncuklar ve referans boncuklar olarak adlandırılan 380 nm yeşil floresan boncukların bir karışımını içerir. İçi boş organo silika boncukların konsantrasyonu 1 x 108 boncuk / mL'dir.- VER01A ve VER01B boncuklarından bir numune hazırlayın, her birinden bir damla (50 μL) 1 mL 0.22 μm filtrelenmiş PBS'de 5.000 boncuk/μL nihai konsantrasyon ile seyrelterek.
NOT: Kullanmadan önce boncukları 5 saniye boyunca vordekleyin. - SSC günlük ölçeğinin FITC günlük ölçeğine karşı bir nokta grafiği oluşturun.
- VER01B boncuklarını alın ve SSC/FITC nokta grafiğinin sağ üst kısmında referans boncukları iyi ayırt etmek için voltajı ayarlayın (Şekil 3A).
- Bu boncuk popülasyonunun etrafında bir bölge belirleyin.
- FSC günlük ölçeğine karşı SSC günlük ölçeğinin bir nokta grafiğini oluşturun. Referans boncukları ve VER01B boncuk popülasyonunu tanımlayın. VER01B boncuk popülasyonu etrafında bir bölge ayarlayın (Şekil 3B).
- VER01A boncuklarını alın ve bu boncuk popülasyonunun etrafında bir bölge oluşturun (Şekil 3C).
NOT: Bu boncuk popülasyonu, cihazın arka plan gürültüsü ile kısmen örtüşür. - 0,22 μm filtreli PBS elde edin ve en küçük boncukların görselleştirmesini kaybetmeden cihazın arka plan gürültüsünü azaltmak için eşiği ayarlayın.
NOT: Saçılma kalibrasyonu, aşağıdaki çaplara sahip bir floresan boncuk karışımı olan FSC Megamix boncuklar (bundan böyle FSC polistiren boncuklar olarak anılacaktır) kullanılarak yapılabilir: 100 nm, 300 nm, 500 nm ve 900 nm. İçi boş organo silika boncukların kullanımı, EV'lere benzer kırılma indisi dağılımı ve ışık saçılma özelliklerine sahip oldukları için FSC polistiren boncuklara tercih edilmelidir. 300 nm FSC polistiren boncukların popülasyonu, içi boş organo silika boncukların referansı ile örtüşmektedir. Bu nedenle, içi boş organo silika boncuklara dayalı bir geçit, akış sitometresinde benzer büyüklükteki EV'leri seçer.
- VER01A ve VER01B boncuklarından bir numune hazırlayın, her birinden bir damla (50 μL) 1 mL 0.22 μm filtrelenmiş PBS'de 5.000 boncuk/μL nihai konsantrasyon ile seyrelterek.
- Numune alımı
- FITC günlük ölçeğine karşı SSC günlük ölçeğinin bir nokta grafiğini oluşturun, 0,22 μm filtrelenmiş PBS elde edin ve referans arka plan gürültüsünü tanımlayın (Şekil 4A).
NOT: Sitometrenin akış hızını Düşük olarak ayarlayın ve akış hızını kontrol edin. Olay/olayların sayısı 2.000 olay/sn'den fazla olmamalıdır. Akış hızı Düşük, düşük diferansiyel basınçta anlamına gelir. - Kontrol örneğini (boyanmamış EV'ler) alın ve akış hızını kontrol edin. Olay sayısının yaklaşık 5.000 olay/sn olduğundan emin olun.
NOT: Olay sayısı önerilenden daha fazlaysa, numuneyi seyreltin. - PBS'yi lekelenmiş ve CFSE numunesi olarak işlenmiş olarak alın ve hiçbir pozitif olayın görünür olmadığını kontrol edin (Şekil 4B).
- CFSE lekeli numuneyi alın. Akış hızına göre seyreltin. CFSE pozitif olaylarını tanımlayan bir bölge ve CFSE negatif olaylarını tanımlayan bir bölge çizin. Kontrol olarak boyanmamış bir numune kullanın (Şekil 5A, B). Bunlar sıralama bölgeleridir.
- FITC günlük ölçeğine karşı SSC günlük ölçeğinin bir nokta grafiğini oluşturun, 0,22 μm filtrelenmiş PBS elde edin ve referans arka plan gürültüsünü tanımlayın (Şekil 4A).
- Numune sıralama
- Sıralayıcı yazılımında yeni bir protokol açın (araç çubuğunda Dosya > Protokolü > Yeni'yi seçin).
- Sıralayıcı yazılımında, Veri Toplama Ayarı'na tıklayın; pencerede Edinme Parametresi, ilgilenilen kanalları seçin ve diğerlerini devre dışı bırakın. Bu özel panel için etkinleştirilen sinyaller şunlardır: 488-FSC1, 488-FSC2, 488-SSC ve 488-513/26 (CFSE sinyali için).
- Örnekleyicinin üzerine 5 mL numune tüpü yerleştirin. Dokunmatik ekranda, Yükle düğmesine tıklayın ve sıralayıcı yazılımı araç çubuğunda Alım'ı seçin > Başlat'ı seçin (veya F2 düğmesine basın). Örnek özelliklerden oluşan bir pencere açılacaktır; Örneğin adını girin ve Tamam'a tıklayın.
- İlgilenilen arsa ile paneli oluşturun ve geçit stratejisini oluşturun.
- Sıralayıcı yazılımı araç çubuğunda Histogram > Histogram oluştur'u seçin.
- Çalışma alanında, ilki x ekseni 488-FSC1 Yükseklik Günlüğü parametresi ve y ekseni 488-SSC Yükseklik Günlüğü, ikincisi x ekseni 488-FSC2 Yükseklik Günlüğü parametresi ve y ekseni 488-SSC Yükseklik Günlüğü, üçüncüsü x ekseni 488-513/26 CFSE Yükseklik Günlüğü parametresi ve y ekseni 488-SSC Yükseklik Günlüğü olmak üzere üç nokta grafiği oluşturun.
- Sırala Sekmesinde, sıralanacak bölgeyi/bölgeleri belirleyin. Sıralayıcı yazılımında, Sıralama Ayarı'nı tıklatın. Sıralama Mantığı ve İstatistik penceresinde, mantık oluşturucuda sıralanacak bölgeyi seçin.
NOT: Sıralama kararı vermek için dikkate alınması gereken farklı ayarlar vardır: Sıralama Mantığı, Sıralama Modu ve Zarfı Bırakma. Sıralama Mantığı , geçit stratejisine atıfta bulunuyor. Seçili kapının dışında kalan olaylar sıralanmaz. Sıralama Modu , nihai çıktıyla ilgilidir. Arındırma Modunda çalışın, bu şekilde sıralanan tüm damlalar yalnızca istenen olumlu olayları içerir. Damla Zarfı , pozitif olayın damlasındaki konuma göre kaç damla yükleneceğini ve sıralanacağını tanımlar: tüm olumlu olayların sıralandığından emin olmak için 1-2 damla seçin. - Akış hızı sabit olduğunda, alımı durdurun (sıralayıcı yazılımının araç çubuğunda Alım'ı Durdur'> seçin veya F2 düğmesine tekrar basın). Sıralamayı başlatın (sıralayıcı yazılımının araç çubuğunda Sırala > Başlat'ı seçin veya F4 düğmesine basın).
NOT: Sıralamaya başlamadan önce Test Akışını kontrol edin. Sıralanan fraksiyonun toplama tüpüne doğru şekilde düştüğünü doğrulayın. - Sıralama ayarını kaydedin. Sıralayıcı yazılımının araç çubuğunda Sırala'yı seçin > Sıralama Ayarlarını Kaydet'i seçin.
- Sıralanmış popülasyonun saflık kontrolü
- Yüksek diferansiyel basınçta 10 dakika boyunca 5 mL'lik bir temizleme solüsyonu tüpü ve 10 dakika boyunca 5 mL'lik bir DI su tüpü alarak cihazı yıkayın.
- 0.22 μm filtrelenmiş PBS alın ve CFSE pozitif olay olup olmadığını kontrol edin.
- Sınıflandırılan numunenin 5 μL'sini 100 μL'lik 0.22 μm filtrelenmiş PBS içinde seyreltin.
- Tüm numune hacimlerini alın ve kaydedin (Şekil 5C, D).
NOT: Hem CFSE pozitif hem de negatif sıralanmış EV'lerin yeniden analizi rapor edilmiştir.
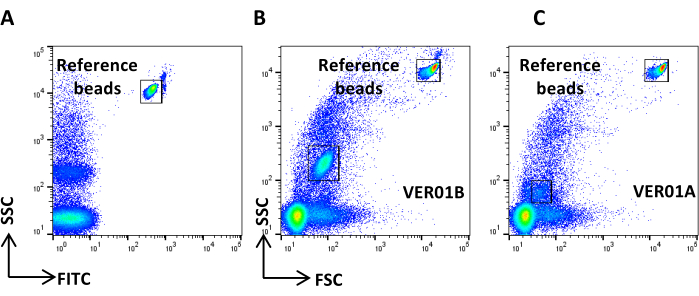
Şekil 3: İçi boş organo silika boncuklarla fiziksel parametre ayarı. (A) SSC/FITC nokta grafiği: SSC parametresini ayarlamak için referans yeşili, floresan boncuklar kullanılmıştır. (B) VER01B ve (C) VER01A boncuklarının SSC/FSC nokta grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
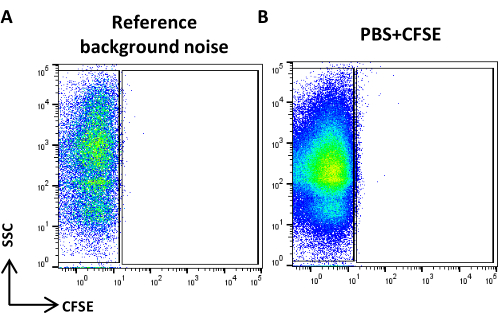
Şekil 4: Referans arka plan gürültüsü. (A) PBS örneğinin SSC/CFSE nokta grafiği. (B) PBS + CFSE örneğinin SSC/CFSE nokta grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
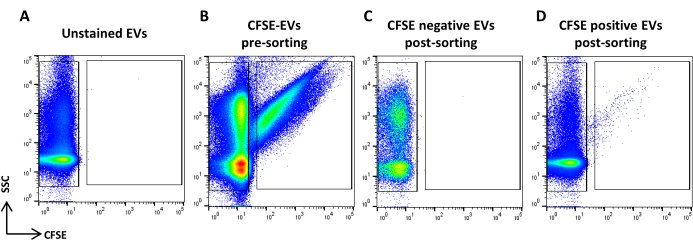
Şekil 5: CFSE lekeli ASC-EV'ler sıralaması. (A) lekelenmemiş EV'lerin SSC/CFSE nokta grafiği, (B) CFSE lekeli EV'ler, (C) sıralama sonrası CFSE negatif EV'ler ve (D) sıralama sonrası CFSE pozitif EV'ler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Sıralama sonrası analizler
NOT: Ayırma işleminden sonra malzeme miktarının sınırlı olması nedeniyle, tüm analizleri gerçekleştirmek mümkün olmayabilir. Elde edilen miktar ile aşağıdakiler gerçekleştirilir.
- Akış sitometrisi ile EV'nin karakterizasyonu: yüzey boyama (bkz. adım 2.2)
NOT: Numune hazırlama dışında numuneleri ön sıralama için daha önce açıklandığı gibi. Tasnif işleminden sonra numuneler seyreltilmeden kullanılabilir.- Seyreltilmemiş sıralanmış numuneler kullanın ve adım 2.2.3'e göre ilerleyin. (Şekil 6A)
- EV konsantrasyonunun ve boyutunun NTA ile karakterizasyonu (bkz. adım 2.4)
NOT: Numune hazırlama dışında numuneleri ön sıralama için daha önce açıklandığı gibi. Tasnif işleminden sonra numuneler seyreltilmeden kullanılabilir.- Seyreltilmemiş sıralanmış numuneler kullanın ve adım 2.4.2'ye göre ilerleyin. (Şekil 6B)
- EV morfolojisinin TEM ile karakterizasyonu (bkz. adım 2.5)
NOT: Numune hazırlama dışında numuneleri ön sıralama için daha önce açıklandığı gibi.- Bir santrifüj yoğunlaştırıcıya (rejenere selüloz membran, MWCO 100 kDa), kapağa 2 mL PBS ekleyin ve sallanan bir kova rotorunda 10 dakika boyunca 4.000 x g'da santrifüjleyin. Filtre cihazının altından filtrelenmemiş PBS'yi çıkarın.
- Toplama tüpünden süzüntü aspire edin. Ana hatlarıyla belirtilen santrifüjlü ultrafiltrasyon protokolü, 15 mL'ye kadar numunenin (maksimum hacim) işlenmesine dayanmaktadır.
- AU-15 filtresine 15 mL'ye kadar numune ekleyin ve cihazı kapatın. 4.000 x g'da 30 dakikaya kadar santrifüjleyin. Cihazın izin verdiği minimum hacime, yaklaşık 100-150 μL'ye kadar konsantre olun.
- Konsantre sıralanmış EV numunesini filtre cihazından geri kazanın ve numunelerin ön tasnif edilmesi için daha önce açıklandığı gibi ilerleyin TEM (adım 2.5.2) ( Şekil 6C).
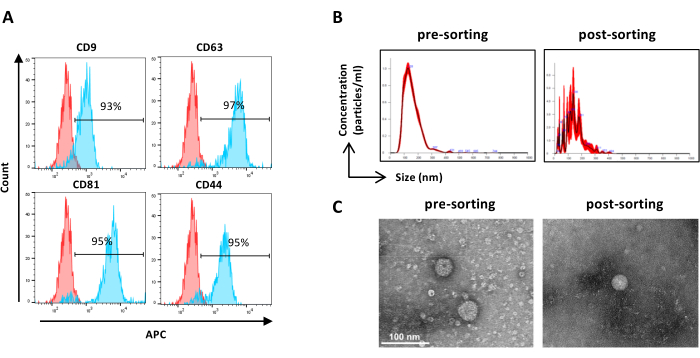
Şekil 6: Sıralanmış ASC-EV'lerin karakterizasyonu. EV belirteçlerinin akış sitometrisi analizi. Aşağıdaki belirteçlerin ekspresyonu analiz edildi: CD9, CD63, CD81 ve CD44. Belirteç ekspresyonu için sadece CFSE pozitif ASC-EV'ler analiz edildi. (A) Histogramlar, boyanmamış (kırmızı histogramlar) ve lekeli (mavi histogramlar) ASC-EV'leri temsil eder. (B) ASC-EV'lerin NTA tarafından karakterizasyonu. Histogramlar, ön sıralama (solda) ve sıralama sonrası (sağda) numunelerin konsantrasyonunu (partiküller/mL)/boyutunu (nm) temsil eder. (C) ASC-EV'lerin ön sıralama (solda) ve sıralama sonrası (sağda) numunenin TEM ile görselleştirilmesi. Ölçek çubukları = 100 nm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
FSC polistiren tanecikleri, cihaz kurulumunu ve sıralama koşullarını doğrulamak için sıralanmıştır. FSC polistiren boncuklar, 100 nm, 300 nm, 500 nm ve 900 nm arasında değişen floresan boncukların bir karışımıdır ve FITC kanalında görülebilir. Şekil 7A , sıralamadan önce dört boncuk popülasyonu ile FITC günlük ölçeği nokta grafiğine karşı SSC günlük ölçeğini göstermektedir. 100 nm, 300 nm ve 500 nm'lik floresan popül...
Tartışmalar
EV'leri analiz etmek ve sıralamak, küçük boyutları ve çoğu akış sitometresinin algılama sınırına yakın olmaları nedeniyle zordur. Amacımız, CFSE ile etiketlenmiş AMSC'lerden türetilen EV'leri izole etmek için bir protokol geliştirmekti. CFSE, antikorlar tarafından verilen protein agregatları gibi istenmeyen partiküllerin oluşumu olmadan, bildirilen yüksek EV etiketleme verimliliği (%≥90) nedeniyle boyama yöntemi olarak seçilmiştir. Bununla birlikte, estera...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Teknik destek için Emanuele Canonico'ya teşekkür ederiz. Bu çalışmanın bir kısmı, IRCCS Ospedale San Raffaele ve Università Vita-Salute San Raffaele tarafından kurulan gelişmiş bir mikroskopi laboratuvarı olan ALEMBIC'de gerçekleştirildi. Enrico Ragni ve Laura de Girolamo'nun çalışmaları İtalya Sağlık Bakanlığı "Ricerca Corrente" tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
Referanslar
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231 (2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63 (2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718 (2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25 (2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603 (2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734 (2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442 (2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır