需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为细胞外囊泡分离设置成功的分选
摘要
该协议提供了对间充质基质细胞释放的细胞外囊泡 (EV) 进行分类的详细描述。特别关注仪器设置和分选条件的优化。目标是对细胞外囊泡进行分类,同时保留其特性。
摘要
间充质基质细胞 (MSC) 释放的细胞外囊泡 (EV) 包含一组具有再生和抗炎作用的 microRNA。因此,纯化的 MSC-EV 被设想为多种疾病的下一代治疗选择。在该协议中,我们报告了从脂肪来源的 MSC (ASC) 的上清液中成功分选 EV 的策略,通常用于骨科再生医学应用。
首先,我们描述了样品制备,重点是 EV 分离和用羧基荧光素琥珀酰亚胺酯 (CFSE) 标记荧光检测的步骤;随后,我们详细介绍了排序过程,该过程构成了协议的主要部分。
除了 MISEV 2023 和 MIFlowCyt EV 指南定义的规则外,我们还应用了有关喷嘴尺寸、频率和护套压力的特定实验条件。使用选择的直径珠子建立形态参数,以覆盖 EV 尺寸的理论范围。在 ASC-EVs 分选后,我们通过使用分选机重新分析分选组分并使用纳米颗粒跟踪分析技术验证 EV 粒度分布,对分选组分进行纯度检查。
由于 EV 的重要性日益增加,拥有一个纯粹的群体来研究和表征变得越来越重要。在这里,我们演示了一个 winner 策略,用于设置排序以实现此目标。
引言
细胞外囊泡 (EV) 是一组异质的膜结构囊泡,几乎由所有细胞释放,由脂质双层分隔,无法自行复制1。它们存在于多种生物液体中,例如血浆、血清、唾液、母乳、尿液、支气管灌洗液、羊水、脑脊液和恶性腹水2。EV 的主要功能之一是在供体细胞和受体细胞之间运输各种分子,包括核酸、蛋白质、脂质和碳水化合物。这可以通过多种机制发生,例如直接膜融合、受体-配体相互作用、内吞作用和吞噬作用 3,4。因此,它们已被证明在许多生理和病理过程中发挥重要作用,并且它们作为疾病的新型生物标志物、药物递送载体和治疗剂显示出相当大的前景 5,6。
间充质基质细胞 (MSC) 是可以从许多组织中分离的多能细胞,包括脂肪组织、牙髓、脐带血、胎盘、羊水、沃顿胶,甚至大脑、肺、胸腺、胰腺、脾脏、肝脏和肾脏。近年来,他们引起了人们对再生医学的极大兴趣7。与骨髓等其他来源相比,脂肪来源的间充质干细胞 (ASC) 可以通过侵入性较小的程序从脂肪组织中采集,从而降低严重并发症的风险并避免伦理问题8。
此外,脂肪组织含有的 MSC 浓度明显高于骨髓 (1% 对 >0.01%) 和其他来源,如真皮、牙髓、脐带和胎盘。MSC 在受伤组织和细胞的再生中至关重要,因为它们具有分化能力以及分泌广泛的生长因子、趋化因子和细胞因子;这些治疗益处归因于它们的分化能力,但也归因于它们分泌广泛的生长因子、趋化因子和细胞因子的事实。一个突出的例子是 MSC 对骨科疾病的治疗潜力,其中 "肌肉骨骼疾病 "一词在 clinicaltrials.gov 下注册的临床研究数量较多(2024年 5 月 13 日访问)。
此外,MSC 还可以分泌 EV,通过将信息传递给受损细胞或组织来参与组织再生,并发挥类似于母细胞的生物活性 9,10。出于这个原因,MSC-EV 可能是细胞疗法的有价值的替代品,以实现无细胞方法11,有两项临床研究涉及 MSC-EV 治疗骨科疾病(NCT05261360 和 NCT04998058)。然而,电动汽车的临床应用仍然存在一些挑战。例如,人们对 EV 分离技术存在一些担忧:它们中的大多数不能保证囊泡的纯度或完整性。此外,一些分离技术复杂、耗时且重复性低,因此不适合临床使用12。
另一方面,细胞分选是一种常用的方法,允许使用特异性荧光标记物从异质细胞悬液中分离单细胞13。它可用于多种应用,并适用于不同的样品类型。然而,尽管细胞分选是一项成熟且广泛使用的技术,但 EV 分选仍然非常具有挑战性,因为即使是最敏感的流式细胞仪,大多数 EV 也低于最低检测阈值。有一些功能使分拣机更适合此目的。首先,使用空气喷射系统,其中悬浮颗粒的气流由空气中的激光询问,而不是在流通池内;该系统通过减少样品所承受的应力来保存样品。第二个重要的一点是,在光流和收集透镜之间存在一个"遮挡"条,这降低了仪器的背景光学噪声。虽然它很低,但背景噪声并没有被完全消除,并构成了一个参考,它为落在阈值以下的事件提供了一个部分窗口:它对于分析接近仪器14 的"检测限"的事件非常重要。最后,该分选仪具有双路径前向散射 (FSC) 和两种不同的掩模,可以更好地区分样品中的小颗粒和大颗粒。
基于此,我们开发了一种方案,旨在通过使用高灵敏度细胞分选仪分离羧基荧光素琥珀酰亚胺酯 (CFSE) 标记的 MSC-EV。为了最大限度地减少对 EV 的作并保持其完整性和数量,我们在样品制备过程中避免了超速离心步骤。此外,还调整了分选条件以最大限度地减少囊泡上的应力,包括通过降低与喷嘴尺寸相关的分选压力(70 μm 喷嘴,压力为 35 psi)进一步优化我们的仪器。
Access restricted. Please log in or start a trial to view this content.
研究方案
该方案由四个部分组成:(1) 样品制备,(2) ASC-EVs 表征,(3) ASC-EVs 分选,以及 (4) 分选后分析。 图 1 显示了代表工作流程的示意图。
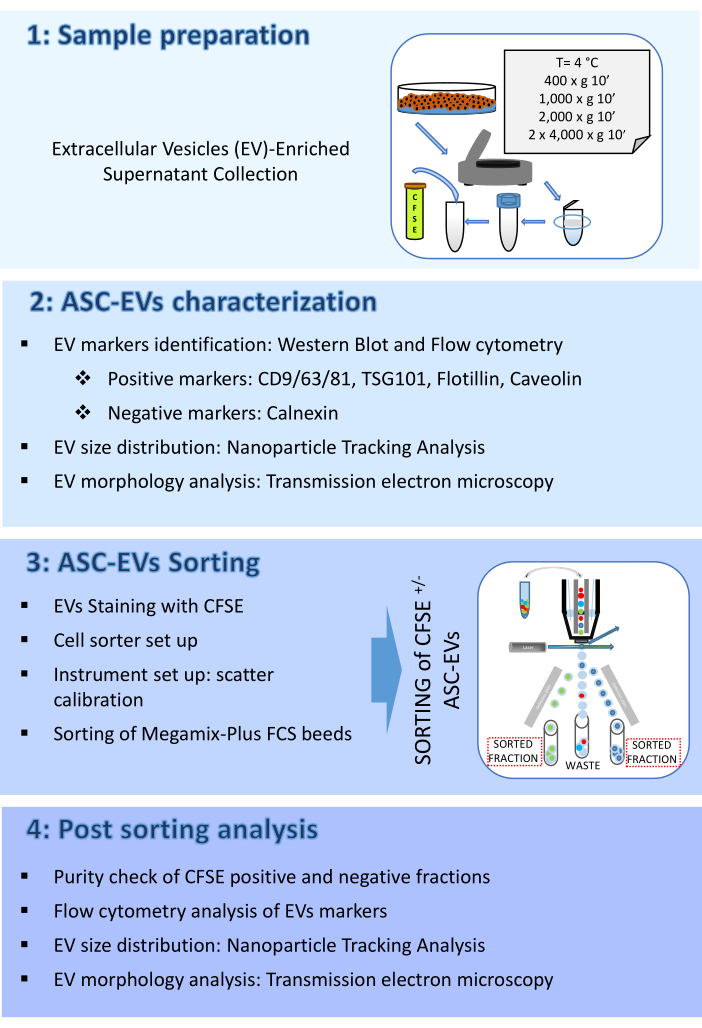
图 1:协议流程图。 流程图显示了实验方案中涉及的步骤。(1) 样品制备,(2) 分选前囊泡的表征,(3) 分选,以及 (4) 分选后囊泡分析。 请单击此处查看此图的较大版本。
1. 样品制备
- 富含细胞外囊泡 (EV) 的上清液收集
- 解冻或收集在 EV 收集之前培养的脂肪 MSC (ASC)(通常为 1 至 5 次传代),并为每个 ASC 分离物接种相同数量的细胞(例如,每 175 cm2 培养瓶表面 100 万个细胞导致大约 60%-70% 汇合)。
- 根据要求的方案,在补充有无 EV 的胎牛血清 (FBS) 或人血小板裂解物 (hPL) 的适当培养基(本方案的 DMEM-F12)中培养 ASCs,持续 48-72 小时。
- 为了获得不含 EV 的 FBS 或 hPL,在 4 °C 下以 120,000 x g 超速离心过夜并使用上清液。
注意:从这一点开始,指示的离心力始终是指所用仪器、转子和管的平均值。请记住,不同的转子或管子可能具有可变的每 rpm g 力和 k 因子。有关比较转子和调整 g 力和速度的简单方法,请参阅 https://www.beckman.it/centrifuges/rotors/calculator 可用的转换表之一。
- 为了获得不含 EV 的 FBS 或 hPL,在 4 °C 下以 120,000 x g 超速离心过夜并使用上清液。
- 在细胞汇合度为 90% 时,分离 ASC 并计数,并悬浮于适当体积的无血清培养基中,理想情况下每 1 x 10个 ASC 1 mL。在 24 孔板中以悬浮液接种 ASC,每孔 1 mL。如果没有血清,细胞将保持悬浮状态并形成球状体。96 小时后,收集上清液。
- 通过在 4 °C 下连续离心去除漂浮细胞和碎片:400 x g 10 分钟,1,000 x g 10 分钟,2,000 x g 10 分钟,两次 4,000 x g 10 分钟。
- 通过 0.22 μm 过滤器过滤上清液,以去除大于 220 nm 的剩余颗粒。
注意:立即用于下游应用,或在 4 °C 下最多储存一晚,如果在 24 小时内未执行进一步的步骤,请在 -80 °C 下冷冻。
- 用于分拣的 EV 染色
- 制备 5 mM 的 5(6)-羧基荧光素二乙酸酯 N-琥珀酰亚胺酯 (CFSE) 溶液。新鲜制备或避光在 -20 °C 下冷冻使用。
- 直接从步骤1.1.1-1.1.5(24小时内)进行或在4°C下解冻-80°C储存的含有EV的上清液。
- 染色前,在 37 °C 下加热上清液,并加入 CFSE,最终浓度为 10 μM(500 倍稀释)。在 37 °C 下在黑暗中孵育 1 小时。
- 在孵育过程中,向离心浓缩器(再生纤维素膜,MWCO 100 kDa)中加入 2 mL PBS,加盖,并在水平转子中以 4,000 x g 离心 10 分钟。从过滤装置底部取出未过滤的 PBS,并从收集管中吸出滤液。
注:概述的离心超滤方案基于处理多达 15 mL 的样品(最大体积)。 - 向离心浓缩器中加入最多 15 mL 样品并加盖装置。以 4,000 x g 离心长达 30 分钟。
注:这将产生平均 500 μL 的最终样品。但是,根据样品的性质和流速等因素,达到所需浓度所需的离心时间可能会有所不同。 - 从离心机中取出装置并清空收集管。向过滤装置中加入 14 mL PBS。以 4,000 x g 离心长达 30 分钟。
- 重复步骤 1.2.6。
- 从过滤装置中回收浓缩的 CFSE 染色的 EV 样品,约 500 μL,并在 4 °C 下避光储存 100 μL,同时继续对剩余样品进行分选。
2. ASC-EVs 表征
- EV 标志物的 Western blot 分析
- 在 RT 下以 376 x g 的离心沉淀 ASC (1 x 10,6) 5 分钟,并悬浮在补充有蛋白酶抑制剂的适当裂解缓冲液中。使用所选的检测试剂盒进行蛋白质定量。
注意:根据本研究的经验,使用二辛可宁酸测定技术可获得最佳定量结果。 - 用 Bradford 技术定量相当于 1 x 106 个 ASC 的 ASCs 浓缩上清液或对应于 1 x 106 个 ASC 的沉淀 EV,在 4 °C 下以 100,000 x g 保持 1 小时,并悬浮在补充有蛋白酶抑制剂的适当裂解缓冲液中。使用所选的检测试剂盒进行蛋白质定量。
注:根据本研究的经验,使用 Bicchinoninic acid 测定技术可获得 EV 颗粒的最佳定量结果。 - 如果使用浓缩上清液代替纯化的 EV,则在 5% 2-巯基乙醇和 2x Laemmli 缓冲液中裂解样品。
注意:根据本研究的经验,浓缩的上清液和纯化的 EV 对阳性和阴性 EV 标志物的结果相当。 - 在 110 V 下在 10% 聚丙烯酰胺凝胶中加载并分离样品 (1-10 μg) 90 分钟。
- 以 250 mA 转移到硝酸纤维素膜上 120 分钟。
- 用丽春红 S 对膜进行染色,以观察样品和分子量标准转移。在轻轻摇晃下用 PBS 去除丽春红 S。
- 用 5% 脱脂奶粉和 0.1% 吐温的 PBS 溶液封闭膜 60 分钟。
- 在4°C下,用适当的抗体探测工作稀释度的膜,包括阳性(例如,在这项工作中CD9、CD81、TSG101和Flotillin)和阴性(例如,在这项工作中为Calnexin)EV标志物。
- 在 PBS 中用 0.1% Tween 洗涤,并在 RT 下与适当的过氧化物酶偶联的二抗孵育 45 分钟,然后用所选的 ECL 系统显示条带。使用可用的成像系统获取图像(图 2A)。
- 在 RT 下以 376 x g 的离心沉淀 ASC (1 x 10,6) 5 分钟,并悬浮在补充有蛋白酶抑制剂的适当裂解缓冲液中。使用所选的检测试剂盒进行蛋白质定量。
- EV 标志物的流式细胞术分析:表面染色
- 使用前,将每种单克隆抗体 (mAb) 在 4 °C 下以 15,000-17,000 x g 离心 30 分钟,以消除可能导致假阳性信号的聚集体。此外,在 4 °C 下以 1,000 x g 的离心力将 mAb 过滤到单独的 0.22 μm 离心过滤管中,直到所有混合物都通过过滤器,并且没有抗体液体残留在过滤器表面。将 mAb 储存在 4 °C。
- 在 0.22 μm 过滤的 PBS 中制备 CFSE 染色的 EV 的 1:10 稀释液(参见步骤 1.2.1-1.2.8)。
- 孵育 100 μL 样品或 0.22 μm 过滤 PBS,含或不含 EV 特异性 mAb(抗 CD9/63/81)或 MSC 特异性 mAb(抗 CD44),预先滴定。在 4 °C 下在黑暗中孵育 30 分钟。
注意:该方案为检测典型的 EV 和 MSC 谱系标记而开发,可扩展到所有其他细胞谱系或 EV 亚型特异性表面标记。不要使用落在异硫氰酸荧光素 (FITC) 通道中的荧光染料,以避免与 EV 的 CFSE 染色重叠。使用与一种荧光染料(例如别藻蓝蛋白 (APC))偶联的每个 mAb 进行单次染色。可以进行多色染色,但必须包括对照以解决潜在的抗体空间位阻问题。有必要单独或在混合物中测试单个抗体,并确保信号具有可比性。此外,需要将 FMO 包含在控件中。 - 按照步骤 3.2 中的说明设置散射校准。
- 创建侧向散射 (SSC) 对数刻度与 FITC 对数刻度的点图,并运行一管 0.22 μm 过滤的 PBS 或未染色的 EV;在 FITC 通道上设置阈值,并将其调整为排除大多数背景噪声的最大值。绘制一个区域,标识 CFSE 阳性事件。
- 创建在 CFSE 阳性事件区域设门的 APC 直方图,并运行一管 0.22 μm 过滤的 PBS 或未染色的 EV。
注:对于 APC 增益,请使用通过仪器 QC 建立的增益,但建议执行特定的增益以优化仪器性能。 - 向染色样品中加入 200 μL 0.22 μm 过滤的 PBS 并采集。使用低流速(每分钟 10 μL)进行采集和记录。如果可能,请在 FITC 正门中记录至少 5,000 个事件。
- 使用 mAb 染色的 PBS 对照来检测 mAb 可能的非特异性信号。以相同的流速读取所有样品管,以确保运行之间的一致性。
- 为避免样品交叉污染,请在每个分析管之间运行去污剂 10 秒,然后用去离子 (DI) 水运行 10 秒(图 2B)。
注:为避免任何液流仪器不稳定,请采集样品 10 秒,然后开始记录。
- EV 标志物的流式细胞术分析:细胞内染色
注:对于细胞内染色,请使用包含固定和透化试剂的特异性试剂盒。Anti-Caveolin mAb 与 Alexa 488 偶联。IC 染色是在不存在 CFSE 的情况下进行的。- 使用前,如前所述离心 mAb(步骤 2.2.1)。
- 对于细胞内染色,请遵循制造商的说明(图 2C)。
- 通过纳米颗粒跟踪分析 (NTA) 表征 EV 浓度和大小
- 对样品进行适当稀释,以在 NTA 仪器显示屏的观察框中获得 20-120 个事件。
- 使用 1 mL 胰岛素注射器将样品注入 NTA 仪器样品室。
- 将 NTA 软件设置为记录,如下所示:5 个标准测量,每个测量 60 秒,流量泵设置为 30。
- 将光强度设置为适当的值,以便清楚地区分粒子和背景,并在 NTA 软件上运行捕获脚本。
注意:摄像机级别设置可能会影响粒子检测。如果该值太高,则会出现乳白色背景和强烈的粒子光散射,覆盖大部分粒子信号。如果该值太低,尽管获得了较暗的背景,但可能会错过大多数不太亮的事件。应监测每个样品以获得最佳设置。 - 如果每帧粒子数低于 20 或大于 80,请调整稀释因子。
- 将阈值设置为 4 以分析上清液的平均模态大小和颗粒浓度。考虑初始稀释因子。
- 每次采样后用去离子水清洁仪器室,以避免交叉污染。
- 打开 NTA 分析软件并对采集的样品进行分析,同时考虑稀释因子(图 2D)。
- 通过透射电子显微镜 (TEM) 表征 EV 形态
- 收集ASCs浓缩的上清液或通过超速离心(100,000 x g ,4°C,1小时)分离EV,然后在相同体积的PBS中沉淀悬浮液。
- 让 5 μL 浓缩上清液或 EV 在碳涂层网格上吸收 10 分钟。用滤纸吸干多余的液体滴。
- 使用相同体积的样品滴 (5 μL) 在水性悬浮液中用 2% 乙酸铀酰进行阴性染色 10 分钟。用滤纸接触网格,去除多余的乙酸铀酰。
- 在室温 (RT) 下干燥网格,并用 120 kV 的透射电子显微镜检查(图 2E)。
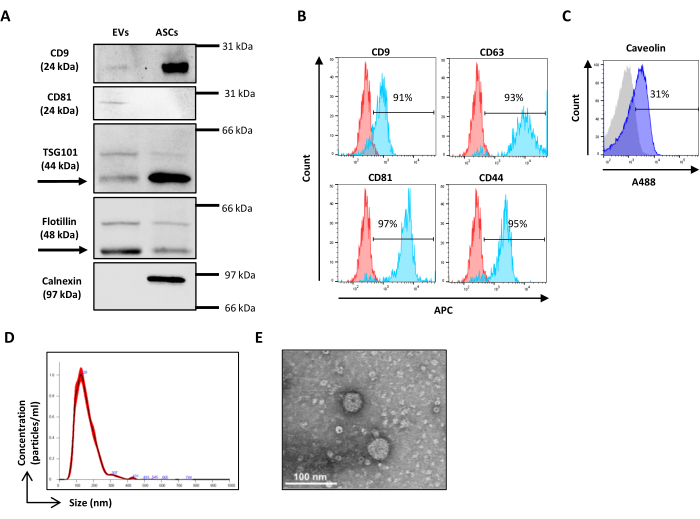
图 2:ASC-EV 表征。 (A) EV 阳性(CD9、CD81、TSG101 和 Flotillin)和阴性(钙联蛋白)标志物的代表性蛋白质印迹。报告了相应的分子量,并且 ASCs 裂解物已用作对照。(B) EV 标志物的流式细胞术分析。分析以下标志物的表达:CD9 、 CD63 、 CD81 和 CD44。仅分析 CFSE 阳性 ASC-EVs 的标志物表达。直方图表示未染色(红色直方图)和染色(蓝色直方图)ASC-EV。(C) EV 标志物 Caveolin 的流式细胞术细胞内分析。直方图表示未染色(灰色直方图)和染色(蓝色直方图)ASC-EV。(D) NTA 对 ASC-EV 的表征。直方图表示样品的浓度 (颗粒/mL)/大小 (nm)。(E) 通过 TEM 对 ASC-EVs 进行可视化。比例尺 = 100 nm。 请单击此处查看此图的较大版本。
3. ASC-EVs 分拣
- 细胞分选仪设置
注:细胞分选仪是一种流式细胞仪,能够从异质起始样品中分离纯细胞群。细胞分选仪通过用压电器件高频振荡液流来分离目标颗粒,以生成包含事件的液滴。包含目标颗粒(如细胞或囊泡)的液滴通过金属偏转板带电和偏转。分选后的馏分用于执行下游分析。- 打开压力管路并抽真空。
注意: 一些分拣机具有自动启动功能,而另一些分拣机具有手动启动功能。手动启动的分拣机是首选,因为它可以优化一些技术特性,例如频率、压力和喷嘴尖端的选择。特别是,建议以 66,000 Hz 的频率、35 psi 的压力和 70 μm 的喷嘴工作。 - 打开仪器,打开生物安全柜,然后启动分选仪软件。
- 对液流装置加压,然后打开液流系统。
- 激活 Drop Drive,这是喷嘴中的压电晶体,振动会产生液滴。
- 执行 去泡 程序以消除系统中气泡的存在,然后在高压差下运行 5 mL 管清洁溶液 5 分钟,并在 5 mL 管去离子水中运行 5 分钟。
- 执行手动 启动 过程。
- 在 Laser Control 选项卡上,按 Laser Power 按钮打开激光电源。
注意:对所有激光器重复此过程:蓝色 488 nm、黄绿色 561 nm、紫色 405 nm 和红色 640 nm。 - 检查流的垂直对齐方式。
注意:如有需要,移动喷嘴组装台,特别是前后千分尺、左右千分尺和万向节,以调整垂直对齐并用上下千分尺验证垂直流;为了获得最佳对齐效果,每个激光器上的流必须是垂直的。如果这是第一次使用特定喷嘴,则需要进行 Laser Delay 。在触摸屏面板的 Laser and Stream Intercept 选项卡上,选择正确的喷嘴尺寸,按下 Laser Delay(激光延迟 )按钮,然后按照激光延迟说明执行激光延迟程序。通常,当改变护套压力并因此改变喷嘴尖端时,激光 延迟测定 会在找到对准之前执行。在 激光延迟 程序结束时,建议按照屏幕上的说明执行背景图像减法程序,以最大限度地减少背景信号。 - 通过按下 Laser Stream Intercept 选项卡、绿色箭头按钮并按照触摸屏显示器上的说明执行激光光斑测定。
- 在 Laser Control 选项卡上,按 Laser Power 按钮打开激光电源。
- 初始化 Intellisort。设置丢弃驱动频率和默认振幅值,这将使流形成液滴。
- 执行此步骤后,加载保存的配置。要加载保存的设置配置,请在排序软件工具栏上选择 Load Sort Setting 。检查不同的频率和振幅后,选择确保最佳跌落稳定性的那个。以 66,000 Hz 的频率和大约 40-45 V 的振幅工作。
- 执行 精细激光对准 程序。
- 在进样器中装入一管 5 mL QC 对齐微珠并运行;在 Fine Alignment 选项卡上选择在 X 轴和 Y 轴上所需的参数,以便可视化压实和准直的焊缝。在 数据显示区域,首先选择 488 - 513/26-H 作为 Y 轴参数 ,选择 488-FSC1-H 作为 X 轴参数。然后,要微调所有激光器,请选择 405-488/59-H 作为 Y 轴参数 ,选择 640-795/70-H 作为 X 轴参数。
注意:所选参数取决于分拣机的激光配置。仪器手册建议选择在针孔条上具有最大空间分离的激光器。为此,请使用紫色激光 (405 nm) 和红色激光 (640 nm)。 - 分拣机专家检查手动对齐后,执行 自动 QC。选择 QC 微珠的直径:直径 3 μm。
注意:在此过程结束时,结果可能是 QC 未通过 或 QC 通过。如果 QC 失败,则需要手动优化对准。 - 将 QC 采集保存在软件 Alignment 方案中。
- 在进样器中装入一管 5 mL QC 对齐微珠并运行;在 Fine Alignment 选项卡上选择在 X 轴和 Y 轴上所需的参数,以便可视化压实和准直的焊缝。在 数据显示区域,首先选择 488 - 513/26-H 作为 Y 轴参数 ,选择 488-FSC1-H 作为 X 轴参数。然后,要微调所有激光器,请选择 405-488/59-H 作为 Y 轴参数 ,选择 640-795/70-H 作为 X 轴参数。
- 完成 Intellisort 过程
- 将偏转板放置在分选仪中的正确位置并打开电压(建议在偏转板上充电 3,000 V)。
- 选择 6 Tube Holder 排序输出,启用在 Stream Indicator(流指示器)上选择它们的流,然后执行 Test Stream(测试流)。
注意:如果流没有明确分离和定义,请调整 充电相位、调整或修改其他参数,以获得明确定义且不振荡的流。 - 启用 Intellisort Automatic Drop Delay Determination 按钮。此步骤允许设置正确的 drop delay。完成此步骤后,再次验证流。
- 激活 Intellisort 维护模式。手动验证 Drop Delay 。
- 在分拣机软件上加载手动 Drop Delay 协议。获取荧光对照微珠。
- 插入正确的载玻片架。在分拣软件中,选择 Sort > Drop Delay Wizard。选择 Sort Logic (排序逻辑)。
- 用荧光显微镜验证第五个水坑上是否存在 97% 的荧光珠。
- 打开压力管路并抽真空。
- 仪器设置:散射校准
注:使用 Verity Shells 微珠(以下称为空心有机二氧化硅微珠)进行散射校准。这些有机硅二氧化硅珠的特点是比聚苯乙烯珠更接近 EV 的折射率分布和光散射特性,因此允许设置 SSC 和 FSC 电压以更好地区分类似 EV 的事件和电子噪声。有机二氧化硅微珠由两个装有微珠混合物的小瓶 VER01A(189 nm 微珠)和 VER01B(374 nm 微珠)组成。每个样品瓶都包含空心有机二氧化硅微珠和 380 nm 绿色荧光微珠的混合物,称为参比微珠。空心有机二氧化硅珠的浓度为 1 x 108 个珠子/mL。- 通过在 1 mL 0.22 μm 过滤的 PBS 中稀释一滴 (50 μL),制备 VER01A 和 VER01B 珠子,终浓度为 5,000 个珠子/μL。
注意:使用前将珠子涡旋 5 秒。 - 创建 SSC 对数刻度与 FITC 对数刻度的点图。
- 获取 VER01B 珠子并调整电压以在 SSC/FITC 点图的右上方很好地区分参考珠子(图 3A)。
- 在此珠子群周围设置一个区域。
- 创建 SSC 对数标度与 FSC 对数标度的点图。鉴定参比微珠和 VER01B 微珠群。在 VER01B 珠子群周围设置一个区域(图 3B)。
- 获取 VER01A 珠子并在该珠子群周围创建一个区域(图 3C)。
注意:这些珠子与仪器的背景噪声部分重叠。 - 采集 0.22 μm 过滤的 PBS 并调整阈值以降低仪器的背景噪音,而不会丢失最小珠子的可视化。
注:可以使用 FSC Megamix 微珠(以下简称 FSC 聚苯乙烯微珠)进行散射校准,FSC Megamix 微珠是以下直径的荧光微珠混合物:100 nm、300 nm、500 nm 和 900 nm。使用 FSC 聚苯乙烯珠子必须优于 FSC 聚苯乙烯珠子,因为它们具有类似于 EV 的折射率分布和光散射特性。300 nm FSC 聚苯乙烯珠的种群与空心有机二氧化硅珠的参考重叠。因此,基于空心有机二氧化硅珠的门在流式细胞仪上选择相似大小的 EV。
- 通过在 1 mL 0.22 μm 过滤的 PBS 中稀释一滴 (50 μL),制备 VER01A 和 VER01B 珠子,终浓度为 5,000 个珠子/μL。
- 样品采集
- 创建 SSC 对数刻度与 FITC 对数刻度的点图,获取 0.22 μm 过滤的 PBS,并定义参考背景噪声(图 4A)。
注:将流式细胞仪的流速设置为"低"并控制流速。事件数/秒不得超过 2,000 个事件/秒。流量 低 表示在低压差下。 - 获取对照样品(未染色的 EV)并检查流速。确保事件数/秒约为 5,000 个事件/秒。
注:如果事件数超过建议的数量,请稀释样品。 - 获取 PBS 染色并作为 CFSE 样品处理,并检查是否没有可见的阳性事件(图 4B)。
- 获取 CFSE 染色样品。根据流速稀释。绘制一个标识 CFSE 阳性事件的区域和一个标识 CFSE 阴性事件的区域。使用未染色的样品作为对照(图 5A、B)。这些是排序区域。
- 创建 SSC 对数刻度与 FITC 对数刻度的点图,获取 0.22 μm 过滤的 PBS,并定义参考背景噪声(图 4A)。
- 样品分拣
- 在排序软件上,打开一个新协议(在工具栏上选择 File > Protocol > New)。
- 在分拣机上软件上,单击 Data Acquisition Setting;在 Acquisition Parameter 窗口中,选择感兴趣的通道并禁用其他通道。对于此特定面板,信号支持为: 488-FSC1、488-FSC2、488-SSC 和 488-513/26 (用于 CFSE 信号)。
- 在进样器上找到 5 mL 样品管。在触摸屏上,单击 Load 按钮,然后在分拣机软件工具栏上,选择 Acquisition > Start (或按 F2 按钮)。将出现一个样本属性窗口;插入示例的名称,然后单击 OK。
- 使用感兴趣的绘图创建面板并创建门控策略。
- 在排序软件工具栏上,选择 Histogram > Create histogram。
- 在工作区中,创建三个点图,第一个点图在 x 轴 488-FSC1 上具有高度对数参数和 y 轴 488-SSC 高度对数,第二个点图在 x 轴 488-FSC2 上具有高度对数参数和 y 轴 488-SSC 高度对数,第三个点图在 x 轴上具有 CFSE 高度对数 参数和 y 轴 488-SSC 高度对数。
- 在 Sort 选项卡上,确定要排序的区域。在排序软件上,单击 Sort Setting(排序设置)。在 Sort Logic and Statistic 窗口中,选择要在 logic builder 中排序的区域。
注:要做出排序决定,需要考虑不同的设置: Sort Logic(排序逻辑)、 Sort Mode(排序模式)和 Drop Envelope(放置包络)。 Sort Logic 指的是门控策略。所选入口之外的事件不会排序。 Sort Mode 与最终输出相关。在 Purify 模式下工作,这样,所有排序的 drops 都只包含所需的积极事件。 Drop Envelope 定义将收取多少 drop,并根据 positive 事件的 drop 中的位置进行排序:选择 1-2 drops 以确保所有 positive 事件都已排序。 - 当流速稳定时,停止采集(在分选仪软件的工具栏上,选择 Acquisition > Stop 或再次按 F2 按钮)。开始排序(在排序软件的工具栏上,选择 Sort > Start 或按 F4 按钮)。
注意:在开始排序之前,请检查 Test Stream。验证分选后的馏分是否正确落入收集管中。 - 保存排序设置。在排序软件的工具栏上,选择 Sort > Save Sort Settings。
- 分选群体的纯度检查
- 通过在高压差下获取 5 mL 管清洁溶液 10 分钟和一管 5 mL 去离子水 10 分钟来清洗仪器。
- 获取 0.22 μm 过滤的 PBS 并检查是否不存在 CFSE 阳性事件。
- 在 100 μL 0.22 μm 过滤的 PBS 中稀释 5 μL 分选样品。
- 采集并记录所有样品体积(图 5C、D)。
注意:报告了 CFSE 阳性和阴性分类 EV 的重新分析。
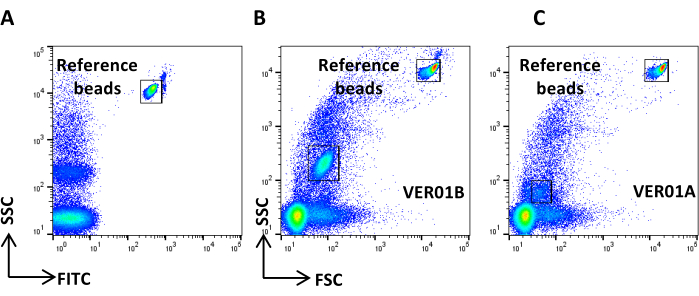
图 3:使用空心有机二氧化硅珠进行物理参数设置。 (A) SSC/FITC 点图:参考绿色荧光珠已用于设置 SSC 参数。(B) VER01B 和 (C) VER01A 微珠的 SSC/FSC 点图。 请单击此处查看此图的较大版本。
图 4:参考背景噪声。 (A) PBS 样品的 SSC/CFSE 点图。(B) PBS + CFSE 样品的 SSC/CFSE 点图。 请单击此处查看此图的较大版本。
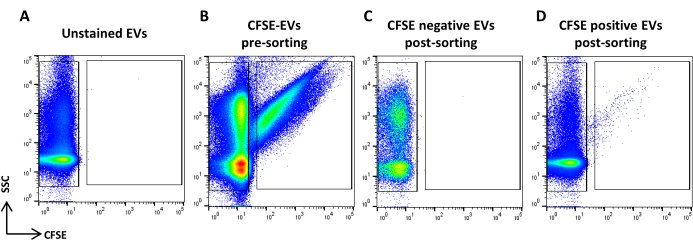
图 5:CFSE 染色的 ASC-EV 分选。 (A) 未染色 EV 的 SSC/CFSE 点图,(B) CFSE 染色的 EV,(C) CFSE 阴性 EV 后分选,以及 (D) CFSE 阳性 EV 后分选。 请单击此处查看此图的较大版本。
4. 后排序分析
注意:由于分选后的材料数量有限,可能无法执行所有分析。使用获得的数量,执行以下作。
- 通过流式细胞术表征 EV:表面染色(参见步骤 2.2)
注:如前所述,除样品制备外,样品的预分选除外。分选后的样品可以原液使用。- 使用未稀释的分选样品,并按照步骤 2.2.3 进行。(图 6A)
- 通过 NTA 表征 EV 浓度和大小(参见步骤 2.4)
注:如前所述,除样品制备外,样品的预分选除外。分选后的样品可以原液使用。- 使用未稀释的分选样品,并按照步骤 2.4.2 进行。(图 6B)
- 通过 TEM 表征 EV 形态(参见步骤 2.5)
注:如前所述,除样品制备外,样品的预分选除外。- 向离心浓缩器(再生纤维素膜,MWCO 100 kDa)中加入 2 mL PBS,加盖,并在摆动桶转子中以 4,000 x g 离心 10 分钟。从过滤装置底部去除未过滤的 PBS。
- 从收集管中吸出滤液。概述的离心超滤方案基于处理高达 15 mL 的样品(最大体积)。
- 向 AU-15 过滤器中加入最多 15 mL 样品并加盖设备。以 4,000 x g 离心长达 30 分钟。浓缩至设备允许的最小体积,约 100-150 μL。
- 从过滤装置中回收浓缩分选的 EV 样品,并按照前面描述的预分选样品 TEM(步骤 2.5.2)( 图 6C)进行。
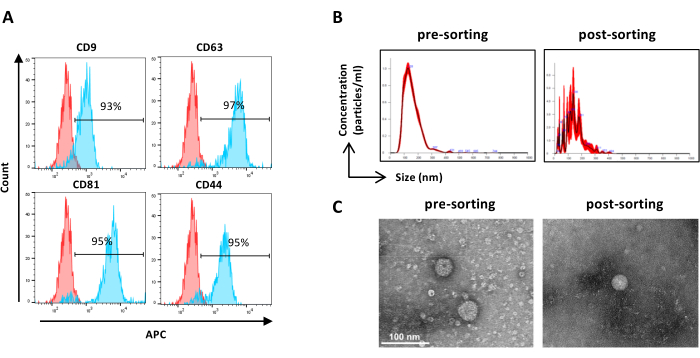
图 6:分选的 ASC-EV 的表征。EV 标志物的流式细胞术分析。分析以下标志物的表达:CD9 、 CD63 、 CD81 和 CD44。仅分析 CFSE 阳性 ASC-EVs 的标志物表达。(A) 直方图表示未染色(红色直方图)和染色(蓝色直方图)ASC-EV。(B) NTA 对 ASC-EV 的表征。直方图表示分选前(左)和分选后(右)样品的浓度 (颗粒/mL)/粒径 (nm)。(C) 通过 TEM 对前分选(左)和后分选(右)样品进行 ASC-EV 的可视化。比例尺 = 100 nm。请单击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
FSC 聚苯乙烯微珠已经过分选,以验证仪器设置和分选条件。FSC 聚苯乙烯微珠是 100 nm、300 nm、500 nm 和 900 nm 荧光微珠的混合物,在 FITC 通道上可见。 图 7A 显示了分选前四个微珠群的 SSC 对数刻度与 FITC 对数刻度点图。对 100 nm、300 nm 和 500 nm 的荧光群进行门控和分选。分析分选的磁珠的纯度和富集度,作为初始概念验证(图 7B?...
Access restricted. Please log in or start a trial to view this content.
讨论
由于 EV 体积小,而且接近大多数流式细胞仪的检测极限,因此分析和分拣 EV 具有挑战性。我们的目标是开发一种方案,用于分离源自 CFSE 标记的 AMSC 的 EV。选择 CFSE 作为染色方法,因为据报道其 EVS 标记效率高 (≥90%),并且不会形成不需要的颗粒,例如抗体提供的蛋白质聚集体。然而,可能会遗漏少数没有酯酶的 EV,未来的研究将需要确定能够标记这些颗粒以进行分?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可披露的。
致谢
我们感谢 Emanuele Canonico 的技术支持。这项工作的一部分是在 ALEMBIC 进行的,这是一个由 IRCCS Ospedale San Raffaele 和 Università Vita-Salute San Raffaele 建立的先进显微镜实验室。Enrico Ragni 和 Laura de Girolamo 的工作得到了意大利卫生部"Ricerca Corrente"的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
参考文献
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。