このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞外小胞単離のための適切なソーティングの設定
要約
このプロトコルは、間葉系間質細胞によって放出される細胞外小胞(EV)の選別について詳細に説明しています。特に、機器の設定と選別条件の最適化に焦点を当てています。目標は、細胞外小胞の特性を維持しながら選別することです。
要約
間葉系間質細胞(MSC)から放出される細胞外小胞(EV)には、再生作用と抗炎症作用を持つマイクロRNAが一組含まれています。そのため、精製されたMSC-EVは、さまざまな疾患に対する次世代の治療選択肢として想定されています。このプロトコルでは、整形外科の再生医療アプリケーションでよく使用される脂肪由来MSC(ASC)の上清からEVをうまく選別するための戦略を報告します。
まず、蛍光検出のためのカルボキシフルオレセインスクシンイミジルエステル(CFSE)によるEVの単離と標識のステップに焦点を当てたサンプル調製について説明しました。続いて、プロトコルの主要部分を構成する選別プロセスについて詳しく説明します。
MISEV 2023 と MIFlowCyt EV ガイドラインで定義されたルールに加えて、ノズルのサイズ、周波数、シース圧力に関する特定の実験条件を適用しました。形態学的パラメータは、EVサイズの理論範囲をカバーするために選択された直径のビーズを使用して確立されます。ASC-EVの選別後、選別機で再分析し、ナノ粒子追跡分析技術でEVサイズ分布を確認することにより、選別された画分を純度チェックしました。
EVの重要性が増しているため、純粋な人口を研究し、特性評価することが重要になってきています。ここでは、この目標を達成するために並べ替えを設定する勝者戦略を示します。
概要
細胞外小胞(EV)は、ほとんどすべての細胞から放出される膜構造の小胞の不均一なグループであり、脂質二重層で区切られており、それ自体で複製することはできません1。それらは、血漿、血清、唾液、母乳、尿、気管支洗浄液、羊水、脳脊髄液、悪性腹水など、いくつかの生体液に見られます2。EVの主な機能の1つは、ドナーとレシピエント細胞の間で、核酸、タンパク質、脂質、炭水化物などのさまざまな分子を輸送することです。これは、直接膜融合、受容体-リガンド相互作用、エンドサイトーシス、食作用など、さまざまなメカニズムを通じて発生する可能性があります3,4。このため、それらは多くの生理学的および病理学的プロセスにおいて重要な役割を果たすことが実証されており、疾患の新規バイオマーカー、薬物送達媒体、および治療薬としてかなりの有望性を示しています5,6。
間葉系間質細胞(MSC)は、脂肪組織、歯髄、臍帯血、胎盤、羊水、ウォートンゼリー、さらには脳、肺、胸腺、膵臓、脾臓、肝臓、腎臓など、多くの組織から単離できる多能性細胞です。近年、再生医療7に高い関心が寄せられています。脂肪由来の間葉系幹細胞(ASC)は、骨髄などの他の供給源と比較して侵襲性の低い手順で脂肪組織から採取できるため、重篤な合併症のリスクが低くなり、倫理的問題を回避できます8。
さらに、脂肪組織には、骨髄や真皮、歯髄、臍帯、胎盤などの他の供給源よりも大幅に高い濃度のMSCが含まれています(>0.01%)。MSCは、その分化能力と成長因子、ケモカイン、サイトカインの広範なレパートリーの分泌により、損傷した組織や細胞の再生に不可欠です。これらの治療上の利点は、それらの分化能力だけでなく、成長因子、ケモカイン、およびサイトカインの広範なレパートリーを分泌するという事実にも起因しています。顕著な例は、整形外科疾患に対するMSCの治療可能性であり、「筋骨格疾患」という用語は、clinicaltrials.gov 年未満の登録臨床研究数が多かった(2024年5月13日 アクセス)。
さらに、MSCは、損傷した細胞または組織に情報を伝達することにより組織再生に関与するEVを分泌し、母細胞と同様の生物学的活性を発揮することもできる9,10。このため、MSC-EVは、整形外科疾患に対するMSC-EVを含む2つの臨床試験(NCT05261360およびNCT04998058)で、無細胞アプローチ11を達成するための細胞治療の貴重な代替品となる可能性があります。しかし、EVの臨床応用には、まだいくつかの課題が残っています。例えば、EVの分離技術にはいくつかの懸念があり、そのほとんどが小胞の純度や完全性を保証するものではありません。さらに、一部の単離技術は複雑で時間がかかり、再現性が低いため、臨床使用には適していません12。
一方、セルソーティングは、特異的な蛍光マーカー13を用いて不均一な細胞懸濁液から単一細胞を単離することを可能にする一般的に使用される方法である。多くのアプリケーションに使用でき、さまざまなサンプルタイプに適応できます。しかし、セルソーティングは確立され、広く使用されている技術ですが、ほとんどのEVは最も感度の高いフローサイトメーターでさえも最小検出閾値を下回っているため、EVソーティングは依然として非常に困難です。この目的にソーターをより適したものにするいくつかの機能があります。まず第一に、粒子を懸濁するストリームがフローセル内ではなく空気中のレーザーによって調査されるジェットインエアシステムを使用します。このシステムは、サンプルが受ける応力を減らすことにより、サンプルを保持します。2つ目の重要な点は、ストリームと収集レンズの間に「隠蔽」バーが存在することで、機器のバックグラウンド光学ノイズが減少することです。それは低いですが、バックグラウンドノイズは完全に除去されておらず、しきい値に該当するイベントへの部分的なウィンドウを提供する参照を構成します:機器14の「検出限界」に近いイベントの分析にとって非常に重要です。最後に、ソーターは、サンプル中の小さな粒子と大きな粒子の識別を改善することを可能にする2つの異なるマスクを備えたデュアルパス前方散乱光(FSC)を備えています。
これに基づき、高感度セルソーターを用いて、カルボキシフルオレセインスクシンイミジルエステル(CFSE)標識MSC-EVを分離することを目的としたプロトコールを開発しました。EVの操作を最小限に抑え、その完全性と量を維持するために、サンプル調製中の超遠心分離ステップを回避しました。さらに、ノズルサイズ(35psiの圧力に対して70μmノズル)を下げることにより、装置をさらに最適化するなど、小胞へのストレスを最小限に抑えるために選別条件を調整しました。
プロトコル
ここでのプロトコルは、(1)サンプル調製、(2)ASC-EVの特性評価、(3)ASC-EVの選別、(4)選別後の分析の4つの部分で構成されています。ワークフローを表す概略図を 図 1 に示します。
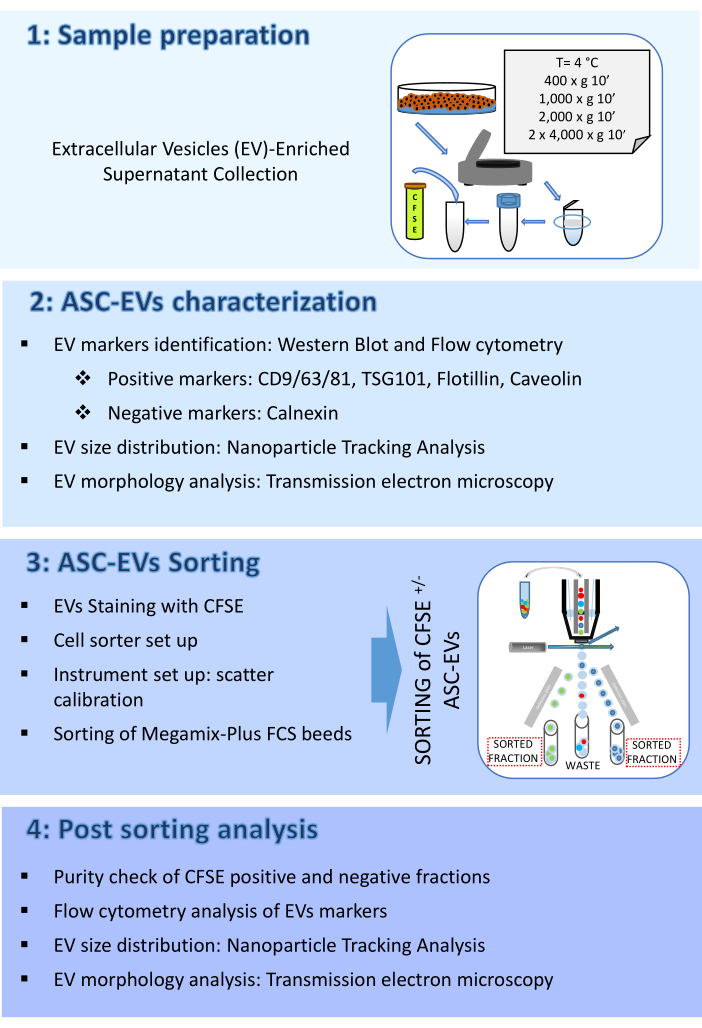
図1:プロトコルフローチャート。 フローチャートには、プロトコルに関連する手順が示されています。(1)サンプル調製、(2)選別前の小胞の特性評価、(3)選別、および(4)選別後の小胞の分析。 この図の拡大版を表示するには、ここをクリックしてください。
1. サンプル調製
- 細胞外小胞(EV)が豊富な上清コレクション
- EVの収集前に継代で培養した脂肪MSC(ASC)を解凍または収集し(通常は継代1〜5)、各ASCごとに播種すると、同じ量の細胞が分離されます(たとえば、フラスコ表面の175cm2あたり100万個の細胞が約60%〜70%のコンフルエントになります)。
- 要求されたプロトコルに従って、要求されたプロトコルに従って、EV-free ウシ胎児血清 (FBS) またはヒト血小板溶解物 (hPL) を添加した適切な培養培地 (このプロトコルでは DMEM-F12) で ASC を 48-72 時間増殖させます。
- EVフリーのFBSまたはhPLを得るには、120,000 x g で4°Cで一晩超遠心分離し、上清を使用します。
注:この時点から、示された遠心力は、常に使用済みの機器、ローター、チューブの平均値を意味します。ローターやチューブが異なれば、rpmあたりのg力とkファクターが変動する場合があることに注意してください。ローターを比較し、Gフォースと速度を調整する簡単な方法については、https://www.beckman.it/centrifuges/rotors/calculator 利用可能な換算表のいずれかを参照してください。
- EVフリーのFBSまたはhPLを得るには、120,000 x g で4°Cで一晩超遠心分離し、上清を使用します。
- 細胞のコンフルエンスが90%になったら、ASCを分離してカウントし、適切な量の無血清培地(理想的には1 x 106 ASCあたり1 mL)に懸濁します。ASCを懸濁液中の24ウェルプレートに1ウェルあたり1 mLで播種します。血清がないと、細胞は懸濁液のままでスフェロイドを形成します。96時間後、上清を回収します。
- 4°Cでの連続遠心分離により、浮遊細胞と破片を除去します:400 x g で10分間、1,000 x g で10分間、2,000 x g で10分間、および2回4,000 x g で10分間。
- 0.22 μmフィルターで上清をろ過し、220 nmを超える残りの粒子を除去します。
注意: ダウンストリームアプリケーションにすぐに使用するか、4°Cで最大1晩保管するか、24時間以内にさらに手順を実行しない場合は-80°Cで凍結します。
- 選別のためのEV染色
- 5(6)-カルボキシフルオレセインジアセテートN-スクシンイミジルエステル(CFSE)の5 mM溶液を調製します。作りたてで使用するか、光を避けて-20°Cで冷凍してください。
- ステップ1.1.1-1.1.5(24時間以内)から直接進むか、-80°Cで保存されたEV含有上清を4°Cで解凍します。
- 染色する前に、上清を37°Cで温め、CFSEを添加して最終濃度を10 μM(500倍希釈)にします。暗所で37°Cで1時間インキュベートします。
- インキュベーション中に、2 mLのPBSを遠心濃縮器(再生セルロースメンブレン、MWCO 100 kDa)に添加し、キャップをして、スイングバケットローターで4,000 x g で10分間遠心分離します。ろ過されていないPBSをフィルターデバイスの底から取り外し、収集チューブからろ液を吸引します。
注:概説されている遠心限外ろ過プロトコルは、最大15 mLのサンプル(最大容量)の処理に基づいています。 - 最大15 mLのサンプルを遠心濃縮器に追加し、デバイスにキャップをします。4,000 x g で最大30分間遠心分離します。
注:これにより、平均して500μLの最終サンプルが得られます。ただし、サンプルの性質や流量などの要因によっては、目的の濃度を達成するために必要な遠心分離時間が異なる場合があります。 - 遠心分離機からデバイスを取り外し、収集チューブを空にします。フィルターデバイスに14mLのPBSを加えます。4,000 x g で最大30分間遠心分離します。
- 手順1.2.6を繰り返します。
- CFSE染色した濃縮EVsサンプルをフィルターデバイスから約500 μLまで回収し、100 μLを暗所4°Cで保存し、残りのサンプルの選別を進めます。
2. ASC-EVの特性評価
- EVマーカーのウェスタンブロット解析
- ペレットASC(1 x 106)を376 x g で室温で5分間、プロテアーゼ阻害剤を添加した適切な溶解緩衝液に懸濁します。選択したアッセイでタンパク質の定量を行います。
注:この研究で経験したように、最良の定量結果はビシンコニン酸アッセイ技術で得られます。 - Bradford法で1 x 106 ASCsに相当するASCs濃縮上清を定量するか、1 x 106 ASCsに対応するペレットEVを100,000 x g 、4°Cで1時間定量し、プロテアーゼ阻害剤を添加した適切な溶解緩衝液に懸濁します。選択したアッセイでタンパク質の定量を行います。
注:この研究で経験したように、EVペレットの最良の定量結果は、ビシンコニン酸アッセイ技術で得られます。 - 精製されたEVの代わりに濃縮された上清を使用する場合は、サンプルを5%の2-メルカプトエタノールと2x Laemmli緩衝液で溶解します。
注:この研究で経験したように、濃縮された上清と精製されたEVの両方が、陽性と負のEVマーカーに対して同等の結果をもたらします。 - サンプル(1-10 μg)を10%ポリアクリルアミドゲルにロードし、110 Vで90分間分離します。
- ニトロセルロースメンブレンに250mAで120分間移します。
- Ponceau Sでメンブレンを染色し、サンプルとラダーの転写を視覚化します。Ponceau SはPBSで軽く振って取り外します。
- 5%脱脂粉乳と0.1%TweenをPBSで60分間ブロックします。
- 陽性(例:この研究でCD9、CD81、TSG101、Flotillin)および陰性(例:この研究でCalnexin)のEVマーカーを含む適切な抗体を含む適切な抗体を含むメンブレンを、4°Cで一晩でプローブします。
- PBSで0.1% Tweenで洗浄し、適切なペルオキシダーゼ標識二次抗体と室温で45分間インキュベートしてから、選択したECLシステムでバンドが明らかになります。利用可能なイメージングシステムで画像を取得します(図2A)。
- ペレットASC(1 x 106)を376 x g で室温で5分間、プロテアーゼ阻害剤を添加した適切な溶解緩衝液に懸濁します。選択したアッセイでタンパク質の定量を行います。
- EVマーカーのフローサイトメトリー解析:表面染色
- 使用前に、各モノクローナル抗体(mAb)を15,000-17,000 x g で4°Cで30分間遠心分離し、偽陽性シグナルを引き起こす可能性のある凝集体を除去します。さらに、mAbsを別々の0.22 μm遠心式フィルターチューブに1,000 x g 、4°Cでろ過し、すべての混合物がフィルターを通過し、フィルターの表面に抗体液が残らなくなるまで加熱します。mAbは4°Cで保存してください。
- CFSEで染色したEV(ステップ1.2.1-1.2.8を参照)を0.22μmでろ過したPBSで1:10に希釈して調製します。
- 100 μLのサンプル、または0.22 μmフィルターPBSを、EV特異的モノクローナル抗体(抗CD9/63/81)またはMSC特異的モノクローナル抗体(抗CD44)の有無にかかわらずインキュベートします。暗所で4°Cで30分間インキュベートします。
注:このプロトコルは、典型的なEVおよびMSC系統マーカーを検出するために開発され、他のすべての細胞系統またはEVサブタイプ特異的な表面マーカーに拡張することができます。フルオレセインイソチオシアネート(FITC)チャネルに落ちる蛍光色素は、EVのCFSE染色との重複を避けるために使用しないでください。1つの蛍光色素(アロフィコシアニン(APC)など)と結合した各mAbを使用して、1回の染色を行います。多色染色も可能ですが、抗体立体障害の問題に対処するためにコントロールを含める必要があります。個々の抗体を単独で、または混合物内で試験し、シグナルが同等であることを確認する必要があります。さらに、FMOをコントロールに含める必要があります。 - ステップ 3.2 の説明に従って、散乱キャリブレーションを設定します。
- サイドスキャッター(SSC)対数スケールとFITC対数スケールのドットプロットを作成し、0.22 μmでろ過したPBSまたは未染色のEVのチューブを泳動します。FITCチャンネルのしきい値を設定し、バックグラウンドノイズの大部分を除外する最大値に調整します。CFSE の正のイベントを識別する領域を描画します。
- CFSE 陽性イベント領域にゲートされた APC ヒストグラム プロットを作成し、0.22 μm でフィルタリングした PBS または未染色 EV のチューブを実行します。
注意: APCゲインについては、機器のQCで確立されたゲインを使用しますが、機器の性能を最適化するために特定のゲインを実行することをお勧めします。 - 0.22 μmフィルターPBSを200 μLで染色したサンプルに加え、取得します。取得と記録には低流量(10μL/分)を使用してください。可能であれば、FITC ポジティブゲートに少なくとも 5,000 のイベントを記録します。
- mAb染色PBSコントロールを使用して、mAbの可能性のある非特異的シグナルを検出します。すべてのサンプルチューブを同じ流速で読み取り、分析間の一貫性を確保します。
- サンプルの相互汚染を避けるために、分析した各チューブ間に界面活性剤を10秒間流し、続いて脱イオン(DI)水で10秒間流します(図2B)。
注:流路系機器が不安定にならないように、サンプルを10秒間取得してから、録音を開始します。
- EVマーカーのフローサイトメトリー解析:細胞内染色
注:細胞内染色には、固定試薬と透過化試薬を含む特定のキットを使用してください。抗カベオリンmAbは、Alexa 488と結合しています。IC染色は、CFSEの非存在下で行われています。- 使用前に、前述のようにmAbを遠心分離します(ステップ2.2.1)。
- 細胞内染色については、製造元の指示に従ってください(図2C)。
- ナノ粒子追跡分析(NTA)によるEVの濃度とサイズの評価
- サンプルを適切に希釈して、NTA機器ディスプレイの表示フレームで20〜120のイベントを取得します。
- 1 mLのインスリンシリンジを使用して、サンプルをNTA装置のサンプルチャンバーに注入します。
- 記録用のNTAソフトウェアを次のように設定します:5つの標準測定値、各60秒、およびフローポンプを30に設定します。
- 光の強度を適切な値に設定すると、背景から粒子を明確に区別し、NTAソフトウェアでキャプチャスクリプトを実行できます。
注意: カメラレベルの設定は、粒子の検出に影響を与える可能性があります。値が高すぎると、乳白色の背景と強い粒子光散乱が現れ、ほとんどの粒子信号を覆います。値が小さすぎると、暗い背景が得られますが、明るさの低いイベントのほとんどが見逃される可能性があります。各サンプルは、最適な設定のために監視する必要があります。 - フレームあたりの粒子数が 20 未満または 80 を超える場合は、希釈係数を調整します。
- しきい値を 4 に設定して、上清の平均モーダル サイズと粒子濃度を解析します。初期希釈係数を考慮に入れてください。
- 各サンプルの後に脱イオン水で装置チャンバーを洗浄し、相互汚染を避けてください。
- NTA分析ソフトウェアを開き、希釈係数を考慮して、取得したサンプルに対して分析を実行します(図2D)。
- 透過型電子顕微鏡(TEM)によるEV形態の評価
- ASCsが濃縮された上清を回収するか、超遠心分離(100,000 x g 、4°Cで1時間)した後、同量のPBSにペレット懸濁液を添加してEVを分離します。
- 5 μLの濃縮上清またはEVをカーボンコーティングされたグリッドに10分間吸収します。濾紙で余分な液体の滴を吸い取ります。
- 2%酢酸ウラニルを水性懸濁液中で、同じ量のサンプル滴下(5 μL)を使用して10分間ネガティブ染色を行います。余分な酢酸ウラニルは、フィルターペーパーでグリッドに触れて取り除きます。
- グリッドを室温(RT)で乾燥させ、透過型電子顕微鏡で120kVで調べます(図2E)。
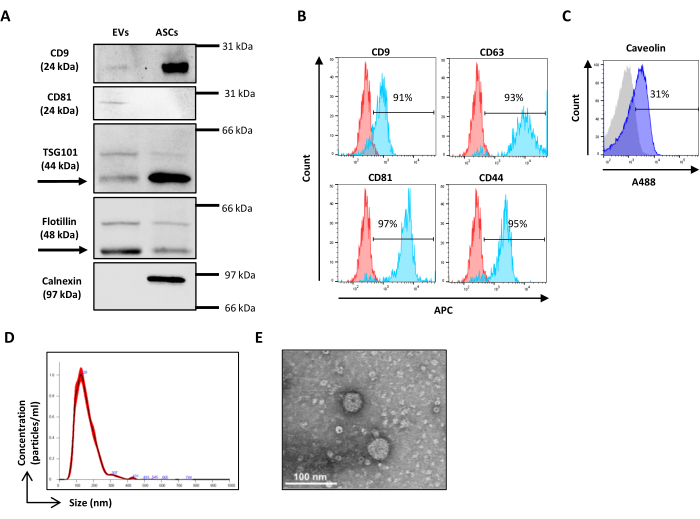
図2:ASC-EVの特性評価 (A)陽性マーカー(CD9、CD81、TSG101、およびFlotillin)および陰性マーカー(Calnexin)の代表的なウェスタンブロット。対応する分子量が報告されており、ASCsライセートがコントロールとして使用されています。(B)EVマーカーのフローサイトメトリー解析。次のマーカーの発現を分析しました:CD9、CD63、CD81、およびCD44。マーカー発現について解析したのは、CFSE陽性のASC-EVのみでした。ヒストグラムは、染色されていない(赤いヒストグラム)と染色された(青いヒストグラム)ASC-EVを表しています。(C)フローサイトメトリーによるEVマーカーカベオリンの細胞内解析。ヒストグラムは、染色されていない(灰色のヒストグラム)と染色された(青色のヒストグラム)ASC-EVを表しています。(D)NTAによるASC-EVの特性評価。ヒストグラムは、サンプルの濃度(粒子/mL)/サイズ(nm)を表します。(E) TEMによるASC-EVの可視化スケールバー= 100nm。 この図の拡大版を表示するには、ここをクリックしてください。
3. ASC-EVの選別
- セルソーターのセットアップ
注:セルソーターは、不均一な開始サンプルから純粋な集団を分離することを可能にするフローサイトメーターです。セルソーターは、圧電でストリームを高周波で振動させることで、目的の粒子を分離し、イベントを含む液滴を生成します。細胞や小胞などの目的の粒子を含んでいた液滴は、金属の偏向プレートを介して帯電および偏向されます。ソートされた分率は、下流分析を実行するために使用されます。- 圧力ラインを開き、掃除機をかけます。
注:一部のソーターには自動起動がありますが、他のソーターには手動起動があります。手動起動のソーターは、周波数、圧力、ノズルチップの選択など、一部の技術的特徴を最適化できるため、好まれます。特に、66,000 Hzの周波数、35 psiの圧力、および70 μmのノズルで作業することをお勧めします。 - 装置の電源を入れ、バイオセーフティキャビネットを開き、ソーターソフトウェアを起動します。
- 流路系を加圧してから、流路系のスイッチを入れます。
- ノズル内の圧電結晶である ドロップドライブをアクティブにして、振動して液滴を発生させます。
- デバブリング手順を実行してシステム内の気泡の存在を排除し、5 mLの洗浄液チューブを高差圧で5分間、5 mLのチューブDI水を5分間実行します。
- 手動 の起動 手順を実行します。
- [レーザー制御]タブで、[レーザー電源]ボタンを押してレーザー電源をオンにします。
注意: すべてのレーザー(青488 nm、黄緑561 nm、紫405 nm、赤640 nm)についてこの手順を繰り返します。 - ストリームの垂直方向の配置を調べます。
注:必要に応じて、ノズルアセンブリステージ、特に前後のマイクロメーター、左右のマイクロメーター、ジンバルを動かして垂直方向の位置合わせを調整し、上下のマイクロメーターで垂直方向の流れを確認します。最適な位置合わせを行うには、各レーザーでストリームを垂直にする必要があります。特定のノズルを初めて使用する場合は、 レーザー遅延 を行う必要があります。タッチ スクリーン パネルの [レーザーとストリーム インターセプト ] タブで、正しいノズル サイズを選択し、[ レーザー遅延 ] ボタンを押し、レーザー遅延の指示に従ってレーザー遅延手順を実行します。一般に、シース圧力、ひいてはノズル先端を変更する場合、アライメントを見つける前に レーザー遅延決定 が実行されます。 Laser Delay 手順の最後に、背景信号を最小限に抑えるために、画面の指示に従ってBackground Image Subtract手順を実行することをお勧めします。 - Laser Stream Intercept(レーザーストリームインターセプト)タブ、緑色の矢印(Green Arrow)ボタンを押し、タッチスクリーンモニターの指示に従って、Laser Spot Determination を実行します。
- [レーザー制御]タブで、[レーザー電源]ボタンを押してレーザー電源をオンにします。
- Intellisort を初期化します。ドロップ ドライブ周波数とデフォルトの振幅値を設定して、ストリームが液滴を形成するようにします。
- この手順を実行したら、保存した設定を読み込みます。保存した設定設定をロードするには、ソーターソフトウェアツールバーの [ソート設定のロード] を選択します。さまざまな周波数と振幅を確認した後、最高の落下安定性を確保する最適なものを選択します。66,000 Hzの周波数と約40〜45 Vの振幅で動作します。
- ファインレーザーアライメント手順を実行します。
- サンプラーに5 mLチューブのQCアライメントビーズをロードし、実行します。[Fine Alignment]タブで、X軸とY軸上の目的のパラメータを選択して、十分に圧縮されコリメートされたビーズを視覚化します。データ表示エリアで、まずY軸パラメータに488 - 513/26-Hを、X軸パラメータに488-FSC1-Hを選択します。次に、すべてのレーザーを微調整するには、Y軸パラメータに405-488/59-Hを、X軸パラメータに640-795/70-Hを選択します。
注意: 選択されるパラメータは、ソーターのレーザー構成によって異なります。装置マニュアルの提案は、ピンホールストリップ上で最も空間的な分離を持つレーザーを選択することです。この目的のために、バイオレットレーザー(405 nm)とレッドレーザー(640 nm)を使用します。 - ソーターの専門家が手動アライメントを確認したら、 自動QCを実行します。QCビーズの直径を選択します:直径3μm。
注:この手順の最後に、 QCが合格しなかった 、または QCが合格したという結果になる可能性があります。QCが失敗した場合は、手動でアライメントを最適化する必要があります。 - QC取得をソフトウェアの Alignment protocolに保存します。
- サンプラーに5 mLチューブのQCアライメントビーズをロードし、実行します。[Fine Alignment]タブで、X軸とY軸上の目的のパラメータを選択して、十分に圧縮されコリメートされたビーズを視覚化します。データ表示エリアで、まずY軸パラメータに488 - 513/26-Hを、X軸パラメータに488-FSC1-Hを選択します。次に、すべてのレーザーを微調整するには、Y軸パラメータに405-488/59-Hを、X軸パラメータに640-795/70-Hを選択します。
- Intellisort プロシージャの終了
- ソーター内の正しい位置に偏向プレートを配置し、電圧をオンにします(偏向プレートに3,000Vの充電を推奨)。
- 6チューブホルダーソート出力を選択し、ストリームインジケーターでストリームを選択して、テストストリームを実行します。
注意: ストリームが明確に分離および定義されていない場合は 、充電フェーズを調整し、デファンニング、またはその他のパラメーターを変更して、明確に定義され、振動しないストリームを取得します。 - Intellisort の [自動ドロップ遅延決定] ボタンを有効にします。この手順により、正しいドロップ遅延を設定できます。この手順の後、ストリームを再度確認します。
- Intellisort 保守モードをアクティブにします。ドロップ遅延を手動で確認します。
- 手動の ドロップディレイ プロトコルをソーターソフトウェアにロードします。蛍光コントロールビーズを取得します。
- 正しいスライドホルダーを挿入します。ソーターソフトウェアで、[ ソート]>ドロップ遅延ウィザードを選択します。 [ソートロジック]を選択します。
- 蛍光顕微鏡で、5番目の水たまりに97%の蛍光ビーズが存在することを確認します。
- 圧力ラインを開き、掃除機をかけます。
- 装置のセットアップ:散布図キャリブレーション
注:散乱キャリブレーションは、Verity Shellsビーズ(以下、中空有機シリカビーズと呼びます)を使用して行われます。これらの有機シリカビーズは、ポリスチレンビーズよりもEVに近い屈折率分布と光散乱特性を特徴としているため、SSCおよびFSC電圧の設定により、EVのようなイベントと電子ノイズをより適切に区別できます。有機シリカビーズは、ビーズ混合物を含む2つのバイアル、VER01A(189 nmビーズ)とVER01B(374 nmビーズ)で構成されています。各バイアルには、中空の有機シリカビーズと380 nmの緑色蛍光ビーズの混合物が含まれており、リファレンスビーズと呼ばれます。中空有機シリカビーズの濃度は1 x 108 ビーズ/ mLです。- VER01AおよびVER01Bビーズのサンプルを調製するには、それぞれ1滴(50 μL)を0.22 μmフィルターPBSの1 mLに希釈し、最終濃度を5,000ビーズ/μLにします。
注意: 使用する前に、ビーズを5秒間ボルテックスします。 - SSC 対数スケールと FITC 対数スケールのドット プロットを作成します。
- VER01Bビーズを取得し、SSC/FITCドットプロットの右上部分でリファレンスビーズがよく識別されるように電圧を調整します(図3A)。
- このビーズの集団の周りに領域を設定します。
- SSC 対数スケールと FSC 対数スケールのドット プロットを作成します。参照ビーズとVER01Bビーズ集団を特定します。VER01Bビーズ集団の周囲に領域を設定します(図3B)。
- VER01Aビーズを取得し、このビーズ集団の周囲に領域を作成します(図3C)。
注意: このビーズの集団は、機器のバックグラウンドノイズと部分的に重なります。 - 0.22 μmでフィルタリングされたPBSを取得し、しきい値を調整して、最小のビーズの視覚化を損なうことなく、機器のバックグラウンドノイズを低減します。
注:散乱キャリブレーションは、直径100 nm、300 nm、500 nm、および900 nmの蛍光ビーズの混合物であるFSC Megamixビーズ(以下、FSCポリスチレンビーズと呼びます)を使用して行うことができます。中空有機シリカビーズの使用は、EVと同様の屈折率分布と光散乱特性を備えているため、FSCポリスチレンビーズよりも優先する必要があります。300 nm FSCポリスチレンビーズの集団は、中空の有機シリカビーズの参照と重複しています。したがって、中空有機シリカビーズに基づくゲートは、フローサイトメーターで同様のサイズのEVを選択します。
- VER01AおよびVER01Bビーズのサンプルを調製するには、それぞれ1滴(50 μL)を0.22 μmフィルターPBSの1 mLに希釈し、最終濃度を5,000ビーズ/μLにします。
- サンプル取得
- SSC対数スケールとFITC対数スケールのドットプロットを作成し、0.22 μmでフィルタリングされたPBSを取得し、基準バックグラウンドノイズを定義します(図4A)。
注:サイトメーターの流量を低に設定し、流量を制御します。イベント数は 2,000 イベント/秒を超えてはなりません。流量 低とは、低差圧を意味します。 - 対照試料(未染色EV)を採取し、流量を確認します。イベント数/秒が約 5,000 イベント/秒であることを確認します。
注:イベント数が推奨数を超える場合は、サンプルを希釈します。 - CFSEサンプルとして染色および処理されたPBSを取得し、陽性イベントが見られないことを確認します(図4B)。
- CFSE染色サンプルを取得します。流量に基づいて希釈します。CFSE の正のイベントを識別する領域と、CFSE の負のイベントを識別する領域を描画します。未染色のサンプルをコントロールとして使用します(図5A、B)。これらはソート領域です。
- SSC対数スケールとFITC対数スケールのドットプロットを作成し、0.22 μmでフィルタリングされたPBSを取得し、基準バックグラウンドノイズを定義します(図4A)。
- サンプルの選別
- ソーターソフトウェアで、新しいプロトコルを開きます(ツールバーで [ファイル]>[プロトコル]>[新規]を選択します)。
- ソーターソフトウェアで、[ データ収集設定]をクリックします。ウィンドウの [Acquisition Parameter]で、目的のチャネルを選択し、他のチャネルを無効にします。この特定のパネルの場合、信号可能は 、488-FSC1、488-FSC2、488-SSC、および 488-513/26 (CFSE信号用)です。
- サンプルの5 mLチューブをサンプラー上に配置します。タッチスクリーンで[ ロード ]ボタンをクリックし、ソーターソフトウェアのツールバーで[ 取得]>[開始 ]を選択します(または F2 ボタンを押します)。サンプルプロパティのウィンドウが表示されます。サンプルの名前を挿入し、[ OK] をクリックします。
- 関心のあるプロットを使用してパネルを作成し、ゲーティング戦略を作成します。
- ソーター ソフトウェア ツールバーで、[ヒストグラム] > [ヒストグラムの作成] を選択します。
- ワークスペースで 3 つのドット プロットを作成します。最初のドット プロットは on x-axis 488-FSC1 Height-Log パラメータと y-axis 488-SSC Height-Log、2 番目のドット プロットは on x-axis 488-FSC2 Height-Log パラメータと y-axis 488-SSC Height-Log、3 つ目は on x-axis 488-513/26 CFSE Height-Log パラメータと y-axis 488-SSC Height-Log のドット プロットです。
- [並べ替え] タブで、並べ替える地域を特定します。ソーターソフトウェアで、[ソート設定]をクリックします。「ソート・ロジックおよび統計」ウィンドウで、ロジック・ビルダーでソートする領域を選択します。
注: 並べ替えを決定するには、 並べ替えロジック、 並べ替えモード、 ドロップ エンベロープなど、さまざまな設定を考慮する必要があります。 ソートロジック は、ゲーティング戦略を参照しています。選択したゲートの外側にあるイベントはソートされません。 ソートモード は、最終出力に関連しています。 浄化モードで作業すると、このように、ソートされたすべてのドロップには、必要なポジティブイベントのみが含まれます。 ドロップエンベロープ は、ポジティブイベントのドロップ内の位置に関連して充電およびソートされるドロップの数を定義します:すべてのポジティブイベントがソートされていることを確認するために1〜2ドロップを選択します。 - 流量が安定したら、集録を停止します(ソーターソフトウェアのツールバーで、[ 集荷]>[停止 ]を選択するか、 もう一度F2 ボタンを押します)。ソートを開始します(ソーターソフトウェアのツールバーで、[ ソート]>[開始 ]を選択するか、 F4 ボタンを押します)。
注: 並べ替えを開始する前に、 テストストリームを確認してください。選別された画分が収集チューブに正しく収まることを確認します。 - ソート設定を保存します。ソーターソフトウェアのツールバーで、[ ソート]>[ソート設定の保存]を選択します。
- 選別された母集団の純度チェック
- 装置を洗浄するには、5 mLのチューブを洗浄液で高差圧で10分間、5 mLのチューブを取り出してDI水を10分間使用します。
- 0.22 μmでフィルタリングされたPBSを取得し、CFSE陽性のイベントが存在しないことを確認します。
- 選別したサンプル5 μLを0.22 μmフィルターPBSの100 μLで希釈します。
- すべてのサンプル量を取得して記録します(図5C、D)。
注:CFSE陽性と陰性の両方のソートされたEVの再分析が報告されています。
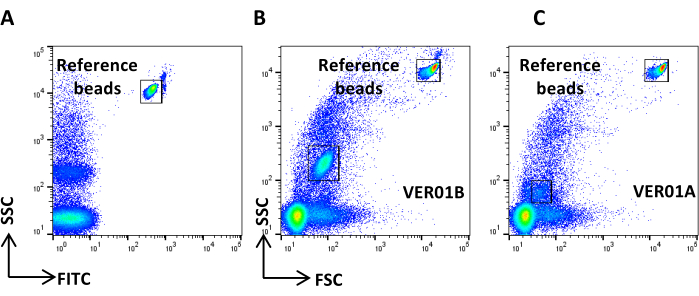
図3:中空有機シリカビーズによる物理パラメータ設定。 (A)SSC / FITCドットプロット:参照緑色の蛍光ビーズを使用してSSCパラメータを設定しています。(B)VER01Bビーズと(C)VER01AビーズのSSC/FSCドットプロット。 この図の拡大版を表示するには、ここをクリックしてください。
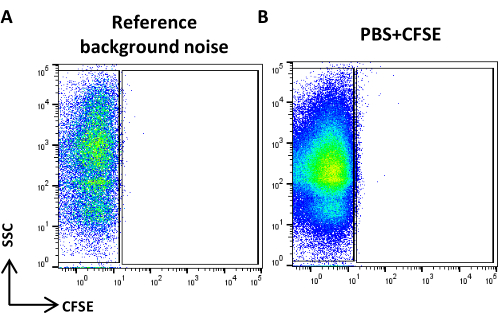
図4:参照バックグラウンドノイズ (A)PBSサンプルのSSC/CFSEドットプロット。(B)PBS+CFSEサンプルのSSC/CFSEドットプロット。 この図の拡大版を表示するには、ここをクリックしてください。
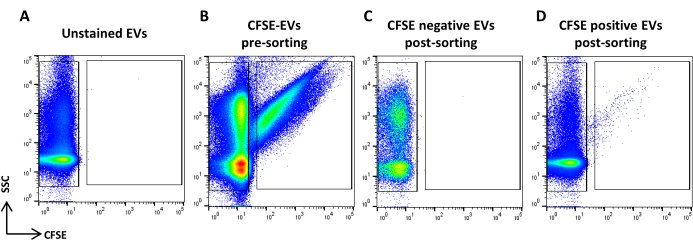
図5:CFSE染色ASC-EVの選別(A)未染色EVのSSC/CFSEドットプロット、(B)CFSE染色EV、(C)選別後のCFSE陰性EV、(D)選別後のCFSE陽性EV。この図の拡大版を表示するには、ここをクリックしてください。
4. ポストソーティング分析
注:選別後の材料の量が限られているため、すべての分析を実行できない場合があります。得られた量により、以下のことが行われる。
- フローサイトメトリーによるEVの特性評価:表面染色(ステップ2.2を参照)
注:サンプル調製以外のサンプルの事前選別については、前述のように述べています。選別後のサンプルは原液のまま使用してもよい。- 希釈されていない選別されたサンプルを使用し、ステップ2.2.3に従って進めます。(図6A)
- NTAによるEV濃度とサイズの特性評価(ステップ2.4を参照)
注:サンプル調製以外のサンプルの事前選別については、前述のように述べています。選別後のサンプルは原液のまま使用してもよい。- 希釈されていない選別されたサンプルを使用し、ステップ2.4.2に従って進めます。(図6B)
- TEMによるEV形態の特性評価(ステップ2.5を参照)
注:サンプル調製以外のサンプルの事前選別については、前述のように述べています。- 遠心濃縮器(再生セルロースメンブレン、MWCO 100 kDa)にPBS2 mLを加え、キャップをして、スイングバケットローターで4,000 x g で10分間遠心分離します。フィルターデバイスの底部からろ過されていないPBSを取り外します。
- 収集チューブから濾液を吸引します。概説されている遠心限外ろ過プロトコルは、最大15 mLのサンプル(最大容量)の処理に基づいています。
- AU-15フィルターに最大15mLのサンプルを加え、デバイスにキャップをします。4,000 x g で最大30分間遠心分離します。デバイスが許容する最小容量(約100〜150μL)まで濃縮します。
- 濃縮された選別されたEVサンプルをフィルターデバイスから回収し、前述したサンプルTEMの事前選別(ステップ2.5.2)( 図6C)について述べたように進めます。
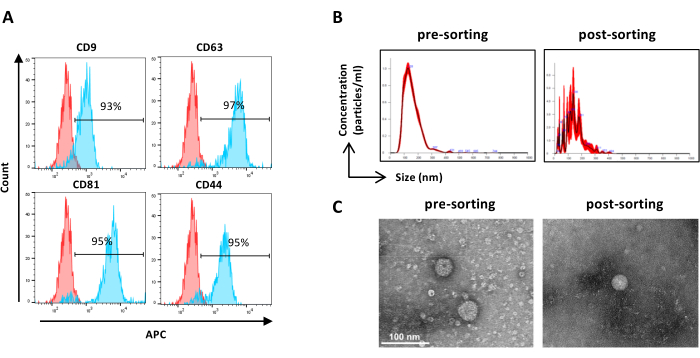
図6:選別されたASC-EVの特性評価。EVマーカーのフローサイトメトリー解析。CD9、CD63、CD81、およびCD44のマーカーの発現を分析しました。マーカー発現について解析したのは、CFSE陽性のASC-EVのみでした。(A)ヒストグラムは、染色されていない(赤色のヒストグラム)と染色された(青色のヒストグラム)ASC-EVを表しています。(B)NTAによるASC-EVの特性評価。ヒストグラムは、選別前(左)と選別後(右)のサンプルの濃度(粒子/mL)/サイズ(nm)を表します。(C)プレソーティング(左)とポストソーティング(右)の試料のTEMによるASC-EVの可視化。スケールバー = 100 nm。この図の拡大版を表示するには、ここをクリックしてください。
結果
FSCポリスチレンビーズは、装置のセットアップと選別条件を検証するために選別されています。FSCポリスチレンビーズは、100 nm、300 nm、500 nm、900 nmの範囲の蛍光ビーズの混合物で、FITCチャネルで見ることができます。 図7A は、ソート前の4つのビーズ集団を使用したSSC対数スケールとFITC対数スケールのドットプロットを示しています。100 nm、30...
ディスカッション
EVはサイズが小さく、ほとんどのフローサイトメーターの検出限界に近いため、分析と選別は困難です。私たちの目的は、CFSEでラベル付けされたAMSCから派生したEVを分離するためのプロトコルを開発することでした。CFSEは、抗体によって与えられるタンパク質凝集体などの不要な粒子が形成されないという高いEV標識効率(≥90%)が報告されているため、染色方法とし?...
開示事項
著者は何も開示していません。
謝辞
技術サポートを提供してくださったEmanuele Canonicoに感謝します。この研究の一部は、IRCCS Ospedale San RaffaeleとUniversità Vita-Salute San Raffaeleによって設立された高度な顕微鏡研究所であるALEMBICで行われました。エンリコ・ラグニとローラ・デ・ジローラモの仕事は、イタリア保健省「リチェルカ・コレンテ」の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
参考文献
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231 (2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63 (2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718 (2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25 (2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603 (2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734 (2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442 (2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved