Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Постановка успешной сортировки для выделения внеклеточных везикул
В этой статье
Резюме
Этот протокол дает подробное описание сортировки внеклеточных везикул (ВВ), выделяемых мезенхимальными стромальными клетками. В частности, основное внимание уделяется настройке приборов и оптимизации условий сортировки. Цель состоит в том, чтобы отсортировать внеклеточные везикулы с сохранением их характеристик.
Аннотация
Внеклеточные везикулы (ВВ), высвобождаемые мезенхимальными стромальными клетками (МСК), содержат набор микроРНК с регенеративной и противовоспалительной ролью. Таким образом, очищенные MSC-EV рассматриваются как терапевтический вариант следующего поколения для широкого спектра заболеваний. В этом протоколе мы описываем стратегию успешной сортировки ВВ от надосадочной жидкости жировых МСК (МСК), часто используемых в ортопедической регенеративной медицине.
Во-первых, мы описали подготовку образца, уделяя особое внимание этапам выделения EV и мечения карбоксифлуоресцеином сукцинимидиловым эфиром (CFSE) для обнаружения флуоресценции; Далее мы подробно описали процесс сортировки, который составляет основную часть протокола.
В дополнение к правилам, определенным в рекомендациях MISEV 2023 и MIFlowCyt EV, мы применили специальные экспериментальные условия, касающиеся размера, частоты и давления оболочки сопла. Морфологические параметры устанавливаются с помощью валиков диаметров, выбранных для покрытия теоретического диапазона размеров EV. После сортировки ASC-EV мы провели проверку чистоты отсортированной фракции, повторно проанализировав ее с помощью сортировщика и проверив распределение EV по размерам с помощью метода анализа с отслеживанием наночастиц.
В связи с растущей важностью электромобилей наличие чистой популяции для изучения и характеристики становится критически важным. В этой статье мы продемонстрируем выигрышную стратегию для настройки сортировки для достижения этой цели.
Введение
Внеклеточные везикулы (ВВ) представляют собой гетерогенную группу мембранно-структурированных везикул, выделяемых почти всеми клетками, ограниченных липидным бислоем, неспособных к самостоятельной репликации1. Они могут быть обнаружены в нескольких биожидкостях, таких как плазма крови, сыворотка, слюна, грудное молоко, моча, жидкость бронхиального лаважа, амниотическая жидкость, спинномозговая жидкость и злокачественный асцит2. Одной из основных функций ВВ является транспортировка различных молекул, включая нуклеиновые кислоты, белки, липиды и углеводы, между донорской и реципиентной клетками. Это может происходить с помощью различных механизмов, таких как прямое слияние мембран, рецептор-лигандное взаимодействие, эндоцитоз и фагоцитоз 3,4. По этой причине было продемонстрировано, что они играют важную роль во многих физиологических и патологических процессах, и они демонстрируют значительные перспективы в качестве новых биомаркеров заболеваний, в качестве средств доставки лекарств и в качестве терапевтическихагентов.
Мезенхимальные стромальные клетки (МСК) представляют собой мультипотентные клетки, которые могут быть выделены из многих тканей, включая жировую ткань, пульпу зуба, пуповинную кровь, плаценту, амниотическую жидкость, желе Уортона и даже мозг, легкие, тимус, поджелудочную железу, селезенку, печень и почки. В последние годы они привлекли значительный интерес к регенеративной медицине7. Мезенхимальные стволовые клетки (ASC), полученные из жировой ткани, могут быть получены из жировой ткани с помощью менее инвазивной процедуры по сравнению с другими источниками, такими как костный мозг, что приводит к снижению риска тяжелых осложнений и позволяет избежатьэтических проблем.
Кроме того, жировая ткань содержит значительно более высокую концентрацию МСК, чем костный мозг (1% против >0,01%) и другие источники, такие как дерма, пульпа зуба, пуповина и плацента. МСК играют решающую роль в регенерации поврежденных тканей и клеток благодаря их способности к дифференцировке и секреции широкого репертуара факторов роста, хемокинов и цитокинов; Эти терапевтические преимущества объясняются их способностью к дифференцировке, а также тем фактом, что они выделяют широкий репертуар факторов роста, хемокинов и цитокинов. Ярким примером является терапевтический потенциал МСК для лечения ортопедических заболеваний, при этом термин «заболевания опорно-двигательного аппарата» имеет наибольшее количество зарегистрированных клинических исследований за clinicaltrials.gov год (по состоянию на 13мая 2024 года).
Кроме того, МСК могут также секретировать ВВ, которые участвуют в регенерации тканей путем передачи информации поврежденным клеткам или тканям и проявляют биологическую активность, аналогичную материнской клетке 9,10. По этой причине МСК-ВВ могут быть ценной заменой клеточной терапии для достижения бесклеточного подхода11, с двумя клиническими исследованиями с использованием МСК-ВВ для ортопедических состояний (NCT05261360 и NCT04998058). Тем не менее, все еще существует ряд проблем для клинического применения электромобилей. Например, существуют некоторые опасения по поводу методов изоляции электромобилей: большинство из них не гарантируют чистоту или целостность везикул. Кроме того, некоторые методы изоляции являются сложными, трудоемкими и имеют низкую повторяемость, что делает их непригодными для клинического использования12.
Сортировка клеток, с другой стороны, является широко используемым методом, который позволяет выделить отдельные клетки из гетерогенных клеточных суспензий с использованием специфических флуоресцентныхмаркеров13. Его можно использовать для многих применений и адаптировать к различным типам образцов. Однако, несмотря на то, что сортировка клеток является хорошо зарекомендовавшей себя и широко используемой технологией, сортировка EV по-прежнему очень сложна, поскольку большинство EV находятся ниже минимального порога обнаружения даже для самых чувствительных проточных цитометров. Есть некоторые особенности, которые делают сортировщик более подходящим для этой цели. Прежде всего, с помощью системы Jet-in-air, в которой поток, суспензирующий частицы, опрашивается лазерами на воздухе, а не внутри проточной ячейки; Эта система сохраняет образец, снижая напряжение, которому он подвергается. Вторым важным моментом является наличие полосы «затемнения» между потоком и линзой сбора, которая снижает фоновый оптический шум прибора. Несмотря на то, что фоновый шум низкий, он не устраняется полностью и представляет собой эталон, который обеспечивает частичное окно в события, попадающие под пороговое значение: это очень важно для анализа событий, которые близки к «пределу обнаружения» прибора14. Наконец, сортировщик оснащен двухканальным прямым рассеянием (FSC) с двумя различными масками, которые обеспечивают улучшенную дискриминацию между мелкими и крупными частицами в образце.
На основе этого мы разработали протокол, направленный на выделение меченых MSC-EV карбоксифлуоресцеина сукцинимидилового эфира (CFSE) с помощью высокочувствительного клеточного сортировщика. Чтобы свести к минимуму манипуляции с электромобилями и сохранить их целостность и количество, мы избегали этапов ультрацентрифугирования во время подготовки образцов. Кроме того, условия сортировки были скорректированы таким образом, чтобы свести к минимуму нагрузку на везикулы, включая дальнейшую оптимизацию нашего прибора за счет снижения давления сортировки, связанного с размером сопла (сопло 70 мкм при давлении 35 фунтов на квадратный дюйм).
Access restricted. Please log in or start a trial to view this content.
протокол
Протокол здесь состоит из четырех частей: (1) Подготовка образцов, (2) Характеристика ASC-EVs, (3) Сортировка ASC-EV и (4) Анализ после сортировки. Схема, представляющая рабочий процесс, показана на рисунке 1.
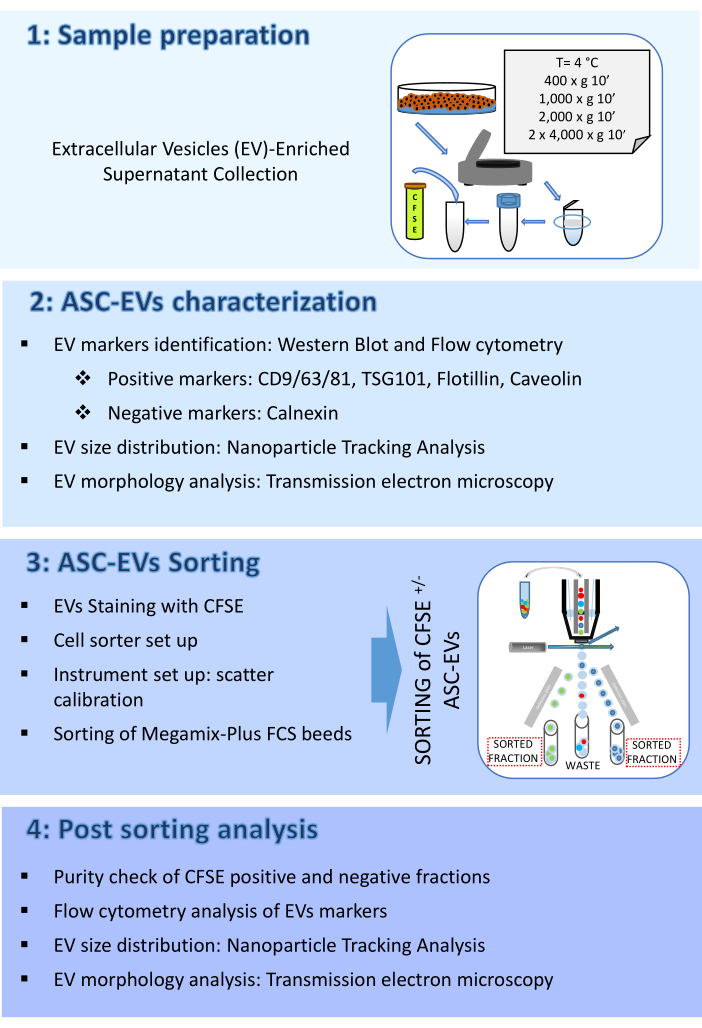
Рисунок 1: Блок-схема протокола. На блок-схеме показаны этапы, включенные в протокол. (1) подготовка образцов, (2) характеристика везикул перед сортировкой, (3) сортировка и (4) анализ везикул после сортировки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Подготовка образцов
- Коллекция надосадочной жидкости, обогащенная внеклеточными везикулами (EV)
- Размораживание или сбор жировых МСК (ИСС), которые были культивированы в пассаже до сбора ВВ (обычно проходы с 1 по 5), и посев на каждый ПСС изолируют идентичное количество клеток (например, 1 миллион клеток на 175см2 поверхности колбы приводит к примерно 60%-70% слиянию).
- Выращивайте ASC в соответствующей питательной среде (DMEM-F12 для данного протокола) с добавлением фетальной бычьей сыворотки (FBS) без EV или лизата тромбоцитов человека (hPL), в соответствии с требуемым протоколом, в течение 48-72 ч.
- Чтобы получить FBS или hPL без EV, ультрацентрифугу при 120 000 x g в течение ночи при 4 °C и используйте надосадочную жидкость.
ПРИМЕЧАНИЕ: С этого момента под отображаемой центробежной силой всегда понимается среднее значение для используемого прибора, ротора и труб. Имейте в виду, что разные роторы или трубки могут иметь переменную перегрузку на оборот и k-фактор. Для простого сравнения роторов и регулировки перегрузки и скорости обратитесь к одной из доступных таблиц преобразования https://www.beckman.it/centrifuges/rotors/calculator.
- Чтобы получить FBS или hPL без EV, ультрацентрифугу при 120 000 x g в течение ночи при 4 °C и используйте надосадочную жидкость.
- При 90% слиянии клеток отделите и подсчитайте ИСК и суспендируйте в нужном объеме бессывороточной среды, в идеале 1 мл на 1 x 106 ИСС. Высевают АСК в суспензии в 24-луночные планшеты по 1 мл на лунку. Без сыворотки клетки останутся во взвешенном состоянии и образуют сфероид. Через 96 ч соберите надосадочную жидкость.
- Удалите плавающие клетки и мусор с помощью последовательного центрифугирования при 4 °C: 400 x g в течение 10 мин, 1 000 x g в течение 10 мин, 2 000 x g в течение 10 мин и дважды 4 000 x g в течение 10 мин.
- Отфильтруйте надосадочную жидкость через фильтр 0,22 мкм, чтобы удалить оставшиеся частицы размером более 220 нм.
ПРИМЕЧАНИЕ: Используйте немедленно для последующих применений или храните не более одной ночи при температуре 4 °C или заморозьте при -80 °C, если дальнейшие действия не будут выполнены в течение 24 часов.
- Окрашивание электромобилей для сортировки
- Приготовьте 5 мМ раствор 5(6)-карбоксифлуоресцеина диацетата N-сукцинимидилового эфира (CFSE). Используйте его свежеприготовленным или заморозьте при температуре -20 °C в защищенном от света месте.
- Приступайте непосредственно к шагам 1.1.1-1.1.5 (в течение 24 ч) или размораживайте хранящиеся ВВ-содержащие надосадочные жидкости при температуре 4 °С.
- Перед окрашиванием нагрейте надосадочную жидкость при температуре 37 °C и добавьте CFSE до конечной концентрации 10 мкМ (500-кратное разбавление). Выдерживать в течение 1 ч при температуре 37 °C в темноте.
- Во время инкубации добавьте 2 мл PBS в центробежный концентратор (мембрана из регенерированной целлюлозы, MWCO 100 кДа), крышку и центрифугируйте при давлении 4 000 x g в течение 10 минут в роторе с качающимся ведром. Удалите нефильтрованный PBS со дна фильтрующего устройства и отсасывайте фильтрат из сборной трубки.
ПРИМЕЧАНИЕ: Описанный протокол центробежной ультрафильтрации основан на обработке до 15 мл образца (максимальный объем). - Добавьте до 15 мл образца в центробежный концентратор и закройте устройство. Центрифуга при давлении 4 000 x g до 30 мин.
ПРИМЕЧАНИЕ: В результате получается окончательный образец в среднем 500 μл. Однако в зависимости от таких факторов, как характер образца и скорость потока, время центрифугирования, необходимое для достижения желаемой концентрации, может варьироваться. - Снимите устройство с центрифуги и опорожните сборную пробирку. Добавьте в фильтрующее устройство 14 мл PBS. Центрифуга при давлении 4 000 x g до 30 мин.
- Повторите шаг 1.2.6.
- Извлеките из фильтрующего устройства концентрированный образец EVs, окрашенный CFSE, примерно 500 μл и храните 100 μL при температуре 4 °C в темноте, продолжая сортировку оставшегося образца.
2. Характеристика ASC-EV
- Вестерн-блоттинг маркеров EV
- Гранулы ASC (1 x 106) при 376 x g при RT в течение 5 мин и суспендировать в соответствующем буфере для лизиса с добавлением ингибиторов протеазы. Проведите количественное определение белка с помощью выбранного анализа.
ПРИМЕЧАНИЕ: Как показывает опыт данного исследования, наилучшие результаты количественной оценки достигаются с помощью метода анализа бицинхониновой кислоты. - Количественно определить концентрированный надосадочный слой в эквиваленте 1 x 106 ASC по методу Брэдфорда или гранулированные EV, соответствующие 1 x 106 ASC при 100 000 x g при 4 °C в течение 1 ч, и суспендировать в соответствующем буфере для лизиса с добавлением ингибиторов протеазы. Проведите количественное определение белка с помощью выбранного анализа.
ПРИМЕЧАНИЕ: Как показывает опыт данного исследования, наилучшие результаты количественной оценки для гранул EV достигаются с помощью метода анализа бицинхониновой кислоты. - Если вместо очищенных EV используется концентрированный надосадочный агент, лизируйте образцы в 5% 2-меркаптоэтанола и 2x буфере Laemmli.
ПРИМЕЧАНИЕ: Как показывает опыт данного исследования, как концентрированная надосадочная жидкость, так и очищенные ВВ дают сопоставимые результаты для положительных и отрицательных маркеров ВВ. - Загрузить и разделить образцы (1-10 мкг) в 10% полиакриламидный гель при напряжении 110 В в течение 90 мин.
- Перенести на нитроцеллюлозную мембрану при давлении 250 мА на 120 мин.
- Окрашивание мембраны с помощью Ponceau S для визуализации образцов и переноса по лестнице. Удалите Ponceau S с PBS под легким встряхиванием.
- Заблокируйте мембраны 5% обезжиренным сухим молоком и 0,1% подростком в PBS в течение 60 минут.
- Зондирующие мембраны с соответствующими антителами при рабочих разведениях, включая положительные (например, в данной работе CD9, CD81, TSG101 и Flotillin) и отрицательные (например, в данной работе Calnexin) маркеры EV, при 4°С в течение суток.
- Промыть 0,1% Tween в PBS и инкубировать с соответствующими пероксидазными вторичными антителами в течение 45 мин при ЛТ до выявления полосы с помощью системы ECL по выбору. Получение изображений с помощью доступной системы визуализации (рис. 2A).
- Гранулы ASC (1 x 106) при 376 x g при RT в течение 5 мин и суспендировать в соответствующем буфере для лизиса с добавлением ингибиторов протеазы. Проведите количественное определение белка с помощью выбранного анализа.
- Проточный цитометрический анализ маркеров EV: поверхностное окрашивание
- Перед применением центрифугируйте каждое моноклональное антитело (mAb) при 15 000-17 000 x g в течение 30 минут при 4 °C для устранения агрегатов, которые могут вызывать ложноположительные сигналы. Далее мАТ фильтруют в отдельные центробежные фильтрующие трубки размером 0,22 мкм при давлении 1000 x g при 4 °C до тех пор, пока вся смесь не пройдет через фильтр и на поверхности фильтра не останется жидкости с антителами. Храните mAb при температуре 4 °C.
- Приготовьте разведение EV, окрашенных CFSE в соотношении 1:10 (см. шаг 1.2.1-1.2.8) в PBS, отфильтрованном по 0,22 мкм.
- Инкубируйте 100 мкл образцов или 0,22 мкм отфильтрованных PBS с EV-специфичными mAb (анти-CD9/63/81) или MSC-специфичными mAb (анти-CD44) или MSC-специфичными mAb (анти-CD44), ранее титрованными. Проводить инкубацию при температуре 4 °C в темноте в течение 30 минут.
Примечание: Этот протокол, разработанный для обнаружения типичных ВВ и маркеров линии МСК, может быть расширен на все другие маркеры клеточной линии или подтип-специфичные для ВВ поверхности. Не используйте флуорохромы, попадающие в канал флуоресцеина изотиоцианата (FITC), чтобы избежать перекрытия при окрашивании CFSE на электромобилях. Выполните однократное окрашивание с использованием каждого mAb, конъюгированного с одним флуорохрома, например, аллофикоцианином (APC). Многоцветное окрашивание возможно, но необходимо включить контроль для устранения потенциальных проблем со стерическими препятствиями антителами. Необходимо протестировать отдельные антитела по отдельности или в составе смеси и убедиться в том, что сигнал сопоставим. Кроме того, FMO должны быть включены в систему контроля. - Настройте калибровку разброса, как описано в шаге 3.2.
- Создание точечной диаграммы логарифмической шкалы бокового рассеяния (SSC) в сравнении с логарифмической шкалой FITC и прогоните трубку с фильтрацией 0,22 мкм либо PBS, либо неокрашенных EV; установите пороговое значение на канале FITC и настройте его на максимальные значения, исключающие большую часть фонового шума. Нарисуйте регион, определяющий положительные события CFSE.
- Создайте график гистограммы APC, стробированный по области положительных событий CFSE, и прогоните трубку с фильтрацией 0,22 мкм либо PBS, либо неокрашенных EV.
ПРИМЕЧАНИЕ: Для усиления APC используйте усиление, установленное с помощью контроля качества прибора, хотя рекомендуется выполнить определенное усиление для оптимизации характеристик инструмента. - Добавьте 200 мкл PBS, отфильтрованного по 0,22 мкм, к окрашенным образцам и соберите. Используйте низкий расход (10 мкл в минуту) для сбора и записи. Если возможно, запишите не менее 5 000 событий в положительный гейт FITC.
- Используйте элемент управления PBS, окрашенный mAb, для обнаружения возможных неспецифических сигналов mAb. Считывание всех пробирок с одной и той же скоростью потока для обеспечения согласованности между прогонами.
- Чтобы избежать перекрестного загрязнения пробы, запустите моющее средство в течение 10 секунд между каждой анализируемой пробиркой, а затем 10 с деионизированной (DI) водой (Рисунок 2B).
ПРИМЕЧАНИЕ: Во избежание нестабильности прибора Fluidics получите образец в течение 10 секунд, а затем начните запись.
- Анализ маркера EV методом проточной цитометрии: внутриклеточное окрашивание
ПРИМЕЧАНИЕ: Для внутриклеточного окрашивания используйте специальный набор, содержащий реагенты для фиксации и пермеабилизации. Анти-кавеолин mAb конъюгирован с Alexa 488. Окрашивание IC проводилось в отсутствие CFSE.- Перед использованием центрифугируйте mAb, как описано ранее (шаг 2.2.1).
- Для внутриклеточного окрашивания следуйте инструкциям производителя (рисунок 2C).
- Определение концентрации и размера EV с помощью анализа с отслеживанием наночастиц (NTA)
- Сделайте соответствующие разведения образцов для получения 20-120 событий в кадре обзора дисплея прибора NTA.
- Введите образцы в камеру для образцов инструмента NTA с помощью инсулинового шприца объемом 1 мл.
- Настройте программное обеспечение NTA для записи следующим образом: 5 стандартных измерений, по 60 с каждое, и насос расхода, установленный на 30.
- Установите интенсивность света на соответствующее значение, позволяющее четко различить частицы на фоне, и запустите скрипт захвата в программном обеспечении NTA.
ПРИМЕЧАНИЕ: Настройка уровня камеры может повлиять на обнаружение частиц. Если значение слишком велико, возникает молочный фон и сильное рассеяние света частиц, охватывающее большую часть сигналов частиц. Если значение слишком низкое, хотя и получается более темный фон, возможно, будет пропущено большинство менее ярких событий. Каждый образец должен контролироваться для оптимальной настройки. - Отрегулируйте коэффициент разбавления, если количество частиц на кадр меньше 20 или больше 80.
- Установите пороговое значение 4 для анализа среднего модального размера и концентрации частиц надосадочной жидкости. Учитывайте исходные коэффициенты разведения.
- Очищайте камеру прибора деионизированной водой после каждого образца, чтобы избежать перекрестного загрязнения.
- Откройте программное обеспечение для анализа NTA и выполните анализ полученных образцов с учетом коэффициента разбавления (рисунок 2D).
- Определение характеристик морфологии EV с помощью просвечивающей электронной микроскопии (ПЭМ)
- Соберите концентрированный надосадочный слой ASC или изолируйте EV путем ультрацентрифугирования (100 000 x g при 4 °C в течение 1 ч) с последующей суспензией гранул в том же объеме PBS.
- Дайте 5 мкл концентрированной надосадочной жидкости или EV впитаться на решетках с углеродным покрытием в течение 10 минут. Промокните лишние капли жидкости фильтровальной бумагой.
- Провести отрицательное окрашивание 2% уранилацетатом в водной суспензии в течение 10 мин с использованием идентичного объема капли образца (5 мкл). Удалите излишки уранилацетата, прикоснувшись к сетке фильтровальной бумагой.
- Высушите решетку при комнатной температуре (RT) и рассмотрите ее с помощью просвечивающего электронного микроскопа при напряжении 120 кВ (рис. 2E).
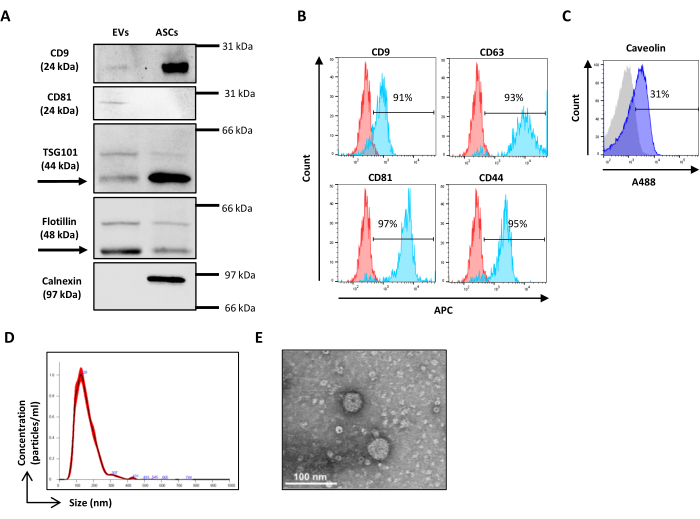
Рисунок 2: Характеристика ASC-EVs. (A) Репрезентативный вестерн-блот положительных (CD9, CD81, TSG101 и Flotillin) и отрицательных (Calnexin) маркеров. Сообщается о соответствующих молекулярных массах, а в качестве контроля используются лизаты ASC. (B) Анализ маркеров EVs методом проточной цитометрии. Анализировали экспрессию следующих маркеров: CD9, CD63, CD81 и CD44. Только CFSE-положительные ASC-EV были проанализированы на экспрессию маркеров. Гистограммы представляют собой неокрашенные (красные гистограммы) и окрашенные (синие гистограммы) ASC-EV. (В) Проточная цитометрия внутриклеточный анализ маркера EVs Caveolin. Гистограммы представляют собой неокрашенные (серая гистограмма) и окрашенные (синие гистограммы) ASC-EV. (D) Определение характеристик ASC-EV компанией NTA. Гистограммы представляют собой концентрацию (частиц/мл)/размер (нм) образца. e) Визуализация ASC-EV с помощью TEM. Масштабные линейки = 100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Сортировка ASC-EV
- Настройка сортировщика ячеек
ПРИМЕЧАНИЕ: Сортировщик клеток представляет собой проточный цитометр, который позволяет выделить чистую популяцию из гетерогенного исходного образца. Сортировщик ячеек отделяет целевые частицы путем колебания потока с помощью пьезоэлектрика с высокой частотой для генерации капель, содержащих событие. Капли, содержащие интересующие частицы, такие как клетки или везикулы, заряжаются и отклоняются через металлические отклоняющие пластины. Отсортированная фракция используется для выполнения последующего анализа.- Откройте напорный трубопровод и пропылесосьте.
ПРИМЕЧАНИЕ: Некоторые сортировщики имеют автоматический запуск, в то время как другие имеют ручной запуск. Сортировщик с ручным запуском является предпочтительным, так как он позволяет оптимизировать некоторые технические характеристики, такие как частота, давление и выбор наконечника форсунки. В частности, рекомендуется работать с частотой 66 000 Гц, давлением 35 psi и соплом 70 мкм. - Включите прибор, откройте шкаф биобезопасности и запустите программное обеспечение сортировщика.
- Нагнетайте давление в гидродинамической системе, а затем включите ее в жидкостную систему.
- Активируйте Drop Drive, пьезоэлектрический кристалл в сопле, который вибрирует, образуя капли.
- Выполните процедуру удаления пузырьков для устранения наличия пузырьков в системе, а затем запустите пробирку 5 мл чистящего раствора в течение 5 минут при высоком перепаде давления и 5 мл пробирки деионизированной воды в течение 5 минут.
- Выполните процедуру запуска вручную.
- На вкладке «Управление лазером» нажмите кнопку «Питание лазера », чтобы включить питание лазера.
ПРИМЕЧАНИЕ: Повторите эту процедуру для всех лазеров: синего 488 нм, желто-зеленого 561 нм, фиолетового 405 нм и красного 640 нм. - Изучите вертикальное выравнивание потока.
ПРИМЕЧАНИЕ: В случае необходимости переместите ступень сборки сопла, в частности, передний и задний микрометр, левый и правый микрометр, а также кардан для регулировки вертикального выравнивания и проверки вертикального потока с помощью верхнего и нижнего микрометра; Для наилучшего выравнивания поток должен быть вертикальным на каждом лазере. Если вы впервые используете определенную насадку, необходимо выполнить лазерную задержку . На сенсорной панели на вкладке «Лазер и перехват потока » выберите правильный размер сопла, нажмите кнопку «Лазерная задержка » и следуйте инструкциям по лазерной задержке, чтобы выполнить процедуру лазерной задержки. Как правило, при изменении давления тубуса и, следовательно, кончика сопла, лазерное определение задержки выполняется до нахождения юстировки. В конце процедуры лазерной задержки предлагается выполнить процедуру вычитания фонового изображения, следуя инструкциям на экране, чтобы свести к минимуму фоновый сигнал. - Выполните определение лазерного пятна, нажав на вкладку «Перехват лазерного потока», кнопку с зеленой стрелкой и следуя инструкциям на сенсорном мониторе.
- На вкладке «Управление лазером» нажмите кнопку «Питание лазера », чтобы включить питание лазера.
- Инициализируйте Intellisort. Установите частоту падения и значение амплитуды по умолчанию, при котором поток образует каплю.
- После выполнения этого шага загрузите сохраненную конфигурацию. Чтобы загрузить сохраненную конфигурацию настроек, выберите «Загрузить настройку сортировки » на панели инструментов программного обеспечения сортировщика. Проверив различные частоты и амплитуды, выберите лучшую, которая обеспечивает наилучшую устойчивость к падениям. Работают на частоте 66 000 Гц и амплитуде около 40-45 В.
- Выполните процедуру точного лазерного выравнивания .
- Загрузите в пробоотборник пробирку объемом 5 мл с валиками для выравнивания QC и запустите ее; выберите на вкладке Fine Alignment нужный параметр по оси X и Y для того, чтобы визуализировать хорошо уплотненные и коллимированные бусины. В области отображения данных выберите в первую очередь 488 - 513/26-H для параметра по оси Y и 488-FSC1-H для параметра по оси X. Затем, чтобы выполнить тонкую настройку всех лазеров, выберите 405-488/59-H для параметра по оси Y и 640-795/70-H для параметра по оси X.
ПРИМЕЧАНИЕ: Выбранные параметры зависят от конфигурации лазера сортировщика. Рекомендация по работе с прибором заключается в выборе лазеров с наибольшим пространственным разнесением на полосе точечного отверстия. Для этого используют фиолетовый лазер (405 нм) и красный лазер (640 нм). - После того, как специалист по сортировщику проверит ручное выравнивание, выполните автоматический контроль качества. Выберите диаметр валиков для контроля качества: диаметр 3 мкм.
ПРИМЕЧАНИЕ: В конце этой процедуры результатом может быть то, что контроль качества не пройден или контроль качества пройден. В случае, если контроль качества не удается, необходимо вручную оптимизировать центровку. - Сохраните данные контроля качества в программном протоколе Alignment.
- Загрузите в пробоотборник пробирку объемом 5 мл с валиками для выравнивания QC и запустите ее; выберите на вкладке Fine Alignment нужный параметр по оси X и Y для того, чтобы визуализировать хорошо уплотненные и коллимированные бусины. В области отображения данных выберите в первую очередь 488 - 513/26-H для параметра по оси Y и 488-FSC1-H для параметра по оси X. Затем, чтобы выполнить тонкую настройку всех лазеров, выберите 405-488/59-H для параметра по оси Y и 640-795/70-H для параметра по оси X.
- Завершение процедуры Intellisort
- Расположите отклоняющие пластины в правильном положении в сортировщике и включите напряжение (рекомендуется зарядка 3 000 В на отклоняющих пластинах).
- Выберите 6 Tube Holder для сортировки выхода, включите потоки, выбрав их на индикаторе потока, и выполните тестовый поток.
ПРИМЕЧАНИЕ: Если потоки четко не разделены и не определены, отрегулируйте фазу заряда, дефраннинг или измените другие параметры, чтобы получить четко определенный и не колеблющийся поток. - Включите кнопку Intellisort Automatic Drop Delay Definition . Этот шаг позволяет установить правильную задержку падения. После этого шага снова проверьте потоки.
- Активируйте режим обслуживания Intellisort. Проверьте задержку сброса вручную.
- Загрузите ручной протокол Drop Delay в программное обеспечение сортировщика. Приобретите флуоресцентные контрольные шарики.
- Вставьте правильный держатель слайдов. В программном обеспечении сортировщика выберите «Сортировать > мастер задержки сброса». Выберите Логика сортировки.
- Проверьте с помощью флуоресцентного микроскопа наличие 97% флуоресцентных шариков на пятой луже.
- Откройте напорный трубопровод и пропылесосьте.
- Настройка прибора: калибровка разброса
ПРИМЕЧАНИЕ: Калибровка рассеяния выполняется с использованием бусин Verity Shells (далее именуемых полыми органическими гранулами кремнезема). Эти кремнеорганические шарики характеризуются распределением показателя преломления и свойствами светорассеяния, более близкими к электромобилям, чем к полистирольным шарикам, что позволяет при настройке напряжения SSC и FSC лучше различать события, подобные EV, и электронный шум. Органоорганические гранулы кремнезема состоят из двух флаконов со смесями гранул: VER01A (189 нм шариков) и VER01B (374 нм шариков). Каждый флакон содержит смесь полых кремнеорганических гранул и зеленых флуоресцентных бусин длиной 380 нм, называемых эталонными бусинами. Концентрация полых органических гранул кремнезема составляет 1 x 108 гранул/мл.- Приготовьте образец гранул VER01A и VER01B, разбавив по одной капле (50 мкл) каждого из них в 1 мл 0,22 мкм отфильтрованного PBS с конечной концентрацией 5 000 бусин/мкл.
ПРИМЕЧАНИЕ: Перед использованием сделайте вихревую обработку бусин в течение 5 секунд. - Создайте точечную диаграмму логарифмической шкалы SSC в сравнении с логарифмической шкалой FITC.
- Получите швы VER01B и отрегулируйте напряжение, чтобы хорошо различить эталонные швы в верхней правой части точечной диаграммы SSC/FITC (Рисунок 3A).
- Установите область вокруг этой популяции бусин.
- Создайте точечную диаграмму логарифмической шкалы SSC в сравнении с логарифмической шкалой FSC. Определите эталонные бусины и популяцию бусин VER01B. Задайте область вокруг популяции бусин VER01B (рисунок 3B).
- Приобретите бусины VER01A и создайте область вокруг этой популяции бусин (Рисунок 3C).
ПРИМЕЧАНИЕ: Эта популяция бусин частично перекрывается с фоновым шумом инструмента. - Получите PBS с фильтрацией 0,22 мкм и отрегулируйте порог для снижения фонового шума прибора без потери визуализации мельчайших бусин.
ПРИМЕЧАНИЕ: Калибровка рассеяния может быть выполнена с использованием шариков FSC Megamix (далее именуемых гранулами полистирола FSC), смеси флуоресцентных шариков со следующими диаметрами: 100 нм, 300 нм, 500 нм и 900 нм. Использование полых органоорганических гранул кремнезема должно быть предпочтительнее, чем гранул из полистирола FSC, поскольку они имеют распределение показателя преломления и свойства рассеяния света, аналогичные электромобилям. Популяция 300 нм гранул полистирола FSC перекрывается с эталоном полых органоорганических гранул кремнезема. Таким образом, затвор на основе полых кремнеорганических гранул кремнезема выбирает EV аналогичного размера на проточном цитометре.
- Приготовьте образец гранул VER01A и VER01B, разбавив по одной капле (50 мкл) каждого из них в 1 мл 0,22 мкм отфильтрованного PBS с конечной концентрацией 5 000 бусин/мкл.
- Получение образцов
- Создайте точечную диаграмму логарифмической шкалы SSC в сравнении с логарифмической шкалой FITC, получите PBS с фильтрацией 0,22 мкм и определите эталонный фоновый шум (рис. 4A).
ПРИМЕЧАНИЕ: Установите скорость потока цитометра в положение «Низкая» и контролируйте скорость потока. Количество событий/ов не должно превышать 2 000 событий/с. Расход Низкий означает при низком перепаде давления. - Возьмите контрольный образец (неокрашенные электромобили) и проверьте скорость потока. Убедитесь, что количество событий/ов составляет около 5 000 событий/с.
ПРИМЕЧАНИЕ: Если количество событий превышает предложенное, разбавьте образец. - Получите окрашенный PBS и обработанный как образец CFSE, и убедитесь, что положительные события не видны (рис. 4B).
- Приобретите образец окрашивания CFSE. Разбавляют его исходя из скорости потока. Нарисуйте регион, определяющий положительные события CFSE, и регион, определяющий отрицательные события CFSE. В качестве контроля используйте неокрашенный образец (рисунок 5A, B). Это регионы сортировки.
- Создайте точечную диаграмму логарифмической шкалы SSC в сравнении с логарифмической шкалой FITC, получите PBS с фильтрацией 0,22 мкм и определите эталонный фоновый шум (рис. 4A).
- Сортировка образцов
- В программном обеспечении сортировщика откройте новый протокол (на панели инструментов выберите Файл > протокол > Новый).
- В программном обеспечении сортировщика нажмите «Настройка сбора данных»; в окне Acquisition Parameter выберите интересующие каналы и отключите остальные. Для этой конкретной панели поддерживаются следующие сигналы: 488-FSC1, 488-FSC2, 488-SSC и 488-513/26 (для сигнала CFSE).
- Найдите на пробоотборнике 5 мл пробирки с образцом. На сенсорном экране нажмите кнопку Загрузить , а на панели инструментов программного обеспечения сортировщика выберите Сбор данных > Начать (или нажмите кнопку F2 ). Появится окно с образцами свойств; Вставьте имя образца и нажмите OK.
- Создайте панель, с интересующим вас участком и создайте стратегию стробирования.
- На панели инструментов программного обеспечения сортировщика выберите Гистограмма > Создать гистограмму.
- В рабочей области создадим три точечных графика, первый с параметром 488-FSC1 Height-Log по оси x и параметром Height-Log по оси Y 488-SSC Height-Log, второй с параметром Height-Log по оси X 488-FSC2 и параметром Height-Log по оси Y 488-SSC Height-Log, третий с параметром Height-Log по оси X 488-513/26 CFSE Height-Log и по оси Y 488-SSC Height-Log.
- На вкладке Сортировка определите регионы, которые необходимо отсортировать. В программном обеспечении сортировщика нажмите кнопку Настройка сортировки. В окне Сортировка логики и статистики выберите область для сортировки в построителе логики.
ПРИМЕЧАНИЕ: Чтобы принять решение о сортировке, необходимо учитывать различные настройки: «Логика сортировки», «Режим сортировки» и «Огибающая». Логика сортировки относится к стратегии стробирования. События, которые находятся за пределами выбранных ворот, не сортируются. Режим сортировки связан с конечным выводом. Работайте в режиме Очищения, таким образом, все отсортированные капли содержат только желаемые положительные события. Drop Envelope определяет, сколько капель будет начислено и отсортировано в зависимости от местоположения в дропе положительного события: выберите 1-2 капли, чтобы быть уверенным, что все положительные события отсортированы. - Когда расход стабилен, остановите сбор данных (на панели инструментов программного обеспечения сортировщика выберите Сбор > Остановить или нажмите кнопку F2 еще раз). Начните сортировку (на панели инструментов программного обеспечения сортировщика выберите «Сортировать» > «Пуск » или нажмите кнопку F4 ).
ПРИМЕЧАНИЕ: Прежде чем начать сортировку, проверьте тестовый поток. Убедитесь, что отсортированная фракция правильно попадает в сборную пробирку. - Сохраните настройку сортировки. На панели инструментов программного обеспечения сортировщика выберите «Сортировка» > «Сохранить настройки сортировки».
- Проверка чистоты отсортированного населения
- Промойте прибор, набрав 5 мл чистящего раствора в течение 10 минут при высоком перепаде давления и 5 мл воды DI в течение 10 минут.
- Получите PBS с фильтрацией 0,22 мкм и убедитесь, что нет CFSE-положительных событий.
- Развести 5 мкл отсортированного образца в 100 мкл 0,22 мкм отфильтрованного PBS.
- Соберите и запишите все объемы образцов (рис. 5C, D).
ПРИМЕЧАНИЕ: Сообщается о повторном анализе как положительных, так и отрицательных отсортированных EV CFSE.
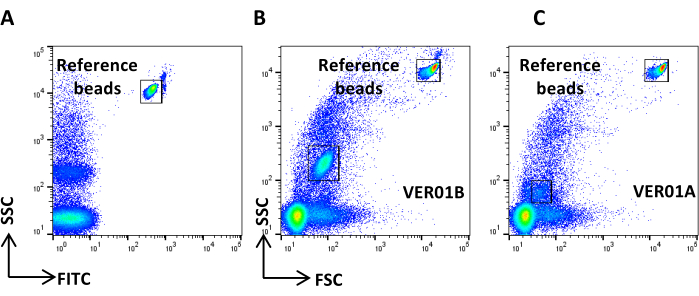
Рисунок 3: Настройка физических параметров с помощью полых органических гранул кремнезема. (A) Точечная диаграмма SSC/FITC: для установки параметра SSC использовались опорные зеленые флуоресцентные шарики. Точечная диаграмма SSC/FSC из (B) бусин VER01B и (C) VER01A. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
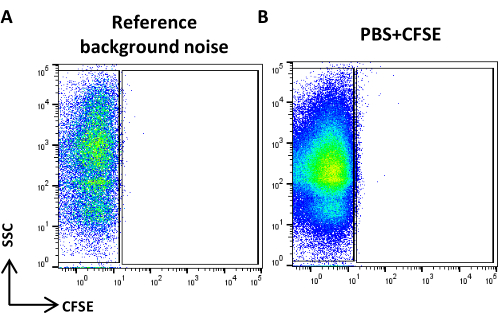
Рисунок 4: Эталонный фоновый шум. (A) Точечная диаграмма SSC/CFSE образца PBS. (B) Точечная диаграмма SSC/CFSE образца PBS + CFSE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
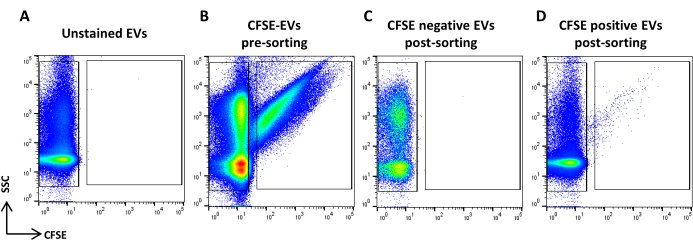
Рисунок 5: Сортировка окрашенных ASC-EV CFSE. (A) Точечная диаграмма SSC/CFSE неокрашенных EV, (B) Окрашенные CFSE EV, (C) отрицательные CFSE EV после сортировки и (D) CFSE положительные EV. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Анализ после сортировки
ПРИМЕЧАНИЕ: Из-за ограниченного количества материала после сортировки может оказаться невозможным выполнить все анализы. С полученной суммой выполняются следующие действия.
- Определение характеристик EV с помощью проточной цитометрии: поверхностное окрашивание (см. шаг 2.2)
ПРИМЕЧАНИЕ: Как описано ранее для предварительной сортировки образцов, за исключением подготовки образцов. Образцы после сортировки можно использовать в неразбавленном виде.- Используйте неразбавленные отсортированные образцы и действуйте в соответствии с пунктом 2.2.3. (Рисунок 6А)
- Определение концентрации и размера EV с помощью NTA (см. шаг 2.4)
ПРИМЕЧАНИЕ: Как описано ранее для предварительной сортировки образцов, за исключением подготовки образцов. Образцы после сортировки можно использовать в неразбавленном виде.- Используйте неразбавленные отсортированные образцы и действуйте в соответствии с шагом 2.4.2. (Рисунок 6В)
- Определение характеристик морфологии EV с помощью ПЭМ (см. шаг 2.5)
ПРИМЕЧАНИЕ: Как описано ранее для предварительной сортировки образцов, за исключением подготовки образцов.- Добавьте 2 мл PBS в центробежный концентратор (мембрана из регенерированной целлюлозы, MWCO 100 кДа), крышку и центрифугуйте при давлении 4 000 x g в течение 10 минут в роторе с качающимся ведром. Удалите нефильтрованный PBS со дна фильтрующего устройства.
- Фильтрат аспирата из сборной пробирки. Описанный протокол центробежной ультрафильтрации основан на обработке образцов объемом до 15 мл (максимальный объем).
- Добавьте до 15 мл образца в фильтр AU-15 и закройте устройство крышкой. Центрифуга при давлении 4 000 x g до 30 мин. Сконцентрируйте до минимального объема, который позволяет устройство, примерно 100-150 μл.
- Извлеките концентрированную отсортированную пробу EV из фильтрующего устройства и действуйте, как описано ранее для предварительной сортировки проб TEM (шаг 2.5.2) ( рис. 6C).
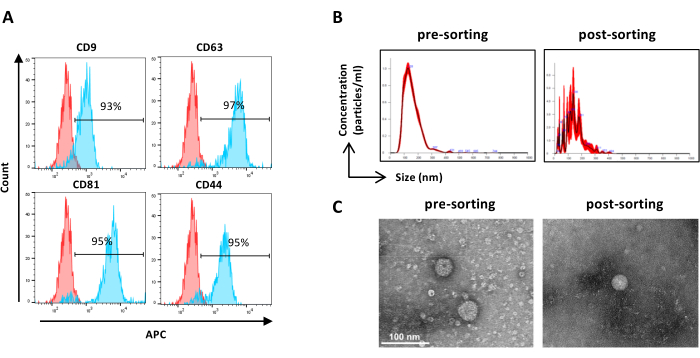
Рисунок 6: Характеристика отсортированных ASC-EV. Проточный цитометрический анализ маркеров EV. Анализировали экспрессию следующих маркеров: CD9, CD63, CD81 и CD44. Только CFSE-положительные ASC-EV были проанализированы на экспрессию маркеров. (A) Гистограммы представляют собой неокрашенные (красные гистограммы) и окрашенные (синие гистограммы) ASC-EV. (B) Определение характеристик ASC-EV компанией NTA. Гистограммы представляют собой концентрацию (частиц/мл)/размер (нм) образцов предварительной сортировки (слева) и после сортировки (справа). (C) Визуализация ASC-EV с помощью ПЭМ предварительной сортировки (слева) и последующей сортировки (справа) пробы. Масштабные линейки = 100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Гранулы из полистирола FSC были отсортированы для проверки настройки прибора и условий сортировки. Шарики из полистирола FSC представляют собой смесь флуоресцентных шариков в диапазоне от 100 нм, 300 нм, 500 нм и 900 нм, которые видны на канале FITC. На рисунке 7A п?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Анализ и сортировка EV является сложной задачей из-за их небольшого размера и того факта, что они близки к пределу обнаружения большинства проточных цитометров. Наша цель состояла в том, чтобы разработать протокол для изоляции электромобилей, полученных из AMSC, помечен?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Благодарим Эмануэле Канонико за техническую поддержку. Часть этой работы была выполнена в ALEMBIC, передовой микроскопической лаборатории, созданной IRCCS Ospedale San Raffaele и Università Vita-Salute San Raffaele. Работа Энрико Рагни и Лауры де Джироламо была поддержана Министерством здравоохранения Италии, "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
Ссылки
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены