É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Configurando uma classificação bem-sucedida para isolamento de vesículas extracelulares
Neste Artigo
Resumo
Este protocolo fornece uma descrição detalhada da classificação de vesículas extracelulares (EVs) liberadas por células estromais mesenquimais. Em particular, ele se concentra na configuração do instrumento e na otimização das condições de classificação. O objetivo é classificar as vesículas extracelulares, preservando suas características.
Resumo
As vesículas extracelulares (EVs) liberadas pelas células estromais mesenquimais (MSCs) contêm um conjunto de microRNAs com papéis regenerativos e anti-inflamatórios. Portanto, os MSC-EVs purificados são concebidos como uma opção terapêutica de última geração para uma ampla gama de doenças. Neste protocolo, relatamos a estratégia para classificar com sucesso EVs do sobrenadante de MSCs derivadas de tecido adiposo (ASCs), frequentemente usadas em aplicações de medicina regenerativa ortopédica.
Primeiro, descrevemos a preparação da amostra, com foco nas etapas de isolamento EV e marcação com éster succinimidílico carboxifluoresceína (CFSE) para detecção de fluorescência; Posteriormente, detalhamos o processo de triagem, que constitui a parte principal do protocolo.
Além das regras definidas pelas diretrizes MISEV 2023 e MIFlowCyt EV, aplicamos condições experimentais específicas relativas ao tamanho do bico, frequência e pressão da bainha. Os parâmetros morfológicos são estabelecidos usando contas de diâmetros selecionados para cobrir a faixa teórica do tamanho do EV. Após a classificação de ASC-EVs, realizamos uma verificação de pureza da fração classificada, reanalisando-a com o classificador e verificando a distribuição do tamanho EV com a técnica de análise de rastreamento de nanopartículas.
Devido à crescente importância dos VEs, ter uma população pura para estudar e caracterizar está se tornando crucial. Aqui, demonstramos uma estratégia vencedora para configurar a classificação para atingir esse objetivo.
Introdução
As vesículas extracelulares (EVs) são um grupo heterogêneo de vesículas estruturadas por membrana liberadas por quase todas as células, delimitadas por uma bicamada lipídica, incapazes de se replicar por conta própria1. Podem ser encontrados em vários biofluidos, como plasma sanguíneo, soro, saliva, leite materno, urina, lavado brônquico, líquido amniótico, líquido cefalorraquidiano e ascite maligna2. Uma das principais funções dos EVs é transportar várias moléculas, incluindo ácidos nucléicos, proteínas, lipídios e carboidratos, entre uma célula doadora e uma receptora. Isso pode ocorrer por meio de vários mecanismos, como fusão direta da membrana, interação receptor-ligante, endocitose e fagocitose 3,4. Por esse motivo, eles demonstraram desempenhar um papel importante em muitos processos fisiológicos e patológicos e se mostram consideráveis como novos biomarcadores de doenças, como veículos de entrega de medicamentos e como agentes terapêuticos 5,6.
As células estromais mesenquimais (MSCs) são células multipotentes que podem ser isoladas de muitos tecidos, incluindo tecido adiposo, polpa dentária, sangue do cordão umbilical, placenta, líquido amniótico, geléia de Wharton e até mesmo cérebro, pulmão, timo, pâncreas, baço, fígado e rim. Nos últimos anos, eles têm atraído considerável interesse pela medicina regenerativa7. As células-tronco mesenquimais (ASCs) derivadas do tecido adiposo podem ser colhidas do tecido adiposo por meio de um procedimento menos invasivo em comparação com outras fontes, como a medula óssea, resultando em menores riscos de complicações graves e evitando questões éticas8.
Além disso, o tecido adiposo contém uma concentração significativamente maior de MSCs do que a medula óssea (1% versus >0,01%) e outras fontes, como derme, polpa dentária, cordão umbilical e placenta. As MSCs são cruciais na regeneração de tecidos e células lesadas devido à sua capacidade de diferenciação e secreção de um amplo repertório de fatores de crescimento, quimiocinas e citocinas; Esses benefícios terapêuticos são atribuíveis à sua capacidade de diferenciação, mas também ao fato de secretarem um amplo repertório de fatores de crescimento, quimiocinas e citocinas. Um exemplo marcante é dado pelo potencial terapêutico das MSCs para condições ortopédicas, com o termo "Doenças Musculoesqueléticas" tendo o maior número de estudos clínicos registrados em clinicaltrials.gov (acessado em 13de maio de 2024).
Além disso, as MSCs também podem secretar EVs que participam da regeneração tecidual por meio da transferência de informações para células ou tecidos danificados e exercem atividade biológica semelhante às células-mãe 9,10. Por esse motivo, as MSC-EVs podem ser um substituto valioso para a terapia celular para alcançar uma abordagem livre de células11, com dois estudos clínicos envolvendo MSC-EVs para condições ortopédicas (NCT05261360 e NCT04998058). No entanto, ainda existem vários desafios para as aplicações clínicas dos VEs. Por exemplo, existem algumas preocupações sobre as técnicas de isolamento de EV: a maioria delas não garante a pureza ou integridade da vesícula. Além disso, algumas técnicas de isolamento são complexas, demoradas e têm baixa repetibilidade, tornando-as inadequadas para uso clínico12.
A classificação celular, por outro lado, é um método comumente usado que permite o isolamento de células únicas de suspensões celulares heterogêneas usando marcadores fluorescentes específicos13. Pode ser usado para muitas aplicações e adaptado a diferentes tipos de amostras. No entanto, embora a classificação de células seja uma tecnologia bem estabelecida e amplamente utilizada, a classificação de EV ainda é muito desafiadora porque a maioria dos EVs está abaixo do limite mínimo de detecção até mesmo para os citômetros de fluxo mais sensíveis. Existem alguns recursos que tornam um classificador mais adequado para essa finalidade. Em primeiro lugar, usando um sistema Jet-in-air no qual o fluxo que suspende as partículas é interrogado por lasers no ar, em vez de dentro de uma célula de fluxo; Este sistema preserva a amostra, diminuindo o estresse a que ela é submetida. Um segundo ponto importante é a presença de uma barra de "obscurecimento" entre o fluxo e a lente de coleta que diminui o ruído óptico de fundo do instrumento. Embora seja baixo, o ruído de fundo não é completamente eliminado e constitui uma referência que fornece uma janela parcial para os eventos que se enquadram no limiar: é muito importante para a análise de eventos que estão próximos do "limite de detecção" do instrumento14. Finalmente, o classificador apresenta um Forward Scatter (FSC) de caminho duplo com duas máscaras diferentes que permitem uma melhor discriminação entre partículas pequenas e grandes na amostra.
Com base nisso, desenvolvemos um protocolo com o objetivo de separar o éster succinimidílico de carboxifluoresceína (CFSE) marcado com MSC-EVs usando um classificador de células de alta sensibilidade. Para minimizar a manipulação de EVs e preservar sua integridade e quantidade, evitamos etapas de ultracentrifugação durante o preparo da amostra. Além disso, as condições de classificação foram ajustadas para minimizar o estresse nas vesículas, incluindo uma otimização adicional de nosso instrumento, reduzindo a pressão de classificação associada ao tamanho do bico (bico de 70 μm para uma pressão de 35 psi).
Access restricted. Please log in or start a trial to view this content.
Protocolo
O protocolo aqui consiste em quatro partes: (1) Preparação da amostra, (2) caracterização de ASC-EVs, (3) classificação de ASC-EVs e (4) análise pós-classificação. Um esquema que representa o fluxo de trabalho é mostrado na Figura 1.
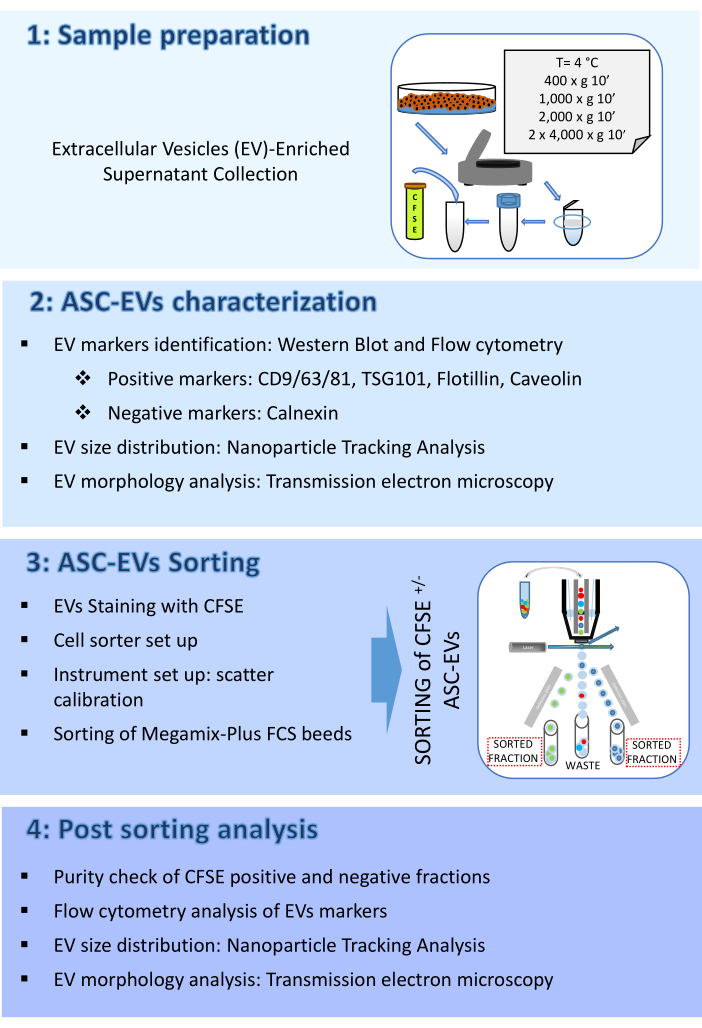
Figura 1: Fluxograma do protocolo. O fluxograma mostra as etapas envolvidas no protocolo. (1) preparação de amostras, (2) caracterização de vesículas antes da triagem, (3) classificação e (4) análise de vesículas pós-triagem. Clique aqui para ver uma versão maior desta figura.
1. Preparação da amostra
- Coleção de sobrenadantes enriquecida com vesículas extracelulares (EV)
- Descongelar ou coletar MSCs adiposas (ASCs) que foram cultivadas na passagem antes da coleta de EVs (geralmente passagem 1 a 5) e semear por cada ASC isolar uma quantidade idêntica de células (por exemplo, 1 milhão de células por 175 cm2 de superfície do frasco resulta em aproximadamente 60% -70% de confluência).
- Cultive ASCs no meio de cultura apropriado (DMEM-F12 para este protocolo) suplementado com soro fetal bovino (FBS) livre de EV ou lisado de plaquetas humanas (hPL), conforme o protocolo solicitado, por 48-72 h.
- Para obter FBS ou hPL livre de EV, ultracentrifugar a 120.000 x g durante a noite a 4 °C e usar o sobrenadante.
NOTA: A partir deste ponto, a força centrífuga indicada é sempre a média para o instrumento, rotor e tubos usados. Lembre-se de que diferentes rotores ou tubos podem ter força g variável por rpm e fator k. Para uma maneira fácil de comparar rotores e ajustar a força g e a velocidade, consulte uma das tabelas de conversão disponíveis https://www.beckman.it/centrifuges/rotors/calculator.
- Para obter FBS ou hPL livre de EV, ultracentrifugar a 120.000 x g durante a noite a 4 °C e usar o sobrenadante.
- A 90% de confluência celular, desconecte e conte as ASCs e suspenda em um volume adequado de meio livre de soro, idealmente 1 mL por 1 x 106 ASCs. Semeie ASCs em suspensão em placas de 24 poços com 1 mL por poço. Sem soro, as células permanecerão em suspensão e formarão um esferóide. Após 96 h, recolher o sobrenadante.
- Remover células flutuantes e detritos por centrifugação em série a 4 °C: 400 x g durante 10 min, 1.000 x g durante 10 min, 2.000 x g durante 10 min e duas vezes 4.000 x g durante 10 min.
- Filtrar o sobrenadante através de um filtro de 0,22 μm para remover as partículas restantes maiores que 220 nm.
NOTA: Use imediatamente para aplicações a jusante ou armazene por no máximo uma noite a 4 ° C ou congele a -80 ° C se outras etapas não forem executadas em 24 h.
- Coloração EVs para classificação
- Preparar uma solução a 5 mM de éster N-succinimidílico de diacetato de 5(6)-carboxifluoresceína (CFSE). Use-o preparado na hora ou congele a -20 °C protegido da luz.
- Proceder directamente a partir dos passos 1.1.1-1.1.5 (dentro de 24 h) ou descongelar a 4 °C os sobrenadantes contendo EV armazenados a -80 °C.
- Antes da coloração, aqueça os sobrenadantes a 37 °C e adicione CFSE para uma concentração final de 10 μM (diluição de 500 vezes). Incubar durante 1 h a 37 °C no escuro.
- Durante a incubação, adicione 2 mL de PBS a um concentrador centrífugo (membrana de celulose regenerada, MWCO 100 kDa), tampa e centrifugue a 4.000 x g por 10 min em um rotor de caçamba oscilante. Remover o PBS não filtrado do fundo do dispositivo filtrante e aspirar o filtrado do tubo de recolha.
NOTA: O protocolo de ultrafiltração centrífuga descrito é baseado no processamento de até 15 mL da amostra (volume máximo). - Adicione até 15 mL de amostra ao concentrador centrífugo e tampe o dispositivo. Centrifugue a 4.000 x g por até 30 min.
NOTA: Isso produzirá uma amostra final de 500 μL em média. No entanto, dependendo de fatores como a natureza da amostra e a vazão, o tempo de centrifugação necessário para atingir a concentração desejada pode variar. - Remova o dispositivo da centrífuga e esvazie o tubo de coleta. Adicione 14 mL de PBS ao dispositivo de filtro. Centrifugue a 4.000 x g por até 30 min.
- Repita a etapa 1.2.6.
- Recuperar amostras de EVs concentradas coradas com CFSE do dispositivo filtrante, aproximadamente 500 μL, e armazenar 100 μL a 4 °C no escuro enquanto procede à classificação da amostra restante.
2. Caracterização de ASC-EVs
- Análise de Western blot de marcadores EV
- ASCs de pellets (1 x 106) a 376 x g em RT por 5 min e suspender em tampão de lise apropriado suplementado com inibidores de protease. Realize a quantificação de proteínas com o ensaio de sua escolha.
NOTA: Como experimentado neste estudo, os melhores resultados de quantificação são obtidos com a técnica de ensaio de ácido bicinconínico. - Quantificar o sobrenadante concentrado em ASCs equivalente a 1 x 106 ASCs com a técnica de Bradford ou EVs de pellets correspondentes a 1 x 106 ASCs a 100.000 x g a 4 ° C por 1 h e suspender em tampão de lise apropriado suplementado com inibidores de protease. Realize a quantificação de proteínas com o ensaio de sua escolha.
NOTA: Conforme experimentado neste estudo, os melhores resultados de quantificação para pellets EV são obtidos com a técnica de ensaio de ácido bicinconínico. - Se for usado sobrenadante concentrado no lugar de EVs purificados, lisar as amostras em 5% de 2-mercaptoetanol e 2x tampão Laemmli.
NOTA: Conforme experimentado neste estudo, tanto o sobrenadante concentrado quanto os EVs purificados fornecem resultados comparáveis para marcadores EV positivos e negativos. - Carregue e separe as amostras (1-10 μg) em um gel de poliacrilamida a 10% a 110 V por 90 min.
- Transferir para uma membrana de nitrocelulose a 250 mA durante 120 min.
- Membrana de coloração com Ponceau S para visualização de amostras e transferência em escada. Remova Ponceau S com PBS sob agitação suave.
- Bloqueie as membranas com 5% de leite em pó desnatado e 0,1% de Tween em PBS por 60 min.
- Sonda membranas com anticorpos apropriados em diluições de trabalho, incluindo marcadores EV positivos (por exemplo, neste trabalho CD9, CD81, TSG101 e Flotilina) e negativos (por exemplo, neste trabalho Calnexin), a 4 ° C durante a noite.
- Lave com Tween a 0.1% em PBS e incube com anticorpos secundários conjugados com peroxidase apropriados por 45 min em RT antes que a banda se revele com o sistema ECL de escolha. Adquira imagens com um sistema de imagem disponível (Figura 2A).
- ASCs de pellets (1 x 106) a 376 x g em RT por 5 min e suspender em tampão de lise apropriado suplementado com inibidores de protease. Realize a quantificação de proteínas com o ensaio de sua escolha.
- Análise por citometria de fluxo de marcadores EV: coloração superficial
- Antes de usar, centrifugue cada anticorpo monoclonal (mAb) a 15.000-17.000 x g por 30 min a 4 ° C para eliminar agregados, que podem causar sinais falsos positivos. Além disso, filtre os mAbs em tubos de filtro centrífugo separados de 0,22 μm a 1.000 x g a 4 ° C até que toda a mistura tenha passado pelo filtro e nenhum líquido de anticorpo permaneça na superfície do filtro. Armazene os mAbs a 4 °C.
- Prepare uma diluição de 1:10 de EVs corados com CFSE (consulte as etapas 1.2.1-1.2.8) em PBS filtrado com 0,22 μm.
- Incubar 100 μL de amostras, ou PBS filtrado por 0,22 μm, com ou sem mAbs específicos para EV (anti-CD9/63/81) ou mAbs específicos para MSC (anti-CD44), previamente titulados. Realize a incubação a 4 °C no escuro por 30 min.
NOTA: Este protocolo, desenvolvido para detectar EVs típicos e marcadores de linhagem MSC, pode ser estendido a todas as outras linhagens celulares ou marcadores de superfície específicos do subtipo EVs. Não use fluorocromos que caiam no canal de isotiocianato de fluoresceína (FITC) para evitar sobreposição com a coloração CFSE de EVs. Realize uma única coloração usando cada mAb conjugado com um fluorocromo, por exemplo, aloficocianina (APC). A coloração multicolorida é possível, mas os controles devem ser incluídos para resolver possíveis problemas de impedimento estérico de anticorpos. É necessário testar os anticorpos individuais sozinhos ou dentro de uma mistura e garantir que o sinal seja comparável. Além disso, os FMOs precisam ser incluídos entre os controles. - Configure a calibração de dispersão conforme descrito na etapa 3.2.
- Crie um gráfico de pontos da escala logarítmica de dispersão lateral (SSC) versus a escala logarítmica FITC e execute um tubo de PBS filtrado por 0,22 μm ou EVs não corados; defina o limite no canal FITC e ajuste-o para os valores mais altos que excluem a maioria do ruído de fundo. Desenhe uma região identificando os eventos positivos do CFSE.
- Crie um gráfico de histograma APC fechado na região de eventos positivos CFSE e execute um tubo de PBS filtrado por 0,22 μm ou EVs não corados.
NOTA: Para ganho de APC, use o ganho estabelecido com o CQ do instrumento, embora seja recomendado realizar uma gaintração específica para otimizar o desempenho do instrumento. - Adicione 200 μL de PBS filtrado a 0,22 μm às amostras coradas e adquira. Use uma taxa de fluxo baixa (10 μL por minuto) para aquisição e gravação. Se possível, registre pelo menos 5.000 eventos na porta positiva do FITC.
- Use o controle PBS corado com mAb para detectar possíveis sinais aespecíficos dos mAbs. Leia todos os tubos de amostra na mesma taxa de fluxo para garantir a consistência entre as execuções.
- Para evitar a contaminação cruzada da amostra, passe um detergente por 10 s entre cada tubo analisado, seguido de 10 s com água deionizada (DI) (Figura 2B).
NOTA: Para evitar qualquer instabilidade do instrumento fluídico, adquira a amostra por 10 s e comece a gravar.
- Análise de citometria de fluxo do marcador EV: Coloração intracelular
NOTA: Para coloração intracelular, use um kit específico contendo reagentes de fixação e permeabilização. O mAb anti-caveolina é conjugado com Alexa 488. A coloração IC foi realizada na ausência de CFSE.- Antes de usar, centrifugue o mAb conforme descrito anteriormente (etapa 2.2.1).
- Para coloração intracelular, siga as instruções do fabricante (Figura 2C).
- Caracterização da concentração e tamanho de EV por análise de rastreamento de nanopartículas (NTA)
- Faça diluições apropriadas das amostras para obter 20-120 eventos no quadro de visualização do visor do instrumento NTA.
- Injetar as amostras na câmara de recolha de amostras do instrumento NTA utilizando uma seringa de insulina de 1 ml.
- Defina o software NTA para gravação da seguinte forma: 5 medições padrão, 60 s cada, e uma bomba de fluxo ajustada para 30.
- Defina a intensidade da luz para um valor apropriado, permitindo distinguir claramente as partículas do fundo e executar o script de captura no software NTA.
NOTA: A configuração do nível da câmera pode influenciar a detecção de partículas. Se o valor for muito alto, um fundo leitoso e um forte espalhamento de luz de partículas emergem, cobrindo a maioria dos sinais de partículas. Se o valor for muito baixo, embora um fundo mais escuro seja obtido, é possível que a maioria dos eventos menos claros seja perdida. Cada amostra deve ser monitorada para uma configuração ideal. - Ajustar o factor de diluição se as partículas por imagem forem inferiores a 20 ou superiores a 80.
- Defina o limite como 4 para analisar o tamanho modal médio e a concentração de partículas do sobrenadante. Ter em conta os factores de diluição iniciais.
- Limpe a câmara do instrumento com água deionizada após cada sample para evitar contaminação cruzada.
- Abra o software de análise NTA e faça a análise nas amostras adquiridas, levando em consideração o fator de diluição (Figura 2D).
- Caracterização da morfologia do EV por microscopia eletrônica de transmissão (MET)
- Coletar sobrenadante concentrado em ASCs ou isolar EVs por ultracentrifugação (100.000 x g a 4 °C por 1 h) seguida de suspensão de pellets no mesmo volume de PBS.
- Permita que 5 μL do sobrenadante concentrado ou EVs sejam absorvidos em grades revestidas de carbono por 10 min. Seque o excesso de gotas de líquido com papel de filtro.
- Realize a coloração negativa com acetato de uranila a 2% em suspensão aquosa por 10 min usando um volume idêntico da gota da amostra (5 μL). Remova o excesso de acetato de uranilo tocando na grade com papel de filtro.
- Secar a grelha à temperatura ambiente (RT) e examiná-la com um microscópio electrónico de transmissão a 120 kV (figura 2E).
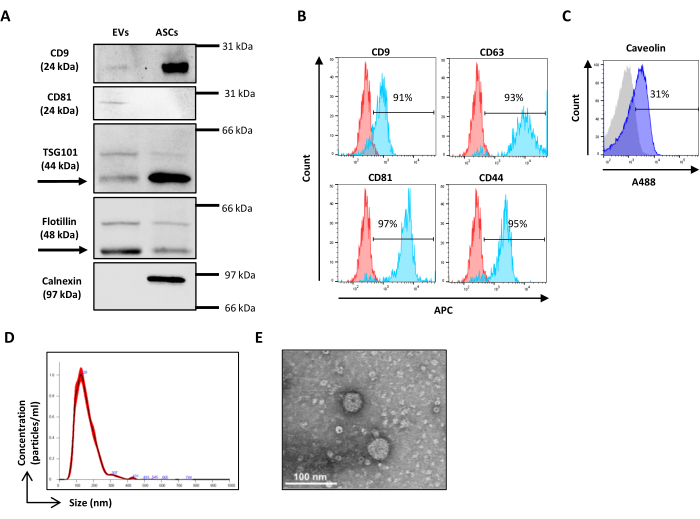
Figura 2: Caracterização de ASC-EVs. (A) Western blot representativo de marcadores positivos (CD9, CD81, TSG101 e Flotilina) e negativos (Calnexin) de Western blot representativos. Os pesos moleculares correspondentes são relatados e os lisados de ASCs têm sido usados como controle. (B) Análise de citometria de fluxo de marcadores EVs. A expressão dos seguintes marcadores foi analisada: CD9, CD63, CD81 e CD44. Apenas ASC-EVs positivos para CFSE foram analisados quanto à expressão do marcador. Os histogramas representam ASC-EVs não corados (histogramas vermelhos) e corados (histogramas azuis). (C) Análise intracelular de citometria de fluxo do marcador EVs Caveolina. Os histogramas representam ASC-EVs não corados (histograma cinza) e corados (histogramas azuis). (D) Caracterização de ASC-EVs pela NTA. Os histogramas representam a concentração (partículas/mL)/tamanho (nm) da amostra. (E) Visualização de ASC-EVs por TEM. Barras de escala = 100 nm. Clique aqui para ver uma versão maior desta figura.
3. Classificação de ASC-EVs
- Configuração do classificador de células
NOTA: Um classificador de células é um citômetro de fluxo que permite o isolamento de uma população pura de uma amostra inicial heterogênea. O classificador de células separa as partículas alvo oscilando o fluxo com um piezoelétrico em alta frequência para gerar gotas contendo um evento. As gotas que continham as partículas de interesse, como células ou vesículas, são carregadas e desviadas através de placas de deflexão de metal. A fração ordenada é usada para realizar a análise a jusante.- Abra a linha de pressão e aspire.
NOTA: Alguns classificadores têm uma inicialização automática, enquanto outros têm uma inicialização manual. Um classificador com inicialização manual é o preferido, pois permite a otimização de algumas características técnicas, como frequência, pressão e a escolha da ponta do bico. Em particular, recomenda-se trabalhar com uma frequência de 66.000 Hz, uma pressão de 35 psi e um bico de 70 μm. - Ligue o instrumento, abra o gabinete de biossegurança e inicie o software do classificador.
- Pressurize os fluidos e, em seguida, ligue o sistema fluídico.
- Ative o Drop Drive, o cristal piezoelétrico no bico que vibra para ter gotículas.
- Execute o procedimento de desborbulhamento para eliminar a presença de bolhas no sistema e, em seguida, execute um tubo de 5 mL de solução de limpeza por 5 min em alta pressão diferencial e um tubo de 5 mL de água DI por 5 min.
- Execute o procedimento de inicialização manual.
- Na guia Controle do Laser, pressione o botão Laser Power para ligar o laser.
NOTA: Repita este procedimento para todos os lasers: Azul 488 nm, Amarelo-Verde 561 nm, Violeta 405 nm e Vermelho 640 nm. - Examine o alinhamento vertical do fluxo.
NOTA: Em caso de necessidade, mova o conjunto do bico stage, em particular, micrômetro frontal e traseiro, micrômetro esquerdo e direito e gimbal para ajustar o alinhamento vertical e verificar o fluxo vertical com micrômetro para cima e para baixo; Para o melhor alinhamento, o fluxo deve ser vertical em cada laser. Se esta é a primeira vez que se usa um bico específico, um atraso de laser precisa ser feito. No painel da tela sensível ao toque, na guia Laser and Stream Intercept , selecione o tamanho correto do bico, pressione o botão Laser Delay e siga as instruções de atraso do laser para executar o procedimento de atraso do laser. Em geral, ao alterar a pressão da bainha e, consequentemente, a ponta do bico, a determinação do atraso do laser é executada antes de encontrar o alinhamento. Ao final do procedimento de Laser Delay , sugere-se que o Procedimento de Subtração da Imagem de Fundo seja realizado seguindo as instruções na tela para minimizar o sinal de fundo. - Execute a determinação do ponto do laser pressionando a guia Interceptação do fluxo de laser , o botão Seta verde e seguindo as instruções no monitor da tela sensível ao toque.
- Na guia Controle do Laser, pressione o botão Laser Power para ligar o laser.
- Inicialize o Intellisort. Defina a frequência do drive de queda e um valor de amplitude padrão, o que faz com que o fluxo forme uma gota.
- Depois que essa etapa for executada, carregue uma configuração salva. Para carregar uma configuração salva, selecione Carregar configuração de classificação na barra de ferramentas do software classificador. Depois de verificar diferentes frequências e amplitudes, escolha a melhor que garanta a melhor estabilidade de queda. Trabalhe a uma frequência de 66.000 Hz e uma amplitude de cerca de 40-45 V.
- Execute o procedimento de alinhamento a laser fino .
- Carregue no amostrador um tubo de 5 mL de grânulos de alinhamento QC e execute-o; selecione na guia Alinhamento fino o parâmetro desejado nos eixos X e Y para visualizar os cordões bem compactados e colimados. Na área de exibição de dados, selecione primeiro 488 - 513/26-H para o parâmetro do eixo Y e 488-FSC1-H para o parâmetro do eixo X. Em seguida, para ajustar todos os lasers, selecione 405-488/59-H para o parâmetro do eixo Y e 640-795/70-H para o parâmetro do eixo X.
NOTA: Os parâmetros selecionados dependem da configuração do laser do classificador. A sugestão manual do instrumento é a escolha dos lasers que possuem maior separação espacial na faixa de orifício. Para isso, use um laser violeta (405 nm) e um laser vermelho (640 nm). - Uma vez que o alinhamento manual é verificado pelo especialista em classificação, execute o QC automático. Selecione o diâmetro dos grânulos QC: 3 μm de diâmetro.
NOTA: No final deste procedimento, o resultado pode ser QC não aprovado ou QC aprovado. Caso o CQ falhe, é necessário otimizar manualmente o alinhamento. - Salve a aquisição de CQ no protocolo de alinhamento do software.
- Carregue no amostrador um tubo de 5 mL de grânulos de alinhamento QC e execute-o; selecione na guia Alinhamento fino o parâmetro desejado nos eixos X e Y para visualizar os cordões bem compactados e colimados. Na área de exibição de dados, selecione primeiro 488 - 513/26-H para o parâmetro do eixo Y e 488-FSC1-H para o parâmetro do eixo X. Em seguida, para ajustar todos os lasers, selecione 405-488/59-H para o parâmetro do eixo Y e 640-795/70-H para o parâmetro do eixo X.
- Finalizar o procedimento do Intellisort
- Localize as placas de deflexão na posição correta no classificador e ligue o voltage (recomenda-se carga de 3,000 V nas placas de deflexão).
- Escolha a saída de classificação de 6 suportes de tubos, habilite os fluxos selecionando-os no indicador de fluxo e execute o fluxo de teste.
NOTA: Se os fluxos não estiverem claramente separados e definidos, ajuste a fase de carga, defanning ou modifique outros parâmetros para obter um fluxo claramente definido e não oscilante. - Habilite o botão Determinação Automática de Atraso de Queda do Intellisort . Esta etapa permite definir o atraso de queda correto. Após esta etapa, verifique os fluxos novamente.
- Ative o modo de manutenção do Intellisort. Verifique o atraso de queda manualmente.
- Carregue o protocolo manual de atraso de queda no software do classificador. Adquira esferas de controle fluorescentes.
- Insira o suporte de slide correto. No software classificador, selecione Assistente de Classificação > Atraso de Queda. Selecione Lógica de classificação.
- Verifique com um microscópio fluorescente a presença de 97% de esferas fluorescentes na quinta poça.
- Abra a linha de pressão e aspire.
- Configuração do instrumento: Calibração de dispersão
NOTA: A calibração de dispersão é realizada usando contas Verity Shells (doravante chamadas de contas ocas de organo sílica). Esses grânulos de organo sílica são caracterizados por uma distribuição de índice de refração e propriedades de dispersão de luz mais próximas dos EVs do que dos grânulos de poliestireno, permitindo assim a configuração da tensão SSC e FSC para discriminar melhor entre eventos semelhantes a EV e o ruído eletrônico. Os grânulos de organo sílica são constituídos por dois frascos com misturas de grânulos, VER01A (grânulos de 189 nm) e VER01B (grânulos de 374 nm). Cada frasco para injetáveis contém uma mistura de esferas ocas de organo sílica e esferas fluorescentes verdes de 380 nm, referidas como esferas de referência. A concentração dos grânulos ocos de organo sílica é de 1 x 108 grânulos / mL.- Prepare uma amostra de grânulos VER01A e VER01B diluindo uma gota (50 μL) de cada um em 1 mL de PBS filtrado com 0,22 μm com uma concentração final de 5.000 grânulos / μL.
NOTA: Agite as contas por 5 s antes de usar. - Crie um gráfico de pontos da escala de log SSC versus a escala de log FITC.
- Adquira os cordões VER01B e ajuste a tensão para discriminar bem os cordões de referência na parte superior direita do gráfico de pontos SSC/FITC (Figura 3A).
- Defina uma região ao redor dessa população de contas.
- Crie um gráfico de pontos da escala de log do SSC versus a escala de log do FSC. Identifique as contas de referência e a população de contas VER01B. Defina uma região ao redor da população de grânulos VER01B (Figura 3B).
- Adquira grânulos VER01A e crie uma região ao redor dessa população de grânulos (Figura 3C).
NOTA: Esta população de contas se sobrepõe parcialmente ao ruído de fundo do instrumento. - Adquira PBS filtrado de 0,22 μm e ajuste o limite para diminuir o ruído de fundo do instrumento sem perder a visualização das menores contas.
NOTA: A calibração de dispersão pode ser feita usando grânulos FSC Megamix (doravante chamados de grânulos de poliestireno FSC), uma mistura de grânulos fluorescentes com os seguintes diâmetros: 100 nm, 300 nm, 500 nm e 900 nm. O uso dos grânulos ocos de organo sílica deve ser preferido aos grânulos de poliestireno FSC porque eles têm distribuição de índice de refração e propriedades de dispersão de luz semelhantes aos EVs. A população de grânulos de poliestireno FSC de 300 nm se sobrepõe à referência dos grânulos ocos de organo sílica. Portanto, uma porta baseada em esferas ocas de organo sílica seleciona EVs de tamanho semelhante no citômetro de fluxo.
- Prepare uma amostra de grânulos VER01A e VER01B diluindo uma gota (50 μL) de cada um em 1 mL de PBS filtrado com 0,22 μm com uma concentração final de 5.000 grânulos / μL.
- Aquisição de amostras
- Crie um gráfico de pontos da escala logarítmica SSC versus a escala logarítmica FITC, adquira PBS filtrado por 0,22 μm e defina o ruído de fundo de referência (Figura 4A).
NOTA: Defina a taxa de fluxo do citômetro para Baixa e controle a taxa de fluxo. O número de eventos/s não deve ser superior a 2.000 eventos/s. Vazão baixa significa baixa pressão diferencial. - Adquirir a amostra de controlo (VE não corada) e verificar o caudal. Certifique-se de que o número de eventos/s seja de cerca de 5.000 eventos/s.
NOTA: Se o número de eventos exceder o sugerido, dilua a amostra. - Adquira PBS corado e tratado como a amostra CFSE e verifique se nenhum evento positivo é visível ( Figura 4B ).
- Adquira a amostra corada com CFSE. Dilua-o com base na taxa de fluxo. Desenhe uma região identificando os eventos positivos do CFSE e outra identificando os eventos negativos do CFSE. Use uma amostra não corada como controle (Figura 5A, B). Estas são as regiões de classificação.
- Crie um gráfico de pontos da escala logarítmica SSC versus a escala logarítmica FITC, adquira PBS filtrado por 0,22 μm e defina o ruído de fundo de referência (Figura 4A).
- Classificação de amostras
- No software classificador, abra um novo protocolo (na barra de ferramentas, selecione Arquivo > Protocolo > Novo).
- No software classificador, clique em Configuração de aquisição de dados; na janela Parâmetro de aquisição, selecione os canais de interesse e desative os demais. Para este painel específico, os sinais habilitados são: 488-FSC1, 488-FSC2, 488-SSC e 488-513/26 (para sinal CFSE).
- Localize no amostrador um tubo de 5 ml de amostra. Na tela sensível ao toque, clique no botão Carregar e, na barra de ferramentas do software classificador, selecione Aquisição > Início (ou pressione o botão F2 ). Uma janela de propriedades de amostra aparecerá; Insira o nome da amostra e clique em OK.
- Crie o painel, com o gráfico de interesse e crie a estratégia de gating.
- Na barra de ferramentas do software classificador, selecione Histograma > Criar histograma.
- Na área de trabalho, crie três gráficos de pontos, o primeiro com o parâmetro Height-Log 488-FSC1 no eixo x e o Height-Log 488-SSC do eixo y, o segundo com o parâmetro Height-Log no eixo x 488-FSC2 e o Height-Log 488-SSC do eixo y, o terceiro com o parâmetro Height-Log do eixo x 488-513/26 CFSE e o Height-Log do eixo y 488-SSC.
- Na guia Classificar, identifique a(s) região(ões) a ser(em) classificada(s). No software classificador, clique em Configuração de classificação. Na janela Lógica e Estatística de Classificação , selecione a região a ser classificada no construtor de lógicas.
NOTA: Para tomar uma decisão de classificação, há diferentes configurações a serem levadas em consideração: Lógica de classificação, Modo de classificação e Soltar envelope. A Lógica de Classificação está se referindo à estratégia de gating. Os eventos que estão fora do portão selecionado não são classificados. O Modo de Classificação está relacionado à saída final. Trabalhe em Modo Purificar, desta forma, todas as gotas classificadas contêm apenas os eventos positivos desejados. O Drop Envelope define quantas gotas serão cobradas e classificadas em relação ao local na queda do evento positivo: escolha 1-2 gotas para ter certeza de que todos os eventos positivos sejam classificados. - Quando a taxa de fluxo estiver estável, pare a aquisição (na barra de ferramentas do software classificador, selecione Aquisição > Parar ou pressione o botão F2 novamente). Inicie a classificação (na barra de ferramentas do software classificador, selecione Classificar > Iniciar ou pressione o botão F4 ).
NOTA: Antes de iniciar a classificação, verifique o fluxo de teste. Verifique se a fração classificada cai corretamente no tubo de coleta. - Salve a configuração de classificação. Na barra de ferramentas do software classificador, selecione Classificar > Salvar configurações de classificação.
- Verificação da pureza da população selecionada
- Lave o instrumento adquirindo um tubo de 5 mL de solução de limpeza por 10 min em alta pressão diferencial e um tubo de 5 mL de água DI por 10 min.
- Adquira PBS filtrado por 0,22 μm e verifique se nenhum evento positivo para CFSE está presente.
- Diluir 5 μL da amostra classificada em 100 μL de PBS filtrado a 0,22 μm.
- Adquira e registre todos os volumes de amostra (Figura 5C, D).
NOTA: A reanálise de EVs classificados CFSE positivos e negativos é relatada.
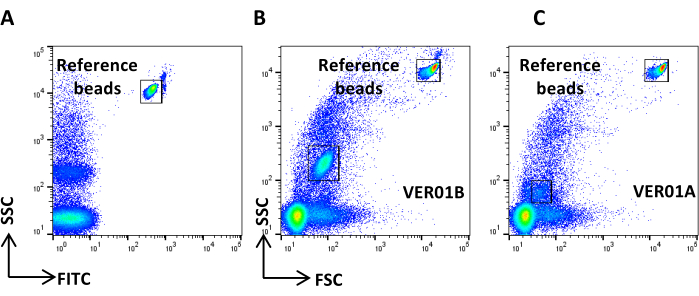
Figura 3: Parametrização física com esferas ocas de organo sílica .(A) Gráfico de pontos SSC / FITC: contas fluorescentes verdes de referência foram usadas para definir o parâmetro SSC. Gráfico de pontos SSC/FSC de (B) VER01B e (C) VER01A. Clique aqui para ver uma versão maior desta figura.
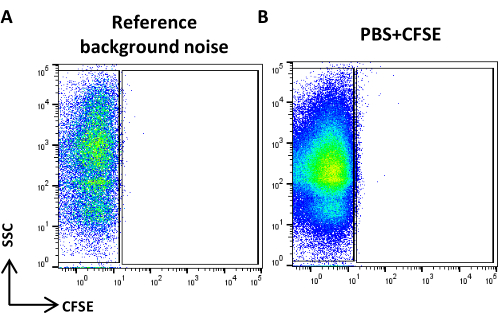
Figura 4: Ruído de fundo de referência. (A) Gráfico de pontos SSC / CFSE da amostra PBS. (B) Gráfico de pontos SSC / CFSE da amostra PBS + CFSE. Clique aqui para ver uma versão maior desta figura.
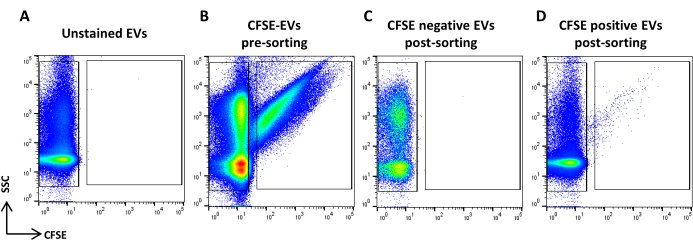
Figura 5: Classificação de ASC-EVs corados com CFSE. (A) Gráfico de pontos SSC/CFSE de EVs não corados, (B) EVs corados com CFSE, (C) EVs negativos CFSE pós-classificação e (D) EVs CFSE positivos pós-classificação. Clique aqui para ver uma versão maior desta figura.
4. Análises pós-ordenação
NOTA: Devido à quantidade limitada de material após a classificação, pode não ser possível realizar todas as análises. Com a quantidade obtida, são realizados os seguintes.
- Caracterização de EV por citometria de fluxo: coloração superficial (ver passo 2.2)
NOTA: Conforme descrito anteriormente para pré-classificação de amostras, exceto para preparação de amostras. As amostras após a triagem podem ser utilizadas sem diluição.- Utilizar amostras separadas não diluídas e proceder de acordo com o passo 2.2.3. (Figura 6A)
- Caracterização da concentração e tamanho de EV por NTA (consulte a etapa 2.4)
NOTA: Conforme descrito anteriormente para pré-classificação de amostras, exceto para preparação de amostras. As amostras após a triagem podem ser utilizadas sem diluição.- Utilizar amostras separadas não diluídas e proceder de acordo com o passo 2.4.2. (Figura 6B)
- Caracterização da morfologia EV por MET (ver etapa 2.5)
NOTA: Conforme descrito anteriormente para pré-classificação de amostras, exceto para preparação de amostras.- Adicione 2 mL de PBS a um concentrador centrífugo (membrana de celulose regenerada, MWCO 100 kDa), tampa e centrifugue a 4.000 x g por 10 min em um rotor de caçamba oscilante. Remova o PBS não filtrado da parte inferior do dispositivo de filtro.
- Aspirar o filtrado do tubo de recolha. O protocolo de ultrafiltração centrífuga descrito é baseado no processamento de amostras de até 15 mL (volume máximo).
- Adicione até 15 mL de amostra ao filtro AU-15 e tampe o dispositivo. Centrifugue a 4.000 x g por até 30 min. Concentre até o volume mínimo que o dispositivo permite, aproximadamente 100-150 μL.
- Recuperar a amostra EV concentrada do dispositivo filtrante e proceder como descrito anteriormente para a pré-selecção das amostras MET (passo 2.5.2) ( figura 6C).
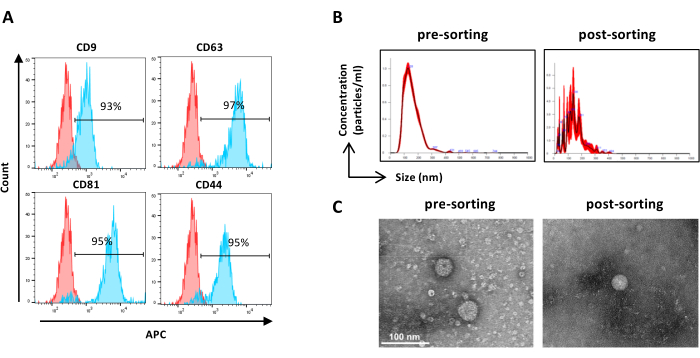
Figura 6: Caracterização de ASC-EVs classificados. Análise por citometria de fluxo de marcadores EV. A expressão dos seguintes marcadores foi analisada: CD9, CD63, CD81 e CD44. Apenas ASC-EVs positivos para CFSE foram analisados quanto à expressão do marcador. (A) Os histogramas representam ASC-EVs não corados (histogramas vermelhos) e corados (histogramas azuis). (B) Caracterização de ASC-EVs pela NTA. Os histogramas representam a concentração (partículas/mL)/tamanho (nm) das amostras de pré-classificação (esquerda) e pós-classificação (direita). (C) Visualização de ASC-EVs por TEM de amostra pré-triagem (esquerda) e pós-triagem (direita). Barras de escala = 100 nm. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Os grânulos de poliestireno FSC foram classificados para validar a configuração do instrumento e as condições de classificação. Os grânulos de poliestireno FSC são uma mistura de grânulos fluorescentes que variam de 100 nm, 300 nm, 500 nm e 900 nm e são visíveis no canal FITC. A Figura 7A mostra a escala logarítmica SSC versus o gráfico de pontos da escala logarítmica FITC com as quatro populações de grânulos antes da classificação. As po...
Access restricted. Please log in or start a trial to view this content.
Discussão
Analisar e classificar EVs é um desafio devido ao seu pequeno tamanho e ao fato de estarem próximos do limite de detecção da maioria dos citômetros de fluxo. Nosso objetivo foi desenvolver um protocolo para isolar EVs derivados de AMSCs marcados com CFSE. O CFSE foi selecionado como método de coloração devido à sua alta eficiência de marcação de EVs relatada (≥90%), sem a formação de partículas indesejadas, como agregados de proteínas fornecidos por anticorpos. No entan...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos a Emanuele Canonico pelo suporte técnico. Parte deste trabalho foi realizado no ALEMBIC, um laboratório de microscopia avançada estabelecido pelo IRCCS Ospedale San Raffaele e Università Vita-Salute San Raffaele. O trabalho de Enrico Ragni e Laura de Girolamo foi apoiado pelo Ministério da Saúde italiano, "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
Referências
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados