A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نهج نمذجة العناصر المحدودة القائمة على الصور بالموجات فوق الصوتية داخل الأوعية الدموية لقياس الخصائص الميكانيكية في الجسم الحي للشريان التاجي البشري
* These authors contributed equally
In This Article
Summary
في الجسم الحي ، تظهر صور الموجات فوق الصوتية داخل الأوعية الدموية حركة المقطع العرضي التاجي المقابلة لظروف تحميل الضغط المختلفة. استنادا إلى نموذج العناصر المحدودة ، تم استخدام مخطط تكراري لتحديد الخصائص الميكانيكية الخاصة بالمريض للشرايين التاجية في الجسم الحي من خلال مطابقة حركة الشريان التاجي من النموذج الحسابي والصور الطبية.
Abstract
يمكن أن يوفر تحديد الخصائص الميكانيكية لجدران الشرايين التاجية معلومات مفيدة لتشخيص أمراض الشريان التاجي وإدارتها وعلاجها. نظرا لعدم توفر عينات الشريان التاجي الخاصة بالمريض للمرضى الذين يحتاجون إلى مراقبة مستمرة ، يصبح الاختبار التجريبي المباشر لخصائص مادة الأوعية الدموية مستحيلا. عادة ما تستخدم نماذج الشريان التاجي الحالية معلمات المواد من الأدبيات المتاحة ، مما يؤدي إلى أخطاء كبيرة في حساب الإجهاد / الإجهاد الميكانيكي. هنا ، سنقدم نهج التحديث القائم على نموذج العناصر المحدودة (FEMBUA) لتحديد خصائص المواد الخاصة بالمريض في الجسم الحي للشرايين التاجية بناء على الصور الطبية. في الجسم الحي ، تم الحصول على صور الموجات فوق الصوتية داخل الأوعية الدموية (IVUS) والأنسجة الافتراضية (VH) - IVUS للشرايين التاجية من مريض مصاب بمرض الشريان التاجي. تم تقسيم صور Cine IVUS التي تظهر حركة الأوعية الدموية خلال دورة قلبية واحدة ، وتم اختيار إطارين IVUS بمحيط التجويف الأقصى والحد الأدنى لتمثيل هندسة الشريان التاجي في ظل ظروف الضغط الانقباضي والانبساطي ، على التوالي. تم أيضا تقسيم صورة VH-IVUS للحصول على ملامح الأوعية الدموية ، وأضيف سمك طبقة يبلغ 0.05 سم إلى ملامح VH-IVUS لإعادة بناء هندسة الشريان التاجي. تم إنشاء نموذج عنصر محدود حسابي باستخدام نموذج مادة موني ريفلين متباين الخواص يستخدم لوصف الخصائص الميكانيكية للوعاء وظروف ضغط الدم النابض الموصوفة على السطح اللمعي التاجي لجعله ينقبض ويتوسع. بعد ذلك ، تم استخدام نهج التحديث التكراري لتحديد المعلمات المادية لنموذج Mooney-Rivlin متباين الخواص من خلال مطابقة محيط التجويف الأدنى والحد الأقصى من نموذج العناصر المحدودة الحسابية مع تلك الموجودة في صور IVUS السينمائية. يمكن توسيع نهج التحديث القائم على نموذج العناصر المحدودة المستند إلى الصور بنجاح لتحديد الخصائص المادية لجدران الشرايين في أسرة الأوعية الدموية المختلفة ويحمل إمكانية تقييم مخاطر أمراض القلب والأوعية الدموية.
Introduction
يعد مرض الشريان التاجي (CAD) أحد الأسباب الرئيسية للوفيات والمراضة ، حيث يمثل أكثر من 9.14 مليون حالة وفاة في عام 2019 على مستوىالعالم 1،2. غالبا ما يكون تطور أمراض الشريان التاجي ، مثل تصلب الشرايين والتضيق ، مصحوبا بتغيرات في القوى الميكانيكية وتغيرات في خصائص مواد جدار الأوعيةالدموية 3. الخصائص المادية للشرايين التاجية ليست فقط حجر الزاوية لتحديد استجابتها الميكانيكية للحمل الفسيولوجي ولكن أيضا العناصر الرئيسية لمحاكاة السلوك الميكانيكي للأوعية الدموية ، والتنبؤ بتطور آفات تصلب الشرايين ، وتقييم التأثير العلاجي لمختلف الأجهزة الطبية4،5. وبالتالي ، فإن الفهم العميق والقياس الكمي الدقيق لخصائص المواد التاجية لها قيمة قصوى للتشخيص المبكر للمرض والطب الدقيق وتقييم التشخيص6.
التجارب الميكانيكية للأنسجة التاجية المعزولة ، مثل الاختبار ثنائي المحور المستوي ، واختبار المسافة البادئة ، وتمديد التضخم ، واختبار التمدد أحادي المحور ، هي طرق شائعة لتحديد الخواص الميكانيكية لجدران الأوعية التاجية خارج الجسم الحي7،8،9. من هذه الأساليب ، تم الحصول على عينات من الشريان التاجي من المرضى أو التجارب. تم إجراء اختبار ميكانيكي لتحديد استجابات الإجهاد لجدار الوعاء تحت ظروف الإجهاد المختلفة ، ثم تم تحديد معلمات المواد من خلال تركيب البيانات التجريبية10. أظهرت الدراسات السابقة أن خصائص الشريان التاجي غير خطية للغاية ومتباينةالخواص 11. على الرغم من أن التجارب خارج الجسم الحي يمكن أن توفر بيانات دقيقة عن خصائص المواد ، إلا أن هناك قيودا كبيرة أيضا ، وهي كما يلي: أولا ، سيكون السلوك الميكانيكي للعينة بعد إخراجها من الأشخاص الأحياء مختلفا عن السلوك الموجود في الظروف في الجسم الحي ، مما قد يؤثر على دقة نتائج الاختبار. ثانيا ، بسبب القيود الأخلاقية والعملية ، من الصعب الحصول على مجموعة كبيرة من الأنسجة الطبيعية أو المرضية للشرايين التاجية لإجراء الاختبار الميكانيكي.
للتغلب على هذه القيود ، استكشف الباحثون تقنيات جديدة للقياس الكمي في الجسم الحي ، وفي الوقت الفعلي ، والخاص بالمريض لخصائص المواد التاجية. من بينها ، يبشر نهج التحديث القائم على نموذج العناصر المحدودة (FEMBUA) القائم على الصورة الطبية بمعالجة هذه القضايا الصعبة. يستخدم هذا النهج تقنيات التصوير المتقدمة مثل الموجات فوق الصوتية داخل الأوعية الدموية (IVUS) وعلم الأنسجة الافتراضي (VH) -IVUS لالتقاط هندسة الشريان التاجي التفصيلية وتركيبات الأنسجة وحركتها12. من خلال إنشاء نماذج العناصر المحدودة ثلاثية الأبعاد (FE) ودمج ظروف ضغط الدم الفسيولوجية الخاصة بالمريض ، يمكن استعادة السلوك الوعائي الديناميكي أثناء دورات القلب عن طريق تحسين معلمات المواد لمطابقة بيانات الصورة من أجل القياس الكمي السريع والدقيق لخصائص المواد التاجية13. تشمل مزايا نهج تحديث FE في الجسم الحي على تجارب خارج الجسم الحي التقييم في الجسم الحي دون استئصال الأنسجة ، وتسهيل التقييمات واسعة النطاق ، ومحاكاة ديناميكيات الأوعية الدموية في ظل ظروف معقدة للمساعدة في فهم الفيزيولوجيا المرضية لأمراض الشريان التاجي.
في هذه الورقة ، يتم تقديم الخطوات الرئيسية لنهج التحديث القائم على نموذج العناصر المحدودة ، والتي تشمل تجزئة ومعالجة مفصلة لصورة IVUS و VH-IVUS السينمائية ، وإعادة بناء نموذج هيكل الطبقة الرقيقة الحسابي فقط ، وتنفيذ المخطط التكراري للبحث عن معلمات المواد المثلى لأنسجة الشرايين التاجية. الهدف من هذا البروتوكول هو تحديد الخصائص المادية للشريان التاجي من عينة مريضة مصابة بمرض الشريان التاجي باستخدام طريقة FEMBUA كعرض توضيحي ، وخاصة توضيح الطرق خطوة بخطوة. اختتمنا بمناقشة أهمية هذه الطريقة والجوانب الأخرى لهذه الطريقة في الجسم الحي .
المشاركة المختارة هي أنثى تبلغ من العمر 64 عاما وليس لها تاريخ سريري سابق لمرض الشريان التاجي. تم تشخيص هذا المريض بمرض الشريان التاجي بعد ظهور أعراض ألم في الصدر. تم إجراء تصوير الأوعية التاجية وفحص IVUS لتأكيد التشخيص. تم العثور على آفة لويحية مع تضيق بنسبة 60٪ في منتصف الشريان الهابط الأمامي الأيسر. بعد التقييم ، تم اعتماد العلاج الطبي الأمثل لعلاج المريض.
Protocol
تم الحصول على البيانات السريرية غير المحددة ، بما في ذلك صور IVUS في الجسم الحي وبيانات ضغط الدم ، من مريض مصاب بمرض الشريان التاجي في مستشفى Zhongda ، جامعة ساوث إيست ، مع الحصول على موافقة مستنيرة. تم اختيار عينة المريض من مجموعة المرضى في دراسة سريرية حول آفات تصلب الشرايين التاجية المتوسطة لتوضيح طريقة تحديد الخصائص المادية للأوعية التاجية الخاصة بالمريض14. أجريت الدراسة وفقا للبروتوكول المعتمد من قبل لجنة أخلاقيات البحث السريري في مستشفى تشونغدا ، جامعة ساوث إيست (رقم الموافقة: 2017ZDSYLL023-p01).
1. الحصول على البيانات ومعالجتها
- الحصول على صور Cine IVUS و VH-IVUS
- ضع قسطرة IVUS البعيدة عن آفة تصلب الشرايين بتوجيه من تصوير الأوعية التاجية واسحبها مرة أخرى إلى الجانب القريب. قم بإنشاء صور IVUS ذات تدرج رمادي على طول الطريق لتصور المقطع العرضي للوعاء التاجي.
- استخدم نظام التصوير IVUS المجهز بقسطرة بلاتينية عالية الأداء 20 ميجاهرتز و 2.9F للحصول على صور IVUS للجزء الشرياني التاجي مع لويحات تصلب الشرايين من المريض المصاب بمرض الشريان التاجي (الشكل 1).
- أثناء الحصول على صورة IVUS ، أوقف القسطرة مؤقتا في موقع الآفة المحدد مسبقا لمدة ثانية تقريبا للحصول على سلسلة من صور IVUS تسمى cine IVUS. أظهرت صور IVUS السينمائية بوضوح التغيرات المقطعية الديناميكية في موقع اللويحات المحددة خلال الدورة القلبية.
- قم بإنشاء صور VH-IVUS بناء على إطارات IVUS المكتسبة في لحظة ذروة R على تخطيط كهربية القلب لتصور مكونات البلاك في شكل مرمز بالألوان باستخدام نظام التصوير.
ملاحظة: توفر صور VH-IVUS خريطة ألوان بديهية لأربعة مكونات رئيسية للبلاك في لويحات تصلب الشرايين: اللب النخر الغني بالدهون (الدهون) باللون الأحمر ، والتكلس باللون الأبيض ، والأنسجة الليفية باللون الأخضر الداكن ، والأنسجة الدهنية الليفية باللون الأخضر الفاتح. - احفظ صور VH-IVUS و cine IVUS بتنسيق DICOM للتحليل دون اتصال بالإنترنت.
- تجزئة الصور ومعالجتها
- افتح ملفات DICOM باستخدام العارض، وانقر نقرا مزدوجا فوق اسم التسلسل المقابل لفتح الصورة وانقر فوق تصدير > تصدير الصور لحفظ كل إطار سينمائي IVUS أو إطار VH-IVUS كصورة فردية بتنسيق BMP. تحتوي كل صورة BMP على 500 × 500 بكسل ، كما هو موضح في ملف DICOM الأصلي.
- افحص صورة cine IVUS إطارا تلو الآخر للعثور على الإطارات المتتالية التي تم الحصول عليها في موقع البلاك المحدد مسبقا خلال دورة قلبية واحدة. كان هناك 26 إطارا للأنابيب السينمائية IVUS تم إنشاؤها خلال دورة قلبية واحدة لموقع البلاك العينة هذا.
- افحص جميع صور VH-IVUS التي تم إنشاؤها للعثور على صورة VH-IVUS التي تم الحصول عليها في موقع البلاك المحدد. تم إنشاء صور VH-IVUS المستخدمة هنا باستخدام إطار IVUS واحد من إطارات IVUS السينمائية في دورة قلبية واحدة.
- صور VH-IVUS و cine IVUS باستخدام برنامج ImageJ للحصول على ملامح حدود السفينة وحدود مكونات البلاك (انظر الشكل 1C).
- حدد علامة التبويب Straight > Segmented Line وحدد يدويا ملامح التجويف والحدود الخارجية للوعاء التاجي ومكونات البلاك على صور سينمائية IVUS و VH-IVUS. بالنسبة لصورة IVUS السينمائية ، قم فقط بتقسيم ملامح التجويف وحدود الوعاء الخارجي ، بينما بالنسبة لصورة VH-IVUS ، قم بتقسيم ملامح التجويف وحدود الوعاء الخارجي وحدود مكونات البلاك.
- من أجل البساطة ، احتفظ فقط بمكونات الدهون الكبيرة لإنشاء نموذج عنصر محدود وتجاهل المكونات الدهنية الصغيرة المعزولة. كان هناك دهون واحدة فقط في عينة البلاك هذه. تراكب الخطوط المحددة على الصور الأصلية باستخدام علامة التبويب Image > Overlay > Add Selection (إضافة تحديد ).
- انتقل إلى قائمة إلى مدير العائد على الاستثمار لإدارة الخطوط وضبط الخصائص وتعيين الألوان وعرض الخط على القيم المناسبة لتحسين المرئيات. حدد علامة التبويب خصائص ، وقم بتعيين لون الحد إلى لون مختلف، واملأ عرض الخط عند العرض. هنا ، قم بتعيين ألوان الخط على أنها أخضر وأزرق وأحمر لخطوط التجويف والحدود الخارجية والدهون ، على التوالي ، وعرض الخط على 3.
- قم بتنعيم الخطوط باستخدام Edit > Selection > Fit Spline من شريط الأوامر بعد تحديد محيط معين للحصول على محيط سلس. تستخدم هذه العملية تقنيات تركيب منحنى الشريحة لتنعيم الخطوط تلقائيا.
- انقر فوق ملف > حفظ باسم > علامة التبويب إحداثيات XY لحفظ إحداثيات النقاط لكل محيط مثل التجويف والحد الخارجي ومكون اللوحة في ملف txt منفصل. يحتوي هذا الملف على قيم الإحداثيات x و y للنقاط التي تشكل الكفاف ، مع وحدات البكسل كوحدة.
- سجل الحجم المادي الحقيقي لكل بكسل في صور cine IVUS و VH-IVUS (يشار إليها بحجم البكسل) من ملف DICOM. المسافة الحقيقية لبكسل واحد في بيانات IVUS المستخدمة هنا هي 0.002 سم. سيتم استخدام هذه المعلومات لتحويل إحداثيات النقطة مع البكسل كوحدة إلى المسافة الحقيقية مع سم كوحدة.
- معالجة البيانات الكنتورية
- معالجة بيانات كفاف Cine IVUS
- اقرأ ملفات txt لملامح التجويف من جميع صور IVUS السينمائية في دورة قلبية واحدة باستخدام MATLAB.
- اضرب جميع خطوط التجويف بحجم البكسل للحصول على الحجم الفعلي لخطوط التجويف.
- احسب محيطات التجويف لجميع خطوط التجويف وحدد إطارات IVUS بمحيط التجويف الأقصى (Cmax) والحد الأدنى (Cmin) ، والتي تمثل الظروف الانبساطي والانقباضي ، على التوالي.
- معالجة بيانات كنتور VH-IVUS
- اقرأ ملفات txt لملامح مكونات التجويف والحدود الخارجية والبلاك من صورة VH-IVUS باستخدام MATLAB.
- اضرب جميع الخطوط بحجم البكسل للحصول على الحجم الفعلي لجميع الخطوط العريضة.
- أعد تقسيم كل كفاف إلى 100 نقطة متباعدة بشكل متساو وقم بتنعيم 2D للحصول على بيانات كفاف VH-IVUS جديدة لتحل محل البيانات القديمة.
- معالجة بيانات كفاف Cine IVUS
2. نموذج العناصر المحدودة
- إعادة بناء هندسة الأوعية التاجية
- قم بإنشاء طبقة واحدة من الخطوط في الفضاء ثلاثي الأبعاد عن طريق إضافة قيمة إحداثيات z لجميع نقاط خطوط VH-IVUS ، بما في ذلك التجويف والحدود الخارجية والدهون ، وتعيين z = 0 لجميع النقاط (الشكل 2).
- قم بإنشاء طبقة أخرى من الخطوط عن طريق إضافة قيمة إحداثيات z لجميع نقاط خطوط VH-IVUS وإعادة تعيين z = 0.05 سم لجميع النقاط.
ملاحظة: تعيد هاتان الطبقتان من الخطوط بناء هندسة الأوعية التاجية ثلاثية الأبعاد لنموذج هيكل الطبقة الرقيقة فقط عن طريق إضافة سماكة طبقة ثابتة 0.05 سم إلى ملامح VH-IVUS (الشكل 2).
- توليد شبكة العناصر المحدودة
- قم بإنشاء معالم مساعدة عن طريق الاستيفاء الخطي للتجويف وملامح الحدود الخارجية بأوزان 1/3 و 2/3 (الشكل 3 أ) لكل طبقة.
- قسم مساحة الوعاء إلى 8 أجزاء محيطية و 3 أجزاء شعاعية (انظر الشكل 3 ب) عن طريق توصيل التجويف / الحدود الخارجية بأقرب نقطة على محيط الدهون (على سبيل المثال ، النقطتان A و B في الشكل 3 ب) أو اثنين من الخطوط المساعدة بخطوط شعاعية.
- قم بتوصيل جميع النقاط بين الطبقات بخطوط مستقيمة ، لتشكيل هيكل ثلاثي الأبعاد بأحجام 3 × 8 (الشكل 3 ب). قسم كل حجم باستخدام عناصر سداسية السطوح لإنشاء شبكة العناصر المحدودة (الشكل 3C) ومجموعات المواد المختلفة (الشكل 3D).
- قم بإجراء تحليل شبكي عن طريق تحسين كثافة الشبكة بنسبة 10٪ حتى < التغييرات في المحاليل 5٪.
- تعريف الخاصية المادية
- استخدم نموذج مادة موني ريفلين متباين الخواص المعدل لوصف الخصائص المادية لجدار الأوعية الدموية التاجية. كان من المفترض أن تكون الأوعية التاجية ومكونات اللويحات شديدة المرونة ، ومتباينة الخواص ، وغير قابلة للانضغاط تقريبا ، ومتجانسة ، ووظيفة كثافة طاقة الإجهاد لنموذج مادة موني ريفلين المعدل متباين الخواص هي:
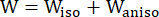 (1)
(1)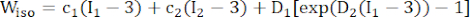 (2)
(2)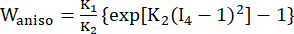 (3)
(3)
حيث I1 و I2 هما الثوابت الأولى والثانية لموتر تشوه Cauchy-Green الأيمن C المعرف بأنه c = [cij] = XTX ، X = [Xij] = [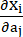 ] ، (Xi) كان الموضع الحالي (aj) هو الموضع الأصلي ، I4 = cij (nc) i (nc) j ، nc كان متجه الوحدة في الاتجاه المحيطي للوعاء. ج1 ، (ج)2 و D1 و D2 و K1 و K2 هي معلمات مادية خاصة بالمريض.
] ، (Xi) كان الموضع الحالي (aj) هو الموضع الأصلي ، I4 = cij (nc) i (nc) j ، nc كان متجه الوحدة في الاتجاه المحيطي للوعاء. ج1 ، (ج)2 و D1 و D2 و K1 و K2 هي معلمات مادية خاصة بالمريض. - قم بتعيين القيم الأولية لمعلمات المواد لوعاء تاجي خاص بالمريض وفقا لنتائج الاختبار ثنائي المحور خارج الجسم الحي ، أي c1 = −1،312.9 kPa ، c2 = 114.7 kPa ، D1 = 629.7 kPa ، D2 = 2.0 ، K1 = 35.9 kPa و K2 = 23.5 (الشكل 4A-B) 13،15.
- قم بتعيين معلمات المواد لمكون البلاك إن وجد. وبشكل أكثر تحديدا ، بالنسبة للدهون ، ج1 = 0.5 كيلو باسكال ، ج2 = 0 ، د1 = 0.5 كيلو باسكال ، و D2 = 1.5 ؛ للتكلس ، استخدمنا c1 = 920 كيلو باسكال ، ج2 = 0 ، D1 = 360 كيلو باسكال ، و د2 = 2.0 (الشكل 4 ب) 16.
ملاحظة: تم افتراض أن مكونات البلاك (الدهون والتكلس) شديدة المرونة ، متناحية، وغير قابلة للانضغاط تقريبا ، وتم وصف خصائصها الميكانيكية بواسطة نموذج مادة موني ريفلين متناحي الخواص مع وظائف كثافة طاقة الإجهاد الواردة في الصيغة (2).
- استخدم نموذج مادة موني ريفلين متباين الخواص المعدل لوصف الخصائص المادية لجدار الأوعية الدموية التاجية. كان من المفترض أن تكون الأوعية التاجية ومكونات اللويحات شديدة المرونة ، ومتباينة الخواص ، وغير قابلة للانضغاط تقريبا ، ومتجانسة ، ووظيفة كثافة طاقة الإجهاد لنموذج مادة موني ريفلين المعدل متباين الخواص هي:
- تحديد المعادلات الحاكمة والشروط الحدودية
- تحديد المعادلات الحاكمة لنموذج هيكل الطبقة الرقيقة فقط ، والذي يتضمن معادلة الحركة ، وعلاقة الإجهاد والإزاحة غير الخطية Cauchy-Green ، ونموذج مادة الأوعية التاجية11.
- وصف أشكال موجات ضغط الدم الخاصة بالمريض على سطح التجويف لمحاكاة الظروف الفسيولوجية الحقيقية (الشكل 4 ج). للحصول على أشكال موجة ضغط الدم الخاصة بالمريض ، قم بقياس شكل موجة ضغط الأبهر النموذجي بقيم ضغط الانقباضي والانبساطي المقاسة بواسطة صفعة الذراع (الشكل 4 د).
3. نهج التحديث القائم على نموذج العناصر المحدودة لخصائص مادة الشريان التاجي الخاصة بالمريض
ملاحظة: يتم توضيح العملية التكرارية لتحديد خصائص المواد التاجية الخاصة بالمريض في الشكل 5.
- حدد هندسة عدم الحمل المقابلة لحالة الضغط الصفري كهندسة أولية للنموذج الحسابي عن طريق تقليص الهندسة التاجية المعاد بناؤها من صورة VH-IVUS محوريا بمعدل انكماش ثابت بنسبة 95٪ ومحيطيا مع انكماش محيطي (يشار إليه باسم S) تم تعيينه في البداية على أنه 98٪.
ملاحظة: نظرا لأن الهندسة التاجية التي أعيد بناؤها من صورة VH-IVUS كانت في ظروف في الجسم الحي مع ضغط الدم الموصوف على التجويف والتمدد المحوري من الأجزاء الشريانية التاجية البعيدة والقريبة المربوطة ، يجب أن تتقلص الهندسة التاجية في الجسم الحي محيطيا ومحوريا للحصول على هندسة الضغط الصفر. - قم بإصلاح معدل الانكماش المحوري عند 95٪ وقم بتحديث الانكماش المحيطي خلال الخطوات التالية.
- حدد نسبة المواد (المشار إليها ب k) لتعيين خصائص المواد الخاصة بالمريض للوعاء التاجي على النحو التالي: c1 = k * (−1،312.9) kPa ، c2 = k * 114.7 kPa ، D1 = k * 629.7 kPa ، K1 = k * 35.9 kPa ، وإصلاح D2 = 2.0 و K2 = 23.5.
ملاحظة: نظرا لأنه تم الحصول على نقطتي بيانات فقط (الحد الأدنى والحد الأقصى لمحيط التجويف المقابل للضغوط الانبساطي والانقباضي) لتحديد المعلمات غير المعروفة (معدل الانكماش المحيطي S ومعلمات المواد لنموذج Mooney-Rivlin) ، فقد قمنا بتقليل عدد المعلمات غير المعروفة بافتراض أن الخصائص المادية الخاصة بالمريض في الجسم الحي للوعاء التاجي كانت متناسبة مع التخمين الأولي مع نسبة المواد المشار إليها باسم k: أي ، c1 = k * (−1،312.9) كيلو باسكال ، ج2 = ك * 114.7 كيلو باسكال ، د1 = ك * 629.7 كيلو باسكال ، ك1 = ك * 35.9 كيلو باسكال ، بينما D2 = 2.0 و K2 = 23.5 تم إصلاحها. - قم بتحديث قيمة k المعينة إلى قيمة أولية k من 1 جنبا إلى جنب مع معدل الانكماش المحيطي S أثناء الإجراء التكراري التالي.
- قم بتشغيل برنامج لحل النموذج الحسابي للحصول على النتائج العددية.
- اكتب جميع الأوامر لإنشاء نموذج بنية الطبقة الرقيقة فقط في ملف دفعي (ملف تكميلي 1) باستخدام MATLAB.
- قم بتحميل هذا الملف الدفعي باستخدام واجهة المستخدم المتقدمة (AUI) لإنشاء النموذج (الشكل 6 أ). قم بحل نموذج هيكل الطبقة الرقيقة فقط بالنقر فوق ملف البيانات / الحل واحفظه كملف .dat (الشكل 6C). محاكاة ثلاث دورات قلبية واعتماد الحل في الدورة الأخيرة لتقديم النتائج العددية.
- قم بتصدير نتائج إحداثيات العقدة إلى ملف txt عن طريق التنقل في قائمة > قائمة القيم > المنطقة وتحديد X-POSITION وY-POSITION وZ-POSITION في المتغيرات المراد إدراجها ضمن الإحداثيات. انقر فوق تطبيق وتصدير لتصدير نتائج الإحداثيات.
- احفظ بيانات محيط التجويف المقابلة لظروف الضغط الانبساطي والانقباضي .txt الملفات لحسابات محيط التجويف.
- قارن محيط التجويف المحسوبة بواسطة نموذج FE (نموذج هيكل الطبقة الرقيقة فقط) في حالة الضغط الانبساطي مع بيانات IVUS السينمائية في الجسم الحي (Cmin) وتحقق مما إذا كان الخطأ النسبي <1٪). إذا تم استيفاء الشرط ، فانتقل إلى الخطوة التالية ، أو قم بتحديث نسبة المواد k باستخدام طريقة secant وانتقل إلى الخطوة 3.3 لإعادة التشغيل مرة أخرى17،18.
ملاحظة: في التكرار الأول ، تم استخدام طريقة نيوتن لتحديث نسبة المواد بدلا من طريقة secant. - قارن محيط التجويف المحسوبة بواسطة نموذج FE في حالة الضغط الانقباضي مع بيانات IVUS السينمائية في الجسم الحي (Cmax) وتحقق مما إذا كان الخطأ النسبي <1٪. إذا كانت الإجابة بنعم، فقم بإيقاف الإجراء التكراري، أو قم بتحديث معدل الانكماش المحيطي S وأعد التوجيه إلى الخطوة 3.4 لإعادة التشغيل مرة أخرى.
ملاحظة: في التكرار الأول ، تم استخدام طريقة نيوتن لتحديث معدل الانكماش المحيطي بدلا من طريقة secant. - سجل قيم S و k المثلى واحسب معلمات المواد المقابلة لنموذج مادة موني ريفلين.
- ارسم منحنيات نسبة الإجهاد والتمدد المحيطية والمحورية للوعاء التاجي (الشكل 7) ، والتي يمكن اشتقاقها على النحو التالي:
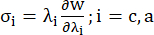 (4)
(4)
حيث يمثل σ إجهاد كوشي ، يمثل λ نسبة التمدد ، أنا = ج ، يمثل a الاتجاهات المحيطية والمحورية.- لرسم منحنى مادي في اتجاه معين ، قم بإصلاح نسبة التمدد في الاتجاه الآخر إلى 1. احسب معامل يونغ الفعال في المحيط والمحوري (المسمى YMc و YMa ، على التوالي) كميل دالة المقياس لمنحنى المادة عند فاصل نسبة التمدد [1.0 ، 1.1] لتعكس صلابة المواد العامة للشريان التاجي13:
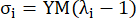 (5)
(5)
- لرسم منحنى مادي في اتجاه معين ، قم بإصلاح نسبة التمدد في الاتجاه الآخر إلى 1. احسب معامل يونغ الفعال في المحيط والمحوري (المسمى YMc و YMa ، على التوالي) كميل دالة المقياس لمنحنى المادة عند فاصل نسبة التمدد [1.0 ، 1.1] لتعكس صلابة المواد العامة للشريان التاجي13:
- استخراج توزيعات الإجهاد / الإجهاد البلاك في أي وقت وتسجيل توزيع العقدة وقيم الإجهاد القصوى خلال المرحلتين الانقباضية والانبساطي (الشكل 8).
النتائج
نصف بالتفصيل طريقة FEMBUA ، والتي تتيح تحليل سريع لمواد البلاك والإجهاد للويحات التاجية بعد تصوير IVUS في الوقت الفعلي ويمكنها تحديد خصائص المواد في الجسم الحي والنتائج الميكانيكية الحيوية للويحات. يتم توفير معلمات المواد في الجسم الحي لنموذج مادة Mooney-Rivlin لهذا الو...
Discussion
الخطوات الحاسمة في البروتوكول
تكمن الخطوة الأكثر أهمية في نهج التحديث المستند إلى نموذج العناصر المحدودة في الإجراء التكراري. في هذا النهج ، يجب أن يستعيد نموذج العناصر المحدودة بدقة حركة الأوعية التاجية على المقطع العرضي للأوعية الدموية من صور IVUS السينما...
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث جزئيا من قبل مشروع علوم وتكنولوجيا الصحة الطبية في مقاطعة شاندونغ (رقم 202425020256 و 202403010254) ، ومنح المؤسسة الوطنية للعلوم الطبيعية في الصين 11972117 و 11802060 ، ومؤسسة العلوم الطبيعية لمقاطعة جيانغسو بموجب المنحة رقم BK20180352 ، ومؤسسة العلوم الطبيعية لمقاطعة شاندونغ بموجب المنحة رقم ZR2024QA110.
Materials
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
References
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved