Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Koroner Arterinin İn Vivo Mekanik Özelliklerinin Ölçülmesi için İntravasküler Ultrason Görüntü Tabanlı Sonlu Elemanlar Modelleme Yaklaşımı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
İn vivo cine intravasküler ultrason görüntüleri, farklı basınç yükleme koşullarına karşılık gelen koroner kesit hareketini gösterir. Sonlu elemanlar modeline dayalı olarak, hesaplamalı modelden ve tıbbi görüntülerden koroner hareketi eşleştirerek in vivo olarak koroner arterlerin hastaya özgü mekanik özelliklerini belirlemek için yinelemeli bir şema kullanıldı.
Özet
Koroner arter duvarlarının mekanik özelliklerinin ölçülmesi, koroner arter hastalıklarının tanı, yönetim ve tedavisi için anlamlı bilgiler sağlayabilir. Sürekli izleme gerektiren hastalar için hastaya özgü koroner örnekler mevcut olmadığından, damar materyali özelliklerinin doğrudan deneysel olarak test edilmesi imkansız hale gelir. Mevcut koroner modeller tipik olarak mevcut literatürdeki malzeme parametrelerini kullanır ve bu da önemli mekanik stres/gerinim hesaplama hatalarına yol açar. Burada, tıbbi görüntülere dayalı olarak koroner arterlerin hastaya özgü in vivo malzeme özelliklerini ölçmek için sonlu elemanlar modeli tabanlı bir güncelleme yaklaşımı (FEMBUA) sunacağız. Koroner arter hastalığı olan bir hastadan in vivo cine intravasküler ultrason (IVUS) ve koroner arterlerin sanal histoloji (VH)-IVUS görüntüleri elde edildi. Bir kardiyak siklus boyunca vasküler hareketi gösteren sinüs IVUS görüntüleri segmentlere ayrıldı ve sistolik ve diyastolik basınç koşulları altında koroner geometriyi temsil etmek için sırasıyla maksimum ve minimum lümen çevresine sahip iki IVUS çerçevesi seçildi. VH-IVUS görüntüsü de damar konturlarını elde etmek için segmentlere ayrıldı ve koroner geometriyi yeniden oluşturmak için VH-IVUS konturlarına 0.05 cm'lik bir tabaka kalınlığı eklendi. Damarın mekanik özelliklerini ve koroner lümen yüzeyine büzülmesini ve genişlemesini sağlamak için öngörülen pulsatil kan basıncı koşullarını tanımlamak için kullanılan bir anizotropik Mooney-Rivlin malzeme modeli ile hesaplamalı bir sonlu elemanlar modeli oluşturuldu. Daha sonra, hesaplamalı sonlu elemanlar modelinden minimum ve maksimum lümen çevrelerini cine IVUS görüntülerinden elde edilenlerle eşleştirerek anizotropik Mooney-Rivlin modelinin malzeme parametrelerini belirlemek için yinelemeli bir güncelleme yaklaşımı kullanılmıştır. Bu görüntü tabanlı sonlu elemanlar modeli tabanlı güncelleme yaklaşımı, çeşitli vasküler yataklardaki arteriyel duvarların malzeme özelliklerini belirlemek için başarılı bir şekilde genişletilebilir ve kardiyovasküler hastalıkların risk değerlendirmesi için potansiyel taşır.
Giriş
Koroner arter hastalığı (KAH), 2019 yılında dünya çapında 9,14 milyondan fazla ölüme neden olan mortalite ve morbiditenin önde gelen nedenlerinden biridir 1,2. Ateroskleroz ve stenoz gibi koroner arter hastalıklarının gelişimine genellikle mekanik kuvvetlerdeki değişiklikler ve vasküler duvar malzeme özelliklerindeki değişiklikler eşlik eder3. Koroner arterlerin malzeme özellikleri, sadece fizyolojik yüklenmeye mekanik tepkilerini belirlemek için değil, aynı zamanda kan damarlarının mekanik davranışını simüle etmek, aterosklerotik lezyonların gelişimini tahmin etmek ve çeşitli tıbbi cihazların terapötik etkisini değerlendirmek için temel unsurlardır 4,5. Sonuç olarak, koroner materyal özelliklerinin derinlemesine anlaşılması ve doğru bir şekilde ölçülmesi, erken hastalık teşhisi, hassas tıp ve prognoz değerlendirmesi için çok önemli bir değere sahiptir6.
Düzlemsel çift eksenli test, girinti testi, şişirme-ekstansiyon ve tek eksenli ekstansiyon testi gibi izole koroner dokuların mekanik deneyleri, koroner damar duvarlarının mekanik özelliklerini ex vivoölçmek için yaygın yaklaşımlardır 7,8,9. Bu yaklaşımlardan hastalardan veya deney hayvanlarından koroner arter örnekleri elde edildi. Farklı gerilme koşulları altında damar duvarının gerinim tepkilerini belirlemek için mekanik testler yapılmış ve daha sonra deney verileri10 uygun hale getirilerek malzeme parametreleri belirlenmiştir. Önceki çalışmalar, koroner özelliklerin oldukça doğrusal olmayan ve anizotropik olduğunu göstermiştir11. Her ne kadar ex vivo deneyler doğru malzeme özellikleri verileri sağlayabilse de, aşağıdaki gibi önemli sınırlamalar da mevcuttur: Birincisi, numunenin canlı deneklerden çıkarıldıktan sonraki mekanik davranışı, in vivo koşullar altındakinden farklı olacaktır ve bu da test sonuçlarının doğruluğunu etkileyebilir. İkincisi, etik ve pratik kısıtlamalar nedeniyle, mekanik testi gerçekleştirmek için koroner arterlerin normal veya patolojik dokularının geniş bir koleksiyonunu elde etmek zordur.
Bu sınırlamaların üstesinden gelmek için araştırmacılar, koroner materyal özelliklerinin in vivo, gerçek zamanlı ve hastaya özgü nicelleştirilmesi için yeni teknikler keşfettiler. Bunlar arasında, tıbbi görüntüye dayalı sonlu elemanlar modeli tabanlı güncelleme yaklaşımı (FEMBUA), bu zorlu sorunları ele alma vaadini taşımaktadır. Bu yaklaşım, ayrıntılı koroner geometriyi, doku bileşimlerini ve hareketini yakalamak için intravasküler ultrason (IVUS) ve sanal histoloji (VH)-IVUS gibi gelişmiş görüntüleme tekniklerinden yararlanır12. 3D sonlu elemanlar (FE) modelleri oluşturarak ve hastaya özgü fizyolojik kan basıncı koşullarını birleştirerek, koroner malzeme özelliklerinin hızlı ve doğru bir şekilde ölçülmesi için malzeme parametrelerinin görüntü verileriyle eşleşecek şekilde optimize edilmesiyle kardiyak döngüler sırasında dinamik vasküler davranış kurtarılabilir13. İn vivo FE güncelleme yaklaşımının ex vivo deneylere göre avantajları arasında doku eksizyonu olmadan in vivo değerlendirme, büyük ölçekli değerlendirmelerin kolaylaştırılması ve koroner hastalıkların patofizyolojisinin anlaşılmasına yardımcı olmak için karmaşık koşullar altında vasküler dinamiklerin simüle edilmesi yer alır.
Bu yazıda, sina IVUS ve VH-IVUS görüntüsünün ayrıntılı bir segmentasyonu ve işlenmesi, yalnızca hesaplamalı ince tabaka yapısı modelinin yeniden yapılandırılması, koroner arteriyel dokular için optimal malzeme parametrelerini aramak için yinelemeli şemanın yürütülmesini içeren sonlu elemanlar modeli tabanlı güncelleme yaklaşımının temel adımları tanıtılmaktadır. Bu protokolün amacı, KAH'lı bir örnek hastadan alınan koroner arterin malzeme özelliklerini, özellikle adım adım yöntemlerin gösterimi olmak üzere FEMBUA yöntemini bir gösteri olarak kullanarak ölçmektir. Bu in vivo yöntemin önemini ve diğer yönlerini tartışarak bitirdik.
Seçilen katılımcı, daha önce klinik koroner arter hastalığı öyküsü olmayan 64 yaşında bir kadındır. Bu hastaya göğüs ağrısı semptomları olduktan sonra koroner arter hastalığı tanısı kondu. Tanıyı doğrulamak için koroner anjiyografi ve IVUS sintigrafisi yapıldı. Sol ön inen arterin ortasında %60 darlıklı plak lezyonu tespit edildi. Değerlendirmeden sonra, hastayı tedavi etmek için optimal tıbbi tedavi benimsendi.
Protokol
İn vivo IVUS görüntüleri ve kan basıncı verileri de dahil olmak üzere tanımlanmamış klinik veriler, Güneydoğu Üniversitesi Zhongda Hastanesi'nde KAH'lı bir hastadan bilgilendirilmiş onam alınarak elde edildi. Örnek hasta, hastaya özgü koroner damarların malzeme özelliklerini ölçme yöntemini göstermek için orta koroner aterosklerotik lezyonlar üzerine yapılan bir klinik çalışmanın hasta havuzundan seçildi14. Çalışma, Güneydoğu Üniversitesi Zhongda Hastanesi Klinik Araştırma Etik Kurulu tarafından onaylanan protokol (onay numarası: 2017ZDSYLL023-p01) sonrasında gerçekleştirilmiştir.
1. Veri toplama ve işleme
- Cine IVUS ve VH-IVUS görüntü alımı
- IVUS kateterini koroner anjiyografi rehberliğinde aterosklerotik lezyonun distaline yerleştirin ve proksimal tarafa geri çekin. Koroner damarın enine kesitini görselleştirmek için yol boyunca gri tonlamalı IVUS görüntüleri oluşturun.
- KAH'lı hastadan aterosklerotik plaklı koroner arter segmentinin IVUS görüntülerini elde etmek için yüksek performanslı 20 MHz, 2.9F platin kateter ile donatılmış IVUS görüntüleme sistemini kullanın (Şekil 1).
- IVUS görüntü alımı sırasında, sine IVUS adı verilen bir IVUS görüntüsü dizisi elde etmek için kateteri önceden seçilen lezyon bölgesinde yaklaşık 2 saniye duraklatın. Sine IVUS görüntüleri, kardiyak siklus boyunca verilen plak bölgesindeki dinamik kesitsel değişiklikleri açıkça gösterdi.
- Görüntüleme sistemini kullanarak plak bileşenlerini renk kodlu formda görselleştirmek için elektrokardiyogramlarda R zirvesi anında elde edilen IVUS karelerine dayalı VH-IVUS görüntüleri oluşturun.
NOT: VH-IVUS görüntüleri, aterosklerotik plaktaki dört temel plak bileşeni için sezgisel bir renk haritası sağlar: kırmızı renkte lipid açısından zengin nekrotik çekirdek (lipid), beyaz renkte kalsifikasyon, koyu yeşil renkte fibröz doku ve açık yeşil renkte fibröz yağ dokusu. - Çevrimdışı analiz için VH-IVUS ve cine IVUS görüntülerini DICOM formatında kaydedin.
- Görüntü segmentasyonu ve işleme
- Görüntüleyiciyi kullanarak DICOM dosyalarını açın, görüntüyü açmak için İlgili Sıra Adı'na çift tıklayın ve her bir cine IVUS çerçevesini veya VH-IVUS çerçevesini BMP formatında ayrı bir görüntü olarak kaydetmek için Dışa Aktar > Görüntüleri Dışa Aktar'a tıklayın. Her BMP görüntüsü, orijinal DICOM dosyasında belirtildiği gibi 500 x 500 piksel içerir.
- Bir kardiyak döngü sırasında önceden seçilmiş plak bölgesinde elde edilen ardışık kareleri bulmak için cine IVUS görüntüsünü kare kare inceleyin. Bu örnek plak bölgesi için bir kardiyak döngü sırasında oluşturulan 26 sine IVUS çerçevesi vardı.
- Verilen plak bölgesinde elde edilen VH-IVUS görüntüsünü bulmak için oluşturulan tüm VH-IVUS görüntülerini inceleyin. Burada kullanılan VH-IVUS görüntüleri, bir kardiyak döngüde sine IVUS çerçevelerinden bir IVUS çerçevesi kullanılarak oluşturulmuştur.
- Damar sınırlarının ve plak bileşeni sınırlarının konturlarını elde etmek için ImageJ yazılımını kullanarak VH-IVUS ve cine IVUS görüntülerini segmentlere ayırın (Bkz. Şekil 1C).
- Düz > Parçalı Çizgi sekmesini seçin ve sine IVUS ve VH-IVUS görüntülerinde lümenin konturlarını, koroner damarın dış sınırını ve plak bileşenlerini manuel olarak tanımlayın. Sine IVUS görüntüsü için sadece lümenin ve dış damar sınırının dış hatlarını segmentlere ayırırken, VH-IVUS görüntüsü için lümenin konturlarını, dış damar sınırını ve plak bileşeni sınırlarını segmentlere ayırın.
- Basitlik için, sonlu elemanlar modeli oluşturmak için yalnızca büyük lipid bileşenlerini tutun ve küçük, izole edilmiş lipid bileşenlerini göz ardı edin. Bu plak örneğinde sadece bir lipid mevcuttu. Görüntü > Kaplaması > Seçim Ekle sekmesini kullanarak çizilen konturları orijinal görüntülerin üzerine yerleştirin.
- Konturları yönetmek, özellikleri ayarlamak ve daha iyi görselleştirme için renkleri ve çizgi genişliğini uygun değerlere ayarlamak için ROI Yöneticisine menüsüne gidin. Özellikler sekmesini seçin, kontur rengini farklı bir renge ayarlayın ve çizgi genişliğini genişlikte doldurun. Burada, lümen, dış sınır ve lipid konturları için çizgi renklerini sırasıyla yeşil, mavi ve kırmızı olarak ve çizgi genişliğini 3 olarak ayarlayın.
- Düzgün bir kontur elde etmek için belirli bir konturu seçtikten sonra komut çubuğundan Edit > Selection > Fit Spline'ı kullanarak konturları düzleştirin. Bu işlem, konturları otomatik olarak düzleştirmek için spline eğrisi uydurma tekniklerini kullanır.
- Lümen, dış sınır > plak bileşeni gibi her konturun nokta koordinatlarını ayrı bir txt dosyasına kaydetmek için Dosya > XY Koordinatları sekmesindeki Kayıt Yap sekmesine tıklayın. Bu dosya, konturu oluşturan noktaların x ve y koordinat değerlerini, birim olarak piksel ile birlikte içerir.
- DICOM dosyasından sinema IVUS ve VH-IVUS görüntülerindeki (piksel boyutu olarak gösterilir) her pikselin gerçek fiziksel boyutunu kaydedin. Burada kullanılan IVUS verilerinde bir piksel için gerçek mesafe 0.002 cm'dir. Bu bilgi, birim olarak piksel ile nokta koordinatlarını, birim olarak cm ile gerçek mesafeye dönüştürmek için kullanılacaktır.
- Kontur veri işleme
- Cine IVUS kontur veri işleme
- MATLAB ile tek bir kardiyak döngüde tüm cine IVUS görüntülerinden lümen konturlarının txt dosyalarını okuyun.
- Lümen konturlarının gerçek boyutunu elde etmek için tüm lümen konturlarını piksel boyutuyla çarpın.
- Tüm lümen konturları için lümen çevrelerini hesaplayın ve sırasıyla diyastolik ve sistolik koşulları temsil eden maksimum (Cmax) ve minimum (Cmin) lümen çevrelerine sahip IVUS çerçevelerini belirleyin.
- VH-IVUS kontur veri işleme
- MATLAB ile VH-IVUS görüntüsünden lümen, dış sınır ve plak bileşenlerinin konturlarının txt dosyalarını okuyun.
- Tüm konturların gerçek boyutunu elde etmek için tüm konturları piksel boyutuyla çarpın.
- Her konturu eşit aralıklı 100 noktaya yeniden bölün ve eskilerinin yerine yeni VH-IVUS kontur verileri elde etmek için 2D yumuşatma gerçekleştirin.
- Cine IVUS kontur veri işleme
2. Sonlu elemanlar modeli
- Koroner damar geometrisi rekonstrüksiyonu
- Lümen, dış sınır ve lipid dahil olmak üzere VH-IVUS konturlarının tüm noktaları için z koordinat değeri ekleyerek üç boyutlu uzayda bir kontur katmanı oluşturun ve tüm noktalar için z = 0 olarak ayarlayın (Şekil 2).
- VH-IVUS konturlarının tüm noktaları için z koordinat değeri ekleyerek başka bir kontur katmanı oluşturun ve tüm noktalar için z = 0,05 cm'yi sıfırlayın.
NOT: Bu iki kontur katmanı, VH-IVUS konturlarına sabit 0,05 cm'lik bir katman kalınlığı ekleyerek, yalnızca ince katmanlı yapı modeli için 3D koroner damar geometrisini yeniden yapılandırır (Şekil 2).
- Sonlu elemanlar ağ oluşturma
- Her katman için 1/3 ve 2/3 ağırlıklarına sahip lümen ve dış sınır konturlarını doğrusal olarak enterpolasyon yaparak iki yardımcı kontur oluşturun (Şekil 3A).
- Lümen/dış sınırı lipid konturu üzerindeki en yakın noktaya (örneğin, Şekil 3B'deki A ve B noktaları) veya radyal çizgilerle iki yardımcı kontura bağlayarak damar alanını 8 çevresel parçaya ve 3 radyal parçaya bölün (bkz. Şekil 3B).
- Katmanlar arasındaki tüm noktaları düz çizgilerle birleştirin ve 3 x 8 hacimli bir 3B yapı oluşturun (Şekil 3B). Sonlu eleman ağını (Şekil 3C) ve farklı malzeme gruplarını (Şekil 3D) oluşturmak için altıyüzlü elemanlar kullanarak her hacmi bölün.
- Çözeltilerdeki değişiklikler %5'e < olana kadar ağ yoğunluğunu %10 oranında rafine ederek bir ağ analizi gerçekleştirin.
- Malzeme özelliği tanımı
- Koroner damar duvarının malzeme özelliklerini tanımlamak için modifiye edilmiş bir anizotropik Mooney-Rivlin malzeme modeli kullanın. Koroner damarlar ve plak bileşenlerinin hiperelastik, anizotropik, neredeyse sıkıştırılamaz ve homojen malzemeler olduğu varsayılmıştır ve modifiye edilmiş anizotropik Mooney-Rivlin malzeme modelinin gerinim enerji yoğunluğu fonksiyonu şu şekildedir:
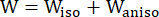 (1)
(1)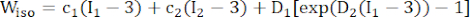 (2)
(2)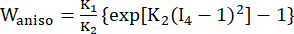 (3)
(3)
burada I1 ve I2 , c = [cij] = XTX olarak tanımlanan sağ Cauchy-Green deformasyon tensörü C'nin birinci ve ikinci değişmezleridir, X = [Xij] = [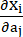 ], (Xi) mevcut konumdu (aj) orijinal konumdu, I4 = cij(nc)i(nc)j, nc kabın çevresel yönündeki birim vektördü. c1, c2, D1, D2, K1 ve K2 hastaya özgü materyal parametreleriydi.
], (Xi) mevcut konumdu (aj) orijinal konumdu, I4 = cij(nc)i(nc)j, nc kabın çevresel yönündeki birim vektördü. c1, c2, D1, D2, K1 ve K2 hastaya özgü materyal parametreleriydi. - Ex vivo çift eksenli test sonuçlarına göre hastaya özgü bir koroner damar için malzeme parametrelerinin başlangıç değerlerini atayın, yani c1 = -1,312.9 kPa, c2 = 114.7 kPa, D1 = 629.7 kPa, D2 = 2.0, K1 = 35.9 kPa ve K2 = 23.5 (Şekil 4A-B)13,15.
- Varsa, plak bileşeni için malzeme parametrelerini atayın. Daha spesifik olarak, lipitler için, c1 = 0.5 kPa, c2 = 0, D1 = 0.5 kPa ve D2 = 1.5; kalsifikasyon için c1=920 kPa, c2=0, D1=360 kPa ve D2=2.0 kullandık (Şekil 4B)16.
NOT: Plak bileşenlerinin (lipid ve kalsifikasyon) hiperelastik, izotropik ve neredeyse sıkıştırılamaz olduğu varsayıldı ve mekanik özellikleri, formül (2)'de verilen gerinim enerji yoğunluğu fonksiyonları ile izotropik Mooney-Rivlin malzeme modeli ile tanımlandı.
- Koroner damar duvarının malzeme özelliklerini tanımlamak için modifiye edilmiş bir anizotropik Mooney-Rivlin malzeme modeli kullanın. Koroner damarlar ve plak bileşenlerinin hiperelastik, anizotropik, neredeyse sıkıştırılamaz ve homojen malzemeler olduğu varsayılmıştır ve modifiye edilmiş anizotropik Mooney-Rivlin malzeme modelinin gerinim enerji yoğunluğu fonksiyonu şu şekildedir:
- Yönetim denklemleri ve sınır koşullarının belirlenmesi
- Hareket denklemi, doğrusal olmayan Cauchy-Green gerinim-yer değiştirme ilişkisi ve koroner damar malzemesi modeli11'i içeren yalnızca ince katman yapı modeli için yönetim denklemlerini tanımlayın.
- Gerçek fizyolojik koşulları simüle etmek için lümen yüzeyinde hastaya özel kan basıncı dalga formlarını reçete edin (Şekil 4C). Hastaya özgü kan basıncı dalga formlarını elde etmek için, kol manşeti ile ölçülen sistolik ve diyastolik basınç değerleri ile tipik bir aort basıncı dalga formunu ölçeklendirin (Şekil 4D).
3. Hastaya özgü koroner arter materyal özellikleri için sonlu elemanlar model tabanlı güncelleme yaklaşımı
NOT: Hastaya özgü koroner materyal özelliklerini belirlemek için yapılan yinelemeli süreç Şekil 5'te gösterilmiştir.
- VH-IVUS görüntüsünden yeniden oluşturulan koroner geometriyi %95'lik sabit bir büzülme oranıyla eksenel olarak ve başlangıçta %98 olarak ayarlanan çevresel büzülme (S olarak gösterilir) ile çevresel olarak küçülterek, hesaplamalı model için başlangıç geometrisi olarak sıfır basınç koşuluna karşılık gelen yüksüz geometriyi belirleyin.
NOT: VH-IVUS görüntüsünden yeniden yapılandırılan koroner geometri, lümen üzerinde öngörülen kan basıncı ve gergin distal ve proksimal koroner arteryel segmentlerden eksenel gerilme ile in vivo koşullar altında olduğundan, in vivo koroner geometri, sıfır basınç geometrisini elde etmek için çevresel ve eksenel olarak küçülmelidir. - Eksenel büzülme oranını %95'e sabitleyin ve aşağıdaki adımlar sırasında çevresel büzülmeyi güncelleyin.
- Koroner damarın hastaya özgü malzeme özelliklerini atamak için malzeme oranını (k olarak gösterilir) tanımlayın: yani, c1 = k * (−1,312.9) kPa, c2 = k * 114.7 kPa, D1 = k * 629.7 kPa, K1 = k * 35.9 kPa ve D2 = 2.0 ve K2 = 23.5.
NOT: Bilinmeyen parametreleri (çevresel büzülme hızı S ve Mooney-Rivlin modelinin malzeme parametreleri) belirlemek için sadece iki veri noktası (diyastolik ve sistolik basınçlara karşılık gelen minimum ve maksimum lümen çevreleri) elde edildiğinden, koroner damarın in vivo hastaya özgü malzeme özelliklerinin, malzeme oranı k olarak gösterilen ilk tahminle orantılı olduğunu varsayarak bilinmeyen parametrelerin sayısını azalttık: yani, c1 = k*(−1,312.9) kPa, c2 = k*114.7 kPa, D1 = k*629.7 kPa, K1 = k*35.9 kPa, D2 = 2.0 ve K2 = 23.5 sabitti. - Aşağıdaki yinelemeli prosedür sırasında k değerini, çevresel büzülme oranı S ile birlikte 1 başlangıç değeri k olarak ayarlayın.
- Sayısal sonuçları elde etmek için hesaplama modelini çözmek için yazılımı çalıştırın.
- Yalnızca ince katman yapı modelini oluşturmak için tüm komutları MATLAB kullanarak bir toplu iş dosyasına (Ek Dosya 1) yazın.
- Modeli oluşturmak için gelişmiş kullanıcı arabirimini (AUI) kullanarak bu toplu iş dosyasını yükleyin (Şekil 6A). Veri Dosyası/Çözümü'ne tıklayarak yalnızca ince katman yapı modelini çözün ve .dat bir dosya olarak kaydedin (Şekil 6C). Üç kardiyak döngüyü simüle edin ve sayısal sonuçları sunmak için son döngüde çözümü benimseyin.
- Bölge >> Değer Listesini Listele'ye giderek ve Koordinat altında Listelenecek Değişkenler'de X-POSITION, Y-POSITION ve Z-POSITION'ı seçerek düğüm koordinatlarının sonuçlarını bir txt dosyasına aktarın. Koordinat sonuçlarını dışa aktarmak için Uygula ve Dışa Aktar'a tıklayın.
- Diyastolik ve sistolik basınç koşullarına karşılık gelen lümen kontur verilerini, lümen çevresi hesaplamaları için .txt dosyalara kaydedin.
- Diyastolik basınç durumunda FE modeli (yalnızca ince dilimli katman yapısı modeli) tarafından hesaplanan lümen çevrelerini in vivo sine IVUS verileriyle (Cmin) karşılaştırın ve bağıl hatanın %<1 olup olmadığını kontrol edin. Koşul karşılandıysa, bir sonraki adıma geçin veya sekant yöntemini kullanarak malzeme oranını k başka bir şekilde güncelleyin ve tekrar17,18 çalıştırmak için adım 3.3'e gidin.
NOT: İlk yinelemede, malzeme oranını güncellemek için sekant yöntemi yerine Newton yöntemi kullanılmıştır. - Sistolik basınç durumunda FE modeli tarafından hesaplanan lümen çevrelerini in vivo sine IVUS verileriyle (Cmax) karşılaştırın ve bağıl hatanın %<1 olup olmadığını kontrol edin. Evet ise, yinelemeli yordamı durdurun veya başka bir şekilde çevresel büzülme oranını S güncelleştirin ve yeniden çalıştırmak için adım 3.4'e yönlendirin.
NOT: İlk yinelemede, sekant yöntemi yerine çevresel büzülme oranını güncellemek için Newton yöntemi kullanılmıştır. - Optimum S ve k değerlerini kaydedin ve Mooney-Rivlin malzeme modelinin karşılık gelen malzeme parametrelerini hesaplayın.
- Koroner damarın çevresel ve eksenel gerilme-gerilme oranı eğrilerini çizin (Şekil 7), bunlar aşağıdaki gibi türetilebilir:
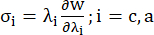 (4)
(4)
burada σ Cauchy gerilmesini temsil eder, λ gerilme oranını temsil eder, i = c, a çevresel ve eksenel yönleri temsil eder.- Belirli bir yönde bir malzeme eğrisi çizmek için, diğer yöndeki esneme oranını 1'e sabitleyin. Koroner arter13'ün genel malzeme sertliğini yansıtmak için gerinme oranı aralığında [1.0, 1.1] malzeme eğrisinin ölçek fonksiyonunun eğimi olarak çevresel ve eksenel (sırasıyla YMc ve YMa olarak etiketlenmiştir) etkin Young modülünü hesaplayın:
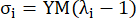 (5)
(5)
- Belirli bir yönde bir malzeme eğrisi çizmek için, diğer yöndeki esneme oranını 1'e sabitleyin. Koroner arter13'ün genel malzeme sertliğini yansıtmak için gerinme oranı aralığında [1.0, 1.1] malzeme eğrisinin ölçek fonksiyonunun eğimi olarak çevresel ve eksenel (sırasıyla YMc ve YMa olarak etiketlenmiştir) etkin Young modülünü hesaplayın:
- Herhangi bir zamanda plak stres/gerinim dağılımlarını çıkarın ve sistolik ve diyastolik fazlar sırasında düğüm dağılımını ve maksimum stres değerlerini kaydedin (Şekil 8).
Sonuçlar
Gerçek zamanlı IVUS görüntüleme sonrası koroner plakların hızlı plak materyali ve stres analizini sağlayan ve plakların in vivo materyal özelliklerini ve biyomekanik sonuçlarını belirleyebilen FEMBUA yöntemini detaylı olarak anlatıyoruz. Bu koroner damar için Mooney-Rivlin malzeme modelinin in vivo malzeme parametreleri Tablo 1'de verilmiştir. Koroner damardaki gerilme/gerinim dağılımları da dahil olmak üzere sonlu elemanlar mod...
Tartışmalar
Protokoldeki kritik adımlar
Sonlu elemanlar modeli tabanlı güncelleme yaklaşımındaki en kritik adım, yinelemeli prosedürde yatmaktadır. Yaklaşımda, sonlu elemanlar modeli, in vivo sine IVUS görüntülerinden vasküler kesit üzerindeki koroner damar hareketini doğru bir şekilde geri kazanmalıdır. Bu amaçla, sonlu elemanlar modeli ile in vivo görüntüler arasındaki lümen çevre farkını en aza indirmek, uygun malzeme özellikleri...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırma kısmen Shandong Eyaleti Tıbbi Sağlık Bilimi ve Teknolojisi Projesi (No. 202425020256 ve 202403010254), Çin Ulusal Doğa Bilimleri Vakfı 11972117 ve 11802060 hibeleri, Jiangsu Eyaleti Doğa Bilimleri Vakfı BK20180352 numaralı hibe numarası ve Shandong Eyaleti Doğa Bilimleri Vakfı tarafından ZR2024QA110 numaralı hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
Referanslar
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır