Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подход к конечно-элементному моделированию на основе внутрисосудистого ультразвукового изображения для количественной оценки in vivo механических свойств коронарной артерии человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
Внутрисосудистые ультразвуковые изображения in vivo показывают движение поперечного сечения коронарных артерий, соответствующее различным условиям нагрузки под давлением. На основе конечно-элементной модели была использована итерационная схема для определения специфических для пациента механических свойств коронарных артерий in vivo путем сопоставления движения коронарных артерий из вычислительной модели и медицинских изображений.
Аннотация
Количественная оценка механических свойств стенок коронарных артерий может предоставить значимую информацию для диагностики, ведения и лечения заболеваний коронарных артерий. Поскольку для пациентов, нуждающихся в постоянном наблюдении, отсутствуют специфические для пациента образцы коронарных артерий, прямое экспериментальное тестирование свойств материала сосудов становится невозможным. В современных моделях коронарных артерий обычно используются параметры материала из доступной литературы, что приводит к значительным ошибкам расчета механических напряжений/деформаций. Здесь мы представим подход к обновлению на основе модели конечных элементов (FEMBUA) для количественной оценки свойств коронарных артерий in vivo на основе медицинских изображений. Внутрисосудистые ультразвуковые исследования (ВСУЗИ) in vivo и виртуальные гистологические (ВГ)-ВСУЗИ изображения коронарных артерий были получены от пациента с ишемической болезнью сердца. Изображения ВСУЗИ, показывающие движение сосудов в течение одного сердечного цикла, были сегментированы, и были выбраны два кадра ВСУЗИ с максимальной и минимальной окружностью просвета для представления геометрии коронарных артерий в условиях систолического и диастолического давления соответственно. Изображение VH-IVUS также было сегментировано для получения контуров сосуда, а к контурам VH-IVUS была добавлена толщина слоя 0,05 см для реконструкции геометрии коронарных артерий. Была создана вычислительная конечно-элементная модель с анизотропной моделью материала Муни-Ривлина, используемой для описания механических свойств сосуда и условий пульсирующего артериального давления, заданных на поверхности коронарного просвета, чтобы заставить ее сжиматься и расширяться. Затем был использован итеративный подход к обновлению для определения параметров материала анизотропной модели Муни-Ривлина путем сопоставления окружностей минимального и максимального люменов из вычислительной конечно-элементной модели с окружностями из изображений ВСУЗИ в кино. Этот подход к обновлению на основе конечно-элементной модели на основе изображений может быть успешно расширен для определения свойств материала артериальных стенок в различных сосудистых руслах и обладает потенциалом для оценки риска сердечно-сосудистых заболеваний.
Введение
Ишемическая болезнь сердца (ИБС) является одной из ведущих причин смертности и заболеваемости, на ее долю приходится более 9,14 млн смертей в 2019 году во всем мире1,2. Развитие заболеваний коронарных артерий, таких как атеросклероз и стеноз, часто сопровождается изменениями механических сил и изменениями свойств материала сосудистой стенки3. Свойства материалов коронарных артерий являются не только краеугольным камнем для определения их механической реакции на физиологическую нагрузку, но и ключевыми элементами для моделирования механического поведения кровеносных сосудов, прогнозирования развития атеросклеротических поражений, оценки терапевтического эффекта различных медицинских устройств 4,5. Следовательно, глубокое понимание и точная количественная оценка свойств коронарных материалов имеют первостепенное значение для ранней диагностики заболеваний, точной медицины и оценки прогноза6.
Механические эксперименты с изолированными коронарными тканями, такие как планарное биаксиальное тестирование, испытание на индентирование, надувание-растяжение и испытание на одноосевое растяжение, являются распространенными подходами к количественной оценке механических свойств стенок коронарных сосудов ex vivo 7,8,9. С помощью этих подходов были получены образцы коронарных артерий от пациентов или подопытных животных. Механические испытания проводились с целью определения деформационных реакций стенки сосуда при различных напряженных условиях, а затем определяли параметры материала путем подгонки экспериментальных данных10. Предыдущие исследования показали, что свойства коронарных артерий сильно нелинейны ианизотропны11. Несмотря на то, что эксперименты ex vivo могут дать точные данные о свойствах материала, существуют и существенные ограничения, которые заключаются в следующем: во-первых, механическое поведение образца после извлечения из него у живых субъектов будет отличаться от такового в условиях in vivo, что может повлиять на точность результатов испытаний. Во-вторых, из-за этических и практических ограничений трудно получить большую коллекцию нормальных или патологических тканей коронарных артерий для проведения механических испытаний.
Чтобы преодолеть эти ограничения, исследователи изучили новые методы количественной оценки свойств коронарных материалов in vivo, в режиме реального времени и для конкретного пациента. Среди них подход к обновлению на основе модели конечных элементов (FEMBUA), основанный на медицинском изображении, обещает решить эти сложные проблемы. Этот подход использует передовые методы визуализации, такие как внутрисосудистое ультразвуковое исследование (ВСУЗИ) и виртуальная гистология (ВГ)-ВСУЗИ для получения подробной информации о геометрии коронарных артерий, составе тканей иих движении. Путем построения 3D-моделей методом конечных элементов (КЭ) и учета специфичных для пациента физиологических условий артериального давления можно восстановить динамическое поведение сосудов во время сердечных циклов путем оптимизации параметров материала для согласования данных изображения для быстрой и точной количественной оценки свойств материала коронарных артерий. Преимущества подхода к обновлению FE in vivo по сравнению с экспериментами ex vivo включают оценку in vivo без иссечения тканей, облегчение крупномасштабных оценок и моделирование сосудистой динамики в сложных условиях, что помогает патофизиологическому пониманию коронарных заболеваний.
В данной работе представлены ключевые этапы подхода к обновлению на основе конечно-элементной модели, которые включают в себя детальную сегментацию и обработку изображения ВСУЗИ и ВГ-УЗИ в кино, реконструкцию вычислительной модели только тонкослойной структуры, выполнение итерационной схемы для поиска оптимальных параметров материала для тканей коронарных артерий. Целью данного протокола является количественная оценка свойств материала коронарной артерии у пациента с ИБС с использованием метода FEMBUA в качестве демонстрации, особенно иллюстрации пошаговых методов. В заключение мы обсудили значение и другие аспекты этого метода in vivo .
Выбранная участница – 64-летняя женщина, не имевшая в анамнезе ишемической болезни сердца. У этого пациента была диагностирована ишемическая болезнь сердца после появления симптомов боли в груди. Для подтверждения диагноза были проведены коронарная ангиограмма и ВСУЗИ. Бляшечное поражение с 60% стенозом было обнаружено в середине левой передней нисходящей артерии. После оценки была принята оптимальная медикаментозная терапия для лечения пациента.
протокол
Обезличенные клинические данные, в том числе изображения ВСУЗИ in vivo и данные об артериальном давлении, были получены от пациента с ИБС в больнице Чжунда Юго-Восточного университета с получением информированного согласия. Выборка пациента была выбрана из пула пациентов клинического исследования промежуточных коронарных атеросклеротических поражений для демонстрации метода количественной оценки свойств материала коронарных сосудов пациента14. Исследование проводилось в соответствии с протоколом, утвержденным Комитетом по этике клинических исследований больницы Чжунда Юго-Восточного университета (номер одобрения: 2017ZDSYLL023-p01).
1. Сбор и обработка данных
- Получение изображений ВСУЗИ и ВГ-ВСУЗИ
- Установите катетер ВСУЗИ дистальнее атеросклеротического поражения под контролем коронарной ангиограммы и оттяните его обратно к проксимальной стороне. Генерируйте изображения ВСУЗИ в оттенках серого, чтобы визуализировать поперечное сечение коронарного сосуда.
- Используйте систему визуализации ВСУЗИ, оснащенную высокопроизводительным платиновым катетером 20 МГц, 2,9F, для получения изображений ВСУЗИ сегмента коронарной артерии с атеросклеротической бляшкой у пациента с ИБС (Рисунок 1).
- Во время получения изображения ВСУЗИ катетер следует поставить на паузу в предварительно выбранном месте поражения примерно на 2 с, чтобы получить последовательность изображений ВСУЗИ, называемую ВСУЗИ в кино. На снимках ВСУЗИ в кино четко видны динамические изменения поперечного сечения в данном месте бляшки в течение сердечного цикла.
- Создание изображений ВГ-ВСУЗИ на основе кадров ВСУЗИ, полученных в момент пика R на электрокардиограммах, для визуализации компонентов бляшек в цветовой кодировке с помощью системы визуализации.
Примечание: Изображения VH-IVUS обеспечивают интуитивно понятную цветовую карту для четырех ключевых компонентов бляшки в атеросклеротической бляшке: богатое липидами некротическое ядро (липид) красного цвета, кальцификация белого цвета, фиброзная ткань темно-зеленого цвета и фиброзная жировая ткань светло-зеленого цвета. - Сохраняйте изображения VH-IVUS и Cine IVUS в формате DICOM для анализа в автономном режиме.
- Сегментация и обработка изображений
- Откройте файлы DICOM с помощью просмотрщика, дважды щелкните имя соответствующей последовательности , чтобы открыть изображение, и нажмите «Экспортировать» > «Экспортировать изображения », чтобы сохранить каждый кадр киносеанса ВСУЗИ или кадр ВХ-ВУЗИ как отдельное изображение в формате BMP. Каждое изображение BMP содержит 500 x 500 пикселей, как указано в исходном файле DICOM.
- Исследуйте покадровое изображение ВСУЗИ в кино, чтобы найти последовательные кадры, полученные в заранее выбранном месте бляшки в течение одного сердечного цикла. В течение одного сердечного цикла было создано 26 кадров ВСУЗИ для этого образца бляшки.
- Изучите все сгенерированные изображения VH-IVUS, чтобы найти изображение VH-IVUS, полученное в указанном месте бляшки. Использованные здесь изображения ВГ-ВСУЗИ были созданы с использованием одного кадра ВСУЗИ из кадров ВСУЗИ в одном сердечном цикле.
- Сегментируйте изображения VH-IVUS и Cine IVUS с помощью программного обеспечения ImageJ для получения контуров границ сосудов и границ компонентов бляшек (см. рис. 1C).
- Выберите вкладку «Прямая > сегментированная линия» и вручную очертите контуры просвета, внешнюю границу коронарного сосуда и компоненты бляшек на изображениях ВСУЗИ и ВГ-ВСУЗИ при киносеансе. Для изображения ВСУЗИ с помощью киносеанса сегментируются только контуры просвета и границы внешнего сосуда, в то время как для изображения ВГ-ВСУЗИ сегментируются контуры просвета, границы внешнего сосуда и границы компонентов бляшки.
- Для простоты сохраняйте только большие липидные компоненты для создания конечно-элементной модели и игнорируйте маленькие изолированные липидные компоненты. В этом образце бляшки присутствовал только один липид. Наложите очерченные контуры на исходные изображения с помощью вкладки «Изображение» > «Наложение» > «Добавить выделение ».
- Перейдите в меню To ROI Manager для управления контурами, настройки свойств и установки цветов и ширины линий на нужные значения для лучшей визуализации. Выберите вкладку Свойства , установите другой цвет обводки и заполните ширину линии по ширине. Здесь установите цвета линий как зеленый, синий и красный для люменов, внешних границ и липидных контуров соответственно, а также ширину линии как 3.
- Сгладьте контуры с помощью команд «Правка» > «Выделение» > «Подогнать сплайн » на панели команд после выбора определенного контура, чтобы получить плавный контур. В этой операции используются методы подгонки шлицевой кривой для автоматического сглаживания контуров.
- Нажмите кнопку Файл > вкладку Сохранить как > Координаты XY, чтобы сохранить координаты точек каждого контура, такие как люмен, внешняя граница и компонент бляшки, в отдельном текстовом файле. Этот файл содержит значения координат x и y точек, составляющих контур, с пикселями в качестве единиц измерения.
- Запишите реальный физический размер каждого пикселя в киноизображения IVUS и VH-IVUS (обозначаются как размер пикселя) из файла DICOM. Реальное расстояние для одного пикселя в данных ВСУЗИ, используемых здесь, составляет 0,002 см. Эта информация будет использоваться для преобразования координат точки с пикселем в качестве единицы измерения в реальное расстояние с cm в качестве единицы измерения.
- Обработка контурных данных
- Обработка данных контура ВСУЗИ Cine
- Чтение текстовых файлов контуров просвета со всех изображений ВСУЗИ в киносеансе за один сердечный цикл с помощью MATLAB.
- Умножьте все световые контуры на размер пикселя, чтобы получить фактический размер световых контуров.
- Рассчитайте окружности просвета для всех контуров просвета и определите рамки ВСУЗИ с максимальной (Cmax) и минимальной (Cmin) окружностями просвета, представляющими диастолическое и систолическое состояние соответственно.
- Обработка контурных данных ВГ-ВСУЗИ
- Чтение текстовых файлов контуров просвета, внешней границы и компонентов бляшки с изображения VH-IVUS с помощью MATLAB.
- Умножьте все контуры на размер пикселя, чтобы получить фактический размер всех контуров.
- Повторно разделите каждый контур на 100 равноудаленных точек и выполните 2D-сглаживание, чтобы получить новые данные контуров VH-IVUS взамен старых.
- Обработка данных контура ВСУЗИ Cine
2. Конечно-элементная модель
- Реконструкция геометрии коронарных сосудов
- Создайте один слой контуров в трехмерном пространстве, добавив значение координаты z для всех точек контуров VH-IVUS, включая просвет, внешнюю границу и липид, и установите z = 0 для всех точек (рис. 2).
- Создайте еще один слой контуров, добавив значение координаты z для всех точек контуров VH-IVUS и сбросив z = 0,05 см для всех точек.
ПРИМЕЧАНИЕ: Эти два слоя контуров реконструируют трехмерную геометрию коронарного сосуда для модели только тонкослойной структуры путем добавления фиксированной толщины слоя 0,05 см к контурам VH-IVUS (Рисунок 2).
- Генерация сетки методом конечных элементов
- Создайте два вспомогательных контура путем линейной интерполяции просвета и контуров внешних границ с весами 1/3 и 2/3 (рис. 3A) для каждого слоя.
- Разделите область сосуда на 8 окружных частей и 3 радиальные части (см. рисунок 3В), соединив границу просвета/внешней границы с ближайшей точкой липидного контура (например, точками А и В на рисунке 3В) или двумя вспомогательными контурами радиальными линиями.
- Соедините все точки между слоями прямыми линиями, образовав 3D-структуру с объемами 3 х 8 (рисунок 3В). Разделите каждый объем с помощью шестигранных элементов, чтобы создать сетку конечных элементов (Рисунок 3C) и различные группы материалов (Рисунок 3D).
- Выполните анализ сетки, уточнив плотность сетки на 10% до изменения растворов < 5%.
- Определение свойств материала
- Используйте модифицированную анизотропную модель материала Муни-Ривлина для описания свойств материала стенки коронарного сосуда. Предполагается, что коронарные сосуды и компоненты бляшек являются гиперупругими, анизотропными, почти несжимаемыми и однородными материалами, а функция плотности энергии деформации модифицированной анизотропной модели материала Муни-Ривлина составляет:
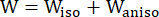 (1)
(1)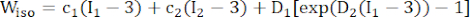 (2)
(2)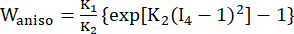 (3)
(3)
где I1 и I2 — первый и второй инварианты правого тензора деформации Коши-Грина C, определенного как c = [cij] = XTX, X = [Xij] = [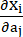 ], (Xi) — текущее положение (aj) — исходное положение, I4 = cij(nc)i(nc)j, nc — единичный вектор в окружном направлении судна. c1, c2, D1, D2, K1 и K2 были параметрами материала, специфичными для пациента.
], (Xi) — текущее положение (aj) — исходное положение, I4 = cij(nc)i(nc)j, nc — единичный вектор в окружном направлении судна. c1, c2, D1, D2, K1 и K2 были параметрами материала, специфичными для пациента. - Присвойте исходные значения параметров материала для специфического для пациента коронарного сосуда по результатам биаксиального исследования ex vivo, то есть c1 = −1 312,9 кПа, c2 = 114,7 кПа, D1 = 629,7 кПа, D2 = 2,0, K1 = 35,9 кПа и K2 = 23,5 (рис. 4A-B)13,15.
- Назначьте параметры материала для компонента бляшки, если он присутствует. В частности, для липидов c1=0,5 кПа, c2=0, D1=0,5 кПа и D2=1,5; для кальцификации использовали c1=920 кПа, c2=0, D1=360 кПаи D2=2,0 (рис. 4B)16.
Примечание: Компоненты бляшек (липиды и кальцификация) считались гиперупругими, изотропными и почти несжимаемыми, а их механические свойства описывались с помощью изотропной модели материала Муни-Ривлина с функциями плотности энергии деформации, приведенными в формуле (2).
- Используйте модифицированную анизотропную модель материала Муни-Ривлина для описания свойств материала стенки коронарного сосуда. Предполагается, что коронарные сосуды и компоненты бляшек являются гиперупругими, анизотропными, почти несжимаемыми и однородными материалами, а функция плотности энергии деформации модифицированной анизотропной модели материала Муни-Ривлина составляет:
- Настройка управляющих уравнений и граничных условий
- Определение управляющих уравнений для модели только тонкослойной структуры, которая включает уравнение движения, нелинейное соотношение деформации и смещения Коши-Грина и модель материала коронарного сосуда11.
- Назначайте специфические для пациента формы волн артериального давления на поверхности просвета для моделирования реальных физиологических условий (рис. 4C). Чтобы получить специфические для пациента формы волны артериального давления, составьте типичную форму волны аортального давления со значениями систолического и диастолического давления, измеренными с помощью манжеты руки (Рисунок 4D).
3. Подход к обновлению на основе модели конечных элементов для свойств материала коронарных артерий, специфичных для пациента
ПРИМЕЧАНИЕ: Итерационный процесс определения свойств коронарного материала для конкретного пациента проиллюстрирован на рисунке 5.
- Определите геометрию холостого хода, соответствующую условию нулевого давления, в качестве исходной геометрии для расчетной модели путем сжатия коронарной геометрии, восстановленной по изображению VH-IVUS, в осевом направлении с фиксированной скоростью усадки 95% и окружно с окружной усадкой (обозначенной как S), первоначально установленной равной 98%.
ПРИМЕЧАНИЕ: Поскольку геометрия коронарных артерий, реконструированная по изображению VH-IVUS, находилась в условиях in vivo с артериальным давлением, назначенным на просвет и аксиальным растяжением от привязанных дистальных и проксимальных сегментов коронарных артерий, геометрия коронарных артерий in vivo должна сжиматься по окружности и в осевом направлении для получения геометрии нулевого давления. - Зафиксируйте скорость осевой усадки на уровне 95% и обновите окружную усадку во время следующих шагов.
- Определите соотношение материалов (обозначается как k), чтобы присвоить свойства материала коронарного сосуда для конкретного пациента следующим образом: то есть, c1 = k*(−1 312,9) кПа, c2 = k*114,7 кПа, D1 = k*629,7 кПа, K1 = k*35,9 кПа, а фиксация D2 = 2,0 и K2 = 23,5.
ПРИМЕЧАНИЕ: Поскольку для определения неизвестных параметров (скорость усадки окружности окружности окружности S и параметры материала модели Муни-Ривлина были получены только две точки данных (минимальная и максимальная окружности просвета, соответствующие диастолическому и систолическому давлениям), мы уменьшили количество неизвестных параметров, предположив, что свойства материала коронарного сосуда in vivo для пациента пропорциональны исходному предположению с соотношением материалов, обозначенным как k: то есть, c1 = k*(−1 312,9) кПа, c2 = k*114,7 кПа, D1 = k*629,7 кПа, K1 = k*35,9 кПа, в то время как D2 = 2,0 и K2 = 23,5 были фиксированными. - Обновите заданное значение k до начального значения k, равного 1, вместе с окружной скоростью усадки S во время следующей итерационной процедуры.
- Запустите программное обеспечение для решения вычислительной модели для получения численных результатов.
- Запишите все команды для создания тонкослойной модели, состоящей только из структуры, в пакетный файл (Дополнительный файл 1) с помощью MATLAB.
- Загрузите этот пакетный файл с помощью расширенного пользовательского интерфейса (AUI) для создания модели (рисунок 6A). Рассмотрите тонкослойную структурную модель, нажав кнопку Data File/Solution, и сохраните ее как файл .dat (рисунок 6C). Смоделируйте три сердечных цикла и примите решение в последнем цикле для представления численных результатов.
- Чтобы экспортировать результаты координат узлов в файл txt, перейдите в раздел Список значений > Список значений > зоне и выберите X-POSITION, Y-POSITION и Z-POSITION в разделе Переменные для списка в разделе Координаты. Нажмите кнопку Применить и экспортировать , чтобы экспортировать результаты координат.
- Сохраняйте данные о контуре просвета, соответствующие условиям диастолического и систолического давления, в файлы .txt для расчета окружности просвета.
- Сравните окружности просвета, рассчитанные по модели КЭ (модель структуры тонкого слоя) в условиях диастолического давления с данными ВСУЗИ (Cmin) in vivo cine и проверьте, составила ли относительная ошибка <1%. Если условие было выполнено, то переходите к следующему шагу, либо иным образом обновляйте отношение материала k с помощью секущего метода и переходите к шагу 3.3, чтобы снова запустить17,18.
ПРИМЕЧАНИЕ: В первой итеративе для обновления соотношения материалов использовался метод Ньютона, а не метод секущих. - Сравните окружности просвета, рассчитанные по модели FE в условиях систолического давления, с данными ВСУЗИ in vivo cine (Cmax) и проверьте, составила ли относительная ошибка <1%. Если да, то остановите итеративную процедуру или иным образом обновите окружную скорость усадки S и перенаправьте на шаг 3.4 для повторного выполнения.
ПРИМЕЧАНИЕ: В первой итеративе метод Ньютона использовался для обновления скорости окружной усадки вместо метода секущей. - Запишите оптимальные значения S и k и рассчитайте соответствующие параметры материала модели материала Муни-Ривлина.
- Постройте кривые окружного и осевого отношения напряжения к растяжению коронарного сосуда (рис. 7), которые можно получить следующим образом:
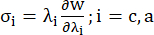 (4)
(4)
где σ представляет напряжение Коши, λ — коэффициент растяжения, i = c, a — окружное и осевое направления.- Чтобы нарисовать кривую материала в определенном направлении, зафиксируйте коэффициент растяжения в другом направлении равным 1. Рассчитайте эффективный модуль Юнга в окружном и осевом (обозначенных как YMc и YMa, соответственно) как наклон масштабной функции кривой материала в интервале коэффициента растяжения [1.0, 1.1], чтобы отразить общую жесткость материала коронарной артерии13:
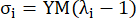 (5)
(5)
- Чтобы нарисовать кривую материала в определенном направлении, зафиксируйте коэффициент растяжения в другом направлении равным 1. Рассчитайте эффективный модуль Юнга в окружном и осевом (обозначенных как YMc и YMa, соответственно) как наклон масштабной функции кривой материала в интервале коэффициента растяжения [1.0, 1.1], чтобы отразить общую жесткость материала коронарной артерии13:
- Извлекайте распределение напряжения/деформации бляшки в любое время и записывайте распределение узлов и максимальные значения напряжения во время систолической и диастолической фаз (рис. 8).
Результаты
Мы подробно описываем метод FEMBUA, который позволяет проводить быстрый анализ материала бляшек и напряжений коронарных бляшек после визуализации ВСУЗИ в режиме реального времени, а также позволяет определить свойства материала in vivo и биомеханические результаты ?...
Обсуждение
Критические шаги в протоколе
Наиболее важным шагом в подходе к обновлению на основе конечно-элементной модели является итерационная процедура. В этом подходе конечно-элементная модель должна точно восстанавливать движение коронарных сосудов на сосудист?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было частично поддержано Проектом медицинских наук и технологий провинции Шаньдун (No 202425020256 и 202403010254), грантами Национального фонда естественных наук Китая 11972117 и 11802060, Фондом естественных наук провинции Цзянсу в рамках гранта No BK20180352 и Фондом естественных наук провинции Шаньдун в рамках гранта No ZR2024QA110.
Материалы
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
Ссылки
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены